-
Medical journals
- Career
Monitorování perorální antikoagulační léčby v ambulantní praxi
Authors: M. Penka; J. Gumulec; A. Buliková; M. Matýšková; P. Smejkal; J. Kissová; M. Šlechtová; J. Novotný; G. Chlupová
Published in: Kardiol Rev Int Med 2007, 9(3): 159-164
Overview
Kumariny jsou typickým lékem ambulantní praxe a spektrum nemocných, kteří je užívají se stále rozšiřuje. Zároveň se také mění podmínky a možnosti jejich indikace, sledování jejich účinku a úprava léčby – jak ze strany praktického lékaře nemocného, případně specialistů podílejících se na péči o nemocného, tak nakonec i nemocného samého. S nárůstem poznatků se také mění celá filozofie léčby, přístup k ní i k okolnostem, které ji provázejí nebo ji ovlivňují.
Klíčová slova:
trombóza – kumariny – warfarin – point of care testing – ambulantní péče – domácí léčbaÚvod
Dikumarolové látky či zkráceně kumariny nebo méně správně antivitaminy K jsou léky, které se v klinické medicíně používají od poloviny minulého století.
Jejich účinek se dá shrnout stručně a schematicky do následujících 2 bodů [1]:
- zasahují do metabolizmu K–vitamin dependentních působků ovlivněním redukčních pochodů blokádou epoxid reduktázy a reduktázy
- brání karboxylaci γ–glutamátových zbytků faktorů II, VII, IX a X a inhibitorů koagulace – proteinu C a S (schéma).
Schéma 1. Účinek K vitaminu v epoxidovém cyklu [2]. ![Schéma 1. Účinek K vitaminu v epoxidovém cyklu [2].](https://pl-master.mdcdn.cz/media/image/1068af349f4efe54cd18bd95f3ccc9a3.png?version=1537792394)
Kumariny jejich účinek a indikace
K nejvýznamnějším dikumarolovým preparátům patří etylbiskumacetát (Pelentan a Pelentanettae) a acenokumarol (Sintrom) s krátkým poločasem a warfarin (Coumadine, Lawarin, Warfarin), případně fenprokumon (Marcoumar) s poločasem delším [3]. V současné době se v ČR používá takřka výhradně warfarin, zatímco etylbiskumacetát se již ani nepoužívá ani nevyrábí.
Biologický účinek kumarinů sledujeme pomocí protrombinového času (prothrombin time – PT) metodou podle Quicka, vyjádřeného v INR (international normalized ratio), které určuje poměr vyšetřené plazmy k plazmě normálního vzorku přepočteného mezinárodním indexem senzitivity (ISI). Takto získaná laboratorní hodnota se nejlépe hodí ke sledování účinku perorálních antikoagulancií a k jejich srovnání v případech, pocházejí-li z různých laboratoří (obr. 1) [3–5].
K indikacím podání kumarinů patří prevence a léčba především žilního tromboembolizmu (VTE), ale lze je podávat i u nemocných s arteriální trombózou, kde je výhodné je kombinovat i s antiagregancii. Doporučenou cílovou hodnotou INR je 2,0–3,0 [6 – 9], přičemž se nedoporučuje provádět nízkodávkovanou (nedosahující INR 2,0) nebo vysokodávkovanou (přesahující INR 3,1) léčbu, i když některé studie (PREVENT a ELATE) částečný prospěch nízkodávkované léčby warfarinem s INR 1,5–1,9, resp. 1,5–2,0 prokazují [10].
Výhodou warfarinu je možnost jeho podání kojícím matkám, protože nepřechází do mateřského mléka.
Ovlivnění účinku kumarinů
Existuje celá řada okolností, které ovlivňují účinnost kumarinů a ty lze posuzovat podle aspektů klinických a podle aspektů laboratorního sledování. K těm klinickým patří souběžné choroby a interakce kumarinů s léky a potravinami [11]. Z hlediska laboratorního věnujeme pozornost jak preanalytické, tak analytické a postanalytické fázi vyšetření. Významný je zde tedy způsob a provedení odběru krve, dále pak zajištění správných laboratorních podmínek a správná technika samého vyšetření a nakonec i vydání a interpretace výsledků. Zatímco ošetřující lékař ovlivní dopad klinických změn, laboratorní pracovníci mají vliv na odpovídající úroveň provedeného vyšetření, i když právě posledně jmenovaný krok doznává v rámci ambulantní péče významných proměn. Nyní ale zpět ke klinice.
Ke zvýšení účinku kumarinů může dojít za těchto okolností:
- při nedostatku vitaminu K při malabsorpci, obstrukční žloutence, jaterních chorobách, iatrogenně při terapii antibiotiky potlačujícími saprofytickou (K vitamin produkující) střevní flóru
- při zvýšeném metabolizmu, u tyreotoxikózy nebo při déle trvajícím horečnatém stavu
- v průběhu infekce
- při interakci s léky: chlorpromazinem, dipyridamolem, chinidinem, laxancii, nesteroidními antiflogistiky, kortikosteroidy, tolbutamidem, erytromycinem, metronidazolem, s cefalosporiny 3. generace, cimetidinem, amiodaronem, hepariny
Ke snížení účinku kumarinů může dojít za těchto okolností:
- u osob s vrozenou nebo získanou rezistencí na warfarin včetně dědičně podmíněné snížené afinity warfarinových receptorů k warfarinu
- u uremie a hypometabolických stavů
- v rámci interakce s následujícími léky: barbituráty, haloperidolem, aldaktonem, cholestyraminem, rifampicinem, antihistaminiky, perorálními kontraceptivy, griseofulvinem a pochopitelně s vitaminem K či potravinami s jeho vysokým obsahem, přičemž k interferenci s léčbou dochází při přívodu K vitaminu v dávce přesahující 250 μg/den [12]
Graph 1. Grafické znázornění vyjádření INR se zaměřením na terapeutické rozpětí a rozpětí normálních hodnot. 
Graph 2. Použití LMWH k přemosťující léčbě v rámci přípravy výkonu, upraveno dle [26]. ![Použití LMWH k přemosťující léčbě v rámci přípravy výkonu, upraveno dle [26].](https://pl-master.mdcdn.cz/media/image/7db25fd04b5d880b7d231a8ffa8422a0.png?version=1537794826)
Komplikace léčby kumariny
Další významnou klinickou okolností jsou komplikace léčby kumariny. K nim patří krvácení, warfarinem indukovaná kožní nekróza a teratogenní účinek [13–15].
Krvácení, jehož výskyt činí přibližně 7 % (fatální 0,5 %), je dáno především předávkováním warfarinem a nesprávně sledovanou léčbou (tab. 2).
Table 1. Riziko tromboembolických komplikací z hlediska výkonu [19]. ![Riziko tromboembolických komplikací z hlediska výkonu [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0486cc47c08fbe0033623c56e7824a68.png)
Může být však zapříčiněno i mutací propeptidu FIX, zvýšenou senzitivitou vůči warfarinu (danou například mutací VKORC1) a sníženým odbourávání warfarinu (resp. jeho 2 izomerů) např. v důsledku mutace cytochromu P450.
Warfarinem indukovaná kožní nekróza může být důsledkem současného defektu proteinu C, může provázet úvod léčby warfariny, zvláště pokud není veden pod clonou antitrombotické léčby hepariny a je-li zpočátku a déle podávána vyšší dávka warfarinu. Jedná se o syndrom analogický purpuře fuĺminans novorozenců a může mít závažné důsledky.
S teratogenními účinky se lze setkat, je-li warfarinem léčena těhotná v době mezi 6.12. týdnem gravidity.
Někdy se setkáváme naopak se selháním léčby i při dosažení účinné laboratorní kontroly Takové selhání může provázet např. nádorové choroby. Méně často se setkáváme i s osteoporózou či padáním vlasů.
K tomu, abychom nevystavovali nemocného nebezpečí vzniku komplikací, je nutno dodržovat kontraindikace podání kumarinů, ke kterým patří:
- těhotenství (hlavně 1. a 3. trimestr)
- choroby jater a slinivky
- vrozené či získané krvácivé stavy
- čerstvé operační zákroky nebo stavy těsně po operaci
- přítomnost nebo hrozba čerstvého krvácení
- chybí-li spolupráce pacienta pří léčbě a kontrole
- léčba bez možnosti laboratorních kontrol
- abúzus alkoholu
Pakliže se již komplikace vyskytnou, existuje řada systematických doporučení týkajících se opatření při předávkování kumariny. Na tomto místě uvádíme jako příklad doporučení britského výboru pro standardizaci v hematologii [3] z roku 1996, které je běžně užíváno a které respektuje laboratorní hodnoty i klinické příznaky:
- při INR 3,0–6,0, není-li provázeno krvácením, redukujeme či vynecháme dávku léku
- při INR 6,0–8,0 vynecháme dávky do nástupu hodnoty INR < 5,0
- při INR > 8,0 vynecháme dávku warfarinu a podáme p.o. vitamin K v dávce 0,5–2,5 mg (je zajímavé, že je účinnější perorální než subkutánní aplikace)
- při velkém krvácení podáváme koncentrát faktorů protrombinového komplexu a/nebo vitamin K 5 mg p.o. či i.v., což již vyžaduje hospitalizaci a za dramatických okolností takového krvácení je možno pomýšlet i na použití rekombinantního aktivovaného faktoru VII (rFVIIa)
Pro péči o nemocné na dlouhodobé antikoagulační léčbě jsou důležité obecné principy léčby kumariny, které lze shrnout následovně:
- začít podávat kumariny spolu s heparinem a převádět nejméně 5 dní a přitom volit spíše menší dávku kumarinů
- zajistit podmínky a spolupráci s nemocným a jeho dalšími ošetřujícími lékaři; zajistit jejich poučení
- kontrolovat léčbu nejméně 1krát za 4 týdny, maximálně 6 týdnů [17]
- uvážlivě měnit snižovat, zvyšovat a přerušovat léčbu (viz níže)
- ponechávat léčbu potřebně dlouhou dobu [18]
- pokud možno neměnit preparáty warfarinu z důvodu odlišnosti jejich struktury (zatímco Warfarin je amorfní, Lawarin je krystalická sůl)
Příprava nemocného k intervenčnímuzákroku
V některých případech se od ošetřujícího lékaře požaduje, aby zajistil přípravu k chirurgickému či jinému intervenčnímu zákroku. V těchto případech vycházíme z posouzení míry rizika daného samým chirurgickým výkonem (tab. 1) a dále z míry trombeombolického rizika daného přerušením antikoagulační léčby.
Table 2. Krvácení po warfarinu ve výsledcích provedených studií, z nichž nevýraznější představují výsledky Altmanna et al z roku 1991 ukazuje, že při kolísání hodnot INR v rozpětí mezi 3,0-4,5 je provázena 24% rizikem vzniku trombózy, zatímco léčba vedená v rozmezí 2,0-2,9 pouhým 6% výskytem. Faktem je, že ne všechny studie přinášejí tak přesvědčivé výsledky, nicméně závislost na kolísání rozpětí INR je zřejmá [16]. ![Krvácení po warfarinu ve výsledcích provedených studií, z nichž nevýraznější představují výsledky Altmanna et al z roku 1991 ukazuje, že při kolísání hodnot INR v rozpětí mezi 3,0-4,5 je provázena 24% rizikem vzniku trombózy, zatímco léčba vedená v rozmezí 2,0-2,9 pouhým 6% výskytem. Faktem je, že ne všechny studie přinášejí tak přesvědčivé výsledky, nicméně závislost na kolísání rozpětí INR je zřejmá [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6265bff4a1cdf08f6e4d9b5fd9636c8c.png)
V závislosti na míře rizika lze provádět dle J. Ansella et al [11] (7. konsenzuální konference ACPP) přípravu v závislosti na míře rizika tromboembolie (případně krvácení) následovně:
Nízké riziko tromboembolie:
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem dosažení INR blízko normálním hodnotám před výkonem)
- v případě vyššího VTE rizika samého výkonu pooperační profylaxe nefrakcionovaným heparinem (unfractionated heparin – UFH 5000 j.s.c.) či nízkomolekulárním heparinem (low–molecular–weight heparin – LMWH) + současné pokračování terapie warfarinem
Poznámka: profylaxe UFH či LMWH může být zahájena předoperačně.
Střední riziko tromboembolie:
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem poklesu INR před výkonem)
- 2 dny před operací zahájení profylaxe UFH (5 000 j. s. c.) či LMWH + pooperační pokračování terapie warfarinem
Poznámka: někdy je doporučována profylaxe vyššími dávkami UFH či plnými dávkami LMWH.
Vysoké riziko tromboembolie
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem dosažení normálních hodnot INR před výkonem)
- před operací – cca 2 dny za normalizace INR profylaxe plnou dávkou UFH či LMWH + současné pooperační pokračování terapie warfarinem
Poznámka: je-li profylaxe plnými dávkami UFH či plnými dávkami LMWH podávána s.c., pak ji ukončíme 12–24 hod před výkonem; je-li UFH aplikován kontinuálně i.v., ukončíme jeho podávání cca 5 hod před výkonem.
Nízké riziko krvácení
- warfarin snížíme od 4. či 5. dne před výkonem k dosažení nastavení INR cca 1.3 – 1.5
- pokračování plné (původní) terapie warfarinem zahajujeme ihned po výkonu
Poznámka: profylaxe UFH či LMWH může být zajištěna, je-li to nezbytné.
Vždy je nutno posuzovat míru nebezpečí z hlediska obou klinických extrémů – krvácení či retrombózy. Pak vycházíme z doporučení, jaké hodnoty INR lze podle klinické situace připustit. S. Schulman [20] postuluje zmíněnou závislost v následující 3 rovinách (tab. 3).
Table 3. Stanovení cílového INR z hlediska míry možných komplikací. 
Hodnoty INR přitom z hlediska hodnocení nastavení úrovně antikoagulačního účinku odpovídají určité plazmatické koncentraci jednotlivých faktorů krevního srážení (tab.4) [20].
Table 4. Plazmatická koncentrace faktorů krevního srážení reflektovaná hodnotou INR. 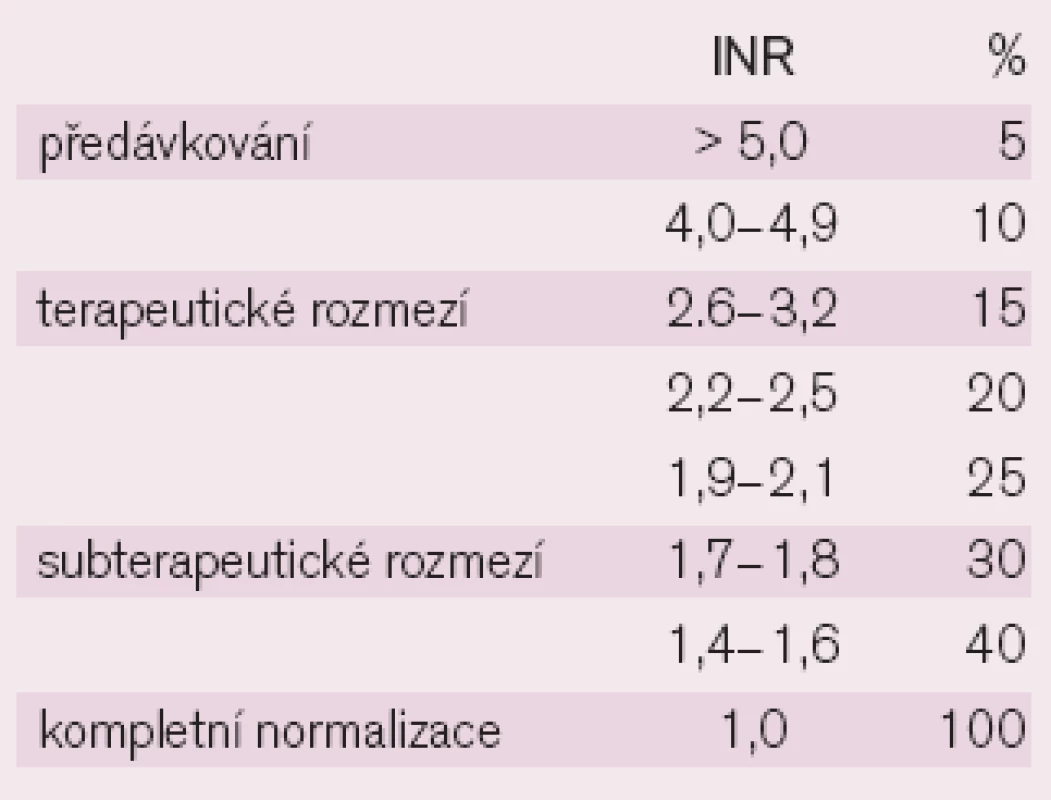
K rychlé korekci INR lze použít plazmu či plazmatické deriváty. Nejčastěji bývá používána čerstvě zmražená plazma (ČZP/fresh frozen plasma – FFP) nebo protrombinový koncentrát (prothrombin complex concentrat – PCC) [21].
Výpočet dávky FFP nebo PCC k požadované korekci INR uvádí tento vzorec:
Počet ml FFP či IU koncentrátu = požadovaná – aktuální koncentrace faktoru (%) × tělesná hmotnost (kg).
Příklad: nemocný po prodělané PE je stižen závažným krvácením ze zažívacího traktu
základní parametry: aktuální INR 7,5 (~ cca 5% biologická aktivita faktorů plazmatického systému), požadované INR ,5 (~ cca 40% ff), tělesná hmotnost je 80 kg.
Výpočet: (40–5) × 80 = 2 800 ml FFP či jednotek PCC
K doplňkovým opatřením přípravy nemocného k intervenčnímu výkonu patří:
- zavedení kaválního filtru – má zabránit komplikujícím embolizacím u nemocných s vysokým rizikem VTE, u kterých je nezbytný urgentní výkon (případně v době do 1 měsíce po prodělané příhodě VTE) [22]
- podávání K vitaminu ke korekci INR (souběžně se substituční léčbou) vždy v dávce nižší (do 5 mg) ! – k vyloučení nebezpečí následného vzniku rezistence k warfarinu; přitom je možná jak i.v., tak i p.o. aplikace; je třeba počítat s nástupem účinku K vitaminu do cca 4 hod od jeho podání [23]
Za určitých okolností perorální léčbu nepřerušujeme ani neupravujeme, pokud nepřesahuje významně dolní limit rozpětí terapeutického účinnosti (INR = 2,0) [11]. Patří k nim extrakce zubů (i mnohočetné) [24,25], dále operace katarakty, artrocentézy a endoskopie zažívacího traktu.
Doporučený postup v rámci přípravy nemocného na dlouhodobé antikoagulační léčbě k intervenci (chirurgické, gynekologické, invazivního vyšetření apod.) by tedy bylo možno shrnout do následujících bodů:
- vysazení (snížení) dávky warfarinu
- nasazení antitrombotické alternativní léčby
- korekce INR k okamžiku výkonu s aplikací profylaktické dávky LMWH
- navrácení původní léčby po (nebo v den) výkonu pod clonou plné (léčebné) heparinizace nefrakcionovaným (unfractionated heparin – UFH) nebo nízkomolekulárním (low molecular weight heparin – LMWH) heparinem
U zákroků s pooperačním krvácením nebo jeho rizikem pokračujeme v pooperačním průběhu v antitrombotické alternativní léčbě heparinem a na původní léčbu warfarinem přecházíme obvyklým způsobem, ale později.
Trvalé následky či smrt v souvislosti s trombózou či krvácením nacházíme v důsledku tepenného tromboembolizmu v 70–75 %, žilního tromboembolizmu ve 4–10 % a u pooperačního krvácení v 1–6 % [27]. Z toho je patrno, které klinické situace ohrožují nemocné více a přistupujeme k zajištění nemocných tak, abychom co nejúčinněji zajistili antitrombotickou prevenci a přitom i hemostázu pro daný výkon. Primární je přitom antitrombotická prevence. V každém případě ale zvažujeme, do jaké míry je zajištění antikoagulační, resp. antitrombotické prevence nutné.
V souvislosti s úvahou o zásahu do antikoagulační terapie (AKT) tedy zvažujeme, zda je:
- nutné pokračovat v AKT, přičemž vycházíme ze současných doporučení [11, 28] (nekomplikovaná první trombóza – 3 měsíce, komplikovaná trombóza (PE) – 6–12 měsíců, zjištěný defekt – dlouhodobě (celoživotně), zajištění kritické situace – přechodná cílená)
- nutno AKT přerušit či významně změnit
- výkon naléhavý nebo zda jej lze odložit [29]
Schéma přípravy nemocného k výkonu
- Nutná vysoká úroveň AKT a výkon spěchá: přerušení AKT, substituce PCC či FFP a okamžité převedení nemocného na UFH či LMWH v plné či přechodně krátkodobě v profylaktické dávce
- Možná nižší úroveň AKT a výkon spěchá: snížení dávky AKT, substituce FFP a UFH či LMWH v profylaktické dávce
- Nutná vysoká úroveň AKT a výkon nespěchá: snížení AKT, podání malé dávky K vitaminu (1–2,5 mg), převedení na léčebnou dávku UFH či LMWH; přitom v době, kdy ještě přetrvává hodnota INR v terapeutickém rozmezí, je možné je podat v profylaktické dávce
- Možná nižší úroveň AKT a výkon nespěchá: snížení AKT, minim. dávka K vitaminu (INR 2,0) a UFH či LMWH v profylaktické dávce
- AT není nutná z důvodu předchozí indikace: zvážení, zda výkon sám vyžaduje AKT, (pokud ne, pak ukončení AKT a pokud ano, pak profylaxe UFH nebo LMWH)
Závěr
Z hlediska současné péče o nemocné v ambulantním sledování a domácí léčbě je velmi významné zavedení možnosti využití míst rychlé diagnostiky (POCT – point of care testing), kdy se díky přístrojům (např. CoaguChek) dá rychle a z kapilární krve změřit hodnota INR. Protože se jedná o modifikace metody užívané v koagulační laboratoři, je nutno si uvědomit, že se výsledky mohou lišit. Pak je třeba zohlednit stupně odlišnosti a provádí-li se souběžně kontrola oběma způsoby, musí se dávkování přizpůsobovat v závislosti na stupni rozdílu. Tato diagnostika je dobrá pro možnost aktuální a rychlé kontroly, která může být svěřena do rukou praktického lékaře nebo poučeného a spolupracujícího pacienta samého. V souvislosti s tímto systémem sledování je však nutné proškolení lékařů i pacientů, protože se jedná o systém, kde se chyby mohou vyskytnout ve vyšší míře než v rámci klasického sledování. Studie zabývající se touto problematikou však přinášejí povzbudivé údaje o stabilním nastavení nemocných a ve srovnání s běžnou nespecializovanou péčí mohou vést i ke snížení komplikací [30]. Nutný je ovšem také spolehlivý systém archivace výsledků.
V souvislosti s organizací péče o nemocné na dlouhodobé antikoagulační léčbě by bylo vhodné vytvoření sítě kontrolních pracovišť, která by byla napojena přímo na Centra pro trombózu a hemostázu, která působí v největších a fakultních nemocnicích.
Adresa pro korespondenci:
prof. MUDr. Miroslav Penka, CSc.1
prim. MUDr. Jaroslav Gumulec2
MUDr. Alena Buliková, Ph.D.1
MUDr. Miloslava Matýšková, CSc.1
MUDr. Petr Smejkal1
MUDr. Jarmila Kissová1
MUDr. Marie Šlechtová1
MUDr. Jan Novotný1
MUDr. Gabriela Chlupová1
1 Oddělení klinické hematologie LF MU a FN Brno, pracoviště Bohunice
2 Onkologické centrum J. G. Mendela, Nový Jičín
Sources
1.Marder VJ, Rosove MH, Minning DM. Foundation and sites of action pf antithrombotic agents. Best Practice Mueller RL. First–generation agents: aspirin, heparin and coumarins. Best Pract Res Clin Haematol 2004; 17(1): 3–22.
2.Bick RL, Murano G. Physiology of Hemostasis. Clin Lab Med 1994; 14(4): 677–707.
3.Baglin TP, Rose PE and membres of the Haemostasis and Thrombosis Task Force. Guidelines on Oral Anticoagulation: 3rd ed. Br J Haematol 1998; 101 : 374–387.
4.Kessler P. Léčba orálními antikoagulancii. Orion – yhtymä Oyj, Orion Pharma 2002.
5.Kottke–Marchant K. Laboratory diagnosis of hemorrhagic and thrombotic disorders. Diagnostic Hematology. Hematol Oncol Clin North Am 1994; 8(4): 809–853.
6.Bergmann F, Kochhan L, Budde U. Die hereditäre Thrombophilie. Fortschritte in der Diagnostik. Hamostaseologie 1999; 19 : 77–85.
7.Harenberg J, Huhle G, Hoffmann U. Antithrombotische Therapie, Moderne Behandlungsstrategien. Internist 1999; 8 : 885–893.
8.Jaenecke J. Indikationsgebiete fur Antikoagulantien. Post – und praeoperative Antikoagulantienprophylaxe Antikoagulanzien – und Fibrinolzsetherapie. New York: Georg Thieme 1996 : 142–175.
9.Khamashta M, Cuadrado M, Mujic E et al. The management of thrombosis in the antiphospholipid syndrome. N Engl J Med 1995; 332 : 993–997.
10.Menajovsky LB. Long–term Treatment of Venous Thromboembolism. Treatment of Venous Thromboembolism. Continuing Medical Education Series 2006 : 39–47.
11.Matýšková M, Penka M. Interakce antikoagulačních léků s potravinami a potravinovými doplňky. Inter Med Prax 2005; 5 : 29–33.
12.Ansell J, Hirsh J, Poller L et al. The Pharmacology and Management of the vitamin K Antagonists. The Seventh ACCP Konference on Antithrombotick and Thrombolytic therapy. Chest 2004; 126 : 204–233.
13.van Aken H, Bode C, Darius H et al. Anticoagulation: The Present and Future. State–of–the–Art Review. Clin Appl Thromb Hemost 2001; 7(3): 195–204.
14.Hettiarachchi T, Lok J, Prins MH et al. Undiagnosed Malignancy in Patients with Deep Vein Thrombosis, Incidence, Risk factors, and Diagnosis. Cancer 1998; 83(1): 180–185.
15.Sbarouni E, Oakley C. Outcome of pregnancy in women with valve protheses. Br Heart J 1994; 71 : 196–201.
16.Levine MN, Raskob G, Betty RJ et al. Hemorrhagic Complications of Anticoagulant Treatment. The 7th ACCP Conference on Antithrombotick and Thrombolytic therapy. Chest 2004; 126 : 287–310.
17.Utilisation des Traitements antithrombotiques en pratique médicale courante, Recommandations du Groupe d°études sur l°hémostase et la thrombose (GEHT). Sang Thrombose Vasseaux 1996; 8(Numéro special): 1–43.
18.Bick RL. Therapy for Venous Thrombosis: Guidelines for a Competent and Cost – effective Approach. Unresolved Issues and Proposed Gudelines. Clin Appl Thromb Hemost 1999; 5(1): 2–9.
19.Laffan M, Tuddenham E. Assessing thrombotic risk. BMJ 1998; 317 : 520–523.
20.Schulman S, Wahlander K, Lindstrom T et al. For the THRIVE III Investigators. Secondary prevention of venous thromboembolism with oral direct trombin inhibitor ximelagatran. N Engl J Med 2003; 349 : 1813–1721.
21.Makris M, Greaves M, Philips W et al. Emergency oral anticoagulant reversal: the relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy. Thromb Haemost 1996; 77 : 477–480.
22.Kakkar VV, Lorenzo F. Prevention of venous thromboembolism in general surgery. Clin Haematol 1998; 11(2): 605–619.
23.Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med 1997; 336 : 1506–1511.
24.Bulik O. Problematika stomatochirurgického ošetření v průběhu antikoagulační terapie. Čes Stomat 2003; 103(3): 102–106.
25.Bulik O. Extrakce zubů a antikoagulační terapie – srovnání různých postupů. Prakt Zub Lék 2004; 52(3): 68–77.
26.Schellong SM, Halbritter K. Management of anticoagulation before and after surgery in patiens receiving longterm VKA therapy – oral presentation. GSK Thrombosis Masterclass, Berlin 2005.
27.Dunn A, Turpie AGG. Perioperative management of patients on oral anticoagulants: a systematic rewiev. Arch Intern Med 2003; 163 : 901–908.
28.Kearon C, Lindmarker P, Weitz JI. A Time – Limited or an Indefinite–Duration Approach to Anticoagulant Therapy? Controversies in Antithrombotic Therapy. Symposium to the 42nd Annual Meeting of ASH. San Francisco 2000.
29.Penka M, Matýšková M, Buliková A et al. Příprava nemocného s dlouhodobou antikoagulační léčbou v ambulantní praxi k chirurgickému výkonu. Inter Med Prax 2000; 5 : 20–23.
30.Witt DM, Adler MA, Shanahan RL et al. Effect of a centralised clinical pharmacy anticoagulation service on the outcomes of anticoagulant service. Chest 2005; 127 : 1515–1522.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2007 Issue 3-
All articles in this issue
- Plicní arteriální hypertenze
- Přínos stanovení B-natriuretického peptidu pro monitoraci léčby chronického srdečního selhání
- Význam implantabilní monitorovací jednotky u pacientů s neobjasněnou synkopou
- Fallotova tetralogie
- Monitorování perorální antikoagulační léčby v ambulantní praxi
- Deprese u kardiovaskulárního onemocnění
- Metody nukleární medicíny v diagnostice kardiovaskulárních onemocnění
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Monitorování perorální antikoagulační léčby v ambulantní praxi
- Význam implantabilní monitorovací jednotky u pacientů s neobjasněnou synkopou
- Fallotova tetralogie
- Plicní arteriální hypertenze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

