-
Medical journals
- Career
Zhodnocení souboru pacientů vyšetřených perfuzní scintigrafií při stanovení smrti mozku
Authors: M. Havel 1; D. Školoudík 2; D. Nováková 1; P. Švec 3; P. Havránek 3; G. Havlová 1; O. Kraft 1; V. Dedek 1; K. Bukovanský 1; R. Drozdková 1; P. Širůček 1
Authors‘ workplace: Klinika nukleární medicíny, Fakultní nemocnice Ostrava a Lékařská fakulta, Ostravská univerzita 1; Centrum zdravotnického výzkumu, Lékařská fakulta, Ostravská univerzita 2; Transplantační centrum, Fakultní nemocnice Ostrava 3
Published in: Anest. intenziv. Med., 32, 2021, č. 4-5, s. 197-203
Category: Original Papers
Overview
Cíl studie: Zhodnocení souboru pacientů jednoho centra odeslaných ke scintigrafickému vyšetření aperfuze mozku při diagnostice mozkové smrti. Zaměřili jsme se na rozdíly v proporcích vyšetřených dětí a mladistvých vůči dospělým pacientům, z hlediska příčiny vedoucí ke komatóznímu stavu nebo dárcovství v transplantačním programu. Blíže hodnotíme případy, kdy nebyla scintigraficky aperfuze mozku prokázána.
Typ studie: Retrospektivní.
Typ pracoviště: Klinika nukleární medicíny, Fakultní nemocnice.
Materiál a metoda: V období let 2003 až 2020 bylo vyšetřeno celkem 320 pacientů (průměrný věk 44 ± 18 let, 207 mužů, 113 žen), tito byli rozděleni dle věku na mladší 18 let (40, Soubor A) a pacienty s věkem vyšším nebo rovným 18 letům (280, Soubor B). Soubory byly statisticky porovnány, zejména z pohledu příčiny vedoucí ke komatóznímu stavu nebo dárcovství v transplantačním programu.
Výsledky: Pozitivní nález prokazující aperfuzi mozku byl zaznamenán při prvovyšetření celkem u 95 % pacientů. Skupiny se signifikantně lišily v proporcích příčin vedoucích ke kómatu, kdy ve skupině A byl podíl cévních mozkových příhod jen 10 %, ve skupině B naopak cévní mozkové příhody dominovaly s traumaty a jinými zevními příčinami (48 %, resp. 43 %, P < 0,0001). Rozdíly byly také v podílu pacientů, u kterých nebyl proveden orgánový odběr, což bylo signifikantně více ve skupině A (55 % vs. 11 %, P < 0,0001). U těchto pacientů se lišily i proporce příčin vedoucích ke kómatu, minoritní podíl u nich měly cévní mozkové příhody (13 %, P < 0,0001).
Závěr: Perfuzní scintigrafie mozku je dostupnou metodou dobře použitelnou a standardizovanou v rámci diagnostiky mozkové smrti. Existují rozdíly mezi skupinami vyšetřených v dětském věku a v dospělosti, z pohledu příčin vedoucích ke kómatu a i v podílu následných dárců orgánů k transplantaci.Klíčová slova:
transplantace – scintigrafie – smrt mozku – vyšetření perfuze
Úvod
Technologický a medikamentózní pokrok v léčebné péči vede k možnosti udržování oběhu a ventilace i v případě kompletní ireverzibilní ztráty mozkových funkcí. Ta je ovšem neslučitelná s dalším životem jedince, a je dle současné legislativy hlavním kritériem pro stanovení smrti jedince. Koncept tzv. mozkové smrti, tedy základ jeho dnešního pojetí, lze vysledovat až do druhé poloviny 60. let minulého století. Prvně byl přijat legislativně ve státě Kansas v USA v roce 1970, Finsko v roce 1971 pak bylo první evropskou zemí, kde byla nevratná ztráta mozkových funkcí považována za jednu z definic smrti [1]. Tento koncept nahradil původně přijímanou premisu smrti ztrátou životních funkcí, především oběhu nebo ventilace.
V České republice je aktuálně smrt definována v § 2 písm. e) zákona č. 285/2002 Sb. ve znění pozdějších předpisů, o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (Transplantační zákon), jako nevratná ztráta funkce celého mozku, včetně mozkového kmene. Diagnostika takového stavu je dále řešena v § 10 odst. 3, kde je uvedeno, že smrt se diagnostikuje průkazem nevratné zástavy krevního oběhu nebo nevratné ztráty funkce celého mozku, včetně mozkového kmene v případech, kdy jsou funkce dýchání nebo krevního oběhu udržovány uměle. Příloha „C“ samotného transplantačního zákona vymezuje i možnosti vyšetření potvrzující nevratnost smrti mozku [2].
Jednou ze zobrazovacích metod, které lze použít ke stanovení aperfuze mozku, je perfuzní scintigrafie mozku po aplikaci 99mTc‑hexametylpropylenaminooximu (99mTc‑HMPAO) nebo
99mTc‑etylencysteindietylesteru (99mTc‑ECD). Algoritmus provedení je pokryt národními radiologickými standardy [3]. Naše pracoviště má relativně dlouhodobou zkušenost s touto diagnostikou v rámci zavedené mezioborové spolupráce.Cílem práce je prezentovat soubor pacientů vyšetřených metodou perfuzní scintigrafie mozku v rámci jednoho pracoviště v období od zavedení metody až po současnost, se zaměřením na základní popisné charakteristiky a jejich srovnání mezi skupinami pacientů mladších a starších 18 let. Zabýváme se především příčinami vedoucími ke komatóznímu stavu, samotnými výsledky vyšetření a následným vstupem pacientů jako dárců do transplantačního programu.
Materiál a metodika
Zpracovaný soubor tvoří postupně vyšetřovaní pacienti, kteří byli odesláni na vyšetření na naši kliniku z důvodů stanovení aperfuze mozku během posledních 18 let (2003 až 2020). Data byla získávána retrospektivně z dostupné dokumentace. Byly zaznamenány základní popisné charakteristiky vyšetřených pacientů, předchozí stavy vedoucí k diagnostice mozkové smrti a výsledek vyšetření.
Scintigrafie
Scintigrafické vyšetření bylo provedeno na základě požadavku o diagnostiku aperfuze mozku vždy po předchozím vyšetření neurologem, který stanovil známky mozkové smrti na podkladě klinického vyšetření u pacienta v hlubokém kómatu, tj. areflexii nad C1.
Radiofarmakum bylo pacientovi aplikováno po kontrole středního arteriálního tlaku, který byl vyžadován pro dospělého jedince alespoň 80 mmHg, pro dítě minimálně 60 mmHg. Při krevním tlaku pod touto hraniční hodnotou byly aplikovány vazopresory, a až po úpravě krevního tlaku nad hraniční hodnotu bylo aplikováno radiofarmakum.
Pacientovi bylo nitrožilně podáno standardně 700 MBq radiofarmaka 99mTc‑HMPAO nebo 99mTc‑ECD, aktivita byla korigována dle hmotnosti vyšetřovaného. Aplikace aktivity proběhla bolusově buď do zavedené periferní intravenózní kanyly, nebo do centrálního přístupu, vždy následovaná dostatečným proplachem (min. 40 ml) fyziologického roztoku. Scintigrafické snímání bylo provedeno na dvouhlavé tomografické scintigrafické gamakameře Siemens eCam Signature (Siemens Healthineers AG, Erlangen, Německo).
Akvizice dynamické studie, odpovídající angiografické fázi, započala ihned po podání radiofarmaka, během 2 minut bylo nahráno dynamicky 30 scintigramů, každý v délce trvání 2 sekund. Následně pak byla provedena statická scintigrafie v projekci přední, zadní, pravé a levé, v délce trvání vždy 4 minuty na projekci (nebo do dosažení minimálně 300 000 impulsů na projekci). V zorném poli detektoru byla vždy celá hlava a krk.
Pozitivní nález pro průkaz mozkové aperfuze představovalo chybění známek akumulace radiofarmaka intrakraniálně ve všech provedených projekcích. Jakýkoliv jiný nález, i třeba minimální či nehomogenní akumulace aktivity ve tkáni mozku, byl hodnocen jako přetrvávající perfuze mozku.
V případě zjištění reziduální perfuze mozku bylo dle indikace neurologa v některých případech provedeno opakované vyšetření s minimálním časovým odstupem 24 hodin od první aplikace radiofarmaka.
Statistika
Soubor pacientů byl rozdělen dle věku pacientů na děti a mladistvé (věk nižší než 18 let, Skupina A) a dospělé (věk vyšší nebo roven 18 let,Skupina B). Zvlášť byla následně zpracována skupina pacientů s negativním výsledkem diagnostiky aperfuze. Kvalitativní data, jako pohlaví pacientů, příčina kómatu, dárcovství orgánů, byly porovnány chí‑kvadrát testem, kvantitativní data, jako věk v hodnocených podskupinách, pak parametrickými či neparametrickými testy, kde to bylo vhodné. Testy byly ověřovány na hladině statistické významnosti 0,05. Zpracování dat včetně tvorby grafů proběhlo v nástrojích sady Microsoft Excel (Microsoft Excel pro Mac, verze 16.34).
Studie byla schválena lokální etickou komisí (19. března 2020, číslo jednací 293/2020).
Výsledky
V období let 2003 až 2020 bylo na klinice nukleární medicíny provedeno celkem 335 scintigrafických vyšetření k diagnostice aperfuze mozku u 320 pacientů (207 mužů a 113 žen, průměrný věk 44 ± 18 let, medián 48 let). Nejmladším vyšetřeným byl novorozenec stáří 8 dnů, nejstarším pacientem byl muž ve věku 75 let. Vyšetřených mladších 18 let bylo 40 (13 %) – Skupina A. Ve věku nad 18 let včetně bylo 280 (87 %) pacientů – Skupina B.
Příčiny kómatu a následné smrti mozku
Z celkového počtu 320 vyšetřovaných pacientů bylo u 142 (44 %) z nich jako příčina kómatu a následné smrti mozku trauma a jiné zevní příčiny (33 dopravní nehody, 19 suicidia, 2 utonutí, 88 ostatní zevní příčiny), ve 140 (44 %) případech cévní mozkové příhody (124 intrakraniální krvácení netraumatické etiologie, 16 ischemické cévní mozkové příhody) a ve zbylých 38 (12 %) případech jiné důvody (5 mozkové tumory, 8 komplikace zánětlivých stavů a 25 jiné příčiny hypoxie).
Mezi věkovými skupinami A a B byly zjištěny signifikantní rozdíly v proporcích příčin kómatu. Ve skupině A převládala traumata a jiné zevní příčiny, ve skupině B byly naopak častější cévní mozkové příhody (P < 0,0001) – podrobněji viz tabulku 1. Skupiny se nelišily ve struktuře pohlaví vyšetřených. Ve skupině A bylo 65 % mužů, stejně jako ve skupině B (P = 0,9647) – viz tabulku 1 a graf 1.
Graph 1. Příčiny kómatu u skupiny A (věk < 18 let) a B (věk ≥ 18 let) 
Table 1. Charakteristiky věkových skupin < 18 let a ≥ 18 let 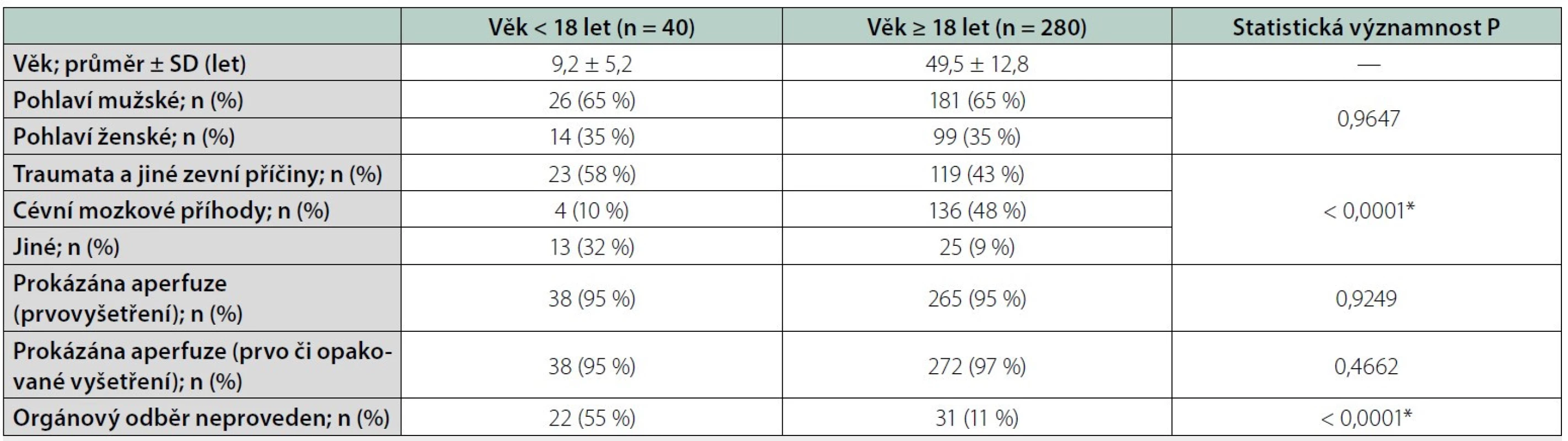
SD – směrodatná odchylka Výsledky scintigrafického vyšetření
Pozitivní scintigrafický nález prokazující aperfuzi mozku byl zaznamenán u 303 (95 %) prvovyšetření. Bylo to u 38 (95 %) pacientů ve skupině A a u 265 (95 %) pacientů ve skupině B, při prvním nebo opakovaném vyšetření u 38 (95 %) pacientů ve skupině A a u 272 (97 %) pacientů ve skupině B. Tyto podíly se mezi skupinami významně nelišily (P = 0,9249, resp. P = 0,4662, tabulka 1). Příklad výsledku scintigrafického vyšetření prokazující aperfuzi mozku a výsledku ukazujícího reziduální mozkovou perfuzi jsou uvedeny v obrázku 1 a 2.
Image 1. Scintigrafické vyšetření aperfuze mozku – aperfuze mozku potvrzena, akumulace radiofarmaka ve tkáni mozku není patrná 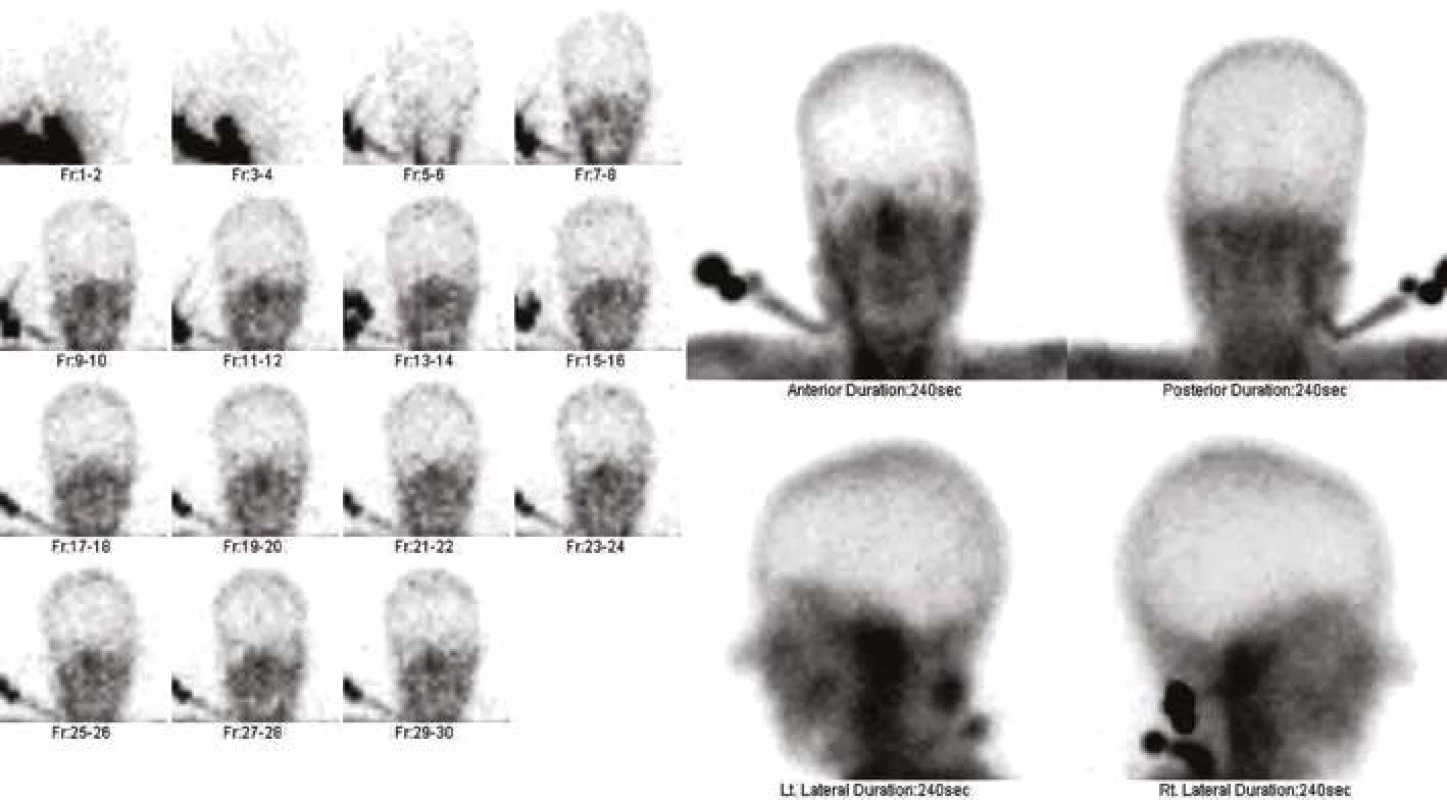
Image 2. Scintigrafické vyšetření aperfuze mozku – aperfuze mozku nepotvrzena, patrná je reziduální akumulace radiofarmaka v mozku 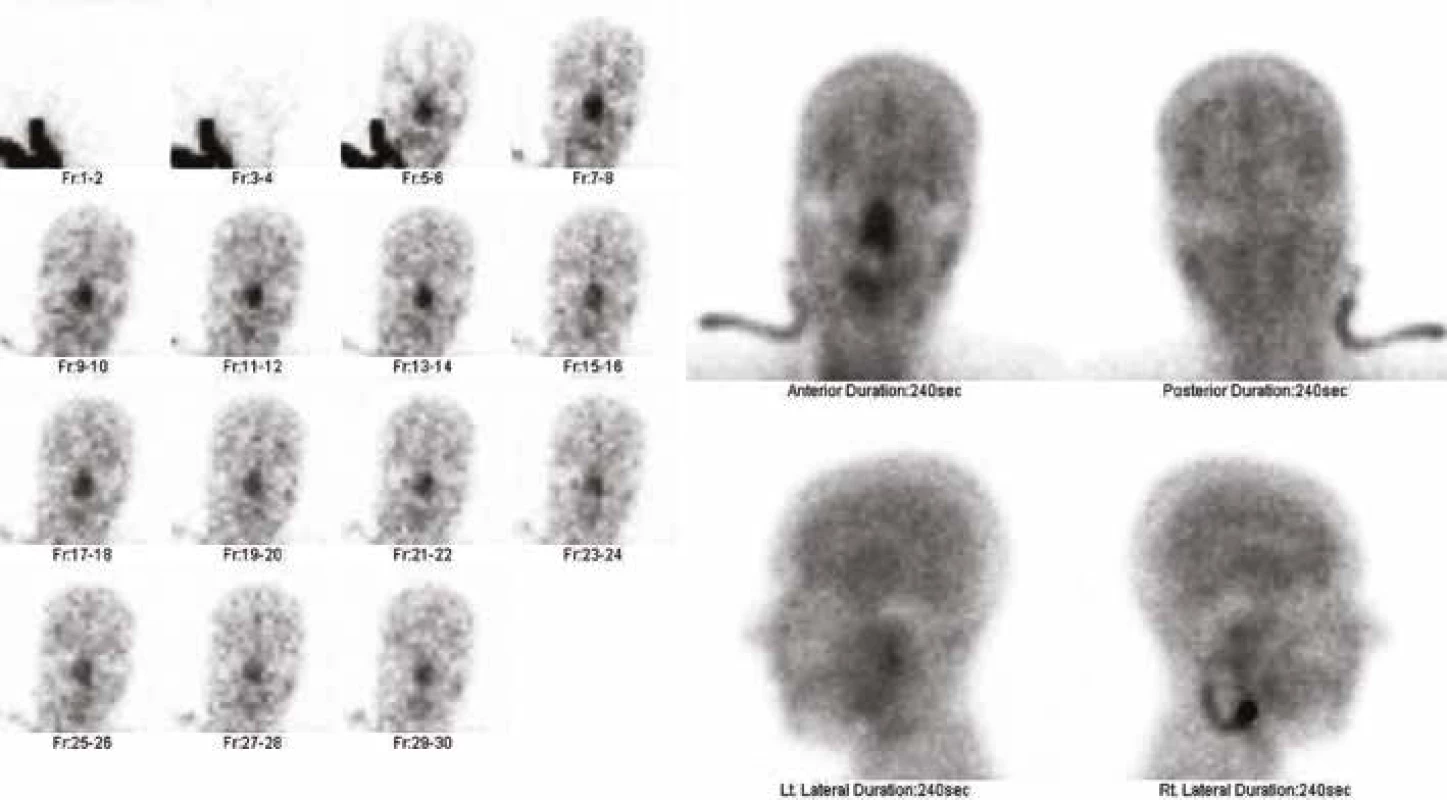
Pacienti s negativním scintigrafickým výsledkem
Mozková smrt nebyla prokázána u 17 (5 %) prvovyšetření. U 14 z těchto pacientů byla provedena opakovaná scintigrafická diagnostika s odstupem minimálně 24 hodin (u 13 pacientů jedno opakování, u jednoho pacienta opakování dvě), které v 7 případech již aperfuzi prokázalo. V případě 7 pacientů, u kterých nebyla aperfuze prokázána ani při opakovaném vyšetření, došlo k úmrtí pacientů v intervalu nejdéle do tří dnů při paliativní péči, v jednom takovém případě se stal pacient dárcem orgánů po prokázání nevratné zástavy cirkulace. U 3 pacientů nebylo opakované scintigrafické vyšetření provedeno, 2 z nich zemřeli do 24 hodin od vyšetření, u jednoho byla následující den aperfuze mozku prokázána angiograficky (graf 2). Charakteristiky podsouboru pacientů, u kterých nebyla aperfuze mozku při prvovyšetření prokázána, jsou shrnuty v tabulce 2.
Table 2. teristika pacientů, u kterých nebyla diagnostikována aperfuze mozku při prvovyšetření 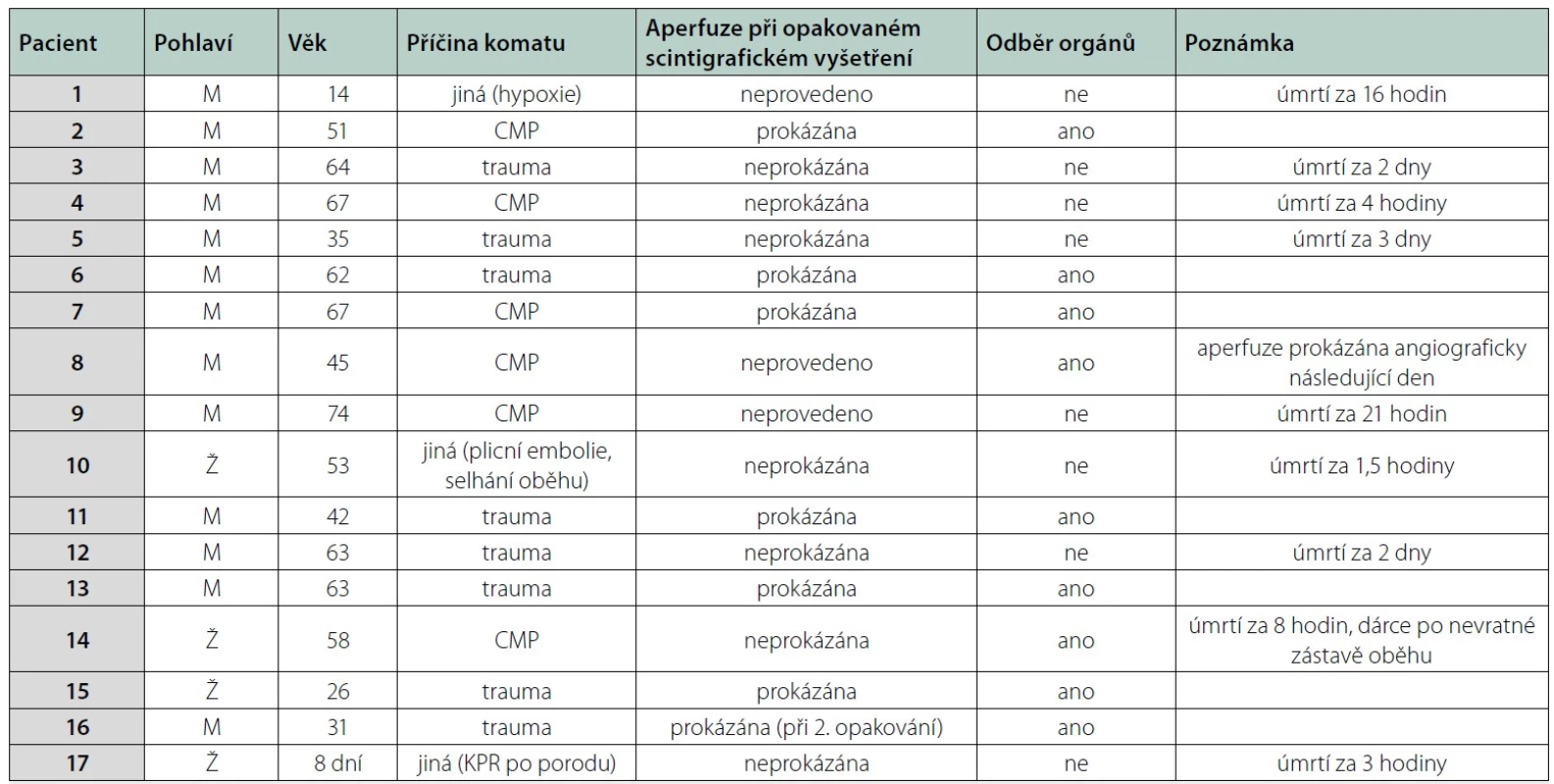
Graph 2. Podíl pozitivních a negativních výsledků scintigrafického vyšetření – celý soubor 
Graph 3. Orgánový odběr, ve skupině A (věk < 18 let) a B (věk ≥ 18 let) 
Graph 4. Příčiny kómatu u pacientů s a bez provedeného orgánového odběru 
Nebyly zde nalezeny signifikantní rozdíly oproti subjektům s pozitivním scintigrafickým nálezem aperfuze mozku při prvovyšetření v příčinách vedoucích ke smrti mozku (P = 0,6616), v pohlaví (P = 0,2962) ani ve věku vyšetřovaných (P = 0,3601).
Odběr orgánů
Odběr orgánů k transplantaci byl proveden celkem ve 267 (83 %) případech, v 53 (17 %) případech nebyl orgánový odběr proveden, a to u 22 (55 %) vyšetřených ve skupině A a u 31 (11 %) ve skupině B. Tento rozdíl mezi oběma skupinami byl statisticky významný (P < 0,0001), viz tabulku 1, graf 3.
Skupina pacientů, u kterých nebyl proveden orgánový odběr, se signifikantně odlišovala proporcemi příčin vedoucích ke komatóznímu stavu (P < 0,0001), kdy v ní minoritní podíly měly cévní mozkové příhody s 13 % případů, trauma a jiné zevní příčiny byly zastoupeny v 51 % a ostatní příčiny ve 36 %. U pacientů s provedeným orgánovým odběrem bylo zastoupení cévních mozkových příhod 50 %, traumata a jiné zevní příčiny a ostatní příčiny se vyskytovaly ve 43 %, resp. 7 % (graf 4).
Diskuze
Naše výstupy ukazují vysoký podíl pozitivních scintigrafických výsledků indikovaného vyšetření k diagnostice aperfuze mozku po předchozím klinickém vyšetření neurologem, celkově 95 %. Zřetelné jsou rozdíly v příčinách kómatu mezi dětmi a dospělými. Tyto skupiny vyšetřených se zásadně liší i v podílu vstupujících jako dárci dále do transplantačního programu.
Legislativní definice smrti, a s tím spojená diagnostika, se stala důležitým milníkem pro další rozvoj transplantační medicíny. Nebo spíše naopak, tento rozvoj si vynutil přesně definovat smrt jedince. V roce 1968 publikovala ad hoc skupina Harvardské lékařské školy, složená z několika odborností i mimo oblast medicíny, s ohledem na teologický a etický aspekt definice smrti, zásadní práci, ve které byly použity termíny syndrom mozkové smrti a nevratné kóma a smrt mozku. V reportu byly definovány i postupy diagnostiky takového stavu, a to především na podkladě klinických známek [4]. Klinické projevy mozkové smrti jsou kóma, vymizení kmenových reflexů a apnoe [5]. V České republice je definice smrti součástí tzv. Transplantačního zákona, popsaná jako nevratná ztráta funkce celého mozku, včetně mozkového kmene [2]. Vymezení termínu smrt v právním předpisu je důležité, jelikož transplantaci od zemřelého dárce lze legálně provést až poté, co kompetentní lékař smrt stanoví. O diagnóze smrti mozku lze dle litery zákona uvažovat v případě, je‑li přítomna nevratná strukturální léze mozku, pacient je v hlubokém bezvědomí, na umělé plicní ventilaci a jsou vyloučeny reversibilní příčiny kómatu (např. intoxikace, hypotermie apod.).
Klinické vyšetření je doplněno vyšetřením potvrzujícím nevratnost smrti mozku, jedním z nich je i mozková perfuzní scintigrafie. Principiálně jsou používána stejná radiofarmaka jako při perfuzní scintigrafii mozku i v jiných indikacích. Tyto lipofilní látky prochází za fyziologických podmínek přes hematoencefalickou bariéru a akumulují se v mozkové tkáni, relativně více v astrocytech, za fyziologických podmínek úměrně regionálnímu průtoku [6, 7]. Akumulace ve viabilních buňkách je pak zajištěna přeměnou radiofarmaka na jeho hydrofilní formu. V případě aperfuze ale akumulace tohoto radioindikátoru v mozku chybí a nálezu dominuje depozice aktivity v měkkých tkáních skalpu a obličeje (typický je tzv. „hot nose sign“, který je podmíněn relativně vysokou akumulací radiofarmaka v měkkých tkáních nosu) [8].
Důležité je zachování kvality všech kroků procedury scintigrafického vyšetření, a to již od přípravy radiofarmaka, které musí splňovat dané parametry, především radiochemickou čistotu, která je vždy testována. Samotnou aplikaci radiofarmaka je možné provést pouze u monitorovaného pacienta se zachovalým krevním oběhem, což je ověřeno kontrolou středního arteriálního tlaku, který by měl být minimálně 80 mmHg u dospělých a 60 mmHg u dětí. Tímto je snaha zabránit vyšetření při hypoperfuzi mozku způsobené už samotným sníženým srdečním výdejem [9].
Ve velmi omezených případech může být obraz perfuze na scintigramu zachován i při smrti mozku. Popsán je případ akumulace radiofarmaka v případě mozkové smrti u novorozence, kterou lze vysvětlit možností zvětšení objemu novorozenecké lebky provázející edém mozku, působící proti nitrolební hypertenzi, a tím i proti redukci perfuzního tlaku. Přítomnost perfuze mozku detekované scintigraficky u mrtvých pacientů se tedy může omezeně vyskytovat. Specificita vyšetření je ale vysoká, udávaná až 100 % [9, 10]. I v našem souboru jsme zaznamenali případy (5 %), kdy i přes klinické známky smrti mozku byla zjištěna na scintigramu reziduální perfuze mozku. S odstupem minimálně 24 hodin, který je třeba zachovat pro rozpad radioaktivity z předchozího vyšetření, podstoupilo 14 ze 17 těchto pacientů opakované scintigrafické vyšetření, kdy byla aperfuze celého mozku prokázána v 7 případech (50 % z opakovaně vyšetřených). Domníváme se, že toto může být způsobeno tím, že porušená funkce předchází morfologické změny a odložený čas přináší prostor pro další rozvoj edému, který vede k prohloubení hypoperfuze, resp. k aperfuzi. Progredující charakter stavu představuje i to, že nikdo z pacientů s negativním vyšetřením nepřežil následně déle než 4 dny. Nenašli jsme určité sledované markery, které by byly spojeny se scintigrafickým nálezem neprokazujícím aperfuzi, avšak podíl těchto pacientů na celkovém počtu vyšetřených pro obecnější zhodnocení byl relativně nízký.
Invazivní digitální subtrakční angiografie mozkových tepen je vysoce senzitivní i specifickou metodou k diagnostice perfuze mozku. Její použití by mělo být upřednostněno v případě očekávaného benefitu pro pacienta, především pokud se předpokládá touto cestou i možné léčebné ovlivnění kómatu, jinak může být spojeno s rizikem vazospasmu vedoucího k možnému dalšímu poškození mozku [9]. V případě diagnostiky aperfuze při klinických známkách smrti mozku toto omezení ale může být přinejmenším diskutabilní, obecně je angiografie považována za „zlatý standard“. Limitací může být falešná pozitivita testu u pacientů v hypotenzi, také u pacientů po kraniotomii nebo při ventrikulární drenáži, čili v případě poklesu nitrolebního tlaku. Také je třeba počítat s tím, že jisté opacity lze sledovat až u 30 % pacientů, pravděpodobně jako obraz artefaktu při selektivní katetrizaci a vysokých aplikačních rychlostech [11]. Neinvazivní variantou je pak výpočetní tomografická angiografie, která je uvedena jako jedno z dalších možných vyšetření potvrzujících nevratnost klinických známek smrti mozku v naší legislativě, ještě vedle transkraniální Dopplerovské ultrasonografie, hodnotící rychlosti krevního průtoku, a vyšetření sluchových kmenových evokovaných potenciálů (BAEP) [2, 12].
Míra úmrtnosti je obecně relativně vysoká v prvním roce života, poté klesá a následně opět roste až do nejvyšších věkových kategorií. Obecně bývá uváděna vyšší intenzita úmrtnosti mužů ve všech věkových kategoriích, oproti ženám [13]. Námi prezentovaný soubor však nepředstavuje typický vzorek obyvatelstva, a proto nekopíruje příčiny úmrtí udávané v běžné populaci. I tak měla skupina vyšetřených pacientů ve věku nižším než 18 let jisté charakteristiky, kterými se odlišovala od skupiny vyšetřených dospělých, především rozdílnou distribuci příčin kómatu. Lze to přičítat tomu, že úrazy jsou celosvětově i v České republice nejčastější příčinou úmrtí dětí a mladých dospělých, naopak výskyt cévních mozkových příhod se zvyšuje s věkem [14, 15].
Přibližně polovina dětí se scintigrafickým průkazem aperfuze mozku nebyla zařazena do transplantačního programu, což je signifikantně větší podíl než u dospělé populace. Ztráta dítěte je traumatizujícím zážitkem, a tato situace má oproti dárcovství orgánů u dospělých svá specifika [16]. Část dětských pacientů se nestala dárci vzhledem k nesouhlasu rodičů. Vliv na výsledný rozdíl mezi dětmi a dospělými mohly mít i odlišnosti ve struktuře příčin vedoucích ke kómatu mezi oběma skupinami. U vyšetřených dětí byly relativně četnější příčiny, které mohou představovat i potenciální kontraindikace dárcovství, mezi které patří kupříkladu závažné infekční stavy neovlivnitelné léčbou, intoxikace, zhoubná nádorová bujení [17].
S radiofarmakem nejsou spojeny jiné vedlejší účinky na organismus vyšetřovaného. Na druhou stranu právě komplexnost celého procesu počínajícího už specializovanou přípravou radiofarmaka, které vzhledem k běžící radioaktivní přeměně a chemickým vlastnostem sloučeniny nemůže být vyrobeno do zásoby, ale vždy těsně před každým takovým vyšetřením, omezuje do jisté míry dostupnost této metody na některých pracovištích mimo standardní pracovní dobu ambulancí specializovaných pracovišť. Jinak se ale jedná o spolehlivou a rychlou metodu umožňující s vysokou specificitou potvrdit přítomnost aperfuze mozku jako průkaz mozkové smrti.
Závěr
Na závěr lze říci, že scintigrafické stanovení aperfuze mozku je jednou z dostupných zobrazovacích metod efektivně využitelných v algoritmu stanovení mozkové smrti, která potvrzuje klinické známky smrti dle našich výsledků v 95 % případů. Existují signifikantní rozdíly ve spektru příčin komatózního stavu mezi vyšetřovanými pacienty v dětském věku a v dospělosti, tyto skupiny se liší i podílem dárců vstupujících do transplantačního programu.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Část dat byla prezentována formou posteru na mezinárodním kongresu EANM 2017 ve Vídni, abstrakt: Širůček P, Havel M, Kraft O. Brain death scintigraphy. In: OCT 2017: European journal of nuclear medicine and molecular imaging 2017 New York. NY 10013 USA: Springer, 233 Spring St., New York, NY 10013 USA, 2017. s. 618–618. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Havel M. – první a korespondující autor, zpracování dat, podíl na klinické části; Školoudík D. – zásadní revize celkové osnovy článku, podíl na úvodu, diskuzi, vytěžení dat; Nováková D. – sběr dat, podíl na klinické části; Švec P. – podíl na klinické části, podíl na diskuzi, revize; Havránek P. – podíl na klinické části, podíl na diskuzi; Havlová G., Kraft O., Dedek V., Bukovanský K., Drozdková R. – podíl na klinické části, sběr dat, podíl na diskuzi, revize; Širůček P. – podíl na klinické části, sběr dat, iniciátor studie. Financování: Žádné. Projednání etickou komisí: Etická komise FN Ostrava, projednáno 19. března 2020, číslo jednací 293/2020.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martin Havel, Ph.D., MBA,
Článek přijat redakcí: 8. 7. 2021
Článek přijat k tisku: 31. 10. 2021
Sources
- Randell TT. Medical and legal considerations of brain death. Acta Anaesthesiol Scand. 2004; 48(2): 139–144.
- Česko. Zákon č. 285/2002 Sb. ze dne 30. května 2002 o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (Transplantační zákon). Česká republika: Sbírka zákonů; 2002.
- Standardy zdravotní péče – „Národní radiologické standardy - nukleární medicína“. Soubor doporučení a návod pro tvorbu místních radiologických postupů (standardů) na diagnostických a terapeutických pracovištích nukleární medicíny v České republice. Věstník Ministerstva Zdravotnictví České republiky. 2016; 2016(2/2016): 203–364.
- Beecher HK. A Definition of Irreversible Coma: Report of the Ad Hoc Committee of the Harvard Medical School to Examine the Definition of Brain Death. JAMA J Am Med Assoc. 1968; 205(6): 337–340.
- Goila AK, Pawar M. The diagnosis of brain death. Indian J Crit Care Med. 2009; 13(1): 7–11.
- Kapucu ÖL, Nobili F, Varrone A, Booij J, Borght TV, Nagren K, et al. EANM procedure guideline for brain perfusion SPECT using 99 m Tc‑labelled radiopharmaceuticals, version 2 Background and definitions. Eur J Nucl Med Mol Imaging. 2009; 36(12): 2093.
- Zerarka S, Pellerin L, Slosman D, Magistretti PJ. Astrocytes as a Predominant Cellular Site of 99mTc‑HMPAO Retention. J Cereb Blood Flow Metab. 2001; 21(4): 456–468.
- Conrad GR, Sinha P. Scintigraphy as a confirmatory test of brain death. Semin Nucl Med. 2003; 33(4): 312–323.
- Weckesser M, Schober O. Brain death revisited: Utility confirmed for nuclear medicine. Eur J Nucl Med. 1999; 26(11): 1387–1391.
- Medlock MD, Hanigan WC, Cruse RP. Dissociation of cerebral blood flow, glucose metabolism, and electrical activity in pediatric brain death. J Neurosurg. 1993; 79(5): 752–755.
- Rizvi T, Batchala P, Mukherjee S. Brain Death: Diagnosis and Imaging Techniques. Semin Ultrasound, CT MRI. 2018; 39(5): 515–529.
- Tomek A, Školoudík D, Škoda O, Neumann J, Šaňák D, Mikulík R, et al. Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP. Česká a Slov Neurol a Neurochir. 2016; 79(5): 608–611.
- Odbor statistiky obyvatelstva Český statistický úř ad. Vývoj úmrtnosti v České republice za období 2006-2016. 2017.
- Janoušek S, Kukla L, Sedlak P, Roth Z, Zvadová Z, Vignerová J, et al. Dětská úrazovost v České republice v období let 2009 a 2010. Čes‑slov Pediat. 2011; 66(3).
- Bruthans J. Epidemiologie a prognóza cévních mozkových příhod. Remedia. 2009; 19(2): 128–131.
- Rodrigue JR, Cornell DL, Howard RJ. Pediatric organ donation: what factors most influence parents’ donation decisions? Pediatr Crit Care Med. 2008; 9(2): 180–185.
- Česko. Vyhláška č. 113/2013 Sb. ze dne 7. května 2013 o stanovení bližších podmínek posuzování zdravotní způsobilosti a rozsahu vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací). Česká republika: Sbírka zákonů; 2013.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2021 Issue 4-5-
All articles in this issue
- Ohlédnutí za světovým kongresem anesteziologů
- Zhodnocení souboru pacientů vyšetřených perfuzní scintigrafií při stanovení smrti mozku
- Peroperační FiO2 a dlouhodobá pooperační mortalita
- Peroperační PEEP u obezních pacientů/pacientek
- Antagonizace nervosvalové blokády sugammadexem vs. neostigminem u pacientů podstupujících roboticky asistované urologické výkony – vliv na čas extubace a kvalitu zotavení – monocentrická prospektivní randomizovaná studie
- Pooperační změny poruch dýchání ve spánku v závislosti na použité anesteziologické technice: observační studie
- Použití methylenové modři v terapii refrakterního distributivního šoku
- Prevence venózní tromboembolie u pacientů v intenzivní péči
- Extraglotické pomůcky a jejich role v zajišťování dýchacích cest na bitevním poli
- Prophylaxis of venous thromboembolism in critically ill patients
- Popáleniny horních dýchacích cest a jícnu
- Centrální anticholinergní syndrom – zapomenutá diagnóza?
- Patron anesteziologů, sv. René, má svátek 28. 11.
- Nové zkušební otázky k atestaci
- Limity v přežití úspěšné akutní intenzivní péče
- Pooperační únavový syndrom
- Výběr z „NEJM Guideline Watch 2021“
- Mezinárodní doporučení pro postup u pacientů se sepsí a septickým šokem 2021
- Porodnická anestezie a srdeční choroby v klinickém pohledu
- Kognitivní omezení a dysfunkce po sepsi
- Zajímavosti, tipy a triky, informace z jiných oborů
- Současný pohled na dobu předoperačního lačnění novorozenců
- Vzpomínka na MUDr. Zdeňka Bystřického, CSc.
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Popáleniny horních dýchacích cest a jícnu
- Pooperační únavový syndrom
- Použití methylenové modři v terapii refrakterního distributivního šoku
- Prevence venózní tromboembolie u pacientů v intenzivní péči
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

