-
Medical journals
- Career
Prevence venózní tromboembolie u pacientů v intenzivní péči
Authors: R. Cihlář 1,2; V. Šrámek 1,3; P. Suk 1,3,4
Authors‘ workplace: Lékařská fakulta Masarykovy Univerzity, Brno 1; Anesteziologicko‑resuscitační, oddělení Nemocnice České Budějovice, a. s. 2; Anesteziologicko‑resuscitační, klinika, Fakultní nemocnice u sv. Anny v Brně 3; Mezinárodní centrum klinického výzkumu, Fakultní nemocnice u sv. Anny v Brně 4
Published in: Anest. intenziv. Med., 32, 2021, č. 4-5, s. 218-224
Category: Review Article
Overview
Tromboembolie je komplikace, která se vyskytuje u všech skupin hospitalizovaných pacientů. V intenzivní péči je riziko jejího vzniku výrazně vyšší díky řadě přidružených rizikových faktorů. Preventivní opatření založená především na podávání antikoagulačních látek a použití mechanických prostředků výrazně snižují riziko vzniku trombózy a také následné plicní embolie, která je nejzávažnější trombotickou komplikací s vysokou mortalitou.
Cílem tohoto přehledového článku je popsat možnosti prevence vzniku a rozvoje tromboembolie a jejich komplikací a současně upozornit na specifika u pacientů v intenzivní péči. Zvláštní pozornost je věnována klinickým situacím, které tromboprofylaxi ovlivňují – především selhání oběhu, jater a ledvin. Uvedeno je také shrnutí recentních doporučených postupů v profylaxi tromboembolie pro intenzivní péči.Klíčová slova:
intenzivní péče – tromboembolie – Heparin – hluboká žilní trombóza – nízkomolekulární heparin – profylaxe
Úvod
Výskyt hluboké žilní trombózy (HŽT) je u pacientů v intenzivní péči zvýšený. Nejčastější lokalizací vzniku trombu je hluboký žilní systém dolních končetin a pánve. Největším rizikem HŽT je uvolnění části sraženiny s jejím následným vmetením do plicního řečiště a rozvojem plicní embolie, která, pokud je asociovaná s hemodynamickou nestabilitou, má až 14% mortalitu [1]. Významný je i výskyt HŽT v žilách horních končetin, která je většinou spojená se zavedením centrálních žilních katetrů, malignitou či traumatem horní končetiny. Jen výjimečně však vede k plicní embolii a ve studiích nebyl prokázán vliv na mortalitu [2]. U pacientů v intenzivní péči se, oproti ostatním nemocným, přidružuje řada dalších rizikových faktorů rozvoje HŽT. Jejich přehled je uveden v tabulce 1. Ve studiích se uvádí výskyt HŽT mezi 13 a 31 % u pacientů hospitalizovaných na JIP [3]. Hluboká žilní trombóza a následná embolie vedou k prodloužení doby umělé plicní ventilace i doby pobytu na jednotce intenzivní péče a také k vzestupu mortality a nákladů na péči [4].
Table 1. Rizikové faktory hluboké žilní trombózy 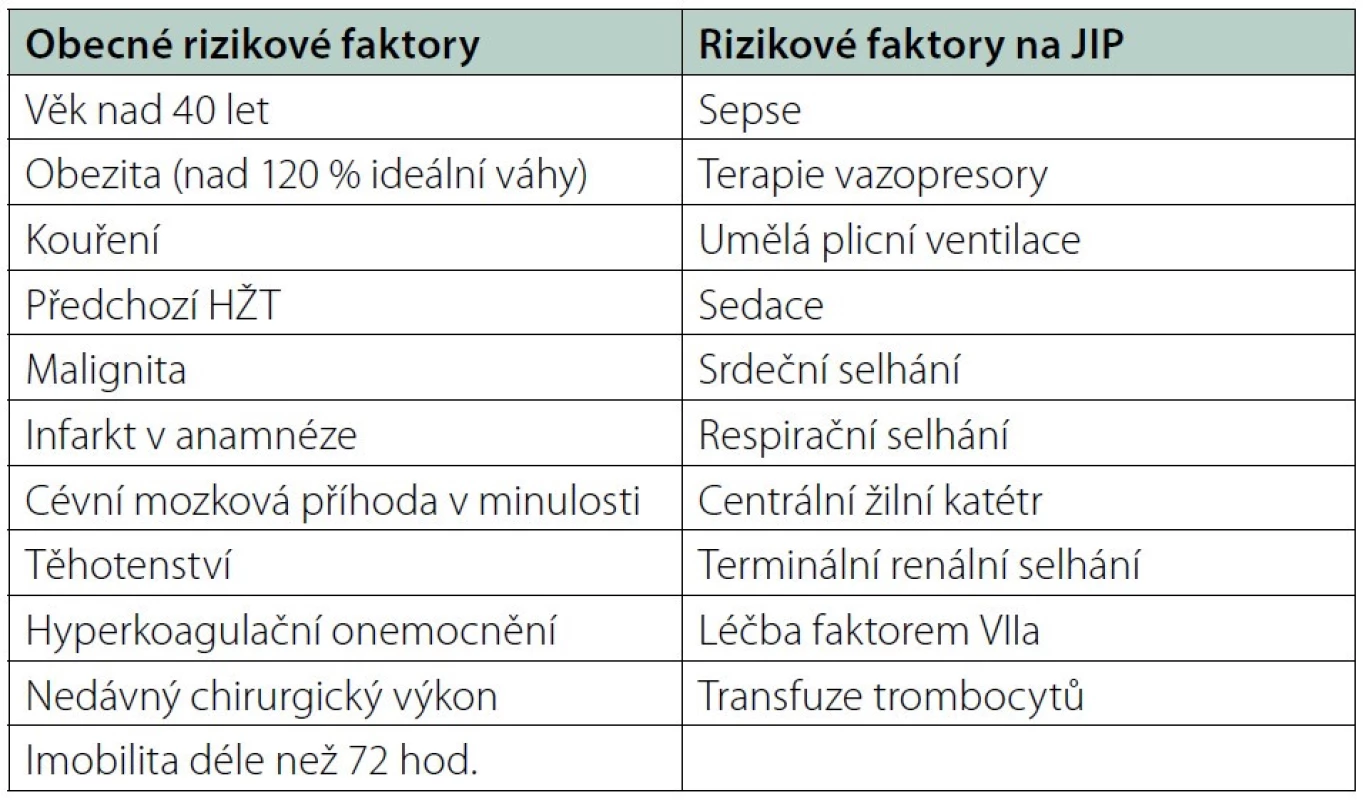
Diagnostika HŽT
U pacientů na JIP jsou omezené možnosti diagnostiky hluboké žilní trombózy. Často probíhá bezpříznakově nebo jsou klinické příznaky jen obtížně hodnotitelné, především pro vyšší výskyt edémů při kumulaci tekutin, horšího posouzení jak bolestivosti dolních končetin (DK), tak i omezení hybnosti v kloubech DK. Plicní embolie je pak často prvním projevem HŽT. Z laboratorních vyšetření máme k dispozici stanovení D‑dimerů v séru, které má však nízkou specificitu a neodráží míru rizika vzniku hluboké žilní trombózy [5]. Jako jedinou spolehlivou metodou diagnostiky HŽT zůstává sonografické vyšetření hlubokého žilního systému DK a pánve. Při rutinním použití sonografie hlubokého žilního systému se zvyšuje průkaznost asymptomatické trombózy dolních končetin z 2,6 % na 9,6 % [6]. Přesto není rutinní sonografie žil DK doporučována u pacientů se zavedenou tromboprofylaxí a nízkým klinickým podezřením na HŽT [7]. Detekce asymptomatické nebo distální HŽT může vést k zahájení antikoagulační terapie, která zvyšuje riziko krvácení, ale nemusí vést ke snížení vzniku komplikací trombózy [7]. Snížení výskytu žilní trombózy a rizika vzniku plicní embolie lze dosáhnout pomocí preventivních opatření [7].
Možnosti prevence vzniku tromboembolie u pacientů v intenzivní péči
Farmakologická profylaxe
Bylo prokázáno signifikantní snížení výskytu HŽT u pacientů s preventivním podáváním nízkomolekulárního heparinu [8, 9] i nefrakcionovaného heparinu [10, 11]. Recentní doporučené postupy uvádějí doporučení pro užití farmakologické profylaxe vzniku žilní trombózy u pacientů hospitalizovaných na JIP – Americká škola hrudních lékařů (American College of Chest Physicians – ACCP) se silou doporučení 2C [12], Evropská anesteziologická společnost (European Society of Anaesthesilogy and Intensive Care – ESAIC) doporučení IB [7]. Obě tyto společnosti také doporučují použití nízkomolekulárního heparinu (Low Molecular Weight Heparin – LMWH) před nefrakcionovaným heparinem (UnFractionated Heparin – UFH). Tato doporučení jsou podložena daty ze studie PROTECT [9], kde autoři potvrdili stejný efekt v prevenci HŽT, ale nižší výskyt plicní embolie u pacientů s LMWH. Snížení incidence HŽT bylo prokázáno u subkutánně podaného LMWH oproti nefrakcionovanému heparinu ve studii s pacienty se srdečním a respiračním selháním [13] a u pacientů s těžkým traumatem [14]. Aplikace LMWH signifikantně snižuje riziko rozvoje heparinem indukované trombocytopenie (HIT) oproti profylaktickému podávání nefrakcionovaného heparinu [9, 15]. Nebyl však prokázán rozdíl ve výskytu krvácivých komplikací mezi pacienty léčenými nefrakcionovaným nebo nízkomolekulárním heparinem [8, 15, 16].
Nefrakcionovaný heparin
Heparin je přirozeně se vyskytující antikoagulační látka, jehož zdrojem jsou žírné buňky ve tkáních savců. Je tvořen řadou mukopolysacharidových řetězců, jejichž molekulová hmotnost kolísá mezi 3 000 až 40 000 daltony. Heparin sám o sobě nemá antikoagulační vlastnosti, jeho biologická aktivita je podmíněna přítomností plazmatického antitrombinu III (AT III). Ten inhibuje proteolytické působení aktivovaných faktorů srážení, především trombinu a aktivovaného faktoru X (Xa) tím, že s nimi tvoří stabilní ekvimolární komplexy. Heparin jejich tvorbu asi 1000× urychluje [18]. Poměr ovlivnění trombinu a faktoru Xa se u nefrakcionovaného heparinu pohybuje kolem 1 : 1. Působením heparinu dochází k blokádě i dalších koagulačních procesů: zvyšuje uvolnění inhibitoru tkáňového faktoru (tissue factor pathway inhibitor – TFPI) a snižuje se schopnost agregace krevních destiček. Heparin má jen minimální vliv na fibrinolýzu [18]. Nežádoucí účinky heparinu jsou, kromě různých druhů krvácení, které jsou spojeny s jeho antikoagulační aktivitou, také osteoporóza, alopecie a nejvýznamnější pak je rozvoj heparinem indukované trombocytopenie (HIT). Další nevýhodou je i omezená biodostupnost po subkutánním podání (30–50 %). Naopak výhodou heparinu je existence antidota – protaminu, který se váže na heparin za vzniku stabilního komplexu bez antikoagulačního účinku.
Nízkomolekulární hepariny
LMWH vznikají štěpením nefrakcionovaného heparinu na fragmenty o 16–20 monosacharidových jednotkách, které mají molekulovou hmotnost kolem 5 000 daltonů [19]. Takto vzniklé LMWH mají 4× vyšší afinitu k AT III, než má nefrakcionovaný heparin. Vazbou s AT III vzniká komplex AT III/LMWH, který má, na rozdíl od komplexu AT III/UFH, jen malý efekt na trombin. Převážná část jeho antikoagulačního účinku je zprostředkována inaktivací faktoru Xa [20]. Zmenšením molekuly heparinu na LMWH se také výrazně mění biodostupnost nízkomolekulárních heparinů. Velmi dobře se vstřebávají po subkutánním podání (více než 90 %) a mají nízkou vazbu na plazmatické bílkoviny [21]. To vede k udržení jejich stabilní hladiny v plazmě a tedy i k možnosti dobře odhadnout jejich účinek. Poločas nízkomolekulárních heparinů v plazmě není tolik závislý na dávce, jako je tomu u nefrakcionovaného heparinu, ale hlavně na funkci ledvin a renální clearance LMWH [22]. Mají mnohem menší riziko rozvoje heparinem indukované trombocytopenie [9]. Protamin jen částečně antagonizuje účinek LMWH, kdy je schopen eliminovat vliv na trombin (faktor IIa), ale jen minimálně ovlivnit jejich účinek na faktor Xa.
Biodostupnost LMWH u pacientů v intenzivní péči je však odlišná od běžné populace, a to díky rozdílnému vstřebávání po subkutánním podání. Dostupnost je omezena [23] především vlivem periferní vazokonstrikce způsobené účinkem vazopresorů podávaných pacientům v intenzivní péči, jak prokázala i naše studie [23, 24]. Zhoršení biodostupnosti po subkutánní aplikaci je také u pacientů s podkožním edémem způsobeným kumulací tekutin [25]. Vliv edému však nepotvrdil Romerss [26] ve studii, kde srovnával biodostupnost dalteparinu po subkutánní aplikaci u pacientů v intenzivní péči s přítomností edémů a bez jejich výskytu. Srovnání heparinu a dostupných nízkomolekulárních heparinů ukazuje tabulka 2.
Table 2. Srovnání nízkomolekulárních heparinů, fondaparinuxu a UFH 
Legenda: S.C. – subkutánní, I.V. – intravenózní, AKS – akutní koronární syndrom, NAP – nestabilní angina pectoris, STEMI – infarkt myokardu s ST elevací na EKG, HIT – heparinem indukovaná trombocytopenie Monitorace účinku LMWH
K monitoraci účinku LMWH se používá stanovení anti‑Xa aktivity metodou chromogenních substrátů. Nízkomolekulární hepariny tvoří s AT III dimerní komplex (AT III‑LMWH), který vyvazuje v nadbytku dodané definované množství čistého faktoru Xa. Zbytkové množství faktoru Xa se potom stanovuje spektrofotometricky a je nepřímo úměrné koncentraci LMWH v testované plazmě [27]. Doporučená hodnota anti‑Xa aktivity v tromboprofylaxi u pacientů v intenzivní péči není zcela jasně stanovena. Je jen omezený počet studií, které uvádějí cílovou hodnotu špičkové anti‑Xa aktivity v profylaxi HŽT, většinou mezi 0,2–0,4 IU/ml [28–30]. Stanovení špičkové anti‑Xa aktivity je vhodné provést mezi 3. a 4. hodinou od s.c. aplikace, kdy je hladina LMWH nejvyšší. Některé práce však doporučují monitorování údolní anti‑Xa aktivity před podáním další dávky [31–33]. Práce Levina [31] z roku 1989 byla jednou z prvních studií, která prokázala signifikantně vyšší výskyt HŽT u pacientů s údolní anti‑Xa aktivitou nižší než 0,1 IU/ml. Malinoski prokázal, že nedosažení údolní hodnoty anti‑Xa aktivity 0,1 IU/ml u traumatologických kriticky nemocných pacientů, je rizikem pro rozvoj HŽT [33]. Recentní intervenční studie s dalteparinem prokázala významné snížení výskytu HŽT u pacientů s údolní anti‑Xa aktivitou pod 0,1 IU/ml 12 hodin po s.c. aplikaci, kterým byl následně zkrácen dávkovací interval na 2× denně [32]. V praxi se tento přístup však příliš nepoužívá.
Rutinní monitorace anti‑Xa aktivity není v doporučených postupech ACCP a ESAIC u pacientů v intenzivní péči doporučena. Přesto jsou kriticky nemocní jednou ze skupin, kde je vzhledem ke změnám biodostupnosti i eliminace možné zvážit monitorování anti‑Xa aktivity s případnou úpravou dávkování. Je možné sledovat jak špičkovou anti‑Xa aktivitu (cílové rozmezí 0,2–0,4 IU/ml), tak i údolní anti‑Xa aktivitu (cílové rozmezí 0,1–0,2 IU/ml). Tento postup může vést ke snížení výskytu HŽT i krvácivých projevů [34, 35], i když jiné práce přínos nepotvrdily. Příkladem je studie Karcutskie et al. u kriticky nemocných pacientů s traumatem [36], kdy navýšení dávky enoxaparinu při nedostatečné špičkové anti‑Xa aktivitě nevedlo ke snížení výskytu HŽT.
Renální insuficience
Jedním z hlavních rizikových faktorů pro kumulaci LMWH a následně zvýšené riziko rozvoje krvácivých komplikací, je renální insuficience, obvykle definována hodnotou clearance kreatininu pod 30 ml/min. [37]. Je to dáno především tím, že poločas nízkomolekulárních heparinů v plazmě není tolik závislý na dávce, ale především na renální clearance [22]. U těchto pacientů je vhodnější podávat dalteparin, který má vyšší molekulovou hmotnost a jeho eliminace je méně závislá na renálních funkcích [28, 37, 38]. Ten však není t. č. v ČR registrován. Při použití ostatních LMWH s menší molekulou je vhodné u pacientů s renální insuficiencí monitorovat špičkovou anti‑Xa aktivitu, aby nedošlo ke kumulaci LMWH, která je spojena se zvýšeným rizikem krvácivých komplikací [22]. Ve studii s enoxaparinem byla prokázána korelace špičkové anti‑Xa aktivity a clearance kreatininu po s.c. aplikaci terapeutických dávek u pacientů s renálním selháním [39]. V této studii však nebyl pozorován vyšší výskyt krvácivých projevů u pacientů s renální insuficiencí. Přesto je vhodná redukce dávky enoxaparinu, jak uvádějí doporučení ESAIC [7]. Při clearance kreatininu pod 30 ml/min. je vhodné snížit dávku enoxaparinu na 30 mg s.c. 1× denně.
Obézní pacienti
Další skupinou pacientů se špatně predikovatelnou farmakodynamikou jsou obézní jedinci s body mass index (BMI) nad 40 kg/m2, kteří vyžadují odlišný přístup v dávkování LMWH [40]. Je prokázáno, že pacienti s BMI nad 30–40 kg/m2 mají 2× až 3× vyšší výskyt hluboké žilní trombózy než běžná populace [41]. Zdá se, že u vysoce obézních pacientů může vyšší dávkování nízkomolekulárních heparinů snížit výskyt hluboké žilní trombózy [42]. Data u pacientů v intenzivní péči však nejsou dostupná. I proto je u této skupiny pacientů vhodná úpravadávkování podle anti‑Xa aktivity stanovené 4 hodiny po subkutánní aplikaci LMWH [42, 43].
Hepatopatie
U pacientů s poruchou jaterních funkcí je častý deficit koagulačních faktorů a trombocytopenie. Riziko krvácení je však ovlivněno více portální hypertenzí než abnormalitou koagulačních testů, jako je prodloužený protrombinový čas (PT). U hospitalizovaných pacientů je jaterní cirhóza dokonce rizikový faktor pro vznik HŽT [44]. Zvýšené riziko vzniku trombózy je na podkladě vyššího výskytu antifosfolipidových protilátek a častější incidenci vaskulopatií [45]. I přesto, že prodloužený PT nechrání pacienty s cirhózou jater před vznikem hluboké žilní trombózy [46], tito nemocní často nemají farmakologickou profylaxi [47].
Aktuálně nejsou dostupná data na profylaxi HŽT u kriticky nemocných a dokonce ani u hospitalizovaných pacientů s cirhózou jater. Dle doporučení americké gastroenterologické společnosti je farmakologická profylaxe HŽT u pacientů s cirhózou indikována, pokud nejsou přítomny zřejmé kontraindikace [48]. Játra se podílejí na biotransformaci LMWH desulfatizací a depolymerizací na složky s nižší molekulovou hmotností i účinností. Jasná doporučení pro dávkování nejsou dostupná, ale ve studii z roku 2006 byla užita dávka enoxaparinu 40 mg s.c. 1× denně [49]. Proto se standardní profylaktická dávka 1× denně jeví jako racionální. V dalších studiích, které sledovaly tromboprofylaxi u pacientů s poruchou funkce jater [46, 47], nebyla použita žádná profylaxe proti vzniku HŽT a nebo autoři upřednostňovali mechanické metody před farmakologickými.
Mechanická prevence vzniku HŽT
Mechanické metody prevence vzniku hluboké žilní trombózy vedou svým tlakem na dolní končetiny k uzavření povrchový žil a tím zvyšují rychlost proudu v hlubokém žilním systému. Vyšší rychlost proudění v hlubokém systému pak vede ke snížení tendence k tvorbě trombů a výskytu hluboké žilní trombózy. V klinické praxi se používají punčochy s graduovanou kompresí (gratuated compression stockings – GCS) a intermitentní pneumatické kompresní systémy (intermittent pneumatic compression – IPC). Použití GCS je vhodné spíše pro pacienty s chronickou žilní insuficiencí a edémy dolních končetin. V prevenci tromboembolie je lze použít pouze u pacientů s nízkým rizikem vzniku HŽT. Jejich použití v intenzivní péči se podle některých studií nejeví jako příliš vhodné [50], ale je doporučováno ACCP [12]. IPC jsou založeny na přerušované insuflaci návleků na dolních končetinách pomocí externího kompresoru. Kromě zvýšení proudu krve v hlubokém žilním systému, vedou intermitentní komprese navíc k potlačení uvolňování aktivátoru inhibitoru plazminogenu (PAI-1) a naopak k uvolňování tkáňového aktivátoru plazminogenu. Tím dochází k pozitivnímu ovlivnění fibrinolýzy [51]. Je jen omezené množství dat o efektivitě jejich použití u pacientů v intenzivní péči. Jejich nasazení je na zvážení u pacientů s vysokým rizikem krvácení, kteří mají kontraindikaci k farmakoprofylaxi vzhledem k možným „katastrofickým“ důsledkům vzniklého krvácení. Jedná se především o neurochirurgické pacienty s rizikem mozkové nebo míšní hemoragie a nemocné s cévní mozkovou příhodou. Ukázalo se, že IPC jsou účinné v prevenci hluboké žilní trombózy u neurochirurgických pacientů podstupujících kraniotomii [52]. Randomizovaná studie provedená na pacientech s intracerebrálním krvácením navíc zjistila, že IPC je účinnější v prevenci asymptotických HŽT než samotné GCS [53]. Jejich použití by však mělo být krátkodobé, jen po dobu zvýšeného rizika krvácení. Následně je vhodné přejít na standardní farmakoprofylaxi, nejlépe bolusovou aplikací nízkomolekulárního heparinu.
Z dostupných dat vyplývá, že pacienti, u kterých nebyla použita žádná metoda profylaxe proti vzniku HŽT mají vyšší výskyt tromboembolie oproti pacientům, u kterých byla aplikována mechanická prevence užitím IPC [3]. Naopak, pacienti s užitím IPC mají vyšší výskyt tromboembolických komplikací oproti nemocným, u nichž byla aplikována doporučená farmakoprofylaxe nízkomolekulárním nebo nefrakcionovaným heparinem [54]. Arabi [55] ve studii PREVENT hodnotil, zda přidání IPC ke standardní farmakoprofylaxi LMWH nebo UFH vede ke snížení výskytu HŽT. Vzhledem k tomu, že nebyl prokázán rozdíl (3,9 % versus 4,2 %), nepřináší užití IPC u pacientů, kterým je aplikována standardně doporučená farmakoprofylaxe HŽT, žádný přínos [56]. Tyto závěry se úplně neztotožňují s doporučením ESAIC [57], která doporučuje u pacientů s vysokým rizikem HŽT použít kombinaci IPC a farmakoprofylaxe (stupeň 2B).
Kontraindikací mechanických metod v prevenci hluboké žilní trombózy je ischemická choroba dolních končetin (ICHDK), trofické změny a vředy na dolních končetinách, rozsáhlé otoky DK a také pooperační stavy a traumata DK.
Kavální filtry
Kavální filtr je síťka, která se implantuje do dolní duté žíly a jejím úkolem je zachycení trombů uvolněných z žil dolních končetin nebo pánve. Kavální filtr tak brání embolizaci do plic zachycením uvolněného trombu. Rozlišují se dva základní typy kaválních filtrů, a to permanentní a vyjímatelné. Vyjímatelné, které jsou preferovány před permanentními, se po zavedení dají v určitém časovém intervalu opět vyjmout [58]. Jejich zavedení je spojeno s řadou potencionálních komplikací – migrace filtru, jeho vrůstání do dolní duté žíly, perforace dolní duté žíly, riziko tvorby trombu na kaválním filtru s jeho okluzí nebo vznikem plicní embolie [59, 60].
Indikace k zavedení kaválního filtru u pacientů s HŽT jsou absolutní kontraindikace antikoagulační terapie, komplikace antikoagulační terapie vedoucí k nutnosti jejího ukončení a také selhání antikoagulační terapie. V intenzivní péči je zavedení kaválních filtrů zvažováno především u pacientů s polytraumatem, těžkým kraniotraumatem, s mnohočetnými frakturami dlouhých kostí dolních končetin a pánve, kde je antitrombotická i mechanická profylaxe vzniku tromboembolie kontraindikována [61]. Velká recentní studie na traumatologických pacientech však nepotvrdila snížení incidence asymptomatické PE ani snížení 90denní mortality [62]. Na základě EBM nelze rutinní užití kaválních filtrů v profylaxi HŽT doporučit. Jedinou indikací jsou nemocní s akutní proximální HŽT nebo PE a absolutní kontraindikací k antikoagulaci.
Klinická praxe farmakologické profylaxe v intenzivní péči
Všechny pacienty v intenzivní péči je vhodné považovat za pacienty s vysokým rizikem rozvoje HŽT. Proto je důležité, aby všichni tito pacienti měli antitrombotickou prevenci, nejlépe formou farmakologické profylaxe. Doporučení ESAIC pro pacienty v intenzivní péči jsou shrnuta v tabulce 3. Aktuální doporučení však nezahrnují řadu specifických situací u kriticky nemocných pacientů a klinická praxe se často od těchto doporučení odchyluje. Proto jsme na základě dostupné literatury a našich zkušeností popsali možná řešení následujících situací:
- pacienti bez zvýšeného rizika krvácení: vhodná je s.c. aplikace LMWH. Není preferována žádná konkrétní látka, ale enoxaparin má však nejširší indikační použití dle SPC a je i nejčastěji užívaným LMWH ve studiích. Jak již bylo zmíněno, dosažení dostatečné údolní anti‑Xa aktivity je spojené se snížením incidence tromboembolie. Řada prací prokázala, že je nutné užití 40 mg enoxaparinu ve 12hodinových intervalech k dosažení údolní anti‑Xa > 0,1 IU/ml [33–35, 63, 64]. Proto považujeme dávkování 40 mg enoxaparinu po 12 hodinách vhodné pro většinu kritických nemocných bez zvýšeného rizika krvácení. Na druhou stranu je třeba zmínit, že některé práce jsou zaměřené na hodnocení anti‑Xa aktivity a ne na klinický výskyt HŽT. Navíc zahrnují převážně traumatologické a chirurgické pacienty, což znesnadňuje zobecnění na všechny pacienty v intenzivní péči.
- pacienti s vysokým rizikem krvácení: neurochirurgické operace, nitrolební krvácení, kranoiotraumata, polytraumata, kdy je vhodná mechanická prevence IPC po dobu trvání rizika krvácení. Po snížení rizika přechod na subkutánní LMWH dle doporučení uvedených výše.
- pacienti s renální insuficiencí: nejvhodnějším LMWH je dalteparin, má největší molekulovou hmotnost a jeho clearance je méně závislá na renálních funcích. V ČR není registrován. Podle doporučení ACCP [65] je vhodná redukce dávky LMWH při clearance kreatininu pod 30 ml/min. Pro enoxaparin je doporučeno dávkování 30 mg s.c. a 24 h [65]. Dle našich zkušeností jde spíše o konzervativní dávku s minimálním rizikem kumulace, která u řady nemocných nevede k dosažení dostatečné anti‑Xa aktivity, proto se nabízí navýšení dávky s nutností sledování anti‑Xa aktivity.
- obézní pacienti: pacienti s BMI nad 40 kg/m2 nedosahují dostatečné anti‑Xa aktivity po standardní aplikaci enoxaparinu v dávce 30 mg 2× denně [42]. Podobné riziko představuje i síla břišní stěny větší než 50 mm [63]. Podle studie provedené Rowanem [42] je u části obézních pacientů po bariatrické operaci dosaženo dostatečné profylaktické anti‑Xa aktivity při navýšení dávky enoxaparinu s doporučovaných 30 mg na 40 mg enoxaparinu s.c. v intervalu 12 hodin. Nejsou však dostupná data pro pacienty v intenzivní péči.
- pacienti s podporou oběhu katecholaminy: nejsou jasné závěry, zda katecholaminy snižují vstřebávání LMWH po s.c. aplikaci. Některé studie tento vliv potvrdily [23, 24], jiné naopak vyvrátily [9, 66]. V naší studii z roku 2020 [23] byla pozorována úzká korelace mezi časem kapilárního návratu při kompresi nehtového lůžka a sníženou resorpcí LMWH po subkutánní aplikaci, současně byla také prokázaná závislost mezi dávkou noradrenalinu a sníženým vstřebáváním LMWH. Z důvodu možné zhoršené biodostupnosti LMWH po s.c. aplikaci je u pacientů s podporou oběhu vazopresory (prahová dávka není zřejmá) a poruchou periferní perfuze vhodná monitorace anti‑Xa aktivity. Spolehlivé je intravenózní podání, které však nemá oporu v doporučeních a není stanovena dávka ani terapeutický cíl. Pro heparin se jeví adekvátní dávka 10 tisíc IU na 24 hodin v kontinuální infuzi. Dle farmakologického modelu založeného na datech z naší studie [23] vede podání 7 600 IU nadroparinu na 24 hodin k dosažení střední ustálené hladiny anti‑Xa aktivity 0,16 IU/ml, což splňuje požadavky na údolní anti‑Xa aktivitu > 0,1 IU/ml. Je třeba zohlednit sníženou clearance u pacientů s renální insuficiencí. Navíc je nutné uvést, že LMWH nejsou schválené k i.v. aplikaci v prevenci HŽT.
- pacienti s chronickou antikoagulační terapií: pacienti užívající dlouhodobě inhibitory vitaminu K, či nově přímé inhibitory Xa nebo trombinu (přímá perorální antikoagulancia – DOAC), se v intenzivní péči vyskytují stále častěji. Jejich podávání je nejčastěji indikováno u pacientů s fibrilací síní, u pacientů s chlopenními náhradami a dále v prevenci a léčbě hluboké žilní trombózy a PE 67]. O strategii jejich antikoagulační terapie v intenzivní péči je velmi málo publikovaných dat. Práce z roku 2020 [68] zahrnuje pacienty se SARS‑CoV - 2 hospitalizovaných na JIP. Dle závěrů této práce je vhodné u pacientů s HŽT a fibrilací síní, kteří užívají antagonisty vitaminu K, vyčkat na pokles INR pod 2 a pak zahájit léčbu LMWH nebo UFH v terapeutických dávkách. U pacientů léčených DOAC je vhodné vyčkat 12–24 hod. po poslední dávce a uplatnit stejnou strategii – potřebný čas je ale závislý na eliminačním poločase jednotlivých preparátů a renálních funkcích. Při renální insuficienci je nutný delší čas. Naopak u pacientů s mechanickou chlopenní náhradou je třeba časně zahájit léčbu terapeutickými dávkami LMWH nebo nefrakcionovaného heparinu za kontroly anti‑Xa aktivity nebo aPTT [68].
- pacienti s HIT: je nutné okamžité ukončení aplikace jakýchkoli heparinů a zahájení alternativní antikoagulace. Profylaktické dávkování je nedostatečné vzhledem k masivní produkci trombinu a s tím spojeným vysokým rizikem trombotických komplikací [69]. K léčbě HIT jsou ve světě dostupné dva léky, přímý inhibitor trombinu argatroban a nepřímý inhibitor faktoru Xa danaparoid [70]. Ani jeden není v ČR schválen, proto je reálnou možností podání fondaparinuxu, který po navázání na AT III selektivně inhibuje faktor Xa. Riziko HIT při terapii fondaparinuxem je prakticky nulové [71]. Vzhledem k renální eliminaci a dlouhému biologickému poločasu je nutná redukce dávek při poklesu glomerulární filtrace. Na rozdíl od LMWH není jeho absorpce ovlivněna podávanými vazopresory [72]. Jeho podávání u pacientů s HIT však není schváleno Státním ústavem pro kontrolu léčiv ČR.
Table 3. Doporučení Evropské anesteziologické společnosti v prevenci HŽT pro pacienty v intenzivní péči [7, 57, 73] ![Doporučení Evropské anesteziologické společnosti v prevenci HŽT pro pacienty v intenzivní péči [7, 57, 73]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3514606349fa33360bfcd8903fd799e3.jpg)
Závěr
Pacienti v intenzivní péči jsou významně ohroženi vznikem tromboembolie. Rizikovými faktory – vedle samotného závažného onemocnění, které je prakticky vždy spojeno s hyperkoagulací – jsou především umělá plicní ventilace, podávání vazopresorů, zavedení centrálních žilních katetrů, užití eliminačních metod, sedace a dlouhodobá imobilizace. Z důvodu výskytu řady rizikových faktorů je u pacientů na JIP doporučována profylaxe proti vzniku tromboembolie. Standardním postupem je použití nízkomolekulárních heparinů, které se jeví efektivnější než UFH. Řada pacientů v intenzivní péči má i vysoké riziko krvácivých komplikací, zvláště po rozsáhlých operačních výkonech a mozkových příhodách. V této situaci je doporučené užití intermitentních kompresních systémů (IPC) dolních končetin po dobu kontraindikací farmakoprofylaxe. Používání kompresních punčoch dle některých studií není v intenzivní péči vhodné, ale v doporučeních ACCP je stále uvedeno. Pro zavedení kaválního filtru v prevenci vzniku HŽT není dostatečná opora, jeho užití je na zvážení v prevenci PE u nemocných s HŽT a kontraindikací antikoagulační terapie.PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. RC: příprava manuskriptu, VŠ: korekce manuskriptu, PS: příprava a korekce manuskriptu. Financování: Žádné.Článek přijat redakcí: 15. 4. 2021
Článek přijat k tisku: 30. 9. 2021;
Sources
- Jiménez D, Bikdeli B, Barrios D, Quezada A, Del Toro J, Vidal G, et al. Epidemiology, patterns of care and mortality for patients with hemodynamically unstable acute symptomatic pulmonary embolism. Int J Cardiol. 2018 Oct 15; 269 : 327–333.
- Eck RJ, Hulshof L, Wiersema R, Thio CHL, Hiemstra B, van den Oever NCG, et al. Incidence, prognostic factors, and outcomes of venous thromboembolism in critically ill patients: data from two prospective cohort studies. Crit Care. 2021 Jan 12; 25(1): 27.
- Minet C, Potton L, Bonadona A, Hamidfar‑Roy R, Somohano CA, Lugosi M, et al. Venous thromboembolism in the ICU: main characteristics, diagnosis and thromboprophylaxis. Crit Care. 2015 Aug 18; 19 : 287.
- Reynolds PM, Van Matre ET, Wright GC, McQueen RB, Burnham EL, Ho PJM, et al. Evaluation of Prophylactic Heparin Dosage Strategies and Risk Factors for Venous Thromboembolism in the Critically Ill Patient. Pharmacother J Hum Pharmacol Drug Ther. 2019 Mar; 39(3): 232–341.
- Sathe PM, Patwa UD. D Dimer in acute care. Int J Crit Illn Inj Sci. 2014 Jul; 4(3): 229–232.
- the Saudi Critical Care Trials Group, Arabi YM, Burns KEA, Alsolamy SJ, Alshahrani MS,Al‑Hameed FM, et al. Surveillance or no surveillance ultrasonography for deep vein thrombosis and outcomes of critically ill patients: a pre‑planned sub‑study of the PREVENT trial. Intensive Care Med. 2020 Apr; 46(4): 737–746.
- Duranteau J, Taccone FS, Verhamme P, Ageno W. European guidelines on perioperative venous thromboembolism prophylaxis: Intensive care. Eur J Anaesthesiol. 2018 Feb; 35(2): 142–146.
- Fraisse F, Holzapfel L, Couland J‑M, Simonneau G, Bedock B, Feissel M, et al. Nadroparin in the Prevention of Deep Vein Thrombosis in Acute Decompensated COPD. Am J Respir Crit Care Med. 2000 Apr; 161(4): 1109–1114.
- PROTECT Investigators for the Canadian Critical Care Trials Group and the Australian and New Zealand Intensive Care Society Clinical Trials Group, Cook D, Meade M, Guyatt G, Walter S, Heels‑Ansdell D, et al. Dalteparin versus unfractionated heparin in critically ill patients. N Engl J Med. 2011 Apr 7; 364(14): 1305–1314.
- Cade JF. High risk of the critically ill for venous thromboembolism: Crit Care Med. 1982 Jul; 10(7): 448–450.
- Kapoor M, Kupfer YY, Tessler S. Subcutaneous heparin prophylaxis significantly reduces the incidence of venous thromboembolic events in the critically ill: Crit Care Med. 1999 Dec; 27(Supplement): A69.
- Guyatt, Gordon H. Executive Summary: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines. Chest. 2012 Apr; 141(4): 7S–47S.
- Kleber F‑X, Witt C, Vogel G, Koppenhagen K, Schomaker U, Flosbach CW. Randomized comparison of enoxaparin with unfractionated heparin for the prevention of venous thromboembolism in medical patients with heart failure or severe respiratory disease. Am Heart J. 2003 Apr; 145(4): 614–621.
- Geerts WH, Jay RM, Code KI, Chen E, Szalai JP, Saibil EA, et al. A Comparison of Low‑Dose Heparin with Low‑Molecular‑Weight Heparin as Prophylaxis against Venous Thromboembolism after Major Trauma. N Engl J Med. 1996 Sep 5; 335(10): 701–707.
- Warkentin TE, Levine MN, Hirsh J, Horsewood P, Roberts RS, Gent M, et al. Heparin‑Induced Thrombocytopenia in Patients Treated with Low‑Molecular‑Weight Heparin or Unfractionated Heparin. N Engl J Med. 1995 May 18; 332(20): 1330–1336.
- Alexander BR, Antigua AD, Rosenberg AF, Caruso LJ, Voils SA, LeClaire AC. Chemoprophylaxis Use and Risk of Venous Thromboembolism and Death in Adult Patients following Orthotopic Liver Transplantation. J Pharm Pract. 2016 Jun; 29(3): 218–223.
- Samama MM, Cohen AT, Darmon J‑Y, Desjardins L, Eldor A, Janbon C, et al. A Comparison of Enoxaparin with Placebo for the Prevention of Venous Thromboembolism in Acutely Ill Medical Patients. N Engl J Med. 1999 Sep 9; 341(11): 793–800.
- Novotný J, Michalcová J, Penka M. Antikoagulační léčba 2018. Interv Akut Kardiol. 2018; 17(2): 113–122.
- Taktak F, Bütün V, Tuncer C, Demirel HH. Production of LMWH‑conjugated core/shell hydrogels encapsulating paclitaxel for transdermal delivery: In vitro and in vivo assessment. Int J Biol Macromol. 2019 May; 128 : 610–620.
- Mousa SA. Comparative pharmacodynamic assessment of the antiangiogenesis activity of heparin and low‑molecular‑weight heparin fractions: structure‑function relationship. Clin Appl Thromb Hemost. 2013 Feb; 19(1): 48–54.
- Costantino G, Ceriani E, Rusconi AM, Podda GM, Montano N, Duca P, et al. Bleeding Risk during Treatment of Acute Thrombotic Events with Subcutaneous LMWH Compared to Intravenous Unfractionated Heparin; A Systematic Review. Biondi‑Zoccai G, editor. PLoS ONE. 2012 Sep 11; 7(9): e44553.
- Helfer H, Siguret V, Mahé I. Tinzaparin Sodium Pharmacokinetics in Patients with Chronic Kidney Disease: Practical Implications. Am J Cardiovasc Drugs. 2020 Jun; 20(3): 223–228.
- Cihlar R, Sramek V, Papiez A, Penka M, Suk P. Pharmacokinetic Comparison of Subcutaneous and Intravenous Nadroparin Administration for Thromboprophylaxis in Critically Ill Patients on Vasopressors. Pharmacology. 2020; 105(1–2): 73–78.
- Dörffler‑Melly J, de Jonge E, Pont A‑C, Meijers J, Vroom MB, Büller HR, et al. Bioavailability of subcutaneous low‑molecular‑weight heparin to patients on vasopressors. Lancet. 2002 Mar 9; 359(9309): 849–850.
- Haas CE, Nelsen JL, Raghavendran K, Mihalko W, Beres J, Ma Q, et al. Pharmacokinetics and pharmacodynamics of enoxaparin in multiple trauma patients. J Trauma. 2005 Dec; 59(6): 1336–1343; discussion 1343–1344.
- Rommers MK, Van der Lely N, Egberts TCG, van den Bemt PMLA. Anti‑Xa activity after subcutaneous administration of dalteparin in ICU patients with and without subcutaneous oedema: a pilot study. Crit Care. 2006; 10(3): R93.
- Newall F. Anti‑factor Xa (Anti‑Xa) Assay. In: Monagle P, editor. Haemostasis [Internet]. Totowa, NJ: Humana Press; 2013 [cited 2016 Mar 28]. p. 265–72. Available from: http://link.springer.com/10.1007/978-1-62703-339-8_19
- Rabbat CG, Cook DJ, Crowther MA, McDonald E, Clarke F, Meade MO, et al. Dalteparin thromboprophylaxis for critically ill medical‑surgical patients with renal insufficiency. J Crit Care. 2005 Dec; 20(4): 357–363.
- Nutescu EA, Spinler SA, Wittkowsky A, Dager WE. Low‑molecular‑weight heparins in renal impairment and obesity: available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother. 2009 Jun; 43(6): 1064–1083.
- Nohe N, Flemmer A, Rümler R, Praun M, Auberger K. The low molecular weight heparin dalteparin for prophylaxis and therapy of thrombosis in childhood: a report on 48 cases. Eur J Pediatr. 1999 Dec;158 Suppl 3: S134–S139.
- Levine MN, Planes A, Hirsh J, Goodyear M, Vochelle N, Gent M. The relationship between anti‑factor Xa level and clinical outcome in patients receiving enoxaparine low molecular weight heparin to prevent deep vein thrombosis after hip replacement. Thromb Haemost. 1989 Nov 24; 62(3): 940–944.
- Droege ME, Mueller EW, Besl KM, Lemmink JA, Kramer EA, Athota KP, et al. Effect of a dalteparin prophylaxis protocol using anti‑factor Xa concentrations on venous thromboembolism in high‑risk trauma patients. J Trauma Acute Care Surg. 2014 Feb; 76(2): 450–456.
- Malinoski D, Jafari F, Ewing T, Ardary C, Conniff H, Baje M, et al. Standard prophylactic enoxaparin dosing leads to inadequate anti‑Xa levels and increased deep venous thrombosis rates in critically ill trauma and surgical patients. J Trauma. 2010 Apr; 68(4): 874–880.
- Dhillon NK, Smith EJT, Gillette E, Mason R, Barmparas G, Gewertz BL, et al. Trauma patients with lower extremity and pelvic fractures: Should anti‑factor Xa trough level guide prophylactic enoxaparin dose? Int J Surg. 2018 Mar; 51 : 128–132.
- Ko A, Harada MY, Barmparas G, Chung K, Mason R, Yim DA, et al. Association Between Enoxaparin Dosage Adjusted by Anti‑Factor Xa Trough Level and Clinically Evident Venous Thromboembolism After Trauma. JAMA Surg. 2016 01; 151(11): 1006–1013.
- Karcutskie CA, Dharmaraja A, Patel J, Eidelson SA, Padiadpu AB, Martin AG, et al. Association of Anti‑Factor Xa‑Guided Dosing of Enoxaparin With Venous Thromboembolism After Trauma. JAMA Surg. 2018 01; 153(2): 144–149.
- Park D, Southern W, Calvo M, Kushnir M, Solorzano C, Sinnet M, et al. Treatment with Dalteparin is Associated with a Lower Risk of Bleeding Compared to Treatment with Unfractionated Heparin in Patients with Renal Insufficiency. J Gen Intern Med. 2016 Feb; 31(2): 182–187.
- Douketis J, Cook D, Meade M, Guyatt G, Geerts W, Skrobik Y, et al. Prophylaxis against deep vein thrombosis in critically ill patients with severe renal insufficiency with the low‑molecular‑weight heparin dalteparin: an assessment of safety and pharmacodynamics: the DIRECT study. Arch Intern Med. 2008 Sep 8; 168(16): 1805–1812.
- Chow SL, Zammit K, West K, Dannenhoffer M, Lopez‑Candales A. Correlation of Antifactor Xa Concentrations with Renal Function in Patients on Enoxaparin. J Clin Pharmacol. 2003 Jun; 43(6): 586–590.
- Patel JP, Roberts LN, Arya R. Anticoagulating obese patients in the modern era. Br J Haematol. 2011 Oct; 155(2): 137–149.
- Vandiver JW, Ritz LI, Lalama JT. Chemical prophylaxis to prevent venous thromboembolism in morbid obesity: literature review and dosing recommendations. J Thromb Thrombolysis. 2016 Apr; 41(3): 475–481.
- Rowan BO, Kuhl DA, Lee MD, Tichansky DS, Madan AK. Anti‑Xa Levels in Bariatric Surgery Patients Receiving Prophylactic Enoxaparin. Obes Surg. 2008 Feb; 18(2): 162–166.
- Rondina MT, Wheeler M, Rodgers GM, Draper L, Pendleton RC. Weight‑based dosing of enoxaparin for VTE prophylaxis in morbidly obese, medically‑Ill patients. Thromb Res. 2010 Mar; 125(3): 220–223.
- Wu H, Nguyen GC. Liver cirrhosis is associated with venous thromboembolism among hospitalized patients in a nationwide US study. Clin Gastroenterol Hepatol. 2010 Sep; 8(9): 800–805.
- Al‑Dorzi HM, Tamim HM, Aldawood AS, Arabi YM. Venous Thromboembolism in Critically Ill Cirrhotic Patients: Practices of Prophylaxis and Incidence. Thrombosis. 2013; 2013 : 1–7.
- Dabbagh O, Oza A, Prakash S, Sunna R, Saettele TM. Coagulopathy Does Not Protect Against Venous Thromboembolism in Hospitalized Patients With Chronic Liver Disease. Chest. 2010 May; 137(5): 1145–1149.
- Aldawood A, Arabi Y, Aljumah A, Alsaadi A, Rishu A, Aldorzi H, et al. The incidence of venous thromboembolism and practice of deep venous thrombosis prophylaxis in hospitalized cirrhotic patients. Thromb J. 2011; 9(1): 1.
- O’Leary JG, Greenberg CS, Patton HM, Caldwell SH. AGA Clinical Practice Update: Coagulation in Cirrhosis. Gastroenterology. 2019; 157(1): 34–43.e1.
- Villa E, Cammà C, Marietta M, Luongo M, Critelli R, Colopi S, et al. Enoxaparin prevents portal vein thrombosis and liver decompensation in patients with advanced cirrhosis. Gastroenterology. 2012 Nov; 143(5): 1253–1260.e4.
- Lim CS, Davies AH. Graduated compression stockings. Can Med Assoc J. 2014 Jul 8; 186(10): E391–E398.
- Comerota AJ, Chouhan V, Harada RN, Sun L, Hosking J, Veermansunemi R, et al. The Fibrinolytic Effects of Intermittent Pneumatic Compression: Mechanism of Enhanced Fibrinolysis. Ann Surg. 1997 Sep; 226(3): 306–314.
- Turpie AG, Hirsh J, Gent M, Julian D, Johnson J. Prevention of deep vein thrombosis in potential neurosurgical patients. A randomized trial comparing graduated compression stockings alone or graduated compression stockings plus intermittent pneumatic compression with control. Arch Intern Med. 1989 Mar; 149(3): 679–681.
- Lacut K, Bressollette L, Le Gal G, Etienne E, De Tinteniac A, Renault A, et al. Prevention of venous thrombosis in patients with acute intracerebral hemorrhage. Neurology. 2005 Sep 27; 65(6): 865–869.
- Wan B, Fu H‑Y, Yin J‑T, Ren G‑Q. Low‑molecular‑weight heparin and intermittent pneumatic compression for thromboprophylaxis in critical patients. Exp Ther Med. 2015 Dec; 10(6): 2331–2336.
- Arabi YM, Al‑Hameed F, Burns KEA, Mehta S, Alsolamy SJ, Alshahrani MS, et al. Adjunctive Intermittent Pneumatic Compression for Venous Thromboprophylaxis. N Engl J Med. 2019 04; 380(14): 1305–1315.
- Laupland KB, Tabah A, Kelway C, Lipman J. Does intermittent pneumatic compression PREVENT deep vein thrombosis in the ICU? Anaesth Crit Care Pain Med. 2019; 38(4): 303–304.
- Afshari A, Fenger‑Eriksen C, Monreal M, Verhamme P. European guidelines on perioperative venous thromboembolism prophylaxis: Mechanical prophylaxis. Eur J Anaesthesiol. 2018 Feb; 35(2): 112–115.
- Go MR, Keller‑Biehl L, Starr JE. Penetration of the inferior vena cava and adjacent organs after filter placement is associated with retrievable filter type and length of time in place. J Vasc Surg Venous Lymphat Disord. 2014 Apr; 2(2): 174–178.
- Deso SE, Kuo WT. Inferior Vena Cava Filter Elucidation: How to Identify Specific Inferior Vena Cava Filter Types on Multi‑Detector‑Row Computed Tomography Imaging. J Comput Assist Tomogr. 2016 Aug; 40(4): 596–602.
- Deso SE, Idakoji IA, Kuo WT. Evidence‑Based Evaluation of Inferior Vena Cava Filter Complications Based on Filter Type. Semin Interv Radiol. 2016 Jun; 33(2): 93–100.
- Caplin DM, Nikolic B, Kalva SP, Ganguli S, Saad WEA, Zuckerman DA. Quality Improvement Guidelines for the Performance of Inferior Vena Cava Filter Placement for the Prevention of Pulmonary Embolism. J Vasc Interv Radiol. 2011 Sep; S1051044311011365.
- Ho KM, Rao S, Honeybul S, Zellweger R, Wibrow B, Lipman J, et al. A Multicenter Trial of Vena Cava Filters in Severely Injured Patients. N Engl J Med. 2019 25; 381(4): 328–337.
- Rostas JW, Brevard SB, Ahmed N, Allen J, Thacker D, Replogle WH, et al. Standard Dosing of Enoxaparin for Venous Thromboembolism Prophylaxis Is Not Sufficient for Most Patients Within a Trauma Intensive Care Unit. Am Surg. 2015 Sep; 81(9): 889–892.
- Scrimenti A, Seabury RW, Miller CD, Ruangvoravat L, Darko W, Probst LA, et al. Pharmacist recommendations for prophylactic enoxaparin monitoring and dose adjustment in trauma patients admitted to a surgical intensive care unit. Pharm Pract. 2019 Dec; 17(4): 1541.
- Garcia DA, Baglin TP, Weitz JI, Samama MM. Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines. Chest. 2012 Feb; 141(2 Suppl): e24S‑e43S.
- Helviz Y, Dzigivker I, Raveh‑Brawer D, Hersch M, Zevin S, Einav S. Anti‑Factor Xa Activity of Prophylactic Enoxaparin Regimens in Critically Ill Patients. Isr Med Assoc J. 2016 Feb; 18(2): 108–113.
- Ageno W, Gallus AS, Wittkowsky A, Crowther M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines. Chest. 2012 Feb; 141(2 Suppl): e44S‑e88S.
- Testa S, Paoletti O, Giorgi‑Pierfranceschi M, Pan A. Switch from oral anticoagulants to parenteral heparin in SARS‑CoV-2 hospitalized patients. Intern Emerg Med. 2020 Aug; 15(5): 751–753.
- Greinacher A. Heparin‑Induced Thrombocytopenia. Solomon CG, editor. N Engl J Med. 2015 Jul 16; 373(3): 252–261.
- Warkentin TE, Greinacher A, Koster A, Lincoff AM. Treatment and prevention of heparin‑induced thrombocytopenia: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun; 133(6 Suppl): 340S-380S.
- Kuo KHM, Kovacs MJ. Fondaparinux: a potential new therapy for HIT. Hematol Amst Neth. 2005 Aug; 10(4): 271–275.
- Cumbo‑Nacheli G, Samavati L, Guzman JA. Bioavailability of fondaparinux to critically ill patients. J Crit Care. 2011 Aug; 26(4): 342–346.
- Comes RF, Mismetti P, Afshari A. European guidelines on perioperative venous thromboembolism prophylaxis: Inferior vena cava filters. Eur J Anaesthesiol. 2018 Feb; 35(2): 108–111.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2021 Issue 4-5-
All articles in this issue
- Ohlédnutí za světovým kongresem anesteziologů
- Evaluation of patients referred to brain death scintigraphy
- Peroperační FiO2 a dlouhodobá pooperační mortalita
- Peroperační PEEP u obezních pacientů/pacientek
- Antagonization of neuromuscular blockade by sugammadex vs. neostigmine in patients undergoing robotic‑assisted urological procedures – effect on extubation time and quality of the recovery – monocentric prospective randomized study
- Post‑operative sleep‑disordered breathing with different anesthesia techniques: an observational study
- Methylene blue administration in refractory distributive shock
- Prophylaxis of venous thromboembolism in critically ill patients
- Extraglottic devices on the battlefield
- Our article after ten years: Awake cardiac surgery
- Upper airway and esophageal burn injury
- Centrální anticholinergní syndrom – zapomenutá diagnóza?
- Patron anesteziologů, sv. René, má svátek 28. 11.
- Nové zkušební otázky k atestaci
- Limity v přežití úspěšné akutní intenzivní péče
- Pooperační únavový syndrom
- Výběr z „NEJM Guideline Watch 2021“
- Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2021
- Porodnická anestezie a srdeční choroby v klinickém pohledu
- Kognitivní omezení a dysfunkce po sepsi
- Zajímavosti, tipy a triky, informace z jiných oborů
- Současný pohled na dobu předoperačního lačnění novorozenců
- Vzpomínka na MUDr. Zdeňka Bystřického, CSc.
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Upper airway and esophageal burn injury
- Pooperační únavový syndrom
- Methylene blue administration in refractory distributive shock
- Prophylaxis of venous thromboembolism in critically ill patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

