-
Medical journals
- Career
Léčba invazivní aspergilózy – doporučení odborných společností
Authors: Ráčil Zdenek 1; Mayer Jiří 1; Kocmanová Iva 2; Haber Jan 3; Mallátová Naďa 4; Kouba Michal 5; Sedláček Petr 6; Faber Edgar 7; Herold Ivan 8; Múdry Peter 9; Drgoňa Luboš 10; Karas Michal 11; Buchta Vladimír 12; Vydra Jan 13; Kolář Michal 14; Trupl Jan 15; Marešová Vilma 16; Rozsypal Hanuš 16; Nyč Otakar 17; Cwiertka Karel 18
Authors‘ workplace: Interní hematoonkologická klinika, FN Brno 1; Oddělení klinické mikrobiologie, FN Brno 2; I. interní klinika – hematoonkologická VFN, Praha 3; Laboratoř lékařské parazitologie a mykologie, Centrální laboratoře, Nemocnice České Budějovice, a. s. 4; Ústav hematologie a krevní transfuze Praha 5; Klinika dětské hematologie a onkologie FN Motol, Praha 6; Hematoonkologická klinika FN Olomouc 7; ARO, Klaudiánova nemocnice Mladá Boleslav 8; Klinika dětské onkologie, FN Brno 9; Národný onkologický ústav, Bratislava, Slovensko 10; Hematologicko-onkologické oddělení FN Plzeň 11; Ústav klinické mikrobiologie FN Hradec Králové 12; Oddělení klinické hematologie FNKV Praha 13; KAR VFN, Praha 14; Klinika laboratorní medicíny SYNLAB, s. r. o., Bratislava, Slovensko 15; Infekční klinika FN Na Bulovce, Praha 16; Ústav lékařské mikrobiologie FN Motol, Praha 17; Onkologická klinika FN Olomouc 18
Published in: Anest. intenziv. Med., 20, 2009, č. 1, s. 48-56
Category: The recommendations of professional societies
Overview
V současné době jsme svědky narůstající incidence invazivních aspergilových infekcí u nejvíce imunosuprimovaných nemocných, zejména pak u pacientů s akutní leukémií a po transplantaci krvetvorné tkáně. Zásadní pro snížení mortality této život ohrožující infekce je včasně zvolená optimální antimykotická léčba.
Cílem níže předkládaných doporučení je sumarizace dostupných objektivních informací o léčbě invazivní aspergilózy. Práce byla vytvořena panelem expertů na základě analýzy literárních dat a s přihlédnutím k existujícím doporučením European Conference in Infections in Leukemia a Infectious Diseases Society of America.Klíčová slova:
invazivní aspergilóza – léčba – doporučené postupy – antimykotikaObsah
1 Úvod
2 Analýza současných informací o léčbě invazivní aspergilózy (IA)
2. 1 Souhrn informací o použití jednotlivých antimykotik v iniciální léčbě IA
2. 1. 1 Polyeny – amfotericin B deoxycholát a jeho formy na lipidovém nosiči
2. 1. 2 Azoly
2. 1. 3 Echinokandiny
2. 1. 4 Kombinovaná antimykotická léčba
2. 2 Souhrn informací o použití jednotlivých antimykotik v záchranné léčbě IA
2. 2. 1 Amfotericiny B na lipidovém nosiči
2. 2. 2 Azoly
2. 2. 3 Echinokandiny
2. 2. 4 Kombinovaná léčba
2. 3 Souhrn informací o léčbě extrapulmonálních forem IA
2. 3. 1 Invazivní sinonazální aspergilóza
2. 3. 2 Invazivní aspergilóza centrálního nervového systému (CNS)
2. 4 Souhrn informací o dalších léčebných doporučeních
2. 4. 1 Použití leukocytárních růstových faktorů a transfuzí granulocytů
2. 4. 2 Současné podávání imunosupresiv
2. 4. 3 Chirurgická léčba
2. 5 Testování citlivosti kmenů Aspergillus spp. na antimykotika
2. 6 Měření plazmatických koncentrací azolových antimykotik
3 Vlastní doporučení
3. 1 Iniciální léčba IA
3. 2 Záchranná léčba IA
3. 3 Další doporučení
1 Úvod
Invazivní aspergilóza (IA) je v současné době stále častější život ohrožující infekcí imunosuprimovaných nemocných. Z této skupiny jsou nejvíce ohroženi pacienti s akutní leukémií a po alogenní transplantaci krvetvorné tkáně. Rovněž se zvyšuje incidence IA u pacientů po transplantaci solidních orgánů (zejména plic), na jednotkách intenzivní péče, nebo léčených novými léky, jakými jsou především monoklonální protilátky (např. alemtuzumab).
Podrobné informace o současné epidemiologické situaci a detailní popis možností diagnostiky IA byly v české literatuře recentně publikovány jako výsledek 1. workshopu CELL (The Czech leukemia Study group for life), konaného v rámci projektu Oportunní infekce u hematoonkologických nemocných v Brně v lednu 2007 [1].
Cílem těchto doporučení je tedy konsenzus odborných společností v pohledu na léčbu invazivních forem aspergilové infekce, a to zejména na podkladě aktuálních guidelines ECIL (European Conference on Infection in Leukemia: ECIL 1 a ECIL 2) a IDSA (Infectious Disease Society of America) [2, 3].
2 Analýza současných informací o léčbě invazivní aspergilózy (IA)
2. 1 Souhrn informací o použití jednotlivých antimykotik v iniciální léčbě IA
Mezi léky s účinkem na kmeny aspergilů patří amfotericin B a jeho formy na lipidovém nosiči – itrakonazol, vorikonazol, posakonazol a echinokandiny. V současné době je k dispozici pouze 5 randomizovaných studií sledujících tyto preparáty v primoléčbě IA (tab. 1).
Table 1. Souhrn randomizovaných studií srovnávajících účinnost jednotlivých antimykotik v iniciální léčbě invazivní aspergilózy 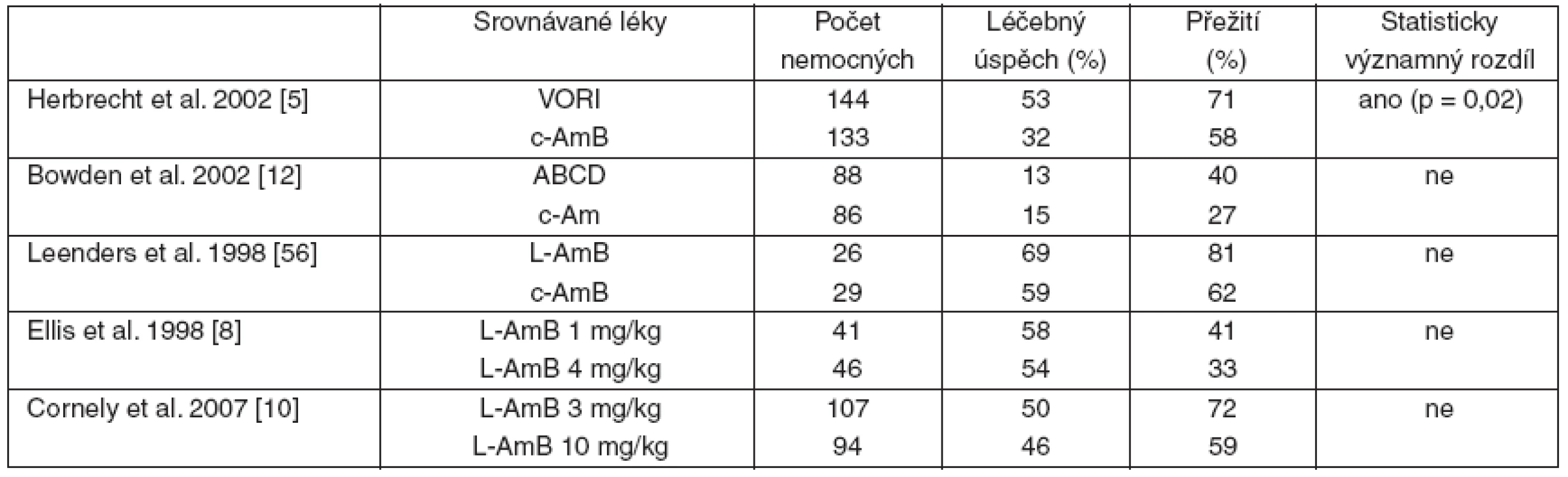
Většina informací o iniciální terapii IA tedy pochází z různě velkých nerandomizovaných kohort nemocných a retrospektivních analýz.
2. 1. 1 Polyeny – amfotericin B deoxycholát a jeho formy na lipidovém nosiči
Amfotericin B deoxycholát (tzv. konvenční amfotericin B, c-AmB) byl donedávna zlatým standardem v léčbě IA s efektivitou maximálně kolem 30 % [5]. Jeho použití je však limitováno nutností intravenózního podání a především jeho toxicitou – nefrotoxicitou (rozvíjející se až u 80 % nemocných), s infuzí spojenou toxicitou (s incidencí 50–60 %) a iontovými dysbalancemi [6].
Amfotericiny B na lipidovém nosiči jsou k dispozici v několika formách – lipozomální amfotericin B (L-AmB – v ČR není registrován), amfotericin B lipidový komplex (ABLC) a amfotericin B koloidní disperze (ABCD) a dosud neprokázaly superioritu v léčbě IA nad c-AmB [7]. Tyto preparáty však mají několik nesporných výhod. Hlavním benefitem je významná redukce nefrotoxicity. I přes snížení rizika poškození ledvinných funkcí však není renální toxicita při jejich použití nulová a pohybuje se (v závislosti na definici nefrotoxicity) od 10 do 30 %. Nežádoucí účinky spojené s infuzí (horečka, zimnice, třesavka a další) jsou méně časté u L-AmB a ABLC, ale naopak vyšší u ABCD. Další výhodou je lepší průnik do některých tkání. Prakticky všechny dosahují ve srovnání s c-AmB vyšší koncentrace v játrech a slezině, L-AmB pak navíc také v mozkové tkáni a ABLC v plicích.
Pro posouzení účinnosti L-AmB v primoléčbě IA je k dispozici „poolovaná“ analýza 3 studií (včetně jedné randomizované [8]), doplněná analýzou pacientů léčených L-AmB v rámci „compassionate“ použití prezentované Cordonnierem et al. [9]. L-AmB vedl k léčebné odpovědi u 47 % pravděpodobných/prokázaných případů IA. V recentně publikované rozsáhlé randomizované studii, která srovnávala efekt dvou různých dávek L-AmB v primoléčbě IA, bylo dosaženo léčebné odpovědi u 50 % pacientů ve větvi s dávkou 3 mg . kg-1 . den-1 a u 46 % nemocných ve skupině léčené vysokou dávkou 10 mg . kg-1 . den-1. Účinnost obou dávek byla tedy srovnatelná a velmi dobrá, ale standardní dávkování (3 mg . kg-1 . den-1) bylo lépe tolerováno [10]. Také přežívání nemocných ve 12. týdnu nebylo mezi oběma skupinami odlišné – 72 % vs 59 %.
Rozsáhlejší data získaná z databáze CLEAR jsou k dispozici pro použití ABLC v iniciální terapii IA, kde byla efektivita ABLC v primoléčbě 139 případů IA 47 % [11].
Posledním z amfotericinů B na lipidovém nosiči je ABCD. ABCD byl srovnáván s c-AmB v relativně velké randomizované studii Bowdena et al. [12]. V obou větvích bylo dosaženo podobné, a to velmi nízké terapeutické odpovědi – 13 % (ABCD) a 15 % (c-AmB). Přežití pacientů bylo vyšší (ne však statisticky významně) ve skupině léčené ABCD. Na základě této práce nelze doporučit ABCD pro primoléčbu IA, neboť jeho účinnost je významně nižší ve srovnání s ostatními lipidovými formami amfotericinu B, ale také některými triazoly.
2. 1. 2 Azoly
I přes dlouhodobou komerční dostupnost itrakonazolu je k dispozici jen minimum informací o jeho použití v iniciální terapii IA. Denning et al. sledovali v otevřené nekomparativní studii účinnost perorální formy itrakonazolu v dávce 600 mg . den-1 (4 dny), následované dávkou 400 mg . den-1; k léčebné odpovědi došlo u 39 % nemocných [13]. Ještě méně informací máme o využitelnosti intravenózní formy itrakonazolu. V malé otevřené nekomparativní studii Caillot et al. prokázali účinnost intravenózní formy itrakonazolu v této indikaci 48%, a to v dávce 200 mg . den-1 (následované po 14 dnech perorální formou v množství 400 mg . den-1) [14].
Použití itrakonazolu v léčbě tak závažné infekce, jakou je IA, má několik limitací: aplikace perorálních forem je spojena s omezenou resorpcí ze zažívacího traktu; naopak intravenózní forma je vzhledem k riziku kumulace vehikula SBECD (sulfo-butyl-ether-cyclodextrin) kontraindikována při zhoršení renálních funkcí; konečně je pak podávání itrakonazolu spojeno s vysokou frekvencí lékových interakcí a výraznými intra - a inter - pacientskými variabilitami plazmatických koncentrací léku díky jeho metabolismu cestou cytochromu P450 [15].
Dosud nejobsáhlejší data o primoléčbě IA přinesla studie Herbrechta et al. srovnávající vorikonazol (6 mg . kg-1 i. v. 2krát denně 1. den, následované 4 mg . kg-1 i. v. 2krát denně minimálně 7 dní, poté s možností přechodu na p. o. léčbu v dávce 200 mg 2krát denně) s c-AmB [5]. Vorikonazol prokázal superioritu nad c-AmB v procentu léčebných odpovědí (52 % vs 32 %), celkovém přežití (71 % vs 58 %) a bezpečnosti podání, a to nezávisle na charakteru nemocných, místě postižení nebo přítomnosti/nepřítomnosti neutropenie.
Podobně jako u itrakonazolu se také u tohoto triazolu 2. generace setkáváme s určitými omezeními: přestože je resorpce vorikonazolu z gastrointestinálního traktu velmi dobrá, při různých abnormalitách může dojít k jejímu zhoršení; navíc podobně jako u itrakonazolu je intenzita metabolismu antimykotika ovlivněna indukcí cytochromu P450, což je příčinou mnoha různých lékových interakcí a relativně velké intra - a inter - pacientské variability plazmatických koncentrací léku; konečně, použití intravenózní formy vorikonazolu je limitováno u renálního selhání kvůli kumulaci nosiče SBECD.
Data o podávání nejnovějšího z triazolů, posakonazolu, v iniciální léčbě IA zatím nejsou k dispozici.
2. 1. 3 Echinokandiny
Přestože jsou dnes dostupní tři zástupci této nové lékové skupiny – kaspofungin, mikafungin a anidulafungin – informace o jejich použití v první linii léčby IA jsou velmi omezené nebo zcela chybí.
Nově byly prezentovány výsledky otevřené multicentrické studie analyzující účinnost kaspofunginu v této indikaci u hematologických nemocných (mimo pacienty po transplantaci krvetvorné tkáně) [16]. K léčebné odpovědi došlo u 33 % z 61 sledovaných jedinců a byla lepší u nemocných bez neutropenie ve srovnání s pacienty s neutropenií (56 % vs 29 %). Celkové přežití pak bylo 54 %. Podle Viscoliho et al. je tedy podávání kaspofunginu v primoléčbě IA poněkud limitované. Nutno ovšem upozornit, že ve studii byla na rozdíl od jiných analýz striktně dodržena EORTC/MSG kritéria pro definici prokázané a pravděpodobné IA, a tak byla vstupní prognóza nemocných poněkud horší. Aplikace kaspofunginu však byla spojena s minimálním výskytem vedlejších účinků a právě vysoká bezpečnost je hlavní výhodou celé této lékové skupiny.
O léčbě IA v první linii dalším z echinokandinů – mikafunginem – jsou minimální informace. V otevřených multicentrických studiích Denninga et al. a Kohna et al. byl mikafungin účinný u 6 z 12 nemocných (50 %), respektive u 6 z 10 nemocných (60 %), s IA [17, 18].
Data o použití anidulafunginu v této indikaci zcela chybí.
2. 1. 4 Kombinovaná antimykotická léčba
Vzhledem k vysoké mortalitě a morbiditě invazivních mykotických infekcí (IFI) se často diskutuje o možnosti kombinované antimykotické léčby. Hlavním důvodem je synergie v efektu na mykotickou buňku při rozdílném mechanismu působení, rozšíření spektra účinku a eventuálně vzájemné doplnění se ve farmakokinetických a farmakodynamických vlastnostech léků [19]. V případě IA se obvykle jedná o kombinaci triazolů druhé generace nebo amfotericinů B na lipidových nosičích s echinokandiny. Dosud však není k dispozici žádná randomizovaná studie ukazující na benefit kombinované antimykotické léčby v první linii terapie IA.
V malé retrospektivní studii Kontoyiannis et al. prokázali léčebnou odpověď u 53 % ze 17 pacientů s IA léčených v první linii kombinací L-AmB s kaspofunginem [20].
Dosud největší publikovanou kohortu nemocných představuje prospektivní multicentrická studie Singhové et al., srovnávající účinnost kombinace vorikonazolu s kaspofunginem v iniciální terapii IA s historickými kontrolami léčenými amfotericiny B na tukovém nosiči [21]. Přestože nebyl mezi oběma skupinami statisticky významný rozdíl v léčebné odpovědi, bylo přežívání při použití kombinované léčby vyšší – 70 % vs 51 %, respektive 68 % vs 51 %. Navíc ve skupině pacientů s renálním selháním byla kombinovaná léčba spojena se statisticky významným zlepšením přežití. Je tedy pravděpodobné, že u vysoce selektované skupiny nejvíce rizikových nemocných bude mít kombinovaná antimykotická terapie své opodstatnění již v iniciální léčbě. Pro všeobecné doporučení je však nutno vyčkat obsáhlejších studií.
2. 2 Souhrn informací o použití jednotlivých antimykotik v záchranné léčbě IA
Téměř u poloviny nemocných léčených pro IA terapie selhává, nebo není tolerována. Literární informace o záchranné léčbě jsou značně limitované, chybí data z randomizovaných studií. Navíc, až na výjimky [22], není znám výsledek léčby po selhání nebo intoleranci vorikonazolu. Absolutní většina níže uvedených informací se tedy týká záchranné léčby po selhání itrakonazolu nebo polyenů. Souhrnně lze říci, že na záchrannou léčbu odpovídá přibližně 30–50 % nemocných, u kterých primární léčba selhala, nebo nebyla tolerována.
2. 2. 1 Amfotericiny B na lipidovém nosiči
Nejobsáhlejší data pro tuto situaci jsou k dispozici u ABLC. V otevřené multicentrické studii Walshe et al. došlo k léčebné odpovědi u 42 % ze 130 nemocných, kterým byl podáván ABLC v záchranné léčbě IA. Velmi podobné výsledky pak byly získány při analýze nemocných z registru CLEAR – záchranná terapie IA pomocí ABLC byla úspěšná u 44 % z 216 pacientů [11].
V „poolované“ analýze 3 studií sledujících účinnost L-AmB došlo k léčebné odpovědi u 32 % z 50 pacientů léčených takto pro selhání nebo netoleranci iniciální terapie IA [23].
Podobné výsledky v záchranné léčbě IA má také ABCD. Podle otevřené multicentrické studie Oppenheima et al. bylo pomocí ABCD úspěšně léčeno 34 % z 32 nemocných [24].
2. 2. 2 Azoly
Data o použití itrakonazolu v iniciální léčbě jsou minimální a v záchranné léčbě zcela chybí.
Vorikonazol prokázal v terapii IA svou účinnost rezistentní nebo refrakterní na primární léčbu ve dvou studiích – v práci Denninga et al. (k odpovědi došlo u 45 % z 51 nemocných) a Perfecta et al. (úspěšná terapie v 38 % z 56 případů IA) [25, 26]. Vorikonazol byl také účinný u 8 z 12 nemocných léčených v primoléčbě kaspofunginem [27].
Perorální forma posakonazolu v dávce 800 mg za den (rozděleně) byla použita v záchranné léčbě IA u 107 nemocných [28]. Efektivita posakonazolu byla 42 % a ve srovnání s kontrolní skupinou pacientů došlo při jeho použití k signifikantnímu zlepšení přežívání.
2. 2. 3 Echinokandiny
Anidulafungin v záchranné léčbě IA dosud studován nebyl. U mikafunginu jsou pak velmi limitované informace z práce Denninga et al., kde k léčebné odpovědi IA došlo u 41 % z 22 nemocných [17].
Podobně jako v primární léčbě je nejvíce dostupných dat pro kaspofungin. V otevřené nekomparativní studii Maertense et al. došlo k léčebné odpovědi u 45 % z 83 nemocných [29]. Také analýza informací od 48 nemocných léčených kaspofunginem v rámci „compassionate“ podávání prokázala jeho velmi dobrou účinnost v záchranné léčbě IA (44 %) [30].
2. 2. 4 Kombinovaná léčba
V záchranné terapii je kombinace antimykotik používána daleko častěji než v primoléčbě, proto je pro posouzení jejího benefitu k dispozici více literárních informací. Podobně jako v primární léčbě jsou v kombinacích obvykle zastoupeny echinokandiny, a z nich pak vzhledem k nejdelší době dostupnosti na trhu kaspofungin.
Kombinace kaspofunginu s c-AmB, ABLC nebo L-AmB v této indikaci vedla k léčebné odpovědi u 35 % z 30 pacientů [31], 35 % pacientů z 31 [20], respektive 50 % z 16 pacientů [32].
V otevřené multicentrické studii Maertense et al. byla záchranná terapie kombinací kaspofunginu s vorikonazolem úspěšná u 60 % ze 30 nemocných [32]. Stejně tak Maarová et al. prokázali u 16 pacientů po alogenní transplantaci krvetvorné tkáně při této kombinaci zlepšení přežití ve 3 měsících ve srovnání s historickými kontrolami léčenými pouze monoterapií vorikonazolem [33].
Raad et al. nově provedli srovnání vlivu dvou různých kombinací s kaspofunginem na mortalitu nemocných s IA [34]. Přežití 33 nemocných léčených kombinací kaspofunginu s vorikonazolem bylo ve 12. týdnu signifikantně lepší, než tomu bylo u 59 pacientů, u kterých byla použita kombinace kaspofunginu s amfotericiny B na lipidovém nosiči – 48 % vs 25 %, p = 0,025. Jednou z pravděpodobných příčin byla nižší toxicita první z kombinací.
Indikace kombinované terapie v rámci záchranné léčby IA byla studována také u dalšího z echinokandinů – u mikafunginu [17]. 174 nemocných bylo léčeno různými kombinacemi s mikafunginem (nejčastěji však spolu s polyeny) a léčebného úspěchu bylo dosaženo u 35 % pacientů.
Z uvedeného vyplývá, že v záchranné terapii IA je důkazů o možných výhodách kombinované antimykotické terapie daleko více a nejvýhodnější se jeví kombinace echinokandinů s vorikonazolem. Data o kombinaci echinokandinů s dalším triazolem druhé generace – posakonazolem – dosud chybí.
2. 3 Souhrn informací o léčbě extrapulmonálních forem IA
2. 3. 1 Invazivní sinonazální aspergilóza
Invazivní infekce paranazálních dutin spojená s destrukcí a invazí do skeletu, respektive měkkých tkání v okolí, může být na jedné straně spojena s IA plic, na druhou stranu může být následně komplikována progresí a vznikem invazivní aspergilové infekce CNS. Zatím není k dispozici randomizovaná studie sledující význam systémové antimykotické léčby a většina informací pochází z malých sérií. Nicméně základem je kombinace adekvátní chirurgické léčby (vždy zvažující možná rizika krvácení a mutilujícího výkonu pro nemocného), spolu se systémovými antimykotiky [35]. Význam lokální aplikace c-AmB je nejistý.
Úspěšně lze sinonazální aspergilózu léčit podáním polyenů, itrakonazolu a vorikonazolu. Pro volbu antimykotika má zásadní význam jednoznačný průkaz etiologického agens (histologický a/nebo kultivační z materiálu z místa postižení). Pokud je infekce vyvolána rodem Aspergillus sp., je lékem volby vorikonazol. Jestliže však informace o původci chybí a není možná histopatologická diference mezi invazivní aspergilózou a zygomykózou, je doporučeno volit léčbu polyeny, eventuálně posakonazolem [3].
2. 3. 2 Invazivní aspergilóza centrálního nervového systému (CNS)
Centrální nervová soustava může být postižena aspergilovou infekcí při hematogenní diseminaci z plic a onemocnění je spojeno s mortalitou, která přesahuje 90 % [36].
Informace o použití amfotericinů B na lipidovém nosiči, itrakonazolu, posakonazolu, echinokandinů nebo kombinované antimykotické léčby jsou omezené, k dispozici jsou spíše kazuistiky nebo malé série poukazující na jejich možný efekt. V práci Pettersona et al. vykazovalo léčebnou odpověď na polyeny nebo itrakonazol pouze 9 % ze 34 nemocných s postižením CNS [36].
Dosud nejobsáhlejší je retrospektivní analýza Schwartze et al., který sledoval účinnost vorikonazolu (případně v kombinaci s neurochirurgickým řešením) u 81 případů aspergilové infekce CNS [37]. Vorikonazol vedl k léčebné odpovědi u 35 % postižených pacientů a terapie snížila extrémní mortalitu infekce na 69 %.
Dříve používaná praxe lokální aplikace c-AmB do likvorových prostor není doporučována – c-AmB neproniká přes mozkové pleny a může vést k chemické arachnoiditidě [3].
2. 4. Souhrn informací o dalších léčebných doporučeních
2. 4. 1 Použití leukocytárních růstových faktorů a transfuzí granulocytů
Perzistující neutropenie je jedním z nejvýznamnějších rizikových faktorů spojených s negativní prognózou nemocných s IA [38]. Prognózu těchto pacientů může pozitivně ovlivnit zkrácení délky neutropenie. Současně se systémovou antimykotickou léčbou jsou proto indikovány granulocyty/granulocyty-makrofágy stimulující růstové faktory, a to do skončení neutropenického období.
Jako dočasné řešení pro překlenutí období do vzestupu počtu neutrofilních granulocytů stimulovaného pomocí leukocytárních růstových faktorů mohou být použity transfuze granulocytů. Jejich význam u pravděpodobné a prokázané IA je kontroverzní, nicméně v práci Dignaniho et al. došlo u 80 % z 15 nemocných s rezistentními IFI, způsobenými vláknitými houbami a léčenými polyeny, alespoň k částečné léčebné odpovědi při podávání transfuzních přípravků získaných od dárců stimulovaných leukocytárními růstovými faktory [39]. Je však nutno znát limity tohoto postupu: data jsou velmi chudá a navíc pocházejí z období před zavedením nových a účinných systémových antimykotik; podání transfuze granulocytů je spojeno s rizikem potransfuzních reakcí včetně TRALI (s transfuzí spojeného akutního plicního poškození) a přenosu CMV infekce u CMV negativních příjemců.
2. 4. 2 Současné podávání imunosupresiv
Aplikace kortikoidů je významným rizikovým faktorem pro vznik IA [38, 40] a nemožnost snížení jejich dávky při již rozvinuté IA vede většinou k neúspěchu v léčbě. Vždy je proto indikováno maximálně možné snížení, eventuálně pokud možno ukončení systémové kortikoterapie [28].
Je-li imunosupresivní léčba dlouhodobá, pak je doporučeno prolonogované podávání účinných antimykotik po dobu jejího trvání.
2. 4. 3 Chirurgická léčba
Současně se systémovou antimykotickou léčbou může být u plicní formy IA nezbytný chirurgický výkon, zejména pokud je větší izolované ložisko v kontaktu s velkou cévou, s perikardem nebo invaduje do hrudní stěny. Stejně tak je nutno chirurgický výkon zvažovat při hemoptýze spojené s izolovaným kavitujícím se ložiskem v plicním parenchymu [41–43] a také individuálně posoudit možnost chirurgické resekce izolovaného ložiska při mimoplicní formě IA, a to včetně postižení CNS.
2. 5 Testování citlivosti kmenů Aspergillus spp. na antimykotika
Pokud je kultivační vyšetření pozitivní, je doporučováno zařazení patogenu až na úroveň druhu, mimo jiné z důvodu primární rezistence A. terreus vůči polyenům [44], která může ovlivnit volbu antimykotik. V literatuře se můžeme setkat také s in vitro a současně in vivo rezistencí A. fumigatus vůči itrakonazolu [45]. Lass-Florová et al. poukázali na korelaci mezi in vitro citlivostí Aspergillus spp. na antimykotika a výsledkem léčby u 29 případů IA [46].
Nicméně standardní metodika testování citlivosti vláknitých hub k antimykotikům není zcela použitelná v rutinní praxi a rovněž z důvodu nejednoznačné korelace mezi výsledky in vitro a in vivo není toto testování všeobecně doporučováno.
2. 6 Měření plazmatických koncentrací azolových antimykotik
V současnéliteratuře se objevuje stále více informací o inter - a intra - pacientské variabilitě ve farmakokinetice triazolových antimykotik, která může vést k ovlivnění výsledku léčby IA [28, 47–52]. Rozdíly v absorpci (u itrakonazolu a posakonazolu), vliv lékových interakcí (u všech tří triazolů) a odlišná genetická výbava jedinců (u vorikonazolu) vedou k rozdílným výsledným plazmatickým koncentracím. Monitorování těchto koncentrací může být důležité z hlediska bezpečnosti (u itrakonazolu a vorikonazolu) a účinnosti léků (u všech tří triazolů) [53].
Glasmacher et al. prokázali možnost selhávání profylaxe u IFI vyvolané vláknitými houbami, jestliže ustálená hladina itrakonazolu v plazmě je nižší než 500 μg . l-1 [49]. Při léčbě IFI je proto doporučováno dosáhnout plazmatické koncentrace léku minimálně nad výše zmíněnou hodnotu, a naopak nepřesáhnout koncentrace nad 2000 μg . l-1, které mohou být spojeny s vyšším výskytem toxických projevů léku [15, 49, 54].
Značnou variabilitu plazmatických koncentrací vorikonazolu prokázalo již několik autorů [47, 51, 52, 55]. V analýze Pascuala et al. bylo častější selhání léčby invazivních mykóz (včetně IA), pokud plazmatické koncentrace vorikonazolu byly rovny nebo nižší než 1 mg. l-1 – 46% selhání vs 12% u nemocných s hladinou nad 1 mg . l-1. Naopak, navýšení dávky u pacientů se selhávající léčbou vedlo k vzestupu plazmatických koncentrací léku a navození léčebné odpovědi [51]. Podobně také v analýze Smithe et al. byla významně vyšší terapeutická odpověď, pokud ustálená plazmatická koncentrace byla vyšší než 2,05 mg . l-1 [47]. Hodnoty převyšující 5 mg . l-1 jsou spojeny s vyšším rizikem toxicity léku [51].
Dosud nejmenší zkušenosti jsou s měřením plazmatických koncentrací posakonazolu. I přes značně intenzivní tkáňovou distribuci léku Walsh et al. prokázali vztah mezi hladinou posakonazolu v plazmě a výsledkem léčby [28]. Významně vyšší léčebná odpověď byla u nemocných s ustálenou plazmatickou hladinou nad 1,48 mg . l-1. Souvislost mezi toxicitou a vysokými hladinami posakonazolu dosud není známa.
Přestože bude nutné k této problematice získat větší množství dat, již teď lze říci, že monitorování plazmatických koncentrací léku je jedním z důležitých faktorů při posuzování selhávání nebo toxicity antimykotické léčby a je tedy doporučováno.
Table 2. Síla doporučení a kvalita důkazů pro užití jednotlivých antimykotik nebo jejich kombinací v iniciální terapii IA 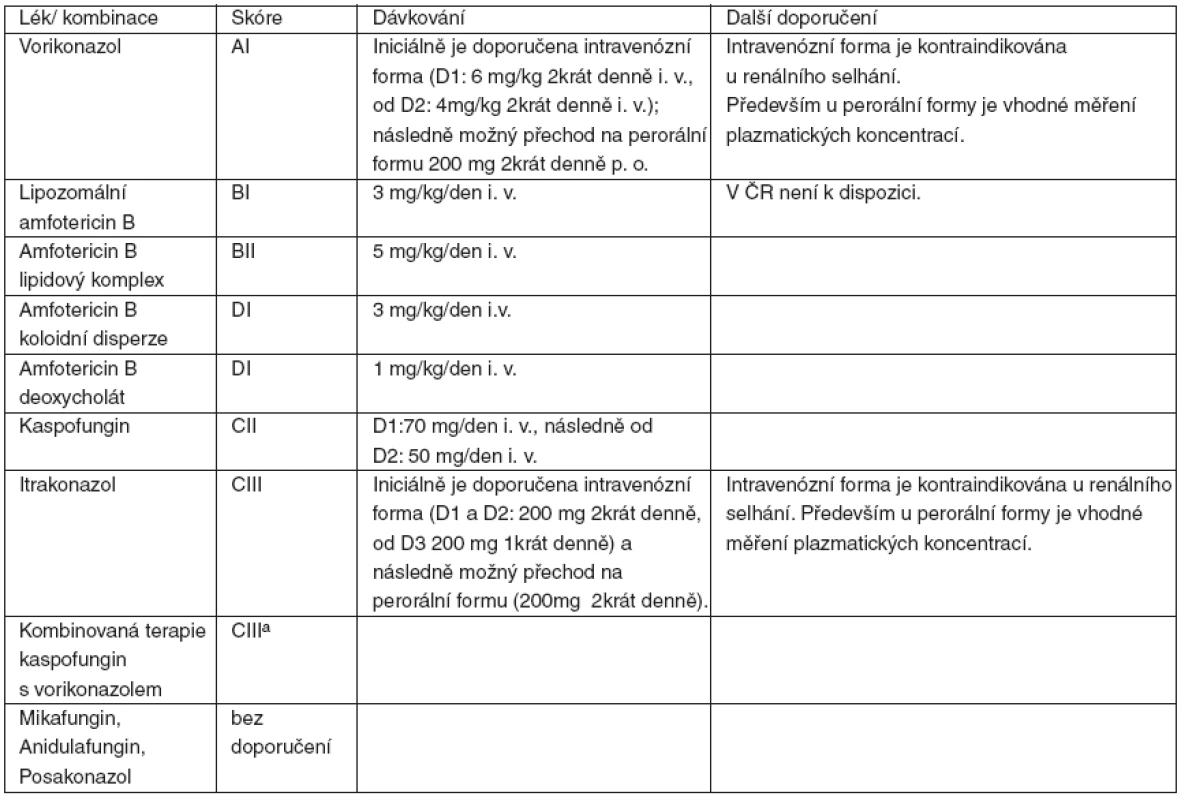
amožné jen výjimečně ve specializovaných centrech u vysoce rizikových nemocných a po konzultaci specialisty Table 3. Síla doporučení a kvalita důkazů pro použití jednotlivých antimykotik nebo jejich kombinací v záchranné léčbě IA 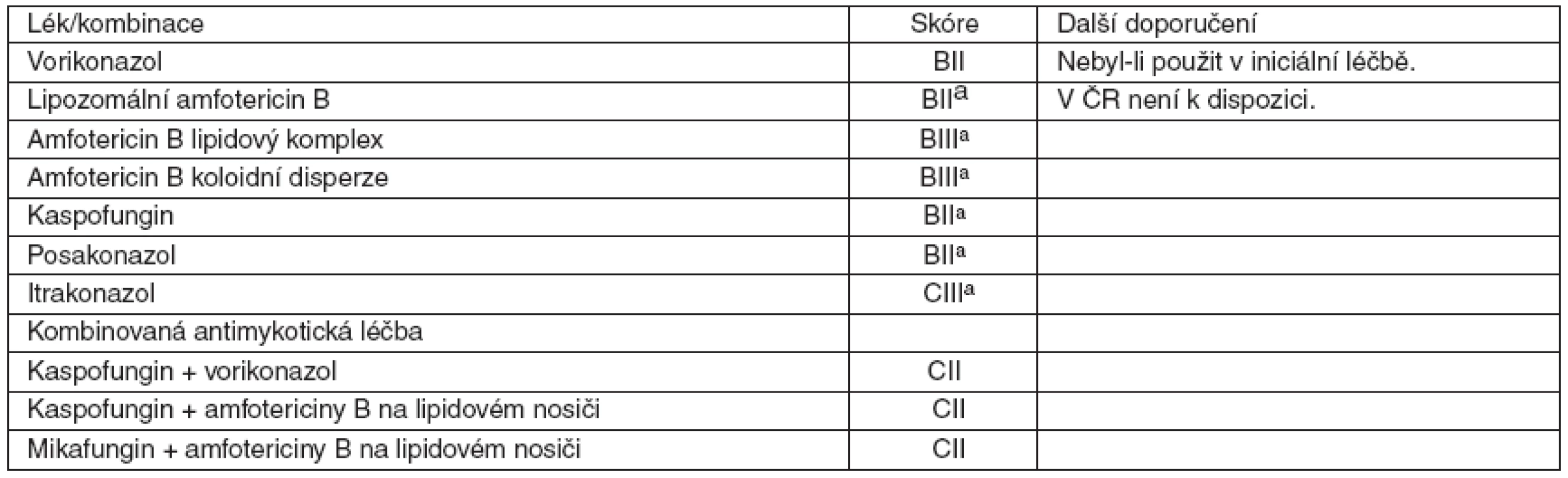
achybí data o použití při selhání vorikonazolu 3 Vlastní doporučení
3. 1 Iniciální léčba IA
Lékem volby v iniciální léčbě plicní formy IA je vorikonazol (AI), který je také doporučován jako iniciální terapie u mimoplicních forem IA včetně postižení CNS (AII). Léčba by měla být zahájena 1. den intravenózní formou (6 mg . kg-1 2krát denně, následně 4 mg . kg-1 2krát denně); v současné době není dostatek informací týkajících se nejvhodnější doby přechodu na perorální formu léku (200 mg 2krát denně). Intravenózní léčba je kontraindikována při renálním selhávání (kumulace SBECD). Především u perorální léčby je nutno zvažovat možnost suboptimálních plazmatických koncentrací vorikonazolu, které mohou vést k nedostatečné léčebné odpovědi IA.
Alternativou vorikonazolu (BI) je lipozomální amfotericin B (L-AmB) v dávce 3 mg . kg-1 . den-1, ale v ČR není k dispozici. Další možností je amfotericin B lipidový komplex (ABLC) v dávce 5 mg . kg-1 . den-1 (BII).
Amfotericin B koloidní disperze není všeobecně doporučován pro léčbu IA vzhledem k horší toleranci léku a objektivně nízké léčebné odpovědi (DI). Podobně není doporučován vzhledem k toxicitě a nedostatečnému účinku amfotericin B deoxycholát (c-AmB) (DI).
Limitované je použití kaspofunginu v monoterapii IA (CII), ale je možné v případech potřeby minimální lékové toxicity. Itrakonazol má omezenou efektivitu v iniciální léčbě IA, navíc však nejsou k dispozici relevantní data pro hodnocení (CIII).
Ostatní echinokandiny a posakonazol nemohou být skórovány pro nedostatečné množství dat.
Kombinovaná léčba kaspofunginem s vorikonazolem v iniciální terapii IA je možná jen výjimečně ve specializovaných centrech u vysoce rizikových nemocných, a to po konzultaci specialisty (CIIIa).
3. 2 Záchranná léčba IA
Pokud nebyl vorikonazol indikován v iniciální léčbě, měl by být použit (BII). Alternativou je kaspofungin, posakonazol nebo ABLC (BII), eventuálně ABCD nebo L-AmB, u nichž jsou však data omezená (BIII). U itrakonazolu informace chybí (CIII).
Kombinovaná antimykotická léčba kaspofunginem s vorikonazolem, nebo kaspofunginem, respektive mikafunginem s amfotericiny na lipidových nosičích, je v případě záchranné terapie možná (CII).
3. 3 Další doporučení
Chirurgická léčba by měla být zvažována přísně individuálně, a to v případech kontaktu plicního ložiska s velkou cévou nebo perikardem, je-li přítomna hemoptýza z izolovaného kavitujícího se ložiska, nebo při solitárním mimoplicním postižení (CIII).
Při neutropenii trvající během rozvinuté IA je doporučeno podání leukocytárních růstových faktorů z důvodu zkrácení délky jejího trvání (BIII).
V průběhu léčby IA by měla být maximálně minimalizována, nebo pokud možno ukončena současná imunosupresivní terapie kortikoidy (AIII).
Pokud je kultivačně prokázán rod Aspergillus spp. jako původce infekce, je doporučeno zařazení na úroveň druhu, neboť tato informace (při infekci A. terreus) může být důležitá pro volbu antimykotik (CIII). Rutinní testování citlivosti na antimykotika však není doporučováno (CIII).
Vhodné je – pokud je k dispozici – měření plazmatických koncentrací azolových antimykotik, neboť výsledek vyšetření může být jedním z faktorů při rozhodování o selhávání nebo toxicitě zvolené antimykotické léčby (BIII).
Optimální délka terapie není známa. Všeobecně se doporučuje, aby účinná antimykotická léčba byla podávána do dosažení kompletní léčebné odpovědi a do vymizení imunodeficientního stavu, který se na vzniku infekce spolupodílel.
Adresa pro korespondenci:
MUDr. Zdenek Ráčil, Ph.D.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: zracil@fnbrno.cz
Sources
1. Ráčil, Z., Mayer, J. (eds) Invazivní aspergilóza: současné možnosti diagnostiky. Vnitř. Lék., 2007, 53, Suppl.
2. Herbrecht, R., Fluckiger, U., Gachot, B. et al. Treatment of invasive Candida and invasive Aspergillus infections in adult haematological patients. European Journal of Cancer Supplements. Guidelines from the First European Conference on Infections in Leukaemia: ECIL1, 2007, 5, p. 49–59.
3. Walsh, T. J., Anaissie, E. J., Denning, D. W. et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin. Infect. Dis., 2008, 46, p. 327–360.
4. Ascioglu, S., Rex, J. H., de Pauw, B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin. Infect. Dis., 2002, 34, p. 7–14.
5. Herbrecht, R., Denning, D. W., Patterson, T. F. et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N. Engl. J. Med., 2002, 347, p. 408–415.
6. Chen, S. C., Sorrell, T. C. Antifungal agents. Med. J. Aust., 2007, 187, p. 404–409.
7. Ostrosky-Zeichner, L., Marr, K. A., Rex, J. H. et al. Amphotericin B: time for a new “gold standard“. Clin. Infect. Dis., 2003, 37, p. 415–425.
8. Ellis, M., Spence, D., de Pauw, B. et al. An EORTC international multicenter randomized trial (EORTC number 19923) comparing two dosages of liposomal amphotericin B for treatment of invasive aspergillosis. Clin. Infect. Dis., 1998, 27, p. 1406–1412.
9. Cordonnier, C., Bresnik, M., Ebrahimi, R. Liposomal Amphotericin B (L-AMB) Efficacy in Invasive Filamentous Fungal Infections (IFI): Pooled Analysis. Program and abstracts of the 44th ICAAC October 30 – November 2, 2004, Abstract M-1022.
10. Cornely, O. A., Maertens, J., Bresnik, M. et al. Liposomal amphotericin B as initial therapy for invasive mold infection: a randomized trial comparing a high-loading dose regimen with standard dosing (AmBiLoad trial). Clin. Infect. Dis., 2007, 44, p. 1289–1297.
11. Chandrasekar, P. H., Ito, J. I. Amphotericin B lipid complex in the management of invasive aspergillosis in immunocompromised patients. Clin. Infect. Dis., 2005, 40, Suppl 6, p. S392–400.
12. Bowden, R., Chandrasekar, P., White, M. H. et al. A double-blind, randomized, controlled trial of amphotericin B colloidal dispersion versus amphotericin B for treatment of invasive aspergillosis in immunocompromised patients. Clin. Infect. Dis., 2002, 35, p. 359–366.
13. Denning, D. W., Lee, J. Y., Hostetler, J. S. et al. NIAID Mycoses Study Group Multicenter Trial of Oral Itraconazole Therapy for Invasive Aspergillosis. Am. J. Med., 1994, 97, p. 135–144.
14. Caillot, D., Bassaris, H., McGeer, A. et al. Intravenous itraconazole followed by oral itraconazole in the treatment of invasive pulmonary aspergillosis in patients with hematologic malignancies, chronic granulomatous disease, or AIDS. Clin. Infect. Dis., 2001, 33, p. e83–90.
15. Prentice, A. G., Glasmacher, A. Making sense of itraconazole pharmacokinetics. J. Antimicrob. Chemother., 2005, 56, Suppl 1, p. i17–i22.
16. Viscoli, C., Herbrecht, R., Akan, H. Caspofungin (C) as first-line therapy of invasive aspergillosis (IA) in haematological patients (pts): a study of the EORTC Infectious Diseases Group. 3th Trends in Medical Mycology 2007: Abstract O.12.
17. Denning, D. W., Marr, K. A., Lau, W. M. et al. Micafungin (FK463), alone or in combination with other systemic antifungal agents, for the treatment of acute invasive aspergillosis. J. Infect., 2006, 53, p. 337–349.
18. Kohno, S., Masaoka, T., Yamaguchi, H. et al. A multicenter, open-label clinical study of micafungin (FK463) in the treatment of deep-seated mycosis in Japan. Scand. J. Infect. Dis., 2004, 36, p. 372–379.
19. Mukherjee, P. K., Sheehan, D. J., Hitchcock, C. A. et al. Combination treatment of invasive fungal infections. Clin. Microbiol. Rev., 2005, 18, p. 163–194.
20. Kontoyiannis, D. P., Hachem, R., Lewis, R. E. et al. Efficacy and toxicity of caspofungin in combination with liposomal amphotericin B as primary or salvage treatment of invasive aspergillosis in patients with hematologic malignancies. Cancer, 2003, 98, p. 292–299.
21. Singh, N., Limaye, A. P., Forrest, G. et al. Combination of voriconazole and caspofungin as primary therapy for invasive aspergillosis in solid organ transplant recipients: a prospective, multicenter, observational study. Transplantation, 2006, 81, p. 320–326.
22. Patterson, T. F., Boucher, H. W., Herbrecht, R. et al. Strategy of following voriconazole versus amphotericin B therapy with other licensed antifungal therapy for primary treatment of invasive aspergillosis: impact of other therapies on outcome. Clin. Infect. Dis., 2005, 41, p. 1448–1452.
23. Cordonnier, C., Bresnik, M., Ebrahimi, R. Liposomal amphotericin B (AmBisome) efficacy in confirmed invasive aspergillosis and other filamentous fungal infections in immunocompromised hosts: a pooled analysis. Mycoses, 2007, 50, p. 205–209.
24. Oppenheim, B. A., Herbrecht, R., Kusne, S. The safety and efficacy of amphotericin B colloidal dispersion in the treatment of invasive mycoses. Clin. Infect. Dis., 1995, 21, p. 1145–1153.
25. Denning, D. W., Ribaud, P., Milpied, N. et al. Efficacy and safety of voriconazole in the treatment of acute invasive aspergillosis. Clin. Infect. Dis., 2002, 34, p. 563–571.
26. Perfect, J. R., Marr, K. A., Walsh, T. J. et al. Voriconazole treatment for less-common, emerging, or refractory fungal infections. Clin. Infect. Dis., 2003, 36, p. 1122–1131.
27. Candoni, A., Mestroni, R., Damiani, D. et al. Caspofungin as first line therapy of pulmonary invasive fungal infections in 32 immunocompromised patients with hematologic malignancies. Eur. J. Haematol., 2005, 75, p. 227–233.
28. Walsh, T. J., Raad, I., Patterson, T. F. et al. Treatment of invasive aspergillosis with posaconazole in patients who are refractory to or intolerant of conventional therapy: an externally controlled trial. Clin. Infect. Dis., 2007, 44, p. 2–12.
29. Maertens, J., Raad, I., Petrikkos, G. et al. Efficacy and safety of caspofungin for treatment of invasive aspergillosis in patients refractory to or intolerant of conventional antifungal therapy. Clin. Infect. Dis., 2004, 39, p. 1563–1571.
30. Kartsonis, N. A., Saah, A. J., Joy Lipka, C. et al. Salvage therapy with caspofungin for invasive aspergillosis: results from the caspofungin compassionate use study. Journal of Infection, 2005, 50, p. 196–205.
31. Aliff, T. B., Maslak, P. G., Jurcic, J. G. et al. Refractory Aspergillus pneumonia in patients with acute leukemia: successful therapy with combination caspofungin and liposomal amphotericin. Cancer, 2003, 97, p. 1025–1032.
32. Maertens, J., Glasmacher, A., Herbrecht, R. et al. Multicenter, noncomparative study of caspofungin in combination with other antifungals as salvage therapy in adults with invasive aspergillosis. Cancer, 2006, 107, p. 2888–2897.
33. Marr, K. A., Boeckh, M., Carter, R. A. et al. Combination antifungal therapy for invasive aspergillosis. Clin. Infect. Dis., 2004, 39, p. 797–802.
34. Raad, I., Hachem, R., Jiang, H. Combination Salvage Therapy of Invasive Aspergillosis (IA) in Patients with Hematologic Malignancy (HM): Which Caspofungin-Containing Regimen? Program and abstracts of the 44th ICAAC 2007: M-624.
35. de Carpentier, J. P., Ramamurthy, L., Denning, D. W. et al. An algorithmic approach to aspergillus sinusitis. J. Laryngol. Otol., 1994, 108, p. 314–318.
36. Patterson, T. F., Kirkpatrick, W. R., White, M. et al. Invasive aspergillosis. Disease spectrum, treatment practices, and outcomes. I3 Aspergillus Study Group. Medicine (Baltimore), 2000, 79, p. 250–260.
37. Schwartz, S., Ruhnke, M., Ribaud, P. et al. Improved outcome in central nervous system aspergillosis, using voriconazole treatment. Blood, 2005, 106, p. 2641–2645.
38. Sunita, M., Martino, R., Franquet, T. et al. Invasive pulmonary aspergillosis in patients with hematologic malignancies: survival and prognostic factors. Haematologica, 2002, 87, p. 528–534.
39. Dignani, M. C., Anaissie, E. J., Hester, J. P. et al. Treatment of neutropenia-related fungal infections with granulocyte colony-stimulating factor-elicited white blood cell transfusions: a pilot study. Leukemia, 1997, 11, p. 1621–1630.
40. Cordonnier, C., Ribaud, P., Herbrecht, R. et al. Prognostic factors for death due to invasive aspergillosis after hematopoietic stem cell transplantation: a 1-year retrospective study of consecutive patients at French transplantation centers. Clin. Infect. Dis., 2006, 42, p. 955–963.
41. Bernard, A., Caillot, D., Couaillier, J. F. et al. Surgical management of invasive pulmonary aspergillosis in neutropenic patients. Ann. Thorac. Surg., 1997, 64, p. 1441–1447.
42. Gossot, D., Validire, P., Vaillancourt, R. et al. Full thoracoscopic approach for surgical management of invasive pulmonary aspergillosis. Ann. Thorac. Surg., 2002, 73, p. 240–244.
43. Pagano, L., Ricci, P., Nosari, A. et al. Fatal haemoptysis in pulmonary filamentous mycosis: an underevaluated cause of death in patients with acute leukaemia in haematological complete remission. A retrospective study and review of the literature. Gimema Infection Program (Gruppo Italiano Malattie Ematologiche dell’Adulto). Br. J. Haematol., 1995, 89, p. 500–505.
44. Steinbach, W. J., Benjamin, D. K. Jr., Kontoyiannis, D. P. et al. Infections due to Aspergillus terreus: a multicenter retrospective analysis of 83 cases. Clin. Infect. Dis., 2004, 39, p. 192–198.
45. Denning, D. W., Radford, S. A., Oakley, K. L. et al. Correlation between in-vitro susceptibility testing to itraconazole and in-vivo outcome of Aspergillus fumigatus infection. J. Antimicrob. Chemother., 1997, 40, p. 401–414.
46. Lass-Florl, C., Kofler, G., Kropshofer, G. et al. In-vitro testing of susceptibility to amphotericin B is a reliable predictor of clinical outcome in invasive aspergillosis. J. Antimicrob. Chemother., 1998, 42, p. 497–502.
47. Smith, J., Safdar, N., Knasinski, V. et al. Voriconazole therapeutic drug monitoring. Antimicrob. Agents. Chemother., 2006, 50, p. 1570–1572.
48. Theuretzbacher, U., Ihle, F., Derendorf, H. Pharmacokinetic/pharmacodynamic profile of voriconazole. Clin. Pharmacokinet., 2006, 45, p. 649–663.
49. Glasmacher, A., Hahn, C., Leutner, C. et al. Breakthrough invasive fungal infections in neutropenic patients after prophylaxis with itraconazole. Mycoses, 1999, 42, p. 443–451.
50. Pasqualotto, A. C., Shah, M., Wynn, R. et al. Voriconazole plasma monitoring. Arch. Dis. Child., 2008.
51. Pascual, A., Calandra, T., Bolay, S. et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves efficacy and safety outcomes. Clin. Infect. Dis., 2008, 46, p. 201–211.
52. Trifilio, S., Pennick, G., Pi, J. et al. Monitoring plasma voriconazole levels may be necessary to avoid subtherapeutic levels in hematopoietic stem cell transplant recipients. Cancer, 2007, 109, p. 1532–1535.
53. Dodds Ashley, E., Lewis, R., Lewis, J. et al. Pharmacology of Systemic Antifungal Agents; doi:10.1086/504492. Clinical Infectious Diseases 2006; 43: S28-S39.
54. Glasmacher, A., Prentice, A. Current experience with itraconazole in neutropenic patients: a concise overview of pharmacological properties and use in prophylactic and empirical antifungal therapy. Clinical Microbiology & Infection, 12, p. 84–90.
55. Pascual, A., Nieth, V., Calandra, T. et al. Variability of voriconazole plasma levels measured by new high-performance liquid chromatography and bioassay methods. Antimicrob. Agents. Chemother., 2007, 51, p. 137–143.
56. Leenders, A. C., Daenen, S., Jansen, R. L. et al. Liposomal amphotericin B compared with amphotericin B deoxycholate in the treatment of documented and suspected neutropenia-associated invasive fungal infections. Br. J. Haematol., 1998, 103, p. 205–212.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 1-
All articles in this issue
- Robotem asistovaná laparoskopie z pohledu anesteziologa
- Výsledky dětské intenzivní péče v České republice za rok 2007
- Význam dechového objemu a jeho monitorování při vysokofrekvenční umělé plicní ventilaci
- Dávkování a způsob podání antibiotik u kriticky nemocných
- Léčba invazivních mykotických infekcí u imunoalterovaných nemocných – doporučení odborných společností*
- Léčba invazivní kandidózy – doporučení odborných společností*
- Léčba invazivní aspergilózy – doporučení odborných společností
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dávkování a způsob podání antibiotik u kriticky nemocných
- Robotem asistovaná laparoskopie z pohledu anesteziologa
- Význam dechového objemu a jeho monitorování při vysokofrekvenční umělé plicní ventilaci
- Léčba invazivní kandidózy – doporučení odborných společností*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

