-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Diosmin/hesperidin: a cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only?
With the advent of novel monocomponent venoactive drugs containing the flavonoid diosmin, the need has arisen to answer the question of therapeutic equivalence of the widely used micronized purified flavonoid fraction (MPFF) contained in Detralex and of the currently introduced monocomponent venoactive drugs.
Experimental work provides evidence that each of the two dominant components, i.e. diosmin and hesperidin, has its specific and distinctive pharmacodynamic effect. There is also evidence of a mutual synergistic effect, e.g. in antiexudative action. Clinical studies have been carried out with MPFF for the most part, and effect has clearly been established in this particular form. Conversely, the results of studies documenting the effect of diosmin alone have been conflicting. Mutual comparisons failed to confirm equivalence of MPFF and monocomponent diosmin in any of the studies. This fact is clearly reflected in the relevant guidelines where the use of MPFF in chronic venous disease is recommended unequivocally (level of evidence 1 and strength of evidence B) while, in the case of monocomponent diosmin, it is stated that treatment can be considered (2C). It can be concluded that both experimental and clinical studies document that only a complex of biologically active flavonoids – a micronized purified flavonoid fraction – has evidence of effect and is recommended by relevant guidelines.
Keywords:
equivalence – diosmin – micronized purified flavonoid fraction – hesperidin – chronic venous disease
Autoři: Debora Karetová 1; Josef Suchopár 2; Jan Bultas 3
Působiště autorů: II. interní klinika kardiologie a angiologie 1. LF UK a VFN Praha 1; INFOPHARM, Praha 2; Farmakologický ústav 3. LF UK Praha 3
Vyšlo v časopise: Vnitř Lék 2020; 66(2): 97-103
Kategorie: Přehledové články
Souhrn
S příchodem nových monokomponentních venofarmak obsahujících flavonoid diosmin vznikla potřeba zodpovědět otázku terapeutické ekvivalence široce užívané mikronizované purifikované flavonoidní frakce (MPFF) obsažené v přípravku Detralex a zaváděných venofarmak monokomponentních.
Experimentální práce dokládají, že každá z dvou dominantních složek, tj. diosmin i hesperidin, má svůj specifický a nezaměnitelný farmakodynamický efekt. Doložen je i vzájemný synergistický efekt např. v antiexudativním působení. Klinické práce byly prováděny vesměs s MPFF, v této formě byl jednoznačně doložen efekt. Naopak výsledky prací dokládajících účinek samotného diosminu jsou rozporuplné. Vzájemné srovnání pak v žádné ze studií nepotvrdilo ekvivalenci MPFF a diosminu monokomponentního. Tuto skutečnost jednoznačně odráží i platné doporučené postupy, kdy užití MPFF při chronické žilní nemoci je jednoznačně doporučeno (evidence 1 se sílou důkazů B), naopak pro monokomponentní diosmin je konstatováno, že léčba může být zvážena (2C).
Lze uzavřít, že experimentální i klinické práce dokládají, že pouze komplex biologicky aktivních flavonoidů – mikronizovaná purifikovaná flavonoidní frakce – má doklad o účinku a je doporučen platnými léčebnými postupy.
Klíčová slova:
mikronizovaná purifikovaná flavonoidní frakce – diosmin – hesperidin – chronická žilní choroba – ekvivalence
Tento článek by neměl být, řečeno slovy emeritního ředitele Medical Tribune Mgr. Jaroslava Hořejšího, „věšákem na reklamu“, ale analýzou situace kolem venoaktivních flavonoidů, a sice pohledem angiologa, farmakologa a farmaceuta. Podnětem k napsání tohoto přehledu je názor zástupců některých farmaceutických firem, kteří v rámci uvedení monokomponentního flavonoidu diosminu přicházejí s tvrzením, že druhá, hesperidinová složka (tj. hesperidin, diosmetin, isorhoifolin a linarin) v kombinovaném přípravku (Detralex®) je jen „nečistotou“, která vlastní farmakodynamický účinek nemá, a jediným farmakologicky účinným flavonoidem je diosmin.
Chronické žilní onemocnění je častou chorobou – v různé míře postihuje téměř tři čtvrtiny dospělých žen a polovinu mužů. Jeho význam spočívá zejména ve zhoršení kvality života v celém spektru klinické manifestace: od bolestivých i méně specifických projevů v časných fázích, po varikózní změny a jejich komplikace. Dominujícím patofyziologickým momentem je přítomnost žilní hypertenze – při insuficienci chlopenního systému nebo omezené průchodnosti hlubokých žil, nebo selhání podpůrných mechanismů důležitých pro žilní návrat. Vedle hemodynamických a anatomických změn vede chronická žilní insuficience k aktivaci řady reparačně‑zánětlivých změn, které jsou zpravidla zodpovědné za průvodní algické projevy, za vlastní progresi onemocnění a spolu s krevní stázou i za případné trombotické komplikace.
V rámci reparačně zánětlivé (imflamazomové) kaskády jsou hypoxií aktivovány četné faktory (hypoxií indukovaný faktor – HIF, vaskulární endoteliální růstový faktor – VEGF aj.) iniciující proliferaci vasa vasorum (Obr. 1.). Leukocytární metaloproteinázy pak poškozují elastickou a kolagenní složku žilní stěny a přispívají k remodelaci – vzniku dilatace a tortuosity. Konečně celá kaskáda aktivovaných zánětlivých cytokinů, interleukinů a růstových faktorů iniciuje jak nekrotické, tak apoptotické pochody (1). Vazoaktivní, resp. venofarmakologická léčba pak ovlivňuje tento proces útlumem pochodů proteolytických, prozánětlivých a protrombotických, naopak mechanismy hojení musí zůstat zachovány. Léčiva z oblasti flavonoidů (polyfenolických molekul rostlinného původu) či glykosaminoglykanů (komplexních sacharidů s navázanou aminoskupinou) typu heparanů a dermatanů splňují řadu těchto vlastností.
Flavonoidy jsou důležitými modulátory celé řady biologických funkcí v rostlinné říši, mají antioxidační efekt, kontrolují reparační a proliferační pochody, konkrétně odpovídají za obranyschopnost rostlin proti virům, bakteriím, plísním a nádorovému bujení. Není tak divu, že i v živočišné říši ovlivňují řadu biologických funkcí. Mechanismem jejich působení je modulace aktivity celé řady enzymů a cytokinů. Ze skupiny asi 60 bioflavonoidů je nejlépe dokumentován efekt diosminu kombinovaného s hesperidinovou frakcí (tzv. mikronizovaná purifikovaná flavonoidní frakce – MPFF). Právě na biologický efekt těchto flavonoidů se zaměříme. Z ostatních venofarmak do skupiny bioflavonoidů patří i jiné látky, konkrétně rutosidy. Řada flavonů je též účinnými látkami heřmánku, ginkgo biloba a řady jiných fytofarmak.
Prevence i léčba žilní insuficience je postavena zejména na úpravě životosprávy, kompresní léčbě, intervenčních a chirurgických přístupech a na farmakoterapii. Ta je reprezentována vazoaktivními léčivy, tradičně označovanými jako venofarmaka. Po desítky let venofarmaka používáme především jako součást léčby při obtížích provázejících chronickou žilní nemoc s cílem zmírnit řadu nepříjemných příznaků, důležitá jsou i při žilních ulceracích (bércových vředech) ke zrychlení hojení defektů, užíváme je i jako přídatnou léčbu u akutních trombóz povrchových žil nebo k urychlení léčby iritovaných či trombozovaných hemorhoidálních žil. Tyto látky původu přírodního, semisyntetické i zcela syntetické, působí v různé míře jedním či více mechanismy účinku – protizánětlivě, zvýšením žilního tonu, snížením propustnosti a lomivosti kapilár, zlepšením stavu mikrocirkulace (zvýšením deformability erytrocytů či snížením aktivace leukocytů) nebo příznivým ovlivněním lymfatické drenáže. Doklady o objektivním působení u řady přípravků chybí.
Z těchto důvodů byl v posledních letech vypracován přehled doložených účinků jednotlivých léčivých substancí (Tab. 1.), který byl včleněn do platných doporučených postupů (2–4). Jak je patrné z tabulky, mikronizovaná purifikovaná flavonoidní frakce obsahující diosmin a hesperidinovou frakci, má v indikaci úpravy příznaků chronické žilní nemoci nejsilnější doporučení pro užití, tj. v kategorii 1, a silný či středně silný průkaz účinku v kategorii A či B. V indikaci hojení žilních ulcerací (v kombinaci s lokální a kompresní léčbou) je uváděna jako jediná účinná léčba (v kategorii IB). Samotný nemikronizovaný či syntetický diosmin má doporučení pro užití jen slabé, stejně tak je velmi slabý průkaz účinku (kategorie 2C).
Tab. 1. Souhrn doporučení pro podávání venofarmak podle systému GRADE (Grading of Recommendations Assessment, Development and Evaluation) dle Doporučení pro léčbu chronických žilních chorob z roku 2018 (24). 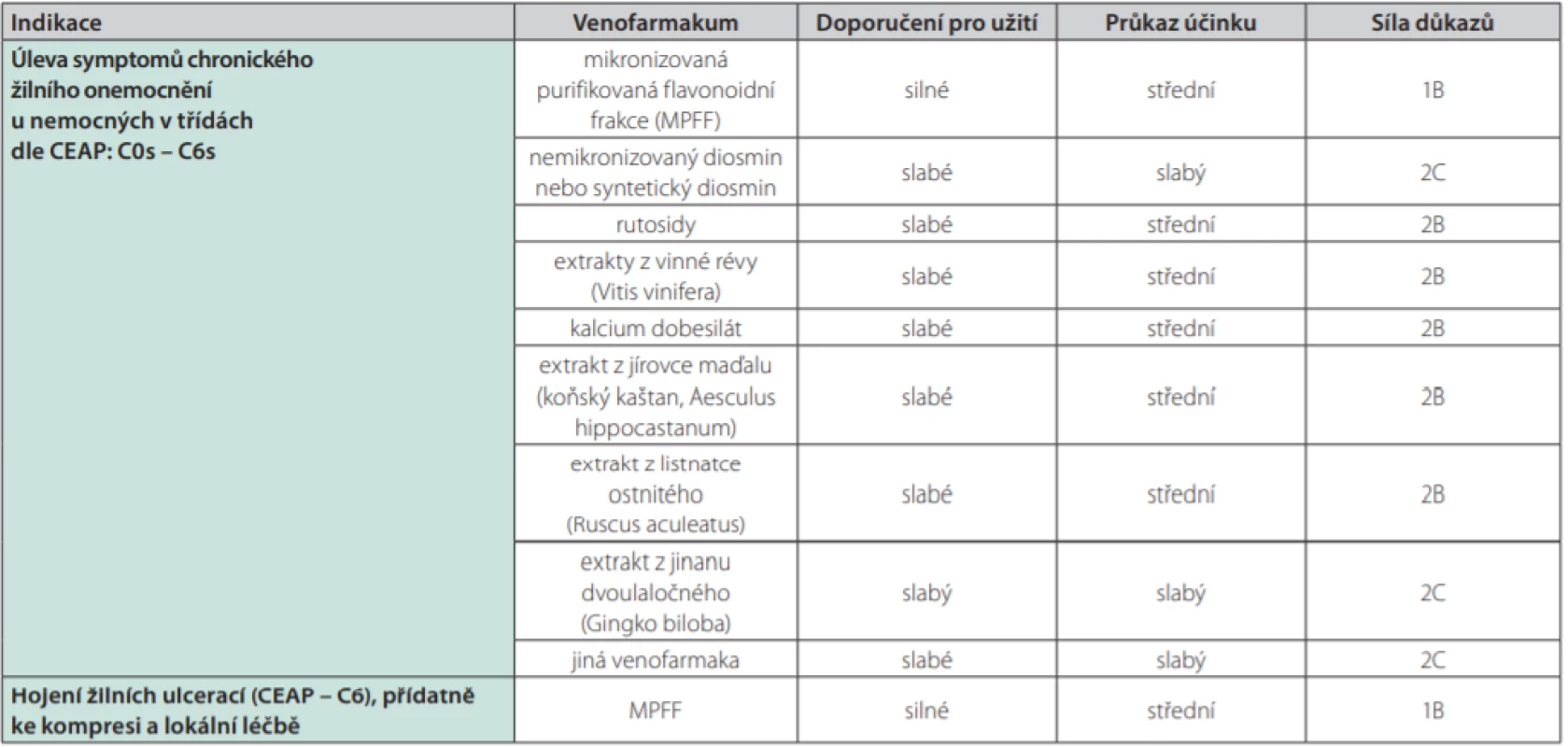
Jsme tedy v situaci, kdy fixní kombinace mikronizovaného diosminu s hesperidinovou frakcí (MPFF) má nejvyšší doporučení pro užití na základě kvalitních a konzistentních klinických studií, kdežto samotný diosmin, zejména není‑li mikronizován, má doporučení pouze na úrovni „možno zvážit použití“. To znamená „bez jasných dokladů o efektu”. Je tedy mezi hesperidinem a diosminem rozdíl ve farmakologickém účinku, který vede k synergistickému působení? Nebo je hesperidin skutečně jen neúčinný „balast“ a veškerý efekt je dán diosminem?
a) Má hesperidin vlastní farmakodynamický účinek?
Hesperidin (HSD) a jeho aglykon – hesperetin (HST), jsou dva flavonoidy z citrusů, které do sebe vzájemně přecházejí. Proto je nutno uvažovat, že jejich biologické vlastnosti jsou stejné a označujeme je HSD/HST. Zcela novým poznatkem je významný vliv HSD/HST v inhibici zánětlivých reakcí. Toho je docíleno přímým zásahem do imflamazomové kaskády. Vlastní zánět (tedy zánětlivě reparační pochody) se výrazně podílejí na klinických projevech chronické žilní nemoci, resp. žilní insuficience. Regulační cytokiny typu tumor necrosis faktoru α (TNFα), interleukinů (zejm. IL1-β a IL6) a další působky aktivují „efektory“, tedy proteiny označované jako molekuly akutní fáze. Mezi tyto proteiny patří zejména C‑reaktivní protein (CRP), který aktivuje zánětlivou odpověď tkání, tkáňový faktor aktivující mimo jiné trombogenezi (TF – tissue factor), či inhibitor plasminogenového aktivátoru 1 (PAI-1), který tlumí fibrinolýzu (Obr. 1.).
Obr. 1. Význam aktivace zánětlivé kaskády (inflamazomu NLRP3) v etiopatogenezi chronické žilní insuficience. Celá řada nox – hypoxie, vzestup žilního tlaku, infekce, aterogenní lipoproteiny (resp. jejich apolipoproteiny) či poškození cévní stěny s uvolněním cytokinů, prostanoidů a dalších mediátorů vede k aktivaci obecné reakce na poškození – k aktivaci imflamazomu NLRP3. Dochází k aktivaci apoptotické kaskády, která na jedné straně odstraní poškozené buňky, nicméně může vést k úbytku buněčných elementů v cévní stěně. Aktivace a diferenciace makrofágů vede mimo jiné k uvolnění řady proteáz, elestáz a kolagenáz, které pak žilní stěnu přímo poškodí. Poslední reakcí je aktivace molekul akutní fáze, zejména C-reaktivního proteinu. Ten, vedle toho, že aktivuje komplement a umožní opsonizaci bakterií, dále propaguje zánětlivou reakci a poškozuje endotelie i ostatní složky žilní stěny. Fibrinogen a inhibitor plasminogenového aktivátoru 1 pak mají protrombotický efekt. Aktivace mitotické reakce, zejména nukleárního transkripčního faktoru kB, iniciuje přestavbu žilní stěny. Výsledkem je pak oslabení žilní stěny, varikózní přeměna, tortuosita a trombotická pohotovost. 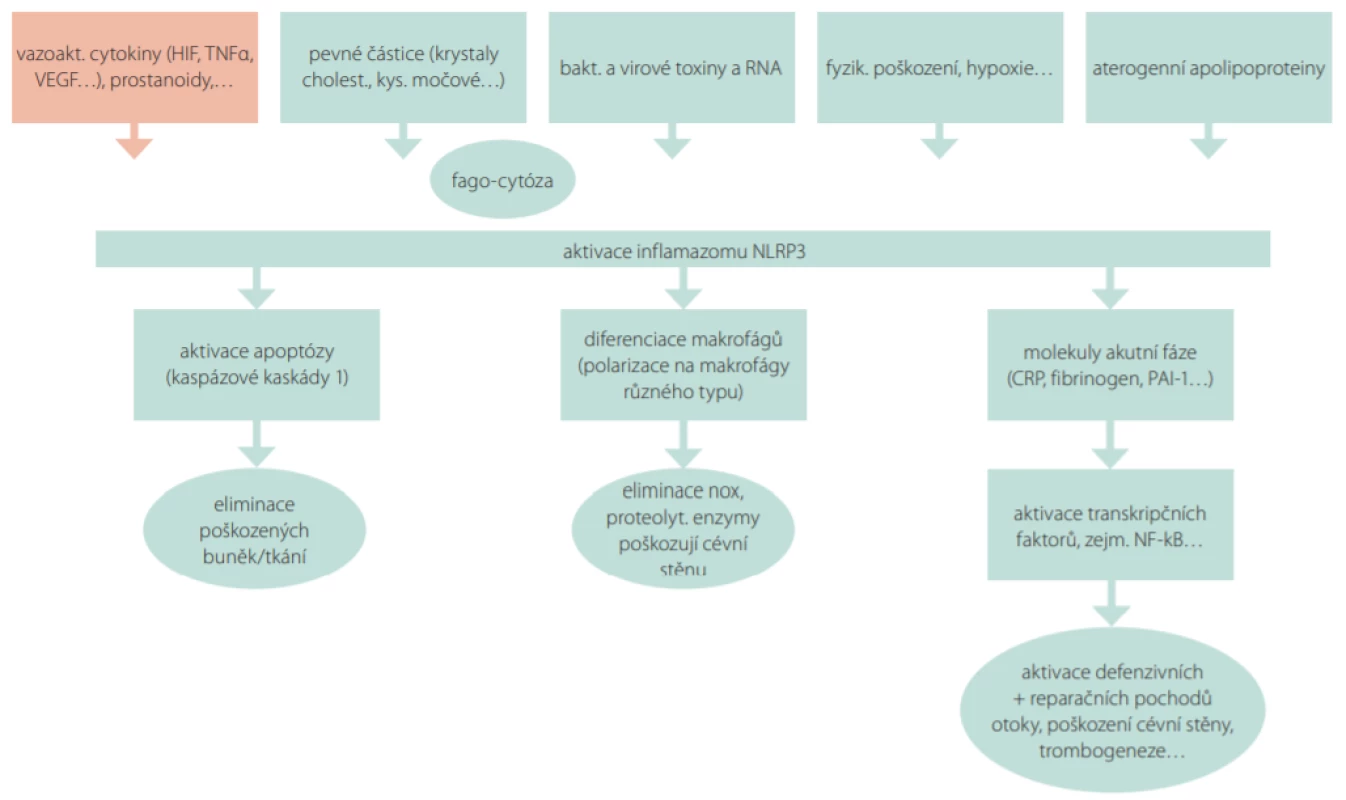
Vysvětlivky: HIF – hypoxií indukovaný faktor, VEGF – vaskulární endoteliální růstový faktor, TNFα – tumor necrosis faktor α, CRP – C -reaktivní protein, PAI-1 – inhibitor plasminogenového aktivátoru, NFkB – nukleární transkripční faktor kB Z předloženého obecně přijatého schématu je možno odvodit, že jak potlačení zánětlivé reakce, tak zásah do hemostázy (potlačení trombogeneze a normalizace trombolýzy) má v chronické žilní insuficienci zásadní význam, a sice jak pro mikrocirkulaci a riziko edému tkání, tak pro riziko trombotizace. Doklady o inhibici regulačních cytokinů (interleukinů i TNFα) a nejvýznamnějšího efektoru zánětlivé kaskády – CRP – po podání hesperidinu je doložen jak daty experimentálními, tak klinickými studiemi.
Experimentální studie dokládají, že hesperidin inhibuje jak řadu cytokinů (zejm. TNFα a interleukiny 1 a 6), tak vazoadhezivních molekul (selektin, intercelulární či vaskulární adhezní molekuly ICAM, resp. VCAM). Tyto molekuly výrazně ovlivňují expresi biologicky vysoce aktivních glykosaminoglykanů, významné složky endoteliálního povrchu. Jejich přítomnost (jako heparany a dermatany) je nutná k zachování nesmáčivosti endotelu (antitrombotické působení), k regulaci proliferace buněčných složek cévní stěny (reparace defektů) a k zajištění defenzivních pochodů (např. obrana proti infekci či metastazování nádorů).
Podobně hesperidin tlumí celou řadu regulačních mechanismů počínaje nukleárním transkripčním faktorem spouštějícím celou kaskádu imflamazomu – tj. faktorem NF‑κB, tlumí expresi inducibilní NO‑syntázy (iNOS) v místě zánětlivé reakce a inhibuje prozánětlivou cyklooxygenázu 2. typu (COX-2) a snižuje expresi prozánětlivých kináz typu MAPK (mitogen‑activated protein kinases). Dominantní klinický význam má zřejmě inhibice COX-2, enzymu syntetizujícího vazodilatační prozánětlivé prostaglandiny, které vedle aktivace imflamazomu aktivují též bolestivé podněty. Následné snížení nabídky molekul akutní fáze, konkrétně CRP, vede k potlačení zánětu na více úrovních (5–8). Jednotlivá místa působení jsou uvedena na Obr. 2.
Obr. 2. Význam jednotlivých faktorů ovlivňujících vývoj žilní insuficience, přestavbu cévní stěny a trombotickou pohotovost, místa působení hesperidinu (H) a diosminu (D). Je patrné, že některá místa působení diosminu a hesperidinu jsou společná, nicméně hesperidin má řadu dalších míst farmakodynamického působení 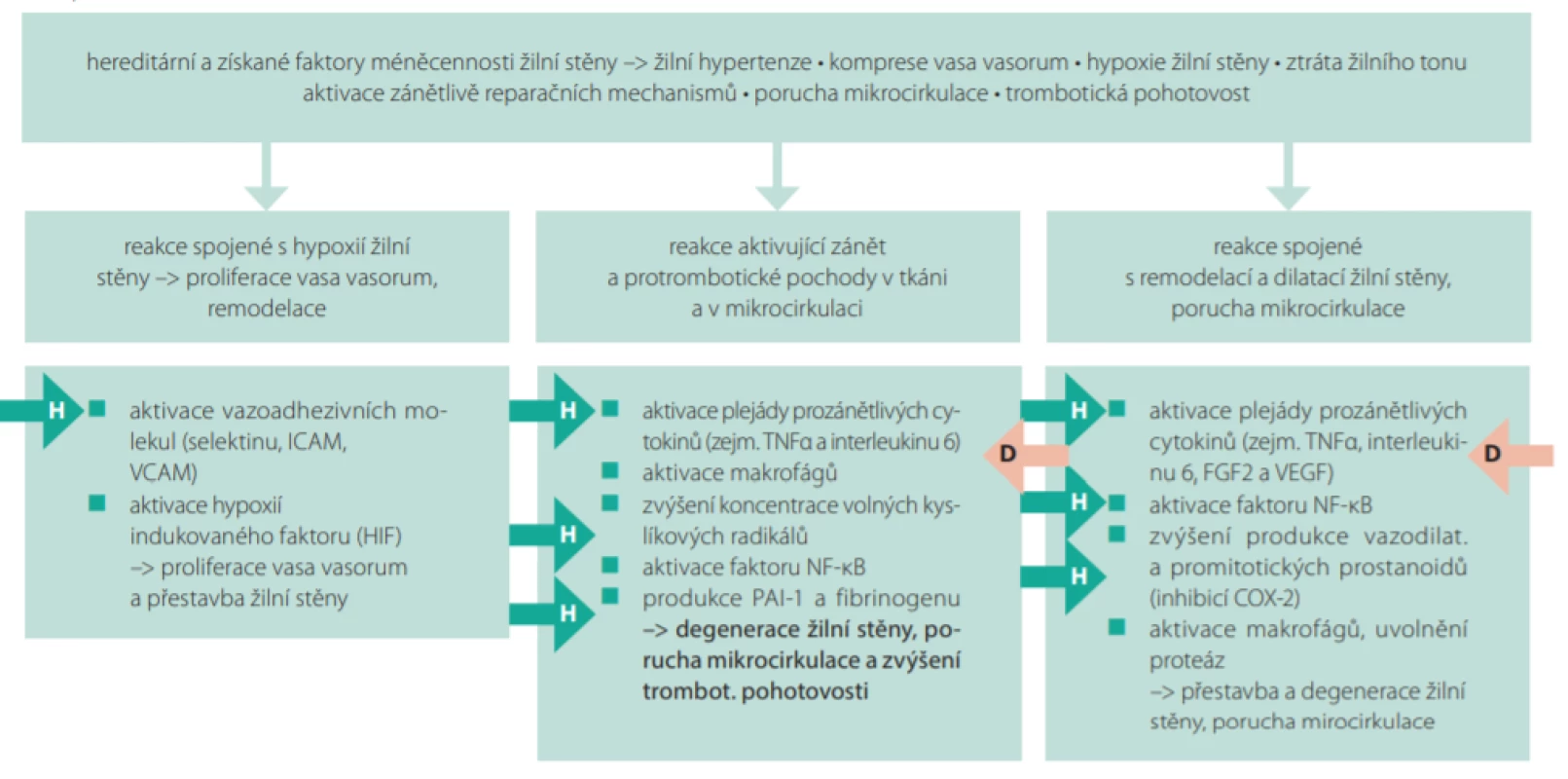
Vysvětlivky: ICAM – intercellular adhesion molecule, FGF2 – fibroblast growth factor 2, COX-2 – cyklooxygenáza 2, vaskulární endoteliální růstový faktor, další zkratky společné s Obr. 1. Platnost těchto pozorování u člověka byla potvrzena v klinických studiích provedených na zdravé populaci i v subpopulacích, kdy jsou molekuly akutní fáze aktivované (9). Takovými populacemi jsou diabetici, nemocní s aterotrombotickou příhodou či s metabolickým syndromem (10–12). Doklad o tom, že se jedná skutečně o efekt hesperidinu, byl podán ve studii, kdy změny sledovaných zánětlivých cytokinů významně korelovaly s plazmatickou hladinou hesperidinu (13).
Můžeme tedy uzavřít, že hesperidin má vlastní farmakodynamický účinek, konkrétně snižuje nežádoucí zánětlivou reakci provázející žilní insuficienci a nepřímo zasahuje též do aktivace hemostázy a fibrinolýzy.
b) Jaký je farmakodynamický efekt monokomponentního diosminu?
Též druhý biologicky aktivní flavonoid – diosmin – má celou řadu farmakodynamických účinků. Účinek diosminu je převážně zprostředkován jeho metabolitem – aglykonem diosmetinem. Jak v experimentu, tak v klinických studiích byl doložen protizánětlivý, antitrombotický účinek. Dále doložen antiexudativní efekt vedoucí k resorpci případných edémů tkáně (14–16).
Efekt MPFF, tedy kombinace diosmin/hesperidinová frakce, dokládá řada studií, často studií velmi kvalitních. Naproti tomu monokomponentnímu diosminu dosud velká pozornost věnována nebyla. Není dostupná žádná in extenso publikovaná studie, která by srovnávala účinek diosminu proti placebu. Jediná studie s názvem EDEN byla v r. 2013 přednesena pouze ve formě přednášky a in extenso nebyly výsledky studie dosud publikovány (17). Tato dvojitě zaslepená, randomizovaná studie sledovala efekt diosminu 600 mg 1× denně (tedy v dávce nižší, než je doporučena) na ústup „bolestivých potiží“ u téměř 400 nemocných s chronickou žilní nedostatačností. Primárním cílem byla změna bolesti měřená na vizuální analogové škále pro hodnocení bolesti venózní etiologie. Výsledky neukázaly statisticky významný rozdíl v účinnosti ve srovnání s placebem. Nutno však zdůraznit, že v této studii byl diosmin poddávkován a léčba trvala jen 28 dnů, tedy nelze říci, že léčba byla prováděna lege artis. Hodnota studie je tak malá.
Druhou studií je recentně publikovaná práce, bohužel nekontro ‑ lovaná, která sledovala efekt diosminu v dávce 2× 600 mg na cytokiny účastnící se zánětlivé kaskády – imflamazomu a na řadu růstových faktorů (18). Po tříměsíční léčbě u 35 nemocných s žilní insuficiencí došlo k významnému poklesu tumor necrosis factor α (TNFα), vascular endothelial growth faktoru (VEGF‑A a VEGF‑C), fibroblast growth faktoru 2 (FGF2) a interleukinu 6 (IL-6). Ze subjektivních ukazatelů došlo k mírné redukci otoků dolních končetin (obvod kotníku poklesl z 31,5 cm na 29 cm) a asi polovina nemocných udávala zmírnění bolestí. I přes absenci kontrolní skupiny je, podobně jako u hesperidinu, doložen protizánětlivý účinek diosminu, pokles koncentrace sledovaných markerů zánětu byl skutečně významný. Např. v případě TNFα klesla koncentrace na 30 % výchozích hodnot. Naproti tomu efekt na klinické parametry, s ohledem na otevřenou a nekontrolovanou studii, přesvědčivý není. Místa působení jednotlivých faktorů uvedena na Obr. 2.
Shrneme‑li, pak je dobře doložen protizánětlivý a protektivní efekt diosminu při standardním dávkování, nicméně nelze říci, že by byl doložen efekt na otoky a bolestivé příznaky provázející chronickou žilní insuficienci.
c) Liší se efekt samotného diosminu od diosminu v kombinaci s hesperidinovou frakcí (MPFF)?
Tato otázka je významná, v řadě případů jsme svědky, že teprve kombinace dvou léčiv vede k validnímu efektu.
Experimentální studie sice nemusí odpovídat klinické praxi, nicméně většina dokladů o farmakologických účincích léčiv je získána v laboratořích v pracech na zvířeti. Dostupná je práce na křečcích, kde autoři porovnávali antiexudativní efekt samotného diosminu a efekt jednotlivých složek MPFF (diosminu, hesperidinu, isorhoifolinu a linarinu). Experimentálně sledovaný efekt odráží klíčový efekt klinický. Závěrem článku autoři shrnují výsledek: „Hesperidin, linarin a isorhoifolin, každý samostatně měl antiexudativní účinek větší než diosmin. Mikronizovaná purifikovaná flavonoidní frakce snižuje permeabilitu více než kterákoli ze složek podaných samostatně a lze předpokládat, že flavonoidy obsažené v MPFF mají synergistický účinek“ (19).
Jsou dostupné tři studie porovnávající diosmin proti kombinaci diosminu s hesperidinovou frakcí (MPFF), všechny z devadesátých let minulého století. Jediná, zcela nedávná studie, bohužel nebyla dosud zveřejněna, byť uběhly téměř dva roky od ukončení. Jak tomu bývá v podobných případech, příčinou zprodlení mohou být rozpaky nad získanými výsledky. Podívejme se však na výsledky dosavadních studií.
První dvojitě zaslepená randomizovaná studie zahrnovala 90 pacientů s chronickou žilní insuficiencí (20). Jedné podskupině pacientů byl podáván nemikronizovaný diosmin v dávkách 1000mg denně a druhé podskupině pacientů byla podávána MPFF v dávkách 1000mg denně, a to po dobu průměrně 28 dnů. Byly sledovány „funkční klinické příznaky“, tj. pocit tíhy, bolesti aj. v dolních končetinách, údaj o edému získán měřením obvodu kotníku, průtokové paramentry získány pletysmografickým vyšetřením s 20, 40 a 60 mm Hg žilní okluzí. Vedle účinnosti byla sledována též tolerance terapie. Podávání MPFF bylo v hodnocení paramentru „zmenšení obvodu kotníku“ i v objektivně zjištěných hodnotách žilní perfuze při pletysmografii statisticky významně účinnější než podávání diosminu, stejně tak byla lepší spokojenost účastníků studie s efektem léčby měřené ústupem potíží. Všechny uvedené ukazatele byly při léčbě MPFF (proti nemikronizovanému diosminu) významně statisticky lepší na 99% hladině významnosti (p < 0,01). Tolerance obou léčebných postupů byla srovnatelná.
Obdobná dvojitě zaslepená randomizovaná studie porovnávala diosmin a MPFF, podávané dávky byly stejné jako ve studii předchozí, sledováno bylo měření obvodu kotníku, pletysmografické parametry s 20, 40 a 60 mm Hg žilní okluzí a tolerance terapie (21). Též v této studii bylo podávání MPFF v ovlivnění edému v oblasti kotníku statisticky významně účinnější než podávání diosminu (p < 0,01).
Třetí studie zahrnovala 69 pacientů. Stejně jako v obou předešlých se jednalo o dvojitě slepou, randomizovanou studii (22). Tato studie je pouze citována různými autory, nelze ji však in extenso dohledat na relevantním zdroji informací (není obsažena ani v databázi Medline, ani v databázi Embase). Zde byly dávky odlišné, řídily se doporučenými dávkami výrobce. V prvé větvi byl jedné podskupině pacientů podáván diosmin (Diovenor® 600 mg) v dávkách 600 mg denně a ve druhé větvi pacientů byla podávána MPFF v dávkách 1000 mg denně. Délka léčby byla průměrně 28 dnů. Účinnost byla sledována měřením obvodu dolní končetiny 10 cm a 30 cm nad kotníkem a kvalita subjektivního zlepšení dotazníky vyplněnými pacientem, tedy v obou případech sledováno objektivní i subjektivní hodnocení účinnosti. Podle autorů nebyly nalezeny statisticky významné rozdíly v hodnocených parametrech.
Jediná recentní práce má charakter „non‑inferioritní“ studie, srovnává samotný diosmin s MPFF (diosmin/hesperidinová frakce) u 120 nemocných se žilní insudiciencí (23). Ač byla dokončena počátkem roku 2018, do konce r. 2019 nebyl publikován výsledek. Běžnou praxí pak je, že pozitivní výsledky, v tomto případě by to byla absence rozdílu mezi diosminem a MPFF, bývají zveřejněny bezprostředně.
Shrneme‑li, pak dvě in extenso publikované studie dokládají významnější efekt MPFF proti samotnému diosminu. Jediná studie, bohužel v plném znění nedohledatelná, rozdíl nenalezla. Na základě dostupných dat rozhodně nelze uzavřít, že by samotný diosmin byl stejně účinný jako mikronizovaná purifikovaná flavonoidní frakce. Naopak máme doklady, že klinicky významný rozdíl existuje.
d) Jak dalece je doložen efekt kombinace diosminu/hesperidinové frakce (mikronizované purifikované flavonoidní frakce)?
purifikované flavonoidní frakce)? Mikronizovaná purifikovaná flavonoidní frakce (v České republice léčivý přípravek Detralex®) je v současné době nejlépe prozkoumaným venofarmakem, jehož účinnost u chronického žilního onemocnění, včetně bércových vředů, a u akutní ataky hemoroidálního onemocnění lze považovat za jednoznačně doloženou. Uváděná nezpochybnitelnost účinnosti vychází z homogenních výsledků řady randomizovaných kontrolovaných klinických studií, systematických přehledů a z provedených meta‑analýz těchto studií. Tomu odpovídá i doporučení k užití, které je v posledních „guidelines“ klasifikováno jako „silné“ (24).
Celkem bylo v minulosti publikováno několik desítek randomizovaných klinických studií, ve kterých byla podávána MPFF, a to oproti placebu nebo jiným venofarmakům. Tyto studie měly různé uspořádání a zahrnovaly různé počty pacientů. Sledované primární i sekundární cíle se lišily podle konkrétního sledovaného onemocnění (chronické žilní onemocnění, bércové vředy, hemoroidy). Jejich analýza ukazuje, že účinnost MPFF u chronického žilní onemocnění včetně bércových vředů a u akutní ataky hemoroidálního onemocnění je velmi dobře doložena řadou dobře provedených randomizovaných kontrolovaných klinických studií, z nichž některé zahrnovaly řádově stovky pacientů. Z hlediska evidence based medicine lze MPFF považovat za prokazatelně účinnou a bezpečnou terapeutickou intervenci.
Vedle randomizovaných a kontrolovaných klinických studií byly dále publikovány prospektivní kontrolované studie, z nichž je nezbytné jmenovat zejména studii RELIEF (25). Tato studie byla multicentrická a probíhala v celkem 23 zemích Evropy, včetně ČR, přičemž do ní bylo zařazeno více než 10 tisíc pacientů s chronickým žilním onemocněním. Prokázáno bylo významné zlepšení závažnosti onemocnění u pacientů hodnocené ústupem subjektivních symptomů (zejm. ústup bolesti, pocitu tíhy v končetinách) i objektivními ukazateli účinku (zejm. výskyt otoku). Zlepšení kvality života i objektivně pozorovaných příznaků choroby bylo významné jak klinicky, tak statisticky (p < 0,0001).
Nejnovější systematický přehled amerických autorů o MPFF v indikaci léčby chronického žilního onemocnění výslovně uvádí, že po provedení kompletní literární rešerše, včetně Cochranovy databáze, bylo identifikováno celkem 10 randomizovaných kontrolovaných klinických studií, které splňovaly přísná kritéria pro zařazení do analýzy (26). Zejména byla požadována přítomnost kompletních primárních dat dokumentujících účinnost. Autoři systematického přehledu uvádějí, že úroveň důkazů podporuje doporučení k použití MPFF v terapii chronického žilního onemocnění, neboť má příznivou klinickou účinnost a nemá žádné klinicky významné nežádoucí účinky. Autoři současně uvádějí, že MPFF je v podmínkách USA jediným venofarmakem, které je registrované jako léčivý přípravek. Autoři se ztotožňují s doporučením Evropské společnosti pro vaskulární chirurgii publikovaným v roce 2015, které doporučilo MPFF pro terapii bércových vředů a jako souběžnou terapii ke kompresivní terapii u chronického žilního onemocnění.
Nejnovější systematický přehled a meta‑analýza studií v indikaci akutních hemoroidů uvádí, že po provedení kompletní literární rešerše obvyklých zdrojů dat, včetně Cochranovy databáze, bylo identifikováno celkem 10 randomizovaných kontrolovaných klinických studií, které splňovaly přísná kritéria pro zařazení do meta‑analýzy (27). Do těchto studií bylo celkem zařazeno 1164 pacientů. Autoři uvádějí, že podávání MFPP snižuje výskyt krvácení doprovázejícího akutní hemoroidy. Výsledky v případě dalších hodnocených parametrů jsou dle autorů nekonzistentní.
K dispozici jsou v současné době tři zásadní meta‑analýzy, každá z nich se zabývá jednou z tří základních indikací MPFF. Prvá se zabývá obecnou meta‑analýzou studií provedenou s venofarmaky typu MPFF v indikaci chronického žilní onemocnění, druhá v indikaci léčby bércových vředů a třetí v indikaci akutní hemoroidy (27–29). Dále je dostupná jedna meta‑analýza srovnávající všechna dostupná venofarmaka postupně v řadě indikací (30). Jaké jsou výsledky?
Prvá meta‑analýza hodnotila studie provedené s MPFF publikované do září 2017 v indikaci léčby chronického žilního onemocnění (28). Celkem do jednotlivých studií vybraných do meta‑analýzy bylo zařazeno 1692 pacientů splňujících přísná kritéria kvality. Hodnoceny byly změny subjektivních parametrů (např. bolest dolních končetin, pocit tíhy v dolních končetinách, otok, křeče, parestezie), objektivních ukazatelů (např. obvod kotníku, zarudnutí dolních končetin, změny kůže v oblasti dolních končetin) a kvalita života pacientů oproti placebu. Kvantitativní analýza dat prokázala, že MPFF ve srovnání s placebem vede ke snížení bolesti dolních končetin (RR 0,53, p = 0,0001, NNT = 4,2), ke snížení pocitu tíhy dolních končetin (RR 0,35, P < 0,00001, NNT = 2,0), výskytu křečí (RR 0,51, p = 0,02, NNT = 4,8), pocitu parestezií (RR 0,45, p = 0,03, NNT = 3,5) nebo pocitu funkčního nepohodlí (RR 0,41, NNT = 3,0). Jak je patrno, efekt – tj. zlepšení nejméně o 50 % – byl významný jak klinicky, tak statisticky. Pokud jde o objektivní parametry, došlo ke snížení obvodu kotníku, tj. k ústupu otoků (SMD -0,59, -1,15 až -0,02), zarudnutí nohy (SMD -0,32, -0,56 až -0,07, RR 0,50, p = 0,03, NNT = 3,6), zlepšení kožních změn (RR 0,18, p = 0,0003, NNT = 1,6) a zvýšení kvality života (SMD -0,21, -0,37 až -0,04, tj. RR 0,28, p < 0,00001, NNT = 2,5). Nízké hodnoty NNT (Number Need to Treat) ukazují, že efekt byl přítomen u podstatné části nemocných, resp. např. v případě zlepšení kožních změn byl efekt u dvou pacientů ze třech léčených.
Druhá meta‑analýza (29) hodnotila studie provedené s MPFF publikované v období let 1996–2001 v indikaci léčby bércových vředů. Zařazeny byly opět pouze studie splňující kritéria kvality a dohledatelnosti výsledků. Celkem bylo do analýzy zařazeno 723 pacientů. Z výsledků této meta‑analýzy vyplývá, že podávání MPFF zvyšuje šanci na vyléčení bércových vředů o 32 % (RR 0,68, CI 90%: 0,97–0,3).
Třetí meta‑analýza (27) hodnotila studie provedené s MPFF publikované v období do dubna 2018 v indikaci léčby akutní exacerbace hemoroidů. Do tří studií splňujících ktitéria a vybraných do meta‑analýzy bylo zařazeno celkem 1164 pacientů. Souhrnná analýza výsledků prokázala, že podávání placeba bylo, ve srovnání s podáváním MPFF, spojeno s vyšším relativním rizikem krvácení, a to 1,46 (1,10-1,93, p = 0,008), tj. proti placebu bylo riziko krvácení sníženo o třetinu.
Poslední z meta‑analýz (30) hodnotila veškeré publikované studie provedené s venofarmaky a publikované v období let 1975–2009, pokud splňovaly kritéria pro zařazení do hodnocení, přičemž do jednotlivých studií vybraných do meta‑analýzy bylo zařazeno celkem 1010 pacientů. V meta‑analýze se uvádí, že MPFF má ve srovnání s placebem nejvyšší efekt (p < 0,00001), ostatní hodnocené intervence mají efekt nižší, nicméně ale statisticky významně vyšší než placebo. Jedinou výjimkou byl diosmin v nemikronizované formě, u této lékové formy statisticky nevýznamný rozdíl oproti placebu prokázán nebyl.
e) Jaké závěry plynou z uvedeného rozboru pro klinickou praxi?
Závěry lze shrnout do několika bodů, všechny jsou náležitě dokumentovány. Jedinou neznámou je výsledek studie porovnávající efekt samotného diosminu s MPFF (23). Do doby odevzdání rukopisu výsledek zveřejněn nebyl.
- Pro mikronizovanou purifikovanou flavonoidní frakci, tedy diosmin v kombinaci s hesperidinovou frakcí, byla prokázána nejširší účinnost v indikaci chronického žilního onemocnění (ve všech stadiích choroby, včetně bércových vředů).
- Dosud nejsou k dispozici údaje prokazující dostatečnou účinnost monokomponentních léčivých přípravků obsahujících léčivou látku diosmin, zejména však diosmin v nemikronizované formě.
- Léčivé přípravky obsahující diosmin nejsou terapeuticky zaměnitel ‑ né s léčivými přípravky obsahujícími mikronizovanou purifikovanou flavonoidní frakci.
- V současné době národní, evropské i americké doporučené postupy upřednostňují mikronizovanou purifikovanou flavonoidní frakci jako jedinou terapii s dobrým průkazem účinku k terapii chronického žilního onemocnění, včetně bércových vředů.
Na otázku, zda kombinace diosmin/hesperidinová frakce je účinným tandemem či zda je hesperidin jen neúčinnou příměsí, lze odpovědět jednoznačně. Každý z flavonoidů má svůj farmakodynamický účinek a pouze pro kombinaci obou složek existují doklady o účinku. Jak dokládá též experimentální práce, kombinace jednotlivých složek flavonoidů má, minimálně na úrovni antiexudativního působení, synergistický účinek (19). Rozhodně tak není možno souhlasit s tvrzením, že jedinou účinnou látkou je diosmin a ostatní flavonoidy jsou jen neúčinnou příměsí.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Debora Karetová, CSc.,
II. interní klinika 1. LF UK a VFN,
U Nemocnice 2,
128 08 Praha 2
Cit. zkr: Vnitř Lék 2020; 66(2): 97–103
Článek přijat redakcí: 16. 1. 2020
Článek přijat k publikaci: 27. 1. 2020
Zdroje
1. Ligi D, Croce L, Mannello F. Chronic venous disorders: The dangerous, the good, and the diverse. Int. J. Mol. Sci. 2018; 19 : 2544,
2. Wittens C, et al. Management of Chronic Venous Disease. Clinical Practice Guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2015; 49 : 678–737.
3. Nicolaides A, Kakkos S, Baekgaard N, et al. Management of chronic venous disorders of the lower limbs. Guidelines according to scientific evidence. Part I. Int Angiol 2018, June 37(3): 232–254.
4. Karetová D. Chronická žilní onemocnění končetin ve světle mezinárodních doporučení publikovaných v roce 2018 (Guidelines for the management of chronic venous disorders of the lower limbs, Int Angiol, 2018), Postgraduální medicína 2019, ročník 21, č. 1 : 52–57.
5. Ding Z, Sun G, Zhu Z. Hesperidin attenuates influenza A virus (H1N1)-induced lung injury in rats through its anti‑inflammatory effect. Antivir Ther. 2018 Apr 6. doi: 10.3851, IMP3235.
6. Lee HJ, Im AR, Kim SM et al. The flavonoid hesperidin exerts anti‑photoaging effect by downregulating matrix metalloproteinase (MMP)-9 expression via mitogen activated protein kinase (MAPK)-dependent signaling pathways. BMC Complement Altern Med. 2018 Jan 30;18(1):39. doi: 10.1186/s12906-017-2058-8.
7. Tejada S, Pinya S, Martorell M et al. Potential anti‑inflammatory effects of hesperidin from the genus Citrus. Curr Med Chem. 2017 Jul 18. doi: 10.2174/0929867324666170718104412
8. Parhiz H, Roohbakhsh A, Soltani F, et al. Antioxidant and anti‑inflammatory properties of the citrus flavonoids hesperidin and hesperetin: an updated review of their molecular mechanisms and experimental models. Phytother Res. 2015 Mar;29(3): 323–331. doi: 10.1002/ptr.5256
9. Milenkovic D, Deval C, Dubray C, et al. Hesperidin displays relevant role in the nutrigenomic effect of orange juice on blood leukocytes in human volunteers: a randomized controlled cross‑over study. PLoS One. 2011; 6(11): e26669.
10. Salden BN, Troost FJ, de Groot E, et al. Randomized clinical trial on the efficacy of hesperidin 2S on validated cardiovascular biomarkers in healthy overweight individuals. Am J Clin Nutr. 2016 Dec;104(6): 1523–1533.
11. Haidari F, Heybar H, Jalali MT, et al. Hesperidin supplementation modulates inflammatory responses following myocardial infarction. J Am Coll Nutr. 2015; 34(3): 205–211.
12. Rizza S, Muniyappa R, Iantorno M, et al. Citrus polyphenol hesperidin stimulates production of nitric oxide in endothelial cells while improving endothelial function and reducing inflammatory markers in patients with metabolic syndrome. J Clin Endocrinol Metab. 2011; 96(5): E782–792.
13. Morand C, Dubray C, Milenkovic D, et al. Hesperidin contributes to the vascular protective effects of orange juice: a randomized crossover study in healthy volunteers. Am J Clin Nutr. 2011; 93(1): 73–80.
14. Takase S, Pascarella L, Lerond L, Bergan JJ Schmid‑Schonbein GW. Venous hypertension, inflammation and valve remodeling. Eur. J. Vasc. Endovasc. Surg. 2004; 28 : 484–493.
15. Das Gracas CDSM, Cyrino FZ, de Carvalho JJ, Blanc‑Guillemaud V, Bouskela E. Protective Effects of Micronized Purified Flavonoid Fraction (MPFF) on a Novel Experimental Model of Chronic Venous Hypertension. Eur. J. Vasc. Endovasc. Surg. 2018;55 : 694–702.
16. Laurent R, Gilly R, Frileux C. Clinical evaluation of a venotropic drug in man. Example of Daflon 500 mg. Int. Angiol. 1988; 7 : 39–43.
17. Efficacy and Safety of Diosmin 600 mg Versus Placebo on Painful Symptomatology in Patients With Chronic Venous Disease of Lower Limbs (EDEN), ClinicalTrials.gov Identifier: NCT01532882.
18. Feldo M, Wójciak‑Kosior M, Sowa I, et al. Effect of Diosmin Administration in Patients with Chronic Venous Disorders on Selected Factors Affecting Angiogenesis. Molecules. 2019; 24(18): 3316.
19. Paysant J, Sansilvestri‑Morel P, Bouskela E, et al. Different flavonoids present in the micronized purified flavonoid fraction (Daflon 500 mg) contribute to its anti‑hyperpermeability effect in the hamster cheek pouch microcirculation. Int Angiol. 2008; 27(1): 81–85.
20. Amato C. Advantage of a micronized flavonoidic fraction (Daflon 500 mg) in comparison with a nonmicronized diosmin. Angiology 1994; 45 : 531–536.
21. Cospite M, Dominici A. Advantage of micronisation of Daflon 500 mg compared with a simple diosmine in the treatment of venous insufficiency. Double blind study. Phlebologie 1998; 51 : 243–247.
22. Henriet J‑P. Insuffisance veineuse fonctionnelle: essai clinique comparatif d’une seule prise par jour de Diovenor® 600 mg (600 mg de diosmine d’hémisynthèse) versus 2 prises par jour d’un mélange de 500 mg de flavonoides (900 mg de diosmine). Phlebologie 1995; 48 : 285–290.
23. Clinical Non‑inferiority Study Between Diosmin 600 mg & Diosmin + Hesperidin in Symptomatic Chronic Venous Insufficiency. ClinicalTrials.gov Identifier: NCT03471910.
24. Nicolaides A, Kakkos S, Baekgaard N, et al. Management of chronic venous disorders of the lower limbs. Guidelines According to Scientific Evidence. Int Angiol. 37(3): 181–254. doi: 10.23736/S0392-9590.18.03999-8.
25. Jantet G. RELIEF study: first consolidated European data. Reflux assEssment and quaLity of lIfe improvement with micronized Flavonoids. Angiology 2000; 51 : 31–37.
26. Bush R, Comerota A, Meissner M, Raffetto JD, Hahn SR, Freeman K. Recommendations for the medical management of chronic venous disease: The role of Micronized Purified Flavanoid Fraction (MPFF). Phlebology 2017; 32 (1_suppl): 3–19.
27. Aziz Z, Huin WK, Badrul Hisham MD, Tang WL, Yaacob S. Efficacy and tolerability of micronized purified flavonoid fractions (MPFF) for haemorrhoids: A systematic review and meta‑analysis. Complement Ther Med 2018; 39 : 49–55.
28. Kakkos SK, Nicolaides AN. Efficacy of micronized purified flavonoid fraction (Daflon®) on improving individual symptoms, signs and quality of life in patients with chronic venous disease: a systematic review and meta‑analysis of randomized double‑blind placebo‑controlled trials. Int Angiol 2018; 37 : 143–154.
29. Coleridge‑Smith P, Lok C, Ramelet AA. Venous leg ulcer: a meta‑analysis of adjunctive therapy with micronized purified flavonoid fraction. Eur J Vasc Endovasc Surg 2005; 30 : 198–208.
30. Allaert FA. Meta‑analysis of the impact of the principal venoactive drugs agents on malleolar venous edema. Int Angiol 2012; 31 : 310–315.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Stárnutí cév a vaskulární paměť
- Co přináší internistům nové doporučení ESC – diabetes?
- Celiakie dospělých
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Diferenciální diagnostika hypoglykemie
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Diabetes a kardiovaskulární onemocnění
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



