-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
Use of platelet lysate for mesenchymal stem cell cultivation
Mesenchymal stem cells (MSCs) are a heterogeneous subset of stromal stem cells that can be isolated from many adult tissues. They can differentiate into cells of the mesodermal lineage, such as adipocytes, osteocytes and chondrocytes, as well as cells of other embryonic lineages. MSCs can interact with cells of both the innate and adaptive immune systems, leading to the modulation of several effector functions. After in vivo administration, MSCs induce peripheral tolerance and migrate to injured tissues, where they can inhibit the release of pro-inflammatory cytokines and promote the survival of damaged cells. This article recapitulates experimental data of MSC sources and mechanisms of MSC - isolation and cultivation according to GMP (good manufacture practice) standards.
Key words:
mesenchymal stem cells – platelet lysate
Autoři: E. Matějková 1; V. Foltánková 2; J. Michálek 2; B. Kubešová 1
Působiště autorů: Tkáňová banka FN Brno, pracoviště Bohunice, přednostka prim. MUDr. Barbara Kubešová 1; Univerzitní centrum buněčné imunoterapie, Babákův výzkumný institut Lékařské fakulty MU Brno, přednosta prof. MUDr. Roman Hájek, CSc. 2
Vyšlo v časopise: Vnitř Lék 2010; 56(Supplementum 1): 46-50
Kategorie: XVI. Pařízkovy dny, Ostrava-Poruba, 25.–26. březen 2010
Souhrn
Mezenchymální stromální buňky (mesenchymal stromal cells – MSC) jsou heterogenní populací kmenových buněk, které lze izolovat z mnoha různých tkání. MSC mohou diferencovat do buněk mezodermální linie (adipocytů, chondrocytů a osteoblastů) i ostatních zárodečných linií. MSC jsou schopny interagovat s buňkami vrozené i získané imunity, a navozovat tak modulaci některých funkcí imunitního systému. Po in vivo podání mohou MSC vyvolat toleranci a migrovat do míst poškozených tkání, kde mohou tlumit vznik prozánětlivých cytokinů a podporovat přežití poškozených buněk. Tato práce shrnuje výsledky experimentů s různými zdroji MSC a dále možnosti jejich izolace a kultivace vzhledem k požadavkům správné klinické praxe (good manufacture practice – GMP).
Klíčová slova:
mezenchymální kmenové buňky – destičkový lyzátÚvod
Mezenchymální kmenové buňky (MSC) jsou nejvíce zastoupeny v kostní dřeni. Jsou to buňky zodpovědné za regeneraci tkání a byly poprvé popsány Friedensteinem et al v roce 1976 [1 – 3].
Mimo kostní dřeň jsou MSC lokalizovány i v jiných tkáních lidského těla – např. v pupečníkové i periferní krvi, tukové tkáni, periostu nebo synoviální tekutině.
Hlavními charakteristikami mezenchymálních kmenových buněk je jejich fibroblastoidní morfologie, schopnost vytvářet CFU - F kolonie, schopnost multipotentní diferenciace (do adipocytů, osteoblastů, chondrocytů nebo myoblastů) a charakteristická skladba povrchových znaků CD34– / CD45– / CD73+/ CD90+/ CD105+ [4].
MSC jsou v poslední době velmi sledovanou populací, a to pro jejich regenerativní potenciál, který je dle prvních výsledků z klinických studií možné využít při léčbě širokého spektra onemocnění (ischemie, autoimunitní choroby, reparace tkání a další). S tím je však spojena potřeba kultivace MSC v režimu GMP – ten mimo jiné stanovuje velmi přísná kritéria na kultivační média (bezsérová nebo bez příměsi zvířecích komponent). Požadavky na média a podmínky pro kultivaci buněk s následným použitím v klinické praxi se řídí směrnicí Evropské komise 2001/ 83/ ES.
Vzhledem k tomu, že trh s komerčními médii s GMP certifikátem je v současnosti velmi omezený, bylo nutné nalézt vlastní kompletní médium pro kultivaci MSC pro klinické použití. V naší laboratoři jsme vyzkoušeli médium s 5% destičkovým lyzátem. Růst MSC v tomto médiu byl porovnán s růstem MSC v komerčních médiích.
Materiál
V našich experimentech bylo zpracováno celkem 25 vzorků biologického materiálu – 15krát aspirát kostní dřeně (2 ml), 5krát výplach z vaku po separaci kostní dřeně a 5krát pupečníková krev. Veškerý biologický materiál byl odebrán ve FN Brno na základě podepsaného informovaného souhlasu pacienta/ dárce.
Metody
Izolace MSC
Pro izolaci MSC byla použita metoda plastické adherence izolovaných mononukleárních buněk.
Biologický materiál byl navrstven na Histopaque (Sigma) v poměru 1 : 2 (Histopaque : materiál) a centrifugován (1 200 ot/ 40 min/ 20 °C). Gradientovou centrifugací se vytvořila vrstva mononukleárních buněk. Tato vrstva byla odebrána, promyta Hanksovým roztokem (Sigma) a poté resuspendována v kultivačním médiu a osazena na 75 cm2 kultivační lahve (Saerstedt) v koncentraci 1 × 106/ cm2.
Kultivace MSC
Kultivace MSC probíhala ve třech různých médiích, po skončení experimentů byly tyto tři typy kultivací vzájemně porovnány.
Prvním médiem bylo MesenCult® Medium (StemCell Technologies), které se připravuje z MesenCult® MSC Basal Medium a Mesenchymal Stem Cell Stimulatory Supplement (Human) v poměru 10 : 1.
Vzhledem k plánované aplikaci MSC pacientům bylo vyzkoušeno také komerční bezsérové médium MesenCult® – ACF Medium (StemCell Technologies).
Třetím typem média bylo námi připravené médium s 5% destičkovým lyzátem. Dulbecco’s Modified Eagle Medium (DMEM) obohacené GlutaMaxem, D - glukózou a pyruvátem (Gibco) bylo smícháno s destičkovým lyzátem (PL) tak, aby finální koncentrace PL byla 5 %. Takto připravené médium bylo přefiltrováno přes 0,22µm filtr.
Kultivace MSC probíhala v inkubátoru s 5% CO2 při 37 °C, médium bylo měněno třikrát týdně. Při dosažení 80 – 90 % konfluence buněk byly MSC pasážovány.
Flow cytometrická analýza povrchových znaků
U MSC byla pomocí flow cytometrie sledována exprese povrchových znaků na přístroji FACSCanto II (BD Biosciences). Dle doporučení ISCT byly sledovány znaky CD34, CD45, CD73, CD90 a CD105, které charakterizují MSC [4].
Bylo analyzováno vždy minimálně 30 000 událostí. Pro analýzu dat byl použit software BD FacsDiva (BD Biosciences), pro grafickou prezentaci dat byl použit Flow - Jo software (Ashland), verze 7.1.2.
Výsledky
Kultivace
Komerční médium MesenCult® (StemCell Technologies) bylo použito pro kultivaci MSC ze všech vzorků kostní dřeně (z výplachů vaků i aspirátů kostní dřeně) a všech vzorků pupečníkové krve. Kultivace MSC byla provedena dle instrukcí výrobce.
Výsledky kultivace shrnuje tab. 1, morfologii buněk kultivovaných v tomto médiu pak ukazuje obr. 1a.
Tab. 1. Přehled výsledků kultivací. 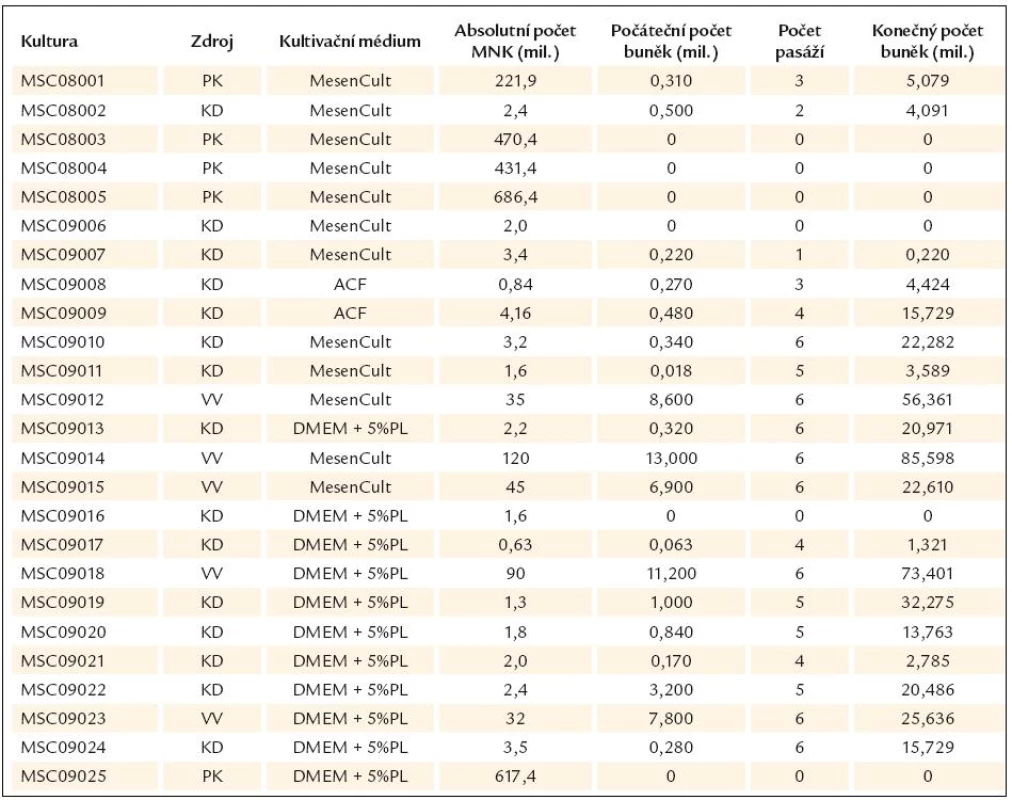
PK – pupečníková krev, KD – kostní dřeň, VV – výplach vaku Počáteční počet buněk – počet adherentních buněk po 1. pasáži, MesenCult – MesenCult® MSC Basal Medium + 10% Mesenchymal Stem Cell Stimulatory Supplement (Human), ACF – bezsérové médium MesenCult®, ACF – Medium (StemCell Technologies), DMEM + 5%PL – Dulbecco’s Modified Eagle Medium s GlutaMaxem a D- glukózou + 5% destičkový lyzát, MNK – mononukleární buňky naizolované z jednotlivých materiálů Na začátku roku 2009 bylo na trh uvedeno bezsérové médium pro kultivaci MSC – MesenCult ACF Medium (StemCell Technologies). Toto médium bylo použito u dvou vzorků kostní dřeně a jako druhý způsob kultivace u tří vzorků kostní dřeně.
Výsledky z těchto kultivací však nebyly uspokojivé – buňky vytvářely CFU - F kolonie až po delším (dvojnásobném) časovém úseku než při kultivaci v médiu MesenCult s 10% séra. Navíc měly buňky sníženou proliferační kapacitu a přecházely do stavu senescence již po třetí, resp. čtvrté pasáži. Proto nebylo toto médium dále používáno. Výsledky kultivace shrnuje tab. 1.
Morfologii buněk z kostní dřeně kultivovaných v tomto médiu ukazuje obr. 1b.
Obr. 1. Morfologie MSC z kostní dřeně (2. pasáž), které byly kultivovány ve třech různých médiích. (a) MesenCult médium s 10% sérem, (c) bezsérové ACF médium, (c) DMEM + 5% destičkový lyzát. Zvětšeno 100krát. 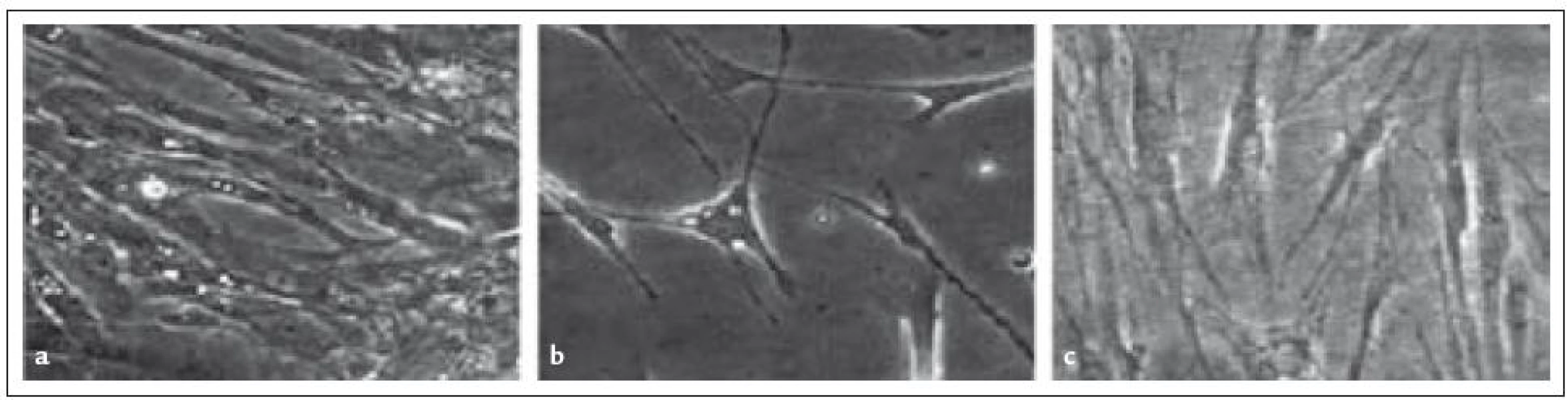
Médium DMEM s 5% destičkovým lyzátem bylo vyvinuto na základě metodiky kultivace MSC týmu Franka Locatelliho v italské Pavii a bylo vybráno na základě splnění požadavků pro GMP standardy.
Poprvé bylo použito pro vzorek MSC z kostní dřeně. Ve srovnání s komerčním médiem MesenCult byly výsledky velmi slibné. Buňky vytvářely CFU - F kolonie již 3. – 6. den (medián 4 dny) po zahájení kultivace a dlouhodobě (do 5. pasáže, ± 1 pasáž) si udržovaly vysoký proliferační potenciál. Morfologie MSC se v průběhu kultivace neměnila. Na základě dosažených výsledků bylo toto médium používáno jako první volba ve všech zbylých kultivacích.
Výsledky kultivace shrnuje tab. 1, morfologie buněk kultivovaných v tomtomédiu pak ukazuje obr. 1c.
Výsledkem je tedy optimalizovaná a zavedená metodika získávání a kultivace mezenchymálních kmenových buněk v kultivačním médiu použitelném pro další klinické experimenty. Postup kultivace byl zpracován do standardního operačního protokolu (SOP), který se v současné době používá v Univerzitním centru buněčné imunoterapie Lékařské fakulty Masarykovy univerzity.
Flow cytometrie
Buňky byly izolovány, část z buněk byla odebrána a po inkubaci s monoklonálními protilátkami byla změřena exprese jejich povrchových znaků. Měření bylo opakováno po 2. pasáži. MSC získané ze všech 3 zdrojů neexprimovaly žádné znaky hematopoetických buněk (CD34, CD45) (obr. 2). Všechny analyzované MSC exprimovaly typické markery mezenchymálních stromálních buněk (CD73, CD90 a CD105) (obr. 2). Exprese CD90 a CD105 na MSC z pupečníkové krve byla významně snížená oproti MSC z kostní dřeně.
Obr. 2. Reprezentativní flow cytometrická analýza MSC z kostní dřeně. 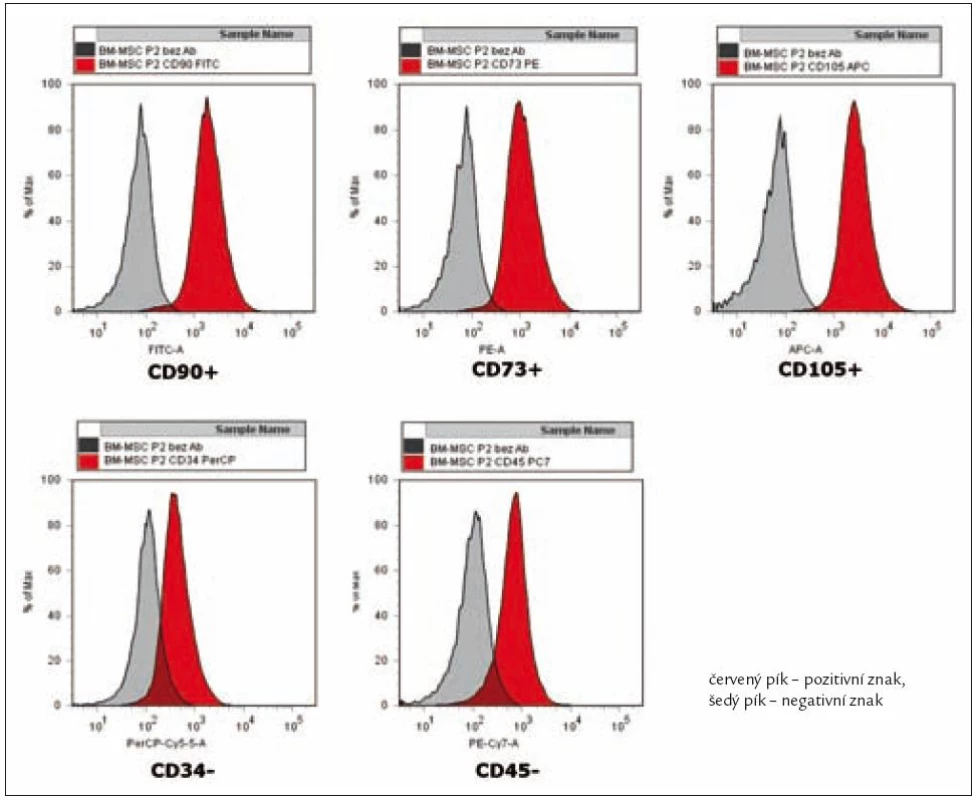
Výsledkem těchto experimentů je potvrzení, že kultivované mezenchymální buňky ze všech zkoumaných zdrojů exprimují znaky charakteristické pro MSC (CD73, CD90, CD105) a zároveň neexprimují znaky hematopoetických buněk CD34 a CD45.
Diskuze
Všechny buňky izolované z těchto tří zdrojů měly typické vlastnosti MSC: fibroblastoidní morfologii, adherenci k plastu, vytváření CFU - F kolonií, schopnost multipotentní diferenciace a expresi charakteristických povrchových proteinů. Markery pro hematopoézu chyběly u všech tří typů MSC, míra exprese CD73 byla u sledovaných buněk shodná. Signifikantní rozdíl byl pozorován u znaků CD90 a CD105. Tyto molekuly jsou asociovány s hematopoézou a migrací buněk, svou úlohu hrají při homingu MSC i ve struktuře stromatu kostní dřeně.
MSC byly izolovány z materiálu od jedinců s různými chorobami (CLL, AML, CMP a další) a různým genetickým zázemím. Variabilita mezi dárci může být těžko sjednocena pro účely izolace MSC, a může tedy významně ovlivnit jejich vlastnosti jako proliferační kapacitu nebo diferenciační schopnost.
Dalším neopominutelným faktem je různý způsob kultivace MSC. Je nutné zohlednit účely, pro které je kultivace MSC prováděna (experimenty, klinické aplikace), a tomu přizpůsobit kultivační protokol. Při klinickém použití MSC je vyvíjen tlak na složení kultivačních médií, kdy je žádoucí používat média bez komponent zvířecího původu (riziko přenosu např. BSE z fetálního bovinního séra). Nejvhodnější jsou média bezsérová, avšak námi testované bezsérové médium expanzi MSC příliš nepodporovalo. Bylo proto vyvinuto médium s destičkovým lyzátem, které splňuje nároky na kultivaci MSC pro následné klinické aplikace.
Při kultivacích bylo pozorováno, že významnou roli v udržení proliferace hraje také kontakt mezi buňkami. Pokud byly buňky pasážovány v 70 – 80% konfluenci, jejich expanzní aktivita byla udržena déle. Jestliže se buňky nechaly dorůst do 100% konfluence, začala se měnit jejich morfologie a významně se snížila jejich ochota k další proliferaci.
Na základě výsledků našich experimentů můžeme konstatovat, že kostní dřeň a výplachy vaků po separaci kostní dřeně jsou vhodnými zdroji pro izolaci a následnou expanzi MSC. Pupečníková krev nebyla vyhodnocena jako vhodný zdroj MSC, a to pro její relativně nízkou proliferační kapacitu, neúspěšnost kultivací a kontaminaci koloniemi hematopoetických progenitorů. Tato fakta jsou zcela v souladu s literaturou. Kern et al uvádí úspěšnost kultivací MSC z pupečníkové krve 63 %, Wagner et al 34 % a Panepucci et al pouze 29 % [5 – 7]. Neúspěch při kultivaci MSC z pupečníkové krve připisujeme tomu, že pupečníkovou krev je nutno zpracovat co nejdříve, nejzazší hranice byla stanovena na 4 hod od odběru [5]. Do naší laboratoře se dostaly vzorky pupečníkové krve právě na hranici tohoto limitu.
Kostní dřeň je zatím nejpoužívanějším zdrojem MSC pro dosavadní klinické aplikace, např. při experimentální léčbě osteogenesis imperfecta, nemoci štěpu proti hostiteli nebo akutního infarktu myokardu. Bohužel počty, výskyt a diferenciační kapacita BM - MSC negativně koreluje s věkem – kostní dřeň tedy nemusí být vhodným zdrojem pro izolaci MSC u starších pacientů. V tomto případě však může být zvážen alogenní přístup. Pokud je vyžadován shodný dárce, jeví se jako nejlepší řešení odběr kostní dřeně nebo tukové tkáně od HLA identického sourozence, haplo-identických příbuzných nebo HLA-identických nepříbuzných dárců.
Transplantace a další klinické využití MSC je však v současné době teprve ve fázi časných klinických studií.
Závěr
Závěrem lze tedy konstatovat, že výsledkem experimentů popsaných v této práci je standardní postup kultivace MSC v režimu GMP a ověření stabilního fenotypu kultivovaných MSC z hlediska jejich stálé morfologie a exprese povrchových znaků. Tyto poznatky jsou odrazovým můstkem pro provedení validace procesu izolace a kultivace MSC z kostní dřeně v Čistých prostorách Babákova výzkumného institutu Lékařské fakulty Masarykovy univerzity v Brně. Poté je plánována klinická studie fáze II,ve které budou autologní MSC podány pacientům s různými autoimunitními chorobami. Tato klinická studie bude dalším rozšířením portfolia Univerzitního centra buněčné imunoterapie v souladu s dlouhodobým zaměřením tohoto pracoviště a nabídne moderní přístup léčby pro indikované pacienty.
Tato práce byla podpořena grantem MŠMT NPVII 2B06058 a grantem rektora Masarykovy univerzity pro tvůrčí činnost studentů č. MUNI/ 31/ E0021/ 2008.
RNDr. Eva Matějková
www.fnbrno.cz
e-mail: eva.matejkova@fnbrno.cz
Doručeno do redakce: 2. 4. 2010
Zdroje
1. Friedenstein AJ, Petrakova KV, Kurolesova AI et al. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation 1968; 6 : 230 – 247.
2. Friedenstein AJ. Precursor cells of mechanocytes. Int Rev Cytol 1976; 47 : 327 – 359.
3. Friedenstein AJ, Chailakhyan RK, Gerasimov UV. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers. Cell Tissue Kinet 1987; 20 : 263 – 272.
4. Horwitz EM, Le Blanc K, Dominici M et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy 2005; 7 : 393 – 395.
5. Kern S, Eichler H, Stoeve J. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells 2006; 5 : 1294 – 1301.
6. Wagner W, Wein F, Seckinger A et al.Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol 2005; 11 : 1402 – 1416.
7. Panepucci RA, Siufi JL, Silva jr. WA. Comparison of gene expression of umbilical cord vein and bone marrow - derived mesenchymal stem cells. Stem Cells 2004; 22 : 1263 – 1278.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo Supplementum 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Oznámení o úmrtí prof. Klementa
- Sborník abstrakt Ostrava- Poruba, 25.– 26. březen 2010
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Úvodní slovo
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Program konference
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



