-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diabetes mellitus, hypertenze a ledviny
Diabetes mellitus, hypertension and kidney
The correlations co-exist among diabetes mellitus, hypertension and the kidney. Renal injury will develop in 35% type-1 and type-2 diabetes mellitus patients. Diabetic nephropathy is the key factor for the occurence of hypertension in type-1 diabetes mellitus. In case of type-2 diabetes mellitus with prevalent essencial hypertension the diabetic nephropathy is supporting factor for the development of hypertension. Untreated or inadequately treated hypertension accelerates the progression of diabetic renal impairment. The presence of diabetes mellitus as well as hypertension or proteinuria is significant cardiovascular risk factor. The goal of treatment with angiotensin converting enzyme inhibitors or AT1 receptor of angiotensin II blockers is both slowing-down of renal injury progression and reduction in risk of cardiovascular complications.
Keywords:
diabetes mellitus - arterial hypertension - diabetic nephropathy - renoprotection - ACE inhibitors - AT1 blockers
Autoři: V. Monhart
Působiště autorů: Interní klinika 1. lékařské fakulty UK a ÚVN Praha, přednosta prof. MUDr. Miroslav Zavoral, Ph. D.
Vyšlo v časopise: Vnitř Lék 2008; 54(5): 499-507
Kategorie: Diabetes a urogenitální systém, Hradec Králové, 1.–2. června 2007
Předneseno na 9. celostátním diabetologickém sympoziu „Diabetes a urogenitální systém“ ve dnech 1.-2. června 2007 v Novém Adalbertinu v Hradci Králové
Souhrn
Mezi diabetes mellitus, arteriální hypertenzí a ledvinami existují vzájemné vztahy. U 35 % pacientů s diabetem 1. typu a 2. typu se vyskytne poškození ledvin. Diabetická nefropatie je klíčovým faktorem vzniku hypertenze u diabetu 1. typu. V případě diabetu 2. typu s převažující esenciální hypertenzí je diabetická nefropatie podpůrným faktorem rozvoje hypertenze. Neléčená nebo nedostatečně léčená hypertenze urychluje progresi diabetického postižení ledvin. Přítomnost diabetu, stejně jako hypertenze nebo proteinurie, je významným kardiovaskulárním rizikovým faktorem. Cílem léčby inhibitory angiotenzin konvertujícího enzymu nebo blokátory AT1 receptoru pro angiotenzin II je jak zpomalení progrese renálního postižení, tak i snížení rizika kardiovaskulárních komplikací.
Klíčová slova:
diabetes mellitus - arteriální hypertenze - diabetická nefropatie - renoprotekce - inhibitory ACE - AT1 blokátoryÚvod
Mezi diabetes mellitus (DM), arteriální hypertenzí a ledvinami existují vzájemné vztahy. Vznik diabetického onemocnění ledvin představuje důležitý faktor rozvoje hypertenze u DM 1. typu a 2. typu. Naopak hypertenze urychluje progresi diabetického postižení ledvin. Přítomnost DM stejně jako vysokého krevního tlaku nebo zvýšeného vylučování bílkoviny do moči je uznávaným rizikovým faktorem kardiovaskulárních onemocnění.
Diabetes mellitus a arteriální hypertenze
Arteriální hypertenze se vyskytuje u DM 1. typu, 2. typu a dalších typů (např. gestačního). U diabetiků je hypertenze 1,5-2krát častější než u nediabetiků. Současný výskyt hypertenze a DM stoupá s věkem, tělesnou hmotností a poklesem fyzické aktivity. Hypertenze se u DM považuje za hormonálně metabolické onemocnění. Při jejím vzniku a udržování se zvažuje účast několika možných faktorů - centrálně podmíněný vyšší tonus sympatiku, efekt inzulinu na cévní stěnu (případně i na ledvinu), stres a hyperkortizolizmus, hormony produkované tukovou tkání, metabolicky podmíněný systémový zánět s endotelovou dysfunkcí.
Prevalence hypertenze u diabetiků
Prevalence hypertenze závisí na věku - u mladších dospělých je 30%, u osob starších 60 roků již přesahuje 60%. Zvýšený krevní tlak je přítomen u 32 % nemocných s DM 1. typu (prevalence srovnatelná s nediabetickou populací) a u 80 % jedinců s DM 2. typu. V závislosti na věku je výskyt hypertenze u obou typů DM shodný - přibližně 55 % u 50letých, 70 % u 60letých a 80 % u 80letých [1]. Diabetická nefropatie (DN) je klíčovým faktorem pro rozvoj hypertenze u DM 1. typu a podpůrným faktorem u DM 2. typu. Z výsledků průřezového vyšetření rizikových faktorů kardiovaskulárních onemocnění u náhodně vybraného 1 % vzorku obyvatel 9 okresů ČR ve věku 25-64 let vyplývá, že v ČR minimálně 550 tisíc osob trpí současně DM a hypertenzí [2]. Reálný odhad současného počtu diabetiků s hypertenzí bez věkové limitace je kolem 700 tisíc osob. V rámci multicentrické epidemiologické studie u diabetiků v České republice byla arteriální hypertenze prokázána u 58 % nemocných s DM 1. typu a u 76 % diabetiků 2. typu. U 50 % sledovaných nebyl zvýšený krevní tlak kontrolovaný z důvodu buď nedostatečné, nebo zcela chybějící léčby hypertenze [3].
Hypertenze u DM 1. typu
Krevní tlak je normální po dobu 10-15 let od vzniku onemocnění. Nejčasnější změnou je chybění nočního poklesu krevního tlaku, a to i u normotenzních a normoalbuminurických jedinců (více u kuřáků). Vzestup nočního krevního tlaku se zvýrazní při vzniku mikroalbuminurie (MAU). V té době ještě nemusí být hypertenze, ale ve srovnání s diabetiky bez MAU již bývá přítomen „vysoký normální krevní tlak“ (130-139/85-89 mm Hg). Při albuminurii přesahující 300 mg/24 hod téměř všichni diabetici 1. typu mají arteriální hypertenzi, její prevalence dále stoupá s rozvojem manifestní proteinurie [4]. Patogeneze hypertenze u DM 1. typu není zcela jasná. Jednoznačné je, že určitou roli v ní hraje zejména DN. Prokazuje se zvýšená hladina atriálního natriuretického peptidu, je přítomná relativní hypervolemie a vyšší obsah sodíku v nitrobuněčném prostoru. Plazmatická reninová aktivita a aldosteron mohou být snížené, normální, ale i zvýšené.
Hypertenze u DM 2. typu
Zvýšený krevní tlak souvisí s obezitou, metabolickým syndromem a také s rozvojem DN. Hypertenze se prokáže až u 80 % nemocných již v době diagnózy metabolického onemocnění a u 90 % jedinců s přítomnou MAU. Nejčasnějším projevem (stejně jako u DM 1. typu) je porucha diurnální variability krevního tlaku s chyběním nočního poklesu („non-dipper“), přítomnost presorické reakce na zátěž a u starších jedinců izolovaná systolická hypertenze [1]. V patogenezi převažující esenciální hypertenze u DM 2. typu se účastní centrální sympatikotonie, retence tekutin a relativní hypervolemie, faktory sdružené s hyperinzulinemií a porucha poddajnosti cévní stěny vedoucí ke snížené schopnosti vazodilatace [5]. Na rozdíl od diabetiků 1. typu není u DM 2. typu příčina hypertenze jednotná (tab. 1). Při vzniku DN se v patogenezi uplatňuje složka sekundární renální parenchymatózní hypertenze. U některých diabetiků je sekundární renální hypertenze vyvolaná nediabetickým glomerulárním onemocněním, např. IgA nefropatií či membranózní glomerulonefritidou [6]. Poměrně častým nálezem u diabetiků je výskyt stenóz ledvinných tepen, které byly zjištěny u 19 % nemocných s DM 2. typu [7]. Při významném jednostranném postižení může dojít k rozvoji renovaskulární hypertenze, při zúžení obou ledvinných tepen nebo jedné tepny v případě solitární ledviny ke vzniku ischemické nefropatie [8]. Renovaskulární onemocnění představuje druhou nejčastější příčinu chronického selhání ledvin u diabetiků [9].
Tab. 1. Patogeneze hypertenze u nemocných s diabetes mellitus. 
Léčba hypertenze u diabetických pacientů
Léčebná opatření vycházejí z nových evropských [10], amerických [11] a českých doporučení pro léčbu hypertenze [12]. Nefarmakologická opatření jsou potřebná zejména u DM 2. typu, zvláště snížení hmotnosti, zvýšení fyzické aktivity a snížení příjmu soli. Antihypertenzní léčba je vhodná jak u hypertenze, tak již u vysokého normálního krevního tlaku. Cílové hodnoty jsou < 130/80 mm Hg. Základem farmakologické léčby je blokáda systému renin-angiotenzin-aldosteron inhibitory angiotenzin konvertujícího enzymu (inhibitory ACE) nebo blokátory AT1 receptoru pro angiotenzin II (AT1 blokátory). U DM 1. typu je více zkušeností s inhibitory ACE, u DM 2. typu bylo dosaženo příznivých výsledků jak s inhibitory ACE, tak i s AT1 blokátory. Použití inhibitorů ACE se zdá být výhodnější pro schopnost prevence nefropatie u DM 2. typu a prokázaný vliv na kardiovaskulární morbiditu a mortalitu. Antiproteinurické působení inhibitorů ACE a AT1 blokátorů je ekvivalentní. Častá je potřeba kombinační léčby. V klinické praxi u obou typů DM začínáme léčbu s inhibitory ACE, přidáváme AT1 blokátory, blokátory kalciových kanálů nedihydropyridinového typu, malé dávky tiazidových diuretik, případně další antihypertenziva [1]. Při poklesu glomerulární filtrace ≤ 60 ml/min/1,73 m2 (≤ 1,0 ml/s/1,73 m2) jsou tiazidová diuretika často neúčinná, proto je nutná jejich záměna za kličková diuretika, nebo se k tiazidům kličková diuretika přidají [10]. S ohledem na vysoké kardiovaskulární riziko musí být součástí farmakoterapie u DM antiagregancia a hypolipidemika. Antiagregační léčba kyselinou acetylsalicylovou vede ireverzibilní blokádou cyklooxygenázy k poklesu tvorby tromboxanu A, a tím přispívá ke snížení rizika vzniku makrovaskulárních komplikací DM. Hypolipidemická léčba upravuje často přítomnou poruchu tukového metabolizmu. Statiny navíc působí antiagregačně, snižují proliferaci hladkého svalstva cévní stěny a mohou vést k poklesu MAU a proteinurie.
Diabetická nefropatie
DN je chronické progredující onemocnění ledvin, které se projevuje narůstajícím vylučováním albuminu do moči, zvyšováním krevního tlaku a postupným snižováním filtrační funkce ledvin, které může vyústit až do chronického selhání ledvin [13]. DN je spojena se zvýšeným kardiovaskulárním rizikem.
Výskyt DN, posuzovaný v epidemiologických studiích na základě opakovaného průkazu proteinurie papírkovou zkouškou, byl zjištěn u 25-45 % diabetiků 1. typu. Dosud není zřejmé, proč přibližně u poloviny diabetiků 1. typu nedojde k rozvoji DN. U DM 2. typu se epidemiologická data o výskytu DN pohybovala dříve v rozmezí pouze 3-16 % [14]. Podhodnocení reálné prevalence DN mohlo souviset se skutečností, že diabetici 2. typu často umírají na jiná onemocnění dříve, než dojde k rozvoji manifestní DN. Dnes se předpokládá 35% prevalence DN u obou typů diabetu [1].
Patogeneze DN není dosud jasná. U geneticky predisponovaných jedinců se předpokládá vliv metabolických mediátorů (transformující růstový faktor β1, vazivový růstový faktor, růstový hormon, vaskulární endotelový růstový faktor) nebo hemodynamických vlivů (lokální nebo cirkulující angiotenzin II), případně jejich kombinace.
Morfologické změny při DN spočívají jak v glomerulárním, tak i v tubulointersticiálním postižení. Dochází ke zbytnění bazální membrány glomerulárních kapilár, zvětšování objemu a expanzi mezangia, ztluštění tubulární bazální membrány, tubulární atrofii a fibróze intersticia. Difuzní nebo nodulární glomeruloskleróza spolu s intersticiální fibrózou a arteriolosklerózou vedou k postupnému zániku glomerulů.
Vývojová stadia DN jsou zřetelněji vyjádřena u DM 1. typu:
- Glomerulární hypertrofie a hyperfiltrace je přítomná již v době diagnózy DM - zvětšená velikost ledvin, vyšší hodnota glomerulární filtrace a zvýšené vylučování albuminu do moči. Téměř u všech pacientů se po zahájení léčby inzulinem albuminurie vrací do normálních hodnot. Stejně klesá i glomerulární filtrace, i když u 1/3 nemocných může zůstat zvýšená.
- Latentní stadium v závislosti na metabolické kompenzaci trvá 2-5 let, je klinicky němé a charakterizované pouze mikroskopickými změnami.
- Incipientní DN se objevuje přibližně po 10 letech od diagnózy DM. Typickým nálezem je trvalá přítomnost MAU. Je vymezená hodnotami albuminu v moči sebrané za určité časové období nebo v jednorázovém ranním vzorku (tab. 2). Podle některých studií může být MAU přítomná již mezi 1.-5. rokem trvání s prevalencí 6-19 % [15,16]. Vylučování albuminu do moči narůstá s dobou trvání diabetu - prevalence MAU po 15-20 letech dosahuje přibližně 25 % a po 30 letech až 40-50 % [17]. U 30 % jedinců s incipientní DN může MAU přejít zpět do normoalbuminurie, naopak pouze 20 % progreduje v průběhu 5-9 let do proteinurie [18]. Zbylá polovina pacientů má stacionární MAU a nepřechází do vyššího stadia DN. Nízké hodnoty MAU (< 80 µg/min či 8 g/mol kreatininu) jsou reverzibilní a vyžadují maximální úsilí o kompenzaci diabetu a kontrolu arteriální hypertenze.
- Manifestní DN se rozvíjí po 15-20 letech trvání diabetu a projevuje se albuminurií > 300 mg/24 hod nebo proteinurií prokazatelnou běžnými testy (> 0,5 g/24 hod). Její množství obvykle narůstá a přesahuje do nefrotického rozmezí proteinurie (> 3,5 g/24 hod/1,73 m2). Erytrocyturie nepatří do typického obrazu manifestní DN. Hladina sérového kreatininu je ve fyziologickém rozmezí, ale bez léčby hodnota kreatininové clearance klesá přibližně o 1 ml/min/měsíc (0,2 ml/s/rok), což představuje od začátku proteinurie období 8-10 roků do rozvoje chronického nezvratného selhání ledvin [19,20]. V této době je hypertenze již přítomná u všech nemocných společně s dalšími pozdními komplikacemi DM - retinopatií a neuropatií. Často je diagnostikován syndrom diabetické nohy a aterosklerotické srdeční či mozkové komplikace.
- Renální insuficience vzniká po 20 letech trvání DM. Dochází k vzestupu hladiny sérového kreatininu nad referenční rozmezí, k poklesu hodnoty glomerulární filtrace o 50-70 %, rozvoji acidózy, anémie, hypokalcemie a hyperfosfatemie. Zhoršuje se kompenzace DM, dochází k nárůstu pozdních produktů glykace (AGE), které společně s hypertenzí a hyperlipoproteinemií urychlují rozvoj pozdních komplikací DM.
Tab. 2. Definice mikroalbuminurie. 
Průběh DN u diabetu 2. typu vykazuje některé odlišnosti. U velkého počtu nemocných (až 40 %) je již při zjištění DM přítomna trvalá MAU a často přetrvává i při dobré kompenzaci DM. Jedna třetina jedinců s MAU progreduje během 5 let do proteinurie. Dalšími důležitými rozdíly mezi oběma typy DM jsou vysoká prevalence hypertenze a důsledky MAU. Zatímco diabetika 1. typu ohrožuje MAU progresí diabetické nefropatie, diabetika 2. typu ještě navíc vznikem kardiovaskulárních komplikací. Diabetiky 1. typu s MAU a všechny diabetiky 2. typu považujeme automaticky za osoby s vysokým kardiovaskulárním rizikem (≥ 5 %) [12].
Léčba diabetické nefropatie
Léčba DN v 3.-4. stadiu se soustřeďuje na kompenzaci DM a kontrolu krevního tlaku. Kompenzace DM ve stadiu incipientní DN vede ke snížení MAU o 25-30 % a k poklesu rizika jak dalšího rozvoje DN, tak i aterosklerózy. Kontrola hypertenze (cílový tlak < 130/80 mm Hg) je důležitá pro zpomalení rozvoje všech pozdních komplikací diabetu [21]. Léčbu nesmí provázet klinická symptomatologie hypotenze. U diabetiků jsou lékem prvé volby inhibitory ACE nebo AT1 blokátory. MAU je indikací pro podání těchto léků bez ohledu na výši krevního tlaku [12].
Léčebná opatření u DN v 5. stadiu vyžadují těsnou spolupráci nefrologa a diabetologa. Kromě metabolické kompenzace a kontroly hypertenze jde o ovlivnění renálně specifických rizikových faktorů jak progrese nefropatie, tak i kardiovaskulárních nemocí (anémie, hyperlipoproteinemie, metabolické acidózy, poruchy kalcium-fosfátového metabolizmu). Je vhodné snížení bílkovin v dietě na 0,8 g/kg/den (ale při zachování vysoké biologické hodnoty) s případným podáním ketoanalog esenciálních aminokyselin, většinou je také potřebná suplementace vápníku a natrium bikarbonátu k ovlivnění metabolické acidózy. Při vzestupu kreatininu nad 300-400 µmol/l je nutná příprava na dialyzační léčbu (vakcinace proti virové hepatitidě B, zhotovení cévního přístupu pro hemodialýzu či zavedení peritoneálního katétru pro kontinuální ambulantní peritoneální dialýzu). U diabetika 1. typu s DN bez výraznějších komplikací se zvažuje indikace ke kombinované transplantaci pankreatu a ledviny nebo k izolované transplantaci ledviny.
Hypertenze a progrese diabetického onemocnění ledvin
Celosvětově je DN v současnosti hlavní příčinou chronického nezvratného selhání ledvin. Hlavním mechanizmem progrese DN do konečného stadia je hypertenze (systémová i glomerulární) a nedostatečná metabolická kontrola. Komplexní léčebný přístup je zaměřen jak na zpomalení progrese renálního postižení, tak i na snížení rizika kardiovaskulárních komplikací. Nejdůležitější renoprotektivní opatření (tab. 3) spočívají v kontrole hypertenze a glykemie [22].
Tab. 3. Zásady renoprotekce u diabetických pacientů [22]. ![Zásady renoprotekce u diabetických pacientů [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e6799840c35b93ee21ee893e6184cd16.png)
Význam optimální kontroly krevního tlaku na vývoj DN u diabetiků 2. typu prokázala studie UKPDS 38 [23]. Intenzivnější kontrola hypertenze (Ø krevní tlak 147/82 mm Hg) ve srovnání s „méně intenzivní“ kontrolou (Ø krevní tlak 154/87 mm Hg) snížila riziko MAU o 29 %, proteinurie o 39 %, mortality související s diabetem o 32 %, mozkové příhody o 44 % a progrese retinopatie o 37 %.
U diabetiků 2. typu byl zjištěn úzký vztah mezi cílovým středním arteriálním tlakem a rychlostí progrese DN [24]. Metaanalýza 11 randomizovaných studií prokázala, že antihypertenzní léčba zpomaluje progresi renální insuficience u DM 2. typu [25]. Glomerulární filtrace u DN klesá přibližně o 10 ml/min/rok. Snížením středního arteriálního tlaku o 10 mm Hg lze tento pokles zpomalit o 3,7 ± 0,92 ml/min/rok. Dalšího snížení poklesu funkce ledvin o 3,4 ± 1,7 ml/min/rok je možné dosáhnout nezávisle na kontrole systémového krevního tlaku specifickým renoprotektivním účinkem inhibitorů ACE nebo AT1 blokátorů.
U DN lze rozlišit 3 stupně preventivních a léčebných opatření:
- primární prevenci bránící přechodu normoalbuminurie do MAU
- sekundární prevenci zaměřenou proti rozvoji proteinurie
- terciární prevenci zpomalující u pacientů s manifestní DN progresi chronické renální insuficience do terminálního selhání ledvin [26]
Renoprotektivní účinky inhibitorů ACE u DN při diabetu 1. typu (tab. 4)
Tab. 4. Studie renoprotektivního účinku inhibitorů ACE na progresi DN při DM 1. typu. 
Primární prevence
Studie EUCLID [27] porovnávala účinek lisinoprilu s placebem u normotenzních normoalbuminurických diabetiků 1. typu. Po 2letém sledování byl zjištěn pouze nevýznamný pokles albuminurie (o 12,7 % výchozí hodnoty).
Sekundární prevence
V European Microalbuminuria Captopril Study léčba kaptoprilem u diabetiků 1. typu s MAU snížila riziko vývoje manifestní DN o 75 % [28]. U 15 % diabetiků 1. typu s MAU ve studii EUCLID [27] lisinopril snížil vstupní MAU o 49,7 %. Podle studie JAPAN-IDDM [29] u převážně normotezních jedinců s DM 1. typu a MAU nebo proteinurií snížil imidapril vylučování albuminu o 41 %, kaptopril o 6 %, naopak po placebu se albuminurie zvýšila o 72 %.
Terciární prevence
Collaborative Study Group [30] sledovala diabetiky 1. typu s manifestní proteinurií a mírnou renální insuficiencí. Captopril ve srovnání s placebem snížil riziko zdvojnásobení hodnoty výchozího sérového kreatininu o 48 % a vzniku terminálního selhání ledvin či úmrtí o 50 %.
Renoprotektivní účinky inhibitorů ACE u DN při diabetu 2. typu (tab. 5)
Tab. 5. Studie renoprotektivního účinku inhibitorů ACE na progresi DN při DM 2. typu. 
Primární prevence
Enalapril [31] snížil u normoalbuminurických diabetiků 2. typu riziko vzniku MAU o 12,5 %. Ve studii BENEDICT bylo u pacientů s DM 2. typu, hypertenzí a normoalbuminurií dosaženo nižšího výskytu MAU při léčbě jak kombinací trandolaprilu s nedihydropyridinovým kalciovým blokátorem verapamilem (5,7 %), tak samotným trandolaprilem (6 %) oproti skupině diabetiků léčených samotným kalciovým blokátorem (11,9 %) či placebem (10 %). Inhibitor ACE snížil riziko vývoje MAU o 40 % [32].
Sekundární prevence
Léčba enalaprilem u normotenzních diabetiků 2. typu s MAU vedla k poklesu rizika progrese do manifestní proteinurie a ke stabilizaci renální funkce [33]. U osob léčených placebem se postupně zvyšovala MAU a u části klesla renální funkce. Při následném 2letém sledování pacientů z této studie [34] bylo při dalším podávání placeba zjištěno pokračující zvyšování MAU a snižování renální funkce. Léčba enalaprilem za celkovou dobu 7 let snížila riziko vývoje manifestní DN o 42 %. U části pacientů převedených po 5leté léčbě placebem na enalapril, MAU i renální funkce zůstaly stabilní, naopak přeřazení z enalaprilu na placebo způsobilo vzestup MAU a pokles renální funkce. Studie HOPE prokázala u diabetických pacientů (převážně 2. typu), že léčba ramiprilem v porovnání s placebem snížila o 24 % riziko vzniku manifestní DN u pacientů s normoalbuminurií nebo MAU [35]. Studie DETAIL [36] u hypertenzních diabetiků 2. typu s MAU a normální nebo jen mírně sníženou renální funkcí při porovnání účinnosti enalaprilu s AT1 blokátorem telmisartanem nezjistila významný rozdíl v poklesu glomerulární filtrace. Progrese z MAU do manifestní proteinurie postihla pouze 17 % sledovaných.
Terciární prevence
U pacientů s DM 2. typu a manifestní DN neexistuje klinická studie s inhibitory ACE v rozsahu srovnatelném se studií u diabetiků 1. typu [30].
Renoprotektivní účinky AT1 blokátorů u DN při diabetu 2. typu (tab. 6)
Tab. 6. Studie renoprotektivního účinku AT1 blokátorů na progresi DN při DM 2. typu. 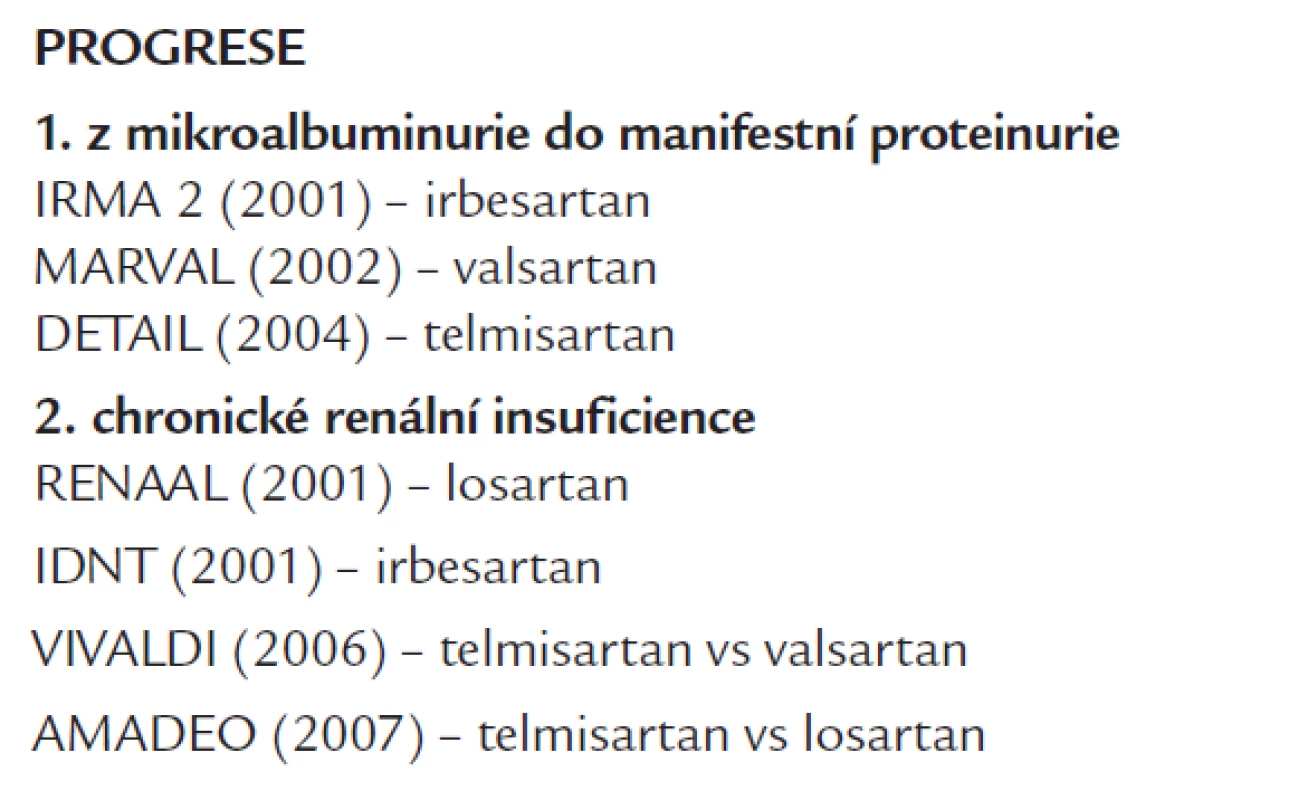
Primární prevence
Klinická studie porovnávající u normoalbuminurických diabetiků 1. nebo 2. typu vliv AT1 blokátoru a placeba v účinku na zpomalení vzniku MAU nebyla publikována.
Sekundární prevence
Ve studii IRMA 2 [37] u hypertenzních diabetiků 2. typu s MAU došlo ke vzniku manifestní DN u 5,2 % léčených 300 mg irbesartanu, u 9,7 % nemocných s 150 mg irbesartanu a u 14,9 % na placebu. MAU se snížila jen u léčených irbesartanem. Ve studii MARVAL [38] u hypertenzních diabetiků 2. typu s MAU valsartan snížil MAU na 56 %, zatímco dihydropyridinový kalciový blokátor amlodipin pouze na 92 % výchozí hodnoty. Návrat z MAU do normoalbuminurie byl významnější u valsartanu než u amlodipinu (29,5 % vs 14,5 %). Studie DETAIL [36] nezjistila u hypertenzních nemocných s DN významný rozdíl ve velikosti poklesu glomerulární filtrace mezi léčenými telmisartanem a enalaprilem (viz Renoprotektivní účinky inhibitorů ACE u DN na podkladě diabetu 2. typu).
Terciární prevence
Ve studii RENAAL [39] u hypertenzních diabetiků 2. typu s proteinurií a mírnou renální insuficiencí losartan snížil riziko zdvojnásobení sérového kreatininu o 25 %, vývoje terminálního selhání ledvin o 28 % a riziko vzniku sdruženého ukazatele o 16 %, a to nezávisle na antihypertenzním účinku. Léčba losartanem vedla k poklesu proteinurie o 35 %, rychlost progrese DN se zpomalila o 18 %.
Studie IDNT [40] randomizovala hypertenzní diabetiky 2. typu s proteinurií a renální insuficiencí k léčbě irbesartanem nebo amlodipinem či placebem. Léčba irbesartanem snížila riziko zdvojnásobení sérového kreatininu, terminálního selhání ledvin nebo úmrtí oproti placebu o 20 % a amlodipinem o 23 %. Po irbesartanu proteinurie poklesla o 33 %, po placebu jen o 10 %.
Ve studii VIVALDI [41] u hypertenzních diabetiků 2. typu s proteinurií a mírnou renální insuficiencí léčba jak telmisartanem, tak valsartanem vedla ke shodnému poklesu proteinurie (o 33 %). Rovněž nebyl zjištěn významný rozdíl ve výskytu kombinovaného ukazatele (zdvojnásobení hladiny sérového kreatininu + vznik terminálního selhání ledvin + celková mortalita). V obdobné studii AMADEO [42] u hypertenzních diabetiků 2. typu s proteinurií a mírnou renální insuficiencí po telmisartanu došlo k významnějšímu poklesu proteinurie (o 29 %) ve srovnání s losartanem (20 %).
Renoprotektivní účinky kombinace inhibitorů ACE s AT1 blokátory u DN
Ve studii CALM [43] u hypertenzních diabetiků 2. typu s MAU snížil lisinopril poměr močové koncentrace albumin/kreatinin o 39 %, kandesartan o 24 % a kombinace obou AT1 blokátorů o 50 %. Posouzení specifického renoprotektivního účinku omezuje skutečnost, že po kandesartanu i lisinoprilu, ale především po jejich kombinaci došlo k významnému snížení systolického (o 25,3 %) i diastolického (o 16,3 %) krevního tlaku.
Závěr
V současné době celosvětově přibližně každý 10. obyvatel trpí chronickým onemocněním ledvin [44,45]. Mezi nejčastější příčiny chronických nefropatií patří DM, hypertenzní a aterosklerotické nemoci ledvin. V rámci světové pandemie diabetu se očekává, že ze 171 milionů nemocných s DM na počátku 3. tisíciletí dojde v roce 2030 k nárůstu na 366 milionů [46]. Obdobnou neradostnou vizí je zvýšení počtu dospělých hypertoniků v roce 2025 přibližně o 60 % na celkový počet 1,56 billionu [47]. Včasné rozpoznání a účinná léčba jak DM, tak i hypertenze je v praxi nejúčinnější cestou ke zvládnutí náporu chronických ledvinných onemocnění [11,48].
prof. MUDr. Václav Monhart, CSc.
www.uvn.cz
e-mail: monhart@uvn.cz
Doručeno do redakce: 31. 3. 2008
Zdroje
1. Svačina Š. Hypertenze při obezitě a diabetu. Praha: Triton 2007.
2. Cífková R. Léčba hypertenze u pacientů s diabetes mellitus ve světle posledních evropských doporučení. Remedia 2004; 14 : 133-141.
3. Škrha J. Arteriální hypertenze u diabetiků v ČR: výsledky studie. In: Widimský J et al. Arteriální hypertenze - současné klinické trendy. V. sympozium - sborník přednášek. Praha: Triton 2007 : 43-48.
4. Parving HH. Impact of blood pressure and antihypertensive treatment on incipient and overt nephropathy, retinopathy, and endothelial permeability in diabetes mellitus. Diabetes Care 1991; 14 : 260-269.
5. Tesař V. Hypertenze u diabetické nefropatie. In: Rychlík I, Tesař V et al. Onemocnění ledvin u diabetes mellitus. Horizonty diabetologie. Díl 2. Praha: Tigis 2005 : 150-161.
6. Rychlík I, Tesař V et al. Onemocnění ledvin u diabetes mellitus. Horizonty diabetologie. Díl 2. Praha: Tigis 2005.
7. De Mast Q, Beutler JJ. Prevalence of atherosclerotic renal artery stenosis: a meta-analysis of 33 studies and 13,591 patients. J Hypertens 2005; 23(Suppl 2): S333.
8. Monhart V. Ischemická nefropatie u diabetiků. In: Rychlík I, Tesař V et al. Onemocnění ledvin u diabetes mellitus. Horizonty diabetologie. Díl 2. Praha: Tigis 2005 : 242-254.
9. Dusilová Sulková S, Rychlík I. Přístup nefrologa k diabetikovi s poškozením ledvin. In: Dusilová Sulková S, Šmahelová A. Multidisciplinární přístup k diabetikovi s onemocněním ledvin. Praha: Tigis 2007 : 43-52.
10. 2007 Guidelines for the Management of Arterial Hypertension. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007; 25 : 1105-1187.
11. KDOQI clinical practice guidelines and clinical practice recommendations for diabetes and chronic kidney disease. Am J Kidney Dis 2007; 49(Suppl 2): S1-S179.
12. Widimský J jr, Cífková R, Špinar J et al (za Českou společnost pro hypertenzi). Doporučení diagnostických a léčebných postupů u arteriální hypertenze - verze 2007. Doporučení České společnosti pro hypertenzi. Cor et Vasa 2008; 50: K005-K020.
13. Marshall SM. Clinical features and management of diabetic nephropathy. In: Textbook of Diabetes. 3rd ed. Oxford: Blackwell Science 2006 : 53.1-53.22.
14. Rušavý Z. Diabetická nefropatie. Akt Nefrol 2002; 8 : 77-81.
15. Bakker A. Detection of microalbuminuria. Receiver operating characteristic curve analysis favors albumin-to-creatinine ratio over albumin concentration. Diabetes Care 1999; 22 : 307-313.
16. Allen T, Cao Z, Youssef S et al. Role of angiotensin II and bradykinin in experimental diabetic nephropathy. Functional and structural studies. Diabetes 1997; 46 : 1612-1618.
17. Bakris GL, Weir MR, De Quatro V et al. Effects of an ACE inhibitors/calcium antagonist combination on proteinuria in diabetic nephropathy. Kidney Int 1998; 54 : 1283-1289.
18. Perušičová J, Rosolová H, Kvapil M. Mikroalbuminurie. In: Trendy soudobé nefrologie. Praha: Galén 1999 : 121-135.
19. Chatuverdi N, Bandinelli S, Mangili R et al. Microalbuminuria in type 1 diabetes: rates, risk factors and glycemic threshold. Kidney Int 2001; 60 : 219-227.
20. Mogensen CE. How to protect the kidney in diabetic patients: with special reference to IDDM. Diabetes 1997; 46(Suppl 2): S104-S111.
21. UKPDS Group. Intensive blood-glucose control with sulfonylureas or insulin compared with conventional treatment and risk of complications on patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352 : 837-853.
22. Miyata T, van Ypersele de Strihou Ch. Renoprotection of angiotensin receptor blockers: beyond blood pressure lowering. Nephrol Dial Transplant 2006; 21 : 846-849.
23. UK Prospective Diabetes Study Group: Tight blood pressure control and risk of macrovascular complications in type 2 diabetes: UKPDS 38. Br Med J 1998; 317 : 703-713.
24. Villarosa IP, Bakris GL. Antihypertensive therapy in type 2 diabetes with neprohropathy. In: Ritz E, Rychlík I (eds). Nepropathy in type 2 diabetes. Oxford: Oxford University Press 1999 : 111-136.
25. Kasiske BL, Kalil RS, Ma JZ et al. Effect of antihypertensive therapy on the kidney in patients with diabetes: a meta-regression analysis. Ann Intern Med 1993; 118 : 129-138.
26. Monhart V. Hypertenze a ledviny. 2nd ed. Praha: Triton 2007.
27. The EUCLID study group. Randomised placebo-controlled trial of lisinopril in normotensive patients with insulin-dependent diabetes and normoalbuminuria or microalbuminuria. Lancet 1997; 349 : 1787-1792.
28. Viberti G, Mogensen CE, Groop LC et al. Effect of captopril on progression to clinical proteinuria in patients with insulin-dependent diabetes mellitus and microalbuminuria. European Microalbuminuria Captopril Study Group. JAMA 1994; 271 : 275-279.
29. Katayama S, Kikkawa R, Isogai S et al. Effect of captopril or imidapril on the progression of diabetic nepropathy in Japanese with type 1 diabetes mellitus: a randomized controlled study (JAPAN-IDDM). Diab Res Clin Pract 2002; 55 : 113-121.
30. Lewis EJ, Hunsicker LG, Bain RP et al. The effect of angiotensin converting enzyme inhibition on diabetic nephropathy. N Engl J Med 1993; 329 : 1456-1462.
31. Ravid M, Brosh D, Levi Z et al. Use of enalapril to attenuate decline in renal function in normotensive, normoalbuminuric patients with type 2 diabetes mellitus. A randomized, controlled trial. Ann Intern Med 1998; 128 : 982-988.
32. Ruggenenti P, Fassi A, Parvano Ilieva A et al (for the Bergamo Nephrologic Diabetes Complications Trial (BENEDICT)). Preventing microalbuminuria in type 2 diabetes. N Engl J Med 2004; 351 : 1941-1951.
33. Ravid M, Savin H, Jutrin I et al. Long-term stabilizing effect of angiotensin-converting enzyme inhibition on plasma creatinine and on proteinuria in normotensive type II diabetic patients. Ann Intern Med 1993; 118 : 577-581.
34. Ravid M, Neumann L, Lishner M. Plasma lipids and the progression of nephropathy in diabetes mellitus type II: effect of ACE inhibitors. Kidney Int 1995; 47 : 907-910.
35. Heart Outcomes Prevention Evaluation (HOPE) Study Investigators: Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: Results of the HOPE study and MICRO-HOPE substudy. Lancet 2000; 355 : 253-259.
36. Barnett AH, Bain SC, Bouter P et al. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med 2004; 351 : 1952-1961.
37. Parving HH, Lehnert H, Brochner-Mortensen J et al. The effect of irbesartan of the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 345 : 870-878.
38. Viberti G, Wheeldon NM (for the MicroAlbuminuria Reduction With VALsartan (MARVAL) Study Investigators). Microalbuminuria reduction with valsartran in patients with type 2 diabetes mellitus. A blood pressure-independent effect. Circulation 2002; 106 : 672-678.
39. Brenner BM, Coper ME, deZeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345 : 861-869.
40. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin receptor antagonist irbesartan in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345 : 851-860.
41. Galle J, Quispe Bravo S, Wanner C. Antiproteinuric effects of telmisartan versus valsartan in patients with type 2 diabetes and overt nephropathy. Diabet Med 2006; 23(Suppl 4): 92-93.
42. Burgess E, Bakris G, Weir M et al. Comparative long term effects of two AT1 receptor blockers on proteinuria in patients with type-2 diabetes and overt nephropathy and hypertension: results of the AMADEO trial. J Hypertens 2007; 25(Suppl 2): S276-S277.
43. Mogensen CE, Neldan S, Tikkanen I et al. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study. Brit Med J 2000; 321 : 1440-1444.
44. Coresh J, Astor BC, Greene T et al. Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. Am J Kidney Dis 2003; 41 : 1-12.
45. De Zeeuw D, Hillege HL, de Jong PE. The kidney, a cardiovascular risk marker and a new target for therapy. Kidney Int 2005; 68(Suppl 98): 25-29.
46. Wild S, Roglic G, Green A et al. Global prevalence of diabetes: Estimations for the year 2000 and projection for 2030. Diabetes Care 2004; 27 : 1047-1053.
47. Kearney PM, Whelton M, Reynolds K et al. Global burden of hypertension: analysis of worldwide data. Lancet 2005; 365 : 217-223.
48. National Kidney Foundation. K/DOQI Clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease: executive summary. Am J Kidney Dis 2004; 43: S14-S33.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Úvodní slovoČlánek Vyšetření ledvin u diabetikaČlánek Metformin a ledvinyČlánek Zborník abstraktov
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2008 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Program 10. celostátního diabetologického sympozia
- Úvodní slovo
- Program 9. celostátního diabetologického sympozia
- Hemokoagulace a renální insuficience, hemokoagulace a diabetes mellitus 2. typu
- Urologické výkony u diabetika
- Nádory ledvin, močového měchýře a prostaty u obezity a diabetu
- Bariatrická chirurgie a ledviny
- Využití orgánově specifických substrátů u onemocnění ledvin diabetika
- Výživa diabetika s onemocněním ledvin
- Imunita na sliznicích se zřetelem na sliznici urogenitálního traktu a diabetes
- Viscerální diabetická neuropatie urogenitálního traktu
- Erektilní dysfunkce, její vztah k diabetu a její řešení v roce 2007
- Epidemiologie diabetické nefropatie
- Vyšetření ledvin u diabetika
- Diabetes mellitus, hypertenze a ledviny
- Systém renin-aldosteron v tuku a v dalších orgánech a tkáních
- Diabetes, dyslipidemie a onemocnění ledvin
- Specifické problémy u dialyzovaných diabetiků v ambulantní praxi
- Specifické aspekty peritoneální dialýzy u diabetiků
- Edukace diabetiků v renálním selhání a po transplantaci
- Metformin a ledviny
- Zborník abstraktov
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Metformin a ledviny
- Hemokoagulace a renální insuficience, hemokoagulace a diabetes mellitus 2. typu
- Zborník abstraktov
- Specifické problémy u dialyzovaných diabetiků v ambulantní praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



