-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
Wall sheer stress in carotid artery and its role in the development of atherosclerosis
Atherosclerosis is associated with systemic risk factors such as arterial hypertension, hyperlipidemia, diabetes mellitus and smoking. Yet it is a focal disease, predominantly affecting predisposed areas. The principal local hemodynamic factor is wall shear stress, i.e. the frictional force acting tangentially on the endothelial cell surface. The effect of wall shear stress on the endothelium depends on its magnitude and direction, as well as on the local vessel geometry and blood flow characteristics. Wall shear stress is an important determinant of endothelial function and phenotype. The article deals with the influence of wall shear stress on endothelial cell function, atherosclerotic plaque formation, and vascular remodelling in the common carotid artery.
Key words:
wall shear stress – endothelium – atherosclerosis – common carotid artery
Autoři: E. Chytilová; J. Malík
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2007; 53(4): 377-381
Kategorie: Přehledné referáty
Souhrn
Ateroskleróza je ovlivněna systémovými rizikovými faktory: arteriální hypertenze, dyslipidemie, diabetes mellitus a kouření. Vyskytuje se však v predilekčních lokalizacích, což ukazuje na působení lokálních hemodynamických vlivů. Hlavním lokálním hemodynamickým faktorem je smykové napětí, působící tangenciálně na povrch endotelu. Důsledky působení smykového napětí na endotel jsou dány jeho směrem velikostí, ale i místní geometrií cévy a charakterem toku. Smykové napětí ovlivňuje expresi v endotelových buňkách a jejich fenotyp. Referát pojednává o vlivu smykového napětí na funkci endotelu, formování aterosklerotického plátu, cévní remodelaci ve společné karotidě.
Klíčová slova:
smykové napětí – endotel – ateroskleróza – arteria carotis communisÚvod
Ateroskleróza patří k nejvýznamnějším zdravotním problémům vyspělých zemí. Mezi rizikové faktory rozvoje aterosklerózy patří především arteriální hypertenze, dyslipidemie, diabetes mellitus. Ateroskleróza je nejčastější příčinou okluzí a stenóz karotických tepen. Aterosklerotické pláty v oblasti a. carotis commmunis a a. carotis interna jsou etiopatogenetickým faktorem 30 % ischemických cévních mozkových příhod. Pláty mohou být zdrojem intrakraniálních embolizací nebo působí hemodynamické změny při stenózách nad 70 %. Přestože je na aterosklerózu nahlíženo jako na systémové onemocnění se známými rizikovými faktory, aterosklerotické léze se vyskytují v predilekčních lokalizacích. V karotickém řečišti aterosklerotické změny postihují především zevní stěny bifurkací. Jedná se o místa, kde dochází k pomalému a v systole dokonce k reverznímu toku krve, a tím k nízkému smykovému napětí (wall shear stress - WSS) s měnlivým vektorem [1].
Smykové napětí je lokálním autoregulačním mechanizmem průsvitu cévy, při dlouhodobě nízkých hodnotách však působí proaterogenně.
Smykové napětí - fyzikální veličina, měření
Cévní stěna je nepřetržitě vystavena působení hemodynamických sil, na které reaguje. Smykové napětí je způsobené dopředným pohybem sloupce krve v cévě. Vektor WSS je tangenciální k cévní stěně, a proto působí pouze na endotelové buňky [2]. Hodnotu WSS můžeme vypočítat dle Poiseuilleova vztahu:
WSS = 4 µ Q/π r3 [1]
WSS je přímo úměrný viskozitě krve µ, průtoku Q a nepřímo úměrný třetí mocnině poloměru cévy r.
Za standardních podmínek je proudění krve nejrychlejší ve středu lumina tepny, nejpomalejší u stěny - je tedy parabolický profil rychlosti proudnic. Wall shear stress můžeme odhadnout z matematických modelů dle rovnic popisujících rozložení rychlosti jednotlivých proudnic v tepně [3]. In vitro je vyšetřováno především působení shear stressu na endotelové buňky za různých podmínek, např. při stálém laminárním proudění [4], pulzatilním laminárním proudění [5], oscilujícím turbulentním proudění [6]. In vivo odhad WSS vyžaduje méně aproximací než matematické a in vitro modely. In vivo odhad WSS předpokládá zjištění smykové rychlosti (shear rate) a viskozity krve, kterou ve velkých cévách považujeme pro danou situaci za ideální newtonovskou tekutinu. Smyková rychlost (s-1) charakterizuje rozdíl rychlostí vrstev tekutiny vztažený na vzdálenost mezi vrstvami. Budeme-li za pomalejší vrstvu považovat endotel, můžeme hovořit o smykové rychlosti u cévní stěny (wall shear rate, WSR). Při odhadu WSR pomocí duplexní dopplerovské ultrasonografie můžeme použít rovnici:
WSR = 4 v/d [2]
Smyková rychlost je přímo úměrná rychlosti toku krve v a nepřímo úměrná vnitřnímu průměru cévy. Předpokladem aplikace rovnice je parabolický model rozložení rychlostí napříč lumen, s rovnými neelastickými stěnami, a lineární proudění krve. Závislost mezi WSS a WSR popisuje Newtonův zákon elasticity:
WSS = µ × WSR [3]
Stanovení viskozity krve je technicky náročné. Hodnota viskozity je závislá na teplotě, na rychlosti toku krve a na hematokritu. Je prokázáno, že při nižších hodnotách hematokritu se viskozita mění pouze málo. Naopak pokud hematokrit stoupá, změny ve viskozitě jsou větší [7,8]. V tepnách s vysokou hodnotou smykové rychlosti (300 s-1), např. v aortě je viskozita krve 3,5 mPa (pro hematokrit 45 %). V žilách, kde hodnoty WSR dosahují 5 s-1, je viskozita krve významně vyšší (10 mPa). Někteří autoři [9] používají arbitrární hodnotu viskozity 3,5 mPa pro arterie, která nezohledňuje ani změny viskozity dané složením krve konkrétního jedince ani rychlost toku.
V lidském organizmu se rychlost toku mění v průběhu srdečního cyklu od nejvyšších hodnot (systolických) k hodnotám nejnižším (enddiastolickým), jedná se o tzv. pulzatilní tok. Analogicky se mění smykové napětí: střední (mWSS) a vrcholové (pWSS). Fyziologicky je mWSS na rovných úsecích tepen konstantní. Při změně geometrie cévy se mění charakter toku krve. V zevní části bifurkací je smykové napětí dlouhodobě nízké a s měnlivým vektorem, což vede lokálně k těžké endoteliální dysfunkci a následně k rozvoji aterosklerotického plátu. Pokud hovoříme o WSS v oblasti karotid, je třeba zvlášť zvažovat jeho hodnoty ve společné karotidě a zvláště v bifurkaci (obr. 1).
Obr. 1. Měření intimomediální šíře a průměru a. carotis communis v podélném řezu způsobu B ultrazvukového off-line pomocí softwaru Image-Pro Plus 4.0. 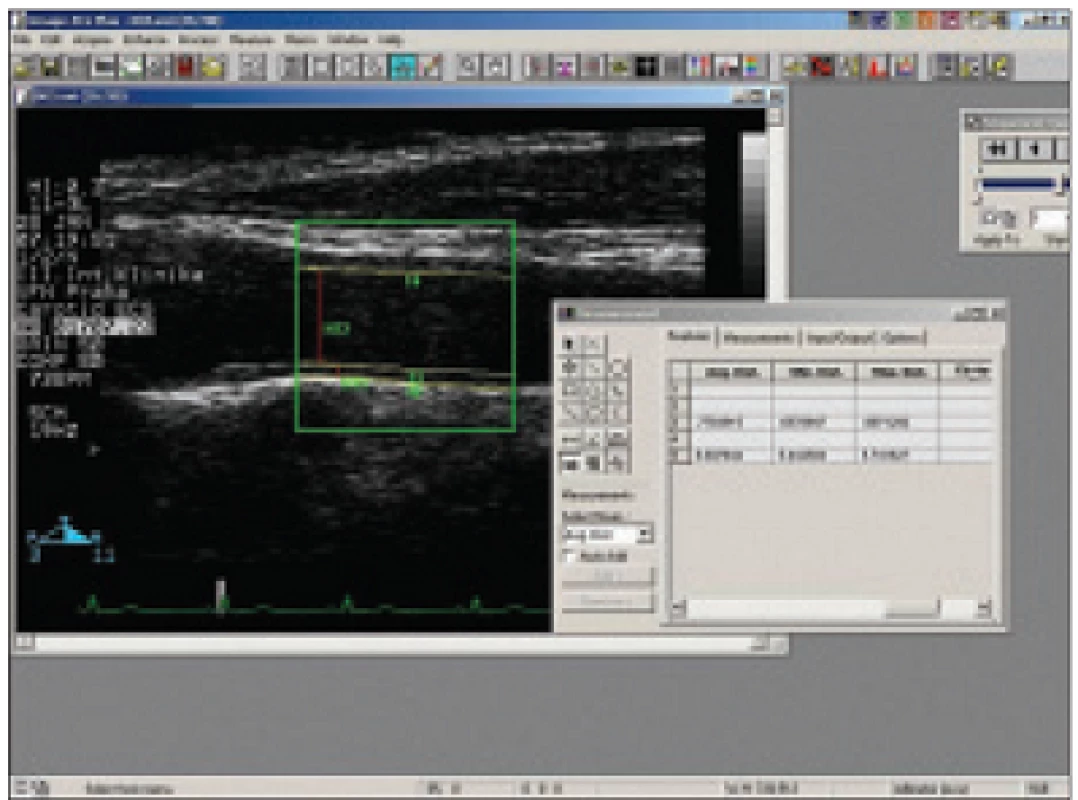
Stejné rovnice [2] a [3] lze samozřejmě použít při výpočtu WSS z hodnot získaných zobrazováním magnetickou rezonancí (magnetic resonance imaging - MRI). MRI je výhodné k vyšetření téměř jakékoliv cévy v lidském těle, vyjma cév v blízkosti kosti nebo dutiny vyplněné vzduchem [10].
Funkce endotelu a smykové napětí
Vnitřní výstelka cév - endotel - je složitý a dynamický orgán, který hraje klíčovou roli ve fyziologických i patologických funkcích organizmu. Wall shear stress ovlivňuje strukturu cytoskeletu endotelu, morfologii a genovou expresi. Wall shear stress dále působí na vazomotoriku cévy a uplatňuje se v zánětlivých reakcích a hemokoagulaci. Jak bylo zmíněno výše, WSS je přímo úměrný rychlosti toku krve a nepřímo úměrný poloměru cévy. Změna WSS vede k zapojení regulačních mechanizmů sloužících k jeho navrácení k původní hodnotě. Za fyziologických podmínek je mWSS v arteriálním řečišti udržován na hodnotě okolo 1,5 Pa [16].
Detekce WSS endotelovými buňkami se uskutečňuje přenosem hemodynamických sil pomocí složek cytoskeletu (transmisí) a je následována přeměnou fyzikální síly na biochemický signál (transdukce). Endoteliální buňky mají mechanoreceptory v podobě kaveol detekující WSS. Kaveoly jsou výchlipky luminální plazmatické membrány, která má vysoký obsah cholesterolu a proteinu kaveolinu. S kaveolinem jsou v oblasti kaveol asociovány regulační proteiny a především endoteliální NO-syntáza (enzym produkující oxid dusnatý), jejíž aktivita je touto vazbou regulována. Důležitou roli hrají zřejmě přímé konformační změny draslíkových membránových kanálů, které po své aktivaci vedou k hyperpolarizaci buňky. Mechanické síly jsou vnímány i intracelulárně prostřednictvím G-proteinů asociovaných s cytoskeletem. Jejich aktivace vede ke spuštění kaskády fosforylací. Tím je přenášena informace do buněčného jádra, kde je aktivována transkripce genů SSRE (shear stress responsive elements) [17].
Krátkodobé zvýšení WSS vyvolá v endoteliální buňce vzestup produkce NO (oxidu dusnatého) a uvolnění prostacyklinu [9]. Tím dojde ke zvětšení lumina cévy a vazodilatace posléze způsobí pokles WSS. Takto funguje základní zpětnovazebný okruh endoteliální vazomotorické regulace.
Na nízké a oscilující WSS endoteliální buňky reagují ztrátou svého longitudinálního uspořádání, mění tvar na polygonální [17]. Tyto změny jsou umožněny přítomností kontraktilního cytoskeletonu. Zvyšuje se exprese genu pro endotelin 1 (ET-1), dlouhodobé vystavení endoteliálních buněk nízkým hodnotám WSS vede ke snížení jeho aktivity. Pokud je endotel vystaven fyziologickému WSS, exprimuje svůj protektivní, antiaterogenní potenciál. Dochází k expresi genů pro vazodilatačně působící látky, inhibitory růstu, fibrinolytika, antiagregační faktory, antioxidanty. Nízký a oscilující WSS zvyšuje expresi adhezivních molekul, zánětlivých mediátorů, vazokonstrikčních látek a snižuje expresi antioxidantů [16].
Smykové napětí a remodelace cévní stěny
Remodelaci cévní stěny můžeme pokládat za reakci na dlouhodobé změny v průtoku krve cévou a/nebo krevního tlaku, které vedou k udržování konstantního obvodového napětí a smykového napětí. Obvodové napětí (circumferential wall stress - CWS, σc) působí kolmo na cévní stěnu, tedy na všechny její vrstvy. Uplatňuje se především u hypertrofie tunica media při arteriální hypertenzi. Obvodové napětí se zvětšuje s poloměrem cévy a zmenšuje s její tloušťkou (Laplaceův zákon). Arteriální remodelaci můžeme popisovat jako ztluštění intimomediální šíře (intima-media thickness - IMT), změny ve vnitřním průměru a interadventiciálním průměru tepny. Charakteristika geometrie remodelace cévní stěny závisí především na hemodynamických podnětech, rizikových faktorech aterosklerózy a na intaktním endotelu.
Měření IMT a. carotis communis pomocí ultrasonografie je jednou z nejběžnějších metod ke zjištění strukturálních změn této tepny. Intimomediální šíře je definována jako součet šířek tunica intima a tunica media cévní stěny. Je závislá na věku, pohlaví, body mass indexu, arteriální hypertenzi, hypercholesterolemii a diabetes mellitus [12]. Je také nepřímo závislá na WSS [12]. Měření IMT hodnotí současně změny postihující intimu a medii. Současné ultrasonografické techniky neumožňují rozlišení těchto typů změn. Intimomediální šíři měříme obvykle v úseku 1 cm před karotickou bifurkací, na zevních stěnách bifurkací a v a. carotis interna v ultrazvukovém zobrazení B způsobem [18]. Četné práce [19,20] prokázaly prediktivní hodnotu vyšší IMT pro stanovení budoucího rizika infarktu myokardu a cévní mozkové příhody. Hodnota IMT také koreluje s angiograficky prokázaným aterosklerotickým postižením koronárních tepen [21]. Silnější prediktivní hodnotu než IMT má přítomnost aterosklerotického plátu [22]. Při nižších hodnotách IMT může odrážet adaptivní odezvu na změnu WSS, průměr cévy, circumferential wall stress (CWS) nebo hodnotu krevního tlaku [23]. Například u nemocných po náhradě aortální chlopně pro těsnou aortální stenózu dochází po operaci k normalizaci průtoku společnou karotidou, zvýšení rychlosti toku krve, a tím k regresi IMT [24]. Změny příčného průměru cévy v průběhu rozvoje aterosklerotických změn závisí na převažujících rizikových faktorech. Při onemocnění diabetes mellitus se zhoršující se glukózovou tolerancí se rozšiřuje IMT při zachování vnitřního průměru tepny, jedná se o tzv. kompenzatorní remodelaci cévní stěny [25]. Rozšíření vnitřního průměru tepny i IMT je přítomno u DM v souvislosti s arteriální hypertenzí [25]. Při počátečním rozvoji aterosklerotických plátů se zvětšuje celý průměr tepny, nedochází tak ke zmenšení lumen tepny. Kompenzatorní rozšíření celého průměru tepny nalézáme především v místech protilehlých k excentrickému plátu. U pokročilých lézí je remodelace méně významná a je přítomna redukce vnitřního průměru tepny. Při této negativní remodelaci dochází k urychlení vzniku významné stenózy. Názorněji viz obr. 2.
Obr. 2. Pozitivní remodelace cévní stěny při zachování vnitřního lumen cévy a negativní remodelace při zmenšení průsvitu cévy. 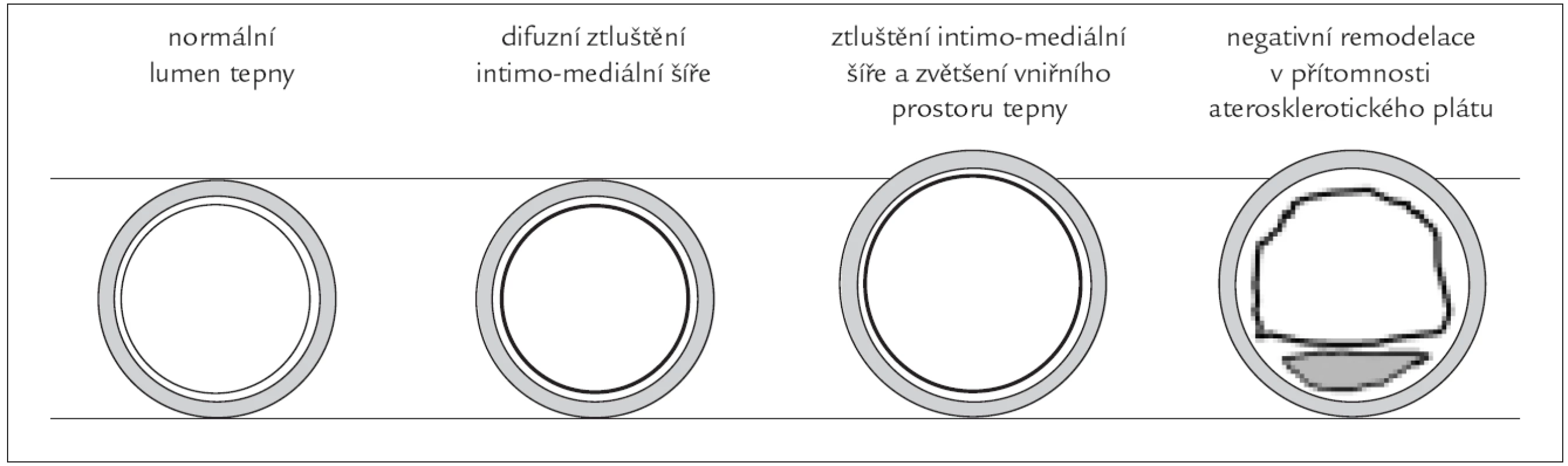
Wall shear stress a ateroskleróza, nestabilní plát
Nízké hodnoty WSS způsobují v přítomnosti dalších rizikových faktorů (diabetes mellitus, arteriální hypertenze, hyperlipidemie, kouření atd) rozvoj aterosklerózy [26]. V případě hemodynamicky významného asymetrického karotického aterosklerotického postižení je na straně léze častěji zjištěna nižší hodnota WSS [27]. Nižší hodnotu WSS nalézáme také v a. carotis communis zodpovědné za ischemickou cévní mozkovou příhodu než kontralaterálně [28].
Těsnou karotickou stenózu nalézáme pouze u 14-21 % pacientů s cévní mozkovou příhodou (CMP) [29]. Většinu CMP tvoří pacienti s hemodynamicky středně významným nebo jen malým plátem [29]. Aterosklerotické pláty můžeme z hlediska rizikovosti rozdělit na stabilní a nestabilní. Stabilní plát má nízký obsah tuků a silný fibrózní kryt. Nestabilní plát má velké lipidové jádro, často s tenkým fibrózním krytem s tendencí k ruptuře, s vytvořením následné trombózy a obturace cévy. Nestabilní pláty můžeme rozpoznat ultrasonograficky: mají vyšší obsah lipidů, a proto jsou hypoechogenní [30,31], změřit lze i tloušťku fibrózní krytu [32].
Shrnutí
Udržování konstantního smykového napětí je jedna ze základních fyziologických regulací průsvitu tepny. Dlouhodobě nízké hodnoty a oscilující vektor WSS jsou lokálním rizikovým faktorem pro rozvoj aterosklerózy. Smykovou rychlost je možné změřit neinvazivně in vivo, např. duplexní dopplerovskou sonografií nebo pomocí magnetické resonance.
MUDr. Eva Chytilová
www.vfn.cz
e-mail: eva.chytilova@vfn.cz
Doručeno do redakce: 23. 3. 2007
Zdroje
1. Zarins CK, Giddens DP, Bharadvaj BK et al. Carotid bifurcation atherosclerosis Quantitative correlation of plaque localization with flow velocity profiles and wall shear stress. Circ Res 1953; 53 : 502-514.
2. Levy BI, Tedgui A. Biology of the arterial wall. Dordrecht/Boston/London: Kluwer academic publishers.
3. Perktold K, Thurner E, Kenner T. Flow and stress characteristics in rigid walled and compliant carotid artery bifurcation models. Med Biol Eng Comput 1994; 32 : 19-26.
4. Dewey CF, Bussolari SR, Gimbrone MA The dynamic response of vascular endothelial cells to fluid shear stress. J Biomech Eng 1981; 103 : 177-185.
5. Ballerman BJ, Dardik A, Eng E et al. Shear stress and the endothelium. Kidney Int(Suppl) 1998; 67: S100-S108.
6. Paszkowiak JJ, Dardik A. Arterial wall shear stress: Observations from bench to bedside. Vasc Endovasc Surg 2003; 37 : 47-57.
7. Lipowski HH, Kovalcheck S, Zweifach BW. The distribution of blood rheological parameters in the microcirculation of cat mesentery. Circ Res 1978; 43 : 738-749.
8. Lipowski HH, Usami S, Chien S In vivo measurement of hematocrit and apparent viscosity in the microvasculature of cat mesentery. Microvasc Res 1980; 19 : 297-319.
9. Papaioannou TG, Karatzis NE, Vavuranakis M et al. Assesment of vascular wall shear stress and implications for atherosclerotic disease. Int J Cardiol 2006; 113 : 12-18.
10. Oshinski JN, Ku DN, Mukundan S jr et al. Determination of wall shear stress in the aorta with the use of MR phase velocity mapping. J Magn Reson Imaging 1995; 5 : 640-647.
11. Hoeks AP, Samijo SK, Brands PJ et al. Assesment of wall shear rate in humans: an ultrasound study. J Vasc Invest 1995; 1 : 108-117.
12. Gnasso A, Carallo C, Irace C et al. Association between intima-media thickness and wall shear stress in common carotid arteries in healthy male subjects. Circulation 1996; 94 : 3257-3262.
13. Samijo SK, Wiligers JM, Brands PJ et al. Reproducibility of shear rate and shear stress assesment by means of ultrasound in the common carotid artery of young human males and females. Ultrasound Med Biol 1997; 23 : 583-590.
14. Kornet L, Lambregts JAC, Hoeks AP et al. Differences in near-wall shear rate in the carotid artery within subjects are asssociated with different intima-media thickenesses. Arterioscl Thromb Vasc Biol 1998; 18 : 1877-1884.
15. Dammers R, Stifft F, Tordoir JH et al. Shear stress depends on vascular territory: comparison between common carotid artery and brachial artery. J Appl Physiol 2003; 95 : 485-489.
16. Malek A, Alper SL, Izumo S. Hemodynamic shear stress and its role in atherosclerosis. JAMA 1999; 282 : 2035-2042.
17. Born GV, Schvartz CJ. Vascular endothelium. Physiology, Pathology and Therapeutic Opportunities. Stuttgart - New York: Schauttauer 1997.
18. Touboul PJ, Hennerici MG, Meairs S et al. Mannheim carotid intima-media thickness concensus (2004-2006). Cerebrovasc Dis 2007; 23 : 75-80.
19. Bots ML, Hoes AW, Koudstaal PJ et al Common carotid intima-media thickness and risk of stroke and myocardial infarction: The Rotterdam Study. Circulation 1997; 96 : 1432-1437.
20. Chambless LE, Heiss G, Folsom AR et al. Association of coronary heart disease incidence with carotid arterial wall thickness and major risk factors. The Atherosclerosis Risk in communities (ARIC) study. Am J Epidemiol 1997; 146 : 483-494.
21. Holaj R, Spacil J, Petrasek J et al. Intima-media thickness OF the common carotid artery is the significant predictor of angiographically proven coronary artery disease. Can J Cardiol 2003; 19 : 670-676.
22. Ebrahim S, Papacosta O, Whincup P et al. Carotid Plaque, Intima-media thickness, cardiovascular risk factors, and prevalent cardiovascular disease in men and women: The British Regional Heart Study. Stroke 1999; 30 : 841-850.
23. Bots ML, Hofman A, Grobbee DE. Increased common carotid intima-media thickness. Adaptive response or reflection of atherosclerosis? Findings from the Rotterdam Study. Stroke 1997; 28 : 2442-2447.
24. Irace C, Gnasso A, Cirillo F et al. Arterial remodelling of the common artery after aortic valve replacement in patients with aortic stenosis. Stroke 2002; 33 : 2446-2450.
25. Henry MA, Piet JK, Dekker JM et al. Carotid arterial remodelling: A maladaptive phenomen in type 2 diabetes but not in impaired glucose metabolism: The Hoorn Study. Stroke 2004; 35 : 671-676.
26. Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Lb Invest 2005; 85 : 9-23.
27. Gnasso A, Irace C, Carralo C et al. In vivo association between low wall shear stress and plaque in subjects with asymmetrical carotid atherosclerosis. Stroke 1997; 28 : 993-998.
28. Carallo C, Lucca FL, Ciamei M et al. Wall shear stress is lower in the carotid artery responsible for unilateral stroke. Atherosclerosis 2006; 185 : 108-113.
29. Mast H, Thompson JL, Lin IF et al. Cigarette smoking as a determinant of high-grade stenosis in Hispanic, black, and white patients with stroke or transient ischemic attack. Stroke 1998; 29 : 908-912.
30. Polak JF, Shemanski L, Oĺeary DH et al. Hypoechoic plaque at US of the carotid artery: An independent risk factor for incident stroke in adults aged 65 years and older. Cardiovascular Health study. Radiology 1998; 208 : 649-654.
31. Mathiesen EB, Bonaa KH, Joakimsen O. Hypoechoic plaques are associated with high risk of ischemic cerebrovascular events in carotid stenosis: The trombo study. Circulation 2001; 103 : 2171-2175.
32. Devuyst G, Ruchat P, Karapanayiotides T Ultrasound measurement of the fibrous cap in symptomatic and asymptomatic atheromatous carotid plaque. Circulation 2005; 111 : 2776-2782.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Předseda České internistické společnosti Richard Češka padesátníkem
- Prevalencia abdominálnej obezity na Slovensku. Štúdia IDEA Slovakia
- Dlouhodobé zkušenosti s infuzní léčbou treprostinilem u nemocných s plicní arteriální hypertenzí v České republice
- Vliv léčby fenofibrátem na rizikový profil nemocných s metabolickým syndromem a smíšenou dyslipidemií léčených ambulantně
- Molekulární genetika infarktu myokardu
- Chronická pankreatitida - etiologická klasifikace a diagnostická kritéria
- Adiponektin a ateroskleróza
- Představuje inhibitor reninu aliskiren nové výhledové možnosti v léčbě kardiovaskulárních onemocnění?
- Genetika dyslipidemií včera, dnes a zítra
- Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
- Tyreopatie, dyslipidemie a kardiovaskulární rizika
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- CRP - marker proinflamačního stavu a kardiovaskulárního rizika
- Sekundární dyslipidemie a jejich léčba
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
- Pravidelná aerobní pohybová aktivita zlepšuje lipidový profil u osob s vyšší než normální tělesnou hmotností
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Intravenózní léčba akutního srdečního selhání
- Duální inhibice cholesterolu prostřednictvím přípravku ezetimib/simavastatin (Inegy®) - nejsnadnější cesta k dosažení cílových hodnot LDL-cholesterolu?
- Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
- Lipoprotein (a)
- Obezita a metabolický syndrom - více otázek než odpovědí?
- Interna - co ji spojuje a co ji naopak rozděluje
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Šeberová Ester: Alergická rýma.
- Petrů V, Krčmová I.: Anafylaktická reakce.
- Beran J, Havlík J.: Pneumokokové nákazy a možnosti očkování proti nim.
- Štolfa J, Štork J et al.: Psoritická artritida a psoriáza.
- Keil R et al.: Gastroskopie.
- Astl J.: Chirurgická léčba nemocí štítné žlázy.
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy. - Špinar J, Vítovec J et al.: Jak dobře žít s nemocným srdcem.
-
Šobrův den, XXIII. konference o hyperlipoproteinemiích
Praha, 7. června 2006
Abstrakta
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Lipoprotein (a)
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- Vedlejší účinky farmakoterapie na hladinu lipidů
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




