-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lipoprotein (a)
Lipoprotein (a)
The lipids are transported by lipoproteins in the blood system. Lipoprotein (a) [Lp (a)] is a unique lipoprotein of the human plasma discovered by professor Berg in 1963. Lp (a) consists of apolipoprotein (a) and LDL particles (apolipoprotein B100). The level and size of Lp (a) are highly variable and largely determined heredity. Clinical studies on animal models have shown that elevated Lp (a) levels are linked with a higher risk of atherosclerosis, even though not all of the conclusions based on the studies that have been carried are convincing. Concentration over 35 mg/dl is considered to be a risk level. Surprisingly high Lp (a) levels in old age are associated with longevity. This may be explained by the physiological role of Lp (a) in tissue reparation, wound healing and anti-cancer effect.
Key words:
lipoprotein (a) – apolipoprotein (a) – atherosclerosis – ischemic heart disease
Autoři: L. Zlatohlávek; K. Zídková; M. Vráblík
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2007; 53(4): 434-440
Kategorie: Přehledné referáty
Souhrn
Tuky jsou v krevním řečišti transportovány ve formě lipoproteinů. V roce 1963 objevil Berg nový lipoprotein, který označil jako lipoprotein (a) Lp (a). Lp (a) se skládá z apolipoproteinu (a) a LDL-částice (apolipoprotein B100). Hladina a velikost Lp (a) jsou velmi variabilní a jsou z velké části dány geneticky. Dle klinických studií a studií na zvířecích modelech jsou zvýšené hladiny Lp (a) spojené se zvýšeným rizikem aterosklerózy, i když závěry všech provedených studií nejsou vždy přesvědčivé. Za rizikové hodnoty jsou považovány hladiny přes 35 mg/dl. Překvapivě vysoké hladiny Lp (a) ve stáří jsou asociovány s dlouhověkostí. Vysvětlení tohoto faktu je možno hledat ve fyziologické roli Lp (a) při reparaci tkání, hojení ran a protinádorovém působení.
Klíčová slova:
lipoprotein (a) - apolipoprotein (a) - ateroskleróza - ischemická choroba srdečníÚvod
Ateroskleróza představuje u člověka jedno z nejvýznamnějších onemocnění. Studiu problematiky, patofyziologie, léčbě a jejích rizikovým faktorům byla věnována řada vědeckých publikací. Jistě nejsou v dnešní době již zpochybnitelné jasné rizikové faktory aterosklerózy, ať neovlivnitelné (pohlaví, věk, genetická výbava a další) nebo ovlivnitelné (dyslipidemie, kouření, nízká pohybová aktivita, obezita, diabetes mellitus, arteriální hypertenze a další). Nicméně u některých pacientů se stejnými rizikovými faktory je manifestace aterosklerózy různorodá (časností manifestace, rozsahem a místem postižení apod). Proto jsou hledány stále nové „emerging“ rizikové faktory, které akcelerují projevy aterosklerózy. Jedním z potencionálních kandidátů je lipoprotein (a), který se po objevení v 70. letech XX. století dostává zpět do světla vědeckého zájmu.
Lipoprotein (a) je plazmatický lipoprotein tvořený z apolipoproteinu (a) a LDL-částice (apolipoprotein B100). Dle klinických studií a studií na zvířecích modelech jsou zvýšené hladiny Lp (a) spojené se zvýšeným rizikem aterosklerózy. Za rizikové hodnoty jsou považovány hladiny přes 300 mg/l. Princip, jakým se Lp (a) uplatňuje v procesu aterogeneze, není zcela znám. Roli hraje pravděpodobně jeho funkce při reparaci a hojení ran, kdy Lp (a) „přináší“ do poškozeného endotelu lipidy jako substrát k hojení, a tím paradoxně přispívá k ukládání dalších lipidů do aterosklerotického plátu. Další jeho jistě významnou rolí je vysoká podobnost s plazminogenem. Jeho vazbou na receptory pro plazminogem inhibuje jako afunkční molekula fibrinolýzu, a tím napomáhá k trombogenezi.
Naopak překvapivě vysoké hladiny Lp (a) ve stáří jsou asociovány s dlouhověkostí. Vysvětlení tohoto faktu je možno hledat právě v jeho roli při reparaci tkání, hojení ran a protinádorovém působení.
Hladina a velikost Lp (a) jsou u člověka velmi variabilní a jsou dány množstvím syntetizovaného apoliproteinu (a). Gen pro lipoprotein (a) je lokalizován na 6. chromozomu. Hladina Lp (a) je z více než 95 % dána geneticky, dále ji může ovlivňovat věk, pohlaví, některé hormony a léky. Hladina není prakticky ovlivnitelná dietou.
Lipoprotein (a) je přítomen u člověka, primátů a ježka evropského, jeho fyziologické a patofyziologické funkce nebyly stále jasně objasněny.
Lipoprotein (a), jeden z dalších potencionálních kandidátů ať aditivního či samostatného rizikového faktoru aterosklerózy, si jistě zaslouží naši pozornost.
Historie
V roce 1963 objevil prof. Berg v plazmě antigen, který přiřadil do oblasti lipoproteinů [1]. Původně byl tento antigen spojován s LDL-částicí, ale Berg ukázal, že tomu tak není, že se jedná o antigen reprezentující odlišnou lipoproteinovou částici a označil ji jako lipoprotein (a) [2]. Po zveřejnění výsledků prof. Berga objevil prof. Seeger [3] pomocí elektroforézy lipoprotein, o kterém se domníval, že se jedná o genetickou variantu β-migrující LDL. Následně bylo dokázáno, že se jedná o nový lipoprotein pohybující se v oblasti pre-β [4]. V roce 1970 popsal prof. Rider lipoprotein, který se sice elektroforeticky choval jako VLDL, ale ultracentrifugací byl porovnatelný s LDL. Všechny práce popisovaly ve skutečnosti Lp (a). Název Lp (a) vznikl jako označení lipoproteinu s antigenními vlastnostmi.
Struktura
Lp (a) má dle elektronové kryomikroskopie [5] zhruba sférický tvar o průměru 21 nm. Skládá se z low-density jádra obaleného high-density pláštěm [6]. Stejně jako LDL-částice obsahuje apolipoprotein B100 a dále druhý, disulfidicky vázaný polypeptid - apolipoprotein (a). Vazba mezi apo (a) a apo B100 je uskutečněna pomocí cysteinu 4057 na apo (a) a Cys 3734 na apo B100 [7]. Apo (a) je vysoce glykozylovaný, hydrofilní protein s velmi malou afinitou k lipidům, který vykazuje rozmanitou délkovou variabilitu [8]. Sestává se z domén, tzv. kringlů (kringl - z dánštiny preclík) a serin-proteázové domény. Kringly mají strukturu trojité smyčky, která je stabilizována třemi disulfidickými vazbami.
Obr. 1. Struktura Lp (a) částice. 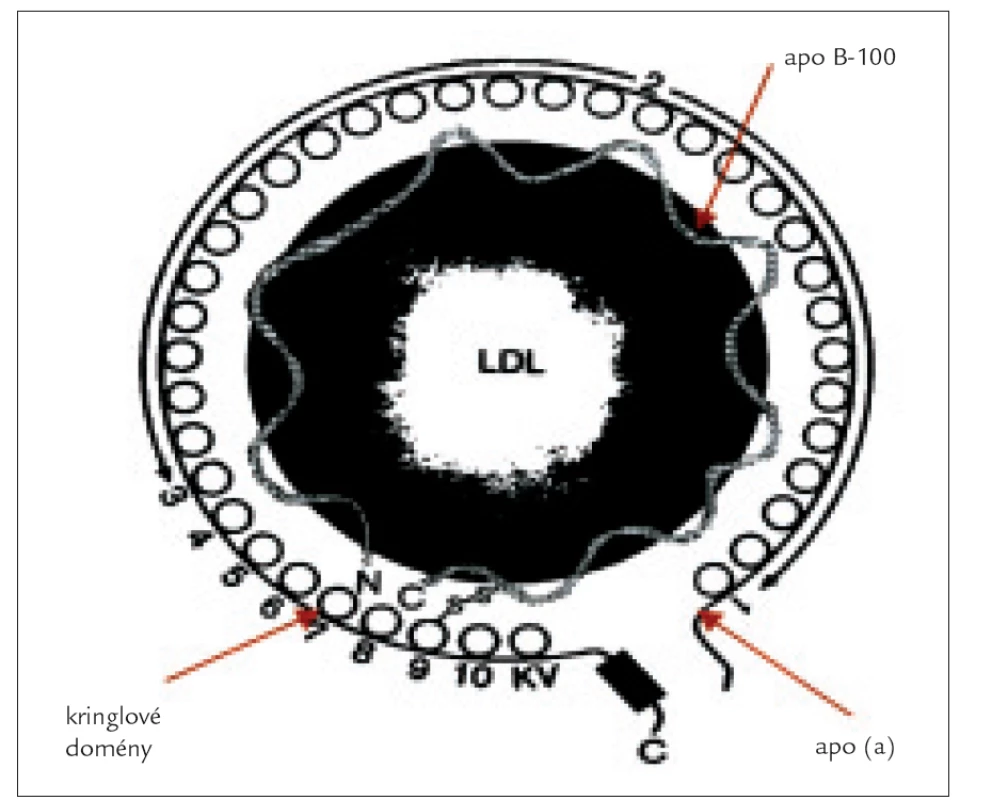
Kringly se vyskytují také v plazminogenu, protrombinu, tkáňovém aktivátoru plazminogenu a dalších proteázách podílejících se na koagulaci a fibrinolýze. Lp (a) obsahuje 11 variant kringlů [9]. Poslední z nich je z 85 % homologní s kringlem V plazminogenu. Zbývajících 10 je podobných, ale nikoli identických s kringlem IV plazminogenu. Těchto 10 je označeno jako kringl IV typy 1-10. Kringly IV typ 1 a 3-10 jsou přítomny pouze v jedné kopii, oproti tomu typ 2 se vyskytuje v různých počtech opakování, a to 3-43krát [10]. A právě tato repetice kringlu IV typ 2 udává rozdílnou velikost apo (a).
Kromě výše zmíněných apolipoproteinů objevili někteří autoři ve svých studiích v Lp (a) dokonce malé množství apo A-I a apo A-II, minimální množství apo D, nikdy však apo C. V postprandiální plazmě byl nalezen Lp (a) bohatý na triglyceridy obsahující apo E.
Plazminogen se díky své vlastnosti vázat lyzin váže na řadu specifických substrátů [11] (např. fibrin, buněčné receptory, endotelové buňky tepen). Kringl IV typ 10 lidského apo (a) má taktéž schopnost se vázat na stejné substráty jako plazminogen, s nímž interferuje jako nefunkční proteáza, např. při trombolýze.
Genetika
Gen pro apo (a) je pravděpodobně jeden z nejpolymorfnějších v lidském genomu. Jeho velikost kolísá od 50 do 300 kb [12]. Gen je lokalizován na 6. chromozomu v oblasti 6q26-q27 asi 50 kb od genu pro plazminogen, se kterým sdílí asi z 80 % homologii. Jeho rozsáhlost je dána mnohonásobným opakováním 5,5 kb dlouhé jednotky kódující kringl IV typ 2 [13] objevující se v rozdílném počtu repetic. Exprese genu probíhá v jaterní buňce.
Míra exprese genu je ovlivňována jeho regulačními oblastmi. V promotorové oblasti, bezprostředně sousedící s kódující sekvencí, se nalézají esenciální transkripční elementy. Rozdílné hladiny u stejných délkových izoforem apo (a) mohou být dány sekvencí a variabilitou v těchto oblastech. Uvažovány jsou především polymorfizmy: +121G/A a +93C/T v proximální části promotoru a repetice (7-11krát) 5 nukleotidů TTTTA (tzv. STR lokus) v distální části promotoru. Další regulační oblasti jsou od vlastního genu značně vzdálené a splňují charakteristiku zesilovačů. Zesilovače DHII (28 kb od genu) a DHIII (20 kb od genu) jsou místy, kde se pravděpodobně uplatňují farmakologické vlivy a vlivy vnitřní regulace (androgeny, estrogeny a další) [14].
Obr. 2. Umístění genu apo(a) a jeho regulačních oblastí na 6. chromozomu. 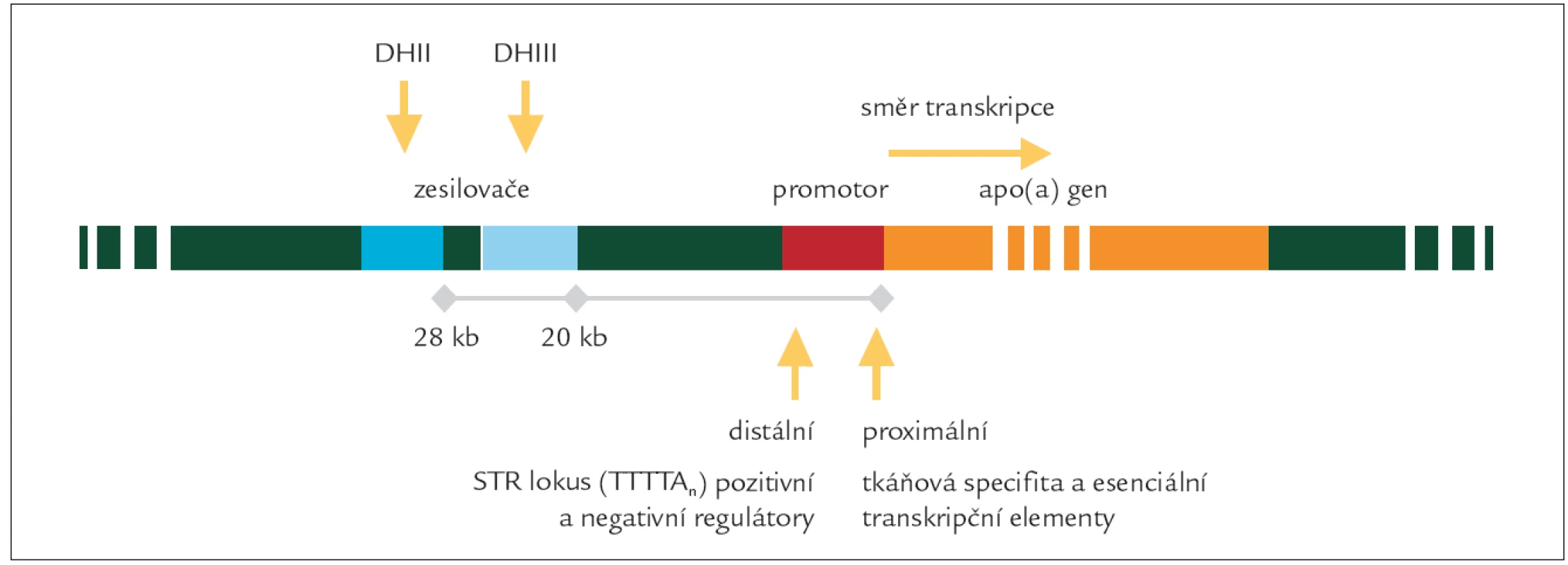
Metabolizmus
Množství kolujícího Lp (a) je dáno zejména množstvím produkce, nikoliv jeho degradace [15].
Lp (a) je syntetizován v játrech [16]. Určujícím faktorem hladiny Lp (a) je množství apo (a), jehož hladiny v jaterní buňce jsou individuální dle míry transkripce a stability příslušné mRNA. V endoplazmatickém retikulu každý kringl prochází sérií posttranslačních modifikací včetně formace 3 disulfidických vazeb a přidání N-vázaných glykanů. Delší formy apo (a) jsou během transportu z endoplazmatického retikula déle zadržovány a mohou být degradovány proteozomy. Malé formy jsou efektivněji transportovány na místo dalšího zpracování, do Golgiho komplexu, kde dochází k dalšímu navázání na N - a O - vázaných glykanů. Nově syntetizovaný apo (a) je transportován na povrch jaterní buňky, kde je shromažďován s lipoproteiny bohatými na apo B100. Nejprve dochází k nekovalentní vazbě mezi volným cysteinem na apo (a) a cysteinem na C konci apo B100. V druhém kroku dochází k disulfidické vazbě mezi dvěma zbytky cysteinu. Tento proces je katalyzován disulfid-izomerázou. Jak bylo popsáno výše, velké formy jsou během posttranslačních úprav více náchylné k degradaci, a proto jsou spojeny s nižšími sérovými hladinami Lp (a), u malých forem je tomu naopak.
10-25 % Lp (a) je konvertováno na LDL-částice, které jsou z oběhu odstraňovány LDL-receptorem [17]. Při pokusech na tkáňových kulturách VLDL [18] receptor internalizoval Lp (a). U myší s „knockoutovaným“ VLDL receptorem dochází ke zvýšení hladin Lp (a).
Ledviny se také podílejí na odstranění Lp (a) z oběhu [19]. Byl zjištěn arteriovenózní gradient v hladinách Lp (a) ledvinných tepen a žil. Pacienti s renální insuficiencí mají zvýšené hladiny Lp (a). Princip, jakým velké glykozylované substráty procházejí do moči, není přesně znám.
Hladina Lp (a) je minimálně ovlivnitelná věkem, pohlavím či dietou a jeho hladina je poměrně stabilní po celou dobu života. U žen po menopauze dochází pravděpodobně vlivem nedostatku estrogenů k vzestupu hladiny Lp (a) o 10-30 %. Estrogeny a kyselina nikotinová působí na úrovni transkripce snížením hladiny příslušné mRNA. Růstový hormon působí opačně.
Fyziologické funkce
Lp (a) je především považován za aterogenní rizikový faktor, nicméně má pravděpodobně i fyziologické funkce. Jedna z možných rolí Lp (a) je jeho úloha při reparaci a hojení ran [17].
Lp (a) vstupuje do procesu hojení po kontaktu extracelulární matrix poraněné tkáně s krevním proudem. Uvolněním defenzinu, peptidu vázáného na degranulovaných neutrofilech, zvyšuje vazbu Lp (a) na endotel [20]. LDL část Lp (a) dodává lipidy pro reparaci tkáně. Lp (a) podporuje další influx ostatních zánětlivých buněk, např. má chemotaktický vliv na monocyty. Dle studií in vitro [21] je Lp (a) schopen fungovat jako scavenger akumulovaných a nadbytečných biologických lipidů. Pomocí repetic domény K IV je schopen navázat zbytky metabolizmu (včetně oxidovaných lipidů) a nabídnout je k dalšímu zpracování.
Lp (a) je přítomen v blízkosti endoteliálních buněk novotvořených cév, avšak nebyl již detekován v lezích po epiteliální regeneraci [22]. In vitro dochází vlivem Lp (a) k inhibici novotvorby cév v nádorovém procesu pravděpodobně zablokováním receptorů pro angiostatin, kterému je strukturou podobný.
Pozoruhodné jsou studie se stoletými lidmi [23], u nichž byla zjištěna spíše vyšší hladina Lp (a) než u srovnávací skupiny středního věku. Zdá se, že pokud nejsou přítomné jiné rizikové faktory aterosklerózy, Lp (a) se spíše uplatňuje v procesu hojení ran a svými možnými antineoplazmatickými vlastnostmi. Pravděpodobně ochranný, protektivní vliv mají vyšší hladiny středně dlouhých délkových variant Lp (a).
U afrických černochů byla zjištěna střední až vyšší koncentrace Lp (a) [24], která je ale způsobena právě středními hodnotami Lp (a) u nositelů dlouhých izoforem. Zde se pravděpodobně uplatňuje jeho ochranná role před tropickými infekcemi či jinými ekologickými faktory. Lp (a) může odstranit oxidované lipidy vznikající v průběhu hemolytické krize, např. při malárii.
Aterogeneze
Řadou studií a pokusy in vitro bylo prokázáno, že se Lp (a) akumuluje v aterosklerotickém plátu, ale nikoli ve zdravé stěně cév. Většina prací studujících aterogenezi Lp (a) byla prováděna in vitro, kde byly sledované parametry izolované, a tudíž plně neodráží situaci in vivo. Ze zatím provedených studií není jasné, která z částí proteinu apo (a) se podílí na rozvoji a tvorbě aterosklerózy nejvíce.
V časné fázi tvorby plaku se Lp (a) nalézá v blízkosti endoteliálních buněk, transport je pravděpodobně zprostředkován VLDL receptory, které jsou přítomny na kapilárách a drobných cévách. Lp (a) je zachycen v lézích vazbou na komponenty extracelulární matrix. Důležitou roli v tomto procesu hraje zřejmě i fibrin. Lp (a) zde zvyšuje expresi adhezivních molekul a napomáhá chemotaxi zánětlivých buněk [25]. Výsledkem interference s plazminem dochází ke snížení aktivity TGF (transformující růstový faktor), a tím ke zvýšení proliferace buněk hladké svaloviny. Lp (a) je v plaku často lokalizován v blízkosti pěnových buněk, s jejichž zbytky a dalšími látkami (např. oxidovanými lipidy) je „scavengován“ do makrofágů pomocí Lp (a) receptorů [26]. Tím zvyšuje Lp (a) lokální depozita cholesterolu v lezích a napomáhá k rozvoji plaku. Konečně se ve velké míře váže na buňky exponované degranulovaným neutrofilům. Lp (a) se dále akumuluje v krevních destičkách [27], kompetuje s plazminogenem o vazbu na fibrin a zpomaluje aktivaci tkáňového aktivátoru plazminogenu, inhibuje lokálně trombolýzu [28]. V pokročilých lézích je apo (a) predominantně lokalizován extracelulárně ve ztluštělé intimě, kde se váže na proteoglykany, fibronektin, tetranektin a fibrin.
Lp (a) ve světle studií
Brzy po objevení Lp (a) se tento lipoprotein dostal do světla zájmu ve vztahu k procesu aterosklerózy. Byla provedena řada studií hledajících vztah Lp (a) k ischemické chorobě.
Vzhledem k rozdílné izolaci, skladování a chemické analýze Lp (a), i k odlišnému designu studií, počtu vyšetřených pacientů a různé statistické analýze, jsou výsledky provedených klinických studií obtížně srovnatelné. Nelze s jistotou uzavřít, že Lp (a) je samostatný rizikový faktor v rozvoji aterosklerózy a okluzi periferních tepen [29]. Tyto nejistoty vycházejí z řady prospektivních studií, které přinášejí data o několika tisících pacientů s ICHS s více než desetiletým sledováním.
Data z Framighamské studie [30] ukazují, že pokud je koncentrace Lp (a) 100 mg/l Lp (a), je Lp (a) platný prediktor kardiovaskulárního rizika u mužů. U žen není tento nález přesvědčivý.
Podobné výsledky vyšly z retrospektivních a case-control studií (tab. 1). V retrospektivních studiích je ovšem těžké rozlišit, zda je elevace Lp (a) kauzální či je zvýšena sekundárně. Některá věrohodná data ukazují, že zvýšené hladiny Lp (a) jsou prediktorem progrese preexistujících změn, které byly monitorovány angiograficky.
Vztah Lp (a) a cévní mozkové příhody byl studován [31] v 16 epidemiologických studiích, z jejichž závěrů nevyplynul Lp (a) jako prediktor ischemické mozkové příhody, ale může být pomocným rizikovým faktorem iktu u pacientů s jiným metabolickým postižením. Jisté podezření vztahu embolických příhod a Lp (a) vzhledem k „oslabené“ fibrinolýze nelze opominout.
Jistě významnou a velice často v odborné literatuře citovanou rolí Lp (a) je jeho vztah k okluzivním komplikacím po různých intervenčních výkonech, jako je perkutánní transluminální koronarografická angioplastika [32], stentování koronárních tepen, kde se uplatňuje samostatně či samozřejmě v kombinaci s ostatními rizikovými faktory. Vysvětlením těchto komplikací je zřejmě inkorporace Lp (a) do stěn tepen během novotvoření intimy po poškození zákrokem. Z provedených studií lze říci, že hladina Lp (a) přes 300 mg/l je rizikovým faktorem okluze, samozřejmě potencována ostatními rizikovými faktory, jako jsou např. vysoké hladiny LDL, nízké hladiny HDL a další.
Vzhledem k možnému negativnímu vlivu na fibrinolýzu je diskutován vztah Lp (a) k žilním trombózám [33], uzávěrům retinálních žil a placentární cirkulace jako příčině retardace růstu plodu. Kombinace rizikových parametrů trombogeneze zřejmě vede k narušení jednotlivých cévních subsystémů, jako jsou např. retinální cévy. Nelze jednoznačně říci, že Lp (a) má vztah k trombofilii a že má jasný synegrický efekt spolu s dříve definovanými a známými protrombotickými prediktory.
Hladiny Lp (a) a možnosti jejich ovlivnění
Bylo provedeno mnoho studií zkoumajících vliv diety na hladinu Lp (a). Byl zkoumán vliv vysokocholesterolové diety [34], po které došlo ke zvýšení apo-B100, ale nikoliv Lp (a). Stejně tak nízkokalorická dieta ani rybí olej neměly vliv na hladinu Lp (a). U žen po redukci váhy o 10 kg došlo k statisticky významnému poklesu Lp (a), ale nebyl pozorován efekt u žen se stejným váhovým úbytkem, které měly hladinu Lp (a) pod 300 mg/l.
Z farmakologické léčby se jeví zatím jako jediný lék ovlivňující hladinu Lp (a) kyselina nikotinová. U hypercholesterolemických pacientů s hladinou Lp (a) přes 300 mg/l došlo k poklesu Lp (a) o 36 %, avšak 45 % pacientů studii pro nežádoucí účinky nedokončilo [35]. Analog kyseliny nikotinové Acipimox v dávce 1 g redukuje hladinu Lp (a) o 8 % méně než kyselina nikotinová. Snížení hladiny Lp (a) bude zřejmě způsobeno ovlivněním jeho syntézy na úrovni regulačních oblastí genu pro apo (a). Kyselina nikotinová také snižuje lipolýzu tukové tkáně, a tím dodání mastných kyselin do jater. Následkem je snížená hladina VLDL-částic a vzestup počtu VLDL-receptorů, pomocí kterých je Lp (a) pravděpodobně také vychytáván. Tento druhý princip se ovšem na snížení Lp (a) podílí minimálně.
Ve dvojitě slepé, placebem kontrolované studii [36] při podávání gemfibrozilu v dávce 50 mg/kg/den došlo ke snížení Lp (a) o 16 %. Inhibitory hydroxy, - metyl-, glutaryl-koenzym A reduktázy (statiny) [37] dle většiny studií neovlivňují hladinu Lp (a) a v několika menších pozorováních došlo dokonce ke zvýšení Lp (a). Po podávání probukolu nebyl pozorován vliv na hladinu Lp (a).
Zaručenou metodou snižující hladinu Lp (a) je aferéza [38]. Princip je stejný jako při LDL-aferéze. V preventivní studii sledující restenózu po PTCA (perkutánní transluminární koronární angiografii) bylo sledováno výrazné snížení těchto příhod o více než 50 % po redukci koncentrace Lp (a) aferézou.
Prvním hormonem, se kterým byla provedena studie prokazující pozitivní vliv na Lp (a), byl analog androgenu stanozol, ale i jiné androgeny snižují hladiny Lp (a). U pacientů s karcinomem prostaty dochází po orchiektomii ke zvýšení hladin Lp (a), kdežto u pacientů léčených estrogeny dochází k poklesu Lp (a) [39]. V mnoha studiích postmenopauzálních žen bylo po podávání monoterapie estrogeny či kombinované terapie s progesteronem pozorováno snížení Lp (a). Stejný vliv byl pozorován po podávání antiestrogenu tamoxifenu.
Z ostatních hormonů zvyšuje hladinu Lp (a) např. růstový hormon, naopak dexametazon nebo adenokortikotropní hormon hladinu Lp (a) snižují. Nálezy u tyreoidních hormonů jsou rozporuplné.
Závěr
Lipoprotein Lp (a) je unikátní lipoproteinová částice nejen svou genetickou determinací, ale i strukturou. Lipoprotein (a) hraje zřejmě významnou úlohu při hojení poškozených tkání. Naopak svým působením v poškozené tkáni endotelu zhoršuje proces aterogeneze. Na základě studií sledujících asociaci mezi zvýšenými koncentracemi Lp (a) a zvýšeným rizikem ischemické choroby lze Lp (a) považovat za samostatný rizikový faktor aterosklerózy, i když závěry studií jsou často rozporuplné. V léčbě zvýšených hladin Lp (a) máme omezené možnosti. Dietní intervence není úspěšná, z farmakologických prostředků snižuje hladinu Lp (a) významně kyselina nikotinová a její deriváty. Důležitou roli hrají pohlavní hormony, které významně ovlivňují hladinu Lp (a).
Použité zkratky
apo (a) - apolipoprotein (a), apo A-I, II - apolipoproteiny A I a AII, apoB-100 - apolipoprotein B-100, apo C - apolipoprotein C, apo D - apolipoprotein D, apo E - apolipoprotein E, Cys – Cystein, BMI - body mass index, HDL - high-density lipoproteins, HMG-CoA - hydroxy-methyl-glutaryl-koenzym A, ICHS - ischemická choroba srdeční, IM - infarkt myokardu, LDL - low-density lipoproteins, Lp (a) - lipoprotein (a), mRNA - messenger Ribonucleotid acid, STR - short tandem repeat, TG - triglyceridy, VLDL - very-low-density lipoproteins
MUDr. Lukáš Zlatohlávek
www.vfn.cz
e-mail: l.zlato@tiscali.cz
Doručeno do redakce: 28. 3. 2007
Zdroje
1. Berg KA. New serum type system in man: the Lp sytem. Acta Patol Microbial Scand 1963; 59 : 369-382.
2. Morrisett JD. Lipoprotein (a): structure, metabolism and epidemiology, Plasma lipoproteins. Elservis Sc Publ 1987; 129-152.
3. Seegers W, Hirschholrn K, Burnett L et al. Basic enzymology of blood coagulation. Science 1965; 149 : 303-304.
4. Dahlen G, Ericson C, Furberg C. Studies on an extra pre-beta lipoprotein fraction. Acta Med Scand Suppl 1972; 531 : 5-9.
5. Sines J, Rothnagel R, van Heel M et al. Electron cryomycroskopy and digital image processing of Lp (a). Chem Phys Lipids 1994; 67/68 : 81-89.
6. Marcovina SM, Morriset JD. Structure and metabolism of lipoprotein (a). Curr Opin in Lip 1995; 6 : 136-145.
7. Koschinsky ML, Cote GP, Gabel B et al. Identification of the cystein residue in apo (a) that mediates extracellular couping with apo B-100. J Bioch 1993; 268 : 1819-1825.
8. Hixson JE, Britten ML, Manis GS et al. Apolipoprotein (a) isoform result from size differences in apo (a) mRNA in baboons. J Biol Chem 1989; 264 : 6013-6016.
9. Morrisett JD, Gaubatz JW, Knapp RD et al. Structural propiertis of apo (a): a major apoprotein of human lipoprotein (a). In lipoprotein (a) edited by Scanu A. San Diego: Academic Press Ic., 1990 : 53-74.
10. Lackner C, Cohen JC, Hobs HH. Molecular definition of the extreme size polymorphism in apolipoprotein (a). Hum Mol Genet 1993; 2 : 933-940.
11. Eaton DL, Fless GM. Partial amino acid seguence of apo (a) shows that it homologous to plasminogen. Proc Natl Acad Sci USA 1987; 84 : 3224-3228.
12. White AL, Hixson JE. Molecular basis for null Lp (a) phenotyps and influence of apo (a) size on plasma Lp (a) level in the baboon. J Biol Chem 2000; 269 : 28716-28723.
13. Lackner C, Boerwinkle E, Leffert C et al. Molecular vasis of apo (a) isoform size heterogenity as revealed by pulsed-field gel electrophoresis. J Clin Invest 1991; 87 : 2153-2161.
14. Boerwickle E. Genetics of plasma lipoprotein (a) concentrations. Current Opinion in Lipidology 1992; 3 : 128-136.
15. Krempler F, Kostner GM, Bolzano K. Turnover of lipoprotein (a) in man. J Clin Invest 1980; 62 : 1483-1490.
16. Kraft HG, Menzel HJ. Changes of genetics apolipoprotein phenotypes caused by liver transplantation: Coplication for apolipoprotein synthesis. J Clin Invest 1989; 83 : 137-142.
17. Hobbs HH, Whute AL. Lipoprotein (a): intrigues and insights. Current Opinion in Lipidology 1999; 10 : 225-236.
18. Argaves KM, Korzansky KF. The aterogenic Lp (a) is internalized and degraded in a process mediated by the VLDL receptor. J Clin Invest 1997; 100 : 2170-2182.
19. Parra HJ, Mezdour H, Cachera C. Lp (a) lipoprotein in patients with chronical renal failure treated by hemodialysis. Clin Chem 1987; 33 : 721.
20. Yhigszi AAR, Lavi E, Bdeir BR et al. Defensin stimulated the binding of Lp (a) to human vascular endothelial and smooth muscle cells. Blood 1997; 12 : 4290-4298.
21. Philips ML, Lembertas AV et al. Physical properties of recombinant apo (a) and its association with LDL to form an Lp (a)-like complex. Biochem 1993; 32 : 3722-3728.
22. Yano Y, Shimokawa K, Okada Y et al. Immunolocalizacion of lp (a) in wounded tissues. J Histochem Cytochem 1997; 45 : 559-568.
23. Baggio G, Donazzan S, Monti D et al. Lp (a) and lipoprotein profile in healthy centenarians: a reappraisal of vascular risk factor. FASEB J 1998; 12 : 433-437.
24. Marcovina SM, Alberts JJ, Wijsman E et al. Differences in Lp (a) concentrations and apo (a) polymorphysm between Black a White Americans. J Lip Res 1996; 37 : 2569-2585.
25. Kojima S, Harpel PC, Rifkin DB. Lipoprotein (a) inhibits the generation of trasforming growth factor beta: an endogenous inhibitor of smooth muscle cell migration. J Cell Biol 1991; 113 : 1439-1445.
26. Heberland ME, Fless GM, Scanu AM et al. Malondialdehyde modification of liporpotein (a) procedurs avid uptake by human monocytomacrophages. J Biol Chem 1992; 267 : 4143-4151.
27. Nacman RL. Trombosis and atherogenesis, molecular connections. Circulation 1992; 96 : 2485-2487.
28. Hajjar KA, Nachman RL. The role of Lp (a) in aterogenesis and trombosis. Ann Rev Med 1996; 47 : 423-442.
29. Cooke JP. The pathophysiology of periferal arterial disease: rational targets for drug interven. Vasc Med 1997; 2 : 227-230.
30. Seman LJ, DeLuca C, Jener JL et al. Lipoprotein (a)-cholesterol and coronary heart disease in the Framingham heart Study. Clin Chem 1999; 45 : 1039-1046.
31. Milionis HJ, Winder AF, Mikhailidis DP. Lp (a) and stroke. J Clin Pathol 2000; 53 : 487-496.
32. Miner SE, Hegele RA, Sparkes J et al. Homocystein, Lp (a) levels and restenosis after PTCA: a prospective study. Am Heart J 2000; 140 : 272-278.
33. von Depka M, Nowak-Gottl U, Eisert R et al. Increased lipoprotein (a) levels as an indipendent risk factor for venous tromboembolism. Blood 2000; 96 : 3364-3368.
34. Bo A. Therapy for lowering lipoprotein (a) levels. Curr Opin in Lipid 1997; 8 : 337-341.
35. Seed M, O´Conner B. The effect of nicotin acid and acipimox on lipoprotein (a) concentration and turnover. Atherosclerosis 1993; 101 : 61-68.
36. Ramharack R, Spahi MA, Nicka GW et al. Gemfibrozil significantly lowers cynomolgus monkey plasma lipoprotein (a)-protein and liver apolipoprotein (a) mRNA levels. J Lipids Res 1995; 36 : 1294-1304.
37. Galetta F, Sampierto T, Basta G et al. Effects of simvastatin on blood levels of lipoprotein (a). Minerva Med 1995; 86 : 299-303.
38. Bambauer R, Schiel R, Keller HE et al. LDL apheresis in the treatment of two patients with coronary heart disease and extremly elevated lipropotein (a) levels. Artific organs 1669; 20 : 340-343.
39. Henriksson P, Angelin B, Berglund L. Hormonal regulatulation of serum Lp (a) levels. Opposite effects after estrogen treatment and orchidectomy in males with prostatic carcinoma. J Clin Invest 1992; 89 : 1166-1171.
40. Armstrong VW, Cremer P, Eberle E et al. The association between serum Lp (a) concentrations and angiografhically assessed coronary atherosclerosis. Dependence on serum LDL levels. Atherosclerosis 1986; 62 : 249-257.
41. Berg K, Dahlen G, Borresen AL. Lp (a) phemotypes, other lipoprotein parameters and a family history of coronary heart disease in modele-aged males. Clin Genet 1979; 16 : 347-352.
42. Buscaglia P, Gazzaruso C, Garzaniti A et al. Lipoprotein (a), apolipoprotein (a) polymorphism, and insulin treatment in type II diabetes patient. Diabetes Care 1995; 18 : 1202-1203.
43. Cremer P, Nagel D, Labrot B et al. Lp (a) is predictor of myocard infarction in comparison to fibrinogen, LDL cholesterol and other risk factors: results from the prospective Gottingen Risk Incidence and Prevalence Study (GRIPS). Eur J Clin Incest 1994; 24 : 444-453.
44. Genest J Jr, Jenner JL, McNamara Jr et al. Prevalence of lipoprotein (a) excess in coronary artery disease. Am J Cardiol 1991; 67 : 1039-1045.
45. Marburger C, Hambrecht R, Niebauer J et al. Association between lipoprotein (a) and progresion of coronary artery disease in modele-aged men. Am J Cardiol 1994; 73 : 742-746.
46. Moliterno DJ, Jokinen EV, Miserez AR et al. No association between plasma lipoprotein (a) concentration and the presence or absence of coronary atherosclerosis in African-Americans. Arterioscler Tromb BASF Biol 1995; 15 : 850-855.
47. Nieminen MS, Mattila KJ, Aalto-Setala K et al. Lipoproteins and thein genetic variation in subject with and without angiographycally verifed coronary Artery disease. Arterioscler Tromb 1992; 12 : 58-59.
48. Parlavecchia M, Pancaldi A, Taramelli R et al. Evidence that apoliprotein (a) phenotype is a risk factor for coronary artery disease in men < 55 years of age. Am J Cardiol 1994; 74 : 346-351.
49. Ridker PM, Hennekers CH, Stampfer MJ. A prospective study of lipoprotein (a) and the risk of myocardial infarction JAMA 1993; 270 : 2195-2199.
50. Rosengren A, Wilhelmsen L, Ericsson E et al. Lipoprotein (a) and coronary heart disease: a prospective case-control study in a general population Hample of modele aged men. BMJ 1990; 301 : 1248-1251.
51. Morrisett JD. The role of lipoprotein (a) in atherosclerosis. Curr Atheroscler Rep 2000; 2 : 234-250.
52. Simons LA. Lipoprotein (a): important risk factor or passing fashion? Med J Aust 1993; 158 : 512-514.
53. Tamura A, Waranabe T, Mikuriya Y et al. Serum lipoprotein (a) concentrations are related to coronary disease progression without new myocardial infarction. Br Heart J 1995; 74 : 365-369.
54. Watts GF, Mazurkiewicz JC, Tonge K et al. Lipoprotein (a) as a determinant of the Severiny of angiographically defined carotid atherosclerosis. QJM 1995; 88 : 321-326.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 4- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Předseda České internistické společnosti Richard Češka padesátníkem
- Prevalencia abdominálnej obezity na Slovensku. Štúdia IDEA Slovakia
- Dlouhodobé zkušenosti s infuzní léčbou treprostinilem u nemocných s plicní arteriální hypertenzí v České republice
- Vliv léčby fenofibrátem na rizikový profil nemocných s metabolickým syndromem a smíšenou dyslipidemií léčených ambulantně
- Molekulární genetika infarktu myokardu
- Chronická pankreatitida - etiologická klasifikace a diagnostická kritéria
- Adiponektin a ateroskleróza
- Představuje inhibitor reninu aliskiren nové výhledové možnosti v léčbě kardiovaskulárních onemocnění?
- Genetika dyslipidemií včera, dnes a zítra
- Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
- Tyreopatie, dyslipidemie a kardiovaskulární rizika
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- CRP - marker proinflamačního stavu a kardiovaskulárního rizika
- Sekundární dyslipidemie a jejich léčba
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
- Pravidelná aerobní pohybová aktivita zlepšuje lipidový profil u osob s vyšší než normální tělesnou hmotností
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Intravenózní léčba akutního srdečního selhání
- Duální inhibice cholesterolu prostřednictvím přípravku ezetimib/simavastatin (Inegy®) - nejsnadnější cesta k dosažení cílových hodnot LDL-cholesterolu?
- Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
- Lipoprotein (a)
- Obezita a metabolický syndrom - více otázek než odpovědí?
- Interna - co ji spojuje a co ji naopak rozděluje
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Šeberová Ester: Alergická rýma.
- Petrů V, Krčmová I.: Anafylaktická reakce.
- Beran J, Havlík J.: Pneumokokové nákazy a možnosti očkování proti nim.
- Štolfa J, Štork J et al.: Psoritická artritida a psoriáza.
- Keil R et al.: Gastroskopie.
- Astl J.: Chirurgická léčba nemocí štítné žlázy.
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy. - Špinar J, Vítovec J et al.: Jak dobře žít s nemocným srdcem.
-
Šobrův den, XXIII. konference o hyperlipoproteinemiích
Praha, 7. června 2006
Abstrakta
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Lipoprotein (a)
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- Vedlejší účinky farmakoterapie na hladinu lipidů
-
Chrobák L et al.: Propedeutika vnitřního lékařství.
Nové, zcela přepracované vydání doplněné testy.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




