-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv obezity na genovou expresi adiponektinu a jeho receptorů v subkutánní tukové tkáni
The influence of obesity on the gene expression of adiponectin and its receptor in subcutaneous adipose tissue
The objective of the study was to measure the concentration of adiponectin in plasma, its mRNA expression and the expression of the adiponectin receptors AdipoR1 and AdipoR2 in subcutaneous adpipose tissue (ST) of women with various levels of fat in their organism. A further objective of the study was to determine to what extent the stated parameters correlate with obesity as defined by BMI (body mass index) and how it can be affected by a very low calorie diet (VLCD).
Patient sample:
The sample of 70 women was divided into groups by BMI: patients with class 3 obesity (BMI > 40 kg.m–2, n = 25), patients with class 1 and 2 obesity (BMI 30–40 kg.m–2, n = 15), overweight patients (BMI 25–30 kg.m–2, n = 10) and a normal healthy control group (BMI 20–25 kg.m–2, n = 20). In the case of 14 women with class 3 obesity, the parameters were measured before and after a three-week diet with an energy content of 2200 kJ (550 kcal)/day (VLCD). Method: Plasma concentrations of adiponectin were measured using an ELISA kit (LINCO Research, USA). Subcutaneous adipose tissue was taken using biopsy. RNA was isolated using a MagNA Pure Compact RNA Isolation Kit (Tissue) (Roche, SRN). The gene expression of adiponectin, AdipoR1 and AdipoR2 was determined using the real-time PCR (RT-PCR) method on a ABI Real-Time PCR 7500 instrument (Applied Biosystems, USA) with TaqMan® Gene Expression Assays hydrolisation probes. β-2-mikroglobulin (β2M) was used as an endogenous control, to which the data was normalised.Results:
The circulatory concentration of adiponectin, its mRNA expression and the mRNA expression of AdipoR1 in ST correlate negatively with BMI (r = –0.524, p < 0.001; r = –0.460, p < 0 001; p = –0.354, p = 0.004). The expression of AdipoR2 in ST did not correlate with BMI. The VLCD reduced weight by 9% but did not affect the plasma concentration of adiponectin or the rate of its expression, or the expression of AdipoR1 and AdipoR2.Conclusion:
Our results show that not only the circulatory concentration of adiponectin but also its mRNA expression and the expression of AdipoR1 in ST are significantly lower in obese women compared to a control group and may contribute to the development of metabolic complications in obesity.Key words:
adiponectin – mRNA expression – obesity
Autoři: Z. Lacinová 1; D. Michalský 2; M. Kasalický 2; M. Dolinková 1; D. Haluzíková 1,3; T. Roubíček 1; J. Krajíčková 1; M. Mráz 1; M. Matoulek 1; M. Haluzík 1
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 1; Chirurgická klinika 1. lékařské fakulty UK a VFN Praha, přednosta doc. MUDr. Jan Šváb, CSc. 2; Ústav tělovýchovného lékařství 1. lékařské fakulty UK a VFN Praha, přednosta doc. MUDr. Zdeněk Vilikus, CSc. 3
Vyšlo v časopise: Vnitř Lék 2007; 53(11): 1190-1197
Kategorie: Původní práce
Souhrn
Cílem práce bylo stanovit sérové koncentrace adiponektinu, jeho mRNA expresi a expresi adiponektinových receptorů AdipoR1 a AdipoR2 v subkutánní tukové tkáni (ST) žen s různým obsahem tuku v organizmu. Dalším cílem této práce bylo určit, do jaké míry uvedené parametry korelují s obezitou charakterizovanou pomocí BMI (body mass index) a jak mohou být ovlivněny nízkokalorickou dietou (VLCD).
Soubor nemocných:
Soubor 70 žen byl rozdělen do skupin podle BMI na pacientky s obezitou 3. stupně (BMI > 40 kg.m-2, n = 25), s obezitou 1. a 2. stupně (BMI 30-40 kg.m-2, n = 15), s nadváhou (BMI 25-30 kg.m- 2, n = 10) a na štíhlé zdravé kontroly (BMI 20-25 kg.m- 2, n = 20). U 14 žen s obezitou 3. stupně byly parametry měřeny před a po 3týdenní dietě s energetickým obsahem 2 200 kJ (550 kcal)/den (VLCD).Metodika:
Sérové koncentrace adiponektinu byly měřeny ELISA kitem (LINCO Research, USA). Subkutánní tuková tkáň byla odebrána biopsií. RNA byla izolována kitem MagNA Pure Compact RNA Isolation Kit (Tissue), Roche, SRN. Genová exprese adiponektinu, AdipoR1 a AdipoR2 byla stanovena metodou real-time PCR (RT-PCR) na přístroji ABI Real-Time PCR 7500 instrument (Applied Biosystems, USA) se specifickými hydrolyzačními sondami TaqMan® Gene Expression Assays. β-2-mikroglobulin (β2M) byl použit jako endogenní kontrola, ke které byla data normalizována.Výsledky:
Cirkulující koncentrace adiponektinu, jeho mRNA exprese a mRNA exprese AdipoR1 v ST negativně korelovaly s BMI (r = -0,524, p < 0,001; r = -0,460, p < 0,001; p = -0,354, p = 0,004). Exprese AdipoR2 v ST s BMI nekorelovala. VLCD vyvolala úbytek hmotnosti o 9 %, avšak neovlivnila sérové koncentrace adiponektinu ani míru jeho exprese, resp. exprese AdipoR1 a AdipoR2.Závěr:
Naše výsledky ukazují, že nejen cirkulující koncentrace adiponektinu, ale i jeho mRNA exprese a exprese AdipoR1 v ST jsou u obézních žen významně snížené ve srovnání s kontrolní skupinou, a tím mohou přispívat k rozvoji metabolických komplikací obezity.Klíčová slova:
adiponektin - mRNA exprese - obezitaÚvod
Zvyšující se incidence a prevalence obezity prakticky ve všech průmyslově vyspělých zemích představuje závažný zdravotnický a v poslední době i socioekonomický problém. Výskyt obezity celosvětově v posledních dvou desetiletí prudce vzrůstá. Přibližně 1/3 populace trpí obezitou (BMI > 30 kg/m2) a druhá 1/3 nadváhou (BMI 25-30 kg/m2).
Obezita nejen zkracuje délku života (asi o 8 let), ale snižuje i jeho kvalitu. Hlavními příčinami obezity jsou převaha energetického příjmu nad výdejem, dědičné vlivy, nedostatek pohybu, psychické vlivy a řada dalších. Obezita je nejen rizikovým faktorem inzulinové rezistence, diabetes mellitus 2. typu, dyslipoproteinemie, hypertenze, ale i nádorových onemocnění [1,2]. Je označována za klíčový problém mortality a morbidity tohoto století.
Endokrinní dysfunkce tukové tkáně provázená kumulací tuku v adipocytech vede na jedné straně ke zvýšenému uvolňování prozánětlivých a inzulinovou rezistenci vyvolávajících adipocytárních hormonů (TNFα, rezistin, interleukin-6 a jiných) a na straně druhé ke sníženému uvolňování některých hormonů s inzulin-senzitizujícími účinky, jako je adiponektin [3-5]. Změny sekrece endokrinních a parakrinních faktorů v tukové tkáni obézních shrnuje Coppack et al [6].
Adiponektin je kvantitativně nejvýznamnějším proteinem exprimovaným tukovou tkání, jehož produkce je do značné míry úměrná BMI. Na rozdíl od leptinu však jde o vztah inverzní, při němž s rostoucím množstvím tukové tkáně jeho cirkulující koncentrace, ale i mRNA exprese v adipocytech klesají [7] a mohou se zvyšovat až po dlouhodobé nízkokalorické dietě (VLCD) [8,9]. Adiponektin zlepšuje inzulinovou senzitivitu tak, že ve svalu stimuluje expresi molekul, které se účastní transportu mastných kyselin (např. CD36), podílí se na jejich oxidaci a využití jako energetického substrátu. Tyto změny pak vedou ke snížení triglyceridů (TG) a jejich metabolitů ektopicky uložených v kosterním svalstvu, což následně zvyšuje inzulinovou senzitivitu na postreceptorové úrovni. Naopak zvýšené ektopické ukládání TG ve tkáních interferuje s aktivací fosfatidylinositol-3-kinázy inzulinem, což vede ke snížené translokaci GLUT4 (glucose transporter 4) k buněčné membráně a následně ke sníženému vychytávání glukózy v důsledku výše popsané snížené citlivosti buněk k účinkům inzulinu [10]. Inzulin-senzitizující efekt adiponektinu je na molekulární úrovni zprostředkován aktivací 5´-AMP-proteinkinázy (AMPK) a PPARα [11,12].
Protizánětlivé a antiaterogenní účinky adiponektinu byly opakovaně podrobně popsány. [13,14]. Adiponektin potlačuje na jedné straně expresi cytoadhezivních molekul, jako je ICAM-1, VCAM-1 a E-selektin, a tím inhibuje adhezi monocytů na cévní endotel a na straně druhé tlumí produkci prozánětlivých cytokinů z makrofágů, a tak potlačuje zánětlivý proces, který je doprovodným jevem jak obezity, tak i časné fáze aterosklerózy. Haluzíková et al shrnuje ve svém článku dosavadní experimentální a klinické zkušenosti o adiponektinu a jeho vztahu k ateroskleróze [15].
Molekulární působení adiponektinu v cílových buňkách je zprostředkováno jeho receptory, které jsou exprimovány v odlišných tkáních různou měrou. Adiponektinový receptor 1 (AdipoR1) má vyšší afinitu k adiponektinu než adiponektinový receptor 2 (AdipoR2). AdipoR1 je hojně exprimován v kosterním svalstvu na rozdíl od AdipoR2, který je vysoce exprimován v játrech [16]. Oba typy receptorů jsou přítomny v adipocytech, v nichž působí adiponektin na adipocyty prostřednictvím svých receptorů autokrinně [17] a parakrinně [18]. Receptory AdipoR1 a AdipoR2 jsou atypické membránové proteiny. Obsahují NH2 terminál uvnitř buňky a COOH terminál vně buňky, čímž se liší od všech receptorů z rodiny G-proteinů. Adiponektin se váže na C-terminál AdipoR1, zatímco N-terminál interaguje s proteinem APPL (adaptor protein containing pleckstrin homology domain, phosphotyrosine binding domain and a leucine zipper motif) [19].
Zdá se, že se receptory liší funkcí v signální dráze adiponektinu. AdipoR1 spíše asociuje s aktivací AMPK, zatímco AdipoR2 souvisí s aktivací PPARα. Snížení exprese obou receptorů vede k aktivaci zánětlivých procesů a akceleraci oxidačního stresu [20].
Míra exprese AdipoR1 a AdipoR2 v játrech a kosterním svalu je zvýšená při hladovění, přičemž hodnoty jsou rychle normalizovány po jeho ukončení [10]. Oba receptory jsou negativně regulovány inzulinem, jak bylo prokázáno u myší, kterým byl navozen stav hypoinzulinemie, resp. hyperglykemie [10]. Snížení exprese receptorů adiponektinu způsobené inzulinem je zprostředkováno aktivací fosfatidylinositol-3-kinázou a Foxo1 (Forkhead box, class O), což následně vede ke snížení vazby adiponektinu k buněčným membránám, a tím se sníží aktivace AMPK a dochází ke zhoršení inzulinové rezistence [11].
Původně se předpokládalo, že adiponektin je exprimován výlučně v adipocytech, v nedávné době byla exprese prokázána v placentě [21], ve svalových buňkách myších experimentálních modelů [22]. Hladiny adiponektinu jsou významně ovlivňovány nutričním stavem organizmu, a to nejen u obézních jedinců, ale také u pacientek s podvýživou. U pacientek s mentální anorexií byly zjištěny paradoxně zvýšené hodnoty cirkulujícího adiponektinu a snížené exprese v subkutánní tukové tkáni [23], což může znamenat, že za určitých okolností se aktivuje exprese adiponektinu v jiných buňkách než v adipocytech.
Exprese adiponektinu v adipocytech může být stimulována i působením syntetických látek. Glitazony nebo thiazolidindiony (TZD) jsou využívány jako inzulin-senzitizující léky u pacientů s diabetes mellitus 2. typu, které zlepšují inzulinovou senzitivitu tak, že se váží na molekulární receptory PPARγ v tukové tkáni. Tím podpoří diferenciaci adipocytů a zvyšují jejich počet. V adipocytech se působením TZD mimo jiné zvyšuje exprese a sekrece adiponektinu a stoupají tak i jeho sérové koncentrace. Naopak PPARα agonisté stimulují expresi adiponektinu a jeho receptoru AdipoR2 ve svalu, což rovněž vede ke zvýšení cirkulujících koncentrací adiponektinu, jak bylo prokázáno u experimentálních modelů myší [22].
Obezita snižuje nejen hodnoty adiponektinu, ale i expresi jeho receptorů, což má za následek snížení účinků adiponektinu a vznik inzulinové resistence [5]. Důsledky chronického snížení exprese adiponektinu v tukové tkáni u obézních pacientů jsou stále nejasné. Redukce hmotnosti vede ke zlepšení některých komplikací obezity včetně inzulinové rezistence [24], přesto klíčové faktory, které jsou zahrnuty v regulaci adiponektinu a jeho receptorů vedoucí ke zlepšení komplikací obézních, však zůstávají neznámé.
Cílem práce bylo ověřit vliv obezity na sérové koncentrace a mRNA exprese adiponektinu a jeho receptorů v podkožní tukové tkáni. Dalším cílem studie bylo zjistit, do jaké míry adiponektin a jeho receptory korelují s BMI a jak mohou být ovlivněny krátkodobou nízkokalorickou dietou (VLCD).
Soubor nemocných
Soubor 70 žen byl rozdělen do skupin podle hodnoty BMI na obézní 3. stupně (BMI > 40 kg.m- 2, n = 25), na obézní 1. a 2. stupně (BMI 30-40 kg.m- 2, n = 15), s nadváhou (BMI 25-30 kg.m- 2, n = 10) a neobézní zdravé kontroly (BMI 20-25 kg.m- 2, n = 20).
14 obézních žen 3. stupně podstoupilo 3týdenní nízkokalorickou dietu.Ženy byly hospitalizovány na III. interní klinice VFN Praha. Energetický obsah diety byl 2 200 kJ (550 kcal)/den.
Žádná z žen neměla prokázaný diabetes mellitus 2. typu či jiné akutní onemocnění ovlivňující příjem potravy či energetický výdej.
Všem ženám byla po celonočním hladovění odebrána krev, byly zváženy, změřeny, byl vypočítán BMI a byla provedena biopsie podkožního tuku v lokální anestezii, při které bylo odebráno asi 100 mg tukové tkáně do stabilizačního činidla RNAlateru (QIAGEN GmbH, Německo). Vzorek tuku byl poté skladován při -70 °C do doby analýzy.
Ženy, které podstoupily VLCD, byly zváženy a změřeny, byla jim odebrána krev a provedena biopsie podkožního tuku před začátkem diety a po jejím ukončení.
Ženy byly před zákrokem informovány o cílech studie a podepsaly informovaný souhlas.
Metody
Hormonální a biochemické stanovení
Adiponektin v séru byl stanoven komerčním RIA kitem (Linco Research, USA, kat. č. EZHADP-61K). Citlivost stanovení byla 1,0 ng/ml. Intra - a interassay variabilita kitů byla < 5 %, resp. < 9,0 %.
Koncentrace inzulinu v séru byla měřena RIA kitem (Cis Bio International, France). Citlivost stanovení byla 2,0 μU/ml. Intra - a interassay variabilita kitů < 4,2 %, resp. 8,8 %.
Biochemické parametry jako glykemie, triglyceridy byly měřeny v Ústavu klinické biochemie VFN Praha.
HOMA-IR byl vypočítán pomocí následujícího vzorce: koncentrace inzulinu v séru (mU/l) × koncentrace glukózy (mmol/l)/22,5 [25].
Stanovení mRNA exprese adiponektinu a jeho receptorů metodou real-time PCR
Celková RNA byla izolována ze vzorku subkutánní tukové tkáně po její homogenizaci pomocí přístroje MagNA Lyser (Roche Diagnostics GmbH, Německo). Z homogenizátu byla RNA extrahována kitem MagNA Pure Compact RNA Isolation (Tissue) na automatickém izolátoru MagNA Pure Compact Instrument (Roche Diagnostics GmbH, Německo). Postup izolace RNA byl optimalizován, jak bylo uvedeno v naší práci [26].
0,1-1 μg RNA bylo použito pro přípravu cDNA. Syntéza byla provedena soupravou RevertAid First Strand cDNA Synthesis Kit (Fermentas Life Sciences, Lithuania) s oligo(dT)18 primery podle doporučení výrobce.
Měření mRNA exprese adiponektinu a jeho receptorů bylo provedeno na přístroji ABI 7500 Real-Time PCR instrument (Applied Biosystems, Foster City, CA, USA). V reakční směsi byla cDNA (1 μg), TaqMan® Universal Master Mix, No AmpErase® UNG (12,5 μl) a specifická hydrolyzační sonda TaqMan® Gene Expression Assay (1,25 μl). Celkový objem reakční směsi byl 25 μl. Podmínky reakce byly následující: po iniciační denaturaci při 95 °C, 10 min následovalo 40 cyklů, v nichž annealing probíhal při 60 °C, 1 min a hydrolýza při 95 °C, 15 s. Geny byly amplifikovány odděleně. Všechny vzorky byly stanoveny nejméně v duplikátu. Kontrola bez cDNA templátu byla zařazena ke každému měření.
Data byla vyjádřena jako Ct hodnoty, tj. jako nejmenší změna fluorescence v závislosti na počtu cyklů. β-2-mikroglobulin (β2M) byl použit jako vnitřní endogenní standard pro kompenzaci použitého množství RNA v reakci a pro korekci účinnosti reverzní transkripce cDNA a PCR. Míra exprese byla vyjádřena jako relativní genová exprese a byla vypočítaná pomocí vzorce 2-∆∆(Ctcytokine-Ctβ2M).
Statistická analýza
Statistická analýza byla provedena pomocí programu SigmaStat (Jandel Scientific, USA). Výsledky jsou vyjádřeny jako průměry ± střední chyba průměru (SEM). Významnost rozdílu mezi skupinami byla stanovena nepárovým t-testem, Mann-Whitney Rank Sum testem, resp. ANOVA Student-Newman-Keuls testem. Parametry u obézních žen před dietou a po 3týdenní VLCD byly hodnoceny pomocí párového t-testu. Spearmanův test byl použit k vyhodnocení korelací mezi jednotlivými parametry.
Výsledky
Základní charakteristika souboru
Základní charakteristika souboru je uvedena v tab. 1 a 2.
V tab. 1 jsou uvedeny klinické a metabolické parametry žen, které se lišily v BMI. Při porovnání kontrolní skupiny se skupinou s nadváhou, resp. s obezitou 1. a 2. stupně či 3. stupně byl rozdíl v BMI mezi skupinami signifikantní (p < 0,01). Hodnota glykemie byla signifikantně zvýšená u pacientek s obezitou 3. stupně v porovnání s kontrolní skupinou (p < 0,05), u ostatních subjektů se koncentrace glykemie pohybovala od 4,0 do 5,3 mmol/l a statisticky se nelišila. Koncentrace inzulinu a HOMA-IR byly signifikantně vyšší u obezity 3. stupně, resp. 1. a 2. stupně v porovnání s kontrolní skupinou (p < 0,01). U žen s nadváhou byla zaznamenána tendence ke zvýšeným hladinám inzulinu, která nedosáhla statistické významnosti. Jednotlivé skupiny se významně nelišily v sérových koncentracích triglyceridů a HDL-cholesterolu.
Tab. 1. Základní charakteristika souboru sledovaných žen. 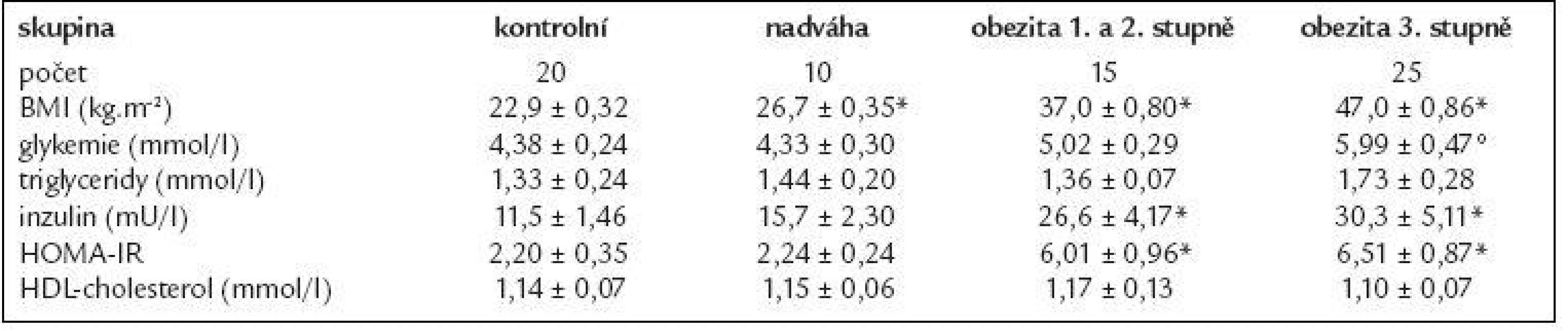
Data jsou vyjádřená jako průměr ± střední chyba průměru (SEM). *p < 0,01 vs kontrolní skupina; °p < 0,05 vs kontrolní skupina 14 morbidně obézních žen podstoupilo restrikční dietu, jejich základní údaje jsou shrnuty v tab. 2. VLCD vedla k redukci hmotnosti o 9 %, současně s poklesem BMI klesala také koncentrace glukózy, HDL-cholesterolu i inzulinu (p < 0,05). Došlo ke zlepšení inzulinové senzitivity vyjádřené pomocí HOMA-IR (p < 0,05). Koncentrace triglyceridů se vlivem VLCD významně nezměnila.
Tab. 2. Základní charakteristika skupiny žen s obezitou 3. stupně před a po VLCD. 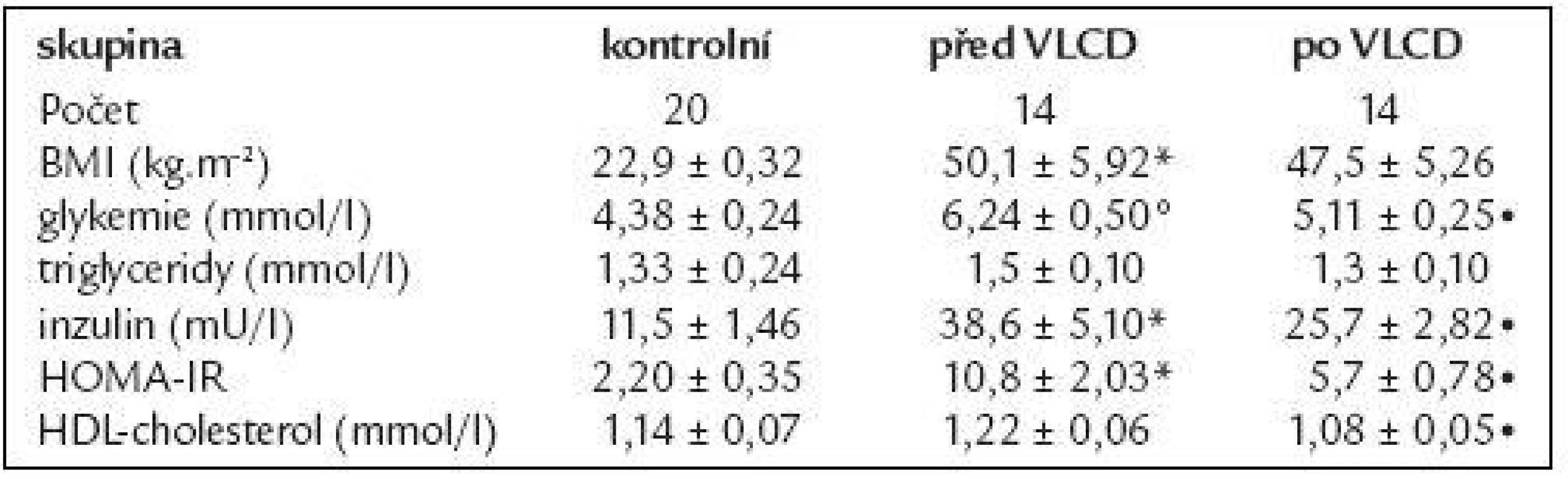
Data jsou vyjádřena jako průměr ± střední chyba průměru (SEM). *p < 0,01 vs kontrolní skupina; °p < 0,05 vs kontrolní skupina; •p < 0,05 vs obézní před a po VLCD Změny cirkulující koncentrace adiponektinu a jeho mRNA exprese ve vztahu k BMI
Změny sérových koncentrací adiponektinu a míra jeho exprese mRNA v závislosti na BMI jsou uvedeny na obr. 1. Je zřejmé, že s rostoucím BMI cirkulující hladiny adiponektinu i míra jeho exprese v subkutánní tukové tkáni klesají.
Graf 1. Sérové koncentrace adiponektinu (a) a exprese mRNA adiponektinu v subkutánní tukové tkáni (b). 
U všech skupin obézních byla zjištěna snížená sérová koncentrace adiponektinu ve srovnání s kontrolní skupinou (nadváha vs kontroly 16,81 ± 2,64 vs 30,04 ± 3,59, p = 0,01; obezita 1. a 2. stupně vs kontroly 15,83 ± 1,71 vs 30,04 ± 3,59, p = 0,002; obezita 3. stupně vs kontroly 13,06 ± 1,03 vs 30,04 ± 3,59, p < 0,001; data jsou vyjádřená jako průměr v μg/ml ± střední chyba průměru).
Exprese mRNA adiponektinu byla u pacientek s obezitou 1. a 2. stupně, resp. 3. stupně snížená v porovnání s kontrolní skupinou (p = 0,025, p < 0,001). Míra exprese mRNA adiponektinu u žen s nadváhou měla tendenci k nižším hodnotám v porovnání s kontrolní skupinou.
Vliv restrikční diety u morbidně obézních na cirkulující koncentrace adiponektinu a na míru exprese je uveden v tab. 3. Cirkulující koncentrace měly tendenci se zvyšovat po VLCD, ale změny nedosáhly statistické významnosti. Exprese mRNA adiponektinu po VLCD se nezměnila.
Tab. 3. Sérové koncentrace adiponektinu a míra jeho mRNA exprese v tukové tkáni včetně expresí receptoru AdipoR1 a AdipoR2 u žen s obezitou 3. stupně před a po redukci hmotnosti. 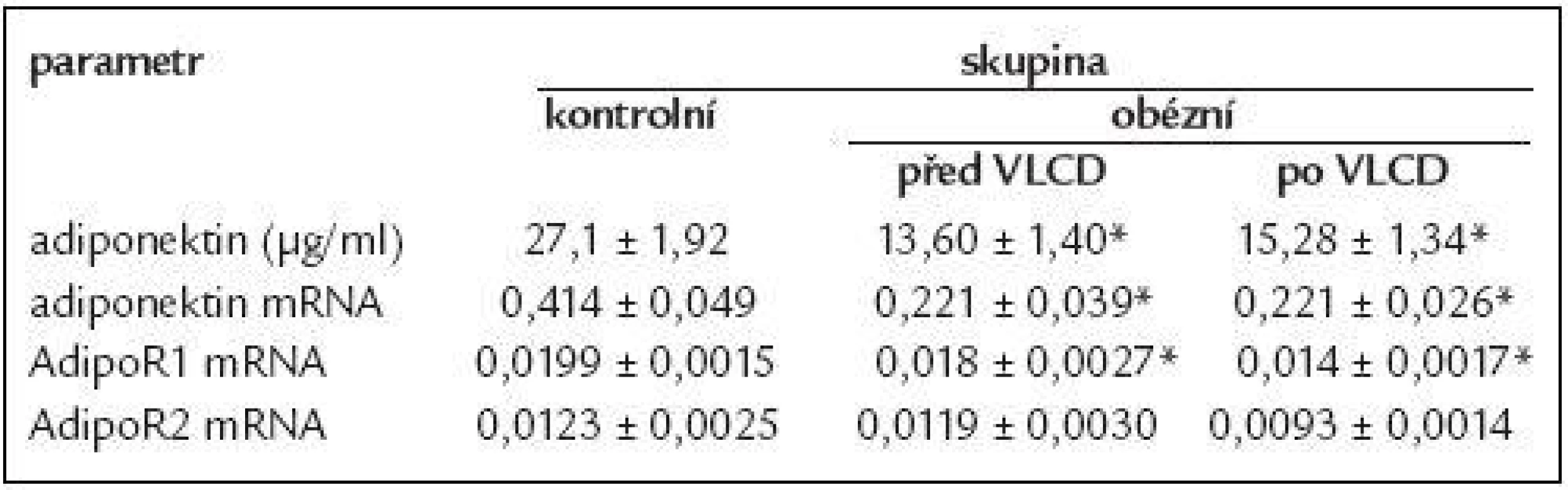
Data jsou vyjádřená jako průměr ± střední chyba průměru (SEM). * p < 0,01 vs kontrolní skupina AdipoR1 a AdipoR2 mRNA exprese v subkutánní tukové tkáni
Hodnoty exprese AdipoR1 a AdipoR2 klesají s rostoucím BMI, jak je uvedeno na obr. 2. Exprese AdipoR1 u pacientek s obezitou 3. stupně byla signifikantně nižší v porovnání s kontrolní skupinou (p = 0,013). Míra exprese mRNA AdipoR2 měla rovněž tendenci klesat s rostoucím BMI, rozdíly však nedosáhly statistické významnosti.
Graf 2. Exprese mRNA AdipoR1 (a) a AdipoR2 (b) v subkutánním tukové tkáni. 
Redukční dieta u morbidně obézních žen neměla vliv na zvýšení exprese obou receptorů, jak je uvedeno v tab. 3.
Vztah adiponektinu, AdipoR1 a AdipoR2 k BMI a biochemickým parametrům
Vztah adiponektinu, AdipoR1 a AdipoR2 ke klinickým a biochemickým parametrům byl studován v celém vyšetřovaném souboru - skupiny byly analyzovány společně (tab. 4). Sérové koncentrace adiponektinu negativně korelovaly s BMI, inzulinem a HOMA-IR, resp. pozitivně s expresí adiponektinu v subkutánní tukové tkáni a nekorelovaly s expresí AdipoR1 a AdipoR2. Obdobné korelace byly zjištěny pro mRNA expresi adiponektinu, tj. negativní korelace s BMI, inzulinem a HOMA-IR. Navíc byla zjištěna pozitivní korelace s expresí AdipoR1 (p < 0,001) a AdipoR2 (p = 0,01). Exprese AdipoR1 v subkutánní tukové tkáni negativně korelovala s BMI a inzulinem na rozdíl od AdipoR2, který s těmito parametry nekoreloval. Exprese AdipoR1 pozitivně korelovala s AdipoR2 (p < 0,001). Hladiny, resp. exprese adiponektinu a ani exprese jeho receptorů nekorelovaly s hladinami glykemie, triglyceridů či HDL-cholesterolu.
Tab. 4. Vztah adiponektinu a jeho receptorů k antropometrickým a biochemickým parametrům hodnoceným v kombinaci všech čtyř skupin (kontrolní, nadváha, obézní 1., 2. a 3. stupně). 
Diskuse
Cílem této práce bylo stanovení exprese mRNA adiponektinu a jeho receptorů v subkutánní tukové tkáni a určení do jaké míry může být exprese mRNA, resp. cirkulující koncentrace adiponektinu ovlivněna různou mírou obezity. Naše práce je jednou z prvních publikací zaměřených na podrobnou kvantifikaci změn adiponektinu a jeho receptorů u žen s nadváhou, respektive s obezitou 1. a 2. stupně.
Řada autorů již popsala, že nejen cirkulující koncentrace adiponektinu, ale i míra jeho exprese v tukové tkáni je významně ovlivněna obezitou [3,8,27]. Na rozdíl od většiny adipocytárních hormonů jako je leptin a některé cytokiny, jejichž exprese v tukové tkáni u obézních stoupá, se exprese adiponektinu naopak snižuje.
Rovněž v našem souboru žen sérové koncentrace i míra exprese adiponektinu negativně korelovaly s BMI. Významným zjištěním bylo, že ženy s nadváhou měly snížené cirkulující koncentrace adiponektinu v porovnání s kontrolní skupinou a míra jeho mRNA exprese v subkutánní tukové tkáni měla tendenci se snižovat, ale rozdíl nedosáhl statistické významnosti. Výsledky dokazují, že ke kvantitativním změnám adiponektinu v subkutánní tukové tkáni dochází již u žen s nadváhou. Exprese mRNA pro adiponektin u obezity 1. a 2. stupně byla navíc signifikantně snížená v porovnání s ženami s nadváhou (p = 0,046). V našem souboru se sérové koncentrace adiponektinu u žen s BMI < 25 pohybovaly v rozmezí 15,3-51,6 μg/ml. Otázkou je, zda nízká koncentrace adiponektinu v séru dosud štíhlých jedinců není rizikovým faktorem pro vznik obezity, resp. inzulinové rezistence, jak také uvádí Sighnal et al [28]. Jsou diskutovány různé hypotézy, podle kterých příčinou nízké koncentrace adiponektinu u štíhlých žen je kombinace vlivů genetických (jednonukleotidové polymorfizmy a mutace genu pro adiponektin) [29] a faktorů vnějšího prostředí souvisejících s obezitou, jako je sedavý způsob života a strava bohatá na tuky.
Poměrně málo informací je známo o působení AdipoR1 a AdipoR2 v organizmu, a navíc jsou tyto údaje rozporuplné. Kadowaki et al [10] uvádí, že obezita snižuje mRNA expresi jak AdipoR1, tak AdipoR2, čímž se snižuje účinek adiponektinu v cílových buňkách a dojde k zvýšení koncentrace TG v tkáních, k oxidačnímu stresu a zánětu a výsledkem těchto změn je rozvoj inzulinové rezistence [30]. AdipoR1 a AdipoR2 jsou dominantní receptory pro adiponektin, a proto mají významnou úlohu v regulaci těchto procesů in vivo.
Exprese mRNA pro AdipoR1 v našem souboru byla snížená u žen s nadváhou, resp. s obezitou 1. a 2. stupně asi o 15 %. U žen s obezitou 3. stupně bylo nalezeno snížení exprese o 25 %. Snížení mRNA exprese AdipoR1 v subkutánní tukové tkáni způsobené obezitou je tedy dalším faktorem, negativně ovlivňujícím účinek adiponektinu v cílových buňkách. Exprese AdipoR2 v subkutánním tuku má tendenci se snižovat při prvních známkách kumulace tuku v buňkách (u žen s nadváhou), tato tendence však v naší studii nedosáhla statistické významnosti. Domníváme se proto, že tento receptor přímo nesouvisí s obezitou, jak bylo také prokázáno i korelační analýzou mezi BMI a AdipoR2. Rasmussen et al [31] studovali genovou expresi adiponektinových receptorů u obézních a zjistili redukci mRNA exprese AdipoR1, resp. AdipoR2 v ST o 60 % a 30 %. Do této studie však bylo zařazeno pouze 11 žen a autoři také neuvádějí, o jaký stupeň obezity se jedná.
Obezita je ve většině případů spojena s rozvojem inzulinové rezistence. Některé studie uvádějí přímou souvislost mezi adiponektinem a inzulinovou rezistencí. Zou et al uvádějí, že adiponektin má protektivní úlohu a snižuje riziko inzulinové rezistence [32].
V našem souboru s hladinami inzulinu negativně korelovaly nejen sérové koncentrace adiponektinu, ale i jeho mRNA exprese a mRNA exprese AdipoR1. O AdipoR1 je známo, že koreluje nejen s hladinami inzulinu, ale i s koncentrací C-peptidu, triglyceridů a cholesterolu v séru. Exprese AdipoR2 souvisí hlavně s koncentrací triglyceridů v séru [30]. V našem souboru tato korelace prokázána nebyla. AdipoR1 a AdipoR2 mohou mít proto odlišnou úlohu v metabolizmu. Capeau et al uvádějí, že receptory mají dokonce opačné působení za stavu nadměrného příjmu stravy bohaté na tuky [19].
V další části naší studie jsme se zaměřili na možné ovlivnění adiponektinu a jeho receptorů dietní intervencí. VLCD u morbidně obézních žen vedla ke zlepšení antropometrických a biochemických parametrů, tj. BMI, glykemie a inzulinu, a tím přispěla ke zlepšení HOMA-IR. VLCD neměla významný vliv na cirkulující koncentrace adiponektinu, na změnu jeho exprese a expresi AdipoR1, resp. AdipoR2. Podobné skutečnosti popsali i jiní autoři [9,24,33-35]. Naopak Rasmussen et al uvádí, že mRNA exprese AdipoR1 v subkutánní tukové tkáni u obézních se po redukci hmotnosti o 12 kg zvýšila o 80 %. Energetická hodnota redukční diety ve studii Rasmussena byla 3 400 kJ/den a studie trvala 8 týdnů [31], tedy podstatně déle než v naší studii. V našem souboru se u žen po VLCD významně snížila hmotnost a zlepšila se jejich inzulinová senzitivita, z hlediska klasifikace obezity zůstaly však i po VLCD v pásmu obezity 3. stupně. To je spolu s relativně krátkým trváním diety jedním z důvodů, proč nedochází k normalizaci mRNA exprese adiponektinu, AdipoR1, resp. AdipoR2. Rovněž cirkulující koncentrace adiponektinu se nezměnily. Naše výsledky tedy nesvědčí pro úlohu adiponektinu při zlepšení inzulinové rezistence po krátkodobé VLCD [35].
Pro správnou interpretaci změn cirkulujících hladin adiponektinu je navíc nutné uvést fakt, že tento hormon je v cirkulaci přítomen v řadě izoforem o různé molekulové hmotnosti. Bylo popsáno, že sérové koncentrace multimerických izoforem adiponektinu tzv. HMW (high molecular weight) frakce korelují s inzulinovou senzitivitou lépe, než jeho hladiny celkové [36]. Vzhledem k tomu, že jsme v této studii změny jednotlivých izoforem adiponektinu neměřili, není vyloučeno, že VLCD mohla ovlivnit hladiny HMW izoformy, resp. jiné izoformy, aniž by se změnily celkové sérové koncentrace adiponektinu. Celkově se však nezdá, že zlepšení inzulinové rezistence u našeho studovaného souboru žen bylo zásadním způsobem zprostředkováno změnami cirkulujícího adiponektinu nebo jeho receptorů v subkutánní tukové tkáni.
Závěr
Hlavním zjištěním naší práce je, že již vzestup BMI v mezích nadváhy vede ke snížení sérových hladin adiponektinu. S dalším vzestupem BMI klesá i jeho exprese v subkutánní tukové tkáni zároveň s expresí mRNA pro AdipoR1. Úlohu AdipoR2 v metabolických pochodech je třeba dále podrobněji stanovit, lze však říci, že obezita pravděpodobně nemá přímý vliv na změny jeho exprese v podkožní tukové tkáni.
Podpořeno VZ MŠM 0021620814 a IGA MZ ČR 8302-5.
RNDr. Zdenka Lacinová
www.vfn.cz
e-mail: lacinova.zdenka@vfn.cz
Doručeno do redakce: 16. 4. 2007
Přijato po recenzi: 2. 8. 2007
Zdroje
1. Haffner SM, Lehto S, Ronnemaa T et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocyrdial infarction. N Engl J Med 1998; 339 : 229-234.
2. Reaven G. Metabolic syndrome: pathophysiology and implications for management of cardiovascular disease. Circulation 2002; 106 : 286-288.
3. Haluzík M, Pařízková J, Haluzík MM. Adiponectin and its role in the obesity-induced insulin resistance and related complications. Physiol Res 2004; 53 : 123-129.
4. Fasshauer M, Paschke R. Regulation of adipocytokines and insulin resistance. Diabetologia 2003; 46 : 1594-603.
5. Weyer C, Funahashi T, Tanaka S et al. Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperinsulinemia. J Clin Endocrinol Metab 2001; 86 : 1930-1935.
6. Coppack SW. Adipose tissue changes in obesity. Biochem Soc Trans 2005; 33 : 1049-1052.
7. Arita Y, Kihara S, Ouchi N et al. Paradoxal decrease of adipose-specific protein, adiponectin, in obezity. Biochem Biophys Res Commun 1999; 257 : 79-83.
8. Yang WS, Lee WJ, Funahashi T et al. Weight reduction increases plasma levels of an adipose-derived anti-inflamatory protein, adiponectin. J Clin Endocrinol Metab 2001; 86 : 3815-3819.
9. Liu YM, Lacorte JM, Viguerie N et al. Adiponectin gene expression in subcutaneous adipose tissue of obese women in response to short-term very low calorie diet and refeeding. J Clin Endocrinol Metab 2003; 88 : 5881-5886.
10. Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocrine Reviews 2005; 26 : 439-451.
11. Tsuchida A, Yamauchi T, Ito Y et al. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity. J Biol Chem 2004; 279 : 30817-30822.
12. Yamauchi T, Kamon J, Waki H et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med 2001; 7 : 941-946.
13. Shimada K, Miyazaki T, Daida H. Adiponectin and atherosclerotic disease. Clin Chim Acta 2004; 344 : 1-12.
14. Matsuzawa Y. The metabolic syndrome and adipokines. FEBS Letters 2006; 580 : 2917-2921.
15. Haluzikova D, Roubicek T, Haluzik M. Adiponectin and atherosclerosis. Vnitř Lék 2007; 53 : 359-363.
16. Yamauchi T, Kamon J, Ito Y et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature 2003; 423 : 762-769.
17. Fasshauer M, Klein J, Kralisch S et al. Growth hormone is a positive regulator of adiponectin receptor 2 in 3T3-L1 adipocytes. FEBS Lett 2004; 558 : 27-32.
18. Civitarese AE, Jenkinson CP, Richardson D et al. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of type 2 diabetes. Diabetologia 2004; 47 : 816-820.
19. Capeau J. The story of adiponectin and its receptors AdipoR1 and R2: To follow. J Hepatol 2007 [Epub, v tisku].
20. Yamauchi T, Nio Y, Maki T et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med 2007; 13 : 332-339.
21. Chen J, Tan B, Karteris E et al. Secretion of adiponectin by human placenta: differential modulation of adiponectin and its receptors by cytokines. Diabetologia 2006; 49 : 1292-1302.
22. Haluzik MM, Lacinova Z, Dolinkova M et al. Improvement of insulin sensitivity after peroxisome proliferator-activated receptor-α agonist treatemnt is accompanied by paradoxical increase of circulating resistin levels. Endocrinology 2006; 147 : 4517-4524.
23. Housova J, Anderlova K, Krizova J et al. Serum adiponectin and resistin concentrations in patients with restrictive and binge/purge form of anorexia nervosa and bulimia nervosa. J Clin Endocrinol Metab 2005; 90 : 1366-1370.
24. Anderlova K, Křemen J, Doležalova R et al. The influence of very-low-calorie diet on serum leptin, soluble leptin receptor, adiponectin and resistin levels in obese women. Physiol Res 2006; 55 : 277-283.
25. Matthews DR, Hosker JP, Rudenski AS et al. Homeostasis model asssessment: insulin resistence and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28 : 412-419.
26. Lacinová Z, Dolinková M, Haluzíková D et al. Optimalizace postupu izolace RNA z tukové tkáně. Klin Biochem Metab 2006; 14 : 96-100.
27. Kern PA, Gina B, Gregorio D et al. Adiponectin expression from human adipose tissue. Relation to obesity, insulin resistence and tumor necrosis factor-α expression. Diabetes 2003; 52 : 1779-1785.
28. Singhal A, Jamieson N, Fewtrell M et al. Adiponectin predicts insulin resistence but not endothelial function in zouny healhy adolescents. J Clin Endocrinol Metab 2005; 90 : 4615-4621.
29. Dolinkova M, Krizova J, Lacinova Z et al. Polymorphisms of adiponectin and resistin genes in patients with obesity and anorexia nervosa. Čas Lék Čes 2006; 145 : 562-566.
30. Kadowaki T, Yamauchi T, Kubota N et al. Adiponectin and adiponectin receptors in insulin resistence, diabetes and the metabolic syndrome. Clin Invest 2006; 116 : 1784-1792.
31. Rasmussen MS, Lihn AS, Pedersen SB et al. Adiponectin receptors in human adipose tissue: effects of obesity, weight loss, and fat depots. Obesity (Silver Spring) 2006; 14 : 28-35.
32. Zou CC, Liang L, Hong F. Relationship between insulin resistance and serum levels of adiponectin and resistin with childhood obesity. Indian Pediatr 2007; 44 : 275-279.
33. Kim MJ, Maachi M, Debard C et al. Increase adiponectin receptor-1 expresion in adipose tissue of impaired glucose-tolerant obese subjects during weight loss. European J Endocrinol 2006; 155 : 161-165.
34. Behre CJ, Gummesson A, Jernas M et al. Dissociation between adipose tissue expression and serum levels of adiponectin during and after diet-induced weight loss in obese subjects with and without the metabolic syndrome. Metabolism 2007; 56 : 1022-1028.
35. Garaulet M, Viguerie N, Porubsky S et al. Adiponectin gene expression and plasma values in obese women during very-low-calorie diet. Relationship with cardiovascular risk factors and insulin resistance. J Clin Endocrinol Metab 2004; 89 : 756-760.
36. Pajvani UB, Hawkins M, Combs TP et al. Complex distribution, not absolute amount of adiponectin, correlates with thiazolidinedione-mediated improvement in insulin sensitivity. J Biol Chem 2004; 279 : 12152-12162.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Využití implantabilních monitorovacích zařízení v diagnostice synkop nejasné etiologie - editorial
- N-terminální peptid pro-BNP a endotelin u hemodialyzovaných nemocných - editorial
- Adiponektin a inzulinová rezistence - editorial
- Vplyv obezity na genovú expresiu adiponektínu a jeho receptoru v subkutánnom tukovom tkanive - editorial
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Dlouhodobé výsledky srdeční resynchronizační léčby u pacientů s těžkým srdečním selháním
- Využití stanovení glykogenfosforylázy BB v diagnostice algické formy akutních koronárních syndromů
- Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
- Variabilita plazmatických hladin big endotelinu a NT-proBNP u nemocných se srdečním selháním v chronickém hemodialyzačním programu
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
- Vliv obezity na genovou expresi adiponektinu a jeho receptorů v subkutánní tukové tkáni
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Význam endoskopické cytoskopie u vyšetření trávicího traktu
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně a Společnosti infekčního lékařství České lékařské společnosti J.E. Purkyně - Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



