-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Guidelines pro léčbu mužské sexuální dysfunkce: erektilní dysfunkce a předčasná ejakulace
Autoři: E. Wespes (chair); I. Eardley; F. Giuliano; D. Hatzichristou; K. Hatzimouratidis (vice‑ chair); I. Moncada; A. Salonia; Y. Vardi
Vyšlo v časopise: Urol List 2014; 12(1): 59-90
Kategorie: Guidelines
OBSAH
- Úvod do problematiky 62
- 1.1 Úvod 62
- 1.2 Metodologie 62
- 1.3 Úrovně důkazů a stupeň doporučení 62
- 1.4 Publikační historie 62
- 1.5 Potenciální střet zájmů 63
- 1.6 Literatura 63
- Erektilní dysfunkce 63
- 2.1 Epidemiologie a rizikové faktory 63
- 2.1.1 Epidemiologie 63
- 2.1.2 Rizikové faktory 63
- 2.1.3 ED po radikální prostatektomii, radioterapii a brachyterapii 64
- 2.1.4 Léčba ED: dopad na každodenní praxi 64
- 2.1.5 Závěry týkající se epidemiologie ED 64
- 2.1.6 Literatura 64
- 2.2 Diagnostika 65
- 2.2.1 Základní postup 65
- 2.2.1.1 Sexuální anamnéza 65
- 2.2.1.2 Fyzikální vyšetření 66
- 2.2.1.3 Laboratorní vyšetření 66
- 2.2.2 Kardiovaskulární systém a sexuální aktivita: rizikový pacient 67
- 2.2.2.1 Pacienti s nízkým rizikem 67
- 2.2.2.2 Pacienti se středním nebo nejednoznačným rizikem 68
- 2.2.2.3 Pacienti s vysokým rizikem 68
- 2.2.3 Speciální diagnostické testy 68
- 2.2.3.1 Test noční tumescence a rigidity penisu 68
- 2.2.3.2 Test intrakavernózní injekce 68
- 2.2.3.3 Duplexní ultrazvukové vyšetření penisu 68
- 2.2.3.4 Arteriografie a dynamická infuzní kavernózometrie nebo kavernózografie 69
- 2.2.3.5 Psychiatrické vyšetření 69
- 2.2.3.6 Abnormality penisu 69
- 2.2.4 Poučení pacienta – konzultace a odeslání ke specialistovi 69
- 2.2.5 Guidelines pro diagnostiku ED 69
- 2.2.6 Literatura 69
- 2.2.1 Základní postup 65
- 2.1 Epidemiologie a rizikové faktory 63
- Léčba erektilní dysfunkce 70
- 3.1 Možnosti léčby 70
- 3.2 Úprava životního stylu u pacientů s ED s rizikovými faktory 70
- 3.3 Erektilní dysfunkce u pacientů po radikální prostatektomii 71
- 3.4 Příčiny ED, které mají šanci na vyléčení 71
- 3.4.1 Hormonální příčiny 71
- 3.4.2 Posttraumatická arteriogenní ED u mladších pacientů 72
- 3.4.3 Psychosexuální poradenství a léčba 72
- 3.5 Léčba první volby 72
- 3.5.1 Perorální farmakoterapie 72
- 3.5.1.1 Sildenafil 72
- 3.5.1.2 Tadalafil 73
- 3.5.1.3 Vardenafil 73
- 3.5.1.4 Volba mezi různými inhibitory PDE5/ preference 73
- 3.5.1.5 Chronická aplikace inhibitorů PDE5 nebo užívání podle potřeby (on demand) 73
- 3.5.1.6 Otázky bezpečnosti při aplikaci inhibitorů PDE5 74
- 3.5.1.6.1 Kardiovaskulární riziko 74
- 3.5.1.6.2 Nitráty jsou kontraindiko-vány u pacientů užívajících inhibitory PDE5 74
- 3.5.1.6.3 Antihypertenziva 74
- 3.5.1.6.4 Lékové interakces α‑blokátory 74
- 3.5.1.6.5 Modifikace dávkování 75
- 3.5.1.7 Léčba pacientů, u nichž selhala aplikace inhibitorů PDE5 75
- 3.5.1.7.1 Kontrola, zda pacient užívá registrovanou medikaci 75
- 3.5.1.7.2 Kontrola, zda byl pacientovi předepsán správný lék a zda pacient dodržuje správné užívání 75
- 3.5.1.7.3 Možnosti u pacientů, kteří dodržují správné užívání inhibitorů PDE5 75
- 3.5.2 Vakuová erekční zařízení 76
- 3.5.3 Terapie rázovou vlnou 76
- 3.5.1 Perorální farmakoterapie 72
- 3.6 Léčba druhé volby 76
- 3.6.1 Intrakavernózní injekce 76
- 3.6.1.1 Alprostadil 76
- 3.6.1.2 Kombinovaná terapie 77
- 3.6.1.3 Intrauretrální aplikace alprostadilu 77
- 3.6.1 Intrakavernózní injekce 76
- 3.7 Léčba třetí volby (penilní protéza) 77
- 3.7.1 Účinnost a spokojenost pacientů s léčbou 78
- 3.7.2 Komplikace 78
- 3.7.3 Závěr 78
- 3.8 Guidelines pro léčbu ED 78
- 3.9 Literatura 78
- Předčasná ejakulace 81
- 4.1 Úvod 81
- 4.2 Definice PE 81
- 4.2.1 Přehled 81
- 4.2.2 Klasifikace 82
- 4.3 Epidemiologie 82
- 4.3.1 Prevalence 82
- 4.3.2 Patofyziologie a rizikové faktory 83
- 4.4 Vliv na kvalitu života 83
- 4.5 Diagnostika 83
- 4.5.1 Doba latence ejakulace intravaginálně (IELT) 83
- 4.5.2 Dotazníky pro hodnocení PE 84
- 4.5.3 Fyzikální vyšetření 84
- 4.6 Doporučení pro diagnostiku PE 84
- 4.7 Literatura 84
- 4.8 Léčba 85
- 4.8.1 Psychologická/ behaviorální terapie 85
- 4.8.1.1 Doporučení pro psychologickou/ behaviorální terapii PE 86
- 4.8.2 Topická anestetika 86
- 4.8.2.1 Krém obsahující lidokain‑prilokain 86
- 4.8.2.2 SS krém (severance secret cream) 86
- 4.8.2.3 Doporučení pro topickou terapii PE 86
- 4.8.3 Selektivní inhibitory zpětného vychytávání serotoninu 86
- 4.8.3.1 Dapoxetin 87
- 4.8.3.2 Doporučení pro léčbu PE 88
- 4.8.4 Inhibitory fosfodiesterázy - 5 88
- 4.8.4.1 Doporučení pro využití inhibitorů PDE5 v rámci léčby PE 88
- 4.8.5 Další preparáty 89
- 4.8.6 Doporučení pro léčbu PE 89
- 4.8.1 Psychologická/ behaviorální terapie 85
- 4.9 Literatura 89
- Závěr 90
- Zkratky užité v textu 90
1. Úvod do problematiky
1.1 Úvod
Erektilní dysfunkce (ED) a předčasná ejakulace (PE) představují dva nejčastější problémy v oblasti sexuálního života pacientů mužského pohlaví [1,2]. Nová perorální medikamentózní léčba způsobila zásadní převrat v diagnostice a léčbě erektilní dysfunkce. Centrum pro publikaci guidelines Evropské urologické asociace sestavilo panel odborníků pro aktualizaci stávajících EAU guidelines pro léčbu ED nebo impotence [3,4].
1.2 Metodologie
Členové panelu provedli systematický průzkum literatury v rámci databáze Medline. Ve slovníku databáze MeSH (Medical Subject Headings) byly vyhledávány termíny: „erektilní dysfunkce“, „sexuální dysfunkce“ a „ejakulace“. Průzkum databáze Medline byl dále doplněn o vyhledávání termínu „předčasná ejakulace“.
Pro účely guidelines byly vybrány všechny články publikované od ledna 2009 (předchozí aktualizace) do ledna 2013. Členové panelu se současně zaměřili na identifikaci nejvýznamnějších problémů, mezer v poznatcích a na stanovení priorit pro budoucí klinický výzkum.
1.3 Úroveň důkazů a stupeň doporučení
Informace uveřejněné v těchto guidelines byly hodnoceny na základě úrovně jednotlivých důkazů (level of evidence) a byly klasifikovány na základě stupně doporučení, které odpovídají definicím uvedeným v tab. 1 a 2 (podle Oxfordského centra pro medicínu založenou na důkazech) [5]. Cílem tohoto systému je zprostředkovat transparentní vztah mezi dostupnými důkazy a příslušným doporučením.
Při klasifikaci doporučení není souvislost mezi úrovní důkazu a stupněm doporučení přímočará. Důkaz publikovaný v RCT nemusí být automaticky hodnocen jako doporučení stupně A, pokud jsou publikované výsledky nekonzistentní nebo jsou shledány metodologické nedostatky. A naopak, absence důkazů vyšší úrovně nevylučuje udělení doporučení stupně A, pokud lze konkrétní důkaz podpořit rozsáhlými klinickými zkušenostmi nebo konsenzem odborníků. Existují výjimky v případě, že nelze provést průkazné studie, kupříkladu z etických nebo jiných důvodů, a nejednoznačná doporučení jsou považována za užitečná.
Podobné případy jsou v textu označeny jako „povýšení hodnocení na základě konsenzu panelu odborníků“. Kvalitu příslušných vědeckých důkazů (jakkoli se jedná o významný faktor) je třeba při volbě příslušného stupně uvážit v kontextu benefitů, limitací, preferencí a nákladů [4 – 6].
Autoři EAU Guidelines neprovádí analýzu nákladů ani systematicky nehodnotí preference na lokální/ národní úrovni. Autoři uvádějí tuto informaci pouze v případě, že je k dispozici.
1.4 Publikační historie
První verze EAU Guidelines pro léčbu erektilní dysfunkce byla uveřejněna v roce 2000 [6] a v následujících letech (2001, 2002, 2004, 2005 a 2009) byly publikovány aktualizace tohoto dokumentu. Zejména publikace z roku 2009 představuje významný posun oproti předchozím verzím díky zařazení problematiky předčasné ejakulace. Současně s tímto vydáním byl titul přejmenován na „EAU Guidelines pro léčbu mužské sexuální dysfunkce“ [7]. V roce 2011 se členové panelu rozhodli publikovat samostatné guidelines zabývající se problematikou zakřivení penisu (uveřejněno 2012) [8].
V odborném časopise EUA European Urology bylo otištěno několik vědeckých souhrnů [3,4,9,10].
K dispozici jsou rovněž zkrácené verze guidelines („kapesní guidelines“) obsahující nejdůležitější informace z guidelines pro léčbu mužské sexuální dysfunkce a guidelines pro léčbu zakřivení penisu, které jsou rovněž periodicky aktualizovány současně s původními verzemi. Všechny dokumenty jsou k dispozici na webové stránce EUA, odkud je možné si je stáhnout pro osobní potřebu. Na webu lze rovněž nalézt překlady jednotlivých národních urologických společností: http:/ / www.uroweb.org/ guidelines/ online ‑ guidelines.
Kapitoly týkající se erektilní dysfunkce byly před uveřejněním dokumentu nezávisle recenzovány.
1.5 Potenciální střet zájmů
Členové panelu podali vyjádření týkající se potenciálního střetu zájmů, které lze rovněž nalézt na webu EAU: http:/ / www.uroweb.org/ guidelines/ online ‑ guidelines.
1.6 Literatura
1. Lindau ST, Schumm LP, Laumann EO et al. N Engl J Med 2007; 357(8): 762 – 774.
2. Rosenberg MT, Sadovsky R. Identification and diagnosis of premature ejaculation. Int J Clin Pract 2007; 61(6): 903 – 908.
3. Wespes E, Amar E, Hatzichristou D et al. Guidelines on erectile dysfunction. Eur Urol 2002; 41(1): 1 – 5.
4. Hatzimouratidis K, Amar E, Eardley I et al. European Guidelines on male sexual dysfunction: erectile dysfunction and premature ejaculation. Eur Urol 2010; 57(5): 804 – 814. doi: 10.1016/ j.eururo.2010.02.020.
5. Oxford Centre for Evidence‑based Medicine – Levels of Evidence. Available from:. http:/ / www.cebm.net/ index.aspx?o=1025.
6. Wespes E, Amar E, Hatzichristou D et al. EAU Guidelines on erectile dysfunction. Brussell: EAU Annual Congress 2000.
7. Wespes E, Amar E, Eardley I et al. EAU Guidelines on male sexual dysfunction (erectile dysfunction and premature ejaculation). Stockholm: EAU Annual Congress 2009.
8. Wespes E, Hatzimouratidis K, Eardley I et al. EAU Guidelines on penile curvature. Paris: EAU Annual Congress 2012.
9. Wespes E, Amar E, Hatzichristou D et al. EAU Guidelines on erectile dysfunction: an update. Eur Urol 2006; 49(5): 806 – 815.
10. Hatzimouratidis K, Eardley I, Giuliano F et al. EAU guidelines on penile curvature. Eur Urol 2012; 62(3): 543 – 552. doi: 10.1016/ j.eururo.2012.05.040.
2. Erektilní dysfunkce
2.1 Epidemiologie a rizikové faktory
Erekce je neuro‑vaskulárně‑tkáňový fenomén pod hormonální kontrolou. Erekce zahrnuje následující fáze: dilataci arterií, relaxaci trabekulární hladké svaloviny a aktivaci korporálního venookluzivního mechanizmu [1,2].
Erektilní dysfunkce je definována jako přetrvávající neschopnost dosáhnout dostatečné erekce, která zajistí uspokojivý pohlavní styk, a tuto erekci udržet. Ačkoli se jedná o benigní stav, erektilní dysfunkce může narušovat psychické i psychosociální zdraví pacienta a může významným způsobem zhoršovat kvalitu jeho života (QoL) i jeho partnerek [3]. Stále více důkazů nasvědčuje tomu, že ED může být časným projevem onemocnění věnčitých tepen a onemocnění periferních cév. ED tedy nelze chápat pouze jako fenomén narušující kvalitu života pacienta, ale rovněž jako potenciální varovný signál poukazující na riziko kardiovaskulárního onemocnění [4 – 8].
2.1.1 Epidemiologie
Epidemiologické údaje prokazují celosvětově vysokou prevalenci i incidenci erektilní dysfunkce. První velkou komunitní studií (kde jsou subjekty vybírány z běžné populace) zabývající se problematikou ED je studie MMAS (Massachusetts male aging study) [3]. Studie uvádí celkem 52% prevalenci ED u neléčených mužů ve věku 40 – 70 let s trvalým pobytem v oblasti Bostonu; specifická prevalence mírné formy ED činila 17,2 %, středně závažné formy ED 25,2 % a závažné formy ED 9,6 %. Studie z Kolína nad Rýnem zahrnující muže ve věku 30 – 80 let uvádí 19,2% prevalenci ED. Spolu se zvyšujícím se věkem subjektů byl zaznamenán prudký nárůst incidence – ze 2,3 % na 53,4 % [9]. Průzkum NHSLS (national health and social life survey) uvádí 31% prevalenci sexuální dysfunkce u mužů (neomezuje se výhradně na ED) [10]. Nejrůznější studie uvádějí různou incidenci ED (údaj vyjadřuje počet nových případů na 1 000 mužů/ rok): studie MMAS 26 [11], brazilská studie 65,6 (průměrná délka sledování 2 roky) [12] a nizozemská studie 19,2 (průměrná délka sledování 4,2 roku) [13]. Tchai ‑ wanská studie uvádí 27% prevalenci ED ve studované populaci celkem a 29% prevalenci ED u mužů ve věku ≥ 40 let [14]. Ve studii z Ghany byla zjištěna 59,6% prevalence ED a byla zaznamenána pozitivní korelace mezi ED, celkovým pocitem nespokojenosti, věkem a dalšími formami sexuální dysfunkce [15]. Rozdíly mezi těmito studiemi lze připisovat odlišné metodologii, rozdílnému věku subjektů a odlišným socioekonomickým a kulturním podmínkám studované populace.
Epidemiologické studie přinášejí konzistentní a přesvědčivé důkazy o existenci souvislosti mezi symptomy dolních cest močových (LUTS)/ benigní hyperplazií prostaty (BPH) a sexuální dysfunkcí u starších mužů, a to bez ohledu na věk pacienta, ostatní komorbidity a životní styl [16]. Studie MSAM ‑ 7 systematicky zkoumá souvislost mezi LUTS a sexuální dysfunkcí u více než 12 000 mužů ve věku 50 – 80 let. Tato studie probíhala v USA a dalších šesti evropských státech (Francie, Německo, Itálie, Nizozemsko, Španělsko a Velká Británie). 83 % jedinců se považovalo za sexuálně aktivní a 71 % mužů uvedlo, že v průběhu uplynulých čtyř týdnů se věnovali sexuální aktivitě alespoň jedenkrát. Celková prevalence LUTS u mužů zařazených do studie činila 90 %. Pouze 19 % mužů s LUTS vyhledalo lékařskou pomoc a pouze 11 % pacientů podstoupilo léčbu. Celková prevalence ED činila 49 % a 10 % pacientů uvedlo úplnou absenci erekce. Celková prevalence ejakulační dysfunkce činila 46 % a 5 % pacientů uvedlo úplnou absenci ejakulace [17].
2.1.2 Rizikové faktory
Některé rizikové faktory má erektilní dysfunkce společné s kardiovaskulárními onemocněními (např. nedostatečná fyzická aktivita, obezita, kouření, hypercholesterolemie a metabolický syndrom), z nichž některé může pacient sám ovlivnit. Muži s mírnou formou ED mají podobné rizikové faktory jako obecná ED populace v klinických studiích. Mírná forma ED je navíc významným indikátorem souvisejícího průvodního onemocnění. Pacienti, kteří si stěžují na mírnou ED, by tedy měli být adekvátně vyšetřeni (pro výskyt kardiovaskulárního onemocnění) [18].
Studie MMAS uvádí 70% pokles rizika ED u mužů, kteří se začali ve středním věku věnovat fyzické aktivitě (ve srovnání s neaktivními muži), a významně nižší incidenci ED u mužů, kteří se pravidelně věnovali fyzické aktivitě po dobu osmi let sledování [19]. Multicentrická, randomizovaná, otevřená studie zahrnující obézní muže s mírnou formou ED srovnává dvě skupiny: první skupina mužů se po dobu dvou let věnovala intenzivní fyzické aktivitě s následným úbytkem váhy, kontrolní skupina mužů byla pouze obecně informována o zdravé stravě a cvičení [20]. U mužů, kteří změnili svůj životní styl, byl zaznamenán významný pokles BMI (indexu tělesné hmotnosti), zvýšení skóre fyzické aktivity a zlepšení erektilní funkce. Tyto změny úzce souvisely s úbytkem váhy a stupněm fyzické aktivity.
Některé studie prokazují, že změna životního stylu a medikamentózní léčba pro zmírnění rizik kardiovaskulárních onemocnění vedou u pacientů s ED ke zlepšení sexuální funkce. Je však třeba podotknout, že pro hodnocení konkrétní role fyzické aktivity a dalších změn životního stylu v rámci prevence nebo léčby ED je nezbytné provedení dalších kontrolovaných prospektivních studií [6].
2.1.3 ED po radikální prostatektomii, radioterapii a brachyterapii
Radikální prostatektomie (RP) (otevřená, laparoskopická i robotická) představuje běžnou terapeutickou modalitu pro léčbu klinicky lokalizovaného karcinomu prostaty u mužů s očekávanou délkou zbytku života alespoň 10 let. Následky této operace však mohou mít dopad na kvalitu života pacienta. Tato skutečnost nabývá na významu spolu se stále častější detekcí karcinomu prostaty u mladších pacientů [21,22]. Výzkumy nasvědčují tomu, že u 25 – 75 % pacientů dojde po operaci ke vzniku ED [23]. Systematický přehled studií ukazuje, že na obnově potence po robotické prostatektomii se podílí řada faktorů. Tento přehled jako první prokazuje významný benefit roboticky asistované robotické radikální prostatektomie oproti retropubické radikální prostatektomii s ohledem na obnovu potence 12 měsíců po operaci [24]. Mezi laparoskopickou RP a roboticky asistovanou laparoskopickou RP však nebyl prokázán žádný významný rozdíl. V současné době nemáme dostatek důkazů, na základě kterých by bylo možné stanovit závěr, že roboticky asistovaná laparoskopická RP má jakýkoli přínos s ohledem na funkční výsledek.
Vedle věku pacienta a zachování neurovaskulárních svazků se jako hlavní faktor pro zachování erektilní funkce jeví zkušenost operatéra. Na vzniku erektilní dysfunkce po RP se podílí celá řada faktorů. Poranění kavernózního nervu spouští proapoptické (ztráta hladké svaloviny) a profibrotické (zvýšení hladiny kolagenu) faktory v corpora cavernosa. Tyto změny mohou být rovněž zapříčiněny nedostatečným okysličováním v důsledku změn v krevním zásobení kavernózních těles, k nimž může docházet při arteriálním poškození během operačního výkonu.
Zásadním faktorem, který souvisí s obnovou erektilní funkce po operaci, je status předoperační potence; vhodný kandidát pro nervyšetřící radikální prostatektomii (NSRP) by tedy měl být před operací potentní [24 – 29]. Je zřejmé, že pro zajištění erektilní funkce po RP je nezbytné zachování kavernózních nervů. Větší pozornost se v současné době rovněž zaměřuje na roli vaskulární insuficience v rámci pooperační ED [30,31]. K ED rovněž dochází často v důsledku ozařování zevním paprskem a brachyterapie indikovaných pro léčbu karcinomu prostaty.
Další mechanizmy přispívající k ED po ozařování prostaty zahrnují poranění neurovaskulárních svazků, cévního zásobení penisu a kavernózní tkáně [32,33]. Alternativní techniky pro léčbu karcinomu prostaty, jako např. kryoterapie a fokusovaný ultrazvuk o vysoké intenzitě (HIFU), jsou spojeny se srovnatelnou nebo dokonce vyšší mírou ED než operační léčba nebo radioterapie [34,35].
2.1.4 Léčba ED: dopad na každodenní praxi
Pokroky v základním a klinickém výzkumu erektilní dysfunkce v uplynulých 15 letech vedly ke vzniku celé řady nových terapeutických modalit, včetně nových farmak pro intrakavernózní, intrauretrální i perorální aplikaci [36 – 38]. Rekonstrukční vaskulární operace je vyhrazena pro vybrané případy arteriální insuficience. Vzhledem k celkově špatnému výsledku neexistuje v současné době žádná indikace pro operace spočívající v podvazu žilního odtoku [39,40].
Díky zvyšujícímu se veřejnému povědomí o problematice erektilní dysfunkce a dostupnosti účinné, bezpečné perorální léčby se snadným užíváním vyhledává v současné době lékařskou pomoc stále více mužů. Bohužel ne všichni lékaři disponují adekvátními znalostmi a klinickými zkušenostmi s léčbou sexuálních poruch. V tomto případě jsou muži před zahájením léčby neadekvátně (nebo dokonce vůbec) vyšetřeni, v důsledku čehož není léčeno průvodní onemocnění, které může být příčinou erektilní dysfunkce. Někteří muži bez ED mohou vyžadovat léčbu pouze z toho důvodu, aby podpořili svůj sexuální výkon.
2.1.5 Závěry týkající se epidemiologie ED (příloha 1)
Příloha 1. Závěry týkající se epidemiologie ED. 
2.1.6 Literatura
1. Lue TF, Tanagho EA. Physiology of erection and pharmacological management of impotence. J Urol 1987; 137(5): 829 – 836.
2. Gratzke C, Angulo J, Chitaley K et al. Anatomy, physiology, and pathophysiology of erectile dysfunction. J Sex Med 2010; 7(1 Pt 2): 445 – 475. doi: 10.1111/ j.1743 - 6109.2009.01624.x.
3. Feldman HA, Goldstein I, Hatzichristou DG et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study. J Urol 1994; 151(1): 54 – 61.
4. Jackson G, Boon N, Eardley I et al. Erectile dysfunction and coronary artery disease prediction: evidence‑based guidance and consensus. Int J Clin Pract 2010; 64(7): 848 – 857. doi: 10.1111/ j.1742 - 1241.2010.02410.x.
5. Dong JY, Zhang YH, Qin LQ. Erectile dysfunction and risk of cardiovascular disease: meta‑analysis of prospective cohort studies. J Am Coll Cardiol 2011; 58(13): 1378 – 1385. doi: 10.1016/ j.jacc.2011.06.024.
6. Gupta BP, Murad MH, Clifton MM et al. The effect of lifestyle modification and cardiovascular risk factor reduction on erectile dysfunction: a systematic review and meta‑analysis. Arch Intern Med 2011; 171(20): 1797 – 1803. doi: 10.1001/ archinternmed.2011.440.
7. Guo W, Liao C, Zou Y et al. Erectile dysfunction and risk of clinical cardiovascular events: a meta‑analysis of seven cohort studies. J Sex Med 2010; 7(8): 2805 – 2816. doi: 10.1111/ j.1743 - 6109.2010.01792.x.
8. Batty GD, Li Q, Czernichow S et al. Erectile dysfunction and later cardiovascular disease in men with type 2 diabetes: prospective cohort study based on the ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified ‑ Release Controlled Evaluation) trial. J Am Coll Cardiol 2010; 56(23): 1908 – 1913. doi: 10.1016/ j.jacc.2010.04.067.
9. Braun M, Wassmer G, Klotz T et al. Epidemiology of erectile dysfunction: results of the ‘Cologne Male Survey’. Int J Impot Res 2000; 12(6): 305 – 311.
10. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA 1999; 281(6): 537 – 544.
11. Johannes CB, Araujo AB, Feldman HA et al.Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusetts male aging study. J Urol 2000; 163(2): 460 – 463.
12. Moreira ED Jr, Lbo CF, Diament A et al. Incidence of erectile dysfunction in men 40 to 69 years old: results from a population‑based cohort study in Brazil. Urology 2003; 61(2): 431 – 436.
13. Schouten BW, Bosch JL, Bernsen RM et al. Incidence rates of erectile dysfunction in the Dutch general population. Effects of definition, clinical relevance and duration of follow‑up in the Krimpen Study. Int J Impot Res 2005; 17(1): 58 – 62.
14. Hwang TI, Tsai TF, Lin YC et al. A survey of erectile dysfunction in Taiwan: use of the erection hardness score and quality of erection questionnaire. J Sex Med 2010; 7(8): 2817 – 2824. doi: 10.1111/ j.1743 - 6109.2010.01837.x.
15. Amidu N, Owiredu WK, Woode E et al. Prevalence of male sexual dysfunction among Ghanaian populace: myth or reality? Int J Impot Res 2010; 22(6): 337 – 342. doi: 10.1038/ ijir.2010.24.
16. Seftel AD, de la Rosette J, Birt J et al. Coexisting lower urinary tract symptoms and erectile dysfunction: a systematic review of epidemiological data. Int J Clin Pract 2013; 67(1): 32 – 45. doi: 10.1111/ ijcp.12044.
17. Rosen R, Altwein J, Boyle P et al. Lower urinary tract symptoms and male sexual dysfunction: the multinational survey of the aging male (MSAM ‑ 7). Eur Urol 2003; 44(6): 637 – 649.
18. Lee JC, Bénard F, Carrier S et al. Do men with mild erectile dysfunction have the same risk factors as the general erectile dysfunction clinical trial population? BJU Int 2011; 107(6): 956 – 960. doi: 10.1111/ j.1464 - 410X.2010.09691.x.
19. Derby CA, Mohr BA, Goldstein I et al. Modifiable risk factors and erectile dysfunction: can lifestyle changes modify risk? Urology 2000; 56(2): 302 – 306.
20. Esposito K, Giugliano F, Di Palo C et al. Effect of lifestyle changes on erectile dysfunction in obese men: a randomized controlled trial. JAMA 2004; 291(24): 2978 – 2984.
21. Salonia A, Burnett AL, Graefen M et al. Prevention and management of postprostatectomy sexual dysfunctions. Part 1: choosing the right patient at the right time for the right surgery. Eur Urol 2012; 62(2): 261 – 272. doi: 10.1016/ j.eururo.2012.04.046.
22. Salonia A, Burnett AL, Graefen M et al. Prevention and management of postprostatectomy sexual dysfunctions part 2: recovery and preservation of erectile function, sexual desire, and orgasmic function. Eur Urol 2012; 62(2): 273 – 286. doi: 10.1016/ j.eururo.2012.04.047.
23. Sanda MG, Dunn RL, Michalski J et al. Quality of life and satisfaction with outcome among prostate ‑ cancer survivors. N Engl J Med 2008; 358(12): 1250 – 1261. doi: 10.1056/ NEJMoa074311.
24. Ficarra V, Novara G, Ahlering TE et al. Systematic review and meta‑analysis of studies reporting potency rates after robot ‑ assisted radical prostatectomy. Eur Urol 2012; 62(3): 418 – 430. doi: 10.1016/ j.eururo.2012.05.046.
25. Hatzimouratidis K, Burnett AL, Hatzichristou D et al.Phosphodiesterase type 5 inhibitors in postprostatectomy erectile dysfunction: a critical analysis of the basic science rationale and clinical application. Eur Urol 2009; 55(2): 334 – 347. doi: 10.1016/ j.eururo.2008.10.028.
26. Magheli A, Burnett AL. Erectile dysfunction following prostatectomy: prevention and treatment. Nat Rev Urol 2009; 6(8): 415 – 427. doi: 10.1038/ nrurol.2009.126.
27. Ferronha F, Barros F, Vaz Santos V et al. Is there any evidence of superiority between retropubic, laparoscopic or robot ‑ assisted radical prostatectomy? International Braz J Urol 2011; 37(2): 146 – 158, discussion: 159 – 160.
28. Barry MJ, Gallagher PM, Skinner JS et al. Adverse effects of robotic ‑ assisted laparoscopic versus open retropubic radical prostatectomy among a nationwide random sample of medicare‑age men. J Clin Oncol 2012; 30(5): 513 – 518. doi: 10.1200/ JCO.2011.36.8621.
29. Vickers A, Savage C, Bianco F et al. Cancer control and functional outcomes after radical prostatectomy as markers of surgical quality: analysis of heterogeneity between surgeons at a single cancer center. Eur Urol 2011; 59(3): 317 – 322. doi: 10.1016/ j.eururo.2010.10.045.
30. Mulhall JP, Slovick R, Hotaling J et al. Erectile dysfunction after radical prostatectomy: hemodynamic profiles and their correlation with the recovery of erectile function. J Urol 2002; 167(3): 1371 – 1375.
31. Secin FP, Touijer K, Mulhall J et al. Anatomy and preservation of accessory pudendal arteries in laparoscopic radical prostatectomy. Eur Urol 2007; 51(5): 1229 – 1235.
32. van der Wielen GJ, Mulhall JP, Incrocci L. Erectile dysfunction after radiotherapy for prostate cancer and radiation dose to the penile structures: a critical review. Radiother Oncol 2007; 84(2): 107 – 113.
33. Stember DS, Mulhall JP. The concept of erectile function preservation (penile rehabilitation) in the patient after brachytherapy for prostate cancer. Brachytherapy 2012; 11(2): 87 – 96. doi: 10.1016/ j.brachy.2012.01.002.
34. Cordeiro ER, Cathelineau X, Thüroff S et al. High‑intensity focused ultrasound (HIFU) for definitive treatment of prostate cancer. BJU Int 2012; 110(9): 1228 – 1242. doi: 10.1111/ j.1464 - 410X.2012.11262.x.
35. Williams SB, Lei Y, Nguyen PL et al. Comparative effectiveness of cryotherapy vs brachytherapy for localised prostate cancer. BJU Int 2012; 110(2 Pt 2): E92 – E98. doi: 10.1111/ j.1464 - 410X.2011.10775.x.
36. Goldstein I, Lue TF, Padma ‑ Nathan H et al. Oral sildenafil in the treatment of erectile dysfunction. 1998. J Urol 2002; 167(2 Pt 2): 1197 – 1203.
37. Hellstrom WJ, Gittelman M, Karlin G et al. Sustained efficacy and tolerability of vardenafil, a highly potent selective phosphodiesterase type 5 inhibitor, in men with erectile dysfunction: results of a randomized, double‑blind, 26‑week placebo ‑ controlled pivotal trial. Urology 2003; 61 (4 Suppl 1): 8 – 14.
38. Brock GB, McMahon CG, Chen KK et al. Efficacy and safety of tadalafil for the treatment of erectile dysfunction: results of integrated analyses. J Urol 2002; 168(4 Pt 1): 1332 – 1336.
39. Wespes E, Schulman C. Venous impotence: pathophysiology, diagnosis and treatment. J Urol 1993; 149(5 Pt 2): 1238 – 1245.
40. Rao DS, Donatucci CF. Vasculogenic impotence. Arterial and venous surgery. Urol Clin North Am 2001; 28(2): 309 – 319.
2.2 Diagnostika
2.2.1 Základní postup
Prvním krokem při vyšetřování pacientů s ED je vždy odebrání lékařské a sexuální anamnézy, v ideálním případě i s partnerkou pacienta [1,2]. Partnerka obvykle není přítomna při úvodním vyšetření, ale je vhodné ji pozvat na další sezení. Patofyziologie ED může být vaskulogenní, neurogenní, anatomická nebo hormonální, může být vyvolána užíváním medikamentů a/ nebo může být psychogenní (tab. 3) [3]. Podrobná lékařská anamnéza může odhalit přítomnost některé z častých poruch souvisejících s ED. Při odběru anamnézy je důležité navodit uvolněnou atmosféru, což usnadní dotazování na erektilní funkci a další aspekty sexuální anamnézy. Příjemná atmosféra je rovněž užitečná pro vysvětlení diagnostického a terapeutického přístupu pacientovi i jeho partnerce.
2.2.1.1 Sexuální anamnéza
Sexuální anamnéza musí zahrnovat (pokud je to možné) informace o současných i předchozích sexuálních vztazích, o současném emočním rozpoložení pacienta, době nástupu a trvání problémů s erekcí, předchozích konzultacích s lékařem a případné léčbě.
Užitečnou informaci rovněž představuje zdravotní stav partnerky po sexuální stránce. Dále je třeba pečlivě zaznamenat údaje týkající se tvrdosti a trvání ranní erekce a erekce navozené sexuální stimulací a jakékoli problémy se vzrušivostí, ejakulací a orgazmem. Při hodnocení různých oblastí sexuálního života (tj. libido, orgazmická funkce, ejakulace, pohlavní styk a celková spokojenost) i hodnocení role jednotlivých terapeutických modalit se užívají validované psychometrické dotazníky jako např. IIEF (mezinárodní index erektilní dysfunkce) [4]. Psychometrická analýza rovněž podporuje užívání skóre pro hodnocení rigidity erekce jako spolehlivou a validní pomůcku v klinické praxi a klinickém výzkumu [5]. U pacientů s klinickou diagnózou deprese se doporučuje užívání škály sestávající ze dvou otázek: „Obtěžovaly Vás v uplynulém měsíci často pocity skleslosti, deprese nebo beznaděje?“ a „Prováděl jste v uplynulém měsíci běžné činnosti s minimálním zájmem či potěšením?“ [6]. Dále je třeba pacienta vyšetřit pro potenciální symptomy hypogonadizmu, zahrnující pokles energie, libida, únavu a narušení kognitivních funkcí, a rovněž symptomy dolních cest močových. Při vhodné indikaci lze užít validované dotazníky jako např. IPSS (Mezinárodní skóre prostatických symptomů).
2.2.1.2 Fyzikální vyšetření
Každý pacient musí podstoupit fyzikální vyšetření zaměřující se na močopohlavní cesty, endokrinní, vaskulární a neurologické systémy [1]. Fyzikální vyšetření může odhalit nečekaná onemocnění jako např. Peyronieho onemocnění, zvětšenou prostatu nebo její asymetrii/ uzlovitost nebo známky a symptomy nasvědčující přítomnosti hypogonadizmu (malá varlata, změny sekundárních sexuálních znaků atd.) [2]. U všech pacientů starších 40 let by mělo být provedeno rektální vyšetření. Dále se doporučuje měření krevního tlaku a tepu (pakliže nebyly měřeny v uplynulých 3 – 6 měsících). Speciální pozornost vyžadují pacienti s kardiovaskulárním onemocněním (kapitola 2.2.2).
2.2.1.3 Laboratorní vyšetření
Laboratorní testy je třeba zvolit individuálně na základě pacientových obtíží a rizikových faktorů. Může být indikováno vyšetření krevního cukru nalačno nebo HbA1c a lipidového profilu, pakliže tyto parametry nebyly hodnoceny v nedávné době. V rámci hormonálních testů je vyšetřen ranní vzorek celkového testosteronu. V případě indikace může být potřeba potvrdit hladinu celkového testosteronu pomocí biodostupného testosteronu nebo výpočtem volného testosteronu. Hraniční hodnota testosteronu, která svědčí o přítomnosti ED, je však nízká a ED je obvykle symptomem závažnějších forem hypogonadizmu [7]. Při hladinách > 8 nmol/ l je korelace mezi cirkulující hladinou testosteronu a sexuální funkcí nevýznamná (schéma 1) [7,8].
Schéma 1. Minimální diagnostický postup (základní postup) při vyšetřování pacientů s ED. 
U vybraných pacientů lze zvážit provedení doplňkových laboratorních testů jako např. měření hladiny PSA pro detekci nebo vyloučení podezření na karcinom prostaty [9]. U pacientů s nízkou hladinou testosteronu jsou indikovány další hormonální testy (např. prolaktin, luteinizační hormon). V případě abnormálního výsledku může být pacient odeslán na endokrinologické vyšetření [10,11]. Ačkoli u většiny mužů s ED fyzikální ani laboratorní vyšetření pravděpodobně nepomůže stanovit přesnou diagnózu, je třeba využít tuto příležitost pro detekci případných závažných komorbidních stavů [12].
2.2.2 Kardiovaskulární systém a sexuální aktivita: rizikový pacient
U pacientů, kteří vyhledají lékařskou pomoc z důvodu sexuální dysfunkce, byla zjištěna vysoká prevalence kardiovaskulárních onemocnění. Kardiovaskulární riziko související se sexuální aktivitou je známou skutečností. Epidemiologické studie poukazují na souvislost mezi kardiovaskulárními a metabolickými rizikovými faktory a sexuální dysfunkcí u pacientů obou pohlaví [13]. ED může u pacientů s diabetem zvýšit senzitivitu screeningu asymptomatického kardiovaskulárního onemocnění [14,15]. ED významně zvyšuje riziko kardiovaskulárního onemocnění, onemocnění věnčitých tepen, mozkové příhody a mortality na všechny příčiny. Vyšší riziko pravděpodobně nesouvisí s běžnými kardiovaskulárními rizikovými faktory [16].
Rozsáhlý výzkum se zabývá farmakologickými vlastnostmi inhibitorů fosfodiesterázy ‑ 5 (PDE5I), a to včetně jejich účinku na aktivitu hladké srdeční svaloviny a celkovou kardiovaskulární bezpečnost. Doporučení EAU Guidelines pro léčbu mužů s ED byla převzata z dříve publikovaných doporučení panelu odborníků z Princeton Consensus konference týkající se sexuální dysfunkce a kardiovaskulárního rizika [17 – 19]. Tato konference byla zaměřena na optimalizaci sexuální funkce při současné ochraně kardiovaskulární funkce. Panel odborníků uveřejnil celkem tři studie [17 – 19]. Třetí Princeton Consensus konference si stanovila dva primární cíle. První cíl spočíval v hodnocení a řešení kardiovaskulárního rizika u mužů s ED bez prokázaného kardiovaskulárního onemocnění se speciálním důrazem na identifikaci mužů s ED, kteří mohou vyžadovat doplňující kardiologické vyšetření. Druhý cíl se soustředí na přehodnocení a úpravu stávajících doporučení pro hodnocení kardiovaskulárního rizika souvisejícího se sexuální aktivitou u mužů s prokázaným kardiovaskulárním onemocněním. Tato doporučení vycházejí ze závěrů první i druhé Princeton Consensus konference: 1. důraz na fyzickou aktivitu a zátěžový test, abychom se před preskripcí léčby ujistili o tom, že kardiovaskulární funkce pacienta je schopna zajistit jeho fyzickou potřebu sexuální aktivity, a 2. důraz na souvislost mezi ED a kardiovaskulárními chorobami, které se mohou vyskytovat asymptomaticky a profitovat z redukce kardiovaskulárního rizika [19].
Pacienty s ED lze na základě kardiovaskulárního rizika rozdělit do tří kategorií (tab. 4), jež lze využít jako východisko pro terapeutický algoritmus pro zahájení nebo obnovu sexuální aktivity pacienta (schéma 2). Klinický lékař je rovněž u většiny pacientů schopen odhadnout riziko sexuální aktivity na základě stupně tolerance fyzické aktivity z anamnézy.
Tab. 4. Stratifikace na základě kardiovaskulárního rizika (na základě druhého konsenzu z Princetonu) [18]. ![Stratifikace na základě kardiovaskulárního rizika (na základě druhého konsenzu z Princetonu) [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b918743cd922b34edc3cd4676eb663a5.png)
Schéma 2. Terapeutický algoritmus pro stanovení stupně sexuální aktivity na základě kardiovaskulárního rizika u pacientů s ED (na základě třetího konsenzu z Pricetonu) [19]. ![Schéma 2. Terapeutický algoritmus pro stanovení stupně sexuální aktivity na základě kardiovaskulárního rizika u pacientů s ED (na základě třetího konsenzu z Pricetonu) [19].](https://pl-master.mdcdn.cz/media/image/847a4c95766a97064a1ef1a120c8f99e.jpg?version=1537794992)
2.2.2.1 Pacienti s nízkým rizikem
Do kategorie s nízkým rizikem se řadí pacienti, jejichž sexuální aktivita není spojena s významným rizikem. Pro tuto kategorii je charakteristická schopnost provádět středně intenzivní fyzickou aktivitu, která je definována jako ≥ 6 „metabolických ekvivalentů výdeje energie v klidovém stavu“ (METs) bez výskytu symptomů. Na základě současných poznatků o nárocích na fyzickou zátěž a emocionální stres při sexuální aktivitě není u pacientů s nízkým rizikem před zahájením (obnovou) sexuální aktivity nebo indikací léčby sexuální dysfunkce nezbytné provádět testování srdeční funkce.
2.2.2.2 Pacienti se středním nebo nejednoznačným rizikem
Tato kategorie zahrnuje jedince s neurčitým onemocněním srdce a jedince, jejichž rizikový profil vyžaduje před zahájením sexuální aktivity vyšetření. Na základě výsledku testů lze pacienty přeřadit do skupiny s nízkým nebo naopak vysokým rizikem. U některých pacientů může být pro posouzení bezpečnosti sexuální aktivity nezbytná konzultace kardiologa.
2.2.2.3 Pacienti s vysokým rizikem
Do této kategorie řadíme pacienty se závažným anebo nestabilním onemocněním srdce, u nichž je sexuální aktivita spojena s významným rizikem. U většiny pacientů s vysokým rizikem je přítomno středně závažné až závažné symptomatické srdeční onemocnění. Pacienty s vysokým rizikem je vhodné odeslat ke kardiologovi a zahájit případnou léčbu. Do té doby, než léčba povede ke stabilizaci onemocnění nebo dokud kardiolog a/ nebo internista nerozhodne, že je sexuální aktivita pro pacienta bezpečná, měl by pacient sexuálně abstinovat.
2.2.3 Speciální diagnostické testy
U většiny pacientů s ED je postačující sexuologické vyšetření, v některých případech však může být nezbytné provedení speciálních diagnostických testů (tab. 5 a 6).
Tab. 5. Indikace pro speciální diagnostické vyšetření. 
Tab. 6. Speciální diagnostické testy. 
2.2.3.1 Test noční tumescence a rigidity penisu
Test noční tumescence a rigidity penisu (NPTR) by měl pacient opakovat alespoň po dvě noci. Erekce dosahující alespoň 60% rigidity na špičce penisu, která trvá po dobu ≥ 10 min, svědčí o funkčním mechanizmu erekce [20].
2.2.3.2 Test intrakavernózní injekce
Test intrakavernózní injekce poskytuje pouze omezenou informaci o stavu cévního zásobení penisu. Za pozitivní se považuje erekce, kterou není možné ohnout a která se dostaví během 10 min po aplikaci intrakavernózní injekce a přetrvá po dobu 30 min [21]. Tento výsledek svědčí o funkční, ale nikoli nezbytně normální erektilní funkci. V tomto případě se může současně vyskytovat arteriální insuficience a/ nebo venookluzivní dysfunkce [22]. Pozitivní test prokazuje, že léčba intrakavernózní injekcí bude u pacienta účinná. Tato diagnostická metoda je však neprůkazná a v případě klinické potřeby by mělo být provedeno duplexní dopplerovské ultrazvukové vyšetření cévního zásobení penisu.
2.2.3.3 Duplexní ultrazvukové vyšetření penisu
Následující hodnoty se obecně považují za normu: maximální systolický průtok krve > 30 cm/ s a rychlost na konci diastoly < 3 cm/ s a index odporu (resistence index) > 0,8 [21]. V případě normálního výsledku duplexního vyšetření není další vyšetření cév nutné.
2.2.3.4 Arteriografie a dynamická infuzní kavernózometrie nebo kavernózografie
Arteriografie a dynamická infuzní kavernózometrie nebo kavernózografie (DICC) by měly být indikovány pouze u jedinců, u nichž zvažujeme vaskulární rekonstrukční operaci [23].
2.2.3.5 Psychiatrické vyšetření
Pacient s psychiatrickým onemocněním by měl navštívit psychiatra, který se specializuje konkrétně na tuto problematiku. U mladších pacientů (< 40 let) s dlouhotrvající primární ED může být psychiatrická konzultace vhodná ještě před zahájením vyšetřování organické poruchy.
2.2.3.6 Abnormality penisu
U pacientů, u nichž je erektilní dysfunkce zapříčiněna abnormalitou penisu, např. hypospadie, vrozené zakřivení penisu nebo Peyronieho onemocnění se zachováním rigidity, může být nezbytná operační korekce.
2.2.4 Poučení pacienta – konzultace a odeslání ke specialistovi
Během konzultace je vhodné s pacientem (a ideálně s jeho stálou partnerkou) prodiskutovat jeho potřeby a očekávání od léčby. Dále je třeba se ujistit o tom, že pacient i jeho partnerka porozuměli podstatě ED a výsledkům diagnostických testů a umožnit jim racionální volbu léčby. Poučení pacienta a jeho partnerky představuje nedílnou součást terapeutického postupu [4,25].
2.2.5 Guidelines pro diagnostiku ED (dop. 1)
Dop. 1. Guidelines pro diagnostiku ED. 
2.2.6 Literatura
1. Davis ‑ Joseph B, Tiefer L, Melman A. Accuracy of the initial history and physical examination to establish the etiology of erectile dysfunction. Urology 1995; 45(3): 498 – 502.
2. Hatzichristou D, Hatzimouratidis K, Bekas M et al. Diagnostic steps in the evaluation of patients with erectile dysfunction. J Urol 2002; 168(2): 615 – 620.
3. Lewis RW. Epidemiology of erectile dysfunction. Urol Clin North Am 2001; 28(2): 209 – 216.
4. Rosen RC, Riley A, Wagner G et al. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology 1997; 49(6): 822 – 830.
5. Mulhall JP, Goldstein I, Bushmakin AG et al. Validation of the erection hardness score. J Sex Med 2007; 4(6): 1626 – 1634.
6. Whooley MA, Avins AL, Miranda J et al. Case ‑ finding instruments for depression. Two questions are as good as many. J Gen Intern Med 1997; 12(7): 439 – 445.
7. Zitzmann M, Faber S, Nieschlag E. Association of specific symptoms and metabolic risks with serum testosterone in older men. J Clin Endocrinol Metab 2006; 91(11): 4335 – 4343.
8. O‘Connor DB, Lee DM, Corona G et al. The relationships between sex hormones and sexual function inmiddle ‑ aged and older European men. J Clin Endocrinol Metab 2011; 96(10): E1577 – E1587. doi: 10.1210/ jc.2010 - 2216.
9. Heidenreich A, Bellmunt J, Bolla M et al. EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localised disease. Eur Urol 2011; 59(1): 61 – 71. doi: 10.1016/ j.eururo.2010.10.039.
10. Morales A, Heaton JP. Hormonal erectile dysfunction. Evaluation and management. Urol Clin North Am 2001; 28(2): 279 – 288.
11. Lue TF, Giuliano F, Montorsi F et al. Summary of the recommendations on sexual dysfunctions in men. J Sex Med 2004; 1(1): 6 – 23.
12. Ghanem HM, Salonia A, Martin‑Morales A. SOP: physical examination and laboratory testing for men with erectile dysfunction. J Sex Med 2013; 10(1): 108 – 110. doi: 10.1111/ j.1743 - 6109.2012.02734.x.
13. Laumann EO, Paik A, Rosen RC. The epidemiology of erectile dysfunction: results from the National Health and Social Life Survey. Int J Impot Res 1999; 11 (Suppl 1): S60 – S64.
14. Gazzaruso C, Coppola A, Montalcini T et al. Erectile dysfunction can improve the effectiveness of the current guidelines for the screening for asymptomatic coronary artery disease in diabetes. Endocrine 2011; 40(2): 273 – 279. doi: 10.1007/ s12020 - 011 - 9523 - 9.
15. Batty GD, Li Q, Czernichow S et al. Erectile dysfunction and later cardiovascular disease in men with type 2 diabetes: prospective cohort study based on the ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified ‑ Release Controlled Evaluation) trial. J Am Coll Cardiol 2010; 56(23): 1908 – 1913. doi: 10.1016/ j.jacc.2010.04.067.
16. Dong JY, Zhang YH, Qin LQ. Erectile dysfunction and risk of cardiovascular disease: meta‑analysis of prospective cohort studies. J Am Coll Cardiol 2011; 58(13): 1378 – 1385. doi: 10.1016/ j.jacc.2011.06.024.
17. DeBusk R, Drory Y, Goldstein I et al. Management of sexual dysfunction in patients with cardiovascular disease: recommendations of The Princeton Consensus Panel. Am J Cardiol 2000; 86(2): 175 – 181.
18. Kostis J, Jackson G, Rosen R et al. Sexual dysfunction and cardiac risk (the Second Princeton Consensus Conference). Am J Cardiol 2005; 96(2): 313 – 321.
19. Nehra A, Jackson G, Miner M et al. The Princeton III Consensus recommendations for the management of erectile dysfunction and cardiovascular disease. Mayo Clin Proc 2012; 87(8): 766 – 778. doi: 10.1016/ j.mayocp.2012.06.015.
20. Hatzichristou DG, Hatzimouratidis K, Ioannides E et al. Nocturnal penile tumescence and rigidity monitoring in young potent volunteers: reproducibility, evaluation criteria and the effect of sexual intercourse. J Urol 1998; 159(6): 1921 – 1926.
21. Meuleman EJ, Diemont WL. Investigation of erectile dysfunction. Diagnostic testing for vascular factors in erectile dysfunction. Urol Clin North Am 1995; 22(4): 803 – 819.
22. Hatzichristou DG, Hatzimouratidis K, Apostolidis A et al. Hemodynamic characterization of a functional erection. Arterial and corporeal veno‑occlusive function in patients with a positive intracavernosal injection test. Eur Urol 1999; 36(1): 60 – 67.
23. Wespes E, Schulman C. Venous impotence: pathophysiology, diagnosis and treatment. J Urol 1993; 149(5 Pt 2): 1238 – 1245.
24. Rosen RC, Leiblum SR, Spector IP. Psychologically based treatment for male erectile disorder: a cognitive ‑ interpersonal model. J Sex Marital Ther 1994; 20(2): 67 – 85.
25. Hatzichristou D, Rosen RC, Broderick G et al. Clinical evaluation and management strategy for sexual dysfunction in men and women. J Sex Med 2004; 1(1): 49 – 57.
3. Léčba erektilní dysfunkce
3.1 Možnosti léčby
Primárním cílem konzultace s pacientem, který trpí erektilní dysfunkcí, je určit příčinu této poruchy a indikovat vhodnou léčbu ED, a nikoli pouze léčit samotné symptomy. ED může souviset se zvratnými rizikovými faktory, jako jsou např. životní styl pacienta nebo faktory související s medikací. Tyto faktory lze modifikovat před zahájením léčby ED nebo i během ní.
Obecně platí, že díky současným možnostem léčby lze ED účinně léčit, ale není možné ji vyléčit. Jedinou výjimkou potvrzující toto pravidlo je erektilní dysfunkce psychogenní etiologie, posttraumatická arteriogenní ED u mladších pacientů a hormonální příčina ED (např. hypogonadizmus a hyperprolaktinemie), které lze speciální léčbou potenciálně vyléčit.
Většina pacientů podstoupí léčbu, která není zaměřena na konkrétní příčinu onemocnění. Terapeutická strategie je tedy strukturovaná a závisí na účinnosti, bezpečnosti, invazivní povaze a ceně jednotlivých přístupů a rovněž na preferencích pacienta [1]. Pro volbu optimálního postupu musí být lékař obeznámen se všemi dostupnými modalitami. Dialog mezi lékařem a pacientem (případně i jeho partnerkou) má tedy zásadní roli v průběhu celé léčby.
Při zvažování terapeutických modalit je nutné zohlednit spokojenost pacienta a jeho partnerky a další faktory týkající se kvality života, účinnosti a bezpečnosti léčby. Schéma 3 uvádí terapeutický algoritmus pro pacienty s ED.
Schéma 3. Terapeutický algoritmus pro pacienty s ED. 
3.2 Úprava životního stylu u pacientů s ED s rizikovými faktory
Při základním vyšetření jsou identifikovány potenciálně zvratné rizikové faktory ED. Změnu životního stylu a modifikaci rizikových faktorů je nutné pacientovi doporučit před zahájením farmakoterapie nebo současně s ní. Případný přínos změny životního stylu může být významný zejména u jedinců s ED a specifickými kardiovaskulárními nebo metabolickými poruchami, jako jsou např. diabetes nebo hypertenze [2 – 4]. Dramatická změna životního stylu může vedle zlepšení erektilní funkce vést rovněž ke zlepšení celkové kardiovaskulární a metabolické funkce. Nejnovější studie prokazují, že úprava životního stylu přináší benefit jak s ohledem na ED, tak na celkový zdravotní stav muže [5,6].
Ačkoli pro přesné posouzení role změn životního stylu v rámci léčby ED a souvisejících kardiovaskulárních onemocnění je nutné provedení dalších studií, modifikaci životního stylu lze pacientovi doporučit jako samostatnou modalitu nebo v kombinaci s aplikací inhibitorů PDE5. Některé studie naznačují, že dramatická modifikace ostatních komorbidních stavů nebo rizikových faktorů může dokonce podpořit účinek inhibitorů PDE5 [7]. Významné zlepšení lze očekávat již tři měsíce od doby, kdy pacient začne postupně měnit své návyky [8]. Tyto výsledky je však nutné potvrdit v kvalitních, kontrolovaných, dlouhodobých studiích. Vzhledem k účinnosti farmakoterapie při léčbě ED musí kliničtí lékaři pacientům prezentovat konkrétní důkazy prokazující benefit změny životního stylu. Doufejme, že další výzkum tyto důkazy poskytne.
3.3 Erektilní dysfunkce u pacientů po radikální prostatektomii
Užívání léčiv pro podporu erektilní funkce po radikální prostatektomii má zásadní význam pro její obnovu po operaci. Několik studií prokazuje vyšší míru obnovy erektilní funkce u pacientů, kteří užívali jakoukoli medikamentózní léčbu (v rámci terapie i profylaxe) po RP. Časná rehabilitace (ve srovnání s oddálenou) erektilní funkce umožňuje zrychlit dobu obnovy potence [9].
V minulosti se pro léčbu erektilní dysfunkce po operaci užívala intrakavernózní injekce [10], uretrální mikročípky [11], vakuová zařízení [12] a penilní implantáty [13]. Intrakavernózní injekce se nadále doporučuje jako modalita pro léčbu druhé volby a implantace penilní protézy pro léčbu třetí volby pacientům, u nichž farmakoterapie nedosahuje adekvátního účinku nebo je tato léčba kontraindikována (kapitoly 3.6 a 3.7).
Skutečný převrat v léčbě erektilní dysfunkce po RP znamenal objev inhibitorů PDE5. Tato farmaka nabízejí účinnost, snadnou aplikaci, dobrou snášenlivost, vynikající bezpečnostní profil a jejich užívání mělo pozitivní dopad na QoL pacienta. Obecně platí, že u pacientů, u nichž dojde po RP ke vzniku erektilní dysfunkce, je aplikace inhibitorů PDE5 málo účinná. Tato skupina farmak je však první volbou pro léčbu pacientů, kteří podstoupili nervyšetřící (NS) operaci. Indikace inhibitorů PDE5 pro léčbu první volby je rozporuplná, protože vedle věku pacienta a typu NS techniky hraje zásadní roli v rámci zachování erektilní funkce po operaci zkušenost operatéra (počet odoperovaných případů) [14 – 16]. Nejlepší účinek přináší léčba pomocí PDE5I u mužů, kteří podstoupili velmi pečlivou NS techniku, kterou častěji provádějí zkušení operatéři [14,15].
Přepokládá se, že časná aplikace vyšších dávek sildenafilu po RP souvisí se zachováním hladké svaloviny corpora cavernosa [17]. Každodenní užívání sildenafilu vede ve srovnání s placebem rovněž k významnější obnově normální spontánní erekce po bilaterální NSRP (u pacientů, kteří byli před výkonem úplně potentní) [18,19]. Různé studie uvádějí různou míru účinnosti sildenafilu u pacientů s ED po RP v rozmezí 35 – 75 % (po NSRP) a 0 – 15 % (po non‑NSRP) [18 – 21].
V rámci léčby ED po RP byla testována účinnost preparátů tadalafilu a vardenafilu podle potřeby (on demand).
- Velká multicentrická studie zahrnující evropské státy a USA testuje účinek tadalafilu u pacientů, u nichž došlo po bilaterální NS operaci ke vzniku ED. Ke zlepšení erektilní funkce došlo u 71 % pacientů, kteří užívali 20 mg tadalafilu, a u 24 % pacientů užívajících placebo. Úspěšného pohlavního styku bylo schopno 52 % pacientů užívajících 20 mg tadalafilu vs 26 % mužů užívajících placebo [22].
- Severoamerická randomizovaná, multicentrická, prospektivní, placebem kontrolovaná studie zkoumá účinnost vardenafilu u pacientů, u nichž došlo ke vzniku ED po unilaterální nebo bilaterální NS operaci [23].
- Po bilaterální NSRP došlo ke zlepšení erektilní funkce u 71 % pacientů užívajících 10 mg vardenafilu a 60 % mužů užívajících 20 mg vardenafilu.
Rozšířená analýza zahrnující tytéž pacienty po NSRP zdůrazňuje benefit aplikace vardenafilu oproti placebu s ohledem na spokojenost pacientů s pohlavním stykem, tvrdost erekce, orgazmickou funkci a celkovou spokojenost se sexuálním výkonem [24].
Randomizovaná, dvojitě zaslepená, dvojitě maskovaná, multicentrická studie s paralelní skupinou zahrnující 87 center v Evropě, Kanadě, jižní Africe a USA srovnává užívání vardenafilu podle potřeby (on demand) vs noční užívání vardenafilu u mužů s ED po bilaterální NSRP. U pacientů, kteří měli před operací skóre ≥ 26 v IIEF ‑ EF doméně, byl vardenafil účinnější při aplikaci podle potřeby, což u pacientů po RP podporuje posun ve způsobu užívání PDEI5 [25].
Prospektivní, randomizovaná, otevřená, multicentrická americká studie zahrnující muže s normální erekcí před bilaterální NSRP prokázala, že perorální a intrauretrální léčba přináší během prvního roku po operaci stejný benefit s ohledem na obnovu funkce penisu [26]. Pacientům, u nichž není účinná perorální aplikace NSRP, může být profylakticky indikována intrakorporální aplikace alprostadilu [27,28]. U pacientů, u nichž selže perorálně i intrakavernózně podávaná farmakoterapie i vakuová zařízení, zůstává uspokojivým řešením implantace penilní protézy [29].
3.4 Příčiny ED, které mají šanci na vyléčení
3.4.1 Hormonální příčiny
U pacientů s abnormální hormonální funkcí může být užitečná konzultace endokrinologa. Nedostatek testosteronu může být důsledkem primárního testikulárního selhání nebo může mít příčinu v hypofýzo ‑ hypotalamické ose, což může zahrnovat i funkční tumor hypofýzy způsobující hyperprolaktinemii.
Substituce testosteronu (intramuskulární, perorální nebo transdermální) je účinná, ale měla by být indikována pouze po vyloučení všech ostatních endokrinologických příčin testikulárního selhání [30]. Substituce testosteronu je rozporuplná u mužů s anamnézou karcinomu prostaty (úroveň důkazu: 4) [31]. Omezené důkazy poukazují na skutečnost, že tato léčba může představovat zbytečné riziko recidivy nebo progrese karcinomu [32]. Před zahájením substituční terapie se doporučuje provedení digitálního rektálního vyšetření, PSA testu, měření hematokritu, vyšetření funkce jater a lipidového profilu [33]. U pacientů užívajících androgenní terapii je nutné monitorovat klinickou odpověď, případné zvýšení hematokritu a vznik onemocnění jater nebo prostaty. Testosteronová terapie je kontraindikována u pacientů s neléčeným karcinomem prostaty nebo nestabilním srdečním onemocněním.
3.4.2 Posttraumatická arteriogenní ED u mladších pacientů
U mladších pacientů s pánevním nebo perineálním traumatem lze pomocí revaskularizace cévního řečiště penisu dosáhnout 60 – 70% dlouhodobé míry úspěšnosti [34]. Léze musí být prokázána pomocí duplexního dopplerovského ultrazvukového vyšetření penisu a potvrzena pomocí farmakoarteriografie. Revaskularizace je kontraindikována u pacientů s korporální venookluzivní dysfunkcí; tuto poruchu je nutné vyloučit pomocí DICC. Operační léčba venookluzivní dysfunkce se vzhledem ke špatným dlouhodobým výsledkům nedoporučuje [35].
3.4.3 Psychosexuální poradenství a léčba
U pacientů se závažnou psychickou poruchou se doporučuje psychosexuální terapie buď samostatně, nebo v kombinaci s jinou terapeutickou modalitou. Psychosexuální terapie vyžaduje dlouhodobé sledování a dosahuje rozdílných výsledků [36].
3.5 Léčba první volby
3.5.1 Perorální farmakoterapie
PDE5 vyvolávají hydrolýzu cGMP v kavernózní tkáni. Inhibice PDE5 vede k relaxaci hladké svaloviny a ke zvýšenému průtoku krve arteriemi, což způsobuje kompresi venózního plexu v subtunice a ztopoření penisu [37].
Evropská agentura pro léčiva (EMA) schválila tři silné selektivní inhibitory PDE5 pro léčbu erektilní dysfunkce. Tyto preparáty nenavozují erekci přímo – pro dosažení erekce je nezbytná sexuální stimulace.
3.5.1.1 Sildenafil
Sildenafil byl prvním inhibitorem PDE5 uvedeným na trh (v roce 1998). Účinná léčba je definována jako dosažení erekce dostatečné tvrdosti umožňující vaginální penetraci. Účinek sildenafilu nastupuje 30 – 60 min po podání.
Účinnost preparátu se snižuje po konzumaci těžkých tučných jídel (z důvodu delší absorpce). Sildenafil se užívá v dávkách 25, 50 a 100 mg. Doporučená počáteční dávka je 50 mg, kterou je třeba dále modifikovat na základě účinku a výskytu vedlejších účinků. Efekt může přetrvat po dobu až 12 hod [38]. Farmakokinetická data lze najít v tab 7. Nežádoucí účinky (tab. 8) jsou obvykle mírné a při delším užívání samy vymizí. Míra ukončení léčby z důvodu výskytu nežádoucích účinků je srovnatelná s placebem [39].
Tab. 7. Přehled klíčových farmakokinetických vlastností tří inhibitorů PDE5 užívaných při léčbě ED.* 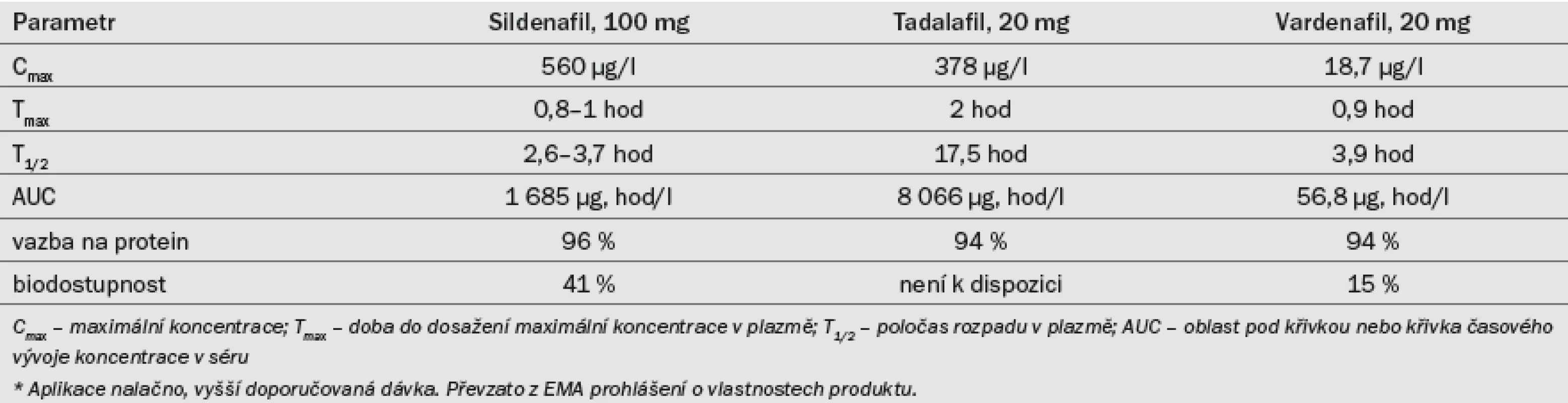
Tab. 8. Nejčastější nežádoucí účinky vyskytující se při užívání inhibitorů PDE5 při léčbě ED.* 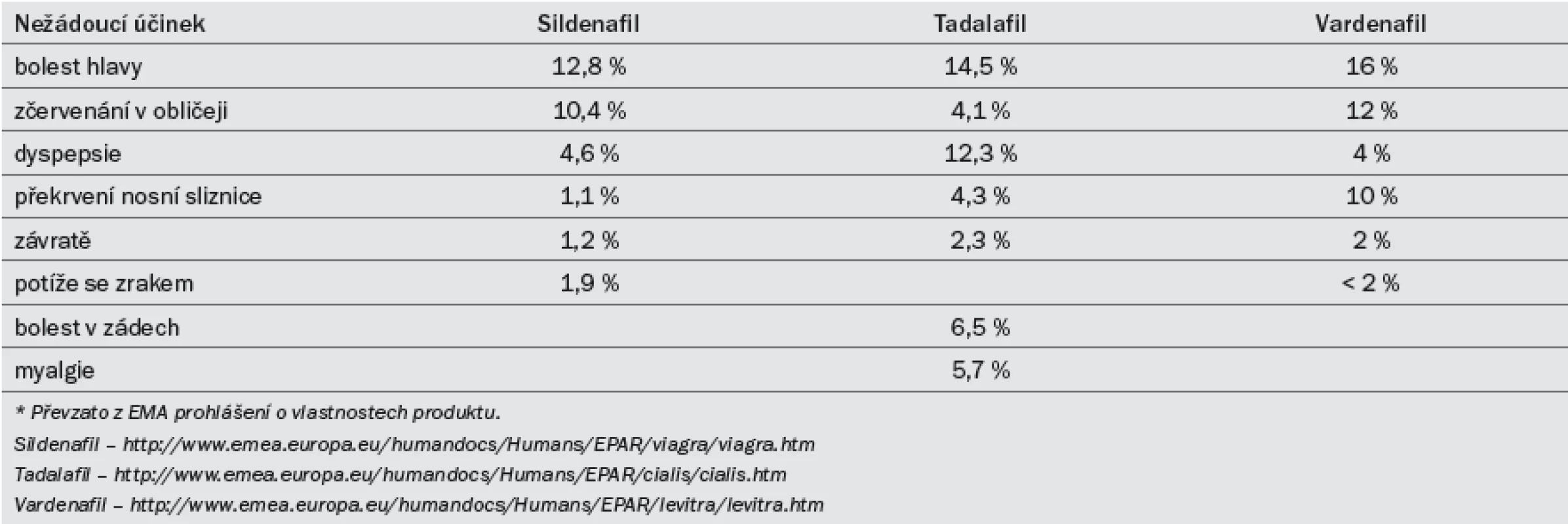
Studie testující velikost dávky uvádí po 24 týdnech léčby zlepšení erekce u 56 % mužů v obecné populaci užívajících 25 mg, u 77 % mužů užívajících 50 mg a u 84 % mužů užívajících 100 mg sildenafilu a u 25 % mužů užívajících placebo [40]. Sildenafil významně zlepšuje skóre IIEF, profil sexuální aktivity (SEP)2, SEP3, skóre obecného hodnocení (GAQ) a spokojenost pacienta s léčbou.
Účinnost sildenafilu byla hodnocena téměř ve všech subpopulacích pacientů s ED. 66,6 % diabetiků uvádí zlepšení erekce (GAQ) a 63 % uvádí úspěšný pohlavní styk ve srovnání s pouze 28,6 % a 33 % muži užívajícími placebo (v tomto pořadí) [41].
3.5.1.2 Tadalafil
Tadalafil byl registrován pro léčbu ED v únoru roku 2003. Účinek nastupuje po 30 min od podání, maximálního efektu dosahuje přibližně po dvou hodinách. Účinek přetrvá až po dobu 36 hod [42] a není ovlivněn konzumací žádných jídel. Pro léčbu ED podle potřeby (on demand) byly schváleny dávky 10 a 20 mg. Doporučená počáteční dávka je 10 mg, kterou je třeba dále modifikovat na základě efektu a výskytu vedlejších účinků. Farmakokinetická data lze najít v tab 7. Nežádoucí účinky (tab. 8) jsou obvykle mírné a při delším užívání samy vymizí. Míra ukončení léčby z důvodu výskytu nežádoucích účinků je srovnatelná s placebem [43].
Studie prováděné před uvedením preparátu na trh (po 12 týdnech léčby a studie testující dávkování) uvádějí zlepšení erekce u 67 % jedinců v obecné populaci užívajících 10 mg tadalafilu, u 81 % mužů užívajících 20 mg a u 35 % mužů užívajících placebo v kontrolní skupině [43]. Pacienti užívající tadalafil uvádějí signifikantní zlepšení skóre IIEF, SEP2, SEP3, GAQ a spokojenost s léčbou. Tyto výsledky potvrzují i studie publikované po uvedení léku na trh [44].
Tadalafil zlepšuje erekci rovněž u obtížně léčitelných subpopulací. 64 % pacientů s diabetem uvedlo zlepšení erekce (tj. zlepšení GAQ) vs 25 % pacientů v kontrolní skupině, změna konečného skóre IIEF ‑ EF činila 7,3 ve srovnání s 0,1 u placeba [45]. U diabetiků je přesto léčba podle potřeby málo účinná; úspěšný pohlavní styk uvádí 21,8 % mužů užívajících placebo, 45,4 % mužů užívajících 10 mg tadalafilu a 49,9 % mužů užívajících 20 mg tadalafilu podle potřeby [46].
3.5.1.3 Vardenafil
Vardenafil je k dispozici pro komerční účely od března roku 2003. Účinek nastupuje 30 min po podání.
Účinnost preparátu se snižuje po konzumaci těžkých tučných jídel (> 57 % tuku). Pro léčbu ED podle potřeby byl schválen vardenafil v dávkování 5, 10 a 20 mg. Doporučená počáteční dávka je 10 mg, kterou je třeba dále modifikovat na základě efektu a výskytu vedlejších účinků. In vitro je vardenafil desetinásobně silnější než sildenafil, což však nutně nemusí být ekvivalentní pro větší klinický účinek [47]. Farmakokinetická data lze najít v tab. 7. Nežádoucí účinky (tab. 8) jsou obvykle mírné a při delším užívání samy vymizí. Míra ukončení léčby z důvodu výskytu nežádoucích účinků je srovnatelná s placebem [48].
Studie testující dávkování uvádí po 12 týdnech léčby zlepšení erekce o 66 % u jedinců v obecné populaci užívajících 5 mg vardenafilu, o 76 % u mužů užívajících 10 mg a o 80 % u mužů užívajících 20 mg vardenafilu (vs 30 % v placebo kontrolní skupině) [49]. Pacienti užívající vardenafil uvádějí významné zlepšení skóre IIEF, SEP2, SEP3, GAQ a spokojenost s léčbou. Tyto výsledky potvrzují i postmarketingové studie [50].
Vardenafil zlepšuje erekci rovněž u obtížně léčitelných subpopulací. Změna konečného skóre IIEF ‑ EF činila 19 u diabetiků užívajících vardenafil ve srovnání s 12,6 u placeba [51]. U diabetiků je přesto opět léčba podle potřeby málo účinná; úspěšný pohlavní styk uvádí 23 % mužů užívajících placebo, 49 % mužů užívajících 10 mg vardenafilu a 54 % mužů užívajících 20 mg vardenafilu podle potřeby [46].
Před nedávnem byla uvedena nová forma vardenafilu – orálně dispergovatelné tablety (ODT). ODT mohou být pro pacienty příjemnější než potahované tablety a mohou být pacienty preferovány. Absorpce preparátu není ovlivněna konzumací žádných potravin a ODT vykazují lepší biodostupnost než potahované tablety [52]. Účinek vardenafilu ve formě ODT potvrzuje několik randomizovaných kontrolovaných studií a pravděpodobně se neliší od klasické formy [53 – 56].
3.5.1.4 Volba mezi různými inhibitory PDE5/ preference
Dosud nemáme k dispozici žádné údaje z dvojitě ani trojitě zaslepených multicentrických studií, které by srovnávaly účinek sildenafilu, tadalafilu a vardenafilu a/ nebo preference pacientů pro jednotlivé preparáty. Volba konkrétního preparátu závisí na četnosti pohlavního styku (příležitostné užívání nebo pravidelná léčba, 3 – 4krát týdně) a osobní zkušenosti pacienta. Pacient musí být informován o délce působení léčiva (krátce ‑ / dlouhopůsobící), potenciálních nevýhodách a způsobu užívání.
3.5.1.5 Chronická aplikace inhibitorů PDE5 nebo užívání podle potřeby (on demand)
Studie na zvířecích modelech ukazují, že dlouhodobé užívání PDE5I zlepšuje nebo působí preventivně proti změnám intrakavernózní tkáně, k nimž dochází v důsledku stárnutí, diabetu nebo poranění v důsledku operační léčby [57 – 62]. Tato data zatím nejsou dispozici v humánní medicíně.
Randomizovaná humánní studie (n = 145) ukázala, že každodenní užívání tadalafilu má za následek významně vyšší skóre IIEF ‑ EF a častější úspěšný pohlavní styk než užívání tadalafilu podle potřeby [63]. Dvě významné randomizované dvojitě zaslepené studie testující 5 a 10 mg tadalafilu denně po dobu 12 týdnů (n = 268) [64] a 2,5 a 5 mg denně po dobu 24 týdnů (n = 286) [65] ukazují, že každodenní aplikace byla pacienty dobře snášena a vedla k významnému zlepšení erektilní funkce. Obě studie však postrádají komparativní skupinu pacientů, kteří by užívali medikaci podle potřeby (on demand). Pro obě studie bylo provedeno otevřené rozšíření – 234 pacientů se zúčastnilo ročního cyklu a 238 pacientů dvouletého cyklu. Bylo zjištěno, že aplikace tadalafiu 5 mg jednou denně byla účinná a byla pacienty dobře snášena [66]. Tadalafil při dávkování 5 mg jednou denně tedy poskytuje alternativu užívání tadalafilu podle potřeby pro dvojice, které upřednostňují spontánní spíše než plánovanou sexuální aktivitu a kteří předpokládají častý pohlavní styk. V tomto případě není nutné dávkování preparátu časově synchronizovat se sexuálním životem. V otevřeném rozšíření testujícím 5 mg tadalafilu s čtyřtýdenním wash ‑ out obdobím však erektilní dysfunkce nebyla u většiny pacientů (přibližně 75 %) po ukončení terapie zachována.
Evropská agentura pro léčiva (EMA) schválila v roce 2007 tadalafil v dávkování 2,5 a 5 mg pro každodenní léčbu ED. Podle EMA lze u pacientů, kteří předpokládají časté užívání tadalafilu (tj. alespoň dvakrát týdně), doporučit aplikaci tadalafilu v dávkování 2,5 mg nebo 5 mg/ den na základě preferencí pacienta a uvážení jeho ošetřujícího lékaře. Doporučovanou dávku 5 mg je třeba užívat jednou denně přibližně ve stejnou dobu. Na základě snášenlivosti léčiva lze dávkování snížit na 2,5 mg/ jednou denně. Pacienty, kteří dlouhodobě užívají tadalafil každý den, je třeba pravidelně monitorovat.
Ve dvojitě zaslepené, placebem kontrolované, multicentrické studii s paralelní skupinou bylo 236 mužů s mírnou až středně závažnou formou ED randomizováno k aplikaci 10 mg vardenafilu jednou denně plus placebo podle potřeby po dobu 12 nebo 24 týdnů nebo aplikaci placeba jednou denně plus 10 mg vardenafilu podle potřeby po dobu 24 týdnů a následnému čtyřtýdennímu wash ‑ out období [67].
Navzdory preklinickým údajům výsledky nasvědčují tomu, že 10 mg vardenafilu nenabízí u pacientů s mírnou až středně závažnou ED po ukončení léčby žádný trvalý benefit na rozdíl od aplikace podle potřeby (on demand).
Jiné studie (otevřené, randomizované, zkřížené studie s malým vzorkem pacientů) ukazují, že dlouhodobé užívání, ale nikoli užívání podle potřeby, tadalafilu zlepšuje endoteliální funkci a poskytuje benefit i po ukončení léčby [68,69]. Tuto skutečnost potvrzuje i jiná studie testující dlouhodobou aplikaci sildenafilu u mužů s diabetem 2. typu [70].
V nedávné době provedená dvojitě zaslepená, placebem kontrolovaná studie zahrnující 298 mužů s diabetem a ED prokázala, že léčba pomocí 2,5 a 5 mg tadalafilu jednou denně po dobu 12 týdnů byla účinná a pacienty dobře snášená. Tento protokol představuje alternativu aplikace preparátu podle potřeby u některých pacientů s diabetem [70].
3.5.1.6 Otázky bezpečnosti při aplikaci inhibitorů PDE5
3.5.1.6.1 Kardiovaskulární riziko
Výsledky klinických studií i postmarketingová data prokazují, že aplikace sildenafilu, tadalafilu a vardenafilu nezpůsobuje zvýšení rizika infarktu myokardu (v rámci dvojitě zaslepených, placebem kontrolovaných studií nebo otevřených studií nebo ve srovnání s očekávanou mírou v obecné populaci odpovídajícího věku).
Žádný z inhibitorů PDE5 nevykazuje u mužů se stabilní anginou pectoris během zátěžového testu nežádoucí efekt na celkovou dobu zátěže ani dobu do vzniku ischemie [72,73]. Ve skutečnosti může tato medikace dokonce zlepšovat výsledky zátěžového testu. Podle současných důkazů užívání sildenafilu nevyvolává žádné změny v kontraktilitě srdeční svaloviny, srdečním výkonu ani spotřebě kyslíku myokardem.
Dlouhodobá aplikace i užívání podle potřeby (od demand) vykazují podobný bezpečnostní profil a oba módy jsou pacienty dobře snášeny.
3.5.1.6.2 Nitráty jsou kontraindikovány u pacientů užívajících inhibitory PDE5
Organické nitráty (např. nitroglycerin, izosorbid mononitrát a izosorbid dinitrát) a další léčiva obsahující nitráty užívané při léčbě anginy pectoris stejně jako amylnitrit nebo amylnitrát (užívané jako rekreační droga „poppers“) jsou absolutní kontraindikací pro užívání PDE5I. Tyto preparáty způsobují akumulaci cGMP a nepředvídatelný pokles krevního tlaku a symptomy hypotenze. Délka trvání interakce mezi organickými nitráty a PDE5I závisí na konkrétním typu užívaných léčiv.
Pokud pacient přesto užije inhibitor PDE5 a pociťuje bolest na prsou, je nezbytné nitroglycerin vysadit alespoň po dobu 24 hod v případě užití sildenafilu (a pravděpodobně rovněž vardenafilu – poločas rozpadu 4 hod) a po dobu alespoň 48 hod v případě tadalafilu (poločas rozpadu 17,5 hod).
Pokud se u pacienta během užívání inhibitorů PDE5 rozvine angina pectoris, musí být po určitou dobu podávána jiná medikace než nitroglycerin. V případě, že je nezbytné po ukončení aplikace inhibitorů PDE5 opět nasadit nitroglycerin, mělo by tak být učiněno až po uplynutí určitého intervalu (viz výše) a pacient musí být pečlivě monitorován.
3.5.1.6.3 Antihypertenziva
Užívání inhibitorů PDE5 současně s antihypertenzivy (inhibitory angiotensin konvertujícího enzymu, blokátory receptoru angiotensinu, blokátory kalciového kanálu, β‑blokátory a diuretiky) může vést k mírnému poklesu krevního tlaku. Tato změna však obvykle není zásadní. Obecně platí, že současná indikace antihypertenziv nezhoršuje výskyt nežádoucích účinků souvisejících s PDE5I, a to dokonce ani v případě, že pacient užívá několik různých typů antihypertenziv.
3.5.1.6.4 Lékové interakce s α‑blokátory
Všechny druhy PDE5I vykazují určitý stupeň interakce s α‑blokátory, což za určitých okolností může vést ke vzniku ortostatické hypotenze.
Balení sildenafilu v současné době obsahuje varování, že pacienti užívající α‑blokátor (zejména doxazosin) by měli při aplikaci 50 nebo 100 mg sildenafilu dbát zvýšené opatrnosti. Hypotenze se nejčastěji objeví během čtyř hodin po užití α‑blokátoru. Jako počáteční dávka se doporučuje 25 mg.
Aplikaci vardenafilu se doporučuje zahájit teprve tehdy, až je pacient užívající α‑blokátor na této léčbě stabilizován.
Současné podávání vardenafilu a tamsulosinu není spojeno s významnou hypotenzí [74].
Podávání tadalafilu se nedoporučuje u pacientů užívajících doxazosin, to však neplatí pro tamsulosin 0,4 mg [75].
Lékové interakce jsou významnější v případě, že inhibitory PDE5 užívají zdraví dobrovolníci, kteří nikdy předtím neužívali α‑blokátory. Před zahájením kombinované léčby by měl být pacient užívající α‑blokátory na této léčbě stabilizován a inhibitory PDE5 je zpočátku třeba podávat v menších dávkách.
Lékové interakce mezi PDE5I a dalšími typy α‑blokátorů (např. alfuzosin jednou denně) nebo kombinace α/ β‑blokátorů (např. carvedilol a labetalol) je třeba podrobit dalšímu výzkumu.
3.5.1.6.5 Modifikace dávkování
Léčiva inhibující dráhu CYP34A budou zpomalovat i metabolickou přeměnu PDE5I. Do této skupiny patří ketokonazol, itrakonazol, erytromycin, klaritromycin a inhibitory HIV proteázy (ritonavir a saquinavir). Vzhledem k tomu, že tato léčiva mohou zvyšovat hladinu PDE5I v krvi, může být nezbytná aplikace nižších dávek.
Další preparáty, jako např. rifampin, fenobarbital, fenytoin a karbamazepin, mohou podporovat CYP3A4 a podporovat metabolickou přeměnu PDE5I, v tomto případě může být nezbytná aplikace vyšších dávek.
U pacientů se závažnou dysfunkcí ledviny nebo jater může být nutná úprava dávkování.
3.5.1.7 Léčba pacientů, u nichž selhala aplikace inhibitorů PDE5
Dvěma hlavními důvody selhání terapie PDE5I je nesprávné užívání léčiva nebo jeho nedostatečný účinek. Další postup u pacientů, u nichž nebyla léčba účinná, závisí na průvodní příčině selhání.
3.5.1.7.1 Kontrola, zda pacient užívá registrovanou medikaci
V současné době existuje významný černý trh s inhibitory PDE5. Množství aktivní látky se v těchto preparátech značně liší. Je velmi důležité se pacienta zeptat na zdroj, odkud lék získal.
3.5.1.7.2 Kontrola, zda byl pacientovi předepsán správný lék a zda pacient dodržuje správné užívání
Hlavním důvodem nesprávného užívání medikace je nedostatečná informace od lékaře. Nesprávné užívání se může projevovat jedním z následujících způsobů:
- nedostatečná sexuální stimulace,
- užívání nesprávné dávky,
- nedostatečný interval mezi podáním léku a pokusem o sexuální styk.
Nedostatečná sexuální stimulace: účinek PDE5I závisí na uvolňování NO v zakončeních parasympatických nervů v erektilní tkáni penisu. Obvyklým stimulem pro uvolnění NO je sexuální stimulace; bez adekvátní sexuální stimulace (a tedy uvolňování NO) nemůže lék účinkovat.
Různé perorálně užívané PDE5I dosahují maximální koncentrace v plazmě za různě dlouhou dobu [76,77]. Ačkoli farmakologického účinku je dosaženo již při nižší než maximální koncentraci léku v plazmě, účinek nastupuje až po uplynutí určité doby po podání. Ačkoli u některých pacientů mohou všechny tři inhibitory PDE5 působit již po 30 min od perorální aplikace, u většiny pacientů nastupuje účinek později; nejdříve za 60 min v případě sildenafilu a vardenafilu a až dvě hodiny v případě tadalafilu [78 – 80].
Absorpce sildenafilu může být zpomalena po jídle a absorpce vardenafilu navíc po tučném jídle [81]. Absorpce tadalafilu je méně ovlivněna konzumací potravy, pakliže mezi perorální aplikací léku a pokusem o pohlavní styk uplyne dostatečný časový interval [77].
Může dojít k tomu, že pacient čeká před pokusem o sexuální aktivitu příliš dlouhou dobu. Poločas rozpadu sildenafilu a vardenafilu je 4 hod, což znamená, že normální okno účinnosti činí 6 – 8 hod po podání, ačkoli byla zaznamenána účinnost i po uplynutí tohoto intervalu. Poločas rozpadu tadalafilu je delší, přibližně 17,5 hod, díky čemuž může preparát účinkovat déle, přibližně 36 hod.
Z finančních důvodů mohou někteří lékaři předepisovat preparát pouze v nižším dávkování. Je třeba ověřit, že pacient po dostatečně dlouhou dobu užíval medikaci v maximální možné dávce. Důkazy prokazují, že adekvátní zkušební protokol zahrnuje alespoň šest aplikací konkrétního preparátu [82].
Data z nekontrolovaných studií ukazují, že adekvátní poučení pacienta může pomoci snížit procento mužů, u nichž je léčba inhibitory PDE5 neúčinná. Pacientovi je třeba vysvětlit význam správného dávkování a načasování léčby a sexuální stimulace. Po znovunasazení konkrétního PDE5I může dojít ke zlepšení erektilní funkce [83 – 85].
Autoři jedné studie [84] zašli ještě dále a pacientům, u nichž byla léčba nadále neúčinná, doporučili další modifikaci. Pacientům užívajícím tadalafil doporučili vyčkat mezi perorální aplikací a pokusem o pohlavní styk alespoň dvě hodiny. Pacienti léčení vardenafilem byli instruoáni užívat lék pouze na lačno. Tato metoda byla v obou skupinách účinná. Do této studie nebyli zařazení žádní pacienti léčení pomocí sildenafilu.
3.5.1.7.3 Možnosti u pacientů, kteří dodržují správné užívání inhibitorů PDE5
Pakliže i při správném užívání adekvátní dávky není dosaženo dostatečného výsledku, lze účinnost medikace podpořit několika dalšími opatřeními, ačkoli pro podporu této strategii existuje pouze minimum důkazů.
Erektilní dysfunkce je obvykle symptomem jiného průvodního onemocnění, jako např. diabetes, hypertenze nebo dyslipidemie. Existují důkazy, které nasvědčují tomu, že u pacientů s hypogonadizmem může normalizace testosteronu v séru zlepšovat účinek PDE5I [86]. Užitečná může být i modifikace ostatních rizikových faktorů (kapitola 3.2).
Randomizovaná studie uvádí, že u pacientů, u nichž selže léčba pomocí sildenafilu, může být užitečné přejít na vardenafil [87]. Vzhledem k nekvalitnímu designu studie je však benefit změny inhibitoru PDE5 pravděpodobně nadsazen.
Randomizovaná, otevřená, zkřížená studie srovnávající sildenafil a tadalafil uvádí, že u některých pacientů může být jeden z inhibitorů účinnější než druhý [88]. 17 % pacientů mělo lepší skóre IIEF ‑ EF (≥ 5 bodů) při užívání tadalafilu než při užívání sildenafilu, zatímco 14 % mělo naopak lepší skóre při léčbě sildenafilem.
Ačkoli tyto rozdíly mohou být zapříčiněny rozdílnými farmakokinetickými vlastnostmi obou preparátů, existuje zde možnost, že i navzdory stejnému mechanizmu účinku sildenafilu a tadalafilu může výměna těchto dvou medikamentů přinášet benefit.
Dvě randomizované studie uvádějí, že každodenní aplikace inhibitoru PDE5 může přinášet benefit u některých pacientů, u nichž selhala léčba podle potřeby. Jedna studie [89] uvádí benefit u pacientů, kteří pravidelně užívali vardenafil nebo tadalafil, jiná studie [84] uvádí benefit každodenní aplikace tadalafilu u mužů, u nichž selhala léčba podle potřeby.
V současné době neexistuje žádná randomizovaná studie, která by potvrdila skutečný benefit této strategie. Na rozdíl od sildenafilu a vardenafilu byl tadalafil registrován pro každodenní užívání v dávkování 2,5 a 5 mg.
V případě selhání léčby by měla být pacientovi nabídnuta alternativa v podobě intrakavernózní injekce nebo vakuových erekčních zařízení.
3.5.2 Vakuová erekční zařízení
Vakuová erekční zařízení (VED) zajišťují pasivní naplnění kavernózních těles. Konstrikční kroužek nasazený na penis pak krev udržuje v corpora cavernosa. Takto navozenou erekci tedy nelze považovat za normální, protože není v souladu s fyziologickými pochody. Užívání VED dosahuje až 90% účinnosti s ohledem na uspokojivý pohlavní styk (bez ohledu na příčinu ED), míra spokojenosti pacientů se pohybuje v rozmezí 27 – 94 % [90]. Nejvíce jsou s léčbou spokojeni muži s motivovanou a chápající partnerkou. V dlouhodobém horizontu klesá použití VED po dvou letech na 50 – 64 % [91]. Většina mužů, kteří si přejí tuto terapii ukončit, tak učiní během prvních tří měsíců.
Nejčastější nežádoucí příhody spojené s touto léčbou se vyskytují u méně než 30 % pacientů a zahrnují bolestivost, neschopnost ejakulovat, petechie, vznik krevní podlitiny a znecitlivění [92]. Vzniku závažných nežádoucích příhod lze předejít sejmutím konstrikčního kroužku do 30 min po jeho nasazení. Užívání VED je kontraindikováno u pacientů s poruchami krvácivosti a pacientů užívajících antikoagulancia.
VED mohou být léčbou volby pro dobře informované, starší pacienty, kteří se věnují sexuální aktivitě pouze příležitostně, a pacienty, jejichž komorbidity vyžadují neinvazivní, nemedikamentózní léčbu ED [90].
3.5.3 Terapie rázovou vlnou
V nedávné době byla představena novinka v léčbě erektilní dysfunkce – aplikace rázových vln o nízké intenzitě [93]. První randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie ukázala, že terapie rázovou vlnou o nízké intenzitě vykazuje pozitivní krátkodobý klinický i fyziologický účinek na erektilní funkci u mužů, u nichž je účinná aplikace inhibitorů PDE5 [94]. Předběžné údaje ukazují rovněž zlepšení penilní hemodynamiky a endoteliální funkce a zlepšení IIEF ‑ EF skóre u pacientů se závažnou ED, u nichž není léčba pomocí PDE5I příliš účinná [95]. Dobrá snášenlivost a rehabilitační potenciál činí z této terapie lákavou modalitu pro pacienty s ED. Vzhledem k omezeným údajům však v současné době nelze pro tuto techniku stanovit žádná doporučení. Rovněž prozatím nejsou k dispozici žádné údaje popisující mechanizmus účinku této terapie. Na krysím modelu s diabetem bylo prokázáno, že terapie rázovou vlnou o nízké intenzitě zlepšuje diabetes díky podpoře regenerace nNOS‑pozitivních nervů, endotelu a hladké svaloviny penisu. Tento účinek je zprostředkován mobilizací endogenních mezenchymálních kmenových buněk (MSCs) [96].
3.6 Léčba druhé volby
Pacientům, u nichž selže perorální farmakoterapie, lze nabídnout intrakavernózní injekci. Tato léčba má vysokou míru účinnosti (85 %) [97,98]. Intrakavernózní aplikace vazoaktivních látek se užívala jako první medikamentózní léčba ED již před více než 20 lety [99].
3.6.1 Intrakavernózní injekce
3.6.1.1 Alprostadil
Prvním a jediným preparátem, který byl schválen pro intrakavernózní léčbu ED, je alprostadil (CaverjectTM, Edex/ ViridalTM) [99]. Intrakavernózně aplikovaný alprostadil je nejúčinnější v rámci monoterapie při dávkování 5 – 40 μg; dávka 40 μg však není v některých evropských státech registrována. Erekce se dostaví po 5 – 15 min a trvá v závislosti na aplikované dávce. Správná technika aplikace vyžaduje nácvik (obvykle postačí jedno nebo dvě ambulantní sezení). V případě, že je pacient méně zručný, může se techniku naučit jeho partnerka. Strach z jehel a penetrace penisu lze vyřešit užíváním speciálního automatického pera, což celou techniku zjednoduší.
V obecné ED populaci, ale i u speciálních subpopulací (např. pacienti s diabetem nebo kardiovaskulárním onemocněním), je míra účinnosti intrakavernózně aplikovaného alprostadilu > 70 %. Sexuální aktivita byla zaznamenána po více než 94 % aplikací. S léčbou je spokojeno 87 – 93,5 % pacientů a 86 – 90,3 % partnerek pacientů [100 – 102].
Komplikace spojené s léčbou pomocí alprostadilu zahrnují bolest v penisu (50 % pacientů uvádí bolestivost, ale pouze po 11 % injekcí celkem), déletrvající erekci (5 %), priapizmus (1 %) a vznik fibrózy (2 %) [103]. Při dlouhodobém užívání bolest obvykle sama vymizí. Bolest lze zmírnit přidáním bikarbonátu sodného nebo lokálního anestetika [104,105]. Při přechodném přerušení léčby fibróza v kavernózní tkáni (z malého hematomu) obvykle vymizí po několika měsících. Vznik fibrózy v tunice však svědčí o vznikajícím Peyronieho onemocnění, což může vyžadovat úplné ukončení léčby. Výskyt systémových vedlejších účinků je ojedinělý, nejčastější nežádoucí příhodou je mírná hypotenze, zejména při aplikaci vyšších dávek.
Léčba je kontraindikována u mužů s anamnézou hypersenzitivity na alprostadil, u mužů s rizikem priapizmu a poruchou krvácivosti.
Navzdory příznivým výsledkům řada pacientů terapii nedodržuje a velké procento pacientů intrakavernózní léčbu ukončí. Uvádí se, že léčbu ukončí 41 – 68 % pacientů [106 – 108], ve většině případů během prvních 2 – 3 měsíců. Komparativní studie uvádí, že aplikace alprostadilu v rámci monoterapie je spojena s nejnižší mírou ukončení léčby (27,5 %) ve srovnání se všemi kombinacemi (37,6 %); po prvních několika měsících léčbu ukončí 10 % pacientů/ rok. Důvody pro ukončení léčby zahrnovaly potřebu permanentního řešení (29 %), nevhodnou partnerku pro tuto léčbu (26 %), malý účinek (23 %) (zejména u pacientů, kteří ukončili léčbu velmi brzy), strach z jehel (23 %), strach z komplikací (22 %) a absenci spontánnosti (21 %). Pro snížení procenta pacientů, kteří intrakavernózní léčbu ukončí, je nezbytné důkladné poradenství při nácviku techniky a pečlivé monitorování pacienta [109].
Intrakavernózní farmakoterapie se v současné době považuje za léčbu druhé volby. U pacientů, u nichž není účinná perorální léčba, má intrakavernózní injekce až 85% úspěšnost. Většina pacientů, kteří jsou dlouhodobě léčeni pomocí intrakavernózní injekce, může přejít na užívání sildenafilu i navzdory průvodní patofyziologii [110 – 112]. Téměř třetina pacientů podstupujících dlouhodobě intrakavernózní léčbu, u nichž byla účinná rovněž aplikace sildenafilu, se však rozhodla pokračovat v intrakavernózní terapii [112,113].
3.6.1.2 Kombinovaná terapie
Kombinovaná terapie nabízí pacientům možnost využít různých mechanizmů účinků jednotlivých preparátů a rovněž je spojena s menším výskytem vedlejších účinků díky nižšímu dávkování léčiv v kombinaci.
Papaverin (20 – 80 mg) je prvním perorálním léčivem, který byl využit pro intrakavernózní injekci. Papaverin je v dnešní době nejčastějším preparátem užívaným v rámci kombinované léčby, protože jeho aplikace v rámci monoterapie je spojena s vysokou incidencí vedlejších účinků.
Fentolamin se užívá v rámci kombinované terapie pro zvýšení účinnosti. V rámci monoterapie dosahuje slabého účinku.
Nečetné údaje v literatuře popisují užívání dalších preparátů jako např. vazoaktivní intestinální peptid (VIP), donory NO (linsidomin), forskolin, otevírače draselného kanálu, moxisylyt nebo CGRP, obvykle v kombinaci s běžnými léčivy [114,115]. Většina těchto kombinací nebyla standardizována a některé preparáty jsou ve většině států světa málo dostupné.
Běžně se užívá kombinace papaverinu (7,5 – 45 mg) plus fentolaminu (0,25 – 1,5 mg), papaverinu (8 – 16 mg) plus fentolaminu (0,2 – 0,4 mg) plus alprostadilu (10 – 20 μg) pro zlepšení účinku. Tato kombinace však nebyla nikdy registrována pro léčbu ED [116 – 118]. Největší účinnosti dosahuje kombinace papaverinu, fentolaminu a alprostadilu (až 92 %); tato kombinace je spojena se srovnatelným výskytem vedlejších účinků jako aplikace alprostadilu v rámci monoterapie, díky nižšímu dávkování alprostadilu má však nižší incidenci bolesti v penisu. Při podávání papaverinu je však častější výskyt fibrózy (5 – 10 %) (v závislosti na celkové dávce), dále byl popsán výskyt mírné hepatotoxicity [119].
Navzdory vysoké účinnosti nemá léčba pomocí intrakavernózní injekce s kombinací preparátů u 5 – 10 % pacientů žádný účinek. Kombinace sildenafilu s intrakavernózní injekcí s trojkombinací preparátů může přinášet benefit až u 31 % pacientů, u nichž selhala léčba pomocí samotné trojkombinace [120]. U 33 % pacientů se však vyskytnou nežádoucí účinky, např. závratě (20 %). Tuto strategii lze zvážit u dobře vybrané populace pacientů před tím, než přistoupíme k implantaci penilní protézy.
3.6.1.3 Intrauretrální aplikace alprostadilu
Alprostadil (125 – 1 000 μg) ve speciální formě pelety (MUSE™) byl registrován pro léčbu ED [121]. Cévní interakce mezi močovou trubicí a corpora cavernosa umožňuje transfer preparátů mezi oběma strukturami [121]. 30 – 65,9 % pacientů dosáhne erekce umožňující pohlavní styk. V klinické praxi se užívají pouze vyšší dávky (500 a 1 000 μg), uváděná míra účinnosti je však velmi nekonzistentní [121 – 123]. Efekt této terapie lze podpořit nasazením konstrikčního kroužku na kořen penisu (ACTIS™) [123,124].
Nejčastější nežádoucí účinky zahrnují lokální bolest (29 – 41 %) a závratě s případnou hypotenzí (1,9 – 14 %). Výskyt penilní fibrózy a priapizmu je velmi ojedinělý (< 1 %). Krvácení z močové trubice (5 %) a infekce močových cest (0,2 %) souvisejí se způsobem aplikace.
Míra účinnosti je významně nižší než při intrakavernózní farmakoterapii [125]. Intrauretrální farmakoterapie se považuje za léčbu druhé volby, která je vhodnou alternativou intrakavernózní terapii u pacientů, kteří preferují méně invazivní, ovšem současně méně účinnou léčbu.
3.7 Léčba třetí volby (penilní protéza)
Implantaci penilní protézy lze zvážit u pacientů, u nichž selhala farmakoterapie, nebo pacientů, kteří preferují trvalé řešení svého problému. V současné době jsou k dispozici dva druhy penilních implantátů – inflatabilní (dvou ‑ a třídílná protéza) a polotuhá (malleable) protéza [126 – 129].
Většina pacientů preferuje trojdílnou inflatabilní protézu vzhledem k „přirozenější“ erekci, které lze pomocí tohoto zařízení dosáhnout. Trojdílná inflatabilní protéza obsahuje samostatný rezervoár, který je umístěn v dutině břišní. Trojdílná protéza nabízí nejlepší rigiditu i ochablost, protože vyplní celá corpora cavernosa. Implantace dvojdílné protézy je schůdným řešením pro pacienty, u nichž předpokládáme, že implantace rezervoáru bude spojena s vysokým rizikem. Polotuhá protéza zajišťuje tuhý penis, který lze ručně napolohovat do požadované pozice [126 – 129].
Implantace se provádí pomocí jednoho ze dvou hlavních přístupů: penoskrotálního nebo infrapubického [126 – 129]. Penoskrotální přístup nabízí perfektní odhalení proximálních crura topořivých těles v případě nutnosti. Pomocí tohoto přístupu lze předejít poranění dorzálního nervu a pumpička se zavádí pod přímou zrakovou kontrolou. Při tomto přístupu je však rezervoár naslepo umístěn do retropubické prostoru, což může být problematické u pacientů s anamnézou rozsáhlé pánevní operace (zejména radikální cystektomie). Pomocí infrapubického přístupu lze rezervoár implantovat pod přímou zrakovou kontrolou. Implantace pumpičky je však v tomto případě náročnější a hrozí zde o něco vyšší riziko poranění dorzálního nervu. Operační revize je v tomto případě náročnější a může být spojena s horším výsledkem.
3.7.1 Účinnost a spokojenost pacientů s léčbou
Implantace protézy je ze všech terapeutických možností spojena s nejvyšší mírou spokojenosti (92 – 100 % pacientů a 91 – 95 % partnerek) díky adekvátnímu poučení a realistickým očekáváním pacienta [130 – 137]. Mulhall et al hodnotili skóre IIEF a EDITS (Erectile Dysfunction Index for Treatment Satisfaction) u pacientů s implantovanou penilní protézou ve tříměsíčních intervalech. Obě skóre se průběžně zlepšovala až do 9. – 12. měsíce po operaci, kdy došlo k jejich stabilizaci. Jeden rok po výkonu došlo ke zlepšení všech následujících proměnných oproti počátečnímu stavu: erekce, ejakulace, orgazmu a celkové spokojenosti se sexuálním životem. Tři měsíce po operaci pacienti uváděli méně příznivé výsledky, což svědčí o tom, že pooperační konzultace a podpora pacienta mají zásadní význam pro maximální spokojenost a dosažení pozitivních výsledků za 9 – 12 měsíců [134].
Dlouhodobá multicentrická studie testující třídílnou inflatabilní protézu AMS 700CX (střední doba sledování 48 měsíců) uvádí, že 79 % pacientů užívalo zařízení alespoň dvakrát měsíčně a 88 % pacientů by doporučilo implantaci příteli nebo rodinnému příslušníku [135]. Jiná multicentrická studie (59měsíční sledování) po téměř pěti letech od operace uvádí, že 92,5 % pacientů užívá protézu průměrně 1,7krát týdně a pacienti i jejich partnerky popisují vynikající nebo alespoň uspokojivý výsledek [132].
Výskyt močové inkontinence a sexuální dysfunkce (zejména ED a orgazmické dysfunkce) u pacientů, kteří mají po RP příznivou prognózu, ukazuje na nezbytnost globálního řešení obou poruch. Při správném klinickém a diagnostickém postupu a posouzení závažnosti poruchy a zohlednění preferencí pacienta je kombinovaná léčba erektilní dysfunkce (s implantací penilní protézy) a stresové močové inkontinence (s implantací mužského slingu nebo artificiálního močového svěrače) účinná a má trvalý výsledek. Kombinovaná léčba poskytuje definitivní řešení tohoto problému [138].
3.7.2 Komplikace
Dvě hlavní komplikace související s implantací penilní protézy zahrnují mechanické selhání a infekci. Díky několika technickým modifikacím nejčastěji užívané trojdílné protézy (AMS 700CX/ CXRTM a Coloplast Alpha I TM) činila míra mechanického selhání po pěti letech sledování méně než 5 % [135,139]. Pečlivá operační technika s vhodnou profylaxí antibiotiky proti grampozitivním a gramnegativním bakteriím snižuje riziko infekce u pacientů s nízkým rizikem při první implantaci protézy na 2 – 3 %. Výskyt infekce lze dále snížit na 1 – 2 % implantací protézy potažené vrstvou antibiotika (AMS Inhibizone™) nebo protézy s hydrofilním povrchem (Coloplast Titan™) [140 – 143].
Do populace s vyšším rizikem řadíme pacienty podstupující operační revizi, pacienty s poruchou obranyschopnosti (imunosuprese, diabetes mellitus, poranění míchy) a pacienty s fibrózou kavernózních těles [126 – 129]. Ačkoli diabetes je považován za jeden z hlavních rizikových faktorů pro vznik infekce, současná data tento předpoklad nepotvrzují [126 – 129]. Výskyt infekce, stejně jako eroze, je významně častější (9 %) u pacientů s poraněním míchy [126 – 129]. V případě infekce je nezbytné protézu vyjmout a zahájit léčbu antibiotiky. Bylo popsáno vyjmutí infikovaného zařízení, proplach a implantace nové protézy, v tomto případě je zásah úspěšný u více než 80 % pacientů [144,145]. Naprostá většina revizí je indikována z důvodu mechanického selhání nebo kombinace eroze a infekce. Celkem u 93 % pacientů je operační revize úspěšná, výsledkem je funkční penilní protéza.
3.7.3 Závěr
Implantace penilní protézy je atraktivním řešením pro pacienty, u nichž selže konzervativní léčba. K dispozici máme dostatek důkazů pro doporučení implantace pacientům, u nichž nemá méně invazivní léčba žádný účinek vzhledem k vysoké míře účinnosti léčby, bezpečnostnímu profilu a spokojenosti pacientů s výsledkem.
3.8 Guidelines pro léčbu ED (dop. 2)
Dop. 2. Guidelines pro léčbu ED. 
3.9 Literatura
1. Hatzichristou D, Rosen RC, Broderick G et al. Clinical evaluation and management strategy for sexual dysfunction in men and women. J Sex Med 2004; 1(1): 49 – 57.
2. Derby CA, Mohr BA, Goldstein I et al. Modifiable risk factors and erectile dysfunction: can lifestyle changes modify risk? Urology 2000; 56(2): 302 – 306.
3. Moyad MA, Barada JH, Lue TF et al. Prevention and treatment of erectile dysfunction using lifestyle changes and dietary supplements: what works and what is worthless, part I. Urol Clin North Am 2004; 31(2): 249 – 257.
4. Moyad MA, Barada JH, Lue TF et al. Prevention and treatment of erectile dysfunction using lifestyle changes and dietary supplements: what works and what is worthless, part II. Urol Clin North Am 2004; 31(2): 259 – 273.
5. Gupta BP, Murad MH, Clifton MM et al. The effect of lifestyle modification and cardiovascular risk factor reduction on erectile dysfunction: a systematic review and meta‑analysis. Arch Intern Med 2011; 171(20): 1797 – 1803. doi: 10.1001/ archinternmed.2011.440.
6. Esposito K, Giugliano F, Di Palo C et al. Effect of lifestyle changes on erectile dysfunction in obese men: a randomized controlled trial. JAMA 2004; 291(24): 2978 – 2984.
7. Guay AT. Optimizing response to phosphodiesterase therapy: impact of risk‑factor management. J Androl 2003; 24 (6 Suppl): S59 – S62.
8. Maio G, Saraeb S, Marchiori A. Physical activity and PDE5 inhibitors in the treatment of erectile dysfunction: results of a randomized controlled study. J Sex Med 2010; 7(6): 2201 – 2208. doi: 10.1111/ j.1743 - 6109.2010.01783.x.
9. Salonia A, Burnett AL, Graefen M et al. Prevention and management of postprostatectomy sexual dysfunctions part 2: recovery and preservation of erectile function, sexual desire, and orgasmic function. Eur Urol 2012; 62(2): 273 – 286. doi: 10.1016/ j.eururo.2012.04.047.
10. Montorsi F, Guazzoni G, Strambi LF et al. Recovery of spontaneous erectile function after nerve ‑ sparing radical retropubic prostatectomy with and without early intracavernous injections of alprostadil: results of a prospective, randomized trial. J Urol 1997; 158(4): 1408 – 1410.
11. Raina R, Pahlajani G, Agarwal A et al. The early use of transurethral alprostadil after radical prostatectomy potentially facilitates an earlier return of erectile function and successful sexual activity. BJU Int 2007; 100(6): 1317 – 1321.
12. Raina R, Agarwal A, Ausmundson S et al. Early use of vacuum constriction device following radical prostatectomy facilitates early sexual activity and potentially earlier return of erectile function. Int J Impot Res 2006; 18(1): 77 – 81.
13. Lane BR, Abouassaly R, Angermeier KW et al. Three ‑ piece inflatable penile prostheses can be safely implanted after radical prostatectomy through a transverse scrotal incision. Urology 2007; 70(3): 539 – 542.
14. Ficarra V, Novara G, Ahlering TE et al. Systematic review and meta‑analysis of studies reporting potency rates after robot ‑ assisted radical prostatectomy. Eur Urol 2012; 62(3): 418 – 430. doi: 10.1016/ j.eururo.2012.05.046.
15. Ayyathurai R, Manoharan M, Nieder AM et al. Factors affecting erectile function after radical retropubic prostatectomy: results from 1620 consecutive patients. BJU Int 2008; 101(7): 833 – 836. doi: 10.1111/ j.1464 - 410X.2007.07409.x.
16. Hollenbeck BK, Dunn RL, Wei JT et al. Deter-minants of long‑term sexual health outcome after radical prostatectomy measured by a validated instrument. J Urol 2003; 169(4): 1453 – 1457.
17. Schwartz EJ, Wong P, Graydon RJ. Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy. J Urol 2004; 171(2 Pt 4): 771 – 774.
18. Padma ‑ Nathan H, McCullough AR, Levine LA et al. Randomized, double‑blind, placebo ‑ controlled study of postoperative nightly sildenafil citrate for the prevention of erectile dysfunction after bilateral nerve ‑ sparing radical prostatectomy. Int J Impot Res 2008; 20(5): 479 – 486. doi: 10.1038/ ijir.2008.33.
19. Bannowsky A, Schulze H, van der Horst C et al. Recovery of erectile function after nerve ‑ sparing radical prostatectomy: improvement with nightly low‑dose sildenafil. BJU Int 2008; 101(10): 1279 – 1283. doi: 10.1111/ j.1464 – 410X.2008.07515.x.
20. Raina R, Lakin MM, Agarwal A et al. Efficacy and factors associated with successful outcome of sildenafil citrate use for erectile dysfunction after radical prostatectomy. Urology 2004; 63(5): 960 – 966.
21. McCullough AR, Levine LA, Padma ‑ Nathan H. Return of nocturnal erections and erectile function after bilateral nerve ‑ sparing radical prostatectomy in men treated nightly with sildenafil citrate: subanalysis of a longitudinal randomized double‑blind placebo ‑ controlled trial. J Sex Med 2008; 5(2): 476 – 484.
22. Montorsi F, Nathan HP, McCullough A et al. Tadalafil in the treatment of erectile dysfunction following bilateral nerve sparing radical retropubic prostatectomy: a randomized, double‑blind, placebo controlled trial. J Urol 2004; 172(3): 1036 – 1041.
23. Brock G, Nehra A, Lipshultz LI et al. Safety and efficacy of vardenafil for the treatment of men with erectile dysfunction after radical retropubic prostatectomy. J Urol 2003; 170(4 Pt 1): 1278 – 1283.
24. Nehra A, Grantmyre J, Nadel A et al. Vardenafil improved patient satisfaction with erectile hardness, orgasmic function and sexual experience in men with erectile dysfunction following nerve sparing radical prostatectomy. J Urol 2005; 173(6): 2067 – 2071.
25. Montorsi F, Brock G, Lee J et al. Effect of nightly versus on ‑ demand vardenafil on recovery of erectile function in men following bilateral nerve ‑ sparing radical prostatectomy. Eur Urol 2008; 54(4): 924 – 931. doi: 10.1016/ j.eururo.2008.06.083.
26. McCullough AR, Hellstrom WG, Wang R et al. Recovery of erectile function after nerve sparing radical prostatectomy and penile rehabilitation with nightly intraurethral alprostadil versus sildenafil citrate. J Urol 2010; 183(6): 2451 – 2456. doi: 10.1016/ j.juro.2010.01.062.
27. Mulhall JP, Bella AJ, Briganti A et al. Erectile function rehabilitation in the radical prostatectomy patient. J Sex Med 2010; 7(4 Pt 2): 1687 – 1698. doi: 10.1111/ j.1743-6109.2010.01804.x.
28. Pace G, Del Rosso A, Vicentini C. Penile rehabilitation therapy following radical prostatectomy. Disabil Rehabil 2010; 32(14): 1204 – 1208. doi: 10.3109/ 09638280903511594.
29. Montague DK. Penile prosthesis implantation for end‑stage erectile dysfunction after radical prostatectomy. Rev Urol 2005; 7 (Suppl 2): S51 – S57.
30. Greenstein A, Mabjeesh NJ, Sofer M et al. Does sildenafil combined with testosterone gel improve erectile dysfunction in hypogonadal men in whom testosterone supplement therapy alone failed? J Urol 2005; 173(2): 530 – 532.
31. Roddam AW, Allen NE, Appleby P et al. Endogenous sex hormones and prostate cancer: a collaborative analysis of 18 prospective studies. J Natl Cancer Inst 2008; 100(3): 170 – 183. doi: 10.1093/ jnci/ djm323.
32. Morgentaler A. Testosterone therapy in men with prostate cancer: scientific and ethical
considerations. J Urol 2013; 189 (1 Suppl): S26 – S33. doi: 10.1016/ j.juro.2012.11.028.
33. Morales A, Heaton JP. Hormonal erectile dysfunction. Evaluation and management. Urol Clin North Am 2001; 28(2): 279 – 288.
34. Rao DS, Donatucci CF. Vasculogenic impotence. Arterial and venous surgery. Urol Clin North Am 2001; 28(2): 309 – 319.
35. Wespes E, Wildschutz T, Roumeguere T et al. The place of surgery for vascular impotence in the third millennium. J Urol 2003; 170(4 Pt 1): 1284 – 1286.
36. Rosen RC. Psychogenic erectile dysfunction. Classification and management. Urol Clin North Am 2001; 28(2): 269 – 278.
37. Lue TF. Erectile dysfunction. N Engl J Med 2000; 342(24): 1802 – 1813.
38. Moncada I, Jara J, Subirá D et al. Efficacy of sildenafil citrate at 12 hours after dosing: re‑exploring the therapeutic window. Eur Urol 2004; 46(3): 357 – 360, discussion: 360 – 361.
39. Langtry HD, Markham A. Sildenafil: a review of its use in erectile dysfunction. Drugs 1999; 57(6): 967 – 989.
40. Goldstein I, Lue TF, Padma ‑ Nathan H et al. Oral sildenafil in the treatment of erectile dysfunction. 1998. J Urol 2002; 167(2 Pt 2): 1197 – 1203.
41. Stuckey BG, Jadzinsky MN, Murphy LJ et al. Sildenafil citrate for treatment of erectile dysfunction in men with type 1 diabetes: results of a randomized controlled trial. Diabetes Care 2003; 26(2): 279 – 284.
42. Porst H, Padma ‑ Nathan H, Giuliano F et al. Efficacy of tadalafil for the treatment of erectile dysfunction at 24 and 36 hours after dosing: a randomized controlled trial. Urology 2003; 62(1): 121 – 125, discussion: 125 – 126.
43. Brock GB, McMahon CG, Chen KK et al. Efficacy and safety of tadalafil for the treatment of erectile dysfunction: results of integrated analyses. J Urol 2002; 168(4 Pt 1): 1332 – 1336.
44. Montorsi F, Verheyden B, Meuleman E et al. Long‑term safety and tolerability of tadalafil in the treatment of erectile dysfunction. Eur Urol 2004; 45(3): 339 – 344, discussion: 344 – 345.
45. Sáenz de Tejada I, Anglin G, Knight JR et al. Effects of tadalafil on erectile dysfunction in men with diabetes. Diabetes Care 2002; 25(12): 2159 – 2164.
46. Fonseca V, Seftel A, Denne J et al. Impact of diabetes mellitus on the severity of erectile dysfunction and response to treatment: analysis of data from tadalafil clinical trials. Diabetologia 2004; 47(11): 1914 – 1923.
47. Bischoff E, Schneider K. A conscious ‑ rabbit model to study vardenafil hydrochloride and other agents that influence penile erection. Int J Impot Res 2001; 13(4): 230 – 235.
48. Keating GM, Scott LJ. Vardenafil: a review of its use in erectile dysfunction. Drugs 2003; 63(23): 2673 – 2703.
49. Porst H, Rosen R, Padma ‑ Nathan H et al. The efficacy and tolerability of vardenafil, a new, oral, selective phosphodiesterase type 5 inhibitor, in patients with erectile dysfunction: the first at ‑ home clinical trial. Int J Impot Res 2001; 13(4): 192 – 199.
50. Potempa AJ, Ulbrich E, Bernard I et al. Efficacy of vardenafil in men with erectile dysfunction: a flexible‑dose community practice study. Eur Urol 2004; 46(1): 73 – 79.
51. Goldstein I, Young JM, Fischer J et al. Vardenafil, a new phosphodiesterase type 5 inhibitor, in the treatment of erectile dysfunction in men with diabetes: a multicenter double‑blind placebo ‑ controlled fixed‑dose study. Diabetes Care 2003; 26(3): 777 – 783.
52. Heinig R, Weimann B, Dietrich H et al. Pharmacokinetics of a new orodispersible tablet formulation of vardenafil: results of three clinical trials. Clin Drug Investig 2011; 31(1): 27 – 41. doi: 10.2165/ 11584950 - 000000000 - 00000.
53. Debruyne FM, Gittelman M, Sperling H et al. Time to onset of action of vardenafil: a retrospective analysis of the pivotal trials for the orodispersible and film ‑ coated tablet formulations. J Sex Med 2011; 8(10): 2912 – 2923. doi: 10.1111/ j.1743 – 6109.2011.02462.x.
54. Sperling H, Gittelman M, Norenberg C et al. Efficacy and safety of an orodispersible vardenafil formulation for the treatment of erectile dysfunction in elderly men and those with underlying conditions: an integrated analysis of two pivotal trials. J Sex Med 2011; 8(1): 261 – 271. doi: 10.1111/ j.1743 - 6109.2010.02005.x.
55. Gittelman M, McMahon CG, Rodríguez ‑ Rivera JA et al. The POTENT II randomised trial: efficacy and safety of an orodispersible vardenafil formulation for the treatment of erectile dysfunction. Int J Clin Pract 2010; 64(5): 594 – 603. doi: 10.1111/ j.1742 - 1241.2010.02358.x.
56. Sperling H, Debruyne F, Boermans A et al. The POTENT I randomized trial: efficacy and safety of an orodispersible vardenafil formulation for the treatment of erectile dysfunction. J Sex Med 2010; 7(4 Pt 1): 1497 – 1507. doi: 10.1111/ j.1743 - 6109.2010.01806.x.
57. Ahn GJ, Yu JY, Choi SM et al. Chronic administration of phosphodiesterase 5 inhibitor improves erectile and endothelial function in a rat model of diabetes. Int J Androl 2005; 28(5): 260 – 266.
58. Kovanecz I, Rambhatla A, Ferrini MG et al. Chronic daily tadalafil prevents the corporal fibrosis and veno‑occlusive dysfunction that occurs after cavernosal nerve resection. BJU Int 2008; 101(2): 203 – 210.
59. Ferrini MG, Davila HH, Kovanecz I et al. Vardenafil prevents fibrosis and loss of corporal smooth muscle that occurs after bilateral cavernosal nerve resection in the rat. Urology 2006; 68(2): 429 – 435.
60. Vignozzi L, Filippi S, Morelli A et al. Effect of chronic tadalafil administration on penile hypoxia induced by cavernous neurotomy in the rat. J Sex Med 2006; 3(3): 419 – 431.
61. Ferrini MG, Kovanecz I, Sanchez S et al. Long‑term continuous treatment with sildenafil ameliorates aging‑related erectile dysfunction and the underlying corporal fibrosis in the rat. Biol Reprod 2007; 76(5): 915 – 923.
62. Behr ‑ Roussel D, Gorny D, Mevel K et al. Chronic sildenafil improves erectile function and endothelium ‑ dependent cavernosal relaxation in rats: lack of tachyphylaxis. Eur Urol 2005; 47(1): 87 – 91.
63. McMahon C. Comparison of efficacy, safety and tolerability of on ‑ demand tadalafil and daily dosed tadalafil for the treatment of erectile dysfunction. J Sex Med 2005; 2(3): 415 – 425.
64. Porst H, Giuliano F, Glina S et al. Evaluation of the efficacy and safety of once ‑ a ‑ day dosing of tadalafil 5 mg and 10 mg in the treatment of erectile dysfunction: results of a multicenter, randomized, double‑blind, placebo ‑ controlled trial. Eur Urol 2006; 50(2): 351 – 359.
65. Rajfer J, Aliotta PJ, Steidle CP et al. Tadalafil dosed once a day in men with erectile dysfunction: a randomized, double‑blind, placebo ‑ controlled study in the US. Int J Impot Res 2007; 19(1): 95 – 103.
66. Porst H, Rajfer J, Casabé A et al. Long‑term safety and efficacy of tadalafil 5 mg dosed once daily in men with erectile dysfunction. J Sex Med 2008; 5(9): 2160 – 2169. doi: 10.1111/ j.1743 - 6109.2008.00935.x.
67. Zumbé J, Porst H, Sommer F et al. Comparable efficacy of once ‑ daily versus on ‑ demand vardenafil in men with mild ‑ to ‑ moderate erectile dysfunction: findings of the RESTORE study. Eur Urol 2008; 54(1): 204 – 210. doi: 10.1111/ j.1743 - 6109.2008.00935.x.
68. Rosano GM, Aversa A, Vitale C et al. Chronic treatment with tadalafil improves endothelial function in men with increased cardiovascular risk. Eur Urol 2005; 47(2): 214 – 220.
69. Aversa A, Greco E, Bruzziches R et al. Relationship between chronic tadalafil administration and improvement of endothelial function in men with erectile dysfunction: a pilot study. Int J Impot Res 2007; 19(2): 200 – 207.
70. Aversa A, Vitale C, Volterrani M et al. Chronic administration of Sildenafil improves markers of endothelial function in men with Type 2 diabetes. Diabet Med 2008; 25(1): 37 – 44. doi: 10.1111/ j.1464 - 5491.2007.02298.x.
71. Hatzichristou D, Gambla M, Rubio ‑ Aurioles E et al. fficacy of tadalafil once daily in men with diabetes mellitus and erectile dysfunction. Diabet Med 2008; 25(2): 138 – 146. doi: 10.1111/ j.1464 - 5491.2007.02338.x.
72. Kloner RA. Novel phosphodiesterase type 5 inhibitors: assessing hemodynamic effects and safety parameters. Clin Cardiol 2004; 27 (4 Suppl 1): I20 – I25.
73. Thadani U, Smith W, Nash S et al. The effect of vardenafil, a potent and highly selective phosphodiesterase ‑ 5 inhibitor for the treatment of erectile dysfunction, on the cardiovascular response to exercise in patients with coronary artery disease. J Am Coll Cardiol 2002; 40(11): 2006 – 2012.
74. Auerbach SM, Gittelman M, Mazzu A et al. Simultaneous administration of vardenafil and tamsulosin does not induce clinically significant hypotension in patients with benign prostatic hyperplasia. Urology 2004; 64(5): 998 – 1003, discussion: 1003 – 1004.
75. Kloner RA, Jackson G, Emmick JT et al. Interaction between the phosphodiesterase 5 inhibitor, tadalafil and 2 alpha‑blockers, doxazosin and tamsulosin in healthy normotensive men. J Urol 2004; 172(5 Pt 1): 1935 – 1940.
76. Nichols DJ, Muirhead GJ, Harness JA. Pharmacokinetics of sildenafil citrate after single oral doses in healthy male subjects: absolute bioavailability, food effects and dose proportionality. Br J Clin Pharmacol 2002; 53 (Suppl 1): 5S ‑ 12S.
77. Forgue ST, Patterson BE, Bedding AW et al. Tadalafil pharmacokinetics in healthy subjects. Br J Clin Pharmacol 2006; 61(3): 280 – 288.
78. Padma ‑ Nathan H, Stecher VJ, Sweeney M et al. Minimal time to successful intercourse after sildenafil citrate: results of a randomized, double‑blind, placebo ‑ controlled trial. Urology 2003; 62(3): 400 – 403.
79. Rosen RC, Padma ‑ Nathan H, Shabsigh R et al. Determining the earliest time within 30 minutes to erectogenic effect after tadalafil 10 and 20 mg: a multicenter, randomized, double‑blind, placebo ‑ controlled, at ‑ home study. J Sex Med 2004; 1(2): 193 – 200.
80. Montorsi F, Padma ‑ Nathan H, Buvat J et al. Earliest time to onset of action leading to success-ful intercourse with vardenafil determined in an at ‑ home setting: a randomized, double‑blind, placebo ‑ controlled trial. J Sex Med 2004; 1(2): 168 – 178.
81. Rajagopalan P, Mazzu A, Xia C et al. Effect of high‑fat breakfast and moderate ‑ fat evening meal on the pharmacokinetics of vardenafil, an oral phosphodiesterase ‑ 5 inhibitor for the treatment of erectile dysfunction. J Clin Pharmacol 2003; 43(3): 260 – 267.
82. McCullough AR, Barada JH, Fawzy A et al. Achieving treatment optimization with sildenafil citrate (Viagra) in patients with erectile dysfunction. Urology 2002; 60 (2 Suppl 2): 28 – 38.
83. Hatzichristou D, Moysidis K, Apostolidis A et al. Sildenafil failures may be due to inadequate patient instructions and follow‑up: a study on 100 non‑responders. Eur Urol 2005; 47(4): 518 – 522.
84. Hatzimouratidis K, Moysidis K, Bekos A et al. Treatment strategy for “non‑responders” to tadalafil and vardenafil: a real‑life study. Eur Urol 2006; 50(1): 126 – 132.
85. Gruenwald I, Shenfeld O, Chen J et al. Positive effect of counseling and dose adjustment in patients with erectile dysfunction who failed treatment with sildenafil. Eur Urol 2006; 50(1): 134 – 140.
86. Greco EA, Spera G, Aversa A. Combining testosterone and PDE5 inhibitors in erectile dysfunction: basic rationale and clinical evidences. Eur Urol 2006; 50(5): 940 – 947.
87. Carson CC, Hatzichristou DG, Carrier S et al. Erectile response with vardenafil in sildenafil nonresponders: a multicentre, double‑blind, 12‑week, flexible‑dose, placebo ‑ controlled erectile dysfunction clinical trial. BJU Int 2004; 94(9): 1301 – 1309.
88. Eardley I, Montorsi F, Jackson G et al. Factors associated with preference for sildenafil citrate and tadalafil for treating erectile dysfunction in men naive to phosphodiesterase 5 inhibitor therapy: post hoc analysis of data from a multicentre, randomized, open ‑ label, crossover study. BJU Int 2007; 100(1): 122 – 129.
89. McMahon C. Efficacy and safety of daily tadalafil in men with erectile dysfunction previously unresponsive to on ‑ demand tadalafil. J Sex Med 2004; 1(3): 292 – 300.
90. Levine LA, Dimitriou RJ. Vacuum constriction and external erection devices in erectile dysfunction. Urol Clin North Am 2001; 28(2): 335 – 341.
91. Cookson MS, Nadig PW. Long‑term results with vacuum constriction device. J Urol 1993; 149(2): 290 – 294.
92. Lewis RW, Witherington R. External vacuum therapy for erectile dysfunction: use and results. World J Urol 1997; 15(1): 78 – 82.
93. Vardi Y, Appel B, Jacob G et al. Can low ‑ intensity extracorporeal shockwave therapy improve erectile function? A 6 – month follow‑up pilot study in patients with organic erectile dysfunction. Eur Urol 2010; 58(2): 243 – 248. doi: 10.1016/ j.eururo.2010.04.004.
94. Vardi Y, Appel B, Kilchevsky A et al. Does low intensity extracorporeal shock wave therapy have a physiological effect on erectile function? Short‑term results of a randomized, double‑blind, sham controlled study. J Urol 2012; 187(5): 1769 – 1775. doi: 10.1016/ j.juro.2011.12.117.
95. Gruenwald I, Appel B, Vardi Y. Low ‑ intensity extracorporeal shock wave therapy – a novel effective treatment for erectile dysfunction in severe ED patients who respond poorly to PDE5 inhibitor therapy. J Sex Med 2012; 9(1): 259 – 264. doi: 10.1111/ j.1743-6109.2011.02498.x.
96. Qiu X, Lin G, Xin Z et al. Effects of low ‑ energy shockwave therapy on the erectile function and tissue of a diabetic rat model. J Sex Med 2013; 10(3): 738 – 746. doi: 10.1111/ jsm.12024.
97. Shabsigh R, Padma ‑ Nathan H, Gittleman M et al. Intracavernous alprostadil alfadex (EDEX/ VIRIDAL) is effective and safe in patients with erectile dysfunction after failing sildenafil (Viagra). Urology 2000; 55(4): 477 – 480.
98. Coombs PG, Heck M, Guhring P et al. A review of outcomes of an intracavernosal injection therapy programme. BJU Int 2012; 110(11): 1787 – 1791. doi: 10.1111/ j.1464 - 410X.2012.11080.x.
99. Leungwattanakij S, Flynn V Jr, Hellstrom WJ. Intracavernosal injection and intraurethral therapy for erectile dysfunction. Urol Clin North Am 2001; 28(2): 343 – 354.
100. Linet OI, Ogrinc FG. Efficacy and safety of intracavernosal alprostadil in men with erectile dysfunction. The Alprostadil Study Group. N Engl J Med 1996; 334(14): 873 – 877.
101. Porst H. The rationale for prostaglandin E1 in erectile failure: a survey of worldwide experience. J Urol 1996; 155(3): 802 – 815.
102. Heaton JP, Lording D, Liu SN et al. Intracavernosal alprostadil is effective for the treatment of erectile dysfunction in diabetic men. Int J Impot Res 2001; 13(6): 317 – 321.
103. Lakin MM, Montague DK, VanderBrug Medendorp S et al. Intracavernous injection therapy: analysis of results and complications. J Urol 1990; 143(6): 1138 – 1141.
104. Kattan S. Double‑blind randomized crossover study comparing intracorporeal prostaglandin E1 with combination of prostaglandin E1 and lidocaine in the treatment of organic impotence. Urology 1995; 45(6): 1032 – 1036.
105. Moriel EZ, Rajfer J. Sodium bicarbonate alleviates penile pain induced by intracavernous injections for erectile dysfunction. J Urol 1993; 149(5 Pt 2):1299 – 1300.
106. Flynn RJ, Williams G. Long‑term follow‑up of patients with erectile dysfunction commenced on self injection with intracavernosal papaverine with or without phentolamine. Br J Urol 1996; 78(4): 628 – 631.
107. Sundaram CP, Thomas W, Pryor LE et al. Long‑term follow‑up of patients receiving injection therapy for erectile dysfunction. Urology 1997; 49(6): 932 – 935.
108. Gupta R, Kirschen J, Barrow RC 2nd et al. Predictors of success and risk factors for attrition in the use of intracavernous injection. J Urol 1997; 157(5): 1681 – 1686.
109. Vardi Y, Sprecher E, Gruenwald I. Logistic regression and survival analysis of 450 impotent patients treated with injection therapy: long‑term dropout parameters. J Urol 2000; 163(2): 467 – 470.
110. Montorsi F, Althof SE, Sweeney M et al. Treatment satisfaction in patients with erectile dysfunction switching from prostaglandin E(1) intracavernosal injection therapy to oral sildenafil citrate. Int J Impot Res 2003; 15(6): 444 – 449.
111. Raina R, Lakin MM, Agarwal A et al. Long‑term intracavernous therapy responders can potentially switch to sildenafil citrate after radical prostatectomy. Urology 2004; 63(3): 532 – 537, discussion: 538.
112. Hatzichristou DG, Apostolidis A, Tzortzis V et al.Sildenafil versus intracavernous injection therapy: efficacy and preference in patients on intracavernous injection for more than 1 year. J Urol 2000; 164(4): 1197 – 1200.
113. Buvat J, Lemaire A, Ratajczyk J. Acceptance, efficacy and preference of Sildenafil in patients on long term auto ‑ intracavernosal therapy: a study with follow‑up at one year. Int J Impot Res 2002; 14(6): 483 – 486.
114. Mulhall JP, Daller M, Traish AM et al. Intracavernosal forskolin: role in management of vasculogenic impotence resistant to standard 3 – agent pharmacotherapy. J Urol 1997; 158(5): 1752 – 1758, discussion: 1758 – 1759.
115. Buvat J, Costa P, Morlier D et al. Double‑blind multicenter study comparing alprostadil alphacyclodextrin with moxisylyte chlorhydrate in patients with chronic erectile dysfunction. J Urol 1998; 159(1): 116 – 119.
116. Bechara A, Casabé A, Chéliz G et al. Comparative study of papaverine plus phentolamine versus prostaglandin E1 in erectile dysfunction. J Urol 1997; 157(6): 2132 – 2134.
117. Bennett AH, Carpenter AJ, Barada JH. An improved vasoactive drug combination for a pharmacological erection program. J Urol 1991; 146(6): 1564 – 1565.
118. McMahon CG. A comparison of the response to the intracavernosal injection of papaverine and phentolamine, prostaglandin E1 and a combination of all three agents in the management of impotence. Int J Impot Res 1991; 3 : 113 – 121.
119. Levine SB, Althof SE, Turner LA et al. Side effects of self administration of intracavernous papaverine and phentolamine for the treatment of impotence. J Urol 1989; 141(1): 54 – 57.
120. McMahon CG, Samali R, Johnson H. Treatment of intracorporeal injection nonresponse with sildenafil alone or in combination with triple agent intracorporeal injection therapy. J Urol 1999; 162(6): 1992 – 1997, discussion: 1997 – 1998.
121. Padma ‑ Nathan H, Hellstrom WJ, Kaiser FE et al.Treatment of men with erectile dysfunction with transurethral alprostadil. Medicated Urethral System for Erection (MUSE) Study Group. N Engl J Med 1997; 336(1): 1 – 7.
122. Fulgham PF, Cochran JS, Denman JL et al. Disappointing initial results with transurethral alprostadil for erectile dysfunction in a urology practice setting. J Urol 1998; 160(6 Pt 1): 2041 – 2046.
123. Mulhall JP, Jahoda AE, Ahmed A et al. Analysis of the consistency of intraurethral prostaglandin E(1) (MUSE) during at ‑ home use. Urology 2001; 58(2): 262 – 266.
124. Costa P, Potempa AJ. Intraurethral alprostadil for erectile dysfunction: a review of the literature. Drugs 2012; 72(17): 2243 – 2254. doi: 10.2165/ 11641380 - 000000000 - 00000.
125. Shabsigh R, Padma ‑ Nathan H, Gittleman M et al.Intracavernous alprostadil alfadex is more efficacious, better tolerated, and preferred over intraurethral alprostadil plus optional actis: a comparative, randomized, crossover, multicenter study. Urology 2000; 55(1): 109 – 113.
126. Mulcahy JJ, Austoni E, Barada JH et al. The penile implant for erectile dysfunction. J Sex Med 2004; 1(1): 98 – 109.
127. Montague DK, Angermeier KW. Penile prosthesis implantation. Urol Clin North Am 2001; 28(2): 355 – 361.
128. Montague DK. Penile prosthesis implantation in the era of medical treatment for erectile dysfunction. Urol Clin North Am 2011; 38(2): 217 – 222. doi: 10.1016/ j.ucl.2011.02.009.
129. Martínez ‑ Salamanca JI, Mueller A, Moncada I et al. Penile prosthesis surgery in patients with corporal fibrosis: a state of the art review. J Sex Med 2011; 8(7): 1880 – 1889. doi: 10.1111/ j.1743 - 6109.2011.02281.x.
130. Holloway FB, Farah RN. Intermediate term assessment of the reliability, function and patient satisfaction with the AMS700 Ultrex penile prosthesis. J Urol 1997; 157(5): 1687 – 1691.
131. Tefilli MV, Dubocq F, Rajpurkar A et al. Assessment of psychosexual adjustment after insertion of inflatable penile prosthesis. Urology 1998; 52(6): 1106 – 1112.
132. Montorsi F, Rigatti P, Carmignani G et al. AMS three ‑ piece inflatable implants for erectile dysfunction: a long‑term multi‑institutional study in 200 consecutive patients. Eur Urol 2000; 37(1): 50 – 55.
133. Lux M, Reyes ‑ Vallejo L, Morgentaler A et al. Outcomes and satisfaction rates for the redesigned 2 - piece penile prosthesis. J Urol 2007; 177(1): 262 – 266.
134. Mulhall JP, Ahmed A, Branch J et al. Serial assessment of efficacy and satisfaction profiles following penile prosthesis surgery. J Urol 2003; 169(4): 1429 – 1433.
135. Carson CC, Mulcahy JJ, Govier FE. Efficacy, safety and patient satisfaction outcomes of the AMS 700CX inflatable penile prosthesis: results of a long‑term multicenter study. AMS 700CX Study Group. J Urol 2000; 164(2): 376 – 380.
136. Natali A, Olianas R, Fisch M. Penile implantation in Europe: successes and complications with 253 implants in Italy and Germany. J Sex Med 2008; 5(6): 1503 – 1512. doi: 10.1111/ j.1743 - 6109.2008.00819.x.
137. Bernal RM, Henry GD. Contemporary patient satisfaction rates for three ‑ piece inflatable penile prostheses. Adv Urol 2012; 2012 : 707321. doi: 10.1155/ 2012/ 707321.
138. Lee D, Westney OL, Wang R. Combination surgery for erectile dysfunction and male incontinence. Curr Urol Rep 2011; 12(6): 461 – 469. doi: 10.1007/ s11934 - 011 - 0220 - 2.
139. Wilson SK, Cleves MA, Delk JR 2nd. Comparison of mechanical reliability of original and enhanced Mentor Alpha I penile prosthesis. J Urol 1999; 162(3 Pt 1): 715 – 718.
140. Carson CC 3rd. Efficacy of antibiotic impregnation of inflatable penile prostheses in decreasing infection in original implants. J Urol 2004; 171(4): 1611 – 1614.
141. Wolter CE, Hellstrom WJ. The hydrophilic ‑ coated inflatable penile prosthesis: 1‑year experience. J Sex Med 2004; 1(2): 221 – 224.
142. Carson CC 3rd, Mulcahy JJ, Harsch MR. Long‑term infection outcomes after original antibiotic impregnated inflatable penile prosthesis implants: up to 7.7 years of followup. J Urol 2011; 185(2): 614 – 618. doi: 10.1016/ j.juro.2010.09.094.
143. Serefoglu EC, Mandava SH, Gokce A et al. Long‑term revision rate due to infection in hydrophilic ‑ coated inflatable penile prostheses: 11‑year follow‑up. J Sex Med 2012; 9(8): 2182 – 2186. doi: 10.1111/ j.1743 - 6109.2012.02830.x.
144. Mulcahy JJ. Long‑term experience with salvage of infected penile implants. J Urol 2000; 163(2): 481 – 482.
145. Henry GD, Donatucci CF, Conners W et al. An outcomes analysis of over 200 revision surgeries for penile prosthesis implantation: a multicenter study. J Sex Med 2012; 9(1): 309 – 315. doi: 10.1111/ j.1743-6109.2011.02524.x.
4. Předčasná ejakulace
4.1 Úvod
Přestože je předčasná ejakulace velmi častou formou sexuální dysfunkce u mužů, mechanizmus této poruchy nebyl doposud dostatečně objasněn. Pacienti často nechtějí hovořit o svých symptomech a řada lékařů není obeznámena s efektivními metodami léčby. Z tohoto důvodu může být stanovena nesprávná diagnóza a zvolena nevhodná léčba [1]. Navíc v současné době neexistuje pro léčbu předčasné ejakulace (PE) žádná registrovaná farmakoterapie.
Tato guidelines prezentují na důkazech založenou analýzu [2] publikací zabývajících se definicí, klinickým hodnocením a léčbou této poruchy. Dále klinickým lékařům přinášejí doporučení pro diagnostiku a léčbu PE.
4.2 Definice PE
4.2.1 Přehled
V minulosti se užívaly dvě oficiální definice předčasné ejakulace, ani jedna z nich však nebyla všeobecně přijata:
- Diagnostický a statistický manuál mentálních poruch IV. revize (DSM ‑ IV ‑ TR) definuje předčasnou ejakulaci jako „přetrvávající nebo recidivující ejakulaci, k níž dochází při minimální sexuální stimulaci již před vaginální penetrací, během ní, nebo krátce po ní, aniž by o ni jedinec usiloval. Lékař musí zohlednit faktory ovlivňující délku trvání fáze vzrušení, jako jsou věk, délku intimního vztahu s partnerkou a četnost pohlavního styku v poslední době“ [3].
- Světová zdravotnická organizace ve své Mezinárodní klasifikaci onemocnění ‑ 10 (ICD ‑ 10) definuje PE jako „neschopnost oddálit ejakulaci tak, aby si muž mohl dostatečně užít sexuální styk, což se projevuje ejakulováním před zahájením sexuálního styku nebo velmi krátce po penetraci (časový údaj: před zahájením pohlavního aktu nebo do 15 sekund po jeho zahájení) nebo se ejakulace dostaví i v případě, že penis není dostatečně ztopořený pro uskutečnění pohlavního styku. Tento problém není zapříčiněn delší sexuální abstinencí“ [4].
V nedávné době byly navrženy další dvě definice:
SICSED (The Second International Consultation on Sexual and Erectile Dysfunction) definuje PE jako „ejakulaci, k níž dochází při minimální stimulaci a dříve, než by si pacient představoval, před vaginální penetrací nebo krátce po ní, což pacientovi způsobuje stres. Nad touto ejakulací pacient nemá žádnou nebo pouze minimální vědomou kontrolu“ [5].
Mezinárodní společnost sexuální medicíny (ISSM) přijala naprosto novou definici PE. Jedná se o první definici PE založenou na důkazech. „Předčasná ejakulace je mužská sexuální dysfunkce, při níž muž vždy nebo téměř vždy ejakuluje před vaginální penetrací nebo během jedné minuty po penetraci a není schopen ve všech nebo téměř všech případech tuto ejakulaci oddálit. Tato dysfunkce má negativní následky v podobě úzkosti, stresu, frustrace a/ nebo vyhýbání se sexuální aktivitě“.
Je třeba poznamenat, že tato definice se vztahuje pouze na muže, kteří se s PE potýkají celý život, a omezuje se pouze na vaginální penetraci, neboť v současné době nemáme k dispozici dostatečné objektivní údaje pro definici získané PE založenou na důkazech [6].
Všechny čtyři definice zohledňují čas, za který se ejakulace dostaví, neschopnost tuto ejakulaci kontrolovat ani oddálit a negativní důsledky pro pacienta (obtěžování/ stres). Hlavním námětem pro debatu je však číselné vyjádření času, za který se ejakulace dostaví. Tento údaj je často označován jako doba latence ejakulace intravaginálně (IELT). Bylo prezentováno několik návrhů pro aktualizaci definice PE během stávající DSM ‑ V a ICD ‑ 11 [7 – 11].
4.2.2 Klasifikace
Předčasnou ejakulaci lze klasifikovat jako „celoživotní“ (primární) nebo „získanou“ (sekundární) [12]. Celoživotní PE pacienta provází celý život od první sexuální zkušenosti. Ejakulace se dostavuje příliš brzy (před vaginální penetrací nebo < 1 – 2 min poté). Získaná PE se u pacienta rozvine postupně nebo náhle po předchozí zkušenosti s normální ejakulací. Doba do ejakulování je krátká, ovšem obvykle ne tak krátká jako v případě celoživotní PE.
V nedávné době byly navrženy další syndromy PE [11]:
- Pro „přirozenou nestálou PE“ je charakteristický nekonzistentní a nepravidelný výskyt předčasné ejakulace, což je normální variací v sexuálním životě.
- Pro „ejakulační dysfunkci připomínající předčasnou ejakulaci“ je charakteristické subjektivní vnímání konzistentně/ nekonzistentně se vyskytujícího rychlého nástupu ejakulace během pohlavního styku, přestože IELT je v normálním rozmezí nebo je dokonce delší. Tuto situaci nelze považovat za symptom ani manifestaci skutečné patologie.
Tyto dva nové typy mohou být užitečné při klasifikaci, diagnostice a léčbě pacientů s PE, konkrétní roli těchto dvou kategorií je třeba teprve definovat [13].
4.3 Epidemiologie
4.3.1 Prevalence
Hlavní problém hodnocení prevalence PE spočívá v absenci přesné (validované) definice v době provádění průzkumů [14]. Navzdory tomu epidemiologické studie konzistentně prokazují, že PE představuje (alespoň podle definice DSM ‑ IV) nejčastější formu mužské sexuální dysfunkce. Prevalence se uvádí v rozmezí 20 – 30 % [15 – 17].
Nejvyšší míru prevalence 31 % (u mužů ve věku 18 – 59 let) uvádí americká studie NHSLS [16].
V jednotlivých věkových kategoriích se uvádí následující míra prevalence: 30 % u mužů ve věku 18 – 29 let, 32 % u mužů ve věku 30 – 39 let, 28 % u mužů ve věku 40 – 49 let a 55 % u mužů ve věku 50 – 59 let. Vysokou míru prevalence v těchto studiích lze přičítat odpovědi na škále (ano/ ne) na otázku, zda se ejakulace dostaví příliš brzo, protože evropské studie uvádějí významně nižší míru prevalence. Britský poštou zasílaný průzkum odhaduje míru prevalence v rozmezí 14 % (3 měsíce) až 31 % (celoživotně) [18]. Francouzský telefonický průzkum mezi muži ve věku 18 – 69 let odhaduje prevalenci celoživotní předčasné ejakulace na 15 % (tento údaj zahrnuje 5 % mužů, kteří často ejakulují před penetrací, a 10 % mužů, kteří ejakulují okamžitě po vaginální penetraci) [19]. Švédský průzkum uvádí 9% míru celkové prevalence u mužů ve věku 18 – 74 let [20], v jednotlivých věkových kategoriích byla zaznamenána následující míra prevalence: 4 % u mužů 18 – 24 let, 7 % u mužů 25 – 34 let, 8 % u mužů 35 – 49 let, 8 % u mužů 50 – 65 let a 14 % u mužů 66 – 74 let.
Dánská studie zabývající se sexuálními problémy založená na dotazníku (12 otázek) a pohovoru se subjekty (23 otázek) uvádí u mužů starších 51 let 14% míru prevalence [21]. Italský průzkum využívající dotazníky uvádí 21% míru prevalence [22]. Nizozemský průzkum (dotazníky, které vyplňuje sám respondent) uvádí u mužů ve věku 50 – 78 let 13% míru prevalence [23].
Mezinárodní internetový průzkum PEPA (Premature Ejaculation Prevalence and Attitudes) uvádí 22,7% míru prevalence (24,0 % v USA, 20,3 % v Německu a 20,0 % v Itálii) [17]. Průzkum GSSAB (Global Study of Sexual Attitudes and Behaviors), který byl proveden v 29 různých státech a zahrnoval muže ve věku 40 – 80 let sestávající z osobního nebo telefonického pohovoru a vyplnění poštovního dotazníku, potvrzuje, že celosvětová prevalence PE činí téměř 30 %. S výjimkou států Středního východu (s o něco nižší mírou prevalence: 10 – 15 %) je míra prevalence PE celosvětově srovnatelná [15]. Observační studie probíhající v pěti evropských státech, která využívala proměnné IELT a PEP (premature ejaculation profile), uvádí 18% míru prevalence [24], což je srovnatelný údaj jako v americké observační studii podobného designu [25].
Další výzkum je třeba zaměřit na identifikaci prevalence celoživotní a získané PE. Omezená data nasvědčují tomu, že prevalence celoživotní PE, definováno jako IELT < 1 – 2 min, činí přibližně 2 – 5 % [20,25]. Tento údaj podporuje mírný stupeň genetické komponenty PE [26] a nízká prevalence IELT < 1 min [27].
4.3.2 Patofyziologie a rizikové faktory
Příčina vzniku PE není známa, omezené údaje podporují hypotézy nasvědčující biologické a psychologické etiologii (např. úzkost, hypersenzitivita penisu a dysfunkce receptoru 5 – HT) [5]. Rovněž patofyziologie PE zůstává z velké části neznámá. Na rozdíl od ED v případě PE nedochází k žádné poruše fyziologických procesů, které mají na starost násilné vypuzení ejakulátu z uretrálního meatu.
U významného procenta mužů s erektilní dysfunkcí se rovněž vyskytne PE [15]. Silná úzkost související s ED může zhoršovat PE, kvůli čemuž může být chybně diagnostikována PE namísto ED.
Podle NHLS není prevalence PE ovlivněna věkem [16,17], zatímco prevalence ED se spolu se zvyšujícím se věkem zhoršuje. Rodinný stav ani finanční podmínky nemají žádný vliv na PE [16]. PE se však vyskytuje častěji u afroamerického a hispánského etnika a muslimů [28,29], prevalence může být vyšší rovněž u populace s menším vzděláním [15,16]. Další rizikové faktory mohou zahrnovat genetické predispozice [30], celkově špatný zdravotní stav a obezitu [16], zánět prostaty [31,32], poruchu hormonu štítné žlázy [33], emocionální problémy a stres [16,34] a traumatickou sexuální zkušenost [15,16].
Jediná publikovaná studie zabývající se modifikací rizik/ preventivními opatřeními [35] uvádí, že úspěšná eradikace organizmů zodpovědných za vznik chronické prostatitidy vedla u pacientů s PE k významnému prodloužení IELT a zlepšení kontroly nad ejakulací (ve srovnání s neléčenými pacienty).
4.4 Vliv na kvalitu života
Muži trpící předčasnou ejakulací častěji uvádějí menší spokojenost s pohlavním stykem a se sexuálním životem vůbec, mají potíže se během aktu uvolnit a rovněž uvádějí menší četnost sexuální aktivity obecně [36,37]. Negativní dopad PE však sahá i mimo rámec sexuální dysfunkce. PE narušuje sebevědomí muže a jeho vztah s partnerkou, může způsobovat psychickou nepohodu, úzkost, pocit studu a depresi [36,38]. PE pravděpodobně nemá žádný vliv na libido ani celkový zájem o sexuální aktivitu [39]. Partnerčina spokojenost s pohlavním životem však klesá spolu se zhoršující se závažností PE [40].
Navzdory závažným psychickým důsledkům a vlivu PE na kvalitu života pouze malé procento mužů vyhledá léčbu. Podle průzkumu GSSAB 78 % mužů, kteří uvedli výskyt sexuální dysfunkce, nevyhledalo odbornou pomoc ani poradenství [15]. Lékařskou pomoc muži častěji vyhledají kvůli erektilní dysfunkci než kvůli PE [15]. Podle průzkumu PEPA vyhledalo lékařskou konzultaci pouze 9 % mužů uvádějících PE [17].
Hlavními důvody, proč muži s PE nevyhledají lékařskou pomoc, jsou pocit studu a přesvědčení, že pro jejich potíže neexistuje žádná léčba. Samotní lékaři se často cítí nepříjemně, pokud mají se svými pacienty konzultovat sexuální otázky, obvykle z důvodu pocitu studu a nedostatečného školení nebo nedostatečných zkušeností s léčbou PE [41,42]. Úkolem lékaře je své pacienty podpořit v diskuzi o PE.
4.5 Diagnostika
Diagnostika PE je založena na medicínské a sexuální anamnéze pacienta [43,44]. Na základě anamnézy je PE klasifikována jako celoživotní nebo získaná. Dále je třeba posoudit, zda se jedná o situační typ (k PE dochází pouze za specifických okolností a pouze s konkrétní partnerkou) nebo je výskyt PE konzistentní. Speciální pozornost je třeba věnovat délce trvání ejakulace, stupni sexuální stimulace, dopadu PE na sexuální život a kvalitu života a užívání/ neužívání medikace. Dále je velmi důležité správně odlišit PE od ED.
U řady pacientů s ED se následkem úzkosti související s obtížemi navodit/ udržet erekci rozvine i sekundární PE [45]. Někteří pacienti si nejsou vědomi skutečnosti, že ochabnutí erekce po ejakulaci je normální, a mohou si mylně stěžovat na erektilní dysfunkci, přestože jejich skutečným problémem je PE [46].
V současné době existuje několik vzájemně se překrývajících definic PE, v nichž se konzistentně vyskytují čtyři následující faktory (tab. 9), což má za následek multidimenzionální diagnostiku [47].
Tab. 9. Společné faktory různých definic ED. 
4.5.1 Doba latence ejakulace intravaginálně (IELT)
Pouze pomocí proměnné IELT nelze definovat PE, protože tento údaj se mezi muži s PE a bez PE významně překrývá [24,25]. IELT má výrazný přímý efekt na pacientovo subjektivní vnímání kontroly nad ejakulací, ale nemá přímý efekt na stres související s ejakulací ani na celkovou spokojenost s pohlavním stykem [48]. Subjektivní vnímání kontroly nad ejakulací pacientem má navíc významný přímý dopad na stres související s ejakulací i celkovou spokojenost s pohlavním stykem (každý z výše uvedených má přímý dopad na partnerské problémy související s ejakulací).
V každodenní klinické praxi je postačující údaj IELT podle vlastního odhadu pacienta. Pomocí odhadu IELT i přesného měření IELT pomocí stopek lze určit správný status PE s 80% senzitivitou a 80% specificitou [49].
Specificitu lze dále zvýšit až na 96 % kombinací IELT s odpovědí na PRO (patient ‑ reported outcome), což je jediná otázka dotazující se na pacientovo subjektivní vnímání kontroly nad ejakulací a spokojenost s pohlavním stykem (škála v rozmezí od 0 = velmi špatný do 4 = velmi dobrý) a stres související s partnerskými problémy (od 0 = žádný do 4 = extrémní). Pro účely klinických studií je však nezbytné užívání údaje IELT naměřeno pomocí stopek.
4.5.2 Dotazníky pro hodnocení PE
Potřeba objektivně zhodnotit PE vedla ke vzniku několika dotazníků založených na PRO [47]. Pouze dva dotazníky umožňují rozlišit pacienty s PE/bez PE:
PEDT (premature ejaculation diagnostic tool) – pětipoložkový dotazník založený na pohovorech s pacienty z USA, Německa a Španělska. Tento instrument hodnotí kontrolu nad ejakulací, frekvenci, minimální stimulaci, stres a partnerské problémy [50,51].
AIPE (arabic index of premature ejaculation) – sedmipoložkový dotazník vyvinutý v Saudské Arábii. Hodnotí sexuální touhu, tvrdost erekce pro uskutečnění pohlavního styku, čas, za který se ejakulace dostaví, kontrolu nad ejakulací, spokojenost pacienta i jeho partnerky, výskyt úzkosti nebo deprese [52].
Tyto instrumenty představují významný krok ke zjednodušení metodologie studií testujících farmakoterapii pro léčbu PE. Dotazníky je však třeba ještě validovat pro užití v různých kulturních podmínkách [53].
Další dotazníky užívané pro popis PE a posouzení účinku léčby zahrnují PEP [25], IPE (Index of Premature Ejaculation) [54] a MSHQ ‑ EjD (Male Sexual Health Questionnaire Ejaculatory Dysfunction) [55]. V současné době je jejich užívání v klinické praxi považováno za volitelné.
4.5.3 Fyzikální vyšetření
Fyzikální vyšetření je součástí úvodního vyšetření všech pacientů s PE. Zahrnuje rychlé vyšetření vaskulárního, endokrinního a neurologického systému s cílem identifikovat průvodní onemocnění související s PE nebo s jinou sexuální dysfunkcí, např. chronická onemocnění, endokrinopatie, autonomní neuropatie, Peyronieho onemocnění, uretritida nebo prostatitida. Laboratorní nebo fyziologické testy je nutné zaměřit na konkrétní nálezy zjištěné při odběru anamnézy nebo fyzikálním vyšetření a v rámci běžného postupu se nedoporučují [44].
4.6 Doporučení pro diagnostiku PE (dop. 3)
Dop. 3. Doporučení pro diagnostiku PE. 
4.7 Literatura
1. Rosenberg MT, Sadovsky R. Identification and diagnosis of premature ejaculation. Int J Clin Pract 2007; 61(6): 903 – 908.
2. Oxford Centre for Evidence ‑ Based Medicine Levels of Evidence (May 2009). Available from: http:/ / www.cebm.net/ index.aspx?o=1025.
3. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 4th Ed. Text Revision. Washington, D.C.: American Psychiatric Publishing, Inc 2000.
4. International Classification of Diseases and Related Health Problems. 10. ed. Geneva: World Health Organization 1994.
5. McMahon CG, Abdo C, Incrocci L et al. Disorders of orgasm and ejaculation in men. J Sex Med 2004; 1(1): 58 – 65.
6. McMahon CG, Althof SE, Waldinger MD et al. An evidence‑based definition of lifelong premature ejaculation: report of the International Society for Sexual Medicine (ISSM) ad hoc committee for the definition of premature ejaculation. J Sex Med 2008; 5(7): 1590 – 1606. doi: 10.1111/ j.1743 - 6109.2008.00901.x.
7. Balon R, Segraves RT, Clayton A. Issues for DSM ‑ V: sexual dysfunction, disorder, or variation along normal distribution: toward rethinking DSM criteria of sexual dysfunctions. Am J Psychiatry 2007; 164(2): 198 – 200.
8. Waldinger MD, Schweitzer DH. The DSM ‑ IV ‑ TR is an inadequate diagnostic tool for premature ejaculation. J Sex Med 2007; 4(3): 822 – 823.
9. Waldinger MD, Schweitzer DH. The use of old and recent DSM definitions of premature ejaculation in observational studies: a contribution to the present debate for a new classification of PE in the DSM ‑ V. J Sex Med 2008; 5(5): 1079 – 1087. doi: 10.1111/ j.1743 - 6109.2008.00789.x.
10. Waldinger MD, Schweitzer DH. Changing paradigms from a historical DSM ‑ III and DSM ‑ IV view toward an evidence‑based definition of premature ejaculation. Part I – validity of DSM ‑ IV ‑ TR. J Sex Med 2006; 3(4): 682 – 692.
11. Waldinger MD, Schweitzer DH. Changing paradigms from a historical DSM ‑ III and DSM ‑ IV view toward an evidence‑based definition of premature ejaculation. Part II ‑ proposals for DSM ‑ V and ICD ‑ 11. J Sex Med 2006; 3(4): 693 – 705.
12. Godpodinoff ML. Premature ejaculation: clinical subgroups and etiology. J Sex Marital Ther 1989; 15(2): 130 – 134.
13. Waldinger MD. Premature ejaculation: state of the art. Urol Clin North Am 2007; 34(4): 591 – 599.
14. Waldinger MD. The neurobiological approach to premature ejaculation. J Urol 2002; 168(6): 2359 – 2367.
15. Laumann EO, Nicolosi A, Glasser DB et al. Sexual problems among women and men aged 40 – 80 y: prevalence and correlates identified in the Global Study of Sexual Attitudes and Behaviors. Int J Impot Res 2005; 17(1): 39 – 57.
16. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA 1999; 281(6): 537 – 544.
17. Porst H, Montorsi F, Rosen RC et al. The Premature Ejaculation Prevalence and Attitudes (PEPA) survey: prevalence, comorbidities, and professional help ‑ seeking. Eur Urol 2007; 51(3): 816 – 823, discussion: 824.
18. Dunn KM, Croft PR, Hackett GI. Sexual problems: a study of the prevalence and need for health care in the general population. Fam Pract 1998; 15(6): 519 – 524.
19. Spira A, Bajos N, Giami A et al. Cross ‑ national comparisons of sexual behavior surveys – methodological difficulties and lessons for prevention. Am J Public Health 1998; 88(5): 730 – 731.
20. Fugl ‑ Meyer AR, Sjogren Fugl ‑ Meyer K. Sexual disabilities, problems and satisfaction in 18 – 74 year old Swedes. Scan J Sexol 1999; 2 : 79 – 105.
21. Solstad K, Hertoft P. Frequency of sexual problems and sexual dysfunction in middle ‑ aged Danish men. Arch Sex Behav 1993; 22(1): 51 – 58.
22. Basile Fasolo C, Mirone V, Gentile V et al. Premature ejaculation: prevalence and associated conditions in a sample of 12,558 men attending the andrology prevention week 2001 – a study of the Italian Society of Andrology (SIA). J Sex Med 2005; 2(3): 376 – 382.
23. Blanker MH, Bosch JL, Groeneveld FP et al. Erectile and ejaculatory dysfunction in a community‑based sample of men 50 to 78 years old: prevalence, concern, and relation to sexual activity. Urology 2001; 57(4): 763 – 768.
24. Giuliano F, Patrick DL, Porst H et al. Premature ejaculation: results from a five ‑ country European observational study. Eur Urol 2008; 53(5): 1048 – 1057.
25. Patrick DL, Althof SE, Pryor JL et al. Premature ejaculation: an observational study of men and thein partners. J Sex Med 2005; 2(3): 358 – 367.
26. Jern P, Santtila P, Witting K et al. Premature and delayed ejaculation: genetic and environmental effects in a population‑based sample of Finnish twins. J Sex Med 2007; 4(6): 1739 – 1749.
27. Waldinger MD, Quinn P, Dilleen M et al. A multinational population survey of intravaginal ejaculation latency time. J Sex Med 2005; 2(4): 492 – 497.
28. Richardson D, Goldmeier D. Premature ejaculation – does country of origin tell us anything about etiology? J Sex Med 2005; 2(4): 508 – 512.
29. Carson C, Gunn K. Premature ejaculation: definition and prevalence. Int J Impot Res 2006; 18 (Suppl 1): S5 – S13.
30. Waldinger MD, Rietschel M, Nöthen MM et al. Familial occurrence of primary premature ejaculation. Psychiatr Genet 1998; 8(1): 37 – 40.
31. Screponi E, Carosa E, Di Stasi SM et al. Prevalence of chronic prostatitis in men with premature ejaculation. Urology 2001; 58(2): 198 – 202.
32. Shamloul R, el ‑ Nashaar A. Chronic prostatitis in premature ejaculation: a cohort study in 153 men. J Sex Med 2006; 3(1): 150 – 154.
33. Carani C, Isidori AM, Granata A et al. Multicenter study on the prevalence of sexual symptoms in male hypo ‑ and hyperthyroid patients. J Clin Endocrinol Metab 2005; 90(12): 6472 – 6479.
34. Dunn KM, Croft PR, Hackett GI. Association of sexual problems with social, psychological, and physical problems in men and women: a cross sectional population survey. J Epidemiol Community Health 1999; 53(3): 144 – 148.
35. El ‑ Nashaar A, Shamloul R. Antibiotic treatment can delay ejaculation in patients with premature ejaculation and chronic bacterial prostatitis. J Sex Med 2007; 4(2): 491 – 496.
36. Rowland D, Perelman M, Althof S et al. Self ‑ reported premature ejaculation and aspects of sexual functioning and satisfaction. J Sex Med 2004; 1(2): 225 – 232.
37. Rowland DL, Patrick DL, Rothman M et al. The psychological burden of premature ejaculation. J Urol 2007; 177(3): 1065 – 1070.
38. Symonds T, Roblin D, Hart K et al. How does premature ejaculation impact a man’s life? J Sex Marital Ther 2003; 29(5): 361 – 370.
39. Riley A, Segraves RT. Treatment of premature ejaculation. Int J Clin Pract 2006; 60(6): 694 – 697.
40. Byers ES, Grenier G. Premature or rapid ejaculation: heterosexual couples’ perceptions of men’s ejaculatory behavior. Arch Sex Behav 2003; 32(3): 261 – 270.
41. Sotomayor M. The burden of premature ejaculation: the patient’s perspective. J Sex Med 2005; 2 (Suppl 2): 110 – 114.
42. Solursh DS, Ernst JL, Lewis RW et al. The human sexuality education of physicians in North American medical schools. Int J Impot Res 2003; 15 (Suppl 5):S41 – S45.
43. Sharlip I. Diagnosis and treatment of premature ejaculation: the physician’s perspective. J Sex Med 2005; 2 (Suppl 2): 103 – 109.
44. Shabsigh R. Diagnosing premature ejaculation: a review. J Sex Med 2006; 3 (Suppl 4): 318 – 323.
45. Rowland DL, Slob AK. Premature ejaculation: psychophysiological considerations in theory, research, and treatment. Annu Rev Sex Res 1997; 8 : 224 – 253.
46. Althof SE. Prevalence, characteristics and implications of premature ejaculation/ rapid ejaculation. J Urol 2006; 175(3 Pt 1): 842 – 848.
47. Althof SE, Symonds T. Patient reported outcomes used in the assessment of premature ejaculation. Urol Clin North Am 2007; 34(4): 581 – 589.
48. Patrick DL, Rowland D, Rothman M. Interrelationships among measures of premature ejaculation: the central role of perceived control. J Sex Med 2007; 4(3): 780 – 788.
49. Rosen RC, McMahon CG, Niederberger C et al. Correlates to the clinical diagnosis of premature ejaculation: results from a large observational study of men and their partners. J Urol 2007; 177(3): 1059 – 1064, discussion: 1064.
50. Symonds T, Perelman M, Althof S et al. Further evidence of the reliability and validity of the premature ejaculation diagnostic tool. Int J Impot Res 2007; 19(5): 521 – 525.
51. Symonds T, Perelman MA, Althof S et al. Development and validation of a premature ejaculation diagnostic tool. Eur Urol 2007; 52(2): 565 – 573.
52. Arafa M, Shamloul R. Development and evaluation of the Arabic Index of Premature Ejaculation (AIPE). J Sex Med 2007; 4(6): 1750 – 1756.
53. McMahon CG. Ejaculatory latency vs. patient ‑ reported outcomes (PROs) as study end points in premature ejaculation clinical trials. Eur Urol 2007; 52(2): 321 – 323.
54. Althof S, Rosen R, Symonds T et al. Development and validation of a new questionnaire to assess sexual satisfaction, control, and distress associated with premature ejaculation. J Sex Med 2006; 3(3): 465 – 475.
55. Rosen RC, Catania JA, Althof SE et al. Development and validation of four ‑ item version of Male Sexual Health Questionnaire to assess ejaculatory dysfunction. Urology 2007; 69(5): 805 – 809.
4.8 Léčba
V řadě partnerských vztahů nezpůsobuje ejakulační dysfunkce žádné nebo pouze minimální potíže. V takovém případě stačí léčbu omezit na psychosexuální poradenství. Před zahájením terapie je s pacientem třeba důkladně prodiskutovat jeho očekávání od léčby. Jakoukoli další sexuální dysfunkci, a zejména erektilní dysfunkci nebo infekci v močopohlavních cestách (např. prostatitida) je vhodné léčit před zahájením terapie PE nebo současně s ní.
Bylo prokázáno, že řada behaviorálních technik přináší benefit při léčbě PE. Tato modalita je vhodná pro pacienty, jimž nevyhovuje farmakoterapie. Behaviorální léčba se však nedoporučuje pacientům s celoživotní PE, alespoň ne v rámci léčby první volby. Tento způsob léčby je časově náročný, vyžaduje podporu partnerky a pro pacienta může být obtížný. Navíc v současné době nejsou známy dlouhodobé výsledky behaviorálních technik u pacientů s PE.
Podstatou léčby celoživotní PE je farmakoterapie. Vzhledem k tomu, že FDA ani EMA dosud neschválily žádnou medikaci pro léčbu PE, jsou dosud všechny aplikace mimo běžnou indikaci. Konzistentní účinek byl dosud zaznamenán pouze při aplikaci selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) a topických anestetik on demand. Dlouhodobé výsledky farmakoterapie nejsou zatím k dispozici.
Autoři provedli analýzu (založenou na důkazech) všech v současné době dostupných léčebných modalit a uvádějí příslušné úrovně důkazů a stupně doporučení. Ve schématu 3 je uveden terapeutický algoritmus.
4.8.1 Psychologická/ behaviorální terapie
Behaviorální strategie využívají zejména tzv. Semansovu [1] „stop ‑ start“ techniku a její modifikace a dále techniku „squeeze“, jak ji popisují Masters a Johnsonová:
- Při „stop ‑ start“ technice partnerka stimuluje penis partnera až do chvíle, kdy pacient pociťuje nutkání ejakulovat. V tomto momentě pacient partnerku zastaví, vyčká, až nutkání přejde, a poté partnerka pokračuje ve stimulaci.
- Technika „squeeze“ je velmi podobná, pouze partnerka vyvíjí těsně před ejakulací manuální tlak na glans penisu tak dlouho, než nutkání ejakulovat pomine.
Obě techniky se obvykle provádí v cyklu se třemi pauzami a poté je pacientovi umožněno ejakulovat.
Behaviorální strategie vycházejí z předpokladu, že k PE dochází v důsledku toho, že pacient není schopen rozpoznat pocit stupňujícího se vzrušení a nevyhnutelnost ejakulace. Tento trénink, kdy je pacient postupně vystavován stále intenzivnější a déletrvající stimulaci, může pomoci oslabit spojitost mezi stimulem a reakcí při současném zachování intenzity a délky trvání stimulu těsně pod prahovou hodnotou, kdy dochází ke spuštění reakce. Různé modifikace těchto technik znesnadňují jejich srovnání.
Masturbace před očekávaným sexuálním aktem je technika, kterou užívá řada mladších mužů.
Po masturbaci je penis desenzitizován, díky čemuž se další ejakulace po refrakterní periodě dostaví později. Jiný přístup spočívá v rozpoznání známek intenzivního vzrušení a jeho udržování těsně pod tou úrovní, jež spouští ejakulační reflex. Tato technika má podobnou účinnost jako technika „stop ‑ start“ [2].
V krátkodobém horizontu se uvádí 50 – 60% míra úspěšnosti [3,4]. V současné době však neexistuje žádný kontrolovaný výzkum, který by potvrzoval účinnost behaviorálních technik. Naopak dvojitě zaslepená, zkřížená studie prokazuje, že farmakoterapie (chlomipramin, sertralin, paroxetin a sildenafil) vede k většímu prodloužení IELT než behaviorální terapie [5]. Klinické poznatky však nasvědčují tomu, že zlepšení docílené pomocí těchto technik nemá trvalý charakter [6,7].
4.8.1.1 Doporučení pro psychologickou/ behaviorální terapii PE (dop. 4)
Dop. 4. Doporučení pro psychologickou/behaviorální léčbu PE. 
4.8.2 Topická anestetika
Aplikace lokálního anestetika pro oddálení ejakulace je nejstarší metodou medikamentózní léčby PE [8].
Několik studií [9,10] podporuje hypotézu, že topické desenzitizující přípravky snižují citlivost glans penisu, a tak oddalují ejakulaci, aniž by však negativně ovlivňovaly prožitek z ejakulace.
4.8.2.1 Krém obsahující lidokain‑prilokain
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie uvádí, že aplikace krému obsahujícího lidokain‑prilokain zvyšuje délku IELT z jedné min (placebo) na 6,7 min v terapeutické skupině [11]. Jiná randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie testující aplikaci krému obsahujícího lidokain‑prilokain uvádí významné prodloužení IELT (měřeno stopkami) z 1,49 na 8,45 min. V placebo skupině nebyl zaznamenán žádný rozdíl (z 1,67 na 1,95 min) [12]. Krém s lidokainem ‑ prilokainem (5%) se aplikuje 20 – 30 min před pohlavním aktem. Déle topicky aplikované anestetikum (30 – 40 min) způsobuje u velkého procenta mužů z důvodu znecitlivění penisu ztrátu erekce [11]. Aby nedošlo k difuzi anestetického přípravku skrze vaginální stěnu (což by způsobilo znecitlivění vaginální stěny partnerky), je nezbytné užívat kondom. Případně lze kondom před pohlavním stykem sejmout a z penisu smýt jakékoli zbytky aktivní látky. Přestože nebyl zaznamenán výskyt žádných významných vedlejších účinků, je topická aplikace anestetika kontraindikována u pacientů (a jejich partnerek) s alergií na kteroukoli složku krému.
Studie II. fáze hodnotí účinnost lidokainu 7,5 mg plus prilokainu 2,5 mg ve formě aerosolu (topical eutectic mixture for premature ejaculation – TEMPE) [13,14]. Doba latence ejakulace intravaginálně se u pacientů užívajících přípravek TEMPE prodloužila z počáteční jedné min na 4,9 min, zatímco u pacientů v placebo skupině pouze z 0,9 min na 1,6 min (p < 0,01). Předpokládá se, že lidokain‑prilokain penetruje do žaludu penisu během 5 – 10 min, neporušenou keratinizovanou kůží však penetruje obtížněji, což vede k redukci znecitlivění penisu i ED [14,15].
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s paralelní skupinou prokazuje, že aplikace lidokainu ‑ prilokainu vykazuje srovnatelnou účinnost jako tato modalita v kombinaci se sildenafilem (50 mg před stykem) a významně lepší účinnost než samotná aplikace sildenafilu [16]. K dispozici však nejsou žádné údaje o IELT.
4.8.2.2 SS krém (severance secret cream)
Krém SS je topické anestetikum obsahující výtažky z devíti bylin. Krém se aplikuje na glans penisu hodinu předem a smyje se bezprostředně před stykem. Krém SS zvyšuje vibrační hranici, prodlužuje délku latence a zvyšuje amplitudu somatosenzoricky vyvolaných potenciálů měřených na glans penisu [17,18]. Dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie [19] uvádí, že aplikace 0,2 g krému vedla k prodloužení IELT z 1,37 min na 10,92 min vs 2,45 min v placebo skupině. Pacienti užívající krém uváděli zlepšení spokojenosti s pohlavním stykem o 82 %, pacienti užívající placebo pouze o 20 %. 18,5 % pacientů uvádělo pocit slabého pálení v oblasti aplikace a mírnou bolestivost. Při aplikaci nebyl zaznamenán žádný nežádoucí efekt na sexuální funkci, partnerku ani žádné systémové vedlejší účinky.
4.8.2.3 Doporučení pro topickou terapii PE (dop. 5)
Dop. 5. Doporučení pro topickou léčbu PE. 
4.8.3 Selektivní inhibitory zpětného vychytávání serotoninu
Ejakulace je zprostředkována spouštěčem ejakulace v míše [20,21] a sestupnou supraspinální modulací z několika oblastí mozku. Na tomto procesu se podílí i neurotransmiter 5 - hydroxytryptamin (5 - HT, serotonin). Inhibující efekt 5 - HT na ejakulaci je pravděpodobně zapříčiněn centrální aktivací (tj. spinálně a supraspinálně) receptorů 5 - HT1B a 5 - HT2C, zatímco stimulace receptorů 5 - HT1A naopak urychluje ejakulaci.
Selektivní inhibitory zpětného vychytávání serotoninu (SSRI) se užívají při léčbě psychických poruch. Vzhledem k tomu, že však mohou oddálit ejakulaci, se užívají běžně i mimo svou indikaci pro léčbu PE.Stejně jako při léčbě deprese se efekt SSRI na PE dostaví až po jednom nebo dvou týdnech [22]. Chronické užívání SSRI může způsobovat dlouhodobé zvýšení hladiny serotoninu v synaptické štěrbině, což vede k desenzitizaci receptorů 5 – HT1A a 5 – HT1B [23]. Již v roce 1973 bylo poprvé popsáno využití clomipraminu, nejvíce serotonergního tricyklického antidepresiva, při léčbě PE [24]. Selektivní inhibitory zpětného vychytávání serotoninu způsobily převrat v léčbě PE, ale rovněž změnily naše chápání PE – jak byla tato porucha vnímána od doby první publikace o paroxetinu v roce 1970 [25]. V současné době představuje aplikace SSRI léčbu první volby pro pacienty s PE. Mezi nejčastěji užívané inhibitory patří citalopram, fluoxetin, fluvoxamin, paroxetin a sertralin – všechny preparáty vykazují podobný mechanizmus účinku.
Systematický přehled a metaanalýza zahrnující všechny studie zabývající se farmakoterapií ukazují, že ačkoli se většina studií potýká s metodologickými nedostatky, několik kvalitních dvojitě zaslepených, placebem kontrolovaných studií potvrzuje terapeutický benefit každodenní aplikace SSRI u pacientů s PE [26]. Otevřené studie a studie, které užívají subjektivní skóre pacientů nebo dotazníky, ukazují větší rozpětí hodnoty vyjadřující oddálení ejakulace než dvojitě zaslepené studie, v kterých byl tento údaj prospektivně měřen pomocí stopek.
Na základě těchto metaanalýz se dalo očekávat, že užívání SSRI povede ke 2,6 – 13,2násobnému prodloužení geometrického průměru IELT. Bylo zjištěno, že paroxetin je účinnější než fluoxetin, clomipramin a sertralin. Sertralin dosahuje větší účinnosti než fluoxetin, zatímco účinek clomipraminu se významně neliší od fluoxetinu a sertralinu. Paroxetin byl podáván v dávkování 20 – 40 mg, sertralin v dávkování 25 – 200 mg, fluoxetin 10 – 60 mg a clomipramin 25 – 50 mg; u studovaných léčiv nebyla zjištěna žádná významná souvislost mezi účinkem a dávkováním. Omezené důkazy nasvědčují tomu, že aplikace citalopramu by mohla být ve srovnání s ostatními SSRI méně účinná a léčba pomocí fluvoxaminu by nemusela přinášet vůbec žádný efekt [27,28].
K oddálení ejakulace může dojít již několik dnů po zahájení léčby, efekt je však více patrný až po 1 – 2 týdnech, protože desenzitizace receptoru trvá určitou dobu. Přestože účinek může přetrvat několik let, po 6 – 12 měsících se může objevit tachyfylaxe (snížení účinku při dlouhodobé aplikaci) [24].
Nejčastější vedlejší účinky zahrnují únavu, ospalost, zívání, nevolnost, zvracení, suchost v ústech, průjem a pocení, obvykle jsou však mírné povahy a po 2 – 3 týdnech se postupně zmírňují [24]. Byl zaznamenán i pokles libida, anorgazmie, anejakulace a ED.
Jedna kontrolovaná studie uvádí, že aplikace clomipraminu podle potřeby (ale nikoli paroxetinu) 3 – 5 hod před stykem byla účinná, ačkoli zlepšení IELT nedosahovalo úrovně zaznamenané při každodenní aplikaci léčiva [29]. Léčbu on demand lze kombinovat s úvodním cyklem každodenní aplikace nebo současnou každodenní aplikací o nízkém dávkování [30,31].
4.8.3.1 Dapoxetin
Dapoxetin je silný SSRI určený pro perorální léčbu PE podle potřeby. Dapoxetin se rychle vstřebává (Tmax 1,5 hod) a je rychle metabolizován, což zabraňuje jeho akumulaci.
Byla publikována společná analýza dvou dvojitě zaslepených, randomizovaných, kontrolovaných studií (1 958 pacientů) testující účinnost dapoxetinu [32]. Pacienti užívali dapoxetin (30 a 60 mg) 1 – 3 hod před stykem.
U pacientů, kteří užívali 30 mg dapoxetinu, došlo k prodloužení IELT z 0,9 min na 1,75 min, u pacientů užívajících 60 mg dávku se IELT zlepšila z 2,78 min na 3,32 min. Zlepšení kontroly nad ejakulací uvádělo 51 % (30 mg) a 58 % pacientů (60 mg).
Aplikace obou dávek dapoxetinu byla účinná již při prvním podání. Nejčastější vedlejší účinky zahrnovaly (vždy první údaj při 30 mg a druhý údaj při 60 mg dapoxetinu) nevolnost (8,7 %, 20,1 %), průjem (3,9 %, 6,8 %), bolest hlavy (5,9 %, 6,8 %) a závratě (3,0 %, 6,2 %).
Subanalýza těchto dvou studií uvádí [33], že 32 % mužů uvedlo zlepšení o dvě kategorie (na pětibodové škále, „velmi špatné“ až „velmi dobré“) nebo více, s ohledem na kontrolu ejakulace a spokojenost se sexuálním životem. Více než 95 % mužů hodnotí celkový pocit ze změny PE jako „mírné zlepšení“, „zlepšení“, nebo „významné zlepšení“ (sedmipoložková škála, od „významné zhoršení“ až po „významné zlepšení”), zatímco 67,1 % mužů uvedlo „zlepšení“ nebo „významné zlepšení“. Pacienti uvádějí rovněž větší zlepšení IELT než muži, u nichž došlo ke zlepšení kontroly o méně než dvě kategorie, průměrná změna (SD) od počátečního stavu činí 3,7 (4,3) vs 0,77 (1,8) min. Ke zlepšení kontroly nad ejakulací o více než dvě kategorie došlo u 36,3 % pacientů užívajících 30 mg a u 44,5 % mužů užívajících 60 mg (vs 15 % placebo).
Jiná randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s paralelní skupinou II. fáze zahrnující 1 162 mužů ze 22 států [34] uvádí průměrné prodloužení IELT z počáteční 0,9 min (všechny skupiny) na 1,9 min (placebo), 3,2 min (dapoxetin 30 mg) a 3,5 min (dapoxetin 60 mg) na konci studie. Geometrický průměr IELT se zvýšil z 0,7 min na 1,1 min, 1,8 min a 2,3 min (v tomto pořadí). U pacientů užívajících dapoxetin došlo k významnému zlepšení všech PEP parametrů a IELT (oproti placebu) po 12 i 24 týdnech (p < 0,001 pro všechny). Nejčastější nežádoucí účinky zahrnovaly nevolnost, závratě, průjem a bolest hlavy.
Výskyt nežádoucích účinků byl příčinou ukončení léčby u 1,3 % (placebo), 3,9 % (dapoxetin 30 mg) a 8,2 % (dapoxetin 60 mg) mužů. Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie III. fáze (1 238 mužů v USA a Kanadě) prokazuje redukci stresu a obtíží v partnerském vztahu (souvisejících s PE) u pacientů užívajících dapoxetin [35].
Dapoxetin byl registrován (prosinec 2008) pro léčbu PE on demand v sedmi evropských státech (Švédsko, Rakousko, Finsko, Německo, Španělsko, Itálie a Portugalsko). Jedná se o první a v součastné době jediný preparát schválený pro tuto indikaci.
4.8.3.2 Doporučení pro léčbu PE (dop. 6)
Dop. 6. Doporučení pro léčbu PE. 
Schéma 4. Léčba PE. Převzato od Lue et al [49]. ![Schéma 4. Léčba PE. Převzato od Lue et al [49].](https://pl-master.mdcdn.cz/media/image/0af821652ab4a310c2e2fb413c44ddc5.jpg?version=1537792219)
4.8.4 Inhibitory fosfodiesterázy-5
Několik v nedávné době publikovaných studií podporuje roli inhibitorů PDE5 v rámci léčby PE. Inhibitory PDE5 mohou zmírňovat úzkost z aktu zabezpečením lepší erekce a mohou snižovat práh dosažení erekce na nižší úroveň vzrušení, takže pro dosažení ejakulace je zapotřebí většího vzrušení. Řada mechanizmů podílejících se na účinku těchto preparátů však zůstává spekulativní [33,36 – 38].
Pouze jediná kvalitní, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie srovnává sildenafil s placebem [39]. Přestože nebylo zaznamenáno významné zlepšení IELT, užívání sildenafilu vedlo ke zvýšení sebevědomí pacienta, zlepšení subjektivního pocitu kontroly nad ejakulací i celkové spokojenosti se sexuálním životem, zmírnění úzkosti a redukci intervalu do dosažení druhé erekce po ejakulaci.
Jiná randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie uvádí, že aplikace lidokainu ‑ prilokainu měla podobný efekt jako aplikace anestetika v kombinaci se sildenafilem (50 mg před stykem), zatímco účinek sildenafilu byl srovnatelný s placebem (údaj IELT není k dispozici) [16]. Naopak jiná randomizovaná, dvojitě zaslepená studie s paralelní skupinou uvádí u pacientů léčených sildenafilem významné zlepšení IELT a spokojenosti a redukci celkové úzkosti ve srovnání s různými SSRI a technikou „pause ‑ squeeze“. Při aplikaci sildenafilu došlo ke zlepšení IELT z 1 min na 15 min, na 4 min při aplikaci clomipraminu, na 3 min při aplikaci sertralinu, na 4 min při aplikaci paroxetinu a na 3 min při užívání techniky „pause ‑ squeeze“ [5].
Několik otevřených studií prokázalo, že sildenafil v kombinaci se SSRI dosahuje lepšího výsledku než SSRI v rámci monoterapie, sildenafil v kombinaci s paroxetinem (vs samotný paroxetin) vede k významnému zlepšení IELT a spokojenosti pacienta [40]. Sildenafil v kombinaci se sertralinem (vs samotný sertralin) způsobuje významné zlepšení IELT a spokojenosti pacienta [41]. Sildenafil v kombinaci s paroxetinem a psychosociální/ behaviorální terapií významně zlepšuje IELT a spojenost u pacientů, u nichž ostatní modality selhaly [42]. Sildenafil v kombinaci s behaviorální terapií významně zlepšuje IELT a spokojenost pacienta (vs samotná behaviorální terapie) [43].
K dispozici jsou pouze omezená data týkající se účinku dalších inhibitorů PDE5 (tadalafil a vardenafil) při léčbě PE [37,38].
Závěrem lze říci, že role inhibitorů PDE5 v rámci léčby PE nebyla dosud stanovena, k dispozici je pouze minimum dvojitě zaslepených placebem kontrolovaných studií.
4.8.4.1 Doporučení pro využití inhibitorů PDE5 v rámci léčby PE (dop. 7)
Dop. 7. Doporučení pro využití inhibitorů PDE5 v rámci léčby PE. 
4.8.5 Další preparáty
Cílem adrenergní blokády u pacientů s PE je redukce tonu sympatiku v oblasti semenných cest, a tedy oddálení ejakulace [44]. Tramadol je analgetikum působící na CNS, jehož efekt spočívá v kombinaci aktivace opioidních receptorů a inhibice zpětného vychytávání serotoninu a noradrenalinu.
Výzkum nasvědčuje tomu, že antagonisté alfa‑1 adrenergních receptorů, terazosin a alfuzosin [45,46] a tramadol [47,48] mohou vykazovat určitý benefit při léčbě PE. Pro komplexnější posouzení jejich role je nezbytný další výzkum. V současné době se užívání antagonistů alfa‑1 adrenergních receptorů v běžné klinické praxi nedoporučuje [49].
4.8.6 Doporučení pro léčbu PE (dop. 8)
Dop. 8. Doporučení pro léčbu PE. 
4.9 Literatura
1. Semans JH. Premature ejaculation: a new approach. South Med J 1956; 49(4): 353 – 358.
2. de Carufel F, Trudel G. Effects of a new functional ‑ sexological treatment for premature ejaculation. J Sex Marital Ther 2006; 32(2): 97 – 114.
3. Grenier G, Byers ES. Rapid ejaculation: a review of conceptual, etiological, and treatment issues. Arch Sex Behav 1995; 24(4): 447 – 472.
4. Metz ME, Pryor JL, Nesvacil LJ et al. Premature ejaculation: a psychophysiological review. J Sex Marital Ther 1997; 23(1): 3 – 23.
5. Abdel ‑ Hamid IA, El Naggar EA, El Gilany AH. Assessment of as needed use of pharmacotherapy and the pause ‑ squeeze technique in premature ejaculation. Int J Impot Res 2001; 13(1): 41 – 45.
6. De Amicis LA, Goldberg DC, LoPiccolo J et al. Clinical follow‑up of couples treated for sexual dysfunction. Arch Sex Behav 1985;14(6): 467 – 489.
7. Hawton K, Catalan J, Martin P et al. Long‑term outcome of sex therapy. Behav Res Ther 1986; 24(6): 665 – 675.
8. Morales A, Barada J, Wyllie MG. A review of the current status of topical treatments for premature ejaculation. BJU Int 2007; 100(3): 493 – 501.
9. Sachs BD, Liu YC. Maintenance of erection of penile glans, but not penile body, after transection of rat cavernous nerves. J Urol 1991; 146(3): 900 – 905.
10. Wieder JA, Brackett NL, Lynne CM et al. Anesthetic block of the dorsal penile nerve inhibits vibratory‑induced ejaculation in men with spinal cord injuries. Urology 2000; 55(6): 915 – 917.
11. Atikeler MK, Gecit I, Senol FA. Optimum usage of prilocaine‑lidocaine cream in premature ejaculation. Andrologia 2002; 34(6): 356 – 359.
12. Busato W, Galindo CC. Topical anaesthetic use for treating premature ejaculation: a double‑blind, randomized, placebo ‑ controlled study. BJU Int 2004; 93(7): 1018 – 1021.
13. Henry R, Morales A, Wyllie MG. TEMPE: Topical Eutectic ‑ Like Mixture for Premature Ejaculation. Expert Opin Drug Deliv 2008; 5(2): 251 – 261. doi: 10.1517/ 17425247.5.2.251.
14. Dinsmore WW, Hackett G, Goldmeier D et al. Topical eutectic mixture for premature ejaculation (TEMPE): a novel aerosol ‑ delivery form of lidocaine ‑ prilocaine for treating premature ejaculation. BJU Int 2007; 99(2): 369 – 375.
15. Henry R, Morales A. Topical lidocaine ‑ prilocaine spray for the treatment of premature ejaculation: a proof of concept study. Int J Impot Res 2003; 15(4): 277 – 281.
16. Atan A, Basar MM, Tuncel A et al. Comparison of efficacy of sildenafil ‑ only, sildenafil plus topical EMLA cream, and topical EMLA ‑ cream ‑ only in treatment of premature ejaculation. Urology 2006; 67(2): 388 – 391.
17. Xin ZC, Choi YD, Seong DH et al. Sensory evoked potential and effect of SS ‑ cream in premature ejaculation. Yonsei Med J 1995; 36(5): 397 – 401.
18. Xin ZC, Choi YD, Lee WH et al. Penile vibratory threshold changes with various doses of SS ‑ cream in patients with primary premature ejaculation. Yonsei Med J 2000; 41(1): 29 – 33.
19. Choi HK, Jung GW, Moon KH et al. Clinical study of SS ‑ cream in patients with lifelong premature ejaculation. Urology 2000; 55(2): 257 – 261.
20. Truitt WA, Coolen LM. Identification of a potential ejaculation generator in the spinal cord. Science 2002; 297(5586): 1566 – 1569.
21. Borgdorff AJ, Bernabé J, Denys P et al. Ejaculation elicited by microstimulation of lumbar spinothalamic neurons. Eur Urol 2008; 54(2): 449 – 456. doi: 10.1016/ j.eururo.2008.03.043.
22. Giuliano F. 5 – Hydroxytryptamine in premature ejaculation: opportunities for therapeutic intervention. Trends Neurosci 2007; 30(2): 79 – 84.
23. Olivier B, van Oorschot R, Waldinger MD. Serotonin, serotonergic receptors, selective serotonin reuptake inhibitors and sexual behaviour. Int Clin Psychopharmacol 1998; 13 (Suppl 6): S9 – S14.
24. Waldinger MD. Premature ejaculation: definition and drug treatment. Drugs 2007; 67(4): 547 – 568.
25. Waldinger MD, Hengeveld MW, Zwinderman AH. Paroxetine treatment of premature ejaculation: a double‑blind, randomized, placebo ‑ controlled study. Am J Psychiatry 1994; 151(9): 1377 – 1379.
26. Waldinger MD, Zwinderman AH, Schweitzer DH et al.Relevance of methodological design for the interpretation of efficacy of drug treatment of premature ejaculation: a systematic review and metaanalysis. Int J Impot Res 2004; 16(4): 369 – 381.
27. Waldinger MD, Zwinderman AH, Olivier B. SSRIs and ejaculation: a double‑blind, randomized, fixed‑dose study with paroxetine and citalopram. J Clin Psychopharmacol 2001; 21(6): 556 – 560.
28. Waldinger MD, Hengeveld MW, Zwinderman AH et al. Effect of SSRI antidepressants on ejaculation: a double‑blind, randomized, placebo ‑ controlled study with fluoxetine, fluvoxamine, paroxetine, and sertraline. J Clin Psychopharmacol 1998; 18(4): 274 – 281.
29. Waldinger MD, Zwinderman AH, Olivier B. On ‑ demand treatment of premature ejaculation with clomipramine and paroxetine: a randomized, double‑blind fixed‑dose study with stopwatch assessment. Eur Urol 2004; 46(4): 510 – 515, discussion: 516.
30. McMahon CG, Touma K. Treatment of premature ejaculation with paroxetine hydrochloride as needed: 2 single‑blind placebo controlled crossover studies. J Urol 1999; 161(6): 1826 – 1830.
31. Kim SW, Paick JS. Short‑term analysis of the effects of as needed use of sertraline at 5 PM for the treatment of premature ejaculation. Urology 1999; 54(3): 544 – 547.
32. Pryor JL, Althof SE, Steidle C et al. Efficacy and tolerability of dapoxetine in treatment of premature ejaculation: an integrated analysis of two double‑blind, randomised controlled trials. Lancet 2006; 368(9539): 929 – 937.
33. Shabsigh R, Patrick DL, Rowland DL et al. Perceived control over ejaculation is central to treatment benefit in men with premature ejaculation: results from phase III trials with dapoxetine. BJU Int 2008; 102(7): 824 – 828. doi: 10.1111/ j.1464 - 410X.2008.07845.x.
34. Buvat J, Tesfaye F, Rothman M et al. Dapoxetine for the treatment of premature ejaculation: results from a randomized, double‑blind, placebo ‑ controlled phase 3 trial in 22 countries. Eur Urol 2009; 55(4): 957 – 967. doi: 10.1016/ j.eururo.2009.01.025.
35. Kaufman JM, Rosen RC, Mudumbi RV et al. Treatment benefit of dapoxetine for premature ejaculation: results from a placebo ‑ controlled phase III trial. BJU Int 2009; 103(5): 651 – 658. doi: 10.1111/ j.1464 - 410X.2008.08165.x.
36. Chen J, Keren ‑ Paz G, Bar ‑ Yosef Y et al. The role of phosphodiesterase type 5 inhibitors in the management of premature ejaculation: a critical analysis of basic science and clinical data. Eur Urol 2007; 52(5): 1331 – 1339.
37. McMahon CG, McMahon CN, Leow LJ et al. Efficacy of type ‑ 5 phosphodiesterase inhibitors in the drug treatment of premature ejaculation: a systematic review. BJU Int 2006; 98(2): 259 – 272.
38. Wang WF, Minhas S, Ralph DJ. Phosphodiesterase 5 inhibitors in the treatment of premature ejaculation. Int J Androl 2006; 29(5): 503 – 509.
39. McMahon CG, Stuckey BG, Andersen M et al. Efficacy of sildenafil citrate (Viagra) in men with premature ejaculation. J Sex Med 2005; 2(3): 368 – 375.
40. Salonia A, Maga T, Colombo R et al. A prospective study comparing paroxetine alone versus paroxetine plus sildenafil in patients with premature ejaculation. J Urol 2002; 168(6): 2486 – 2489.
41. Zhang XS, Wang YX, Huang XY et al. Comparison between sildenafil plus sertraline and sertraline alone in the treatment of premature ejaculation. Zhonghua Nan Ke Xue 2005; 11(7): 520 – 522, 525.
42. Chen J, Mabjeesh NJ, Matzkin H et al. Efficacy of sildenafil as adjuvant therapy to selective serotonin reuptake inhibitor in alleviating premature ejaculation. Urology 2003; 61(1): 197 – 200.
43. Tang W, Ma L, Zhao L et al. Clinical efficacy of Viagra with behavior therapy against premature ejaculation. Zhonghua Nan Ke Xue 2004; 10(5): 366 – 367, 370.
44. Hsieh JT, Chang HC, Law HS et al. In vivo evaluation of serotonergic agents and alpha‑adrenergic blockers on premature ejaculation by inhibiting the seminal vesicle pressure response to electrical nerve stimulation. Br J Urol 1998; 82(2): 237 – 240.
45. Basar MM, Yilmaz E, Ferhat M et al. Terazosin in the treatment of premature ejaculation: a short‑term follow‑up. Int Urol Nephrol 2005; 37(4): 773 – 777.
46. Cavallini G. Alpha ‑ 1 blockade pharmacotherapy in primitive psychogenic premature ejaculation resistant to psychotherapy. Eur Urol 1995; 28(2): 126 – 130.
47. Safarinejad MR, Hosseini SY. Safety and efficacy of tramadol in the treatment of premature ejaculation: a double‑blind, placebo ‑ controlled, fixed‑dose, randomized study. J Clin Psychopharmacol 2006; 26(1): 27 – 31.
48. Salem EA, Wilson SK, Bissada NK et al. Tramadol HCL has promise in on ‑ demand use to treat premature ejaculation. J Sex Med 2008; 5(1): 188 – 193.
49. Lue TF, Giuliano F, Montorsi F et al. Summary of the recommendations on sexual dysfunctions in men. J Sex Med 2004; 1(1): 6 – 23.
5. Závěr
Celosvětová dostupnost tří inhibitorů PDE5 pro perorální aplikaci – sildenafilu, tadalafilu a vardenafilu – znamenala převrat v moderní léčbě erektilní dysfunkce.
Léčba pomocí těchto preparátů dosahuje vysoké účinnosti a je bezpečná dokonce i u obtížně léčitelných populací, jako jsou např. pacienti s diabetem nebo pacienti, kteří podstoupili radikální prostatektomii. Pacientům se doporučuje vyzkoušet všechny tři inhibitory PDE5. Pacient by se měl sám rozhodnout, které léčivo má nejlepší účinek, při současném zohlednění dalších faktorů, jako je rychlost nástupu efektu, trvání účinku, okno možností a výskyt vedlejších účinků.
Pacientům, u nichž selže perorální léčba nebo u nichž je tato léčba kontraindikována, je možné nabídnout intrakavernózní injekci, intrauretrální aplikaci alprostadilu, užívání vakuových konstrikčních zařízení nebo případně implantaci penilní protézy.
Je velmi důležité, aby lékař pacienta upozornil na to, že pohlavní styk je intenzivní fyzickou aktivitou, která zvyšuje rychlost srdeční akce a srdeční zátěž celkově. Před zahájením léčby ED by měl lékař posoudit fyzickou kondici pacienta.
Úspěch jakékoli farmakoterapie pro léčbu erektilní dysfunkce vyžaduje alespoň část funkční integrity mechanizmu erekce. V současné době probíhají další studie testující jednotlivé preparáty a jejich synergistický účinek. Ideální farmakologická léčba erektilní dysfunkce by měla splňovat následující kritéria: dobrou účinnost, snadnou aplikaci, absenci toxicity a vedlejších účinků; měla by umožňovat rychlý nástup účinku a dlouhodobý efekt.
Další velmi častou sexuální poruchou u mužů je předčasná ejakulace s prevalencí 20 – 30 %.
V současné době se užívají čtyři definice PE. Nejrozšířenější klasifikace dělí PE na celoživotní (primární) a získanou (sekundární) formu (syndrom).
Diagnostika PE v běžné klinické praxi je založena na odběru medicínské a sexuální anamnézy, hodnocení parametru IELT, subjektivního vnímání kontroly nad ejakulací pacientem a partnerských potíží souvisejících s ejakulační dysfunkcí. Provedení fyzikálního vyšetření a laboratorních testů může být nezbytné pouze u vybraných pacientů.
Podstatou léčby celoživotní PE je farmakoterapie, která spočívá v každodenním užívání SSRI a topických anestetik. Behaviorální techniky mohou být účinné jak v rámci monoterapie, tak v kombinaci s farmakoterapií, jejich provádění však může být pro pacienta obtížné. Každopádně po ukončení léčby může velmi pravděpodobně dojít k recidivě.
6. Zkratky užité v textu
Tento seznam zahrnuje nejběžnější zkratky.
5 - HT 5 - hydroxytryptamin
AIPE arabic index of premature ejaculation
AUC oblast pod křivkou – křivka proměny koncentrace v séru
BMI index tělesné hmotnosti
CAD onemocnění věnčitých tepen
cGMP cyklický guanosin monofosfát
CGRP peptid odvozený od genu pro kalcitonin
CHF městnavé srdeční selhání
Cmax maximální koncentrace
DICC dynamická infuzní kavernózometrie nebo kavernózografie
DRE digitální rektální vyšetření
DSM ‑ IV ‑ TR Diagnostický a statistický manuál pro psychické choroby – IV. revize
EAU Evropská urologická asociace
ED erektilní dysfunkce
EMEA Evropská agentura pro léčiva
FDA Úřad pro kontrolu potravin a léčiv (USA)
FSH folikuly stimulující hormon
GAQ obecné hodnocení
GR stupeň doporučení
GSSAB global study of sexual attitudes and behaviors
ICD ‑ 10 international classification of diseases ‑ 10
IELT doba latence ejakulace intravaginálně
IIEF mezinárodní index erektilní funkce
IIEF ‑ EF mezinárodní index erektilní funkce doména erektilní funkce
IPE index předčasné ejakulace
ISSM mezinárodní společnost sexuální medicíny
LE úroveň důkazu
LH luteinizační hormon
LVD dysfunkce levé srdeční komory
MET metabolický ekvivalent výdeje energie v klidovém stavu
IM infarkt myokardu
MMAS Massachusetts male aging study
MSHQ ‑ EjD male sexual health questionnaire ejaculatory dysfunction
NHSLS national health and social life survey
NS nervy šetřící
NO oxid dusnatý
NPTR noční penilní tumescence a rigidita
NSRP nervy šetřící radikální prostatektomie
NYHA New York Heart Association
PCa karcinom prostaty
PDE5I inhibitory fosfodiesterázy ‑ 5
PE předčasná ejakulace
PEDT premature ejaculation diagnostic tool
PEP premature ejaculation profile (profil předčasné ejakulace)
PEPA premature ejaculation prevalence and attitudes
PRO patient reported outcome (výsledky uváděné pacientem)
PSA prostatický specifický antigen
QoL kvalita života
RP radikální prostatektomie
SEP sexual encounter profile
SSRI selektivní inhibitory zpětného vychytávání serotoninu
TEMPE topická směs pro léčbu předčasné ejakulace
Tmax čas do dosažení maximální koncentrace v plazmě
VCD vakuová konstrikční zařízení
VIP vazointestinální peptid
Štítky
Dětská urologie Urologie
Článek Editorial
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2014 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Erektilní dysfunkce jako první signál kardiovaskulárního onemocnění a význam diagnostiky
- Erektilní dysfunkce jako důsledek somatických onemocnění a její léčba
- Vývoj medikamentózní terapie ED – minulost, současnost, budoucnost
- Možnosti chirurgické léčby erektilní dysfunkce – dosavadní vývoj a současné možnosti
- Zlepšování kvality operační léčby
- Editorial
- Robotika v urologii: začínáme
- Lokalizace tumoru pomocí technologie fluorescenčního záření blízkého infračervenému záření při roboticky asistované parciální resekci ledviny
- Cílená terapie při léčbě karcinomu z renálních buněk – posun od molekulárních agens ke specifické imunoterapii
- Praktický přístup k léčbě mikční dysfunkce u pacientů obou pohlaví
- Vliv radioterapie na úspěšnost operační léčby mužské inkontinence
-
Zpráva z 13. mezinárodního urologického fóra
Německo, Lipsko 27.– 29. listopadu 2013 - Guidelines pro léčbu mužské sexuální dysfunkce: erektilní dysfunkce a předčasná ejakulace
- Erektilní dysfunkce – patofyziologické mechanizmy vzniku
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Guidelines pro léčbu mužské sexuální dysfunkce: erektilní dysfunkce a předčasná ejakulace
- Praktický přístup k léčbě mikční dysfunkce u pacientů obou pohlaví
- Možnosti chirurgické léčby erektilní dysfunkce – dosavadní vývoj a současné možnosti
- Vývoj medikamentózní terapie ED – minulost, současnost, budoucnost
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání