-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prognostické faktory, molekulární markery a prediktivní instrumenty pro hodnocení uroteliálního karcinomu horních cest močových
PROGNOSTICS FACTORS, MOLECULAR MARKERS AND PREDICTIVE TOOLS IN UPPER TRACT UROTHELIAL CARCINOMA
Upper tract urothelial carcinoma is a rare disease and the outcomes of patients with UTUC are heterogeneous and, therefore, difficult to predict. The lack of randomized trials in patients with UTUC makes decisions complex. Accurate estimation of treatment success, complications, and long-term morbidity are essential for patients to make informed medical decisions. Recently researchers have developed prognostic tools based on statistical models to obtain the most accurate and reliable predictions. Among the available decision tools, nomograms currently represent the most accurate and widely used tools for prediction of outcomes in patients with cancer. The authors of this article discuss the established prognostic factors in UTUC (including clinic-pathological features and molecular markers) and the currently available predictive tools.
Key words:
upper tract urothelial carcinoma, prognostics factors, molecular markers
Autoři: E. Xylinas; T. Klatte; S. Matin; S. F. Shariat
Vyšlo v časopise: Urol List 2013; 11(3): 30-39
Souhrn
Uroteliální karcinom horních cest močových (UTUC) je vzácně se vyskytující onemocnění. Výsledky léčby UTUC jsou značně heterogenní, a lze je tedy obtížně predikovat. Rozhodnutí o volbě léčby rovněž znesnadňuje absence randomizovaných studií, které by se zabývaly léčbou UTUC. Přesná předpověď účinnosti léčby, výskytu komplikací a dlouhodobé morbidity je nezbytná pro informované rozhodnutí. V nedávné době byly vyvinuty prognostické instrumenty založené na statistických modelech, pomocí nichž je možné učinit nejpřesnější a nejspolehlivější předpověď. Z v současné době dostupných instrumentů jsou to nomogramy, které umožňují nejpřesnější predikci výsledků u pacientů s karcinomem. Autoři tohoto článku hodnotí prognostické faktory užívané u pacientů s UTUC (včetně klinicko-patologických parametrů a molekulárních markerů) a v současné době dostupné prediktivní instrumenty.
Klíčová slova:
uroteliální karcinom horních cest močových, prognostické faktory, molekulární markeryÚvod
Uroteliální karcinom horních cest močových (UTUC) je vzácně se vyskytující onemocnění, jež představuje pouze 5 % všech karcinomů urotelu [1]. Výsledky léčby UTUC jsou značně heterogenní, a lze je tedy obtížně predikovat. Vzhledem k nízké incidenci tohoto onemocnění je k dispozici pouze minimum údajů o klinicko-patologických faktorech, pomocí kterých by bylo možné predikovat výsledek léčby. Rozhodnutí o volbě léčby rovněž znesnadňuje absence randomizovaných studií, které by se zabývaly léčbou UTUC. V nedávné době bylo v multicentrické studii identifikováno několik faktorů, které mohou predikovat výsledek radikální nefroureterektomie (RNU) u pacientů s UTUC, což je velkým přínosem pro tradiční klasifikační systém na základě patologického stadia tumoru [2–9].
Přesná předpověď účinnosti léčby, výskytu komplikací a dlouhodobé morbidity je nezbytná, aby pacient mohl učinit informované rozhodnutí o volbě své léčby. Výzkumné týmy vytvořily prognostické instrumenty založené na statistických modelech, pomocí nichž je možné učinit nejpřesnější a nejspolehlivější předpověď. Pomocí těchto instrumentů je možné predikovat výsledek na základě důkazů i individuálně na míru pacientovi. Z instrumentů v současné době dostupných jsou to nomogramy, které umožňují nejpřesnější predikci výsledků u pacientů s karcinomem [10]. Nomogramy se využívají v řadě onkologických disciplín, u pacientů s karcinomy prsu, kolon, prostaty, ledviny i močového měchýře.
Autoři tohoto přehledu hodnotí prognostické faktory užívané u pacientů s UTUC (včetně klinicko-patologických parametrů a molekulárních markerů) a v současné době dostupné prediktivní instrumenty. Tento článek může sloužit jako motivace pro vytvoření podrobnějších směrnic, které by lékařům umožnily lépe porozumět prognóze UTUC.
Faktory týkající se pacienta
Věk
Několik populačních a multicentrických studií uvádí, že vyšší věk pacienta představuje nezávislý prediktor mortality specifické pro karcinom (CSM) po RNU [11–13]. Tento výsledek lze pravděpodobně vysvětlit změnami biologického potenciálu tumoru (UTUC je agresivnější u starších pacientů) i odlišným přístupem k léčbě (např. lékaři u těchto pacientů více váhají s indikací radikální operace). Na základě těchto důkazů by věk neměl být kritériem pro neindikování RNU.
Pohlaví
UTUC se častěji vyskytuje u mužů než u žen (Roupret [1], 2011). Na rozdíl od UC dolních cest močových nevykazuje UTUC u žen agresivnější znaky [6] než u mužů, ani není spojen s horším onkologickým výsledkem po RNU [14]. Pohlaví tedy nelze u pacientů s UTUC považovat za prediktor doby přežití.
Rasa
Incidence UTUC se zvyšuje u pacientů většiny rasových skupin, což je pravděpodobně zapříčiněno časnou detekcí tohoto onemocnění. Nejhorší výsledky byly zaznamenány u afroamerického etnika [15].
Komorbidity podle ASA a ECOG
Bylo prokázáno, že parametr ECOG-PS (Eastern Cooperative Oncology Group performance status) je nezávislým prediktorem vyšší peroperační mortality a celkové mortality po RNU, ovšem nikoli recidivy onemocnění (DR) ani mortality specifické pro karcinom [16]. Francouzský výzkumný tým naopak prokázal souvislost mezi skóre ASA a mortalitou specifickou pro karcinom po RNU [17]. Tato data je však nutné podrobit dalšímu zkoumání a validaci.
Obezita
Prognostický význam obezity byl prokázán hned u několika maligních onemocnění, jako jsou karcinom z renálních buněk a karcinom prostaty. V nedávné době provedená multicentrická studie zkoumá souvislost mezi BMI (indexem tělesné hmotnosti) a onkologickými výsledky u pacientů s UTUC [2]. Autoři zjistili, že BMI ≥ 30 souviselo s recidivou, mortalitou specifickou pro karcinom a celkovou mortalitou. Biologickou podstatu těchto výsledků je však nutné objasnit v dalších studiích.
Kouření a kumulativní expozice
Kouření představuje prokázaný rizikový faktor pro vznik UC [18]. V nedávné době provedená multicentrická studie zkoumá souvislost mezi kouřením a prognózou u pacientů s UTUC [19]. Autoři prokázali, že kuřáctví (zda pacient stále kouří nebo nikdy nekouřil) a kumulativní expozice (silní kuřáci, kteří vykouří > 20 cigaret denně a kouří déle než 20 let) souvisí s vyšším rizikem recidivy a mortality specifické pro karcinom [19]. Zajímavým zjištěním je fakt, že v případě, že pacient přestal s kouřením před více než deseti lety, se škodlivý efekt kuřáctví zmírňuje [19].
Faktory související s UTUC
Hydronefróza
Několik studií zkoumá souvislost mezi hydronefrózou zaznamenanou při předoperačním zobrazovacím vyšetření, patologickým stadiem a dobou přežití specifickou pro karcinom (CSS) u pacientů s UTUC. Bylo zjištěno, že hydronefróza se vyskytuje u pacientů s onemocněním v pokročilejším stadiu [20–22] a souvisí s CSS [23].
Symptomy
Bylo zjištěno, že výskyt systémových symptomů, jako jsou např. bolest nebo úbytek váhy, souvisí s přítomností UTUC ve vyšším stadiu a s vyšším grade [24] a celkovou mortalitou (OM) u pacientů s UTUC [25]. Roli těchto faktorů jako prediktorů výsledku léčby je třeba teprve prokázat v dalších multicentrických studiích.
Lokalizace tumoru
V otázce vlivu lokalizace tumoru (ledvinná pánvička nebo močovod) na prognózu pacientů s UTUC existují rozporuplné názory. Několik starších studií z jediného centra uvádělo, že lokalizace tumoru v močovodu je spojena s horším výsledkem [26,27]. V nedávné době provedená francouzská multicentrická studie tyto výsledky potvrzuje [8]. Několik populačních a multicentrických studií však naopak neprokázalo žádnou souvislost mezi lokalizací tumoru a onkologickým výsledkem po RNU [5,28]. Závěrem lze pouze říci, že v současné době dostupné retrospektivní studie neumožňují vyvodit definitivní závěry týkající se vlivu lokalizace tumoru na prognózu UTUC.
Tyto protichůdné výsledky jasně poukazují na nezbytnost provedení multicentrické prospektivní studie, která bude hodnotit rozdíly v době přežití u pacientů s tumory renální pánvičky a tumory v močovodu.
Multifokální povaha tumoru
Multifokální tumory jsou lokalizovány ve dvou nebo více oblastech močových cest. Bylo prokázáno, že multifokální povaha tumoru (multifokální tumory se vyskytují až u 30 % pacientů) představuje nezávislý prediktor mortality specifické pro karcinom [8,29]. Na základě nejnovějších publikovaných informací by měl patolog ve své zprávě rutinně uvádět přítomnost multifokálního tumoru.
Velikost tumoru
Na základě velikosti tumoru lze predikovat výsledek u řady maligních onemocnění. Za prahovou hodnotu predikující výskyt metastáz se považuje průměr tumoru o velikosti 3 cm [30), průměr o velikosti 4 cm predikuje intravezikální recidivu po RNU [31]. Výsledky obou studií je však nutné potvrdit v dalších studiích zahrnujících větší populace pacientů.
Klinický grade tumoru a stadium
Pomocí endoskopického vyšetření (± biopsie) lze definitivně potvrdit diagnózu UTUC a stratifikovat pacienty na základě rizika onemocnění pro indikaci konzervativní nebo radikální léčby. Na základě vyšetření vzorku biopsie je možné určit přesný grade tumoru a predikovat patologické výsledky [22]. Na rozdíl od UC lokalizovaného v dolních cestách močových je stanovení klinického stadia UTUC velmi obtížné, neboť obvykle není možné odebrat při biopsii vzorek, který by zahrnoval i hlouběji lokalizovanou svalovinu [32].
Předchozí nebo současný výskyt karcinomu močového měchýře
UTUC lze považovat za součást panuroteliálního komplexu, který může zahrnovat multifokální tumory, včetně UC dolních cest močových. Anamnéza karcinomu močového měchýře souvisí s intravezikální recidivou [33,34], recidivou tumoru a mortalitou specifickou pro karcinom po RNU [33,35].
Faktory související s operační léčbou
Odložení operace
Bylo prokázáno, že při léčbě UC v dolních cestách močových má odložení operace po diagnostikování onemocnění (o > 3 měsíce) negativní dopad na prognózu. Multicentrická studie zkoumá vliv délky intervalu mezi diagnostikou UTUC a RNU na onkologické výsledky [36]. Autoři prokázali, že delší interval (≥ 3 měsíce) souvisel u pacientů s invazivním onemocněním s patologickými parametry agresivního tumoru, recidivou onemocnění a mortalitou specifickou pro karcinom [36].
Operační přístup
Otevřená RNU (ONU) s excizí manžety močového měchýře se považuje za zlatý standard pro léčbu UTUC bez ohledu na lokalizaci tumoru v močových cestách [1]. Jako minimálně invazivní alternativa k ONU byla vyvinuta technika laparoskopické RNU (LNU). Výhody tohoto přístupu zahrnují menší krevní ztrátu, kratší hospitalizaci a kratší rekonvalescenci [37,38]. Žádná prospektivní, randomizovaná studie dosud neprokázala mezi laparoskopickým přístupem a ONU žádný rozdíl s ohledem na recidivu ani mortalitu specifickou pro karcinom [39]. Populační studie (s korekcí struktury dat pomocí propensity skóre) a metaanalýza retrospektivních studií v nedávné době potvrdily bezpečnost laparoskopického přístupu s ohledem na onkologický výsledek (ve srovnání s ONU) [37,38].
Léčba tumoru v distálním močovodu
RNU s excizí manžety močového měchýře se považuje za zlatý standard pro léčbu UTUC bez ohledu na lokalizaci tumoru v horních cestách močových [1].
RNU je nezbytné provádět v souladu s onkologickými pravidly, která spočívají v prevenci rozsevu tumoru zabráněním vstupu do močových cest během resekce tumoru. Provádí se rovněž resekce distálního močovodu a jeho ústí, neboť jsou součástí močových cest vykazující vysoké riziko recidivy tumoru. Po odstranění proximální části je prakticky nemožné ji během pooperačního sledování zobrazit nebo vyšetřit endoskopicky. Nejnovější publikace zabývající se dobou přežití po RNU uvádějí, že odstranění distálního močovodu (manžety močového měchýře) má pozitivní dopad na prognózu [40]. Endoskopické vyšetření distálního močovodu je navíc spojeno s vyšším rizikem intravezikální recidivy [9].
Preparace lymfatických uzlin
Provedení lymfadenektomie (LND) během RNU má terapeutický význam a je nejlepší metodou pro stanovení stadia tumoru [41]. Přesná anatomická lokalita pro LND však nebyla zatím jednoznačně definována. Větší benefit pro délku přežití pacienta má pravděpodobně užívání speciálních šablon, spíše než počet odebraných uzlin [41,42]. Podobně jako v případě UCB v dolních cestách močových se pro posouzení pravděpodobnosti, že pacient s onemocněním klasifikovaným jako pN0 skutečně nemá zasažené lymfatické uzliny, doporučuje patologické stanovení stadia uzlin [43]. Všechna data jsou však retrospektivní, v důsledku čehož může být skutečná míra výskytu onemocnění s pozitivními lymfatickými uzlinami nižší nežli ve skutečnosti.
Patologické faktory
Stadium tumoru
Patologické stadium tumoru je nejlepším dostupným faktorem pro předpověď doby přežití u pacientů s UTUC. Tento parametr je nutné zohlednit při konzultaci s pacientem před operační léčbou i po ní a při rozhodování o intenzitě pooperačního sledování a indikaci adjuvantní léčby [35,44].
Grade tumoru
Grade tumoru je rovněž zavedený prediktor výsledku souvisejícího s karcinomem u pacientů s UTUC, protože úzce souvisí s agresivitou tumoru a jeho stadiem. Výsledek léčby lze predikovat na základě klasifikace WHO (Světové zdravotnické organizace) z roku 1973 i 2004 [44,45].
Závěrem lze říci, že grade tumoru představuje významný prediktor výsledku léčby u pacientů s UTUC, a tento parametr je nutné zohlednit v rámci předoperační i pooperační konzultace s pacientem.
Současně se vyskytující karcinom in situ
Současně se vyskytující karcinom in situ (CIS) v horních cestách močových je velmi vzácný jev, který pravděpodobně u pacientů s tumorem ohraničeným na orgán souvisí s recidivou a mortalitou specifickou pro karcinom [46]. Současně se vyskytující CIS rovněž souvisí s intravezikální recidivou po RNU [47,48]. Tento nález je tedy nezbytné u pacientů s UTUC náležitě vyšetřit, neboť tito jedinci mohou vyžadovat agresivnější protokol sledování a topickou léčbu.
Zasažení lymfatických uzlin (LNI)
Přítomnost LNI se považuje za významný prognostický faktor, který nasvědčuje invazi metastazujícího tumoru do regionálních lymfatických uzlin [41,44]. Rovněž bylo prokázáno, že denzita lymfatických uzlin (≥ 30 %) souvisí s recidivou onemocnění a mortalitou specifickou pro karcinom [49]. Závěrem tedy lze říci, že LNI je u pacientů s UTUC významným prognostickým faktorem. Stále je však nutná standardizace indikace lymfadenektomie a šablon užívaných při této intervenci. Rozšíření tumoru mimo uzliny představuje významný prediktor klinického výsledku léčby u pacientů s UTUC a pozitivních lymfatických uzlin [3,49].
Lymfovaskulární invaze
Lymfovaskulární invaze se vyskytuje přibližně u 20 % pacientů s UTUC a představuje nezávislý prediktor doby přežití [4,50]. Status lymfovaskulární invaze by měl být uváděn v patologické zprávě všech vzorků odebraných při RNU [4,50].
Architektura tumoru
Několik studií zkoumá prognostický vliv architektury tumoru (přisedlý versus papilární tumor) na dobu přežití pacientů s UTUC. Tři multicentrické studie uvádějí, že přisedlý tumor souvisí s větší agresivitou tumoru, recidivou onemocnění a mortalitou specifickou pro karcinom [44,51,52]. Tyto výsledky svědčí o tom, že architekturu tumoru je třeba v každém případě uvádět při endoskopickém vyšetření pacienta s UTUC i v patologické zprávě.
Nekróza tumoru
Rozsáhlá nekróza tumoru (definováno jako > 10 % objemu tumoru) představuje nezávislý prediktor onkologického výsledku u pacientů po RNU [53]. V nedávné době provedená multicentrická mezinárodní studie však tuto skutečnost nepotvrdila [54]. Prognostickou roli nekrózy tumoru u pacientů s UTUC je nutné potvrdit ve větších, kvalitních, multicentrických studiích.
Pozitivní chirurgické okraje
Pozitivní chirurgické okraje byly popsány u ≤ 8,5 % případů léčených pomocí RNU a úzce souvisejí s ošetřením manžety močového měchýře. Uvádí se, že přítomnost pozitivních chirurgických okrajů je spojena s vyšší mírou recidivy onemocnění i mortality specifické pro karcinom [55].
Histologické varianty
Téměř u 25 % pacientů s UTUC podstupujících léčbu pomocí RNU jsou přítomny různé histologické varianty [56]. Tyto varianty souvisejí s rysy agresivního onemocnění [56], po přizpůsobení standardním klinicko-patologickým parametrům však nesouvisejí s onkologickým výsledkem [56]. Tyto varianty navíc pravděpodobně nemají u pacientů léčených pomocí RNU žádný vliv na účinnost adjuvantní systémové chemoterapie [57].
Molekulární markery
Tkáňové markery
Několik výzkumných skupin se v současné době zabývá parametry UTUC a drah onkogeneze. Několik studií zkoumá prognostickou roli tkáňových markerů, jako jsou např. regulátory buněčného cyklu (p53) [58], buněčné proliferace (Ki67) [59], angiogeneze (EGFR a HIF1a) [60,61], buněčné adheze (E-cadherin) [62,63] a apoptózy (Bcl-2 a survivin) [64,65]. Všechny tyto tkáňové markery dosahují slibných výsledků v rámci predikce agresivity tumoru a výsledku léčby u pacientů s UTUC. Hlavní nedostatek všech těchto studií však spočívá v jejich retrospektivním designu a malém počtu pacientů, tyto výsledky tedy vyžadují další validaci.
Krevní markery
U pacientů s UTUC bylo zkoumáno pouze několik krevních markerů. Vyšší hladina C-reaktivního proteinu a leukocytů souvisí s recidivou onemocnění a mortalitou specifickou pro karcinom [66–69]. V současné době však nemáme k dispozici adekvátní data, která by podporovala význam krevních markerů jako prediktorů výsledku u pacientů s UTUC.
Genetické markery
Mikrosatelitní nestabilita (MSI) je definována jako přítomnost mutací v sekvencích mikrosatelitů DNA. Bylo prokázáno, že MSI souvisí s dědičným nonpolypózním kolorektálním karcinomem a s celou řadou sporadických karcinomů u člověka. Výskyt MSI byl prokázán rovněž u pacientů s UTUC [70]. Mikrosatelitní nestabilita je rovněž nezávislým molekulárním markerem, který se užívá při hodnocení prognózy tumoru [71].
V současné době však žádný z markerů nesplňuje klinická ani statistická kritéria umožňující jejich zavedení do běžné klinické praxe.
Aktuální predikční instrumenty užívané u pacientů s UTUC
Pro predikci nejrůznějších cílových parametrů před výkonem i po něm se doporučuje užívání nomogramů, jež mohou pomoci při sledování pacienta, identifikaci ideálních kandidátů pro konzervativní léčbu, pro provedení lymfadenektomie nebo aplikaci chemoterapie. Škála parametrů zařazených do nomogramů byla rozšířena – od standardních klinických a patologických parametrů až po nálezy zobrazovacích technik [72].
Předoperační predikce patologických parametrů před radikální nefroureterektomií (tab. 1)
Tab. 1. Prognostické faktory uroteliálního karcinomu horních cest močových týkající se pacienta. 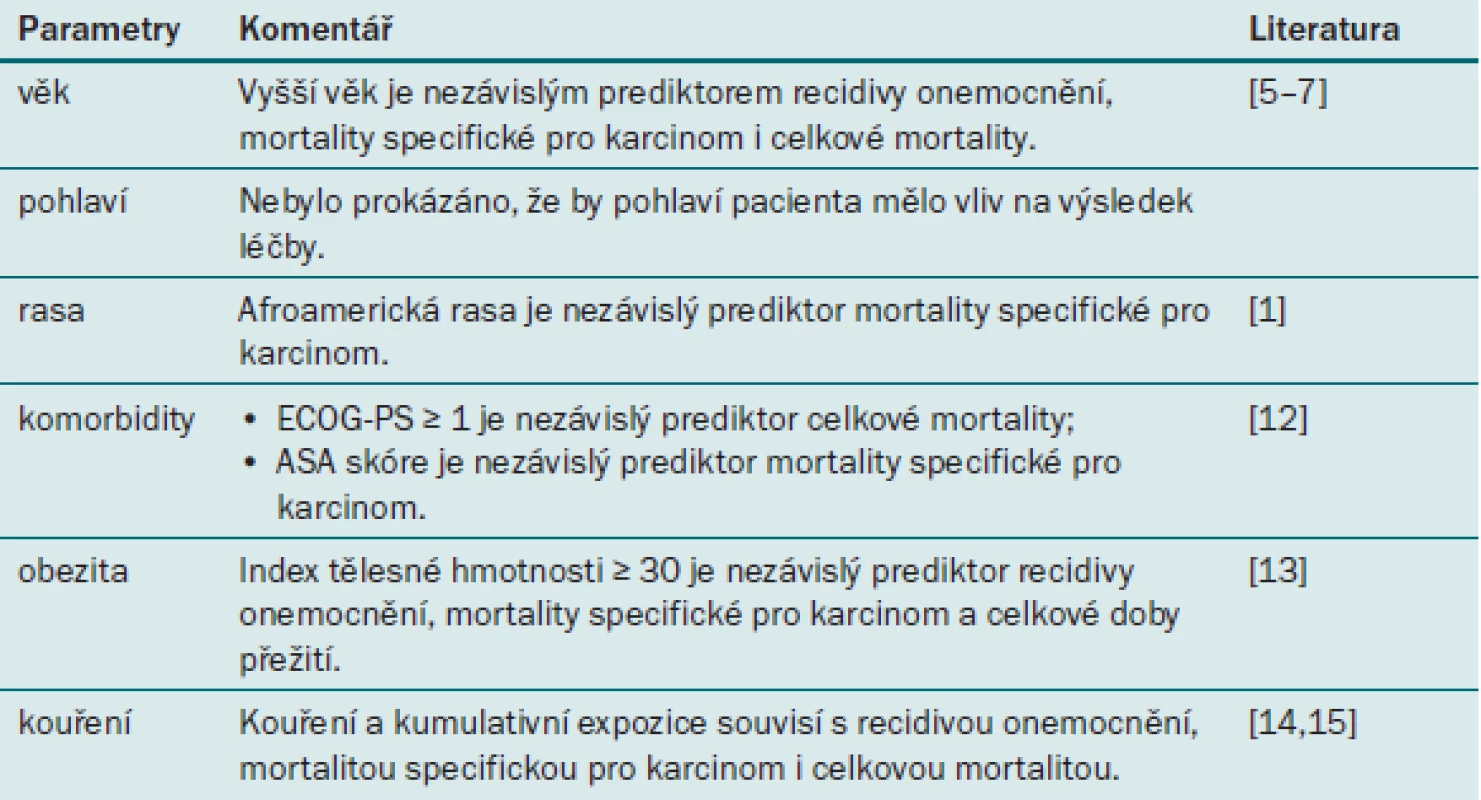
Tab. 2. Prognostické faktory uroteliálního karcinomu horních cest močových týkající se onemocnění. 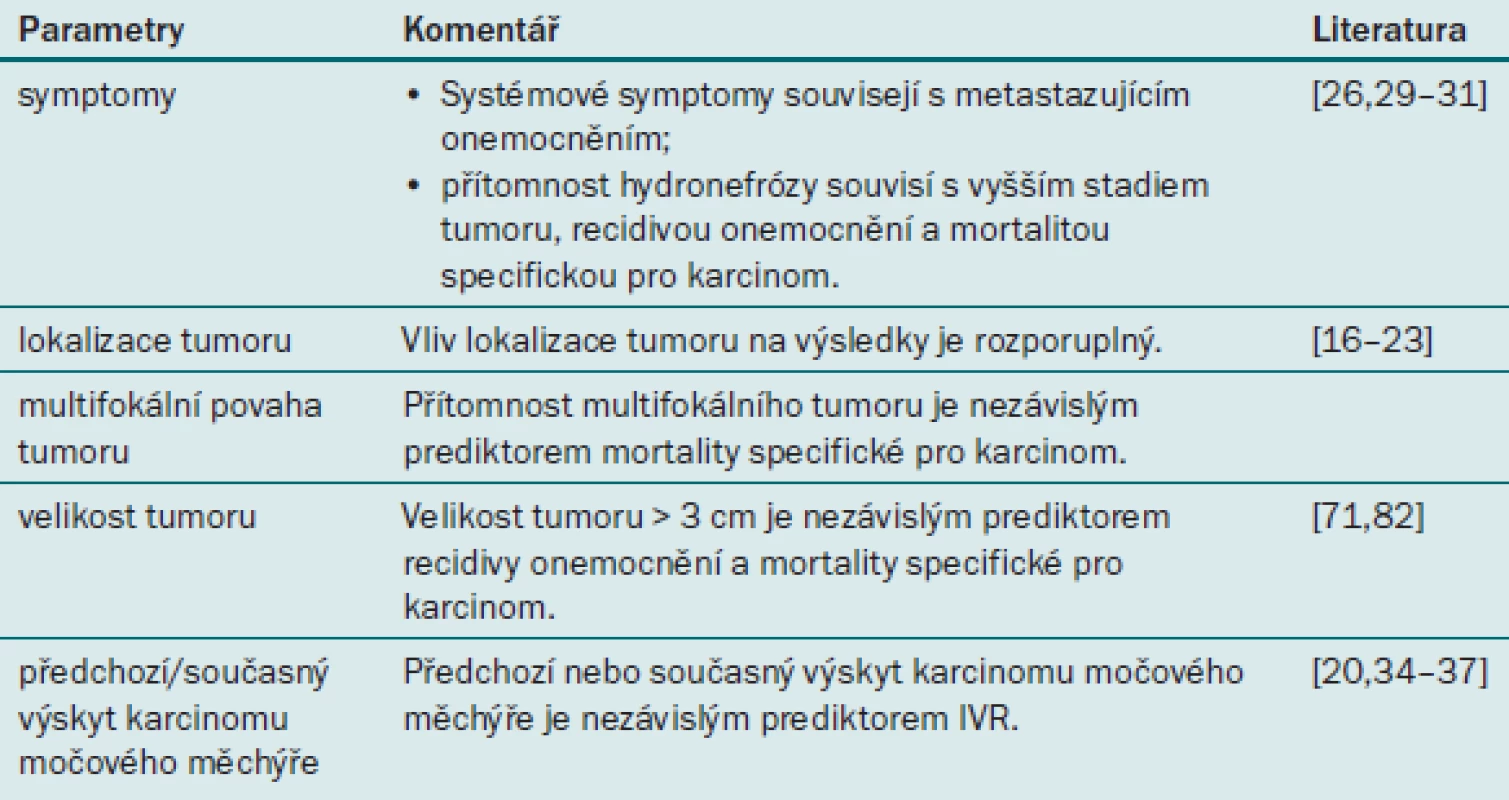
Tab. 3. Prognostické faktory uroteliálního karcinomu horních cest močových týkající se operační léčby. 
Díky zdokonalení endoskopických technik je možné řadu pacientů s UTUC léčit konzervativně (tj. bez indikace RNU). Je známým faktem, že určení stadia tohoto typu tumoru před operací je velmi obtížné, ne-li nemožné. Pomocí predikčních instrumentů je možné identifikovat jedince, kteří mají onemocnění ve stadiu T2 nebo vyšším a budou mít tedy benefit z radikální operace. Lepší porozumění rozsahu lymfadenektomie a uvážená kombinace systémové terapie a operační resekce mohou vést k lepším výsledkům u pacientů s UTUC v pokročilejším stadiu [41]. U pacientů s UTUC může být přínosná zejména neoadjuvantní chemoterapie [73], protože ztráta funkce ledviny po RNU [74] může znemožnit indikaci chemoterapie na bázi cisplatiny. Chemoterapie a agresivnější operační intervence jsou bohužel spojeny s vyšší morbiditou a pacient tak může podstoupit nadbytečnou léčbu. Několik studií prokázalo, že u pacientů s UTUC invadujícím svalovinu přináší benefit LND a neoadjuvantní chemoterapie, zvláště u jedinců s onemocněním neohraničeným na orgán (NOC) [7]. Přesná predikce onemocnění invadujícího svalovinu a/nebo NOC UTUC by tedy pomohla určit vhodné kandidáty pro tuto léčbu a pro zařazení do příslušných klinických studií. V současné době jsou k dispozici pouze tři predikční modely pro využití v předoperačním kontextu [72,75,76].
Margulis et al vytvořili model založený na několika proměnných pro predikci NOC-UTUC. Tento model využívá snadno dostupné předoperační klinické a patologické parametry [76] – lokalizaci, architekturu a grade tumoru. Pomocí tohoto modelu lze predikovat, že bude při RNU přítomen NOC, s 76,6% přesností.
Multicentrická studie zkoumá možnost predikovat onemocnění v pokročilém stadiu na základě přítomnosti hydronefrózy. Brien et al vycházeli z údajů 172 pacientů, kteří podstoupili léčbu UTUC pomocí RNU v pěti referenčních centrech [22]. Autoři zjistili, že výskyt hydronefrózy před operací svědčí o pokročilejším UTUC, a dospěli k závěru, že již pomocí v současné době snadno dostupných zobrazovacích modalit lze zlepšit předoperační stratifikaci pacientů na základě rizika, a umožnit tak informovaný výběr mezi konzervativní léčbou vs exstirpačním operačním výkonem a rozhodnout o potřebě neoadjuvantní chemoterapie. Messer et al potvrdili tyto výsledky u větší populace 408 pacientů [75].
Favaretto et al na základě výsledků zobrazovacích modalit a ureteroskopie [72] zjistili, že nález invaze a hydronefrózy při předoperačním zobrazovacím vyšetření a nález tumoru vyššího grade při ureteroskopii nebo cytologickém vyšetření úzce souvisí s přítomností UTUC invadujícím svalovinu ve vzorku odebraném při RNU (přesnost predikce 71 %).
V dalších studiích je třeba dále prokázat, zda tyto predikční modely mohou pomoci při volbě mezi konzervativní léčbou a RNU, při rozhodování o indikaci neoadjuvantní chemoterapie, a/nebo rozšířené lymfadenektomie. Celkovou přesnost predikce snad bude možné zlepšit využíváním moderních biomarkerů a moderních zobrazovacích modalit [77].
Predikce onkologických výsledků po radikální nefroureterektomii (tab. 1)
Pooperační sledování spoléhá na schopnost doporučit indikaci adjuvantní systémové terapie pacientům, kterým hrozí nejvyšší riziko recidivy a úmrtí na UTUC. Rovněž umožňuje stanovit sledovací protokol na základě důkazů. Pro volbu optimálního postupu bylo navrženo několik pooperačních prognostických rizikových faktorů. Nejčastěji užívané faktory zahrnují patologické stadium [44], grade tumoru [44], lymfovaskulární invazi [4], metastázy do lymfatických uzlin (LN) [41,44,78] a rozsah lymfadenektomie [78]. Pro predikci recidivy onemocnění a mortality specifické pro karcinom po RNU bylo vytvořeno několik nomogramů [79–81].
Jeldres et al vytvořili první nomogram pro pooperační postup u pacientů s UTUC [79]. V databázi SEER (Surveillance, Epidemiology, and End Results) autoři identifikovali celkem 5 918 pacientů s UTUC, kteří byli léčeni pomocí RNU, a rozdělili je na dvě skupiny: vývojovou kohortu (n = 2 959) a externí validační kohortu (n = 2 959). Pomocí jejich modelu založeného na věku, stadiu tumoru, grade tumoru a stavu lymfatických uzlin bylo možné predikovat dobu přežití specifickou pro karcinom po pěti letech se 75,4% přesností. Tento model byl výrazně přesnější (p < 0,01) než TNM klasifikace AJCC/UICC z roku 2002 (American Joint Committee on Cancer–International Union Against Cancer) (64,8 %). Autoři však používali zastaralý systém pro stanovení grade tumoru, který již nelze doporučit [1].
Před nedávnem byly vytvořeny tři nové nomogramy: první nomogram pochází od francouzského týmu [80], druhý od mezinárodního týmu pro UTUC [81] a třetí nomogram využívá kombinaci pacientů z obou výše zmíněných skupin [82]. Yates et al se na základě kombinace klinických a patologických parametrů pokusili vytvořit predikční model pro přesný odhad doby přežití specifické pro karcinom po pěti letech [80]. Do jejich skupiny bylo zařazeno 667 pacientů, kteří podstoupili RNU ve 21 francouzských centrech. Jejich nomogram využívající pět parametrů (věk, lokalizaci tumoru, grade tumoru, stadium T a N status) umožňoval predikci s 78% přesností.
Nomogram mezinárodní skupiny autorů [81] kombinuje několik novějších prognostických faktorů: věk, patologické stadium T, grade tumoru, LN status, lymfovaskulární invazi, architekturu tumoru a současný výskyt CIS. Cha et al [81] pracovali se skupinou 2 244 pacientů léčených pomocí RNU (bez neoadjuvantní nebo adjuvantní terapie) ve 23 mezinárodních centrech. Jejich nomogram umožňoval predikovat recidivu onemocnění se 76,8% přesností a mortalitu specifickou pro karcinom s 81,5% přesností. Tyto modely disponují lepší kalibrací než model AJCC a lze je využít pro individuální přístup k pacientovi, v podobě plánování sledovacího protokolu, ke stratifikaci pacientů pro adjuvantní terapii a zařazení pacientů do klinických studií.
Do studie využívající kombinovaný nomogram bylo zařazeno celkem 3 387 pacientů, kteří podstoupili léčbu pomocí RNU [82]. Celková populace studie byla randomizována na dvě skupiny: vývojovou kohortu (n = 2 371) a externí validační kohortu (n = 1 016). Pro výběr nejvíce funkčního modelu byla užita tzv. analýza rozhodovacích křivek („Decision curve analysis“), zahrnující věk, stadium T, stadium N, architekturu tumoru a přítomnost nebo absenci lymfovaskulární invaze. Rozlišovací síla nomogramu činila 79 %.
Tab. 4. Prognostické faktory uroteliálního karcinomu horních cest močových týkající se patologických parametrů. 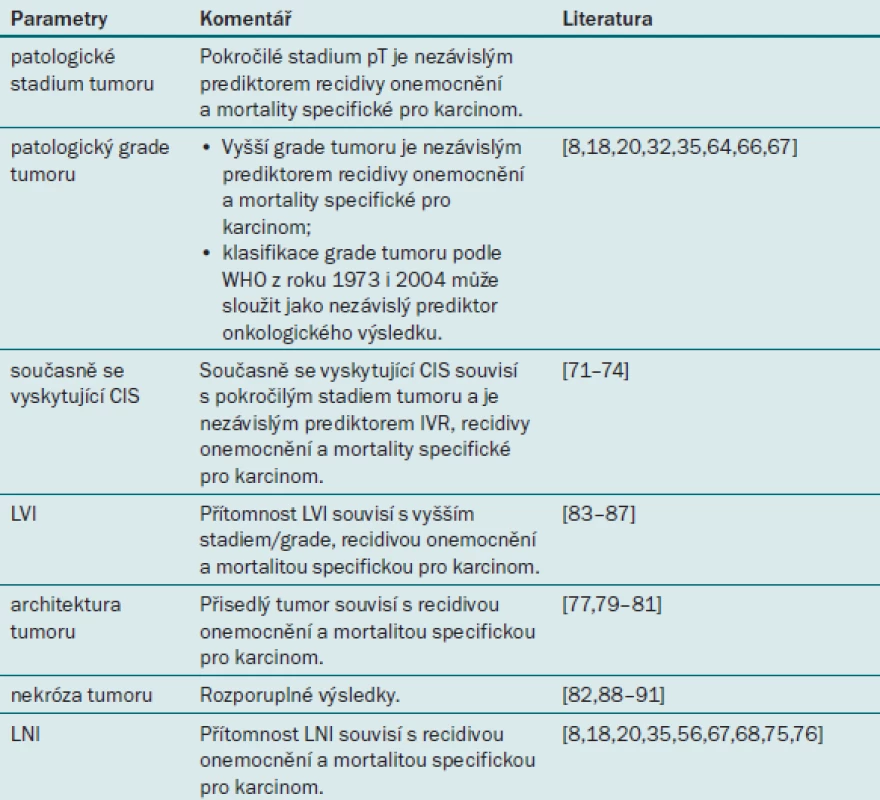
Tab. 5. Přehled molekulárních markerů u pacientů s uroteliálním karcinomem horních cest močových. 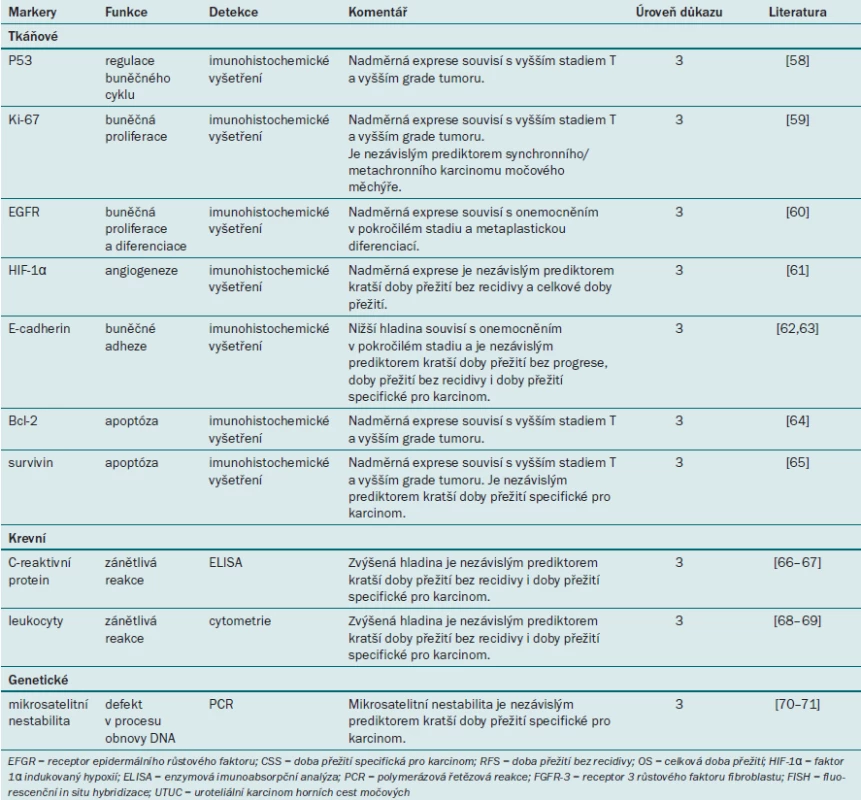
Tab. 6. Prediktivní modely pro hodnocení uroteliálního karcinomu horních cest močových. 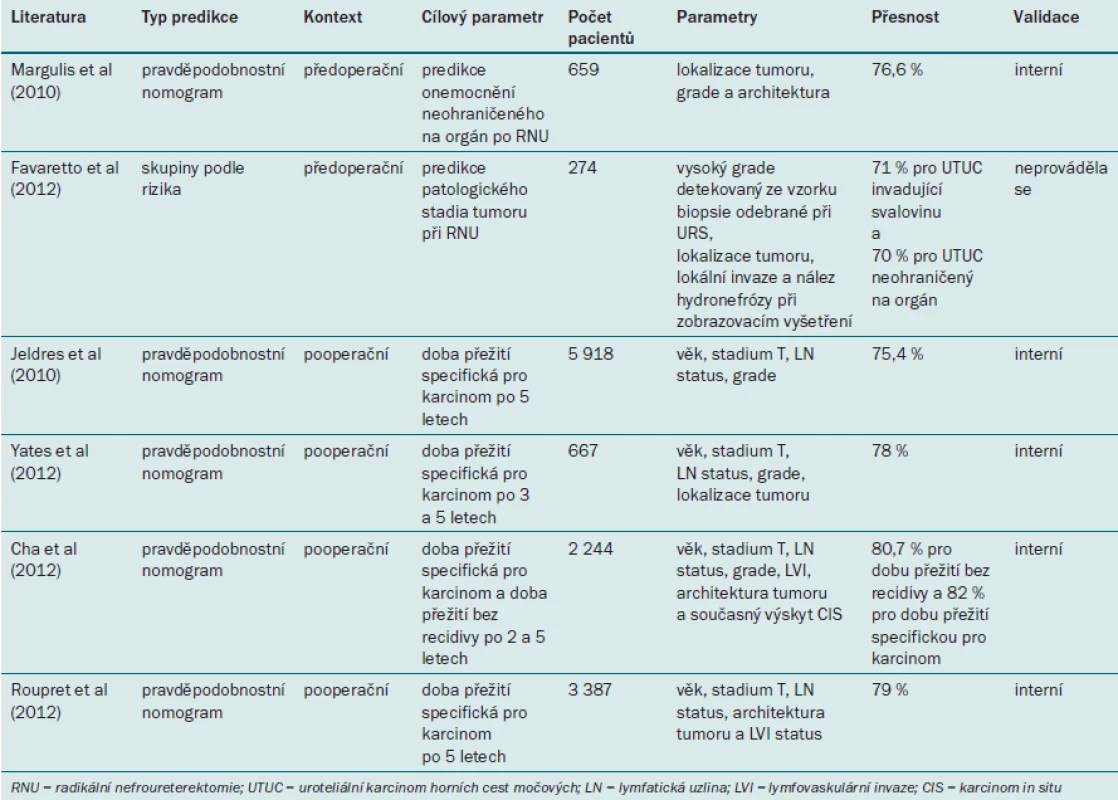
Limitace
Design studie
Zásadní limitací citovaných studií je jejich retrospektivní a multicentrický design [1,72,75,76,79–81], což je ovšem zapříčiněno malou frekvencí výskytu UTUC. Většina modelů byla vytvořena na základě retrospektivních studií, aby byl zahrnut co největší počet pacientů. Aby bylo možné shromáždit velkou populaci pacientů, jsou nezbytné národní i mezinárodní studie, zahrnující více institucí a více lékařů. Speciální kritéria (jako kritéria pro zařazení/nezařazení do studie) navíc neumožňují aplikaci těchto modelů u pacientů s odlišnými parametry a pacientů, kteří podstoupili odlišnou léčbu.
Nedostatečná přesnost predikčních modelů
Žádný z v současné době dostupných modelů není bezchybný. Příčinou může být skutečnost, že nejsou zohledněny všechny potenciální prediktivní rizikové faktory, a neschopnost zkombinovat ideálním způsobem všechny známé prognostické faktory. Uroteliální karcinomy mají velmi heterogenní biologickou povahu. Aby bylo možné postihnout komplexní biologický potenciál UTUC a tak zvýšit přesnost predikce v současné době dostupných instrumentů, bude nezbytné vyvinout nové biomarkery a zobrazovací techniky.
Validace
Tyto nomogramy vykazovaly uspokojivou přesnost (rozlišení mezi pacienty s/bez cílového výstupu, který je předmětem zájmu) a dobrou kalibraci (přesnost predikce u jednotlivých pacientů). Před zavedením těchto predikčních instrumentů do běžné praxe je však nutné je externě validovat na jiných populacích pacientů, než na kterých byly vyvíjeny [83]. Rozdíly v onemocnění, rozdílné parametry pacientů a odlišné protokoly a zkušenosti lékařů mohou snižovat přesnost a kalibraci predikčních nástrojů při aplikaci na jiné populace. Například nomogramy vyvinuté na základě databází z center s velkým objemem výkonů nelze využít pro běžnou klinickou praxi. Všechny predikční nástroje tedy vyžadují externí validaci.
Závěr
Před pěti lety neexistoval žádný predikční instrument pro pacienty s tímto vzácným onemocněním. Kliničtí lékaři volili svá doporučení a rozhodnutí na základě vlastní zkušenosti a publikovaných studií, které však mimo jiné nedostatky zahrnovaly velmi malé populace pacientů. Významný nárůst kvantity a zlepšení kvality výzkumu týkajícího se UTUC spočívající ve spolupráci mezinárodních týmů (např. UTUCC) umožnil vyvinout sofistikované matematické modely pro přesnou predikci výsledků u jednotlivých pacientů. I přesto, že tyto instrumenty představují pro naše pacienty s UTUC významnou přidanou hodnotu, stále mají své limitace. Nejvýznamnějším nedostatkem je absence externí validace, jež může limitovat využití modelů u jiných pacientů, než u kterých byly vyvíjeny. Druhým nedostatkem je skutečnost, že tyto modely mohou vyžadovat častou aktualizaci. Některé ze současných modelů budou pro větší přístupnost a flexibilitu vyžadovat revizi. A poslední nedostatek – tyto modely mohou lékaři pomoci pouze při volbě nejlepšího řešení na základě rizika specifického výsledku. Výzkum zaměřující se na komparativní účinnost zahájil novou éru zmenšující překážky v léčbě pacientů s UTUC. Více než kdykoli předtím je pro zlepšení péče o pacienty s UTUC nezbytná spolupráce různých disciplín na komplexním výzkumu.
Prof. Shahrokh F. Shariat, M.D.
Department of Urology
Medical University of ViennaWähringerGürtel 18–20A-1090 Vienna, Austria
shahrokh.shariat@meduniwien.ac.at
Zdroje
1. Roupret M, Zigeuner R, Palou J et al. European guidelines for the diagnosis and management of upper urinary tract urothelial cell carcinomas: 2011 update. Eur Urol 2011; 59 : 584–594.
2. Ehdaie B, Chromecki TF, Lee RK et al. Obesity adversely impacts disease specific outcomes in patients with upper tract urothelial carcinoma. J Urol 2011; 186 : 66–72.
3. Fajkovic H, Cha EK, Jeldres C et al. Prognostic value of extranodal extension and other lymph node parameters in patients with upper tract urothelial carcinoma. J Urol 2012; 187 : 845–851.
4. Kikuchi E, Margulis V, Karakiewicz PI et al. Lymphovascular invasion predicts clinical outcomes in patients with node-negative upper tract urothelial carcinoma. J Clin Oncol 2009; 27 : 612–618.
5. Raman JD, Ng CK, Scherr DS et al. Impact of tumor location on prognosis for patients with upper tract urothelial carcinoma managed by radical nephroureterectomy. Eur Urol 2010; 57 : 1072–1079.
6. Shariat SF, Favaretto RL, Gupta A et al. Gender differences in radical nephroureterectomy for upper tract urothelial carcinoma. World J Urol 2011; 29 : 481–486.
7. Lughezzani G, Burger M, Margulis V et al. Prognostic factors in upper urinary tract urothelial carcinomas: a comprehensive review of the current literature. Eur Urol 2012; 62 : 100–114.
8. Ouzzane A, Colin P, Xylinas E et al. Ureteral and multifocal tumours have worse prognosis than renal pelvic tumours in urothelial carcinoma of the upper urinary tract treated by nephroureterectomy. Eur Urol 2011; 60 : 1258–1265.
9. Xylinas E, Rink M, Cha EK et al. Impact of Distal Ureter Management on Oncologic Outcomes Following Radical Nephroureterectomy for Upper Tract Urothelial Carcinoma. Eur Urol, 2012
10. Shariat SF, Kattan MW, Vickers AJ et al. Critical review of prostate cancer predictive tools. Future Oncol 2009; 5 : 1555–1584.
11. Lughezzani G, Jeldres C, Isbarn H et al. Nephroureterectomy and segmental ureterectomy in the treatment of invasive upper tract urothelial carcinoma: a population-based study of 2299 patients. Eur J Cancer 2009; 45 : 3291–3297.
12. Shariat SF, Godoy G, Lotan Y et al. Advanced patient age is associated with inferior cancer-specific survival after radical nephroureterectomy. BJU Int 2010; 105 : 1672–1677.
13. Chromecki TF, Ehdaie B, Novara G et al. Chronological age is not an independent predictor of clinical outcomes after radical nephroureterectomy. World J Urol 2011; 29 : 473–480.
14. Lughezzani G, Sun M, Perrotte P et al. Gender-related differences in patients with stage I to III upper tract urothelial carcinoma: results from the Surveillance, Epidemiology, and End Results database. Urology 2010; 75 : 321–327.
15. Raman JD, Messer J, Sielatycki JA et al. Incidence and survival of patients with carcinoma of the ureter and renal pelvis in the USA, 1973–2005. BJU Int 2011; 107 : 1059–1064.
16. Martinez-Salamanca JI, Shariat SF, Rodriguez JC et al. Prognostic role of ECOG performance status in patients with urothelial carcinoma of the upper urinary tract: an international study. BJU Int 2012; 109 : 1155–1161.
17. Berod AA, Colin P, Yates DR et al. The role of American Society of Anesthesiologists scores in predicting urothelial carcinoma of the upper urinary tract outcome after radical nephroureterectomy: results from a national multi-institutional collaborative study. BJU Int, 2012; 110: E1035–E1040.
18. McLaughlin JK, Silverman DT, Hsing AW et al. Cigarette smoking and cancers of the renal pelvis and ureter. Cancer Res 1992; 52 : 254–257.
19. Rink M, Xylinas E, Margulis V et al. Impact of smoking on oncologic outcomes of upper tract urothelial carcinoma after radical nephroureterectomy. Eur Urol 2013; 63 : 1082–1090.
20. Cho KS, Hong SJ, Cho NH et al. Grade of hydronephrosis and tumor diameter as preoperative prognostic factors in ureteral transitional cell carcinoma. Urology 2007; 70 : 662–666.
21. Ito Y, Kikuchi E, Tanaka N et al. Preoperative hydronephrosis grade independently predicts worse pathological outcomes in patients undergoing nephroureterectomy for upper tract urothelial carcinoma. J Urol 2011; 185 : 1621–1626.
22. Brien JC, Shariat SF, Herman MP et al. Preoperative hydronephrosis, ureteroscopic biopsy grade and urinary cytology can improve prediction of advanced upper tract urothelial carcinoma. J Urol 2010; 184 : 69–73.
23. Ng CK, Shariat SF, Lucas SM et al. Does the presence of hydronephrosis on preoperative axial CT imaging predict worse outcomes for patients undergoing nephroureterectomy for upper-tract urothelial carcinoma? Urol Oncol 2011; 29 : 27–32.
24. Raman JD, Shariat SF, Karakiewicz PI et al. Does preoperative symptom classification impact prognosis in patients with clinically localized upper-tract urothelial carcinoma managed by radical nephroureterectomy? Urol Oncol 2011; 29 : 716–723.
25. Inman BA, Tran VT, Fradet Y et al. Carcinoma of the upper urinary tract: predictors of survival and competing causes of mortality. Cancer 2009; 115 : 2853–2862.
26. Park J, Ha SH, Min GE et al. The protective role of renal parenchyma as a barrier to local tumor spread of upper tract transitional cell carcinoma and its impact on patient survival. J Urol 2009; 182 : 894–899.
27. Zigeuner RE, Hutterer G, Chromecki T et al. Bladder tumour development after urothelial carcinoma of the upper urinary tract is related to primary tumour location. BJU Int 2006; 98 : 1181–1186.
28. Favaretto RL, Shariat SF, Chade DC et al. The effect of tumor location on prognosis in patients treated with radical nephroureterectomy at Memorial Sloan-Kettering Cancer Center. Eur Urol 2010; 58 : 574–580.
29. Chromecki TF, Cha EK, Fajkovic H et al. The impact of tumor multifocality on outcomes in patients treated with radical nephroureterectomy. Eur Urol 2012; 61 : 245–253.
30. Simone G, Papalia R, Loreto A et al. Independent prognostic value of tumour diameter and tumour necrosis in upper urinary tract urothelial carcinoma. BJU Int 2009; 103 : 1052–1057.
31. Pieras E, Frontera G, Ruiz X et al. Concomitant carcinoma in situ and tumour size are prognostic factors for bladder recurrence after nephroureterectomy for upper tract transitional cell carcinoma. BJU Int 2010; 106 : 1319–1323.
32. Guarnizo E, Pavlovich CP, Seiba M et al. Ureteroscopic biopsy of upper tract urothelial carcinoma: improved diagnostic accuracy and histopathological considerations using a multi-biopsy approach. J Urol 2000; 163 : 52–55.
33. Mullerad M, Russo P, Golijanin D et al. Bladder cancer as a prognostic factor for upper tract transitional cell carcinoma. J Urol 2004; 172 : 2177–2181.
34. Xylinas E, Colin P, Audenet F et al. Intravesical recurrence after radical nephroureterectomy for upper tract urothelial carcinomas: predictors and impact on subsequent oncological outcomes from a national multicenter study. World J Urol 2013; 31 : 61–68.
35. Novara G, De Marco V, Dalpiaz O et al. Independent predictors of contralateral metachronous upper urinary tract transitional cell carcinoma after nephroureterectomy: multi-institutional dataset from three European centers. Int J Urol 2009; 16 : 187–191.
36. Waldert M, Karakiewicz PI, Raman JD et al. A delay in radical nephroureterectomy can lead to upstaging. BJU Int 2010; 105 : 812–817.
37. Ni S, Tao W, Chen Q et al. Laparoscopic versus open nephroureterectomy for the treatment of upper urinary tract urothelial carcinoma: a systematic review and cumulative analysis of comparative studies. Eur Urol 2012; 61 : 1142–1153.
38. Hanna N, Sun M, Trinh QD et al. Propensity-score-matched comparison of perioperative outcomes between open and laparoscopic nephroureterectomy: a national series. Eur Urol 2012; 61 : 715–721.
39. Simone G, Papalia R, Guaglianone S et al. Laparoscopic versus open nephroureterectomy: perioperative and oncologic outcomes from a randomised prospective study. Eur Urol 2009; 56 : 520–526.
40. Lughezzani G, Sun M, Perrotte P et al. Should bladder cuff excision remain the standard of care at nephroureterectomy in patients with urothelial carcinoma of the renal pelvis? A population-based study. Eur Urol 2010; 57 : 956–962.
41. Roscigno M, Brausi M, Heidenreich A et al. Lymphadenectomy at the time of nephroureterectomy for upper tract urothelial cancer. Eur Urol 2011; 60 : 776–783.
42. Kondo T, Tanabe K. Role of lymphadenectomy in the management of urothelial carcinoma of the bladder and the upper urinary tract. Int J Urol 2012; 19 : 710–721.
43. Xylinas E, Rink M, Margulis V et al. Prediction of true nodal status in patients with pathological lymph node negative upper tract urothelial carcinoma at radical nephroureterectomy. J Urol 2013; 189 : 468–473.
44. Margulis V, Shariat SF, Matin SF et al. Outcomes of radical nephroureterectomy: a series from the Upper Tract Urothelial Carcinoma Collaboration. Cancer 2009; 115 : 1224–1233.
45. Lopez-Beltran A, Bassi P, Pavone-Macaluso M et al. Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis. Eur Urol 2004; 45 : 257–266.
46. Wheat JC, Weizer AZ, Wolf JS, Jr. et al. Concomitant carcinoma in situ is a feature of aggressive disease in patients with organ confined urothelial carcinoma following radical nephroureterectomy. Urol Oncol 2012; 30 : 252–258.
47. Otto W, Shariat SF, Fritsche HM et al. Concomitant carcinoma in situ as an independent prognostic parameter for recurrence and survival in upper tract urothelial carcinoma: a multicenter analysis of 772 patients. World J Urol 2011; 29 : 487–494.
48. Xylinas E, Rink M, Margulis V et al. Multifocal carcinoma in situ of the upper tract is associated with high risk of bladder cancer recurrence. Eur Urol 2012; 61 : 1069–1070.
49. Bolenz C, Shariat SF, Fernandez MI et al. Risk stratification of patients with nodal involvement in upper tract urothelial carcinoma: value of lymph-node density. BJU Int 2009; 103 : 302–306.
50. Novara G, Matsumoto K, Kassouf W et al. Prognostic role of lymphovascular invasion in patients with urothelial carcinoma of the upper urinary tract: an international validation study. Eur Urol 2010; 57 : 1064–1071.
51. Remzi M, Haitel A, Margulis V et al. Tumour architecture is an independent predictor of outcomes after nephroureterectomy: a multi-institutional analysis of 1363 patients. BJU Int 2009; 103 : 307–311.
52. Fritsche HM, Novara G, Burger M et al. Macroscopic sessile tumor architecture is a pathologic feature of biologically aggressive upper tract urothelial carcinoma. Urol Oncol 2010; 30 : 666–672.
53. Zigeuner R, Shariat SF, Margulis V et al. Tumour necrosis is an indicator of aggressive biology in patients with urothelial carcinoma of the upper urinary tract. Eur Urol 2010; 57 : 575–581.
54. Seitz C, Gupta A, Shariat SF et al. Association of tumor necrosis with pathological features and clinical outcome in 754 patients undergoing radical nephroureterectomy for upper tract urothelial carcinoma: an international validation study. J Urol 2010; 184 : 1895–1900.
55. Colin P, Ouzzane A, Yates DR et al. Influence of Positive Surgical Margin Status After Radical Nephroureterectomy on Upper Urinary Tract Urothelial Carcinoma Survival. Ann Surg Oncol, 2012; 19: 3613–3620.
56. Rink M, Robinson BD, Green DA et al. Impact of histological variants on clinical outcomes of patients with upper urinary tract urothelial carcinoma. J Urol 2012; 188 : 398–404.
57. Xylinas E, Rink M, Margulis V et al. Histologic Variants of Upper Tract Urothelial Carcinoma Do Not Affect Response to Adjuvant Chemotherapy After Radical Nephroureterectomy. Eur Urol 2012; 62: e25–e26.
58. Ku JH, Byun SS, Jeong H et al. The Role of p53 on Survival of Upper Urinary Tract Urothelial Carcinoma: A Systematic Review and Meta-Analysis. Clin Genitourin Cancer, 2013; 11 : 221–228.
59. Jeon HG, Jeong IG, Bae J et al. Expression of Ki-67 and COX-2 in patients with upper urinary tract urothelial carcinoma. Urology 2010; 76 : 513 e7–e12.
60. Leibl S, Zigeuner R, Hutterer G et al. EGFR expression in urothelial carcinoma of the upper urinary tract is associated with disease progression and metaplastic morphology. APMIS 2008; 116 : 27–32.
61. Nakanishi K, Hiroi S, Tominaga S et al. Expression of hypoxia-inducible factor-1alpha protein predicts survival in patients with transitional cell carcinoma of the upper urinary tract. Clin Cancer Res 2005; 11 : 2583–2590.
62. Inoue K, Slaton JW, Karashima T et al. The prognostic value of angiogenesis factor expression for predicting recurrence and metastasis of bladder cancer after neoadjuvant chemotherapy and radical cystectomy. Clin Cancer Res 2000; 6 : 4866–4873.
63. Fromont G, Roupret M, Amira N et al. Tissue microarray analysis of the prognostic value of E-cadherin, Ki67, p53, p27, survivin and MSH2 expression in upper urinary tract transitional cell carcinoma. Eur Urol 2005; 48 : 764–770.
64. Nakanishi K, Tominaga S, Hiroi S et al. Expression of survivin does not predict survival in patients with transitional cell carcinoma of the upper urinary tract. Virchows Arch 2002; 441 : 559–563.
65. Jeong IG, Kim SH, Jeon HG et al. Prognostic value of apoptosis-related markers in urothelial cancer of the upper urinary tract. Hum Pathol 2009; 40 : 668–677.
66. Saito K, Kawakami S, Ohtsuka Y et al. The impact of preoperative serum C-reactive protein on the prognosis of patients with upper urinary tract urothelial carcinoma treated surgically. BJU Int 2007; 100 : 269–273.
67. Lehmann J, Suttmann H, Kovac I et al. Transitional cell carcinoma of the ureter: prognostic factors influencing progression and survival. Eur Urol 2007; 51 : 1281–1288.
68. Tanaka N, Kikuchi E, Shirotake S et al. The Predictive Value of C-reactive Protein for Prognosis in Patients with Upper Tract Urothelial Carcinoma Treated with Radical Nephroureterectomy: A Multi-institutional Study. Eur Urol 2012, doi: 10.1016/j.eururo.2012.11.050.
69. Stein B, Schrader AJ, Wegener G et al. Preoperative serum C - reactive protein: a prognostic marker in patients with upper urinary tract urothelial carcinoma. BMC Cancer 2013; 13 : 101.
70. Roupret M, Catto J, Coulet F et al. Microsatellite instability as indicator of MSH2 gene mutation in patients with upper urinary tract transitional cell carcinoma. J Med Genet 2004; 41: e91.
71. Roupret M, Fromont G, Azzouzi AR et al. Microsatellite instability as predictor of survival in patients with invasive upper urinary tract transitional cell carcinoma. Urology 2005; 65 : 1233–1237.
72. Favaretto RL, Shariat SF, Savage C et al. Combining imaging and ureteroscopy variables in a preoperative multivariable model for prediction of muscle-invasive and non-organ confined disease in patients with upper tract urothelial carcinoma. BJU Int 2012; 109 : 77–82.
73. Matin SF, Margulis V, Kamat A et al. Incidence of downstaging and complete remission after neoadjuvant chemotherapy for high-risk upper tract transitional cell carcinoma. Cancer 2010; 116 : 3127–3134.
74. Lane BR, Smith AK, Larson BT et al. Chronic kidney disease after nephroureterectomy for upper tract urothelial carcinoma and implications for the administration of perioperative chemotherapy. Cancer 2010; 116 : 2967–2973.
75. Messer JC, Terrell JD, Herman MP et al. Multi-institutional validation of the ability of preoperative hydronephrosis to predict advanced pathologic tumor stage in upper-tract urothelial carcinoma. Urol Oncol, 2011; 31 : 904–908.
76. Margulis V, Youssef RF, Karakiewicz PI et al. Preoperative multivariable prognostic model for prediction of nonorgan confined urothelial carcinoma of the upper urinary tract. J Urol 2010; 184 : 453–458.
77. Shariat SF, Chade DC, Karakiewicz PI et al. Combination of multiple molecular markers can improve prognostication in patients with locally advanced and lymph node positive bladder cancer. J Urol 2010; 183 : 68–75.
78. Roscigno M, Shariat SF, Margulis V et al. The extent of lymphadenectomy seems to be associated with better survival in patients with nonmetastatic upper-tract urothelial carcinoma: how many lymph nodes should be removed? Eur Urol 2009; 56 : 512–518.
79. Jeldres C, Sun M, Lughezzani G et al. Highly predictive survival nomogram after upper urinary tract urothelial carcinoma. Cancer 2010; 116 : 3774–3784.
80. Yates DR, Hupertan V, Colin P et al. Cancer-specific survival after radical nephroureterectomy for upper urinary tract urothelial carcinoma: proposal and multi-institutional validation of a post-operative nomogram. Br J Cancer 2012; 106 : 1083–1088.
81. Cha EK, Shariat SF, Kormaksson M et al. Predicting clinical outcomes after radical nephroureterectomy for upper tract urothelial carcinoma. Eur Urol 2012; 61 : 818–825.
82. Roupret M, Hupertan V, Seisen T et al. Prediction of cancer-specific survival after radical nephroureterectomy for upper tract urothelial carcinoma: development of an optimized post-operative nomogram using decision curve analysis. J Urol, 2013; 189 : 1662–1669.
83. Nuhn P, May M, Fritsche HM et al. External validation of disease-free survival at 2 or 3 years as a surrogate and new primary endpoint for patients undergoing radical cystectomy for urothelial carcinoma of the bladder. Eur J Surg Oncol 2012; 38 : 637–642.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2013 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- Léčba symptomatické benigní prostatické hyperplazie pomocí holmium laseru
- Úvodní slovo
- Prognostické faktory, molekulární markery a prediktivní instrumenty pro hodnocení uroteliálního karcinomu horních cest močových
- Endometrióza urogenitálního traktu
-
Guidelines AUA pro řešení benigní hyperplazie prostaty (BPH)
1. část - Definice vhodného kandidáta s karcinomem prostaty pro pozorování a pro cílenou fokální terapii
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Endometrióza urogenitálního traktu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



