-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDosavadní zkušenosti s léčbou ropeginterferonem alfa-2b u pacientů s Ph negativními myeloproliferacemi na Interní hematologické a onkologické klinice LF MU a FN Brno
Current experience with ropeginterferon Alfa-2b in Ph negative myeloproliferative neoplasm at the Department of Internal Medicine – Haematology and Oncology in Brno
Background: Ropeginterferon alfa-2b demonstrated efficacy and safety in patients with polycythaemia vera in the PROUD-PV and CONTINUATION-PV multicentric randomised studies. These studies reported the superior effect of ropeginterferon alfa-2b in attaining haematological and molecular remission during the fourth and fifth year of therapy. Patients and Methods: A total of 14 Ph-MPN patients treated with ropeginterferon alfa-2b at our Dept. of Internal Medicine – Haematology and Oncology were analysed from May 2020 to July 2022. Therapy duration, dosing, effect, and tolerance were evaluated. Results: Therapy median duration was 266 days. 14 patients in total were treated; 11 had polycythaemia vera (79%), 2 had essential thrombocythemia (14%), and one patient had secondary myelofibrosis post polycythaemia vera (7%). The median ropeginterferon alfa 2-b dose was 150 μg. Complete haematological remission was attained in 11 (79%) patients. Two patients (14%) had to discontinue treatment. During therapy, six patients (43%) suffered adverse events; only one patient (7%) developed a thromboembolic event. Conclusion: Our initial experience has confirmed the promising effect of ropeginterferon alfa 2-b on haematocrit control and its excellent tolerance among patients.
Keywords:
polycythemia vera – Ph negative myeloproliferative neoplasms – ropeginteferon alpha-2b
Autoři: N. Podstavková 1; B. Weinbergerová 1; J. Procházková 1; M. Bohúnová 2; A. Marečková 2; J. Kotašková 2; I. Ježíšková 2; M. Doubek 1; J. Mayer 1,2
Působiště autorů: Interní hematologická a onkologická klinika, LF MU a FN Brno 1; Centrum molekulární bio logie a genetiky, Interní hematologická a onkologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. 4, p. 213-218.
Kategorie: Původní práce
doi: https://doi.org/10.48095/cctahd2022prolekare.cz15Souhrn
Úvod: Ropeginterferon alfa-2b (RopegIFN) prokázal účinnost a bezpečnost u pacientů s pravou polycytémií v multicentrických randomizovaných studiích PROUD-PV a CONTINUATION-PV. Během 4.–5. roku terapie byl prokázán jednoznačný benefit terapie RopegIFN ve srovnání s nejlepší dostupnou terapií, a to jak ve smyslu dosažení kompletní hematologické remise onemocnění, tak i výrazného snížení mutační alelické zátěže JAK2V617F. Materiál a metodika: Retrospektivní neintervenční analýza byla provedena u celkem 14 pacientů s Ph negativními myeloproliferacemi (Ph-MPN) léčených RopegIFN na Interní hematologické a onkologické klinice (IHOK) v období od května 2020 do července 2022. Hodnocena byla data týkající se délky terapie, dávkování, efektu a tolerance terapie. Výsledky: Medián délky terapie v souboru byl 266 dní. Léčeno bylo celkem 14 pacientů, z toho 11 s pravou polycytémií (79 %), 2 s esenciální trombocytémií (14 %) a 1 se sekundární myelofibrózou po pravé polycytémii (7 %). Medián dávky RopegIFN byl 150 μg. Dosažení kompletní hematologické remise bylo u 11 pacientů (79 %). Terapie byla během doby sledování ukončena u 2 pacientů (14 %). Nežádoucí účinky byly zaznamenány u 6 pacientů (43 %), tromboembolická příhoda byla dokumentována u jednoho pacienta (7 %). Závěr: Naše analýza prvotních zkušeností s terapií RopegIFN potvrdila jeho velmi dobrý efekt na kontrolu hematokritu a zároveň výbornou toleranci u pacientů s Ph-MPN.
Klíčová slova:
pravá polycytemie – Ph negativní myeloproliferativní neoplázie – ropeginterferon alfa-2b
ÚVOD
Ph negativní myeloproliferativní neoplázie představují heterogenní skupinu onemocnění postihujících hematopoetickou kmenovou buňku s následnou aberantní proliferací buněk myeloidní krevní řady, která vede k zvýšené tvorbě erytrocytů, trombocytů a/nebo granulocytů. Mezi nejčastěji se vyskytující podjednotky této skupiny se řadí pravá polycytémie (polycythemia vera – PV), esenciální trombocytémie (ET) a primární myelofibróza (PMF). Mají několik společných znaků; kromě společné patogeneze je pojí obdobný klinický obraz, zvýšený výskyt trombotických a krvácivých komplikací a riziko fibrotické a leukemické transformace. Jednotlivé nozologické jednotky se od sebe navzájem odlišují především dlouhodobou prognózou [1].
Pravá polycytémie, nejčastěji se vyskytující jednotka ze skupiny Ph negativních myeloproliferativních onemocnění, je charakterizována především zmnožením červené krevní řady, často provázené i zvýšením počtu leukocytů a trombocytů [2]. V patogenezi onemocnění hraje klíčovou roli mutace JAK2V617F, přítomná u více než 95 % pacientů s PV. To vede k poruše regulace dráhy JAK/STAT (Janus kinase/signal transducers and activators of transcription), a tím k podpoře nekontrolované proliferace hematopoetických kmenových buněk a zároveň prozánětlivého prostředí v organizmu [2,3]. Kvalitu života pacientů s PV výrazně zhoršují příznaky, jako jsou svědění kůže, únava a poruchy mikrocirkulace. Největším problémem vedoucím ke zvýšené mortalitě a zkrácení délky života této skupiny nemocných oproti zdravé populaci zůstává vysoká četnost trombotických a krvácivých příhod [4].
Možnosti terapie pacientů s PV i přes významný pokrok v terapii hematologických malignit zůstávají limitované. Hlavním cílem terapie u této skupiny onemocnění je snížení rizika vzniku trombotických příhod a oddálení leukemické transformace [4]. Interferon, jako dosud jediný ze skupiny cytoredukční terapie, prokázal u vysokého procenta pacientů navození nejen hematologické, ale i molekulární remise trvající i několik let po ukončení léčby [5]. Vzhledem k absenci teratogenity a leukemogenního transformačního potenciálu je nyní považován za jeden z nejlepších léčivých přípravků na dlouhodobou terapii pacientů nejen s PV, ale i s esenciální trombocytémií a primární myelofibrózou [6]. Interferony-alfa jsou součástí léčebného přístupu u Ph-MPN již více než 40 let, běžnému použití v klinické praxi ale bránila především vyšší četnost jejich nežádoucích účinků ve srovnání s konvenční terapií a jejich off-label použití [7]. Během posledních let vývoj nových pegylovaných forem interferonu-alfa s lepšími farmakokinetickými vlastnostmi a profilem nežádoucích účinků výrazně zvýšil zájem o tuto léčbu u pacientů s Ph-MPN [4]. Díky tomu se terapie pegylovanými formami interferonu rozšířila a stala se součástí oficiálních ELN (European LeukemiaNet) doporučení z roku 2021 do 1. linie terapie pacientů s PV s nízkým rizikem [8].
Ropeginterferon alfa-2b (Besremi®) je v současnosti jako jediný z pegylovaných interferonů schválen a registrován v ČR pro terapii pacientů s PV bez symptomatické splenomegalie. Efektivita a bezpečnost tohoto preparátu byla ověřena v multicentrických randomizovaných studiích PROUD-PV a CONTINUATION-PV, kde byl srovnáván s nejlepší dostupnou terapií, hydroxyureou [9]. Výsledky této studie prokázali v 36. měsíci terapie signifikantně vyšší podíl dosažení celkové hematologické odpovědi a zároveň snížení alelické nálože mutace JAK2V617F ve skupině léčené RopegIFN oproti skupině léčené hydroxyureou [9]. Vysoká alelická nálož mutace JAK2V617F byla identifikována jako rizikový faktor pro vznik trombotických komplikací a taktéž fibrotické transformace u pacientů s PV a ET [10].
Účinnost terapie RopegIFN je dále ověřována i u jiných podtypů Ph-MPN, aktuálně probíhá otevřená multicentrická randomizovaná studie fáze III, SURPASS-ET, hodnotící bezpečnost a efektivitu RopegIFN v srovnání s anagrelidem v rámci druhé linie terapie u pacientů s ET vysokého rizika [11].
Tato práce představuje dosavadní výsledky léčby RopegIFN u pacientů s Ph-MPN v běžné klinické praxi a srovnává je s výsledky léčby v kontrolovaných klinických studiích.
MATERIÁL A METODIKA
Provedli jsme retrospektivní neintervenční analýzu dat týkající se dávkování, efektu a bezpečnosti terapie RopegIFN u pacientů s Ph-MPN sledovaných na IHOK od května 2020 do července 2022.
Zdrojová data byla čerpána z dokumentace pacientů a taktéž z databáze České leukemické skupiny pro život (the Czech Leukemia Study Group – for Life – CELL) pro Ph-MPN (Myeloproliferative Neoplasia Database – MIND).
Parametry krevního obrazu byly sledovány v pravidelných intervalech, kvantita alelické nálože mutace JAK2V617F z periferní krve byla vyšetřována každé 3 měsíce terapie. Analýza přídatných genetických změn byla provedena pomocí NGS (next-generation sequencing) periferní krve před zahájením terapie a následně v pravidelných ročních intervalech. V rámci myeloidního panelu bylo analyzováno celkem 37 genů. Toxicita terapie byla hodnocena podle Společných terminologických kritérií pro nežádoucí účinky – CTCAE (Common Terminology Criteria for Adverse Events) verze 5.0. z roku 2017 [12]. Léčebný efekt byl hodnocen podle společných kritérií ELN a IWG-MRT (International Working Group-Myeloproliferative Neoplasms Research and Treatment) [13]. Trombotické riziko u PV bylo posouzeno na základě věku pacienta a trombotické události v anamnéze, u ET podle tzv. „IPSET skóre“ (International Prognostic Score of Thrombosis in Essential Thrombocytemia) [14,15].
VÝSLEDKY
Ve sledovaném období bylo na IHOK léčeno RopegIFN celkem 14 pacientů. Kompletní charakteristiku sledovaného souboru ukazuje tab. 1. Medián věku pacientů byl 51 let. Dominantně byli zastoupeni pacienti s PV (79 %, n = 11), 2 s ET (14 %) a 1 pacient se sekundární myelofibrózou po PV (7 %), u kterého nebyly přítomné splenomegalie ani konstituční symptomy. V hodnoceném souboru převažovali pacienti, kteří byli v čase diagnózy v nízkém trombotickém riziku (71 %, n = 10) (tab. 1).
Tab. 1. Základní charakteristika souboru pacientů (n = 14). 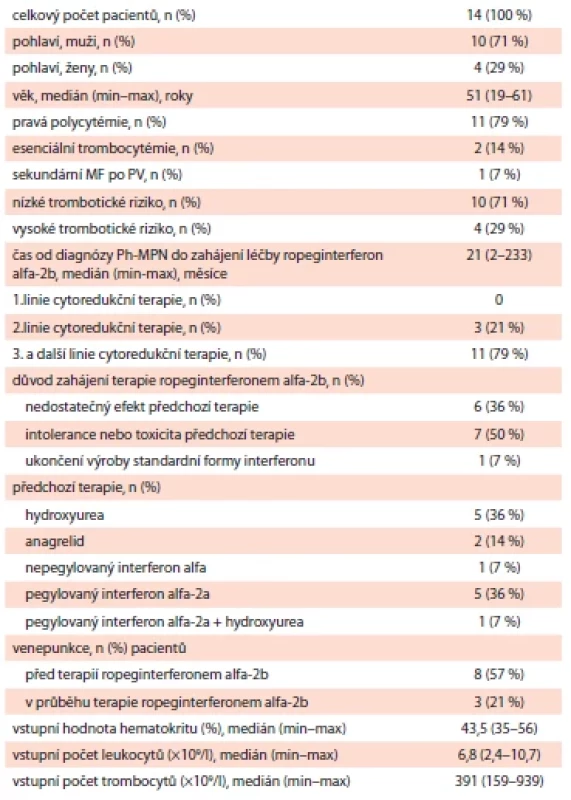
MF po PV – myelofi bróza po pravé polycytémii; Ph-MPN – Ph negativní myeloproliferativní neoplázie Medián času od stanovení diagnózy Ph-MPN do zahájení terapie RopegIFN byl 21 měsíců (min. – 2 měsíce; max. – 233 měsíců). U žádného pacienta nebyl RopegIFN podáván v rámci první léčebné linie, u většiny nemocných se jednalo o třetí nebo vyšší linii terapie. Co se týče důvodů nasazení této terapie, až u poloviny sledovaných se jednalo o toxicitu nebo intoleranci předchozí léčby (50 %, n = 7), u 6 pacientů byl důvodem nedostatečný efekt dosavadní léčby (43 %) a u jednoho pacienta byla terapie nasazena po ukončení výroby standardní formy interferonu (7 %, n = 1). Před nasazením terapie RopegIFN bylo 5 pacientů (36 %) léčeno pegylovaným interferonem alfa-2a, 5 pacientů (36 %) hydroxyureou, 2 pacienti (14 %) užívali anagrelid, 1 pacient (7 %) byl na terapii nepegylovaným interferonem-alfa a rovněž 1 pacient (7 %) byl na kombinované terapii pegylovaným interferonem alfa-2a a hydroxyureou. Před zahájením terapie RopegINF byly venepunkce součásti terapeutického postupu u 8 pacientů (57 %), v průběhu léčby RopegINF byly venepunkce nutné pouze u 3 pacientů (21 %).
Medián délky terapie v souboru byl 266 dní. Přehled nejdůležitějších informací o průběhu terapie RopegIFN zobrazuje tab. 2. U všech pacientů byla účinná dávka podávána každých 14 dnů, u jednoho pacienta došlo za dobu sledování k přechodu do udržovací terapie, a tedy prodloužení aplikace na jednou za 4 týdny. Iniciální dávka byla u 11 pacientů (79 %) 50 µg, u zbylých 3 pacientů (21 %) byla úvodní dávka 100 µg. Dávka byla postupně navyšována dle efektu a tolerance (medián – 150 μg, min. – 50 μg, max. – 250 μg).
Tab. 2. Základní charakteristika průběhu terapie ropeginterferonem alfa-2b (n = 14). 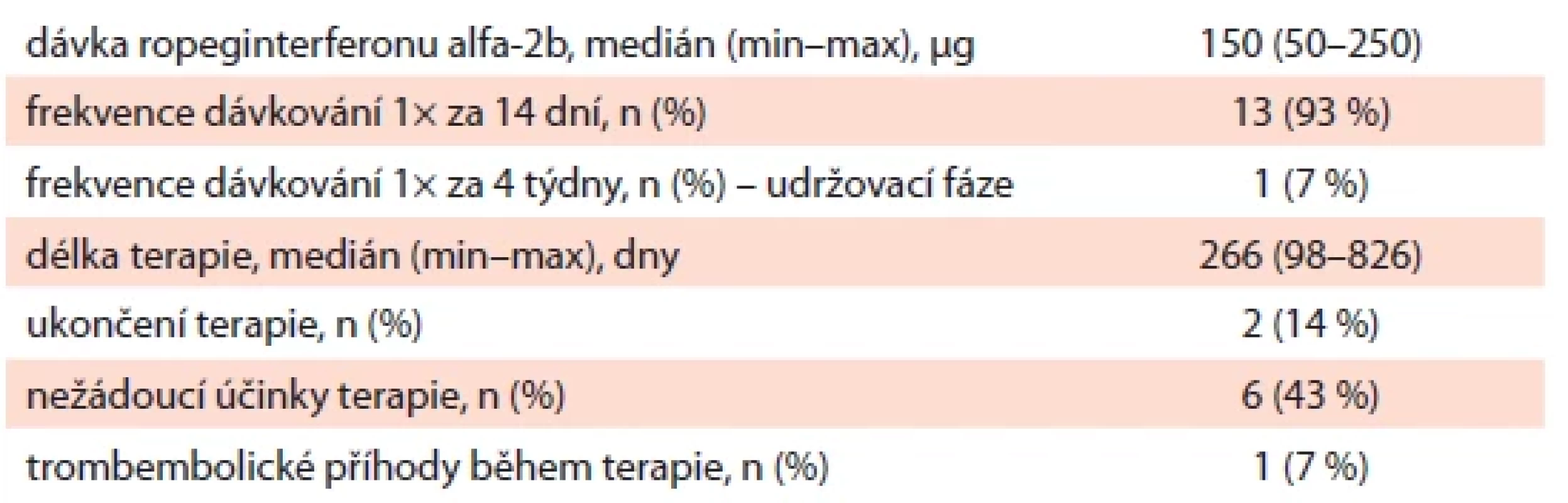
Během sledovaného období došlo u všech pacientů v souboru ke stabilizaci a postupnému poklesu hodnoty hematokritu (graf 1). U pacientů s ET během sledovaného období byl zaznamenán pozvolný pokles trombocytémie. Kompletní hematologické remise bylo dosaženo u 11 pacientů (79 %), medián doby do dosažení této odpovědi byl 5 měsíců.
Graf 1. Vývoj mediánu hladiny hematokritu od zahájení léčby ropeginterferonem alfa-2b ve sledovaném souboru. 
Vývoj mutační alelické nálože JAK2V617F v průběhu léčby RopegIFN ukazuje podrobně tab. 3. Během sledovaného období došlo u všech sledovaných k postupnému poklesu alelické nálože JAK2V617F (graf 2). Při zahájení terapie bylo provedeno vyšetření NGS periferní krve u celkem 12 pacientů, u 7 (58 %) z nich byla přítomna pouze mutace JAK2V617F, u 4 pacientů (33 %) byly zachyceny i další přídatné mutace, konkrétně ASXL1, DNMT3A a DDX41, u jednoho pacienta (9 %) nebyla prokázaná přítomnost žádné mutace z vyšetřovaného myeloidního panelu. V druhém roku terapie byla NGS analýza provedena u 7 pacientů, u naprosté většiny vyšetřených (n = 6; 86 %) byly výsledky shodné s vyšetřením v době zahájení terapie, pouze u jednoho pacienta (14 %) došlo k vymizení mutace JAK2V617F pod detekční hladinu.
Tab. 3. Vývoj mutační alelické zátěže JAK2V617F od zahájení léčby ropeginterferonem alfa-2b ve sledovaném souboru. 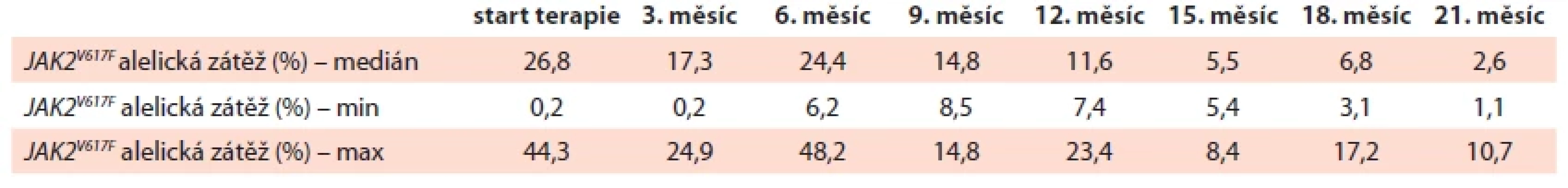
Graf 2. Vývoj mediánu mutační alelické zátěže JAK2V617F od zahájení léčby ropeginterferonem alfa-2b ve sledovaném souboru. 
Terapie byla během doby sledování ukončena u dvou pacientů (14 %), u jednoho pacienta s PV z důvodu progrese onemocnění – přechodu do sekundární myelofibrózy. Následně byla u tohoto pacienta zahájena terapie ruxolitinbem. U druhého pacienta byla terapie RopegIFN předčasně ukončena z důvodu neschválení pokračování terapie zdravotní pojišťovnou, dále byl pacient převeden na léčbu pegylovaným interferonem alfa-2a.
Nežádoucí účinky léčby byly zaznamenány u celkem šesti pacientů (43 %), přičemž u jednoho pacienta se mohlo vyskytovat i více různých nežádoucích účinků. Dominantně se jednalo o hepatopatii (n = 5, 46 %) a neutropenii (n = 4, 36 %), v jednom případě se jednalo o svědění kůže a v jednom případě byly taktéž zaznamenány změny a poruchy nálady. Všechny nežádoucí příhody byly nižších stupňů závažnosti dle CTCAE, max. 2. stupně, podrobně (graf 3). U žádného pacienta nebyl pozorován flu-like syndrom. Terapie nebyla ukončena ani přerušena u žádného pacienta z důvodu nežádoucích účinků nebo intolerance preparátu pacientem.
Graf 3. Vývoj mutační alelické zátěže JAK2V617F od zahájení léčby ropeginterferonem alfa-2b ve sledovaném souboru. 
Během sledovaného období byla zaznamenána pouze 1 trombembolická komplikace (7 %), která se však rozvinula u pacienta během pneumonie způsobené virem SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2).
DISKUZE
Naše práce ukazuje první výsledky a dosavadní zkušenosti s terapií RopegIFN na jednom centru. Medián délky terapie byl pouze 266 dní, nicméně již během této krátké doby bylo možno pozorovat efekt poklesu a stabilizace hodnoty hematokritu a taktéž postupné snížení alelické zátěže mutovaného JAK2V617F. Také je však nutné uvést, že u podstatné části pacientů byla terapie RopegIFN zahájena až v rámci 3. nebo další linie, což mohlo přispět k rychlému dosažení hematologické remise i v krátkém časovém horizontu při nižších dávkách RopegIFN.
Oproti datům ze studií, v našem souboru byly k dosažení hematologické odpovědi postačující výrazně nižší celkové dávky RopegIFN. Medián dávky u sledovaných pacientů byl 150 μg aplikovaný podkožně každých 14 dnů a nejvyšší podaná dávka byla 250 μg každých 14 dnů. Ve studii PROUD-PV a CONTINUATION-PV byl výrazně vyšší medián využívané dávky v 36. měsíci terapie (425 μg) a nejvyšší podávaná dávka (500 μg) [9]. Léčebný efekt ve smyslu dosažení kompletní hematologické remise ve vysokém procentu pacientů (79 %) byl srovnatelný s daty ve studiích PROUD-PV (43 %) a CONTINUATION-PV (71 %) [9].
V souladu s výsledky randomizovaných studií jsme i v souboru našich pacientů prokázali nízkou frekvenci nežádoucích účinků terapie, přičemž nejčastěji se vyskytovala elevace jaterních testů.
Předností naší práce jsou výsledky použití RopegIFNu Ph-MPN v reálné klinické praxi se současným zohledněním velikosti souboru při hodnocení výstupů.
ZÁVĚR
Ropeginterferon alfa-2b představuje účinnou a bezpečnou terapii pacientů s pravou polycytémií, jak bylo prokázáno v klinických studiích s následným schválením EMA (European Medicines Agency) v roce 2018. Léčebný přípravek má potenciál – jako jediný z dosud dostupných cytoredukčních léků pro Ph-MPN dosáhl kromě dosažení hematologické odpovědi taktéž snížení alelické zátěže JAK2V617F, a tím zpomalení přirozené progrese onemocnění. Tento fakt je důležitý především u mladší skupiny pacientů. Jedna z jeho největších předností vzhledem k odlišné pegylaci molekuly a prodlouženému poločasu je reprezentována výrazně lepší snášenlivostí, a tak vynikající compliance pacientů k léčbě.
PODÍL AUTORŮ NA RUKOPISU
NP – napsání rukopisu
NP, JP – příprava analýzy
NP, BW, MD, JM – diagnostika a léčba nemocných
AM, MB, JK, IJ – diagnostika nemocných, molekulární analýzy
NP, BW, MD, JM, AM, MB, JK, IJ – revize a připomínkování rukopisu
PODĚKOVÁNÍ
Práce byla podpořena grantem MZ ČR – RVO (FNBr 65269705), MUNI/A/1330/2021 a projektem Národního ústavu pro výzkum rakoviny (Program EXCELES, ID: LX22NPO5102) – financováno Evropskou unií – Next Generation EU. Molekulární analýzy byly finančně podpořeny firmou AOP Orphan.
PROHLÁŠENÍ AUTORŮ O KONFLIKTU ZÁJMŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne: 6. 10. 2022.
Přijato po recenzi dne: 27. 10. 2022.
MUDr. Natália Podstavková
Interní hematologická a onkologická
klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: podstavkova.natalia@fnbrno.cz
Zdroje
1. Dunbar AJ, Rampal RK, Levine R. Leukemia secondary to myeloproliferative neoplasms. Blood. 2020; 136 (1): 61–70.
2. Spivak JL. Polycythemia vera. Curr Treat Options Oncol. 2018; 19 (2): 12.
3. Hasselbalch HC, Holmstrom MO. Perspectives on interferon-alpha in the treatment of polycythemia vera and related myeloproliferative neoplasms: minimal residual disease and cure? Semin Immunopathol. 2019; 41 : 5–19.
4. Griesshammer M, Gisslinger H, Mesa R. Current and future treatment options for polycythemia vera. Ann Hematol. 2015; 94 : 901–910.
5. Gisslinger H, Zagrijtschuk O, Buxhofer-Ausch V, et al. Ropeginterferon alfa-2b, a novel IFNa-2b, induces high response rates with low toxicity in patients with polycythemia vera. Blood. 2015; 126 (15): 1762–1769.
6. Hasselbalch HC. A new era for IFN-a in the treatment of Philadelphia-negative chronic myeloproliferative neoplasms. Expert Rev Hematol. 2011; 4 (6): 637–655.
7. Kiladjian JJ, Cassinat B, Turlure P, et al. High molecular response rate of polycythemia vera patients treated with pegylated interferon alpha-2a. Blood. 2006; 108 (6): 2037–2040.
8. Marchetti M, Vannucchi AM, Griesshammer M, et al. Appropriate management of polycythaemia vera with cytoreductive drug therapy: European LeukemiaNet 2021 recommendations. Lancet Haematol. 2022; 9 (4): e301–e311.
9. Gisslinger H, Klade C, Georgiev P, et al. PROUD-PV Study Group. Ropeginterferon alfa-2b versus standard therapy for polycythaemia vera (PROUD-PV and CONTINUATION-PV): a randomised, non-inferiority, phase 3 trial and its extension study. Lancet Haematol. 2020; 7 (3): e196–e208.
10. Alvarez-Larrán A, Bellosillo B, Pereira A, et al. JAK2V617F monitoring in polycythemia vera and essential thrombocythemia: clinical usefulness for predicting myelofibrotic transformation and thrombotic events. Am J Hematol. 2014; 89 : 517–523.
11. Verstovsek S, Komatsu N, Gill H, et al. SURPASS-ET: phase III study of ropeginterferon alfa-2b versus anagrelide as second-line therapy in essential thrombocythemia. Future Oncol. 2022; 18 (27): 2999–3009.
12. https: //ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_8.5x11.pdf
13. Barosi G, Mesa R, Finazzi G, et al. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project. Blood. 2013; 121 (23): 4778–4781.
14. Barbui T, Barosi G, Birgegard G, et al. European LeukemiaNet. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol. 2011; 29 (6): 761–770.
15. Barbui T, Finazzi G, Carobbio A, et al. Development and validation of an International Prognostic Score of thrombosis in World Health Organization-essential thrombocythemia (IPSET-thrombosis). Blood. 2012; 120 (26): 5128–5133. AE verze 5.0. z roku 2017
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Efektivita kombinace monoklonálních protilátek tixagevimab-cilgavimab v prevenci a léčbě pacientů s vysokým rizikem rozvoje COVID-19
- Jak anti-SARS-CoV-2 IgG a IgM predikují titr virus neutralizačních protilátek u dárců rekonvalescentní plazmy proti onemocnění COVID-19?
- Dosavadní zkušenosti s léčbou ropeginterferonem alfa-2b u pacientů s Ph negativními myeloproliferacemi na Interní hematologické a onkologické klinice LF MU a FN Brno
- Hemolytická nemoc plodu a novorozence
- Beta-thalassemia minor a maior v těhotenství
- 30 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Prof. MUDr. Karel Indrák, DrSc. se dožívá 75 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hemolytická nemoc plodu a novorozence
- Beta-thalassemia minor a maior v těhotenství
- Dosavadní zkušenosti s léčbou ropeginterferonem alfa-2b u pacientů s Ph negativními myeloproliferacemi na Interní hematologické a onkologické klinice LF MU a FN Brno
- Jak anti-SARS-CoV-2 IgG a IgM predikují titr virus neutralizačních protilátek u dárců rekonvalescentní plazmy proti onemocnění COVID-19?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



