-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hemolytická nemoc plodu a novorozence
Haemolytic disease of the foetus and new-born
This case report describes Rh incompatibility during pregnancy. A pregnant woman with a history of RhD haemolytic disease of the foetus and new-born 6 years ago, presented in the 10th week of her current gestation with an already very high titre of the anti-D alloantibody. Further immunisation with anti-C and anti-G alloantibodies followed. Severe anaemia of the foetus required intrauterine transfusion treatment from the 22nd gestational week.
Keywords:
haemolytic disease of the foetus and new-born – red blood cell antibodies – intrauterine transfusion – Rh(D) immunoprophylaxis – anti-G
Autoři: H. Kostrouchová 1; J. Tylečková 1; Romana Gerychová 2
Působiště autorů: Transfuzní a tkáňové oddělení, FN Brno 1; Gynekologicko-porodnická klinika FN Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. 4, p. 221-225.
Kategorie: Kazuistika
doi: https://doi.org/doi: 10.48095/cctahd2022prolekare.cz13Souhrn
Kazuistika popisuje těhotenství inkompatibilní v Rh skupinovém systému erytrocytů. Těhotná s anamnézou RhD hemolytické nemoci plodu a novorozence v dřívějším těhotenství má již v prvním trimestru aktuální gravidity neobvykle vysoký titr protilátky anti-D a přidávají se i další protilátky anti-C a anti-G. Rozvíjí se závažná anémie plodu, která od 22. týdne gestace vyžaduje opakované substituce intrauterinními transfuzemi erytrocytů. Rozbor této kazuistiky ilustruje problematiku hemolytické nemoci plodu a novorozence po diagnostické i léčebné stránce zejména z pohledu transfuzního lékaře.
Klíčová slova:
hemolytická nemoc plodu a novorozence – antierytrocytární protilátky – intrauterinní transfuze – RhD profylaxe – anti-G
ÚVOD
Hemolytická nemoc plodu a novorozence (hemolytic disease of the fetus and newborn – HDFN) je charakterizována protilátkami tvořenými matkou proti „cizímu“ antigenu/ům na erytrocytech plodu, které zdědil od otce. Aloprotilátky třídy IgG pak prochází placentou, senzibilizují krvinky plodu a vedou k jejich zkrácenému přežívání v důsledku hemolýzy. Vzniklou anémii plod kompenzuje vyšší extramedulární erytropoézou, vedoucí (spolu s hemolýzou) k hepatosplenomegalii s jaterní dysfunkcí a hypoalbuminémií, a k vyšší rychlosti průtoku krve organizmem ve snaze zajistit adekvátní oxygenaci tkání, zejména mozku. Pokračující hemolýza s prohlubující se anémií tak mohou vyústit až v hydrops s následným kardiálním selháním a smrtí plodu. Po narození, kdy bilirubin tvořící se při hemolýze není transportován do mateřského krevního oběhu a funkční kapacita jater novorozence zatím nestačí k jeho odbourání, hraje navíc roli toxicita nekonjugovaného bilirubinu, a to především vůči centrálnímu nervovému systému s možným rozvojem jádrového ikteru [1,2].
K včasné identifikaci gravidit ohrožených rozvojem HDFN slouží imunohematologický screening, který je součástí standardních kontrol všech těhotných [3,4]. Závažnost a průběh HDFN závisí (mimo jiné okolnosti na straně matky i plodu) na specificitě, množství a aviditě (síle vazby na antigen) aloprotilátky. Rizikové jsou protilátky krevně skupinových systémů Rh, Kell (působí více mechanizmem suprese fetální erytropoézy), Kidd a Duffy, jiné vzácněji. Ke kvantifikaci protilátky slouží určení jejího titru (stupeň ředění plazmy, při kterém ještě protilátka reaguje). Klinicky významný titr je pro anti-D či anti-C ≥ 128 (při použití sloupcové aglutinace LISS/NAT – roztok o nízké iontové síle/nepřímý antiglobulinový test): těhotenství dále vyžaduje zvýšené sledování jinou než imunohematologickou metodou na specializovaném pracovišti, ideálně terciárního typu, v perinatologickém centru [1,3].
POPIS PŘÍPADU
U 36leté těhotné, IIG/IP (druhá gravidita, po jednom porodu), poprvé vyšetřované na našem pracovišti, byla při screeningu nepravidelných antierytrocytárních protilátek v 10. týdnu gravidity identifikována protilátka anti-D ve vysokém titru. Slabě reagovala i další protilátka, jejíž reakce odpovídaly specificitě anti-C (tab. 1, 2). Těhotná měla krevní skupinu A RhD negativní ccee Cw - K.
Tab. 1. Identifi kace protilátek (a vyšetření fenotypu) v 10. týdnu gravidity. 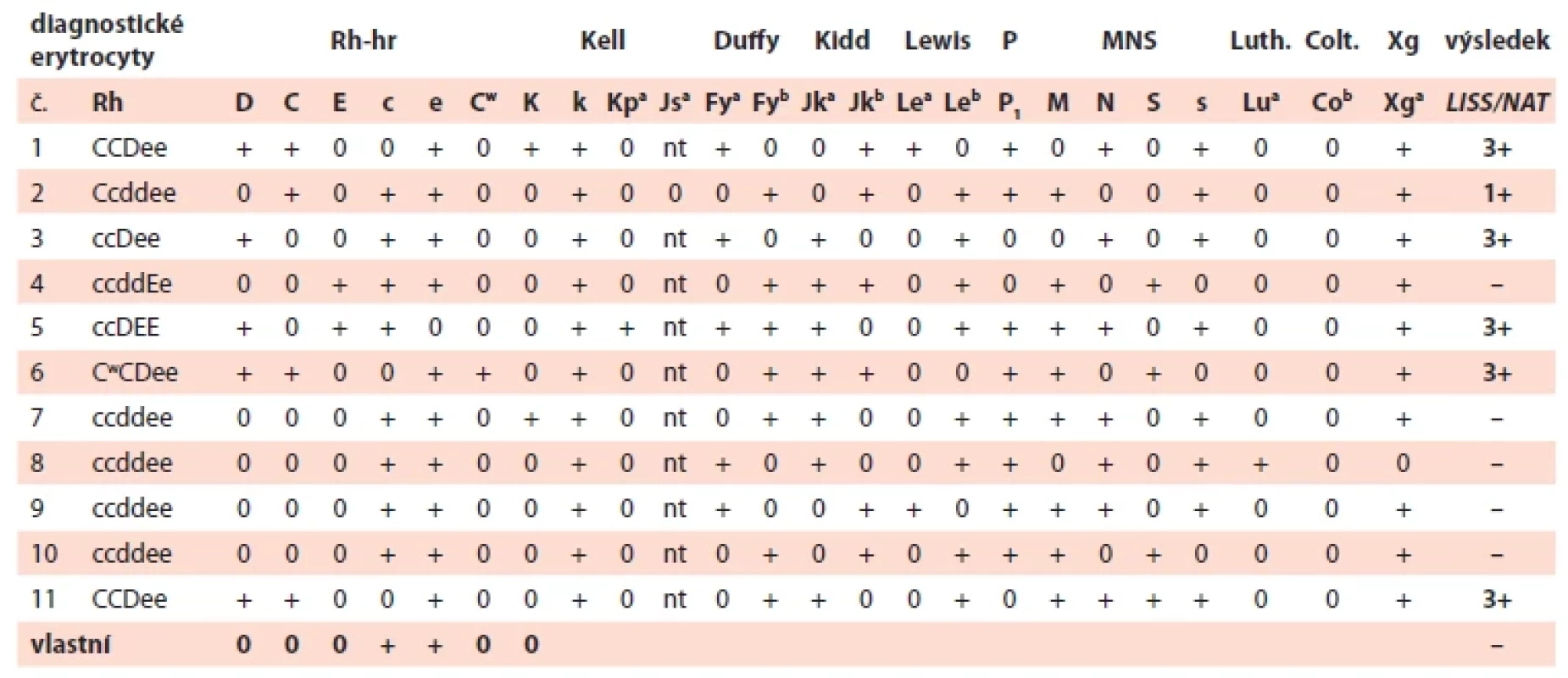
Tab. 2. Stanovení titru protilátky anti-D ve 12. týdnu gravidity (pozn.: doplněno později pro nedostatečné množství vzorku při prvním vyšetření). 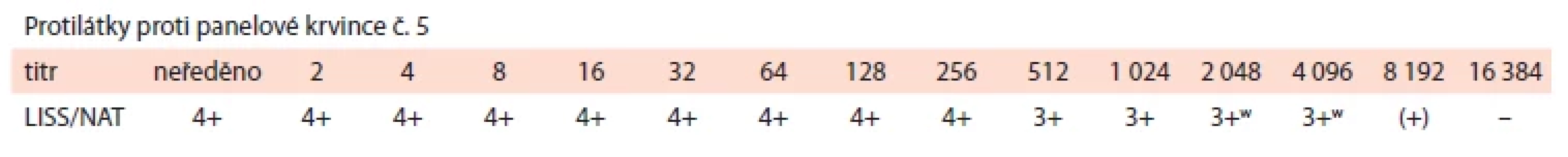
Dle anamnézy těhotná nedostala transfuzi, ale již byla jedenkrát gravidní (před touto první graviditou neproběhl žádný potrat). První těhotenství před šesti lety bylo komplikováno RhD HDFN. Protilátka anti-D tehdy byla zachycena při druhém screeningu v titru 32 (první screening byl negativní). Titr významně vzrostl ke konci gestace, kdy dosáhl hodnoty 512. Ve 38. týdnu bylo rozhodnuto o indukci porodu, který byl nakonec pro poruchu naléhání plodu, nepostup a hrozící hypoxii plodu ukončen akutním císařským řezem. Porozená dívka měla 2 700 g / 45 cm s Apgar skóre 10–10–10 a pH umbilikální arterie 7,26. Významná hyperbilirubinemie, která se u A RhD pozitivní holčičky rozvinula, si vyžádala opakovanou fototerapii (výměnné transfuze nebylo třeba). Postupně ještě progredovala anémie, ve třetím týdnu od narození bylo nutné během krátké rehospitalizace provést transfuzi erytrocytů. Do vymizení anti-D protilátky ve 4. měsíci sledoval dívku ambulantně dětský hematolog, další léčbu stran HDFN ale již nepotřebovala. V případě dalšího těhotenství bylo doporučeno jeho zvýšené sledování.
Vzhledem k imunohematologickému nálezu a anamnéze těhotné bylo žádoucí zjistit, zda je aktuální plod RhD pozitivní, a tedy ohrožen HDFN, či nikoli. Genotypizace RHD z volné fetální DNA izolované z mateřské plazmy, provedená v 16. týdnu gravidity, prokázala RhD pozitivitu plodu.
Při kontrolním imunohematologickém vyšetření v 16. týdnu gravidity reagovaly protilátky anti-D (v titru 8 000) a anti-C (v titru 4) a byla dourčena protilátka anti-G. Antigen G doprovází (zpravidla) antigen D a/nebo C, sérologicky reaguje jako anti-C+D [1,5]. Protilátka anti-G se stanovila pomocí adsorpčních a elučních testů s erytrocyty typu D+C-G+ a D-C+G+, jak znázorňuje obr. 1. Další protilátka se během těhotenství již neobjevila.
Obr. 1. Rozlišení protilátek anti-D,-C,-G / potvrzení přítomnosti anti-G protilátky u těhotné. 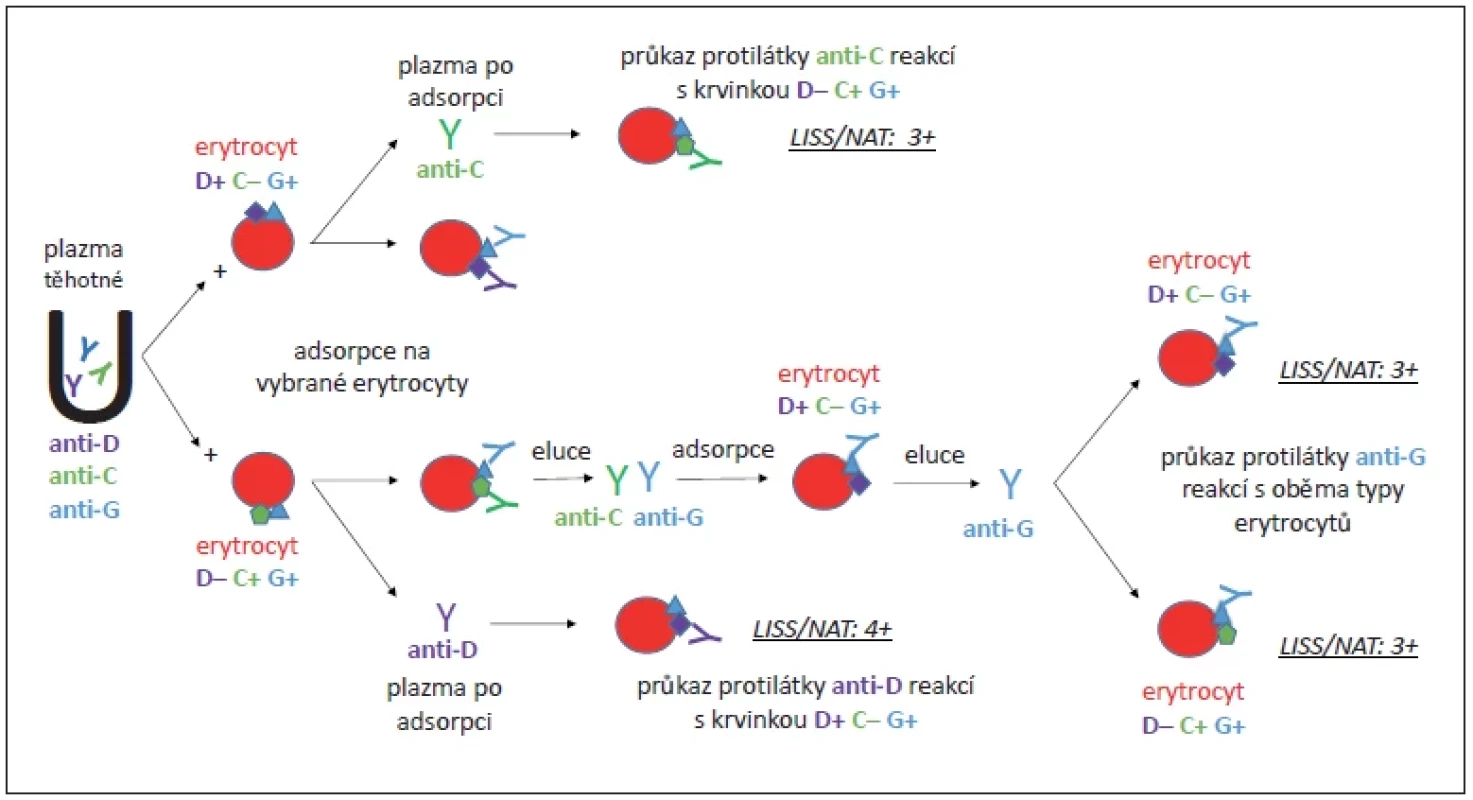
Pro zachycení rozvoje anémie plodu se pravidelně vyšetřovala průtoková rychlost v arteria cerebri media (middle cerebral artery peak systolic velocity – MCA-PSV) pomocí ultrazvukové dopplerometrie. Při kontrole ve 22. týdnu gravidity bylo již zrychlení významné, MCA-PSV přesáhla 1,5násobku mediánu (multiples of the median – MoM), signalizující těžkou anémii plodu. Kordocentéza potvrdila pokles hematokritu pod hodnotu 0,3, indikující intrauterinní transfuzi [1,6]. Ze vzorku fetální krve byla také určena krevní skupina plodu: A RhD pozitivní Ccee Cw - K-. Přímý antiglobulinový test (PAT) byl silně pozitivní.
K substituci erytrocytů do oběhu plodu, intrauterinní transfuzi (IUT), byl vybrán a upraven čerstvý (do pěti dnů od odběru) deleukotizovaný erytrocytový transfuzní přípravek 0 RhD negativní ccee Cw - K-, tj. bez antigenů, proti kterým byly vytvořené mateřské protilátky, kompatibilní s plazmou matky [1,7]. U této transfuzní jednotky ERD (erytrocyty resuspendované deleukotizované) následovala úprava hematokritu ze standardní hodnoty 0,5–0,7 na 0,7–0,85 požadovaná pro EDU (erytrocyty deleukotizované, ozářené, pro IUT) [7]. Cílem je dodat plodu co nejvíce erytrocytů v minimálním možném objemu a nepřetížit jeho krevní oběh. Při výrobě přípravku proto byla po centrifugaci větší část supernatantu odstraněna, erytrocyty se důkladně a šetrně promíchaly, oddělilo se požadované množství pro IUT (s rezervou) a byl zkontrolován konečný hematokrit. Po ozáření g paprsky v dávce 25–50 Gy byl definitivní přípravek vydán k podání [7].
IUT proběhla za aseptických kautel v analgosedaci matky. Pod ultrazvukovou kontrolou byla transabdominálně napíchnuta umbilikální véna a pomalu byly transfundovány erytrocyty v objemu zohledňujícím hmotnost a gestační stáří plodu, jeho výchozí a cílený požadovaný hematokrit (0,4–0,45) a hematokrit EDU. Po ukončení transfuze byl ještě odebrán vzorek ke kontrole dosaženého hematokritu. Při ultrazvukové kontrole plodu následující den sledované parametry vyhovovaly, MCA-PSV byla v normě. K další IUT dospěl plod za 14 dnů, tentokrát se výchozí hematokrit vyšetřil v úvodu vlastního výkonu. Všechny provedené IUT shrnuje tab. 3.
Tab. 3. Podané intrauterinní transfuze. 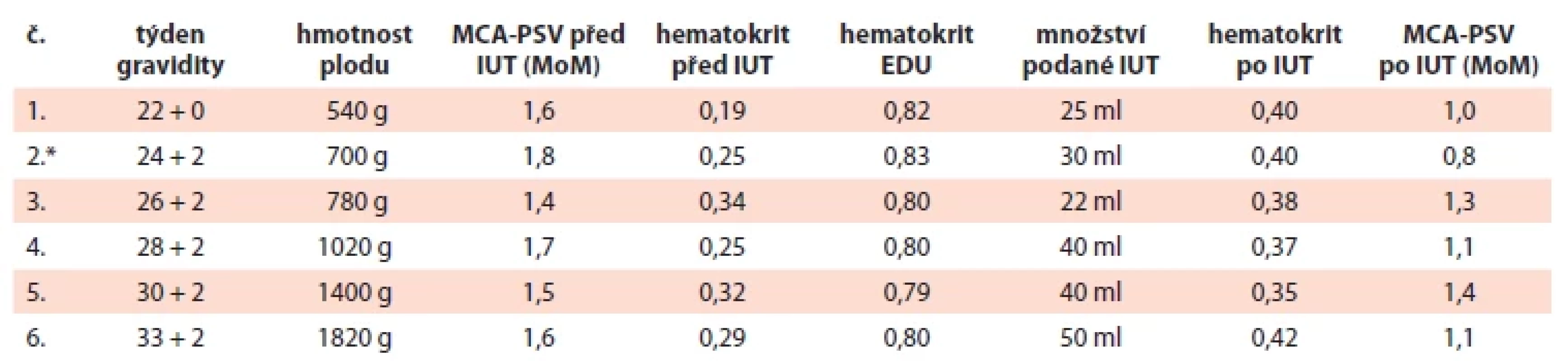
*po 2. IUT zahájena indukce plicní maturace; EDU – erytrocyty deleukotizované, ozářené, pro IUT; IUT – intrauterinní transfuze; MCA-PSV (middle cerebral artery peak systolic velocity) – maximální průtoková rychlost v arteria cerebri media; MoM (multiples of the median) – násobky mediánu Porod proběhl plánovaným císařským řezem ve 36. týdnu gravidity. Dívka s porodní hmotností 2 120 g / 44 cm měla Apgar skóre 9–10–10 a pH umbilikální arterie 7,22. Poporodní hospitalizace trvala 12 dnů, z části v inkubátoru. Ke zvládnutí HDFN bylo v tomto období potřeba intenzivní fototerapie, opakované podávání intravenózních imunoglobulinů, ve věku 96 hod pak pro promptní nárůst bilirubinu a významnou anemizaci i výměnné transfuze. Mateřské protilátky přetrvávaly v plazmě dítěte několik měsíců a další transfuze byly nutné v 11. a 14. týdnu po narození, zajišťovaly se ozářenými 0 RhD negativními ERD. Krevní skupinu kojence nebylo možné sérologicky určit, výsledek vyšetření byl ovlivněný dříve podanými erytrocyty.
DISKUZE A ZÁVĚR
Péče o těhotenství s rizikem HDFN a následně o plod a novorozence s rozvinutou HDFN vyžaduje mezioborovou spolupráci na specializovaném pracovišti. Začíná identifikací potenciálně rizikových těhotenství v 10.–16. týdnu. Pozitivní screening nepravidelných antierytrocytárních protilátek má v ČR cca 5 % těhotných (5 000 ročně), u 1,5 % je identifikována klinicky významná protilátka, přičemž plod nese komplementární antigen v 0,5 % (500 ročně). IUT vyžaduje do 10 % z nich (25–50 ročně) [4]. V případě negativního screeningu či jiného nálezu, který není nutné kontrolovat častěji, je doporučeno vyšetření opakovat cca v 28. týdnu gravidity [1,3].
Zvláštní rizikovou skupinou jsou RhD negativní těhotné bez dosud vytvořené anti-D protilátky, u kterých zavedení RhD profylaxe ve 28. týdnu těhotenství snížilo výskyt aloimunizace o 90 % (cca z 1 % na 0,1 %). Anti-D aloimunizace přesto zůstává nejčastější příčinou vážné HDFN [2]. Antigen D je totiž silně imunogenní, až 75 % RhD negativních jedinců si po kontaktu s RhD pozitivními erytrocyty vytvoří anti-D protilátku (za dva až pět měsíců, výjimečně dříve); na fetálních erytrocytech je D antigen navíc přítomen již velmi brzy (od 6. týdne) [1]. První těhotenství dosud nesenzibilizovaných žen ovšem nebývá rizikové, protože k dostatečně velkému fetomaternálnímu krvácení dochází obvykle až v pokročilém těhotenství / při porodu. Případná AB0 inkompatibilita plodu bývá do určité míry protektivní (protilátky anti-A či anti-B vedou k odstranění fetálních RhD pozitivních erytrocytů proniklých do mateřského oběhu dříve, než způsobí aloimunizaci) [1]. Před zavedením RhD profylaxe si anti-D protilátku po porodu RhD pozitivního dítěte vytvořilo 16 % AB0 kompatibilních RhD negativních matek oproti ≤ 2 % matek inkompatibilních s dítětem v AB0 systému [6].
U těhotné z této kazuistiky byly plody z obou gravidit AB0 kompatibilní. První gravidita byla vstupně bez zvýšeného rizika HDFN, když byl první imunohematologický screening negativní. Aloimunizaci během tohoto těhotenství prokázal druhý screeningový test, při kterém protilátka anti-D reagovala v nízkém titru a podání anti-D imunoglobulinu nebylo indikováno. Titr anti-D se velmi rychle zvýšil v závěru těhotenství a již u prvního RhD inkompatibilního dítěte se rozvinula HDFN s nutností transfuze ve třetím týdnu života (protilátky matky přetrvávaly v oběhu dítěte ještě několik měsíců).
Přestože druhé těhotenství nastalo s víceletým odstupem, těžká fetální hemolýza se manifestovala brzy a vyžádala si celkem šest IUT. Tento invazivní výkon nese 1–3% riziko vážných komplikací. Alternativy v podobě výměnné plazmaferézy či podání intravenózních imunoglobulinů těhotné jsou zvažovány v časných fázích těhotenství, kdy IUT technicky ještě nelze provést. V pokročilejší fázi těhotenství mívá před IUT přednost předčasný porod s postnatální léčbou (za předpokladu dostatečné zralosti plodu) [1,4,6].
Kontrolní imunohematologická vyšetření mají význam i poté, co je plod kontrolován pomocí MCA-PSV, a to z důvodu možného vzniku nových protilátek, které ovlivní výběr erytrocytů k transfuzi (ať už plodu, nebo matce) a mohou být důležité pro další těhotenství. Opakovat titrování protilátky po dosažení kritické hodnoty ovšem není třeba [1,3].
Protilátka anti-G je vzhledem k možným hemolytickým komplikacím považovaná za klinicky významnou. Je třeba na ni myslet při zachycení reakce odpovídající kombinaci protilátek anti-D+C [1,5]. Upřesnění specificity těchto protilátek má velký význam pro rozhodnutí, zda provést RhD profylaxi u RhD negativní dosud nesenzibilizované těhotné tehdy, když není zřejmé, zda se za nálezem anti-D+C neskrývá anti-C+G nebo samostatná anti-G. V těchto případech je aplikace imunoglobulinu indikována (pokud není známo, že je plod RhD negativní) [1].
U této těhotné nebyly vzhledem k její anamnéze pochybnosti o přítomnosti anti-D protilátky. Určování anti-G probíhalo v rámci identifikace a odlišení další nové protilátky, která byla v druhé graviditě detekovaná při vstupním imunohematologickém vyšetření diagnostickým panelem erytrocytů jako anti-C a nebylo zřejmé, zda se nejedná o kombinaci protilátek včetně anti-G. V této době také nebyl známý výsledek stanovení fetálního D antigenu: pokud by byl plod RhD negativní, přítomná anti-D protilátka by neměla klinické uplatnění a těhotenství by nebylo komplikované. Imunohematologické vyšetření těhotné by se zaměřilo na novou protilátku.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
HK – příprava a napsání rukopisu
JT – kontrola a revize rukopisu
RG – ošetřující lékař těhotné, kontrola a revize rukopisu
ČESTNÉ PROHLÁŠENÍ AUTORŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne: 26. 4. 2022
Přijato po recenzi dne: 28. 7. 2022
MUDr. Helena Kostrouchová
Transfuzní a tkáňové oddělení
FN Brno
Jihlavská 20
625 00 Brno
e-mail: kostrouchova.helena@fnbrno.cz
Zdroje
1. Masopust J, Písačka M. Praktická imunohematologie Erytrocyty. 1. vyd. Praha, Mladá fronta a. s., 2016.
2. Solheim BG, Grönn M, Hansen TWR. Hemolytic disease of the fetus and newborn. In: Simon TL, McCullough J, Snyder EL, Solheim BG, Strauss R. G. Rossi‘s Principles of Transfusion Medicine. 5th edition UK, John Wiley & Sons, Ltd., 2016; 528–534.
3. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2010_06 ze dne 1. 3. 2010 verze 3 (2010_06). Imunohematologická vyšetření v těhotenství a po porodu. Dostupné na: https: //www.transfuznispolecnost.cz/doporuceni-stl/doporuceni-stl-c-6-imunohematologicka-vysetreni-v-tehotenstvi-a-po-porodu-12 231
4. Ľubušký M, Holusková I, Procházka M, Hálek J, Klásková E. České gynekologické a porodnické společnosti ČLS JEP ze dne 2. 12. 2016. Management těhotenství s rizikem rozvoje hemolytické nemoci plodu a novorozence. Doporučený postup. Ceska Gynekol 2017; 82 (1): 82–84.
5. International Society of Blood Transfusion; Immunohematology Case Studies 2020–4. Dostupné na: https: //www.isbtweb.org/isbt-working-parties/immunohaematology/resources/immunohaematology-case-studies.html
6. Delaney M, Matthews DC. Hemolytic dis - ease of the fetus and newborn: managing the mother, fetus, and newborn. Hematology Am Soc Hematol Educ Program 2015. 2015; (1): 146–151.
7. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2015_12 ze dne 01. 09. 2015 verze 1. Doporučené postupy pro podání transfuzních přípravků. Dostupné na: https: //www.transfuznispolecnost.cz/doporuceni-stl/doporuceni-stl-c-12-doporucene-postupy-pro-podani-transfuznich-pripravku-12 225
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Efektivita kombinace monoklonálních protilátek tixagevimab-cilgavimab v prevenci a léčbě pacientů s vysokým rizikem rozvoje COVID-19
- Jak anti-SARS-CoV-2 IgG a IgM predikují titr virus neutralizačních protilátek u dárců rekonvalescentní plazmy proti onemocnění COVID-19?
- Dosavadní zkušenosti s léčbou ropeginterferonem alfa-2b u pacientů s Ph negativními myeloproliferacemi na Interní hematologické a onkologické klinice LF MU a FN Brno
- Hemolytická nemoc plodu a novorozence
- Beta-thalassemia minor a maior v těhotenství
- 30 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Prof. MUDr. Karel Indrák, DrSc. se dožívá 75 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hemolytická nemoc plodu a novorozence
- Beta-thalassemia minor a maior v těhotenství
- Dosavadní zkušenosti s léčbou ropeginterferonem alfa-2b u pacientů s Ph negativními myeloproliferacemi na Interní hematologické a onkologické klinice LF MU a FN Brno
- Jak anti-SARS-CoV-2 IgG a IgM predikují titr virus neutralizačních protilátek u dárců rekonvalescentní plazmy proti onemocnění COVID-19?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



