-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
První zkušenosti České MDS skupiny s terapií 5-azacytidinem u nemocných s myelodysplastickým syndromem s vyšším rizikem (IPSS střední 2 a vysoké riziko), akutní myeloidní leukemií do 30 % myeloblastů a chronickou myelomonocytární leukemií II
Initial experience of Czech MDS Group with 5-azacytidine in patients with high risk myelodysplastic syndromes (IPSS intermediate II and high), acute myeloid leukaemia with less than 30% myeloblasts and chronic myelomonocytic leukaemia II
Introduction.
Therapy of high risk myelodysplastic syndromes (MDS) remains unsatisfactory. The only treatment that alters the natural history of the disease is allogeneic stem-cell transplantation, which can be offered to a limited number of young patients. Modern therapy predominantly focuses on prolonging survival, postponing potential acute myeloid leukaemia (AML) transformation and improving quality of life (QoL). New epigenetic therapy, especially methyltransferase inhibitors, has achieved these goals. Here, we present the experience of the Czech MDS Cooperative Group with 5-azaci-tidine treatment of patients with intermediate II and high risk MDS patients (IPSS), chronic myelomonocytic leukaemia II (CMML II) and AML with less than 30% myeloblasts in the bone marrow.Patients and results.
Between October 2008 and June 2012, we used azacitidine treatment in 111 patients (66 M, 45 F), median age 68 years (range 48–85) with the diagnosis: 44 RAEB II, 13 RAEB I, 9 CMML II, 6 RCMD, 28 AML < 30% MB, 7 AML > 30% MB and 4 MDS/MPS. Median follow-up was 8.8 month (range 1–32), median number of cycles of azacitidine was 5 (range 1–28). The most common adverse events included haematological toxicity with neutropenia grade (Gr) 3/4 in 54.9% and thrombocytopenia Gr 3/4 in 70.3%. Non-haematological side effects, mostly only Gr1/2, were gastrointestinal in 21.6% and local reactions and fatigue in 31.5%.Response.
The overall response rate (ORR) was 42.4% (CR 19.6%, CRi 6.5%, PR 16.3%), stable disease (SD) was achieved in 19.6% and haematological improvement (HI) in 57.4%. After one year, based on Kaplan-Meier estimates, 67.8% of patients were alive and the median overall survival (OS) was 16.4 months. We also analysed several clinical parameters collected at the start of azacitidine treatment as prognostic factors for OS (age, sex, ECOG performance status (PS), transfusion dependency, peripheral blast percentage, neutrophil count, platelet count, bone marrow blast percentage, fibrosis, percenta-ge of erythroid precursors in bone marrow, cytogenetic data, WHO classification, IPSS, primary and secondary aetiology of MDS).Conclusion.
Our results correlate very well with other published data (AZA 001, CALGB 9221). OS data are comparable with other “real life” studies. It is also important to take into consideration that our group also included very high risk patients (relapsed, refractory to previous treatment, post-transplant patients and AML with more than 30% myeloblasts). Nevertheless, our results are very promising and support the positive effect of azacitidine compared to standard therapy in high risk MDS patients. The analysis performed so far shows that from the aspect of OS, best response correlates with: cytogenetic aberration, peripheral blast count, neutrophil count and ECOG PS.Key words:
azacytidine, myelodysplastic syndromes, therapy, overall survival, prognostic factors
Autoři: A. Jonášová 1; J. Čermák 2; L. Červinek 3; Lucie Nováková 2; P. Bělohlávková 4; J. Vondráková 5; O. Černá 6; M. Sýkora 5; N. Seifertová 5; L. Walterová 7; J. Libiger 8; I. Hochová 9; J. Ullrychová 8; P. Rohoň 10; J. Obernauerová 11; M. Schutzova 12; V. Vozobulová 12; H. Poláčková 1; K. Kačmářová 13; J. Mužík 14
Působiště autorů: Všeobecná fakultní nemocnice, 1. LF UK Praha 1; Ústav hematologie a krevní transfuze, Praha 2; Fakultní nemocnice Brno, Masarykova univerzita, Brno 3; Fakultní nemocnice Hradec Králové 4; Nemocnice České Budějovice 5; Fakultní nemocnice Královské Vinohrady, Praha 6; Nemocnice Liberec 7; Nemocnice Ústí nad Labem, Teplice 8; Fakultní nemocnice Motol, Praha 9; Fakultní nemocnice Olomouc 10; Nemocnice Mladá Boleslav 11; Fakultní nemocnice Plzeň 12; Česká MDS skupina 13; Institut biostatistiky a analýz, Masarykova univerzita, Brno 14
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 3, p. 125-133.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod.
Terapie vyšších rizikových skupin myelodysplastického syndromu (MDS) je stále problematická. Jedinou kauzální terapií je alogenní transplantace, ta však s ohledem na průměrný věk nemocných s MDS je dostupná malému procentu nemocných. Moderní léčba je hlavně orientována na prodloužení přežívání, oddálení transformace do akutní myeloidní leukemie (AML) a zlepšení kvality života. Tyto cíle splňuje epigenetická terapie, zvláště pak inhibitory metyltrasferázy. Naše práce je věnována zkušenostem České MDS skupiny s terapií 5-azacytidinem (dále jen azacitidin) u nemocných s vyšším rizikem MDS (IPSS střední II a vysoké riziko), s AML do 30 % myeloblastů (MB) ve dřeni a s chronickou myelomonocytární leukemií II (CMML).Pacienti a výsledky.
Od října 2008 do června 2012 bylo léčeno 111 nemocných (66 mužů, 45 žen), medián věku byl 68 let (48–85 let). Podle WHO klasifikace bylo léčeno 44 RAEB II, 13 RAEB I, 9 CMML II, 6 RCMD, 28 AML < 30 % MB, 7 AML > 30 % MB a 4 MDS/MPS. Medián délky sledování od zahájení azacitidinu byl 8,8 měsíců (rozsah 1–32), medián podaných cyklů 5 (rozsah 1–28). Z nežádoucích účinků převažovala hematologická toxicita (neutropenie stupně (Gr) 3/4 – 54,9 % a trombocytopenie Gr 3/4 – 70,3 %) nehematologická toxicita (reakce v místě vpichu, nauzea, zvracení a zácpa) byla většinou Gr 1/2 se vyskytla celkem u 53,1 %.Odpovědi.
Hodnotitelných (tj. nemocných s více než 2 cykly) bylo 92 pacientů, celková odpověď (ORR overall response rate) byla 42,4 % (CR 19,6 %, CRi – dřeňová odpověď bez normalizace krevního obrazu – 6,5 %, PR 16,3 %) stabilní choroby bylo dosaženo u 18 pacientů (19,6 %), hematologické zlepšení (HI; hematology improvement) bylo dosaženo u 67,4 %. V roce přežívá v našem souboru 67,8 % pacientů a medián celkové délky života (OS; overall survival) je 16,4 měsíců. V naší práci jsme se též snažili analyzovat prognostické faktory OS (dostupné klinické parametry při zahájení terapie: věk, pohlaví, PS (performance status), základní WHO podskupiny, IPSS kategorie, počty neutrofilů, destiček, blastů v periferním krevním obraze, transfuzní závislost, ze dřeně: procento blastů, procento červené řady, přítomnost fibrózy, cytogenetické aberace dále primární versus sekundární MDS.Závěr.
Naše výsledky dosažení odpovědí dobře korelují s daty publikovaných studií (AZA 001, CALGB 9221). Výsledky OS jsou rovněž srovnatelné s výsledky jiných zahraničních studií. Nutné je též brát v úvahu, že náš soubor byl na rozdíl od standardních studií vysoce rizikový (předléčení, relabovaní, refrakterní nemocní a zařazení nemocných s AML nad 30 % MB). I přes to jsou výsledky našeho souboru nemocných uspokojivé a procento dosažených odpovědí jasně ukazuje pozitivní efekt a přínos terapie azacytidinem ve srovnání s dosud zavedenou terapií u rizikových skupin MDS. Z hlediska zatím předběžné analýzy prognostických faktorů, které pomáhají určení nejlepších kandidátů terapie, jsou statisticky významné: cytogenetické aberace, ECOG (Eastern Cooperative Oncology Group) PS, hodnoty neutrofilů a počty blastů v periferní krvi.Klíčová slova:
azacitidin, myelodysplastický syndrom, terapie, celkové přežívání, prognostické faktoryÚVOD
Myelodysplastický syndrom (MDS) představuje heterogenní skupinu klonálních chorob hemopoetické kmenové buňky charakterizovaných inefektivní hemopoézou, periferní cytopenií, morfologickou dysplazií a nebezpečím transformace do akutní myeloidní leukemie (AML). MDS je rozděleno do 5 či 8 podskupin (podle FAB či WHO klasifikace), které se liší prognózou, celkovým přežíváním a četností transformací do AML (1, 2). Co se týče rizika progrese a přežívání je onemocnění stratifikováno podle IPSS (international prognostic scoring system) či nověji R-IPSS (revised IPSS) do 4 či 5 rizikových skupin (3, 4).
Nemocní se středním a vyšším IPSS mají významně kratší přežívání, jež se pohybuje od 12 měsíců pro střední II riziko k pouhým 4 měsícům pro nemocné ve skupině s vysokým rizikem. Taktéž doba do transformace do AML je kratší, a to u středního rizika 11 měsíců, u vysokého rizika 2–3 měsíce (3, 4, 5). Obecně pro potřeby terapie dělíme nemocné na nízce a vysoce rizikové.
Terapie nemocných s MDS, zvláště vyšších rizikových skupin, je stále i přes intenzivní výzkum problematická. MDS je – na rozdíl od jiných hematologických malignit – rezistentní vůči standardní chemoterapii. U nemocných v mladších věkových skupinách je důležitým cílem dosažení kompletní remise, což se současnými terapeutickými postupy je možné pouze s transplantací kostní dřeně. Transplantace je však vzhledem k mediánu věku MDS nemocných kolem 65 let použitelná pouze pro velmi limitovaný počet pacientů.
Moderní terapie by měla též plnit léčebné cíle u starší MDS populace, jako je prodloužení přežívání, oddálení transformace do AML a zlepšení kvality života (dále jen QoL – quality of life). Ke všem těmto terapeutickým cílům se přibližuje epigenetická terapie a zvláště pak inhibitory metyltransferázy. U nás je povolen azacitidin. Je indikován v terapii nemocných, kteří nejsou kandidáti alogenní transplantace se středním II a vyšším IPSS rizikem, dále u AML (dříve RAEB-T podle FAB klasifikace) do 30 % myeloblastů a CMML II (podle WHO). Dnes již mnohé klinické studie ukazují zřejmý terapeutický efekt tohoto preparátu u všech skupin MDS nemocných (6, 7, 8). Ve většině studií je patrné především vysoké procento hematologických odpovědí (HI) činící od 50 do 67 %. V největší studii AZA-001 bylo randomizováno 358 nemocných se středním II a vysokým IPSS rizikem do skupin: azacitidin oproti běžné terapii (podpůrná léčba, malé dávky Ara-C (cytosinarabinosid) či standardní chemoterapie jako u AML) (7). Studie demonstrovala efekt azacitidinu, a to nezávisle na věku, pohlaví a stupni rizika podle IPSS. Stěžejním výsledkem studie bylo dosažení významně delšího přežití v rameni s azacitidinem, oproti dosud používané klasické terapii s mediánem celkového přežití 24,5 měsíců proti 15 měsícům. Prodloužena byla také doba do AML transformace a nezanedbatelná byla i čísla dosažených odpovědí (CR 17 %, PR 12 %, HI 40 %). Přežívání ve 2 letech léčených azacitidinem bylo 55 % v rameni s azacitidinem, oproti pouhým 26 % nemocných léčených standardní terapií. Naše práce je věnována zkušenostem České MDS skupiny s azacitidinem u nemocných z vyšších rizikových skupin MDS (IPSS střední II a vysoké riziko) a AML.
PACIENTI A METODIKY
Od října 2008 do června 2012 bylo léčeno 111 nemocných (66 mužů, 45 žen). Nemocní byli léčeni azacitidinem (VidazaTM; Celgene, Summit, NJ, USA) v hematologických centrech České republiky (podle počtu sledovaných nemocných: VFN Praha, ÚHKT Praha, FN Brno, FN Plzeň, FN Hradec Králové, FN Olomouc). Nemocní byli léčeni v souladu s indikacemi SPC (summary of product characteristics – souhrn údajů o přípravku). Jde o retrospektivní analýzu dat. Patnáct prvních nemocných bylo léčeno v rámci CUP (compassionate use program) po podepsání informovaného souhlasu (v souladu s Helsinskou deklarací). U ostatních nemocných byl lék hrazen z prostředků veřejného zdravotního pojištění.
Charakteristiky nemocných jsou shrnuty v tabulce 1. Medián věku byl 68 let (44–85 let). ECOG PS (Eastern Cooperative Oncology Group performance status) se pohyboval mezi 0–2. Medián doby od stanovení diagnózy do zahájení terapie byl 4 měsíce (0–98 měsíců). Podle WHO klasifikace bylo léčeno 44 RAEB II, 13 RAEB-I, 6 RCMD, 9 CMML II, 28 AML < 30 % MB, 7 AML > 30 % MB a 4 MDS/MPS. U 13 % pacientů šlo o sekundární MDS.
Tab. 1. Základní charakteristiky souboru pacientů. 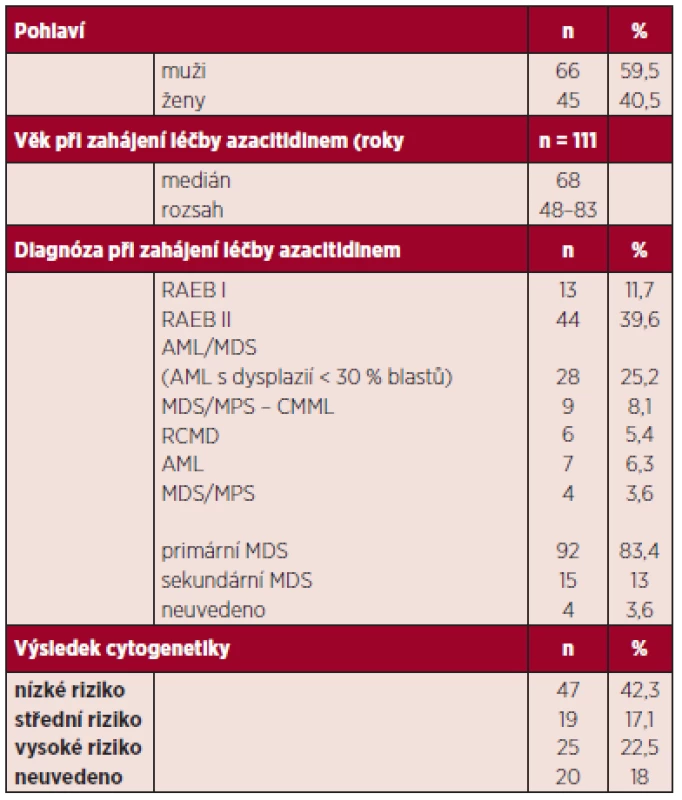
AML – akutní myeloidní leukemie MDS: myelodysplastický syndrom RAEB: refrakterní anémie s excesem blastů RCMD: refrakterní anémie s multilineární dysplazií Výsledky cytogenetického vyšetření byly k dispozici u 91 pacientů, 47 (51,6 %) mělo prognosticky příznivé nálezy, 19 (20,8 %) střední a 25 (27,3 %) špatné (v souladu s IPSS).
U 79 nemocných byl azacitidin podán jako léčba první linie, 4 nemocní byli v relapsu choroby po transplantaci a 18 nemocných bylo již předléčeno intenzivní či nízkodávkovanou chemoterapií (klasická léčba cytosinarabinosid + daunorubicin „3+7“, malé dávky cytosinarabinosidu), u 10 nebyla předchozí terapie uvedena. Medián délky sledování od zahájení azacitidinu byl 8,8 měsíců (rozsah 1–32), medián podaných cyklů 5 (rozsah 1–28) data jsou shrnuta v tabulce 2. Dvanáct nemocných bylo léčeno více než 14 cykly. Azacitidin byl podáván v klasické úvodní dávce 75 mg/m2/den u všech nemocných v subkutánní aplikaci. Stran použitých režimů byly sedmidenní cykly použity u 97,4 % nemocných. V průběhu další terapie se dávky a intervaly cyklů přizpůsobovaly nežádoucím účinkům, a to zvláště výskytu neutropenie a trombocytopenie a byly individuálně měněny.
Tab. 2. Další charakteristiky souboru. 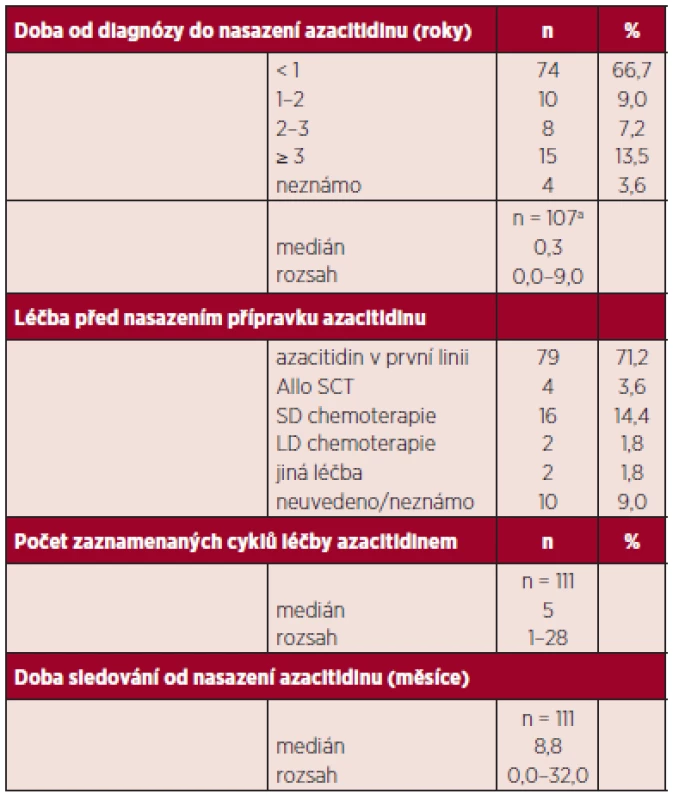
ahodnota není známa u všech pacientů SCT: „stem cell transplant“ transplantace krvetvorných buněk SD: „standard dose“ standardní chemoterapie LD: „low dose“ nízkodávkovaná chemoterapie Kontrolní vyšetření dření se prováděla vždy po každém dalším 3. cyklu a dále individuálně podle podezření na progresi onemocnění. U nemocných, kde byly známky rychlé progrese choroby, byla dřeň provedena před 3. cyklem. Podpůrná terapie se řídila u nemocných pokyny pro terapii nemocných s MDS a principy této terapie v rámci zvyklostí jednotlivých pracovišť.
Odpovědi na terapii byly standardně hodnoceny podle IWG 2006 kritérií (International Working Group criteria, Cheson et al., Blood, 2006).
Hodnotili jsme též určité prognostické klinické parametry před zahájením azacitidinu ve snaze určit optimální kandidáty terapie (Pozn.: Tato analýza není ještě zvláště stran detailního statistického zpracování definitivní). Hodnoceny byly dostupné klinické parametry při zahájení terapie: věk, pohlaví, PS (performance status), základní WHO podskupiny, IPSS kategorie, počty neutrofilů, destiček, blastů v periferním krevním obraze, transfuzní závislost; ze dřeně: procento blastů, procento červené řady, přítomnost fibrózy, cytogenetické aberace a dále primární vs. sekundární MDS a závislost vztahu doby trvání onemocnění před zahájením azacitidinu. Dále byla provedena subanalýza podskupiny nemocných, kteří měli stejná vstupní kritéria a nevíce se blížili době sledování jako u registrační studie AZA-001 (7). Šlo o vzorek 43 pacientů, 30 mužů, 13 žen s mediánem věku 69, PS < 2, nemocní s MDS vyšším rizikem (6 RAEB I, 23 RAEB II, 3 CMML II 7 %) a 11 AML do 30 % MB. V této skupině nebyli nemocní předléčeni, s AML > 30 % MB a po transplantaci. Medián sledování od zahájení azacitidinu byl 14,2 měsíce (2,3 až 24,6) a medián podaných cyklů byl 10 (3–27). Statistické zpracování výsledků bylo prováděno ve spolupráci s institutem biostatistiky a analýz z Masarykovy univerzity Brno (IBA). Popis sledovaných parametrů byl proveden pomocí frekvenčních tabulek a popisných statistik (medián, minimum, maximum). Vztah kategoriálních proměnných byl hodnocen chi-kvadrát testem. K zobrazení přežití pacientů byly použity Kaplanovy-Meierovy křivky přežití, pro srovnání skupin v analýze přežití byl použit log-rank test. Pro stanovení statistické významnosti byla použita hladina α = 0,05.
VÝSLEDKY
Hodnotitelných, tj. nemocných, kteří absolvovali více než 2 cykly, bylo 92. Nemocní byli hodnoceni podle IWG kritérií 2006. Celkem odpovědělo 42,4 %. Nejlepší dosažené odpovědi byly: CR 19,2 %, n = 18, CRi 6,5 %, n = 6, PR 16,3 %, n = 15 (CR-kompletní remise, CRi-inkompletní remise, tj. pouze dřeňová CR nikoli normalizace periferního krevního obrazu, PR-parciální remise). Stabilizace onemocnění (SD; stable disease) bylo dosaženo u 19,6 % n = 18. Progrese onemocnění od zahájení terapie byla zaznamenána u 14,1 %, n = 13. Hematologických zlepšení (HI; hematology improvement) bylo dosaženo celkem u 57,4 %. Jednotlivé typy odpovědí jsou shrnuty v tabulce 3, trvání odpovědi uvádíme v tabulce 4. Zajímavé je, jak bylo publikováno již v jiných pracích, že trvání odpovědi není zcela závislé na její kvalitě. Tak i u našich nemocných, kteří dosáhli stabilizace onemocnění, pozorujeme dobrý efekt na celkové přežívání s mediánem trvání odpovědi 9 měsíců (rozsah 1,2–18,6). Naše sledování většího počtu nemocných jsou zatím relativně krátkodobá, proto i medián přežívání je obtížné správně statisticky zhodnotit, nicméně za použití Kaplanova-Meierova statistického hodnocení je odhadnutý medián celkového přežívání u nemocných léčených více než 2 cykly 16,4 měsíců (graf 1). V rámci porovnání s výsledky studie AZA-001, kde medián sledování nemocných byl 21,2 měsíce a Kaplanův-Meierův medián OS 24,5 měsíce, jsme selektovali 43 nemocných (viz výše) co nejblíže vstupním kritériím AZA-AML a s co nejdelším sledováním. Medián sledování od zahájení azacitidinu byl i tak u našeho vzorku mnohem kratší, a to 14,2 oproti 21,2 z AZA-001. Nicméně, byť stále statisticky obtížně hodnotitelné, pro krátké sledování, jsme u této podskupiny zaznamenali medián OS 17,8 měsíců (graf 2). Finálně jsme analyzovali též menší skupinu 12 nemocných, kteří byli léčeni více než 14 cykly. Jejich medián přežívání nebyl dosažen (graf 3). Statisticky lépe porovnatelnější jsou data přežívání v jednom roce. V roce v České republice přežívá 67,8 %, což velice dobře koreluje s údajem 68,2 % ze studie AZA-001.
Tab. 3. Pacienti léčení azacitidinem alespoň dvěma cykly léčby – léčebné odpovědi (n = 92). 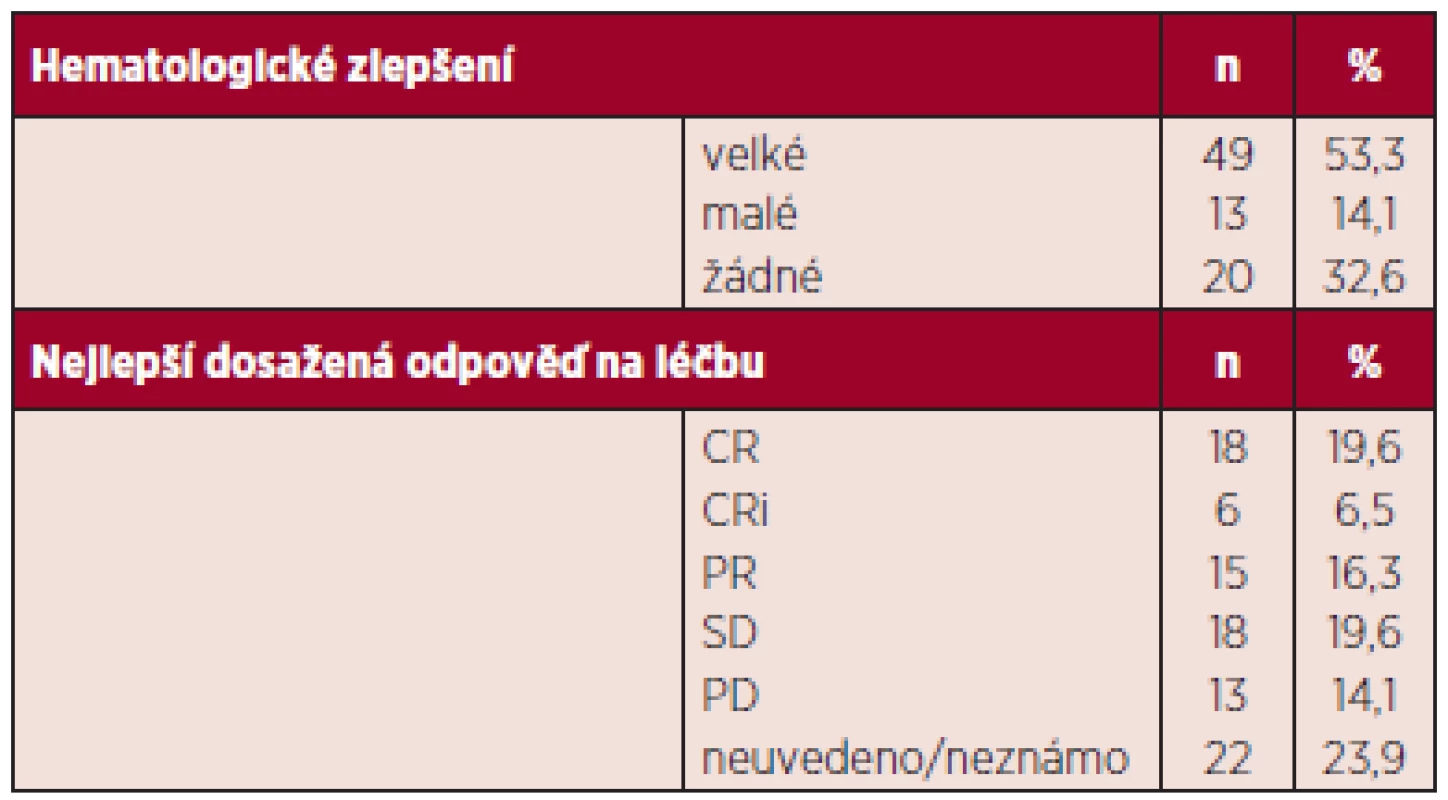
Pozn.: Neuvedeno/neznámo znamená, že nemocní ještě neměli provedeno první kontrolní vyšetření kostní dřeně, které se provádí většinou po 3. či 4. cyklu a nelze zhodnotit CR, PR. CR: kompletní remise, CRi: kompletní remise ve dřeni nikoli normalizace krevního obrazu, PR: parciální remise, SD: stabilní choroba, PD: progresivní choroba Tab. 4. Pacienti léčení azacitidinem alespoň dvěma cykly léčby – doba do dosažení léčebné odpovědi a její trvání. 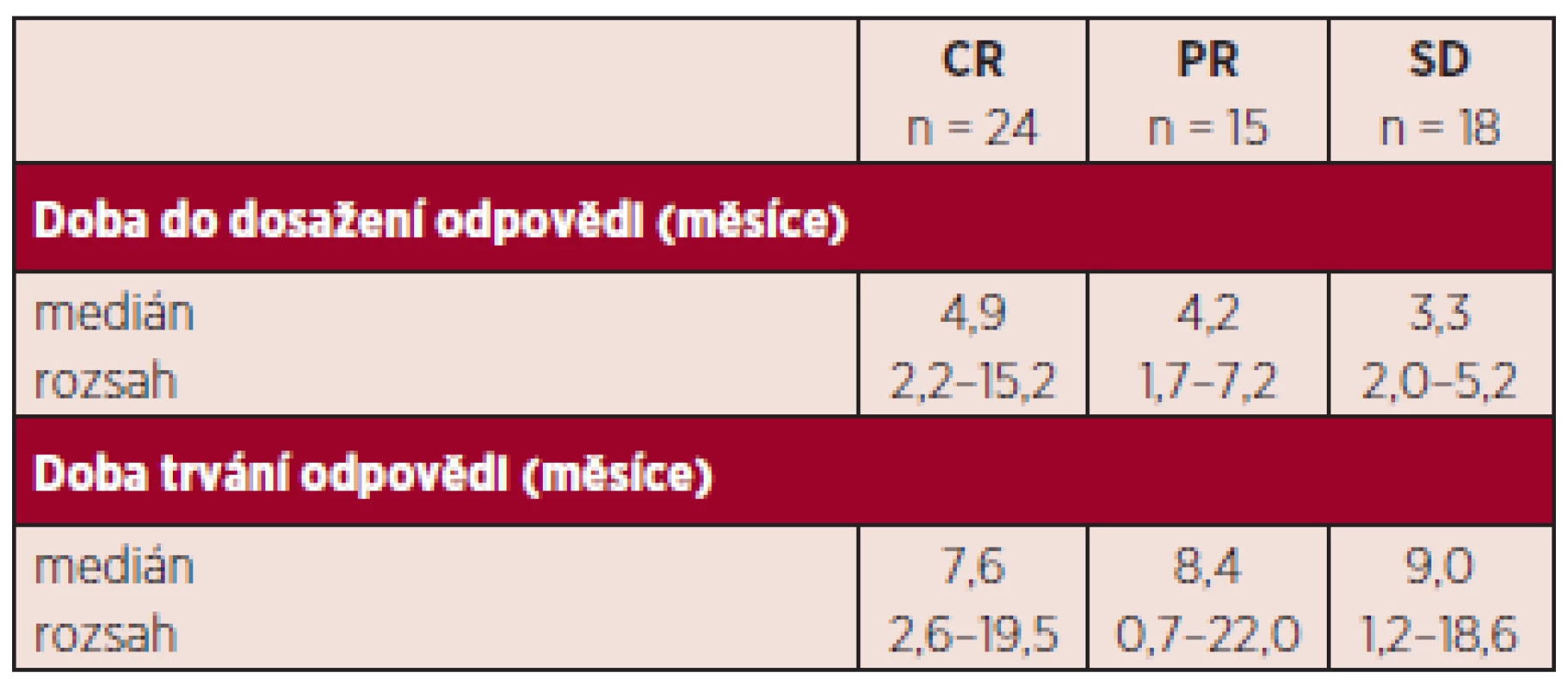
Tab. 5. Nejčastější nežádoucí účinky při terapii azacitidinem (n = 102). 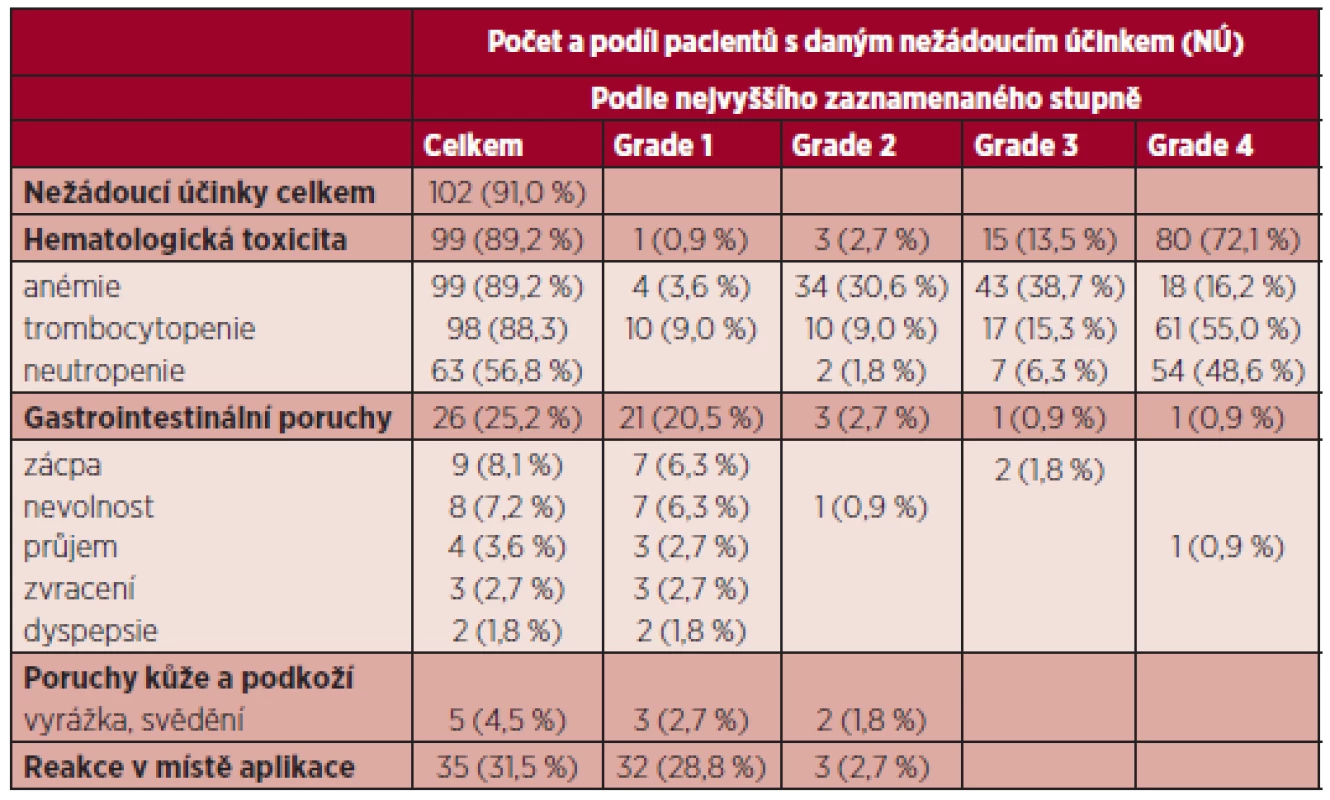
Graf 1. Pacienti léčení azacitidinem alespoň 2 cykly léčby – celkové přežití od zahájení léčby. n = 92 
Graf 2. Pacienti léčení přípravkem Vidaza<sup>®</sup> v reálné klinické praxi v České republice – celkové přežití od zahájení léčby. n = 43 
Graf 3. Pacienti léčení azacitidinem více než 14 cykly léčby v reálné klinické praxi v České republice – celkové přežití od zahájení léčby. n = 12 
Nežádoucí účinky se vyskytly u 91 % pacientů. Z nežádoucích účinků převažovala hematologická toxicita. Hematologické nežádoucí účinky byly zaznamenány celkem u 89,2 % nemocných, z toho nejčastěji se vyskytovala trombocytopenie, a to u 88,3 %. Trombocytopenie stupně (Gr) toxicity 3 a 4 byla dokumentována alespoň jednou v průběhu terapie u 70,3 %. Neutropenie byla přítomna u 56,8 %, s neutropenií Gr 3 a 4 v 54,9 % (tabulka 5). U 30 % nemocných byla hematologická toxicita důvodem redukce dávky či oddálení dalšího cyklu. Jako u jiných studií se nežádoucí hematologické účinky vyskytovaly především v průběhu prvních 4 cyklů. Nehematologické vedlejší účinky byly ve velké většině jen mírné Gr 1 a 2. Šlo především o gastrointestinální obtíže (nauzea, zácpa, zvracení průjem), které byly zaznamenány u 21,6 % nemocných a lokální reakce v místě vpichu u 31,5 %. Až na 2 případy těžší zácpy většinou tyto nežádoucí účinky nevyžadovaly změnu dávky či oddálení cyklu. Hospitalizace pro závažnější nežádoucí účinky, zvláště komplikace cytopenií, byly nutné u 26,4 % pacientů. Devíti nemocným (8,1 %) byl v průběhu závažnější infekce aplikován G-CSF, 20 pacientů dostávalo současně erytropoetin. Terapie byla ukončena dosud u 59 nemocných (53,2 %), progredovalo 43 nemocných (38,7 %). Pro nežádoucí vedlejší účinky byla terapie ukončena pouze u 2 nemocných (1,8 %).
Z hlediska hodnocení prognostických faktorů je nutno brát výsledky zatím jako předběžné, neboť ještě plánujeme podrobnější statistickou analýzu. Nicméně jako významné pro prognózu se jeví procento blastů v periferní krvi: nemocní s počtem > 5 % mají medián OS 5,5 měsíců, < 5 % 16,3 měsíců. Dále je to vstupní počet neu-trofilů, kde mediánem OS u hodnot < 0,5 x 109/l je 10,2 měsíců, oproti 15 měsícům u hodnot vyšších. Statisticky významné jsou cytogenetické aberace s mediánem OS 8,2 měsíců u nemocných s prognosticky špatnou cytogenetikou (komplexní změny, aberace chromozomu 3, monozomie 7), oproti střední a dobré cytogenetice, kde je OS 16, respektive 21 měsíců. Dalším významným faktorem je PS (ECOG) s p = 0,001 v rozdílu mezi PS > či < 2. (Poznámka autorů: Podrobné zpracování prognostických faktorů je předmětem právě probíhající analýzy.)
DISKUSE
Epigenetická modulace zasahuje přímo do funkce genů, ovlivňuje genovou transkripci a tím i expresi genů. DNA metylace je zprostředkována enzymem metyltransferázou. Pakliže dochází k hypermetylaci cytosinových reziduí v oblasti genového promotoru, dochází k poruše regulace transkripce genů a tím ke změně jejich exprese – tzv. gene silencing. Inhibována může být exprese genů nezbytných pro normální regulaci proliferace, diferenciace a buněčné apoptózy (9, 10). U MDS jsou popsány dnes již mnohé hypermetylované geny, které mohou hrát roli i v samotné patogenezi onemocnění. Vedle toho se objevují studie demonstrující skutečně progresivní hypermetylaci genomu s progresí onemocnění (11, 12). Hypermetylaci DNA zabraňují dva inhibitory metyltransferázy, 5-azacytidin a 5-aza-2’-deoxycitidin (decitabin). U nás je povolen azacitidin. Zavedení tohoto preparátu do terapie MDS znamená relativně velký posun nejen v samotné terapii, ale i v poodhalování záhad samotné patogeneze MDS, kde se zdá, že epigenetická modulace hraje důležitou roli. Dnes se však s výzkumem funkce demetylačních preparátů objevují i jiné nové efekty těchto účinných léků, které pravděpodobně ovlivňují apoptózu, diferenciaci; diskutuje se i o imunomodulačním efektu. Cytostatický efekt azacitidinu byl již popsán v 60. letech minulého století, a to naším prvním vědcem – profesorem Františkem Šormem, prezidentem Akademie věd a ředitelem Ústavu organické chemie a biochemie, který první azacitidin syntetizoval.
Jak uvádíme v úvodu, dnes již četné studie ukazují významný terapeutický efekt tohoto preparátu u všech skupin MDS nemocných (6, 7, 8). Ve studii CALGB 9221 bylo randomizováno 191 MDS všech podskupin do ramene s azacitidinem (75 mg/m2/den po dobu 7 dnů á 28 dní), oproti standardní podpůrné terapii (6). Celková odpověď v rameni s azacitidinem byla 60% (7 % CR, 16 % PR a 37 % HI podle IWG kritérií 2000). Doba do AML transformace byla ve skupině s azacitidinem 24 měsíců, oproti 12 měsícům ve skupině s podpůrnou léčbou. Stejně tak OS byl 20 měsíců u léčených azacitidinem proti 14 měsícům se standardní terapií. Ve studii AZA-001 bylo randomizováno 358 nemocných se středním II a vysokým IPSS rizikem do ramene s azacitidinem, oproti běžné terapii (podpůrná léčba, malé dávky Ara-C či standardní chemoterapie jako u AML) (7). Studie opět potvrdila pozitivní efekt azacitidinu, a to nezávisle na věku, pohlaví a stupni rizika podle IPSS (13). Stěžejním výsledkem studie bylo dosažení významně delšího OS v rameni s azcitidinem, oproti dosud používané klasické terapii (podpůrná léčba, nízké dávky cytosin arabinosidu, intenzivní chemoterapie – 3 + 7 režim). Stejného výsledku pak bylo dosaženo i u výrazně rizikové podskupiny nemocných s RAEB-T podle FAB klasifikace, tj. AML do 30 % MB podle WHO (14). Mufti a Lim ve svých studiích demonstrovali významně vysoké procento odpovědí až 67 % u nemocných s abnormalitami chromozomu 7 (nověji i 5 a 8), což až dosud byly skupiny nemocných s minimální odpovědí na konvenční terapii (15, 16, 17). Vedle toho se zdá, že azacitidinem by mohl být používán v udržování kompletních remisí po standardní chemoterapii či alogenní transplantaci a v přípravách na transplantaci (18, 19). I výsledky u AML, zvláště ve vyšším věku, kde již nemůžeme používat standartní intenzivní chemoterapii, se zdají povzbudivé (20, 21).
Specifický pro inhibitory metyltransferázy je jejich postupný a pozvolný nástup účinku, proto je účinek často patrný až po 4–6 cyklech terapie. Medián trvání k dosažení odpovědi jsou 3 měsíce a odpověď se zvyšuje s dalšími cykly. Ve studii AZA 001 bylo 81 % odpovědí u respondentů dosaženo až po 6 cyklech terapie. Procento odpovědí stoupá s prodloužením terapie a efekt můžeme vidět také až po 8 a více cyklech (22). Důležité je též udržení dosažené odpovědi, na tomto je též založeno současné doporučení panelu expertů podávat azacitidin do progrese onemocnění (23). Vedle délky terapie byly vedeny i diskuse stran nejvhodnějšího režimu podávání, i zde je v současné době shoda a opět doporučení panelem expertů v sedmidenní aplikaci, kterou i my u většiny našich nemocných používáme (23, 24).
Námi prezentované výsledky terapie azacitidinem nemocných léčených v České republice jsou ve velmi dobré shodě s výše uvedenými výsledky jiných mezinárodních studií včetně základní studie AZA-001 (7). Zvláště dobrá a také v současné době nejlépe hodnotitelná je hodnota celkové odpovědi a hematologických zlepšení. Naše výsledné hodnoty OS, jak uvádíme ve výsledcích, jsou sice velmi dobré, ale samozřejmě je nutné brát v úvahu zatím velmi krátkou dobu sledování, která ze statistického hlediska zkresluje finální data.
Nicméně pro lékaře zabývající se dlouhodobě terapií MDS v České republice je zřejmé, že azacitidin znamená jistě přelom v léčbě této choroby. S přibývajícími zkušenostmi je ale i u této léčby zřejmé, že ne všichni nemocní jsou vhodnými kandidáty profitujícími z terapie. Tak jako je tomu u chemoterapie, i u azacitidinu se zdá, že např. skupina nemocných s nepříznivým cytogenetickým nálezem představuje stále zvláště rezistentní nemocné se špatnou prognózou. Avšak na rozdíl od zkušeností s chemoterapií je patrné, že na demetylační terapii lépe odpovídají nemocní s aberacemi chromozomu 5 a 7. Podle našich zkušeností (zatím nepublikovaných) se zvláště dobrými kandidáty s dobrou odpovědí jeví skupina nemocných s 5q - i se vstupní těžkou transfuzní dependencí, a to i s další chromozomální aberací. Nutná je též dobrá rozvaha u nemocných s horším ECOG PS. Nemocní s komorbiditami ve špatném stavu, byť unesou demetylační léčbu v mnohých případech podle našich zkušeností lépe než chemoterapii, musí být pečlivě vybíráni z hlediska své perspektivy. Zvláště ti se vstupní významnou neutropenií, která se jeví jako špatný prognostický faktor a představuje větší riziko rozvoje infekcí. Zatím ale nelze říct, že by výše uvedené faktory měly znamenat negativní rozhodnutí z hlediska zahájení terapie azacitidinem, je ale třeba je zvážit při terapeutické rozvaze. Velkým oříškem je následná léčba u nemocných, kteří neodpoví na demetylační léčbu. Většina nemocných má velmi špatnou prognózu, z našich zkušeností s minimální odpovědí na další léčbu představovanou zvláště standardní nebo nízce dávkovanou terapií. Co se týče azacitidinu a transplantací, v ČR nemocní, kteří jsou kandidáti azacitidinu, by podle SPC neměli být též kandidáty transplantace. Tento přístup, ale nejspíše bude měněn na základě probíhajících studií hodnotících azacitidin v předtransplantační léčbě (viz výše).
ZÁVĚR
Závěrem lze shrnout, že azacitidin je v současné době standardní terapií nemocných s vyšším rizikem podle IPSS a znamená pro tyto nemocné krok dopředu. Zvláště pro nemocné nad 65 let, kdy již transplantace může být diskutabilní a kdy velmi často pro současné komorbidity není možno podat standardní chemoterapii, která navíc měla u nemocných s vysokým rizikem (podle IPSS) stejně malé procento odpovědí (25). Velkou výhodou této terapie je možnost ambulantního podávání, únosné procento nežádoucích účinků, méně infekčních komplikací vyžadujících hospitalizaci a zvláště vysoké procento hematologických odpovědí, které jsou hlavním důvodem zkvalitnění života nemocných. Byť výše uvedené výsledky jsou jistě lepší, než jsme byli zvyklí při používání standardní terapie nejčastěji v podobě malých dávek cytosin arabinosidu, je zjevné, že dalším krokem musí být snaha dále zvýšit efekt léčby, dosáhnout většího procenta odpovědí a především jejich delšího trvání. Tímto směrem míří studie používající azacitidin v kombinacích (26, 27, 28). V naší studii jsme použili u 20 nemocných kombinaci s erytropoetiny. Tato kombinace bude předmětem další analýzy, nicméně předběžně se jeví jako prospěšná pro nemocné s nedostačenou erytrocytární odpovědí. V terapii myelodysplastického syndromu bude jistě azacitidin v nadcházejících letech představovat základ terapie u nemocných s MDS s vyšším rizikem a měl by být těmto nemocným poskytnut.
Poděkování: Mgr. Karle Kačmářové za pomoc se sběrem dat a dr. Janu Mužíkovi za statistické analýzy a zpracování.
Práce vznikla za podpory výzkumného záměru: Prvouk-5101-28000ZPVK a Prvouk 27/LF1/1.
Participace jednotlivých spoluautorů na práci
JA – autor práce, sepsání článku, vyšetřování a léčba nemocných, vytvoření registru dat, analýza dat, sběr dat
ČJ – léčba a vyšetřování nemocných, revize a schválení rukopisu
ČL – léčba a vyšetřování nemocných
ČO – léčba a vyšetřování nemocných
NL – léčba a vyšetřování nemocných
BP – léčba a vyšetřování nemocných
VJ – léčba a vyšetřování nemocných
SM – léčba a vyšetřování nemocných
SN – léčba a vyšetřování nemocných
WL – léčba a vyšetřování nemocných
LJ – léčba a vyšetřování nemocných
UJ – léčba a vyšetřování nemocných
HI – vyšetřování nemocných
RP – léčba a vyšetřování nemocných
OJ – léčba a vyšetřování nemocných
SM – léčba a vyšetřování nemocných
VV – léčba a vyšetřování nemocných
PH – sběr dat
KK – sběr dat, pomoc při tvorbě registru, udržování registru
MJ – statistické zpracování dat, provedení grafů
Doručeno do redakce 21. 12. 2012
Přijato po recenzi: 4. 4. 2013
MUDr. Anna Jonášová
1. interní klinika VFN a 1. LF UK Praha
U Nemocnice 2
120 00 Praha 2
e-mail: atjonasotmail.com
Zdroje
1. Bennett JM, Catovsky D, Daniel MT, et al. Proposals for the classifica-tion of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189-99.
2. Harris NL, Jaffe ES, Diebold J, et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting-Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835-49.
3. Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079-88 (erratum, Blood 1998; 91 : 1100).
4. Malcovati L, Germing U, Kuendgen A, et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25 : 3503-10.
5. Malcovati L, Porta MG, Pascutto C, et al. Prognostic factor and life expectancy in MDS classified according WHO criteria: a basis for clinical decision making. J Clin Oncol 2005; 23 : 7594-603.
6. Fenaux P, Mufti GJ, Hellstrom-Lindberg E, et al. International Vidaza High-Risk MDS Survival Study Group. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study. Lancet Oncol 2009; 10(3): 223-32.
7. Silverman LR, Demakos EP, Peterson BL, et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the Cancer and Leukemia Group B. J Clin Oncol 2002; 20(10): 2429-40.
8. Itzykson R, Thépot S, Quesnel B, et al. Groupe Francophone des Myelodysplasies (GFM). Prognostic factors for response and overall survival in 282 patients with higher-risk myelodysplastic syndromes treated with azacitidine. Blood 2011; 117(2): 403-11.
9. Curik N, Burda P, Vargova K, et al. 5-azacitidine in aggressive myelodysplastic syndromes regulates chromatin structure at PU.1 gene and cell differentiation capacity. Leukemia 2012; 26(8): 1804-11.
10. Schmelz K, Wagner M, Dörken B, Tamm I. 5-Aza-2‘-deoxycytidine induces p21WAF expression by demethylation of p73 leading to p53-independent apoptosis in myeloid leukemia. Int J Cancer 2005; 114(5): 683-95.
11. Jiang Y, Dunbar A, Gondek LP, et al. Aberrant DNA methylation is a dominant mechanism in MDS progression to AML. Blood 2009; 113(6): 1315-25.
12. Figueroa ME, Skrabanek L, Li Y, et al. MDS and secondary AML display unique patterns and abundance of aberrant DNA methylation. Blood 2009; 114(16): 3448-58.
13. Seymour JF, Fenaux P, Silverman LR, et al. Effects of azacitidine compared with conventional care regimens in elderly (≥ 75 years) patients with higher-risk myelodysplastic syndromes. Crit Rev Oncol Hematol 2010; 76(3): 218-27.
14. Fenaux P, Mufti GJ, Hellström-Lindberg E, et al. Azacitidine prolongs overall survival compared with conventional care regimens in elderly patients with low bone marrow blast count acute myeloid leukemia. J Clin Oncol 2010; 28(4): 562-9.
15. Raj K, John A, Ho A, et al. CDKN2B methylation status and isolated chromosome 7 abnormalities predict responses to treatment with 5-azacytidine. Leukemia 2007; 21(9): 1937 - 44.
16. Mufti GJ, Fenaux P, Hellstrom-Lindberg E, et al. Treatment of high risk MDS patients (pts) with -7/del(7q) with azacitidine (AZA) versus conventional care regimens (CCR): effects on overall survival (OS). J Clin Oncol 2008; 26: Abstract 7033.
17. Mufti GJ, Gore SD, Valeria Santini V, et al. Influence of karyotype on overall survival in patients with higher-risk myelodysplastic syndrome treated with azacitidine or a conventional care regimen. Blood 2009; 114: Abstract 1755.
18. Grövdal M, Khan R, Aggerholm A, et al. Maintenance treatment with azacitidine for patients with high risk myelodysplastic syndromes or acute myeloid leukaemia in complete remission after intensive chemotherapy. Br J Haematol 2010; 150(3): 293-302.
19. Damaj G, Duhamel A, Robin M, et al. Impact of azacitidine before allogeneic stem-cell transplantation for myelodysplastic syndromes: A study by the Societe Francaise de Greffe de Moelle et de Therapie--Cellulaire and the Groupe-Francophone des Myelodysplasies. J Clin Oncol 2012; 30 : 4533-4540.
20. Quintás-Cardama A, Ravandi F, Liu-Dumlao T, et al. Epigenetic therapy is associated with similar survival compared with intensive chemotherapy in older patients with newly diagnosed acute myeloid leukemia. Blood 2012; 120 : 4840-4845.
21. Al-Ali HK, Jaekel N, Junghanss C, et al. Azacitidine in patients with acute myeloid leukemia medically unfit for or resistant to chemotherapy: a multicenter phase I/II study. Leuk Lymphoma 2012; 53(1): 110-7.
22. Silverman LR, Fenaux P, Mufti GJ, et al. Continued azacitidine therapy beyond time of first response improves quality of response in patients with higher-risk myelodysplastic syndromes. Cancer 2011; 117(12): 2697-702.
23. Fenaux P, Bowen D, Gattermann N, et al. Practical use of azacitidine in higher-risk myelodysplastic syndromes: an expert panel opinion. Leuk Res 2010; 34(11): 1410-6.
24. Lyons RM, Cosgriff T, Modi S, et al. Results of the initial treatment phase of a study of three alternative dosing schedules of azacitidine (Vidaza®) in patients with myelodysplastic syndromes (MDS). J Clin Oncol 2009; 27(11): 1850-6.
25. Fenaux P, Gattermann N, Seymour JF, et al. Prolonged survival with improved tolerability in higher-risk myelodysplastic syndromes: azacitidine compared with low dose ara-C. Br J Haematol 2010; 149(2): 244-9. (Erratum Br J Haematol 2010 Jun; 149(6): 919).
26. Itzykson R, Thépot S, Beyne-Rauzy O, et al. Groupe Francophone des Myelodysplasies (GFM). Does addition of erythropoiesis stimulating agents improve the outcome of higher-risk myelodysplastic syndromes treated with azacitidine? Leuk Res 2012; 36(4): 397-400.
27. Sekeres MA, List AF, Cuthbertson D, et al. Phase I combination trial of lenalidomide and azacitidine in patients with higher-risk myelodysplastic syndromes. J Clin Oncol 2010; 28(13): 2253-8.
28. Silverman LR. Hypomethylating agents in myelodysplastic syndromes changing the inevitable: the value of azacitidine as maintenance therapy, effects on transfusion and combination with other agents. Leuk Res 2009; 33:Suppl 2: S18-21.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Plazmocelulární leukemieČlánek MUDr. Květoslava Petrtýlová
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2013 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- První zkušenosti České MDS skupiny s terapií 5-azacytidinem u nemocných s myelodysplastickým syndromem s vyšším rizikem (IPSS střední 2 a vysoké riziko), akutní myeloidní leukemií do 30 % myeloblastů a chronickou myelomonocytární leukemií II
- Význam stanovení sérových hladin volných lehkých řetězců imunoglobulinu u AL amyloidózy
- Lymfomy gastrointestinálního traktu – klinicko-patologický přehled
- Plazmocelulární leukemie
- Současná léčba myelofibrózy na základě rizikové stratifikace pacientů
- Získané trombofílie ako etiologické činitele včasných tehotenských strát
- Survival and cure trends for European children, adolescents and young adults diagnosed with acute lymphoblastic leukemia from 1982 to 2002
- Mikrobiologická kontrola procesov pri výrobe transfúznych liekov
- K významnému životnímu jubileu prof. MUDr. Jana Kvasničky, DrSc.
- MUDr. Květoslava Petrtýlová
- Analysis of incidence, risk factors and clinical outcome of thromboembolic and bleeding events in 431 allogeneic hematopoietic stem cell transplantation recipients
- Bleeding manifestations and management of children with persistent and chronic immune thrombocytopenia: data from the Intercontinental Cooperative ITP Study Group (ICIS)
- IKZF1 deletion is an independent predictor of outcome in pediatric acute lymphoblastic leukemia treated according to the ALL-BFM 2000 protocol
- Development and validation of a prognostic scoring system for patients with chronic myelomonocytic leukemia
- Outcomes of transplantation using various hematopoietic cell sources in children with Hurler syndrome after myeloablative conditioning
- Rituximab and dexamethasone vs dexamethasone monotherapy in newly diagnosed patients with primary immune thrombocytopenia
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Současná léčba myelofibrózy na základě rizikové stratifikace pacientů
- Lymfomy gastrointestinálního traktu – klinicko-patologický přehled
- Význam stanovení sérových hladin volných lehkých řetězců imunoglobulinu u AL amyloidózy
- Plazmocelulární leukemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



