-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
High-risk monoclonal gammopathy of undetermined significance – to treat or not to treat?
Monoclonal gammopathy of undetermined significance (MGUS) is defined as a clinically silent, symptom-free state that does not meet the diagnostic criteria of multiple myeloma (MM), Waldenström macroglobulinemia, AL-amyloidosis or any other malignant lymphoproliferative disease. Long-term follow-up has demonstrated that this may be a pre-cancerous state with transformation into a malignant monoclonal gammopathy in approximately 1% of cases annually. Probably all cases of MM arise as a transformation of MGUS. In this overview, the author attempts to answer the key question, namely whether it is currently possible in some way to prevent the transformation of MGUS into MM or to at least to slow this down. The answer in MGUS patients is currently unequivocally NO. In view of the significantly higher risk of transformation in patients with asymptomatic multiple myeloma than in patients with MGUS, further analysis by the CMG will focus on this group of patients with the goal of selecting the group at highest risk and to subject this group to early and if possible non toxic treatment.
Key words:
acute leukaemia, minimal residual disease, cytogenetics, molecular cytogenetics, chromosome microdissection, next-generation sequencing, personalized medicine
Autoři: V. Maisnar 1; Hájek R Za Českou Myelomovou Skupinu 2
Působiště autorů: IV. interní hematologická klinika, FN a LF UK Hradec Králové, 2Ústav klinické hematologie, FN Ostrava a LF Ostravské univerzity 1
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 1, p. 22-26.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Monoklonální gamapatie nejasného významu (MGUS) je definována jako klinicky němý bezpříznakový stav, při kterém nejsou splněna diagnostická kritéria mnohočetného myelomu (MM), Waldenströmovy makroglobulinemie, AL-amyloidózy nebo jiného zhoubného lymfoproliferativního onemocnění. Dlouhodobým sledováním bylo prokázáno, že jde o možnou prekancerózu s přechodem v maligní monoklonální gamapatií v přibližně 1 % případů za rok, pravděpodobně všechny případy MM vznikají transformací z MGUS. V rámci přehledného sdělení se autor snaží odpovědět na otázku, zda je v současnosti možné nějakým způsobem transformaci MGUS v MM zabránit nebo ji alespoň zpomalit. Odpovědí u MGUS pacientů je zatím jednoznačné NE. Vzhledem k mnohem vyšší míře rizika transformace u nemocných s asymptomatickým mnohočetným myelomem, než je tomu u pacientů s MGUS, budou další analýzy CMG zaměřeny na tuto skupinu nemocných s cílem vytipovat nejrizikovější skupinu nemocných a tu poté podrobit časné a pokud možno netoxické léčbě.
Klíčová slova:
monoklonální gamapatie nejasného významu (MGUS), diagnostika, prognóza, monitoring, léčbaÚvod
Monoklonální gamapatie jsou velmi heterogenní skupinou onemocnění, která je charakterizována proliferací diferencovaných B-lymfocytů, jejichž klon produkuje elektroforeticky a imunologicky homogenní protein, tzv. monoklonální imunoglobulin (M-Ig; synonyma – paraprotein, M-komponenta, M-gradient), který můžeme prokázat v séru a/nebo v moči (1). V případě monoklonální gamapatie nejasného významu (MGUS) jde o klinicky němý bezpříznakový stav, při kterém nejsou splněna diagnostická kritéria mnohočetného myelomu (MM), Waldenströmovy makroglobulinemie, AL-amyloidózy nebo jiného zhoubného lymfoproliferativního onemocnění (2, 3). Základní klasifikace monoklonálních gamapatií je uvedena v tabulce 1.
Tab. 1. Základní klasifikace monoklonálních gamapatií (3). 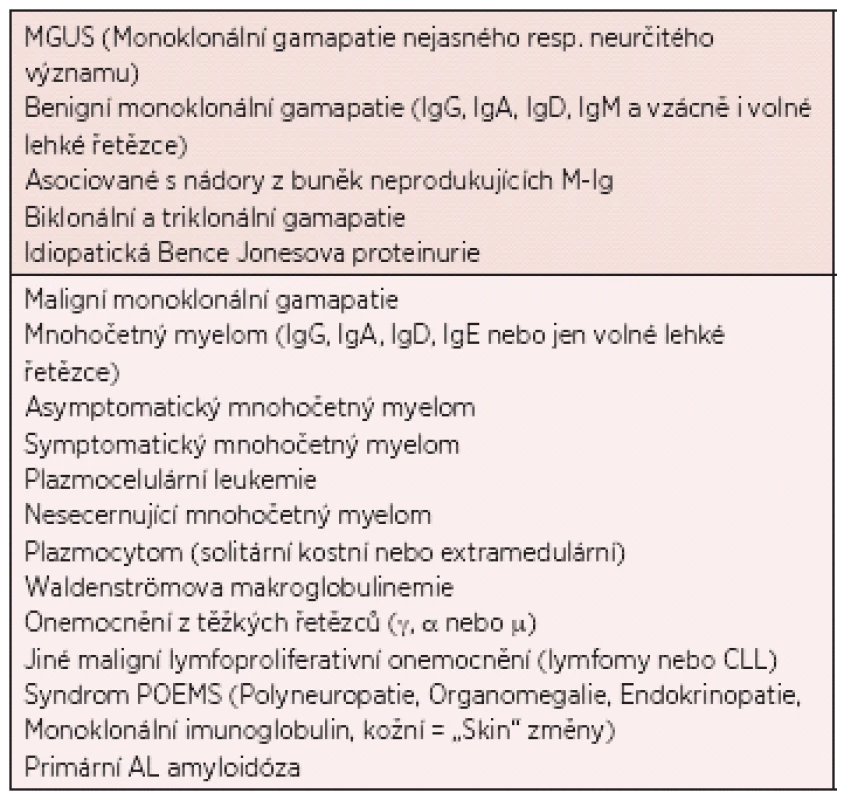
Monoklonální gamapatie jsou v mladších věkových skupinách (pod 50 let) poměrně vzácné (méně než 1 %), ve vyšších věkových skupinách jejich výskyt roste a po 85. roce života a výše se jejich incidence pohybuje mezi 8–15 % (3). Zajímavý je rozdílný výskyt MGUS u různých etnických skupin – 8,6 % u Afroameričanů, 3–6 % u bělochů a 2,7 % u Japonců (4). U bělochů přitom prevalence s věkem narůstá (1,83 % v 50–54 letech a 5,12 % v 70–74 le-tech), u Afroameričanů se naopak prevalence překvapivě s narůstajícím věkem nemění (5,33 % v 50–54 letech a 5,38 % v 70–74 letech) (3). Většinu monoklonálních gamapatií tvoří právě MGUS, které byly dříve považovány za benigní (2, 5). Klíčové biologické a molekulární genetické mechanismy vývoje MGUS nejsou dosud zcela objasněné. Jde o proces, na kterém se spolupodílí mnoho faktorů včetně genetické predispozice, vlivu životního prostředí, možné chronické infekce nebo autoimunitního onemocnění a další. Současné zkušenosti získané jejich dlouhodobým sledováním však hodnotí tyto gamapatie jako možnou prekancerózu s přechodem v maligní monoklonální gamapatií v přibližně 1 % případů za rok (3). Poznatkem z poslední doby je i skutečnost, že transformací z MGUS pravděpodobně vznikají všechny případy MM (dříve se předpokládalo, že pouze jejich menší část), tedy, že neexistuje MM vzniklý „de novo“ bez předchozí fáze MGUS (6, 7).
Diferenciální diagnostika monoklonálních gamapatií
MGUS tedy představuje nejčastější monoklonální gamapatii, se kterou se v praxi můžeme setkat, jejíž incidence je oproti nejčastější maligní monoklonální gamapatii, kterou je mnohočetný myelom, přibližně 100x vyšší.
Základním vyšetřením pro diagnózu jakékoli monoklonální gamapatie zůstává i nadále stanovení přítomnosti monoklonálního imunoglobulinu v séru a/nebo v moči. Druhým zásadním vyšetřením v diagnostice monoklonálních gamapatií je stanovení rozsahu postižení kostní dřeně, nově s nutností potvrzení resp. vyloučení přítomnosti klonální populace nádorových plazmatických buněk (8). Bez ověření tohoto faktu dnes prakticky nemůže být diagnóza monoklonální gamapatie stanovena. Přes všechna diagnostická kritéria a pomocná vyšetření nelze někdy rozhodnout, zda se jedná o mnohočetný myelom, nebo o nemaligní monoklonální gamapatii nejasného významu (viz tabulka 2). Pokud není diagnóza po prvním komplexním vyšetření jasná, je vhodnější ponechat diagnózu otevřenou a osoby s tímto nálezem pravidelně kontrolovat ve 2–3měsíčních intervalech (9).
Tab. 2. Nová diagnostická kritéria MGUS dle IMWG, 2003 (8). 
V poslední době je stále více v diagnostice monoklonálních gamapatií využíváno stanovení volných lehkých řetězců (FLC; Free Light Chains) v séru (10). Výsledek stanovení FLC v séru je dnes součástí i nové prognostické klasifikace monoklonálních gamapatií nejasného významu (viz tab. 3).
Tab. 3. Nová klasifikace monoklonálních gamapatií neurčeného významu (11). 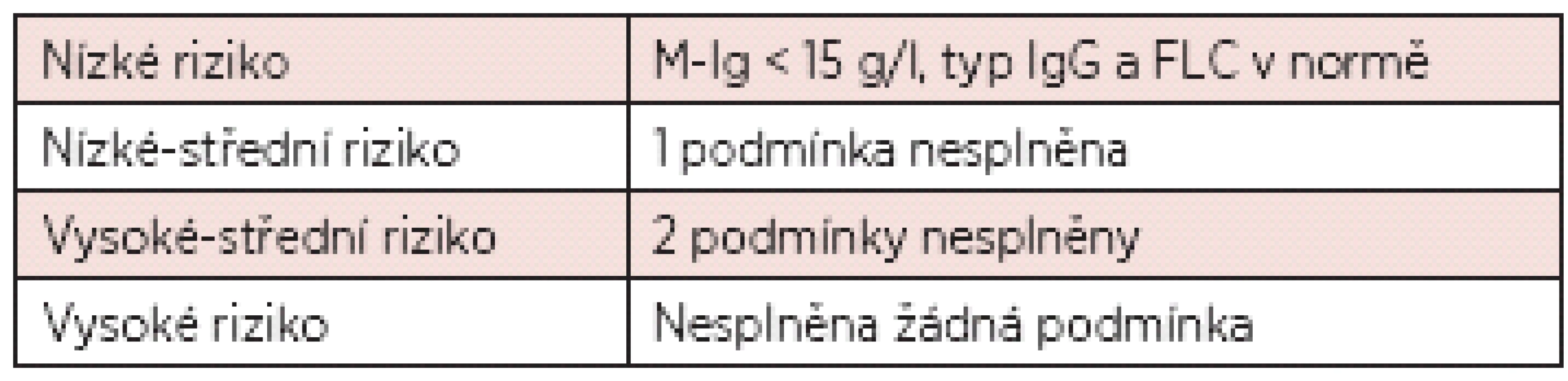
Poznámka: ve skupině nízkého rizika je pouze 5% riziko přechodu do obrazu maligní monoklonální gamapatie do 20 let od stanovení diagnózy MGUS, ve skupině vysokého rizika je pak výše tohoto rizika již 58 %! Rozsáhlá studie Mayo kliniky provedená na registru nemocných s MGUS dále prokázala statisticky významnou závislost progrese v průběhu 20letého sledování na zjištěné koncentrací monoklonálního imunoglobulinu (viz tab. 4) (12).
Tab. 4. Nárůst rizika progrese MGUS v průběhu 20 let s koncentrací M-Ig (12). 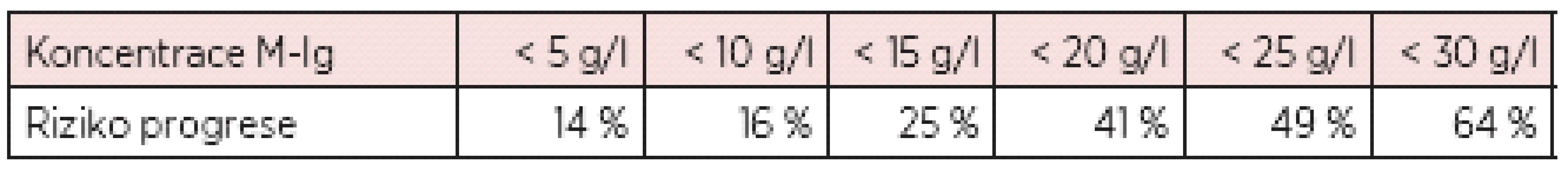
K dalším významným faktorům využitelným v rámci predikce individuálního rizika transformace MGUS patří kromě již uvedených ještě imunoparéza (snížení) neklonálních imunoglobulinů v séru, poměr fenotypově normálních a abnormálních populací plazmatických buněk v kostní dřeni a stanovení přítomnosti některých genetických abnormalit nejlépe pomocí celogenomové analýzy (13, 14, 15, 16).
Proč uvažovat o léčbě asymptomatického onemocnění?
Za posledních 10 let došlo k zásadním změnám nejen v diagnostice mnohočetného myelomu, ale zejména v jeho léčbě. Použití nových léků, jejichž základními představiteli jsou dnes běžně dostupné přípravky – thalidomid, bortezomib a lenalidomid, a rutinně prováděná vysoko dávkovaná léčba s podporou autologního štěpu periferních kmenových buněk u nemocných do 65 let věku, provází v posledních 10 letech zásadní změna mediánu přežití nemocných s MM z původních 2,5 roku při použití konvenční chemoterapie na současných až 7 let (8, 17, 18). Takových výsledků jsme schopni dosahovat i v našich podmínkách, což jsme sami potvrdili na našem souboru 186 transplantovaných nemocných, z nichž v současné době již více než 40 % přežívá dokonce déle než 10 let (19).
Obecná myšlenka zabránit vzniku nádoru ještě na úrovni prekancerózy je přitom velmi silná. Dnes současně již existují technologie umožňující provedení potřebných analýz pro stanovení prognózy i u stavů s nízkým počtem získaných buněk. Konečně jeden z výše uvedených léků, a to konkrétně lenalidomid, má tolerovatelné množství nežádoucích účinků a může tak být zkoušen v rámci klinických studií i u prekanceróz typu MGUS. Zatím jsou však známy výsledky pouze jedné podobné studie, a to u pacientů s již asymptomatickou formou MM, která statisticky signifikantně prodloužila dobu do transformace do symptomatické fáze onemocnění a pravděpodobně i celkové přežití v případě podávání kombinace lenalidomidu s dexametazonem (20). Bohužel tato ani žádná další studie dosud nestratifikovala nemocné podle rizika a neuplatnila tak léčbu pouze u vysoce rizikových nemocných.
Analýza dat MGUS nemocných zadaných do Registru monoklonálních gamapatií
Podle našeho názoru je zahájení léčby zdůvodnitelné pouze u nemocných, u nichž máme jistotu, že s 90% pravděpodobností u nich dojde k transformaci do obrazu MM do 2 let od stanovení diagnózy MGUS. Pouze u takovéto skupiny nemocných s “ultra vysokým rizikem” je dnes v rámci klinických studií podle nás možné podání pokud možno netoxické protinádorové léčby s cílem oddálení resp. zabránění transformace do obrazu symptomatické fáze onemocnění. Proto byla v minulém roce provedena rozsáhlá analýza dat nemocných s MGUS zadaných do Registru monoklonálních gamapatií (RMG) s cílem zjistit, jak velký podíl představuje vysoce riziková skupina dle stratifikace Mayo kliniky (viz tab. 3; 3) v našem souboru nemocných.
V období posledních 5 let byla do RMG zadána data již více než 1500 nemocných s MGUS. Z toho přibližně polovina měla v době diagnózy stanovenu koncentraci volných lehkých řetězců v séru, jejíž znalost je potřebná pro výše uvedenou stratifikaci dle rizika transformace. Z celkem 823 hodnotitelných subjektů splnilo podmínky rizikové skupiny pouze 14 nemocných s MGUS. Celkem u 7,1 % sledovaných osob s MGUS došlo v mediánu 3 let k maligní transformaci. Přestože tedy náš RMG představuje v současnosti jeden z největších analyzovaných souborů nemocných s MGUS na světě a naše analýza potvrdila platnost současného stratifikačního systému, nízké počty nemocných v nejrizikovější skupině nám nedovolují uvažovat o zahájení randomizované klinické studie. V současnosti jsme naopak schopni téměř s jistotou definovat skupinu nemocných s MGUS s rizikem transformace nižším než 1 %. Vzhledem k znalosti mnohem vyššího rizika transformace asymp-tomatické formy MM (viz graf 1) a nově zaváděných prognostických systémů i u této skupiny nemocných (21, 22, 23) plánuje v současnosti Česká myelomová skupina statistickou analýzu zaměřenou na určení rizika transformace do symptomatické formy u osob s asymptomatickým mnohočetným myelomem sledovaných v rámci RMG.
Graf 1. Srovnání rizika progrese do symptomatického MM u nemocných s MGUS a asymptomatickým mnohočetným myelomem. 
Závěrečné shrnutí
Z výše uvedeného vyplývá, že léčba asymptomatických forem MG mimo klinické studie zatím není indikována. Přestože je léčba lenalidomidem relativně netoxická, je nutné vyčkat výsledků dlouhodobé bezpečnosti jeho podávání a dalšího osudu takto léčených nemocných po jejich progresi do symptomatické formy onemocnění. Vzhledem k mnohem vyšší míře rizika transformace u nemocných s asymptomatickým mnohočetným myelomem, než je tomu u pacientů s MGUS, budou další analýzy CMG zaměřeny na tuto skupinu nemocných s cílem vytipovat nejrizikovější skupinu nemocných. Při dosažení 90% jistoty progrese do 2 let od stanovení diagnózy by pak bylo indikováno zahájení časné léčby s cílem zamezení progrese do symptomatické formy onemocnění.
V současnosti nám tedy nadále nezbývá nic jiného, než pacienty s MGUS dispenzarizovat a pečlivě monitorovat v časových intervalech stanovených dle individuálního rizika transformace. Zatím totiž neexistuje vyšetření, na základě kterého by bylo možné poznat již v době stanovení diagnózy, jak se onemocnění bude dále vyvíjet. Jsou-li všechna provedená kontrolní vyšetření stabilní, pak se doporučuje provedení kontrolního vyšetření v odstupu 3–6 měsíců, v případě jasné stability koncentrace MIG („non-evolving type“) dále v intervalu 12 měsíců (9, 23). Za signifikantní nárůst koncentrace MIG se všeobecně považuje jeho 25% zvýšení v intervalu 3 měsíců (minimálně o 5 g/l), v takovém případě by měly být přešetřeny základní charakteristiky onemocnění. Při prokázané osteoporóze je vhodné časné zahájení její komplexní léčby včetně podání bisfosfonátů za účelem snížení rizika pozdějších kostních komplikací (9, 13).
Tato opatření by nám měla umožnit včasné odhalení případné maligní transformace ještě před vznikem možné orgánové komplikace. Je samozřejmé, že v případě jakýchkoliv známek klinické a/nebo laboratorní progrese je nutné zkrácení doporučených intervalů resp. bezprostřední provedení kontrolního vyšetření s ohledem na naléhavost stavu a jeho klinickou sympto-matologii.
Poděkování
Tato publikace vznikla za podpory grantu IGA MZ NT 12215-4/2011.
Podíl na přípravě rukopisu
V. M. – příprava první verze, kontrola a schválení finální verze;
R. H. – kritická revize, kontrola a schválení finální verze.
Doručeno do redakce: 1. 1. 2013
Přijato po recenzi: 21. 1. 2013
Doc. MUDr. Vladimír Maisnar, Ph.D.
IV. interní hematologická klinika
FN a LF UK v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: vladimir.maisnar@fnhk.cz
Zdroje
1. Attaelmannan M, Levinson SS. Understanding and identifying monoclonal gammopathies. Clin Chem 2000; 46 : 1230-8.
2. Kyle RA. Monoclonal gammopathy of undetermined significance and solitary plasmocytoma. Hematol Oncol Clin N Am 1997; 11 : 71-87.
3. Kyle RA, Rajkumar SV. Monoclonal gammopathy of undetermined significance. Br J Haematol 2006; 134 : 573-89.
4. Kristinsson SY, Björkholm M, Anderson TM, et al. Patterns of survival and cause of death following a diagnosis of monoclonal gammopathy of undetermined significance: a population-based study. Haematologica 2009; 94 : 1714-20.
5. Kyle RA, Lust JA. Monoclonal gammopathies of undetermined significance. Semin Hematol 1989; 26 : 176-200.
6. Landgren O, Kyle RA, Rajkumar SV. From myeloma precursor disease to multiple myeloma: new diagnostic concepts and opportunities for early intervention. Clin Cancer Res 2011; 17 : 1243-52.
7. Landgren O, Waxman AJ. Multiple myeloma precursor disease. JAMA 2010; 304 : 2397-404.
8. Durie BGM, Kyle RA, Belch A, et al. Myeloma management guidelines: a consensus report from the Scientific Advisors of the International Myeloma Foundation. Hematol J 2003; 4 : 379-98.
9. Bird J, Behrens J, Westin J, et al. UK Myeloma Forum (UKMF) and Nordic Myeloma Study Froup (NMSG): guidelines for the investigation of newly detected M-proteins and the management of monoclonal gammopathy of undetermined significance (MGUS). Br J Haematol 2009; 147 : 22-42.
10. Dispenzieri A, Kyle R, Mateos MV, et al. International Myeloma Working Group guidelines for serum free light chain analysis in multiple myeloma. Leukemia 2009; 23 : 215-24.
11. Kyle RA, Rajkumar SV. Monoclonal gammopathy of undetermined significance. Br J Haematol 2006; 134 : 573-89.
12. Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002; 346 : 564-9.
13. Kyle RA, Durie BGM, Rajkumar SV, et al. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24 : 1121-7.
14. Paiva B, Vidriales MB, Perez JJ, et al. Multiparametric flow cytometry quantification of bone marrow plasma cells at diagnosis provides more prognostic information than morphological assessment in myeloma patients. Haematologica 2009; 94 : 1599-602.
15. Perez-Persona E, Vidriales MB, Mateo G, et al. New criteria to identify risk of progression in monoclonal gammopathy of uncertain significance and smoldering multiple myeloma based on multiparametric flow cytometry analysis of bone marrow plasma cells. Blood 2007; 110 : 2586-92.
16. Lopez-Corral L, Gutierrez NC, Vidriales MB, et al. The progression from MGUS to smoldering myeloma and eventually to multiple myeloma involves a clonal expansion of genetically abnormal plasma cells. Clin Cancer Res 2011; 17 : 1692-700.
17. Bird JM, Owen RG, D´Sa S, et al. Guidelines for the diagnosis and management of multiple myeloma 2011. Br J Haematol 2011; 154 : 32-75.
18. Kumar SK, Dingli D, Lacy MQ, et al. Outcome after autologous stem cell transplantation for multiple myeloma in patients with preceding plasma cell disorders. Br J Haematol 2008; 141 : 205-11.
19. Maisnar V, Radocha J, Žák P, et al. 15-years of single center experience with stem cell transplantation for multiple myeloma. Haematologica/Hematol J 2011; 96 (Suppl. 1): 89/P-201.
20. Mateos MV, San Miguel JS, Garcia-Sanz R, et al. Results of QuiRedex study. Blood 2010; 116: A-1935.
21. Bladé J, Dimopoulos M, Rosinol L, et al. Smoldering (asymptomatic) multiple myeloma: Current diagnostic criteria, new predictors of outcome, and follow-up recommendations. J Clin Oncol 2010; 28 : 690-7.
22. Pérez-Persona E, Mateo G, Garcia-Sanz R, et al. Risk of progression in smoldering myeloma and monoclonal gammopathies of unknown significance: comparative analysis of the evolution of monoclonal component and multiparameter flow cytometry of bone marrow plasma cells. Br J Haematol 2010; 148 : 110-4.
23. Kyle RA, Durie BGM, Rajkumar SV, et al. A monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24 : 1121-27.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2013 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
- Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
- Výskyt venózního tromboembolismu u žen v časové souvislosti s užíváním hormonální antikoncepce
- Přístupy k antimykotické terapii: od profylaxe k léčbě
- Kryokonzervace krve – historie, metody a současnost
- Úvodník
- Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis
- Cardiovascular risk factors in hematopoietic cell transplantation survivors: role in development of subsequent cardiovascular disease
- A randomized trial of dasatinib 100 mg versus imatinib 400 mg in newly diagnosed chronic-phase chronic myeloid leukemia
- Genome-wide association study identifies germline polymorphisms associated with relapse of childhood acute lymphoblastic leukemia
- A randomized phase II study to evaluate tacrolimus in combination with sirolimus or methotrexate after allogeneic hematopoietic cell transplantation
- Soutěž
- Realita vyšetřování minimální reziduální nemoci u akutních leukemií aneb kolik laboratorní akrobacie je skutečně třeba?
- Identifikace nových molekulárních markerů pro sledování minimální reziduální nemoci u akutních leukemií
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
- Kryokonzervace krve – historie, metody a současnost
- Přístupy k antimykotické terapii: od profylaxe k léčbě
- Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



