-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mikroprostředí kostní dřeně a jeho role v patogenezi leukemií
Bone marrow microenvironment and its role in the pathogenesis of leukaemia
Bone marrow microenvironment plays a key role in the process of haematopoiesis. It has a supportive function for quiescent haematopoietic stem cells located in so called „niches“. It provides appropriate conditions for haematopoietic stem cell differentiation and for the proliferation of blood elements. Under certain conditions, the bone marrow microenvironment may be colonized by circulating peripheral haematopoietic stem cells (a fact used in the process of peripheral blood stem cell transplantation). It is probable that this mechanism is also used by malignant (leukemic) cells to infiltrate the microenvironment and thus take advantage of all the supportive functions provided to divide, proliferate and more or less differentiate into the leukemic population.
Key words:
haematopoiesis, bone marrow microenvironment, haematopoietic stem cell niche
Autoři: E. Létalová 1; M. Doubek 2; F. Folber 1; J. Verner 1; M. Mráz 2; Š. Pospíšilová 2; J. Mayer 2
Působiště autorů: Interní hematoonkologická klinika, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno 1; Středoevropský technologický institut, Masarykova univerzita, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 4, p. 171-176.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Mikroprostředí kostní dřeně hraje zásadní úlohu v procesu krvetvorby. Má podpůrnou funkci pro klidové kmenové buňky usídlené v tzv. nikách kostní dřeně, vytváří podmínky pro rozrůzňování kmenových buněk a novotvorbu krevních elementů. Za určitých podmínek může dojít k osídlení (tzv. homing) mikroprostředí kmenovými buňkami kolujícími v periferní krvi (čehož se využívá u transplantací krvetvorných buněk). Je pravděpodobné, že podobný mechanismus využívá i nádorová (leukemická) buňka. Infiltruje mikroprostředí kostní dřeně a využívá výše zmíněných podpůrných funkcí mikroprostředí k nádorovému růstu, proliferaci a větší či menší diferenciaci leukemické populace.
Klíčová slova:
krvetvorba, mikroprostředí kostní dřeně, niky kmenových krvetvorných buněkStavba a mikroprostředí kostní dřeně
Kostní dřeň, která u dospělého člověka váží přibližně 2600 g, je největším orgánem lidského těla. Skládá se z krvetvorných buněk, krevních sinusoid, stromatu (z řeckého stroma, lůžko) a mezibuněčné matrix.
Krvetvorné buňky – v krvetvorné tkáni se nachází přibližně 1 až 4 hematopoetické kmenové buňky na 100 tisíc jaderných buněk. Identifikace nezralých kmenových hematopoetických buněk od více diferencovaných progenitorových buněk je možná na základě různých fyzikálních vlastností, imunofenotypických a funkčních znaků. Mezi imunofenotypické znaky hemopoetické kmenové buňky patří: CD34+ CD90+ Kit+ CD10- CD14- CD15- CD16- CD19- CD20- (1).
Endotelie krevních sinusoid hrají roli v přechodu zralých krevních elementů ze dřeně do periferního oběhu. Zralé krevní elementy pravděpodobně přecházejí cytoplazmou endotelií, ne mezibuněčnými prostory, jak se předpokládalo dříve. Dále hrají endotelie specifickou úlohu ve vychytávání hematopoetických progenitorových buněk z krevního oběhu a zajišťují jejich „homing“ do stromatu kostní dřeně (1).
Stroma představuje mikroprostředí kostní dřeně, ve kterém rostou a diferencují hematopoetické kmenové buňky. Skládá se z myofibroblastů (retikulární buňky), adipocytů, makrofágů, lymfocytů, plazmatických buněk, endoteliálních, mezenchymálních kmenových a dalších buněk. Myofibroblasty svými výběžky vytváří retikulární síť, v níž jsou zachyceny krvetvorné buňky. Retikulární síť je vyplněna mezibuněčnou hmotou, která je tvořena stromálními buňkami. Mezibuněčná hmota obsahuje různé vláknité proteiny, glykoproteiny a proteoglykany (např. kolagen typu I, III, IV, V, VI, fibronektin, laminin, hemonektin, tenascin, trombospondin aj.) (2–5). Stroma kostní dřeně řídí proliferaci, diferenciaci, obnovu a „homing“ hematopoetických progenitorových buněk a zajišťuje přechod zralých krevních elementů z kostní dřeně do periferního krevního oběhu. Tato funkce je zajištěna jednak stromálními buňkami, které vytváří a secernují růstové faktory, dále mezibuněčnými interakcemi (interakce stromálních buněk s hematopoetickými buňkami), a také interakcemi na molekulární úrovni (tedy mezi hematopoetickými buňkami a složkami extracelulární matrix). Termínem „homing“ označujeme proces, kterým hematopoetické kmenové buňky opouštějí krevní cirkulaci a selektivně osídlují stroma kostní dřeně, ve kterém vysoce specifickými mechanismy interagují s jednotlivými složkami dřeně a zahajují tímto proces krvetvorby (6). „Homing“ se nevyskytuje pouze u hematopoetických progenitorových buněk, které se v cirkulaci běžně objevují, ale také u hematopoetických kmenových buněk, které se do krevního oběhu dostanou arteficiálně transplantací kmenových hematopoetických buněk. Není zcela zřejmé, zda mechanismy „osídlení“ kostní dřeně jsou stejné pro transplantované a normálně cirkulující kmenové hematopoetické buňky. V obou případech však cirkulující progenitory nejprve přilnou k endoteliím krevních sinusoid a poté dochází k migraci progenitorů skrze endotelie do extravaskulárního prostoru uvnitř stromatu kostní dřeně. Proteiny mezibuněčné hmoty poté zahajují a udržují proces dlouhodobé krvetvorby (6). Výzkumy bylo prokázáno, že přihojení štěpu a „homing“ hematopoetických kmenových buněk mohou být zvýšeny inhibicí nebo úplnou delecí peptidázové aktivity proteinu CD26 na povrchu vysoce purifikovaných hematopoetických kmenových buněk (7).
Přímé molekulární interakce mezi krvetvornými buňkami a buňkami stromatu zahrnují interakce ligand-receptor adhezivních molekul na povrchu hemopoetických α a β stromálních buněk. Je známo mnoho buněčných adhezivních molekul, které mohou být rozděleny do několika skupin: sialomuciny, selektiny, integriny a velká skupina imunoglobulinů (8).
Integriny jsou heterodimerické, transmembránové proteiny složené z α a β podjednotky, které jsou spojeny nekovalentní vazbou. Obě podjednotky mají extracelulární a intracelulární doménu. Je známo 18 typů podjednotek α a 8 typů podjednotek β. Do rodiny integrinů se řadí VLA-4 antigen (very late antigen) složený z podjednotky α4 a β1, který je exprimován na povrchu hematopoetických progenitorových buněk a váže se k adhezivní molekule skupiny imunoglobulinů VCAM-1 (vascular cell adhesion molecule) přítomných na stromálních buňkách, makrofázích a endoteliích krevních sinusoid (9). U myší, kterým byla specificky vyřazena funkce α4 integrinu, docházelo k hromadění hematopoetických kmenových a progenitorových buněk v periferní krvi a slezině a současnému snížení počtu hematopoetických kmenových buněk a progenitorů v kostní dřeni. U těchto myší dochází za normálních podmínek k dostatečné tvorbě krevních elementů, mají však opožděnou odpověď za stresových podmínek (po administraci erytropoetinu, opožděný „homing“ po transplantaci kmenových krvetvorných buněk a krátce trvající přihojení štěpu) (10). Podávání protilátek proti VLA-4 či VCAM-1 zvířatům zvyšuje uvolnění (mobilizaci) hemopoetických kmenových buněk a více diferencovaných progenitorových buněk z kostní dřeně (11, 12) a snižuje „homing“ hemopoetických kmenových buněk po transplantaci (13, 14). U pacientů s myelodysplastickým syndromem CD34+ progenitory kostní dřeně vykazují sníženou expresi VLA-4. Tito pacienti mají hypercelulární kostní dřeň, ale nedostatek cirkulujících hematopoetických buněk, svědčící pro chybné vyplavování buněk z kostní dřeně a zvýšenou intramedulární apoptózu (15). Delece genu pro VCAM-1 (16,17) sice nenarušuje hemopoezu či udržování kmenových hematopoetických buněk v kostní dřeni, ale ovlivňuje migraci, především T-lymfocytů, do kostní dřeně a megakaryopoezu (18).
Selektiny jsou buněčné adhezivní molekuly, jejichž funkcí je „homing“ lymfocytů do lymfatických tkání a podporují „rolling – kutálení“ a „adhezi – přilnutí“ leukocytů k buňkám endotelu. Hematopoetické kmenové buňky na svém povrchu také obsahují receptory pro selektiny (19, 20), které tak mohou hrát důležitou roli v migraci kmenových buněk skrz buňky endotelu (21).
Dalším příkladem receptoru a jeho ligandu, jež hraje důležitou roli v interakci mezi kmenovou buňkou a stromatem kostní dřeně, je chemotaktický receptor CXCR4 a jeho liganda SDF-1 (stromal-derived factor-1α) secernovaný stromatem kostní dřeně. Je to jediný známý chemokin, který vyvolává přímou chemotaktickou odpověď hematopoetických kmenových buněk cestou interakce s CXCR4 receptorem na jejich buněčném povrchu (22, 23). Myši, kterým chybí SDF-1 nebo CXCR4, mají porušenou krvetvorbu ve fetální kostní dřeni vzhledem ke snížené schopnosti hematopoetických kmenových buněk z fetálních jater k osídlování fetální kostní dřeně a dřeňové dutiny (24, 25). C3a složka komplementu, která je secernována stromálními buňkami kostní dřeně a jehož hladina je fyziologicky zvýšena při stresu, zvyšuje vazbu CXCR4 k SDF-1 a tím podporuje „homing“ hematopoetických kmenových buněk do kostní dřeně stejně jako stimuluje progenitorové buňky k migraci z kostní dřeně do periferní cirkulace (26).
Proteoglykany (proteiny s vysokým obsahem sulfátů) jako např. heparansulfát, chondroitinsulfát jsou proteiny extracelulární matrix, které mohou přispívat k adhezi mezi kmenovými krvetvornými buňkami a stromatem (27–30). Proteoglykany mohou koncentrovat solubilní růstové faktory jako např. GM-CSF, který se váže k heparansulfátu v extracelulární dřeňové matrix (31, 32).
Niky krvetvorných kmenových buněk
Pojem nika kmenové krvetvorné buňky byl poprvé použit Schofieldem v roce 1978 (33), avšak teprve v nedávné době byla pokusy na zvířecích modelech prokázána podpůrná funkce stromálních nik pro hematopoetické kmenové buňky (34). Nika představuje funkční jednotku.
Ve dřeňové dutině existují minimálně 2 druhy nik kmenových krvetvorných buněk: osteoblastická a vaskulární nika. Malá populace kmenových krvetvorných buněk kostní dřeně lemovaná osteoblasty přiléhá k vrstvě endostu kosti. Část těchto osteoblastů („SNO“ buňky, spindle-shaped (vřetenovité), N-cadherin-pozitivní, CD45 negativní) spolupracuje s krvetvornými kmenovými buňkami a pravděpodobně řídí jejich aktivitu a osud. Osteoblasty tvoří krvetvorné růstové faktory, pro které jsou cílem právě kmenové krvetvorné buňky (35). Poslední výzkumy ukazují, že tzv. klidové hematopoetické kmenové buňky přiléhající k osteoblastické nice podstupují buněčné dělení, v němž jedna z dceřiných buněk slouží sebeobnově a zůstává nediferencovaná a druhá dceřiná buňka diferencuje v progenitorové buňky, které se posouvají směrem do centra dřeňové dutiny do oblasti blízké cévní zóně. Tyto progenitorové buňky se vzdalují od periferní endostální oblasti. Cévní zóna ve středu dřeňové dutiny se skládá z tenké sítě fenestrovaných sinusoidálních cév. Toto je v současné době považováno za oblast takzvané vaskulární niky (36). Současné znalosti podporují teorii, že osteoblastická nika udržuje nezralé kmenové krvetvorné buňky v klidovém stadiu a odpovídá za tvorbu progenitorových buněk, zatímco vaskulární nika slouží jako „úložiště“ diferencujících se progenitorových buněk předtím, než jsou uvolněny do periferní cirkulace. Další studie na zvířecích modelech ukazují, že hematopoetické kmenové buňky nemusejí být pouze v oblasti endostu kosti, jsou také nacházeny v blízkosti endoteliálních buněk v kostní dřeni a ve slezině (37). Endotelie krevních sinusoid podporují vyzrávání hematopoetických kmenových buněk a produkují signály nutné pro přežití a rozvoj dřeňových kmenových buněk sloužících k repopulaci (37, 38).
Mikroprostředí kostní dřeně u chronické lymfocytární leukemie
Chronická lymfocytární leukemie (CLL) je onemocnění charakterizované dynamickou rovnováhou mezi buňkami cirkulujícími v periferní krvi a buňkami umístěnými v permisivním mikroprostředí lymfatických orgánů (39). Cirkulující buňky CLL jsou malé zralé lymfocyty odolné proti apoptóze, zatímco buňky umístěné v nikách permisivního mikroprostředí zahrnují prolymfocyty a paraimunoblasty, které mohou proliferovat. Mikroprostředí hostitele ovlivňuje rovnováhu mezi odolností buněk k apoptóze a aktivní proliferací buněk vytvářením různých signálních drah (obr. 1).
Obr. 1. Hypotetický model vysvětlující klíčovou roli mikroprostředí v udržování a progresi chronické lymfocytární leukemie. EC: endothelial cells; Ag: antigen. Podle: Deaglio S, Malavasi F. Haematologica 2009; 94: 752-756. 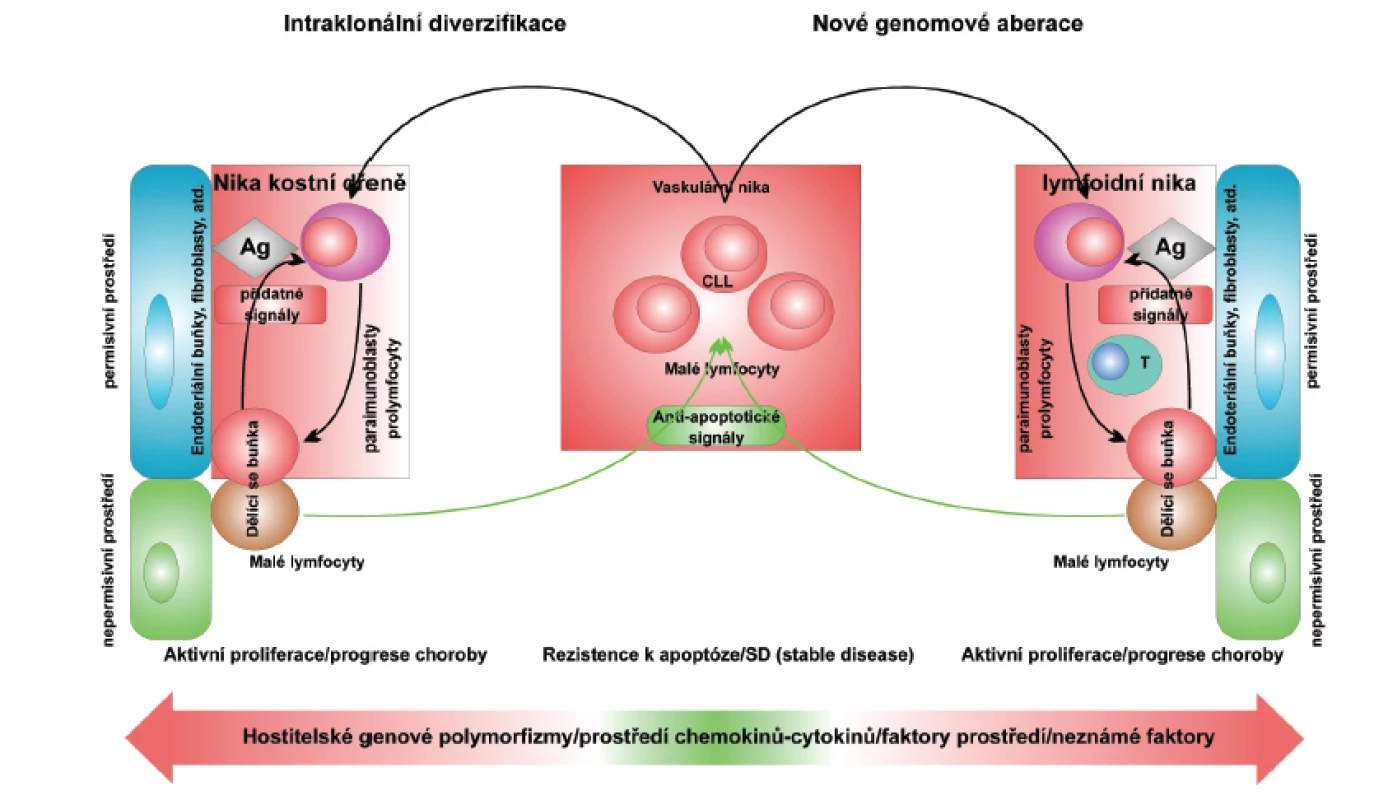
Pro pochopení patogeneze CLL a následně její správnou léčbu je nutné znát molekulární mechanismy a interakce probíhající mezi buňkami CLL, krví, mikroprostředím kostní dřeně, lymfatických uzlin a sleziny. Níže jsou popsány a schematicky zachyceny některé solubilní a buněčně vázané signály regulující interakce mezi buňkami CLL a mikroprostředím (obr. 1).
Receptor CXCR4 je exprimován většinou cirkulujících buněk CLL, nezávisle na molekulárních znacích, klinickém stadiu či procentu infiltrace kostní dřeně. Stromální buňky kostní dřeně a podpůrné (nurse-like) buňky secernují chemokin CXCL12 neboli ligandu CXCR4 receptoru. Osa CXCL12/CXCR4 hraje klíčovou roli v přestupu neoplastických buněk do oblastí pro růst výhodného mikroprostředí (40). Nicméně odpověď vyvolaná vazbou ligandu na CXCR4 receptor se významně liší napříč pacienty s CLL a zdá se, že má vztah k přítomnosti ZAP70 a pozitivitě znaku CD38 (41). Další známou signální drahou je vazba CXCL13 ligandu produkovaného makrofágy kostní dřeně k receptoru CXCR 5 na povrchu CLL buněk (41). Exprese CXCR3 receptoru na povrchu CLL buněk je značně variabilní, ale dlouhodobě stabilní. Pacienti s CLL CXCR3+ mají většinou při stanovení diagnózy pokročilejší stadium choroby, častěji difuzní infiltraci kostní dřeně a tendenci k expresi molekulárních markerů spojených se špatnou prognózou. Buňky CLL jsou značně senzitivní k ligandům receptorů CCL19 a CCL21, jejichž vazba způsobuje zvýšenou transendoteliální migraci oproti normálním B-lymfocytům. CCL19 a CCL21 jsou exprimovány endoteliemi venul v lymfatických uzlinách a celý systém slouží k usnadnění přechodu buněk CLL z cirkulace do lymfatických orgánů (41, 42).
Buňky CLL mohou aktivně secernovat chemokiny, které lákají podpůrné buňky, čímž modifikují mikroprostředí a zlepšují podmínky pro růst buněk.
Mezi solubilní faktory, které řídí rovnováhu mezi stabilitou choroby a progresí, patří malé molekuly s proangiogením potenciálem. Zvýšená angiogeneze je trvale spojována s pokročilejší fází choroby a je známo, že samy buňky CLL mohou secernovat proangiogenní faktory [fibroblastový růstový faktor (FGF), vaskulární endoteliální růstový faktor (VEGF) a angiopoetin (Ang)] a řídit tak novotvorbu cév. Tyto nově vytvořené cévy jsou charakterizovány zvýšenou permeabilitou, čímž přispívají k diseminaci choroby. Buňky CLL mohou také exprimovat receptory pro některé proangiogenní faktory [zahrnující VEGF receptory (VEGFR) 1 a 2 a Tie 2, ligand pro Ang receptor]: převedené signály významně prodlužují buněčné přežití (43).
Buňky CLL ve slezině, lymfatických uzlinách či kostní dřeni nacházejí ideální mikroprostředí pro růst. Antigeny jsou zde přítomny spolu s příslušnou řadou přídatných signálů. Příkladem je CD40L, hojně exprimován T-lymfocyty uvnitř pseudofolikulů, přispívající k proliferaci CD40+ CLL buněk (44). Další signální drahou účastnící se migrace a proliferace CLL buněk je dráha CD31/CD38/ZAP70. Ukazuje se, že CD38 není jen prognostickým ukazatelem u CLL, ale adhezní molekulou a receptorem (s ligandem CD31) prodlužujícím přežití maligních lymfocytů. ZAP-70 je funkčně spojen se systémem DC38. ZAP70+/CD38+ lymfocyty mají zvýšenou tendenci k migraci do výhodného mikroprostředí po stimulaci CXCL12. Zdá se tedy, že v signální dráze CD31/CD38/ZAP70 se spojují proliferační a migrační signály. K aktivaci ZAP70 vedou také signály z B-buněčného receptoru (BCR) po stimulaci (auto)antigenem. Molekula CD49d se váže na VCAM-1 (vascular cell adhesion molecule-1) v proliferačních centrech, což vede ke zvýšení viability CLL buněk (45).
Mikroprostředí kostní dřeně, lymfatických uzlin a sleziny hraje zásadní roli v patogenezi CLL. Interakce leukemických buněk s T-lymfocyty, stromálními buňkami, endoteliemi a dendritickými buňkami pomocí přímých mezibuněčných kontaktů či solubilních signálních molekul usnadňují migraci CLL buněk do prostředí, v němž jsou chráněny proti apoptóze a zvýšeně proliferují. Angiogeneze se podílí na rozvoji a progresi onemocnění zajištěním dostatečného přísunu živin, ochranou proti apoptóze i dalšími mechanismy (46).
Mikroprostředí kostní dřeně u chronické myeloidní leukemie
Chronická myeloidní leukemie (CML) je onemocnění hematopoetické kmenové buňky charakterizované přítomností Filadelfského chromozomu.
Na Filadelfském chromozomu se nachází BCR-ABL onkogen. Chromozom vzniká reciprokou translokací chromozomu 9 a 22 (t(922)(q34q11)) (47,48), je typickou cytogenetickou abnormalitou CML a je identifikován u více než 90 % případů tohoto onemocnění. Expresí BCR-ABL onkogenu vzniká chimerický bcr-abl protein s deregulovanou tyrozin kinázovou aktivitou, který je nezbytný a dostačující pro patogenezi CML (49). Onkoprotein bcr-abl je rozšířen v cytoplazmě a interaguje s různými proteiny zahrnutými v procesu přenosu signálů, což vede k deregulaci proliferace, diferenciace a přežívání (50).
Tyrozin kinázové inhibitory (TKI) jsou velmi účinnými léčivými přípravky v terapii CML schopnými navodit hematologickou a cytogenetickou remisi onemocnění. Neúspěch TKI v eliminaci minimální zbytkové choroby (MRD) je přisuzován přítomnosti tzv. „kmenových buněk CML“ v kompartmentu kostní dřeně, které vedou k relapsu onemocnění (51). Kmenové buňky CML jsou rezistentní k TKI proto, že jsou převážně ve fázi klidového stavu v rámci buněčného cyklu a TKI potřebují k navození buněčné smrti aktivně probíhající buněčný cyklus (52). Tento mechanismus byl demonstrován in vitro studií, kdy u klidových imatinib mesylát (IM) rezistentních CML buněk byla navozena citlivost k IM indukcí buněčného cyklu (53). U kmenových CML buněk byla prokázána snížená hladina transportéru OCT-1 (organic cation transporter-1), který aktivně vychytává molekuly IM do intracelulárního prostředí, a naopak zvýšená hladina povrchových molekul odpovídajících za zvýšené vylučování léčiv z intracelulárního prostředí včetně transportérů MDR1 (mnohočetná léková resistence 1) (54, 55), což jsou další mechanismy zvyšující rezistenci CML kmenových buněk vůči TKI. V průběhu léčby TKI dochází i ke vzniku mutací v BCR-ABL onkogenu, které dávají vzniknout bcr-abl kinázám rezistentním k TKI. Tyto rezistentní bcr-abl kinázy jsou selektovány v CML kmenové buňce, což vede k následné rezistenci CML kmenových buněk k TKI. Ito a kol. prokázali zlepšení ve výsledcích léčby CML navozením buněčného cyklu u klidových nádorových buněk oxidativním stresem způsobeným užitím oxidu arzenitého (As2O3) (56). V této studii se počet klidových leukemických buněk signifikantně snížil a navíc do buněčného cyklu vstoupila většina kmenových buněk ve srovnání s normálními kmenovými buňkami podstupujícími léčbu oxidem arzenitým. Oxidativní stres nerozlišuje mezi normálními kmenovými hematopoetickými buňkami a kmenovými buňkami CML. Proto je do budoucna příslibem cílená léčba zahrnující konjugaci oxidativního stresu s protilátkami specificky rozpoznávajícími kmenové buňky CML. Kandidáty této cílené terapie by mohly být receptory interleukinu 3 (IL-3), které jsou vysokou měrou exprimovány na leukemických kmenových buňkách, zatímco na povrchu normálních hematopoetických kmenových buněk jsou detekovány velmi zřídka (57).
Paget ve své hypotéze „semínka a úrodné půdy“ navrhl koncept, že mikroprostředí rozvíjejícího se nádoru je zásadním regulátorem růstu tumoru (58). To platí i pro CML. U CML byly prokázány určité abnormality ve složení stromatu kostní dřeně, které má sníženou schopnost podporovat růst normálních progenitorů (59), zatímco růst CML progenitorů v kontaktu s tímto CML stromatem byl nepoškozený, což ukazuje, že abnormální interakce mezi buňkami CML a stromatem hrají zásadní úlohu v podpoře přežívání nádorových buněk a udržování minimální reziduální choroby. Leukemické buňky vytvářejí abnormální stromální niky vylučováním SCF (stromální buněčný faktor). Vysoké koncentrace SCF směřují normální hematopoetické kmenové buňky k uhnízdění do těchto abnormálních nik, což vede k narušení rovnováhy v udržování stabilní populace a sebeobnovy hematopoetických kmenových buněk (HSC) (60). Další typ niky je v kostní dřeni vytvořen díky stromálním buňkám (především mezenchymálním kmenovým buňkám), které vylučují chemokin CXCL12 (61). Cirkulující buňky CML včetně kmenových buněk CML exprimují molekulu CXCR4, která je receptorem pro ligandu CXCL12 (62, 63). Buňky CML využívají tento receptor pro usídlení v kostní dřeni, a takto obcházejí buněčnou smrt navozenou TKI. Důkaz o tom, že mezenchymální kmenové buňky v kostní dření chrání a zachovávají CML progenitory od buněčné smrti indukované IM cestou CXCR4-CXCL12 osy, podali Vianello a kol. (64). Přeměnou stromatu kostní dřeně kontrolují buňky CML populaci a osud normálních kmenových buněk.
Osa CXCR4-CXCL12 je hlavním migračním mechanismem buněk CML sloužící k uhnízdění v kostní dřeni. Užití antagonistů CXCR4 nabízí cestu jak mobilizovat CML buňky z kostní dřeně a tím je vystavit působení TKI. Jedním z těchto antagonistů je AMD3100, který obnovil citlivost progenitorových buněk CML k buněčné smrti navozené IM (65, 66). A navíc léčbou AMD3100 byla významně snížena masa CML progenitorů v kostní dřeni (65). Další studie zkoumající účinky kombinace TKI a inhibitorů osy CXCR4-CXCR12 ale musí být provedeny před zahájením užívání této kombinace v klinické praxi.
TKI jsou důkazem, že současná cílená molekulární terapie je účinná v navození kompletní hematologické a cytogenetické odpovědi u vysokého procenta pacientů, avšak existuje stále problém rezistence a intolerance k těmto preparátům (66). U většiny pacientů je možné i přes léčbu detekovat minimální zbytkovou chorobu v mikroprostředí kostní dřeně. Tato klinická pozorování svědčí o tom, že v mikroprostředí existují signální dráhy podporující přežití nádorových buněk. Experimenty ukazují, že působení solubilních faktorů kostní dřeně nebo extracelulární matrix může u nádorových buněk navodit vznik fenotypu mnohočetné lékové rezistence. Tato data vedou k úvahám, že zacílení léčby právě na tyto buněčné pochody by mohlo vést ke zvýšení účinku dosud používané chemoterapie.
Závěr
Porozumění roli mikroprostředí v patogenezi leukemií i dalších nádorových onemocnění by mohlo přispět k racionalizaci a individualizaci léčby a k pochopení výhod užívání kombinací určitých léčivých přípravků.
Poděkování
Autoři děkují panu Michalu Hodovskému za pomoc s přípravou obrázků.
Práce byla podpořena Českou leukemickou skupinou – pro život (CELL).
MUDr. Eva Létalová
Interní hematoonkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
Doručeno do redakce: 9. 6. 2011
Přijato po recenzi: 12. 9. 2011
Zdroje
1. Greer JP, Foerster J, Rodgers GM, Paraskevas F, Glader B, Arber DA, Means RT (Eds.). Wintrobeęs clinical hematology. 12th edition. Vol. 1. Wolters Kluwer/Lippincot Williams & Wilkins, Philadelphia 2009; 1329 s.
2. Yoder MC, Williams DA. Matrix molecule interactions with hematopoietic stem cells. Exp Hematol 1995; 23 : 961-967.
3. Bentley SA. Collagen synthesis by bone marrow stromal cells: a quantitative study. Br J Haematol 1982; 50 : 491-497.
4. Gay RE, Prince CW, Zuckerman KS, et al. The collagenous hemopoietic microenvironment. Humana Press, Clifton 1989; 369-398.
5. Williams DA, Rios M. Stephens C, et al. Fibronectin and VLA-4 in haematopoietic stem cell-microenvironment interactions. Nature 1991; 352 : 438-441.
6. Russell ES. Hereditary anemias of the mouse: a review for geneticists. Adv Genet 1979; 20 : 357-459.
7. Tavassoli M, Hardy CL. Molecular basis of homing of intravenously transplanted stem cells to the bone marrow. Blood 1990; 76 : 1059-1070.
8. Bouvard D, Brakebusch C, Gustafsson E, et al. Functional consequences of integrin gene mutations in mice. Circ Res 2001;89 : 211-223.
9. Levesque JP, Simmons PJ. Cytoskeleton and integrin-mediated adhesion signaling in human CD 34+ hemopoietic progenitor cells. Exp Hematol 1999; 27 : 579-586.
10. Scott LM, Priestley GV, Papayannopoulou T. Deletion of alpha4 integrins from adult hematopoietic cells reveals roles in homeostasis, regeneration, and homing. Mol Cell Biol 2003; 23 : 9349-9360.
11. Papayannopoulou T, Nakamoto B, Peripheralization of hemopoietic progenitors in primates treated with anti-VLA4 integrin. Proc Natl Acad Sci USA 1993; 90 : 9374-9378.
12. Papayannopoulou T, Priestley GV Nakamoto B, Anti-VLA4/VCAM-1-induced mobilization requires cooperative signaling through the kit/mkit ligandparhway. Blood 1998; 91 : 2231-2239.
13. Papayannopoulou T, Craddock C, Nakamoto B, et al. The VLA4/VCAM-1 adhesion pathway defines contrasting mechanisms of lodgement of transplanted murine hemopoietic progenitors between bone marrow and spleen. Proc Natl Acad Sci USA 1995;92 : 9647-9651.
14. Zanjani EC, Flake AW, Almeida-Porada G, et al. Homing of human cells in the fetal sheep model: modulation by antibodies activating or inhibiting very late activation antigen-4-dependent function. Blood 1999;94 : 2515-2522.
15. Delforge M, Raets V, Van Duppen V, et al. CD34+ marrow progenitors from MDS patients with high levels of intramedullary apoptosis have reduced expression of alpha2beta1 and alpha5beta1 integrins. Leukemia 2005; 19 : 57-63.
16. Koni PA, Joshi SK, Temann UA, et al. Conditional vascular cell adhesion molecule 1 deletion in mice: impaired lymphocyte migration to bone marrow. J Exp Med 2001; 193 : 741-754.
17. Leuker CE, Labow M, Muller W, et al. Neonatally induced inactivation of the vascular cell adhesion molecule 1 gene impairs B cell localization and T cell-dependent humoral immune response. J Exp Med 2001; 193 : 755-768.
18. Fox NE, Kaushansky K. Engagement of integrin alpha 4beta1 enhances thrombopoietin-induced megakaryopoiesis. Exp Hematol 2005; 33 : 94-99.
19. Etzioni A, Doerschuk CM, Harlan JM. Of man and mouse: leukocyte and endothelial adhesion molecule deficiencies. Blood 1999; 94 : 3281-3288.
20. Greenberg AW, Kerr WG, Hammer DA. Relationship between selectin-mediated rolling of hematopoietic stem and progenitor cells and progression in hematopoietic development. Blood 2000; 95 : 478-486.
21. Naiyer Aj, Jo DY, Ahm J, et al. Stromal derived factor-1-induced chemokinesis of cord blood CD34(+) cells (long-term culture-initiating cells) through endothelial cells is mediated by E-selectin. Blood 1999; 94 : 4011-4019.
22. Aiuti A, Webb IJ, Bleul C, et al. The chemokine SDF-1 is a chemoattractant for human CD 34+ hematopoietic progenitor cells and provides a new mechanism to explain the mobilization of CD 34+ progenitors to peripheral blood. J Exp Med 1997; 185 : 111-120.
23. Wright DE, Bowman EP, Wagers AJ, et al. Hematopoietic stem cells are uniquely selective in their migratory response to chemokines. J Exp Med 2002; 195 : 1145-1154.
24. Nagasawa T, Hirota S, Tachibana K, et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 1996; 382 : 635-638.
25. Zou YR, Kottmann AH, Kuroda M, et al. Function of the chemokine receptor CXCR4 in haematopoiesis and in cerebellar development. Nature 1998; 393 : 595-599.
26. Uhlman DL, Luikhart SD. The role of proteoglycans in the adhesion and differentiation of hematopoietic cells. In: Long MW, Wicha MS, eds. The hematopoietic microenvironment. Baltimore: The Johns Hopkins University Press, 1993 : 232-245.
27. Wight TN, Kinsella MG, Keating A, et al. Proteoglycans in human long-term bone marrow cultures: biochemical and ultracstructural analyses. Blood 1986; 67 : 1333-1343.
28. Siczkowski M, Clarke D, Gordon MY. Binding of primitive hematopoietic progenitor cells to marrow stromal cells involves heparan sulfate. Blood 1992;80 : 912-919.
29. Minguell JJ, Hard C, Tavassoli M. Membrane-associated chondroitin sulfate proteoglycan and fibronectin mediate the binding of hemopoietic progenitor cells to stromal cells. Exp Cell Res 1992; 201 : 200-207.
30. Bruno E, Luikart SD, Long MW, et al. Marrow-derived heparan sulfate proteoglycan mediates the adhesion of hematopoietic progenitor cells to cytokines. Exp Hematol 1995; 23 : 1212-1217.
31. Gordon MY, Riley GP, Watt SM, et al. Compartmentalization of a haematopoietic growth factor (GM-CSF) by glycosaminoglycans in the bone marrow microenvironment. Nature 1987; 326 : 403-405.
32. Roberts R, Gallagher J, Spooncer E, et al. Heparan sulphate bound growth factors a mechanism for stromal cell mediated haemopoiesis. Nature 1988; 332 : 376-378.
33. Schofield R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells 1978; 4 : 7-25.
34. Yin T, Li L. The stem cell niches in bone. J Clin Invest 2006; 116 : 1195-1201.
35. Taichman RS, Reálky MJ, Emerson SG. Human osteoblasts support human hematopoietic progenitor cells in vitro bone marrow cultures. Blood 1996; 87 : 518-524.
36. Kopp HG, Avecilla ST, Hooper AT, et al. The bone marrow vascular niche: home of HSC differentiation and mobilization. Physiology (Bethesda) 2005; 20 : 349-356.
37. Kiel MJ, Yilmaz OH, Iwashita T, et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and repeal endothelial niches for stem cells. Cell 2005; 121 : 1109-1121.
38. Chute JP, Saini AA, Chute DJ, et al. Ex vivo culture with human brain endothelial cells increases the SCID-repopulating capacity of adult human bone marrow. Blood 2002; 100 : 4433-4439.
39. Caligaris-Cappio F, Ghia P. Novel insights in chronic lymphocytic leukemia: are we getting closer to understanding the pathogenesis of the disease? J Clin Oncol 2008; 26 : 4497-4503.
40. Burger JA, Kipps TJ. CXCR4: a key receptor in the crosstalk between tumor cells and their microenvironment. Blood 2006; 107 : 1761-1767.
41. Burkle A, Niedermeier M, Schmitt-Graff A, Wierda WG, Keating MJ, Burger JA. Overexpression of the CXCR5 chemokine receptor, and its ligand, CXCL13 in B-cell chronic lymphocytic leukemia. Blood 2007; 110 : 3316-3325.
42. Till KJ, Lin K, Zuzel M, Cawley JC. The chemokine receptor CCR7 and alpha4 integrin are important for migration of chronic lymphocytic leukemia cells into lymph nodes. Blood 2002; 99 : 2977-2984.
43. Letilovic T, Vrhovac R, Verstovsek S, Jaksic B, Ferrajoli A. Role of angiogenesis in chronic lymphocytic leukemia. Cancer 2006; 107 : 925-934.
44. von Bergwelt-Baildon M, Maecker B, Schultze J, Gribben JG. CD40 activation: potential for specific immunotherapy in B-CLL. Ann Oncol 2004; 15 : 853-857.
45. Zucchetto A, Benedetti D, Tripodo C, et al. CD38/CD31, the CCL3 and CCL4 chemokines, and CD49d/VCAM-1 are interchained by sequential events sustaining chronic lymphocytic leukemia cell survival. Cancer Res 2009; 69 : 4001-4009.
46. Smolej L. Význam mikroprostředí u chronické lymfocytární leukemie. Transfuze Hematol dnes 2010; 16(suppl. 1): 24-28.
47. Spangrude GJ, Heimfeld S, Weissman IL. Purification and characterization of mouse hematopoietic stem cells. Science 1988; 241 : 58-62.
48. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from primitive hematopoietic cells. Nat Med 1997; 3 : 730-737.
49. Lapidot T, Sirard C, Vormoor J, et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature 1994; 367 : 645-648.
50. Cozzio A, Passegue E, Ayton PM, Karsunky H, Cleary ML, Weissman IL. Similar MLL-associated leukemias arising from self-renewing stem cells and short-lived myeloid progenitors. Genes Dev 2003; 17 : 3029-3035.
51. Krivtsov AV, Twomey D, Feng Z, et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature 2006; 442 : 818-822.
52. Huntly BJ, Shigematsu H, Deguchi K, et al. MOZ-TIF2, but not BCR-ABL, confers properties of leukemic stem cells to committed murine hematopoietic progenitors. Cancer Cell 2004; 6 : 587-596.
53. Rombouts EJ, Pavic B, Lowenberg B, Ploemacher RE. Relation between CXCR-4 expression, Flt3 mutations, and unfavorable prognosis of adult acute myeloid leukemia. Blood 2004; 104 : 550-557.
54. Spoo AC, Lubbert M, Wierda WG, Burger JA. CXCR4 is a prognostic marker in acute myelogenous leukemia. Blood 2007; 109 : 786-791.
55. Somervaille TC, Cleary ML. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell 2006; 10 : 257-268.
56. Krause DS, Lazarides K, von Andrian UH, Van Etten RA. Requirement for CD44 in homing and engraftment of BCR-ABL-expressing leukemic stem cells. Nat Med 2006; 12 : 1175-1180.
57. Florian S, Sonneck K, Hauswirth AW, et al. Detection of molecular targets on the surface of CD34+/CD38 - stem cells in various myeloid malignancies. Leuk Lymphoma 2006; 47 : 207-222.
58. Paget S. The distribution of secondary growths in cancer of the breast. 1889. Cancer Metastasis Rev 1989; 8 : 98-101.
59. Bhatia R, McGlave PB, Dewald GW, Blazar BR, Verfaillie CM. Abnormal function of the bone marrow microenvironment in chronic myelogenous leukemia: role of malignant stromal macrophages. Blood 1995; 85 : 3636-3645.
60. Colmone A, Amorim M, Pontier AL, Wang S, Jablonski E, Sipkins DA. Leukemic cells create bone marrow niches that disrupt the behavior of normal hematopoietic progenitor cells. Science 2008; 322 : 1861-1865.
61. Sugiyama T, Kohara H, Noda M, Nagasawa T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches Immunity 2006; 25 : 977-988.
62. Oberlin E, Amara A, Bachelerie F, et al. The CXC chemokine SDF-1 is the ligand for LESTR/fusin and prevents infection by T-cell-line-adapted HIV-1. Nature 1996; 382 : 833-835.
63. Peled A, Petit I, Kollet O, et al. Dependence of human stem cell engraftment and repopulation of NOD/SCID mice on CXCR4. Science 1999; 283 : 845-848.
64. Vianello F, Villanova F, Tisato V, et al. Bone marrow mesenchymal stromal cells non-selectively protect chronic myeloid leukemia cells from imatinib-induced apoptosis via the CXCR4/CXCL12 axis. Haematologica 2010; 95 : 1081-1089.
65. Dillmann F, Veldwijk MR, Laufs S, et al. Plerixafor inhibits chemotaxis toward SDF-1 and CXCR4-mediated stroma contact in a dose-dependent manner resulting in increased susceptibility of BCR-ABL+ cell to Imatinib and Nilotinib. Leuk Lymphoma 2009; 50 : 1676-1686.
66. Nair RR, Tolentino J, Hazlehurst LA. The bone marrow microenvironment as a sanctuary for minimal residual disease in CML. Biochem Pharmacol 2010; 80 : 602-612.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Odběry dárcovských lymfocytů od nepříbuzných dárců Českého národního registru dárců dřeně (ČNRDD) v letech 1999 – 2010
- Mikroprostředí kostní dřeně a jeho role v patogenezi leukemií
- Sérové hladiny volných lehkých řetězců imunoglobulinu u monoklonální gamapatie nejistého významu a jejich přínos pro stratifikaci a sledování
- Pracovní dny v transfuzním lékařství
- 13. pracovní dny v transfuzním lékařství, celostátní konference s mezinárodní účastí spojená s 4. česko-německým transfuzním dnem, 5. střešovickým transfuzním dnem a postgraduálním kurzem v terapeutických aferézách
- Podávání transfuzních přípravků v pediatrii a neonatologii
- Přehled produkce transfuzní služby ČR za rok 2010 (transfuzní přípravky i plazma pro frakcionaci)
- Autotransfuze v České republice v roce 2010
- Vybrané odborné akce v roce 2012
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2010.
- Životní jubileum MUDr. Vladimír Veselý, CSc.
- OBSAH ROČNÍKU 17/2011 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Podávání transfuzních přípravků v pediatrii a neonatologii
- Mikroprostředí kostní dřeně a jeho role v patogenezi leukemií
- Odběry dárcovských lymfocytů od nepříbuzných dárců Českého národního registru dárců dřeně (ČNRDD) v letech 1999 – 2010
- Životní jubileum MUDr. Vladimír Veselý, CSc.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



