-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Může vyšetření lymfatických uzlin metodou One-Step Nucleic Acid Amplification zpřesnit staging plicních nádorů?
Can the One-Step Nucleic Acid Amplification method of lymph nodes examination make the staging of pulmonary tumours more precise?
Introduction:
The aim of this article is to compare the sensitivity of detecting micrometastases in hilar and mediastinal lymph nodes in case of primary (non-small cell) and secondary (metastases of colorectal carcinoma) pulmonary tumours using standard histopathological examination with haematoxylin-eosin staining, immunohistochemistry examination with Anti-Cytokeratin 19 antibody and examination based on the One-Step Nucleic Acid Amplification method.
Method:
During radical surgical treatment of primary non-small cell lung carcinoma and pulmonary metastases of colorectal carcinoma, hilar and mediastinal lymph nodes of 100 patients enrolled in the study in the period from 2015 to 2017 were extracted based on a standard classification. These lymph nodes were subsequently divided along the longitudinal axis into 4 identical parts where part one and three on the left were intended for examination based on the One-Step Nucleic Acid Amplification method, whereas parts two and four were subjected to histopathological examination. In evaluating the respective parts of the nodes by histological examination, the nodes were first examined by a standard procedure that involves haematoxylin-eosin staining, followed by immunohistochemistry examination with Anti-Cytokeratin 19 antibody. The One-Step Nucleic Acid Amplification method was performed in the kit supplied by Sysmex (Kobe, Japan) and is based on the detection of cytokeratin 19 mRNA (messenger ribonucleic acid) by reverse transcription coupled with isothermal amplification.
Results:
A total of 1,426 lymph nodes of the patients enrolled in the study were extracted and examined using the above mentioned methodology. In 78 patients (78%), identical results were obtained using haematoxylin-eosin staining, immunohistochemistry with Anti-Cytokeratin 19 and One-Step Nucleic Acid Amplification. Micrometastases in the lymph nodes using the One-Step Nucleic Acid Amplification method in the absence of the other methods were proven in 16 patients (16%). Only in 3 cases (3%), the examination by haematoxylin-eosin staining, or immunohistochemistry with Anti-Cytokeratin 19, was positive while One-Step Nucleic Acid Amplification was negative. The results obtained by immunohistochemistry with Anti-Cytokeratin 19 antibody were practically the same as those obtained by haematoxylin-eosin staining (97%).
Conclusion:
The results of the study have demonstrated a higher percentage of metastases detected in hilar and mediastinal lymph nodes if the One-Step Nucleic Acid Amplification method of examination was used compared to haematoxylin-eosin staining and immunohistochemistry with Anti-Cytokeratin 19 antibody (upstaging in 16%). This shows that the examination of lymph nodes using the One-Step Nucleic Acid Amplification method can have a certain potential to make the pulmonary tumours staging more accurate. On the other hand, immunohistochemistry with Anti-Cytokeratin 19 antibody seems to be not so useful. However, it is necessary to prove this hypothesis in follow-up studies, or where applicable, in a larger cohort of patients. Another task is to ascertain, by careful patient monitoring, the influence of the micrometastases detected in their lymph nodes using the One-Step Nucleic Acid Amplification method on these patients’ follow-up.
Key words:
lung cancer – lymph nodes – H&E – IHC CK19 – OSNA assay
Autoři: J. Vodička 1; Š. Vejvodová 1; M. Pešta 2,6; P. Mukenšnabl 3; V. Špidlen 1; V. Kulda 4; K. Houfková 2; O. Topolčan 5
Působiště autorů: Chirurgická klinika, Univerzita Karlova, Lékařská fakulta v Plzni, Fakultní nemocnice Plzeň 1; Ústav biologie, Univerzita Karlova, Lékařská fakulta v Plzni 2; Šiklův ústav patologie, Univerzita Karlova, Lékařská fakulta v Plzni, Fakultní nemocnice Plzeň 3; Ústav lékařské chemie a biochemie, Univerzita Karlova, Lékařská fakulta v Plzni 4; Oddělení nukleární medicíny – centrální laboratoř pro imunoanalýzu, Fakultní nemocnice Plzeň 5; Biomedicínské centrum, Univerzita Karlova, Lékařská fakulta v Plzni 6
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 8, s. 373-378.
Kategorie: Původní práce
Souhrn
Úvod:
Cílem práce je porovnání senzitivity detekce mikrometastáz v hilových a mediastinálních lymfatických uzlinách primárních (nemalobuněčných) a sekundárních (metastázy kolorektálního karcinomu) nádorů plic pomocí standardního histopatologického vyšetření v barvení hematoxylin-eosin, imunohistochemického vyšetření s protilátkou proti cytokeratinu 19 a metodou One-Step Nucleic Acid Amplification.
Metoda:
Při radikální chirurgické léčbě nemalobuněčných primárních plicních karcinomů a metastáz kolorektálního karcinomu byly u 100 pacientů zařazených do studie v období 2015–2017 podle standardního schématu odebrány hilové a mediastinální lymfatické uzliny. Tyto uzliny pak byly v podélné ose děleny na 4 stejné části, přičemž část první a třetí zleva byla určena k vyšetření metodou One-Step Nucleic Acid Amplification, část druhá a čtvrtá k histologickému vyšetření. Při histologickém vyšetření byly příslušné části uzlin nejprve vyšetřeny standardním postupem v barvení hematoxylin-eosin a následně pak i imunohistochemicky s protilátkou proti cytokeratinu 19. Metoda One-Step Nucleic Acid Amplification byla prováděna soupravou firmy Sysmex (Kobe, Japonsko), jejím principem je detekce mRNA (messenger ribonucleic acid) cytokeratinu 19 reverzní transkripcí spojenou s izotermickou amplifikací.
Výsledky:
Celkem bylo nemocným zařazeným do studie odebráno a uvedenou metodikou vyšetřeno 1426 lymfatických uzlin. Shodné výsledky vyšetření hematoxylinem-eosinem, imunohistochemií s protilátkou proti cytokeratinu 19 a One-Step Nucleic Acid Amplification byly zaznamenány u 78 nemocných (78 %). Mikrometastázy v lymfatických uzlinách byly metodou One-Step Nucleic Acid Amplification při negativitě ostatních metod prokázány u 16 pacientů (16 %). Pouze ve 3 případech (3 %) bylo vyšetření hematoxylinem-eosinem, resp. imunohistochemií s protilátkou proti cytokeratinu 19 pozitivní při negativitě metody One-Step Nucleic Acid Amplification. Výsledky imunohistochemie s protilátkou proti cytokeratinu 19 prakticky přesně kopírovaly výsledky vyšetření hematoxylinem-eosinem (97 %).
Závěr:
Výsledky studie prokázaly vyšší procento detekovaných mikrometastáz v hilových a mediastinálních lymfatických uzlinách při vyšetření metodou One-Step Nucleic Acid Amplification ve srovnání s hematoxylinem-eosinem a imunohistochemií s protilátkou proti cytokeratinu 19 (upstaging 16 %). Ukazuje se tak, že vyšetření lymfatických uzlin pomocí metody One-Step Nucleic Acid Amplification může mít určitý potenciál zpřesnit staging plicních nádorů, naopak imunohistochemie s protilátkou proti cytokeratinu 19 změny stagingu téměř nepřináší. Je však nezbytné potvrdit tento předpoklad v dalších studiích, resp. na větším souboru nemocných. Dalším úkolem je také pečlivým sledováním nemocných zjistit souvislost mikrometastáz detekovaných v lymfatických uzlinách metodou One-Step Nucleic Acid Amplification s jejich follow-up.
Klíčová slova:
karcinom plic – lymfatické uzliny – H&E – IHC CK19 – OSNA
Úvod
Detekce nádorových buněk v hilových a mediastinálních lymfatických uzlinách (LU) u nemocných s primárními a sekundárními nádory plic je v současné době limitována možnostmi standardních histopatologických metod. Možnými cestami zvýšení detekce mikrometastáz v regionálních LU mohou být jednak průkaz nádorových buněk imunohistochemickým vyšetřením s protilátkou proti cytokeratinu 19 (IHC CK19), jednak molekulárně genetická metoda OSNA (One-Step Nucleic Acid Amplification), která detekuje mRNA CK19 (messenger ribonucleic acid cytokeratinu 19). Cytokeratin 19 (CK19) je intermediální filamentum cytoskeletu epiteliálních buněk, které je přítomno jak v normálních epiteliálních buňkách, tak v buňkách epiteliálních tumorů a jejich metastáz, nikoli ale v LU. Průkaz CK19 nebo mRNA pro CK19 v LU je tak ukazatelem jejich metastatického postižení nádorovými buňkami epiteliálního původu [1–3].
Hlavním cílem níže prezentované prospektivní studie bylo ověření možnosti zpřesnění patologické TNM (pTNM) klasifikace primárních a sekundárních plicních nádorů senzitivnější detekcí mikrometastáz v LU prostřednictvím IHC CK19 a metody OSNA ve srovnání se standardním histopatologickým vyšetřením hematoxylinem-eosinem (H&E).
Metoda
Soubor pacientů
Do prospektivní studie probíhající v období let 2015 až 2017 byli zařazeni pacienti s operabilním nemalobuněčným plicním karcinomem (NSCLC) a plicními metastázami kolorektálního karcinomu, tj. s nádory, u kterých již byla prokázána exprese CK19 [1]. Soubor, jehož bližší charakteristiky uvádí Tab. 1, tvořilo 100 pacientů.
Tab. 1. Charakteristiky souboru
Tab. 1: Patient characteristics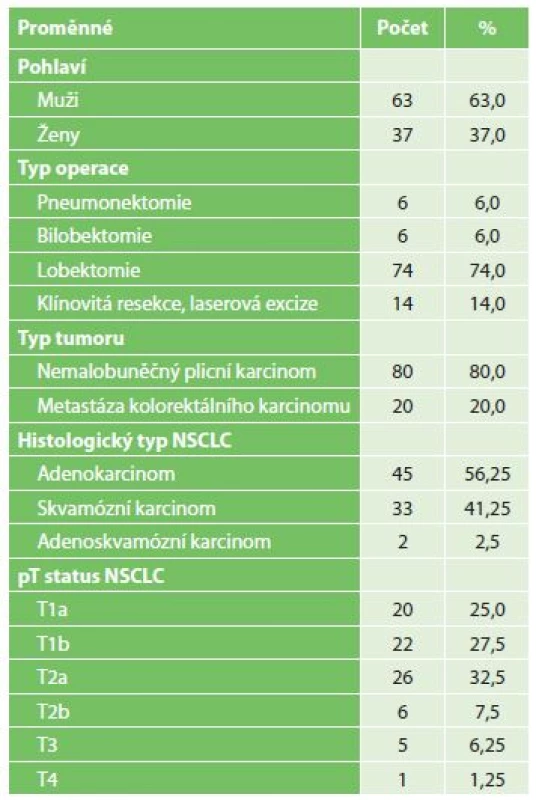
Vysvětlivka: NSCLC – nemalobuněčný plicní karcinom Operační postup
Operačním přístupem byla vždy posterolaterální torakotomie. Rozsah výkonu se odvíjel od typu nádoru, jeho velikosti a lokalizace a v případě metastáz i od jejich počtu. Při NSCLC byla standardním výkonem anatomická plicní resekce v rozsahu lobektomie, bilobektomie či pneumonektomie. Plicní metastázy byly odstraňovány buď klínovitou resekcí (na svorce, staplerem), nebo precizní laserovou excizí pomocí Nd:YAG laseru MY 40 1.3 o vlnové délce laserového paprsku 1318 nm. Nedílnou součástí každé operace byla systematická hilová a mediastinální lymfadenektomie (SMLA) podle zavedeného schématu The International Association for the Study of Lung Cancer (IASLC) z roku 2009 [4].
Zpracování lymfatických uzlin
LU byly ihned po odebrání v podélné ose děleny na 4 stejné části, přičemž část první a třetí zleva byly určeny k vyšetření metodou OSNA, část druhá a čtvrtá k H&E, resp. IHC CK19. Velmi malé LU byly v podélné ose pouze půleny, jedna polovina analogicky připadla k vyšetření metodou OSNA, druhá k H&E, resp. IHC CK19. Dělení vyšetřovaných LU je standardním postupem a je dáno technologií zpracování LU pro jednotlivá vyšetření, kdy vyšetření jednou metodou vylučuje jejich následné použití pro metodu druhou [5,6−9]. Z metodických důvodů byly části LU určené k vyšetření metodou OSNA sloučeny vždy v rámci jedné uzlinové zóny (dle schématu IASLC 2009) do jednoho vyšetření.
Histopatologické a imunohistochemické vyšetření
Při histopatologickém vyšetření byly z příslušných částí LU připraveny standardním způsobem tkáňové bločky, z nichž se pak zhotovily 3−4 µm tenké histologické řezy, které se následně obarvily základním histologickým barvením hematoxylin-eosin. Takto připravené řezy pak byly hodnoceny mikroskopicky. Po provedení tohoto základního histopatologického vyšetření byly vzorky vyšetřeny imunohistochemicky s protilátkou CK19.
Metoda OSNA
Při vyšetření metodou OSNA byly příslušné části LU zpracovány v několika krocích podle pokynů výrobce diagnostické soupravy LYNOAMP BC OSNA (Sysmex, Kobe, Japonsko). Vlastní stanovení přítomnosti mRNA CK19, resp. počtu jejích kopií, jakožto markeru epiteliálních buněk, bylo provedeno v přístroji RD100i. Detekce mRNA CK19 spočívá v současné reverzní transkripci (RT) a amplifikaci pomocí 3 párů primerů při teplotě 65 °C metodou LAMP (Loop Mediated Isothermal Amplification). Každá analýza skupiny LU obsahovala maximálně 600 mg tkáně. V případě větší hmotnosti byla tkáň LU rozdělena na vzorky do 600 mg. Průměrná hmotnost analyzované skupiny LU byla 310 mg, nejmenší LU vážila 20 mg, nejtěžší 4,46 g a byla rozdělena na části o hmotnosti do 600 mg. Uvedený postup respektuje firemní manuál LYNOAMP BC OSNA. Diagnostická souprava obsahuje pro každý test pozitivní a negativní kontrolu, má certifikaci in vitro diagnostických prostředků (IVD). Výsledek reakce umožňuje určit nepřítomnost nádorových buněk (cut off <250 kopií mRNA CK19/µl), přítomnost mikrometastázy (cut off 250−5000 kopií mRNA CK19/µl) nebo makrometastázy (cut off >5000 kopií mRNA CK19/µl). Hodnoty cut off byly stanoveny dle firemního manuálu LYNOAMP BC OSNA a byly použity v předchozích studiích detekce nádorových buněk v LU pacientů s nádory plic [5,7,10−12].
Statistická analýza
Základní deskriptivní statistika byla provedena na základě klinicko-patologických dat pacientů, kteří souhlasili se vstupem do studie. Pro porovnání metod byly použity Vennovy diagramy.
Výsledky
Celkem bylo při 100 radikálních operacích odebráno během SMLA 1426 LU při průměru 14,3 LU na osobu (5−32 LU). Shodných výsledků vyšetření LU metodami H&E, IHC CK19 a OSNA bylo v našem souboru dosaženo u 78 osob (78 %), z toho negativních u 59 osob, pozitivních ve smyslu metastatického postižení LU u 19 osob. Zaznamenali jsme 16 případů (16 %) pozitivních nálezů při vyšetření metodou OSNA, které byly H&E i IHC CK19 negativní. Ve 3 případech (3 %) byla vyšetření H&E a IHC CK19 pozitivní při negativitě metody OSNA. Shodně po jednom případu (vždy 1 %) jsme zaznamenali negativní výsledek vyšetření H&E při pozitivitě IHC CK19 a OSNA, negativní výsledek IHC CK19 při pozitivitě vyšetření H&E a OSNA a pozitivní výsledek IHC CK19 při negativitě vyšetření H&E a OSNA (Graf 1).
Graf 1. Porovnání shody výsledků vyšetření pacientů metodami H&E, IHC CK19 a OSNA pomocí Vennových diagramů
Graph 1: Comparison of identical examination results of patients using the H&E, IHC CK19 and OSNA methods by Venn diagrams
Vysvětlivky: H&E – hematoxylin-eosin; IHC CK19 – imunohistochemické vyšetření s protilátkou proti cytokeratinu 19; OSNA – One-Step Nucleic Acid Amplifi cation Ve skupině NSCLC (80 osob) bylo shody mezi vyšetřeními H&E, IHC CK19 a OSNA dosaženo u 61 pacientů (76,3 %), negativní u 43 osob, pozitivní u 18 osob. Pozitivních nálezů metodou OSNA při negativitě vyšetření H&E, resp. IHC CK19 bylo 13 (16,3 %). Tři případy (3,8 %) byly H&E i IHC CK19 pozitivní při negativitě metody OSNA. Shodně po jednom případu (vždy 1,3 %) jsme zaznamenali negativní výsledek vyšetření H&E při pozitivitě IHC CK19 a OSNA, negativní výsledek IHC CK19 při pozitivitě vyšetření H&E a OSNA a pozitivní výsledek IHC CK19 při negativitě vyšetření H&E a OSNA.
Ve skupině plicních metastáz (20 osob) bylo shody mezi vyšetřeními H&E, IHC CK19 a OSNA dosaženo u 17 pacientů (85 %), negativní u 16 osob, pozitivní u 1 osoby. Pozitivní nálezy metodou OSNA při negativitě vyšetření H&E a IHC CK19 byly 3 (15 %).
Z 16 případů pozitivních nálezů metodou OSNA při H&E, resp. IHC CK19 negativitě se jednalo o 13 případů NSCLC a 3 případy plicních metastáz kolorektálního karcinomu. V 8 případech měli tito nemocní nádorovou diseminací postiženy LU etáže N1, v 5 případech etáže N2 a ve 3 případech etáže N1 i N2. Ve 13 případech se jednalo o nález mikrometastázy v LU, ve dvou případech makrometastázy a v jednom případě jak mikrometastázy, tak makrometastázy.
Dopad neshod detekce nádorových buněk v LU metodami H&E, IHC CK19 a OSNA na pTNM staging ukazuje Tab. 2.
Tab. 2. Změny pTNM stagingu v závislosti na výsledcích vyšetření H&E, IHC CK19 a OSNA
Tab. 2: Changes in the pTNM staging depending on H&E, IHC CK19 and OSNA results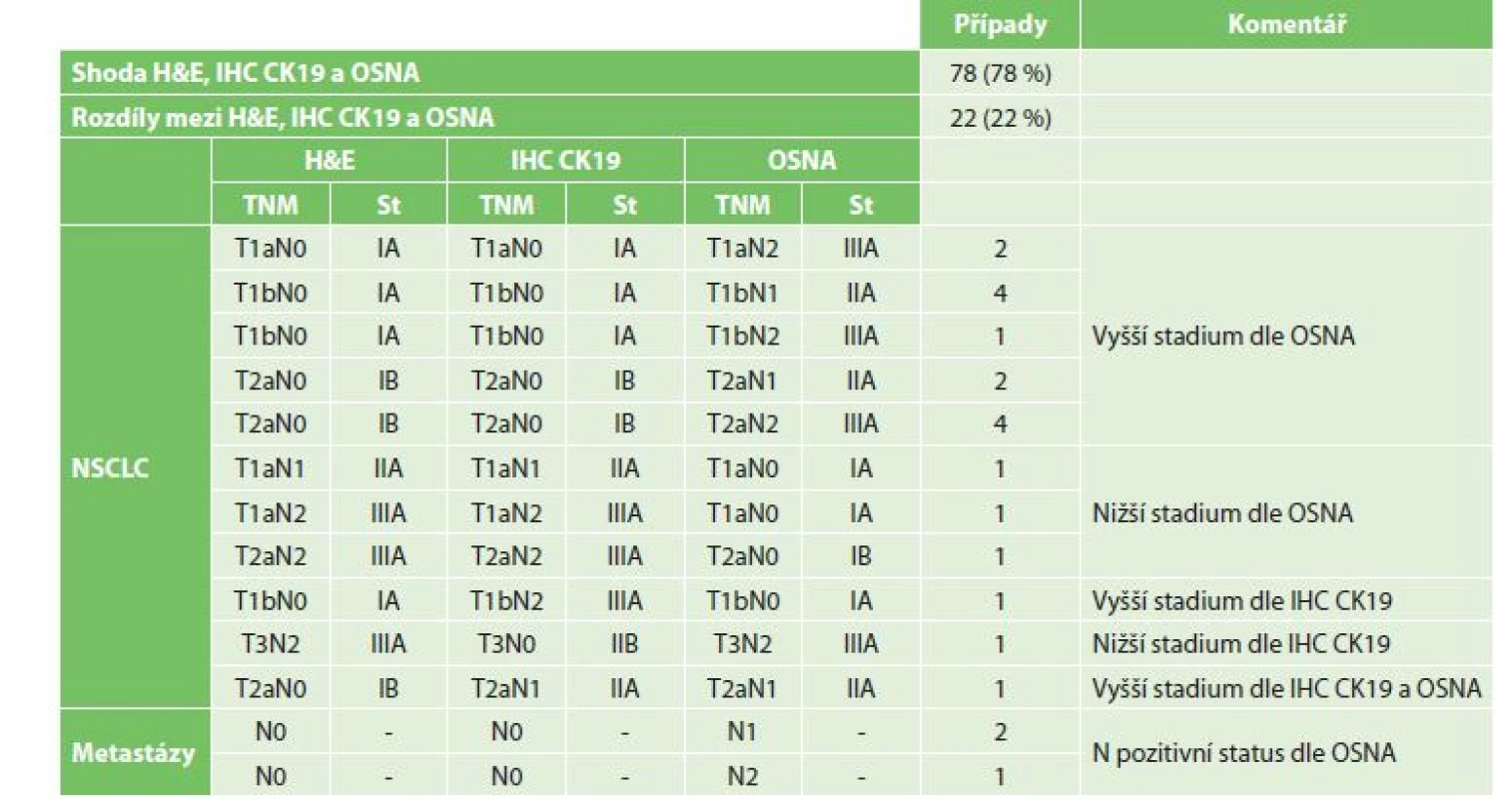
Vysvětlivky: NSCLC – nemalobuněčný plicní karcinom; H&E – hematoxylin-eosin; IHC CK19 – imunohistochemické vyšetření s protilátkou proti cytokeratinu 19; OSNA – One-Step Nucleic Acid Amplifi cation; TNM – klasifi kace maligních nádorů Diskuze
Doporučené postupy pro léčbu jak primárních, tak sekundárních plicních nádorů se odvíjejí nejen od morfologické diagnózy nádoru, ale i od klinického stadia nemoci. Zásadní je proto co nejpřesnější určení stadia onemocnění podle TNM klasifikace (staging), aby mohla být zvolena nejvhodnější léčebná strategie [13]. Nedílnou součástí radikální léčby těchto nádorů je tak nejen jejich chirurgické odstranění, ale i odběr a následné vyšetření regionálních LU, které má v procesu stagingu stěžejní roli. Jednou z možných cest zpřesnění stagingu by mohlo být rutinní zavedení metody OSNA, resp. IHC CK19 do tohoto procesu. V dostupných literárních pramenech je použití metody OSNA v současnosti nejvíce zmiňováno v souvislosti s vyšetřováním regionálních LU u nemocných s karcinomem prsu. Podle většiny autorů poskytuje srovnatelné výsledky se standardním histopatologickým vyšetřením (míra shody 94−96 %, senzitivita 88–93 %, specificita 92−96 %) [5−8,10,14]. Studie zabývající se touto problematikou u nemocných s kolorektálním karcinomem přinesly obdobné výsledky (míra shody 96−97 %, senzitivita 86−96 %, specificita 97−100 %) [3,5,15−18]. Ve prospěch metody hovoří, vedle vyšetření celé homogenizované LU vylučující minutí nádorových buněk při přípravě histologického řezu, také velmi nízká míra falešné pozitivity, resp. negativity [5,15,19,23,26,27]. Existují ale i studie zpochybňující přínos metody OSNA, ať již pro nižší přesnost či vyšší cenu [20,21].
V případě primárních plicních nádorů jsou dosavadní literární údaje o aplikaci metody OSNA velmi sporé, jedná se jen o několik recentních publikací, problematikou plicních metastáz se dosud nezabývala žádná studie [1,11,12,22]. Masai a kol. sledovali expresi CK19 u primárních plicních nádorů a plicních metastáz karcinomu prsu, přičemž CK19 detekovali u 88 % pacientů s plicním karcinomem a u téměř 91 % nemocných s metastázami karcinomu prsu. Současně prokázali při uzlinové diseminaci zmíněných nádorů expresi CK19 v takto postižených LU [1]. Z výsledků této práce jsme vycházeli při volbě nádorů, resp. nemocných, kteří byli předmětem naší studie. Hayama a kol. srovnávali senzitivitu metod OSNA a H&E při vyšetřování LU u primárního plicního karcinomu. Jejich výsledky odpovídají předchozím studiím s karcinomem prsu, resp. kolorektálním karcinomem (senzitivita OSNA 100 %, specificita 92 %), váha této studie je však podle našeho mínění znatelně snížena velmi malým počtem vyšetřených osob (20), resp. LU (pouhých 40) [11]. Poněkud větší soubor prezentoval Inoue se spolupracovníky, kteří vyšetřili 165 LU u 49 nemocných s rovněž příznivými výsledky (pozitivní prediktivní hodnota OSNA 95 %, negativní prediktivní hodnota 99 %, přesnost 99 %) [12]. Asi dosud největší soubor vyšetřovaných publikovali Nakagawa a kol., kteří zkoumali 410 LU u 111 nemocných s nemalobuněčným plicním karcinomem. Míru shody mezi H&E vyšetřením a metodou OSNA nalezli v necelých 93 % s citlivostí přes 79 % [22]. My jsme, ve srovnání s těmito studiemi, dosáhli významně většího počtu vyšetřených LU u 1 pacienta – průměrně 14,3. Podobně vysokého počtu odebraných LU na 1 pacienta dosáhli z recentních studií pouze Croner a kol. a Güller a kol. (shodně 14) [17,23].
Shodných výsledků vyšetření H&E, IHC CK19 a OSNA bylo v našem souboru dosaženo v 78 % případů (mezi H&E a OSNA v 80 %), což je sice méně, než udávají nejlepší výsledky recentních studií (93–97 %) [7,15−19,22,24], avšak tento rozdíl byl dán vyšším počtem OSNA pozitivních nálezů (16 případů – 16 %) při negativitě ostatních metod. Pouze ve 3 případech (3 %) bylo vyšetření H&E, resp. IHC CK19 pozitivní při negativitě metody OSNA, což je procento odpovídající zjištěním ostatních autorů, které si ve shodě s nimi vysvětlujeme, kromě pochopitelné různé senzitivity a specificity použitých vyšetřovacích metod, také nutným dělením LU [19,22,25].
V souladu s nálezy Chena a kol., Güllera a kol. a dalších jsme i v našem souboru pozorovali větší počet odhalených mikrometastáz metodou OSNA ve srovnání s vyšetřením H&E, resp. IHC CK19 [17,19,25–28]. Zde však vyvstává otázka stanovení správné hodnoty cut off pro určení přítomnosti mikrometastázy v LU. Naprostá většina všech autorů (včetně nás) automaticky používala hodnotu 250 kopií mRNA CK19/µl, kterou převzala ze studií zabývajících se diseminací karcinomu prsu (zde má OSNA pozitivní mikrometastáza velikost 0,2–2 mm). U jiných typů nádorů však může být tato hodnota zcela odlišná, což by pochopitelně výrazně ovlivnilo veškeré výsledky. Je proto zcela nezbytné provést další, nejlépe multicentrické studie, které by určily, zda lze jednu hodnotu cut off použít pro více typů nádorů či nikoli [5]. Tamaki a kol., Buglioni a kol. a další také poukazují na možnou predikci postižení dalších etáží LU při pozitivitě vyšetření metodou OSNA, přičemž riziko tohoto postižení stoupá s počtem detekovaných kopií mRNA CK19 v pozitivní LU [7,10,24,29]. Tomu v zásadě odpovídají i naše výsledky, kdy z 11 osob s OSNA pozitivními N1 LU měly 3 osoby (27,3 %) pozitivní i N2 LU. Míra upstagingu 16 % dosažená v našem souboru použitím metody OSNA (resp. 17 % při započtení 1 případu pozitivity IHC CK19 a OSNA) odpovídá literárním údajům uvádějícím rozmezí 2−25 % [17,18,23,30]. Relevantní otázkou v této souvislosti však také je, do jaké míry ovlivní odhalení, resp. přítomnost mikrometastáz v LU follow-up těchto nemocných. Souhlasíme s Osakou a kol., že toto musí být předmětem dalšího zkoumání, resp. pečlivého sledování těchto pacientů [26].
Oproti našemu očekávání se ukázalo, že IHC CK19 nevede k zásadním změnám stagingu. V celých 97 % případů výsledky IHC CK19 přesně kopírovaly výsledky vyšetření H&E. To je v rozporu se zjištěními Vogelaara a kol., podle nichž doplnění IHC CK19 k H&E zvýší staging o 36 % a při kombinaci IHC CK19 a OSNA dokonce o 46,5 % [30]. Určitý přínos by snad mohla mít IHC CK19 alespoň v detekci exprese CK19 určitými nádory (LU) pro rozhodnutí o zařazení metody OSNA do vyšetřovacího procesu. Podle Vilardella a kol., resp. Takamota a kol. může totiž dojít v důsledku předchozí onkologické léčby k poklesu či ztrátě exprese CK19 nádory (LU), což je např. u karcinomu prsu poměrně častý jev [31,32]. Nicméně např. Osako a kol. si myslí, že schopnost metody OSNA detekovat metastázy v LU není ani po předchozí chemoterapii snížena ve srovnání s H&E [6]. Případnou ztrátu exprese CK19 nádory, resp. LU, po neoadjuvantní onkologické léčbě lze na druhou stranu využít jinak – pokud exprese CK19 závisí na životaschopnosti nádorových buněk, tak její ztráta může sloužit jako přesnější marker pro posouzení účinnosti oné onkologické léčby, resp. prognózy pacientů podstupujících neoadjuvantní léčbu [5].
Závěr
Dosažené výsledky ukazují, že vyšetření LU odebraných při SMLA během radikální operace primárních či sekundárních plicních nádorů pomocí metody OSNA může mít, na základě senzitivnější detekce mikrometastáz v LU, určitý potenciál zpřesnit pTNM staging těchto nádorů. Samozřejmě je nezbytné potvrdit tento předpoklad v dalších studiích, resp. na větším souboru nemocných. Zásadním úkolem je dále pečlivým sledováním zjistit souvislost mezi mikrometastázami v LU detekovanými metodou OSNA a follow-up nemocných.
Seznam zkratek
CK19 – cytokeratin 19
H&E – hematoxylin-eosin
IASLC – The International Association for the Study of Lung Cancer
IHC CK19 – imunohistochemické vyšetření s protilátkou proti cytokeratinu 19
LAMP – Loop Mediated Isothermal Amplification
LU – lymfatické uzliny
mRNA – messenger ribonucleic acid
Nd:YAG – Neodymium-doped Yttrium Aluminium Garnet
NSCLC – nemalobuněčný plicní karcinom
OSNA – One-Step Nucleic Acid Amplification
RT – reverzní transkripce
SMLA – systematická hilová a mediastinální lymfadenektomie
TNM – klasifikace maligních nádorů
Podpořeno projekty SVV-2016-260283 a Institucionální výzkum MZ ČR – FNPl, 00669806.
Univerzita Karlova, Lékařská fakulta v Plzni, Husova 3,
301 00 Plzeň, IČ: 00216208, DIČ: CZ00216208.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Etické aspekty
Studie byla před svým zahájením schválena společnou etickou komisí Univerzity Karlovy, Lékařské fakulty v Plzni a Fakultní nemocnice Plzeň a všichni pacienti zařazení do studie s tím předem podepsali informovaný souhlas.
doc. MUDr. Josef Vodička, Ph.D.
Chirurgická klinika FN v Plzni a LF UK v Plzni
alej Svobody 80
304 60 Plzeň
e-mail: vodicka@fnplzen.cz
Zdroje
1. Masai K, Nakagawa K, Yoshida A, et al. Cytokeratin 19 expression in primary thoracic tumors and lymph node metastases. LungCancer 2014;86 : 318−23.
2. Zhang X, Xie J, Yu C, et al. RNA expressionof CK19, EGFR and LUNX in patients with lung cancer micrometastasis. Exp Ther Med 2014;7 : 360−4.
3. Yamamoto N, Daito M, Hiyama K, et al. An optimal mRNA marker for OSNA (One-step nucleic acid amplification) based lymph node metastasis detection in colorectal cancer patients. Jpn J ClinOncol 2013;43 : 264−70.
4. Rusch VW, Asamura H, Watanabe H, et al. Members of IASLC Staging Committee. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol. 2009;4 : 568−77.
5. Tamaki Y. One-step nucleic acid amplification (OSNA): where do we go withit? Int J ClinOncol 2017;22 : 3−10.
6. Osako T, Tsuda H, Horii R, et al. Molecular detection of lymph node metastasis in breast cancer patients treated with preoperative systemic chemotherapy: a prospective multicentre trial using the one-step nucleic acid amplification assay. Br J Cancer 2013;109 : 1693−8.
7. Buglioni S, Di Filippo F, Terrenato I, et al. Quantitative molecular analysis of sentinel lymph node may be predictive of axillary node status in breast cancer classified by molecular subtypes. PLOS One 2013;8:e58823.
8. Le Frère-Belda MA, Bats AS, Gillaizeau F, et al. Diagnostic performance of one-step nucleic acid amplification for intraoperative sentinel node metastasis detection in breast cancer patients. Int J Cancer 2012;130 : 2377−86.
9. Matsuzuka T, Takahashi K, Kawakita D, et al. Intraoperative molecular assessment for lymph node metastasis in head and neck squamous cell carcinoma using one-step nucleic acid amplification (OSNA) assay. Ann Surg Oncol 2012;19 : 3865−70.
10. Osako T, Iwase T, Kimura K, et al. Sentinel node tumour burden quantified based on cytokeratin 19 mRNA copy number predicts non-sentinel node metastases in breast cancer: molecular whole-node analysis of all removed nodes. Eur J Cancer 2013;49 : 1187−95.
11. Hayama M, Chida M, Karube Y, et al. One-step nucleic acid amplification for detection of lymph node metastasis in lung cancer. Ann Thorac Cardiovasc Surg 2014;20 : 181–4.
12. Inoue M, Hiyama K, Nakabayashi K, et al. An accurate and rapid detection of lymph node metastasis in non-small cell lung cancer patients based on one-step nucleic acid amplification assay. Lung Cancer 2012;78 : 212−8.
13. Benej M, Čapov I, Wechsler J, et al. Reevaluace stagingu nodálního statusu nemalobuněčného karcinomu plic (NSCLC) levého horního laloku v intencích revidovaných ESTS doporučení a našich zkušeností. Onkologie 2015;9 : 142−5.
14. Chaudhry A, Williams S, Cook J, et al. Thereal-time intra-operative evaluation of sentinel lymp hnodes in breast cancer patients using One Step Nucleic Acid Amplification (OSNA) and implications for clinical decision-making. Eur J SurgOncol 2014;40 : 150−7.
15. Croner RS, Schellerer V, Demund H, et al. One step nucleic acid amplification (OSNA) − a new method for lymph node staging in colorectal carcinomas. J Transl Med 2010;8 : 83.
16. Yamamoto H, Sekimoto M, Oya M, et al. OSNA-based novel molecular testing for lymph node metastases in colorectal cancer patients: results from a multicenter clinical performance study in Japan. Ann Surg Oncol 2011;18 : 1891−8.
17. Güller U, Zettl A, Worni M, et al. Molecular investigation of lymph nodes in colon cancer patients using one-step nucleic acid amplification (OSNA): a new road to better staging? Cancer 2012;118 : 6039−45.
18. Yamamoto H, Tomita N, Inomata M, et al. OSNA-assisted molecular staging in colorectal cancer: A prospective multicenter trial in Japan. Ann SurgOncol 2016;23 : 391−6.
19. Cserni G. Intraoperative analysis of sentinel lymph nodes in breast cancer by one-step nucleic acid amplification. J ClinPathol 2012;65 : 193−9.
20. Huxley N, Jones-Hughes T, Coelho H, et al. A systematic review and economic evaluation of intraoperative tests [RD-100i one-step nucleic acid amplification (OSNA) system and Metasin test] for detecting sentinel lymph node metastases in breast cancer. Health Technol Assess 2015;19 : 1−215.
21. Oezkan F, Khan AM, Hager T, et al. OSNA: A fast molecular test based on CK19 mRNA concentration for assessment of EBUS-TBNA samples in lung cancer patients. ClinLungCancer 2016;17 : 198−204.
22. Nakagawa K, Asamura H, Tsuta K, et al. The novel one-step nucleic acid amplification (OSNA) assay for the diagnosis of lymph node metastasis in patient swith non-small cell lung cancer (NSCLC): Results of a multicenter prospective study. LungCancer 2016;97 : 1−7.
23. Croner RS, Geppert CI, Bader FG, et al. Molecular staging of lymph node-negative colon carcinomas by one-step nucleic acid amplification (OSNA) results in upstaging of a quarter of patients in a prospective, European, multicentre study. Br J Cancer 2014;110 : 2544−50.
24. Sagara Y, Ohi Y, Matsukata A, et al. Clinical application of the one-step nucleic acid amplification method to detect sentinel lymph node metastasis in breast cancer. Breast Cancer 2013;20 : 181−6.
25. Chen JJ, Chen JY, Yang BL, et al. Comparison of molecular analysis and touch imprint cytology for the intraoperative evaluation of sentinel lymph nodes in primary breast cancer: results of the China Breast Cancer Clinical Study Group (CBCSG) 001c trial. Eur J SurgOncol 2013;39 : 442−9.
26. Osako T, Iwase T, Kimura K, et al. Incidence and possible pathogenesis of sentinel node micrometastases in ductal carcinoma in situ of the breast detected using molecular whole lymph node assay. Br J Cancer 2012;106 : 1675−81.
27. Osako T, Iwase T, Kimura K, et al. Intraoperative molecular assay for sentinel lymph node metastases in early stage breast cancer: a comparative analysis between one-step nucleic acid amplification whole node assay and routine frozen section histology. Cancer 2011;117 : 4365−74.
28. Remoundos DD, Ng VV, Wilson HA, et al. The use of one step nucleic-acid amplification (OSNA) in clinical practice: a single-centre study. Breast 2013;22 : 162−7.
29. Tamaki Y, Sato N, Homma K, et al. Japanese One-Step Nucleic Acid Amplification Study Group. Routine clinical use of the one-step nucleic acid amplification assay for detection of sentinel lymph node metastases in breast cancer patients: results of a multicenter study in Japan. Cancer 2012;118 : 3477−83.
30. Vogelaar FJ, Reimers MS, van der Linden RL, et al. The diagnostic value of One-Step Nucleic acid Amplification (OSNA) for sentinel lymph nodes in colon cancer patients. Ann Surg Oncol 2014;21 : 3924−30.
31. Vilardell F, Novell A, Martin J, et al. Importance of assessing CK19 immunostaining in core biopsies in patients subjected to sentinel node study by OSNA. Virchows Arch 2012;460 : 569−75.
32. Takamoto K, Shimazu K, Naoi Y, et al. One-Step Nucleic Acid Amplification Assay for detection of axillary lymph node metastases in breast cancer patients treated with neoadjuvant chemotherapy. Ann SurgOncol 2016;23 : 78−86.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2018 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Ohlédnutí za letošním kongresem sekce mladých chirurgů
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Může vyšetření lymfatických uzlin metodou One-Step Nucleic Acid Amplification zpřesnit staging plicních nádorů?
- Empyém pleurální dutiny – evaluace výsledků jednoho pracoviště
- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Tuberkulóza pečene − kazuistika
- Invertovaný Meckelův divertikl: raritní příčina ileo-ileální invaginace a krvácení do dolní části zažívacího traktu
- XVIII. Dny mladých chirurgů profesora Stanislava Čárského
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Tuberkulóza pečene − kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



