-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFluorescenční angiografie v detekci kvality perfuze anastomózy u resekce sigmoidea a rekta – zhodnocení průběžných výsledků
Fluorescence angiography in the detection of anastomotic perfusion during rectal and sigmoid resection – preliminary report
Introduction:
The aim of the study was to evaluate the results of fluorescence angiography for assessing anastomotic perfusion after resection of the sigmoid colon and rectum since its introduction into clinical practice at the authors´ workplace and to evaluate the incidence of necessary resection line repositioning based on the quality of perfusion, and also to record any complications in anastomotic healing.Method:
Retrospective unicentric analysis of prospectively collected data from patients with resection of the sigmoid colon and rectum with primary anastomosis. The patient set included 50 patients, 27 males and 23 females; the median age was 64.5 years (33–80). Forty-four patients were indicated for resection for cancer of the sigmoid colon or rectum, while 6 patients had a benign disease. Twenty-nine patients underwent total mesorectal excision with coloanal mechanical or hand-sewn anastomosis and 21 underwent resection of the sigmoid colon or upper rectum with mechanical anastomosis. Prior to the construction of the anastomosis, assessment of perfusion of the anastomotic segments by near infrared (NIR) indocyanine green (ICG) fluorescence angiography was performed in all patients. The quality of perfusion of the mesocolon and bowel wall and its impact on moving the resection line and complications of anastomotic healing 30 days postoperatively were all evaluated.Results:
Assessment of perfusion using fluorescence angiography was technically successfully performed in all 50 patients. In 5 cases (10%) the resection line had to be moved for signs of poor perfusion of the bowel wall. Postoperatively, healing of the anastomosis was complicated in four patients (8%). Dehiscence was recorded in 3 patients (10.3%) with total mesorectal excision and in 1 patient (4.8%) after resection of the sigmoid colon and upper rectum.Conclusion:
The presented results indicate that fluorescence angiography may lead to a decrease in the incidence of anastomotic dehiscence after colorectal resections by mapping in detail the perfusion of the anastomosed segments.Key words:
fluorescence angiography – indocyanine green – anastomotic leak – colorectal resection
Autoři: M. Škrovina 1,2; V. Benčurik 1; E. Holášková 1; J. Bartoš 1; K. Klos 1; M. Macháčková 1; P. Anděl 1
Působiště autorů: Chirurgické oddělení, Nemocnice Nový Jičín, a. s., Centrum vysoce specializované onkologické péče pro dospělé Nový Jičín, primář: MUDr. M. Škrovina Ph. D. 1; I. chirurgická klinika, LF Univerzity Palackého a FN Olomouc, přednosta: prof. MUDr. Č. Neoral, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 10, s. 354-358.
Kategorie: Původní práce
Souhrn
Úvod:
Cílem studie je zhodnotit výsledky zavedení metody detekce perfuze anastomózy po resekci sigmoidea a rekta do praxe na pracovišti autorů a vyhodnotit incidenci nutnosti změny linie resekce v návaznosti na kvalitu perfuze stěny střevní a zároveň zaznamenat komplikace v hojení anastomózy.Metoda:
Retrospektivní unicentrická analýza prospektivně sbíraných dat u pacientů s resekcí sigmoidea a rekta a konstrukcí primární anastomózy. Do souboru bylo zařazeno 50 pacientů, 27 mužů a 23 žen, s mediánem věku 64,5 roku (33–80). 44 pacientů bylo k resekci indikováno pro karcinom sigmoidea anebo rekta, 6 pacientů pro benigní onemocnění. Ve 29 případech se jednalo o totální excizi mezorekta s koloanální mechanickou nebo ručně konstruovanou anastomózou a ve 21 případech byla provedena resekce sigmoidea anebo horního rekta s mechanickou anastomózou. U všech pacientů před konstrukcí anastomózy byla vykonána kontrola perfuze anastomozovaných segmentů metodou NIR (near infrared) fluorescenční angiografie detekcí indocyaninové zeleně (ICG). Byla hodnocena kvalita perfuze mezokolon a stěny střevní s impaktem na nutnost posunutí resekční linie a komplikace v hojení anastomózy v 30denním pooperačním intervalu.Výsledky:
U všech 50 pacientů byla metoda kontroly perfuze fluorescenční angiografií technicky úspěšně realizována. V 5 případech (10 %) bylo nutné posunout linii resekce pro známky špatné perfuze stěny střevní. U 4 pacientů (8 %) byla v pooperačním období zaznamenána komplikace v hojení anastomózy. U pacientů s totální excizí mezorekta byla dehiscence verifikována ve 3 případech (10,3 %) a v 1 případě (4,8 %) se o dehiscenci jednalo po resekci sigmoidea a horního rekta.Závěr:
Prezentované výsledky naznačují, že metoda fluorescenční angiografie může představovat cestu, jež povede ke snížení incidence dehiscence anastomózy kolorektálních resekcí detailním mapováním perfuze anastomózovaných segmentů.Klíčová slova:
fluorescenční angiografie – indocyaninová zeleň – dehiscence anastomózy – kolorektální resekceÚvod
Progrese ve vývoji chirurgických technik, jako jsou standardizace totální excize mezokolon a mezorekta a zavedení laparoskopické a robotické operace, vedla ke zlepšení výsledků v léčbě kolorektálního karcinomu. Na druhé straně se však stále setkáváme s relativně vysokou incidencí komplikací hojení anastomózy. Dehiscence anastomózy, jako závažná komplikace kolorektálních resekcí, je v literárních pramenech udávaná až do 39 % v závislosti na její lokalizaci. Hlavně nízké kolorektální a ultranízké koloanální anastomózy s sebou přinášejí zvýšené riziko dehiscence v porovnání s anastomózami tlustého střeva konstruovanými ve větší vzdálenosti od análního okraje [1,2,3,4]. Dehiscence anastomózy je samozřejmě spjata s vysokou pravděpodobností reoperace, prodloužením jak pobytu na intenzivním lůžku zdravotního zařízení, tak i celkové hospitalizace pacienta a zvýšením finančních nákladů na léčbu. Tato komplikace je spojená s nárůstem procenta perioperační mortality, která může dosáhnout až 24 % [5,6]. Následné reintervence včetně snahy o sanaci dehiscence nízkých anastomóz reoperací anebo za použití endoskopické podtlakové terapie častokrát s sebou přinášejí jak zhoršení funkčního výsledku a celkové kvality života pacienta, tak i zvýšené riziko lokoregionální recidivy. To má za následek další navyšování finančních prostředků na celkovou zdravotní péči [7,8].
Zásadním faktorem pro nekomplikované hojení střevní anastomózy je její dokonalé krevní zásobení. Intraoperační kontrola kvality krevního zásobení sledováním barevné změny tkání anastomózovaných segmentů, kontrola pulzace na hlavních arteriálních kmenech a koncových arteriích, přítomnost krvácení z resekčního okraje, nepřítomnost hematomu či tahu v anastomóze nám dávají pouze orientační informaci o stavu perfuze tkání. Už dlouhou dobu jsou testovány různé možnosti detekce kvality perfuze anastomózovaných střevních segmentů. Ani jedna z těchto metod však zatím nezaznamenala širší využití v denní klinické praxi [9,10].
Použití nové technologie detekce indocyaninové zeleně (indocyanin green, ICG) za využití světla blízkého infračervenému spektru (near-infrared, NIR) nám umožňuje ozřejmit mikroperfuzi tkání v reálném čase a optimalizovat tak kvalitu prokrvení anastomózovaných segmentů. V současném období je používáno několik systémů umožňujících intraoperační mapování kvality perfuze na základě fluorescenční angiografie: D-Light (Karl Storz, Tuttlingen, Germany), FireflyTM (Intuitive Surgical Inc., Sunnyvale, California, USA), SPY EliteTM Kit (LifeCell Corporation, Bridgewater, New Jersey, USA), PinpointTM system (Novadaq, Mississauga, Ontario, Canada) a IC-View® (Pulsion Medical Systems, Munich, Germany). Studií věnujících se problematice hodnocení perfuze anastomózy u kolorektálních resekcí bylo od roku 2010 publikováno několik [11,12 ]. Jejich stručný přehled i základní charakteristika jsou uvedeny v tabulce (Tab. 1).
Tab. 1. Vyhodnocení fluorescenční angiografie u kolorektálních resekcí Tab. 1: Evaluation of fluorescein angiography in colorectal resections 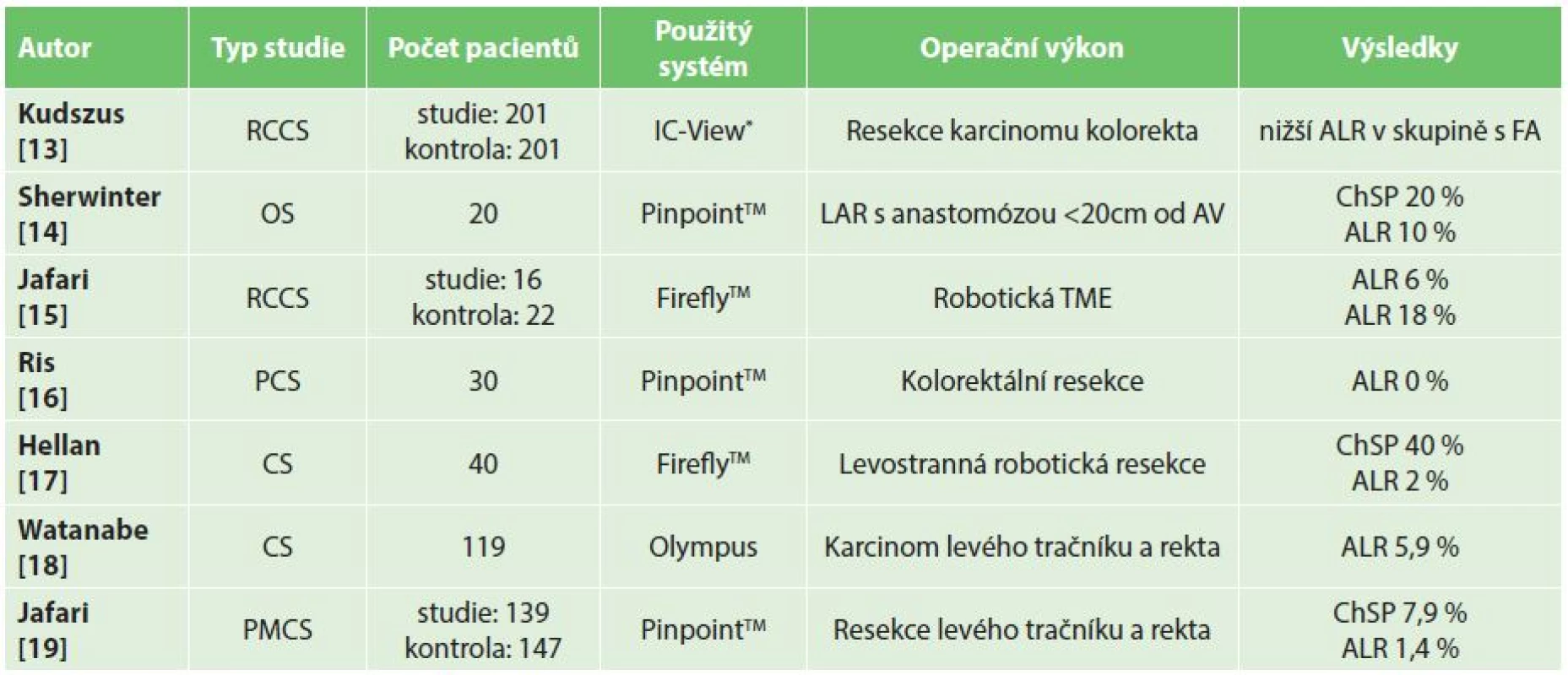
Využití ICG mapování perfuze anastomózy u kolorektálních resekcí metodou fluorescenční angiografie bylo do praxe na Chirurgickém oddělení Nemocnice Nový Jičín, a. s., zavedeno 24. 8. 2015.
Metoda
V období od 24. 8. 2015 do 18. 5. 2016 jsme konsekutivně do studie zařadili prvních 50 pacientů, u kterých byl vykonán resekční výkon na sigmoideu anebo rektu z důvodu přítomnosti karcinomu nebo benigního onemocnění s konstrukcí anastomózy. V souboru bylo 27 mužů a 23 žen. Medián věku pacientů byl 64,5 roku (33–80 let), medián body mass indexu (BMI) byl 27,1 kg/m2 (17,3–43,5 kg/m2).
Pro karcinom lokalizovaný v oblasti sigmoidea nebo konečníku bylo operováno 44 pacientů, 6 pacientů pro benigní onemocnění.
U 21 pacientů s lézí lokalizovanou v oblasti sigmoidea a horního rekta byla vykonána resekce s mechanickou double stapling anastomózou koncem ke konci, v 16 případech laparoskopicky a v 5 případech otevřeně.
Celkem 29 pacientů bylo operováno pro extraperitoneálně lokalizovaný tumor rekta a podstoupili totální excizi mezorekta. Předoperační konkomitantní chemoradioterapii v dlouhém režimu podstoupilo 21 z 28 pacientů s karcinomem (75 %). U 2 operovaných žen byla totální excize mezorekta vykonána jako součást zadní supralevátorové exenterace pánve pro lokálně pokročilý adenokarcinom rekta. Jedna z těchto pacientek podstoupila otevřenou a druhá laparoskopicky asistovanou resekci s mechanickou end to end double stapling anastomózou a protektivní ileostomií. Miniinvazivním přístupem bylo operováno 27 pacientů, 19 laparoskopicky a 8 daVinci robotickým systémem (Intuitive Surgical, Inc. Sunnyvale, California, USA). U 3 pacientů byla vykonána laparoskopicky asistovaná transanální totální excize mezorekta (TaTME) s ručně konstruovanou end to end anastomózou a u 26 operovaných end to end double stapling anastomóza. Celkem 28 pacientů (96,6 %) s totální excizí mezorekta mělo založenou protektivní ileostomii, u jediného pacienta (3,4 %) stomie založena nebyla (Tab. 2).
Tab. 2. Soubor pacientů (n = 50); charakter onemocnění a typ resekčního výkonu Tab. 2: Patient group (n = 50); disease characteristics and type of surgical procedure 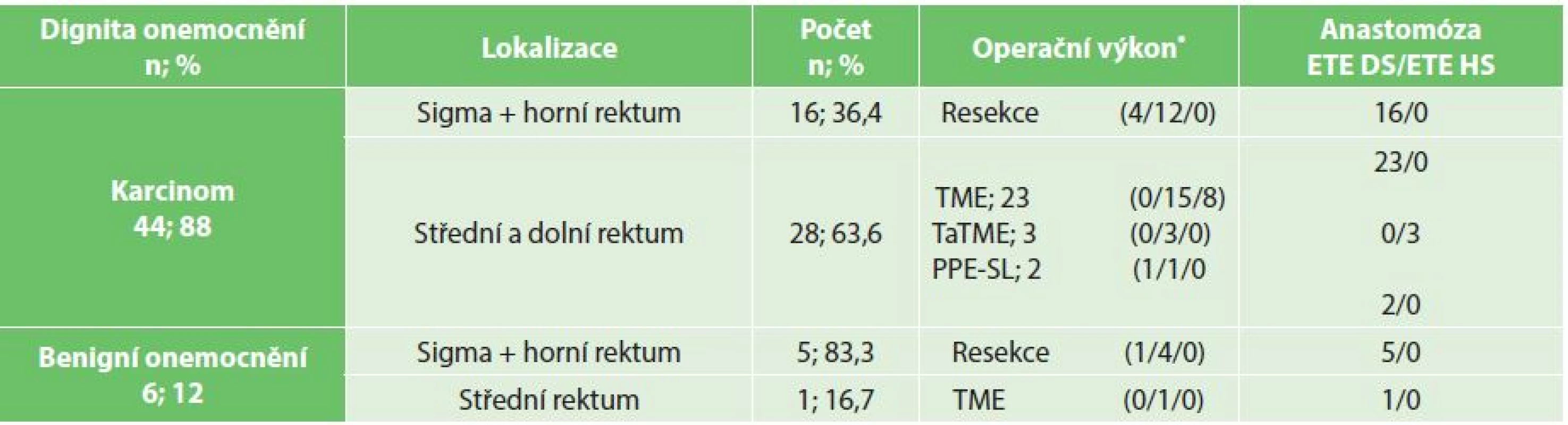
Vysvětlivky: *číslo v závorce udává výkon otevřený/laparoskopický/robotický U všech pacientů byla po přerušení mesocoln anebo mesorekta ke stěně střevní a po označení si předpokládané resekční linie (linie anastomózy) nitrožilně aplikována indocyaninová zeleň (ICG-PULSION® 25 mg 5 mg/ml, PULSION Medical Systems AG, Munich, Germany) v dávce 0,2 mg/kg tělesné hmotnosti pacienta. Následně byla vykonána detekce kvality perfuze s využitím dvou různých systémů. Při otevřené a laparoskopické operaci byl použit systém D-Light (Karl Storz, Tuttlingen, Germany) a FireflyTM (Intuitive Surgical Inc., Sunnyvale, California, USA) při robotické operaci (Obr. 1, 2). V případě nepřítomnosti optimální perfuze v místě označení plánované resekce a anastomózy byla linie resekce posunuta do místa optimální perfuze a tato vzdálenost byla změřena a zaznamenána.
Obr. 1. Střevní segment před aplikací ICG Fig. 1: Bowel segment before ICG aplication 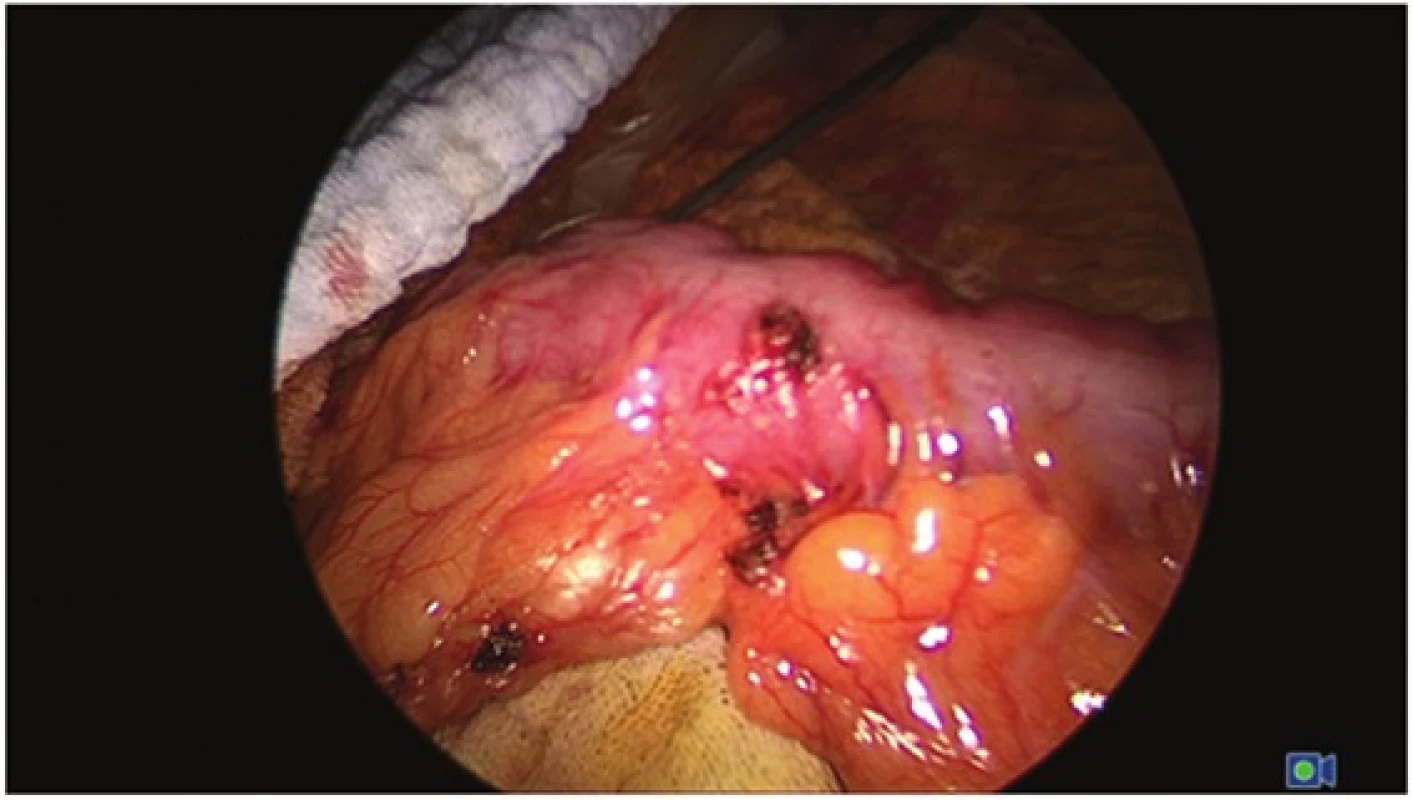
Obr. 2. Střevní segment po aplikaci ICG (modrá – tkáň s optimální perfuzí) Fig. 2: Bowel segment after ICG aplication (blue – tissue with optimal perfusion) 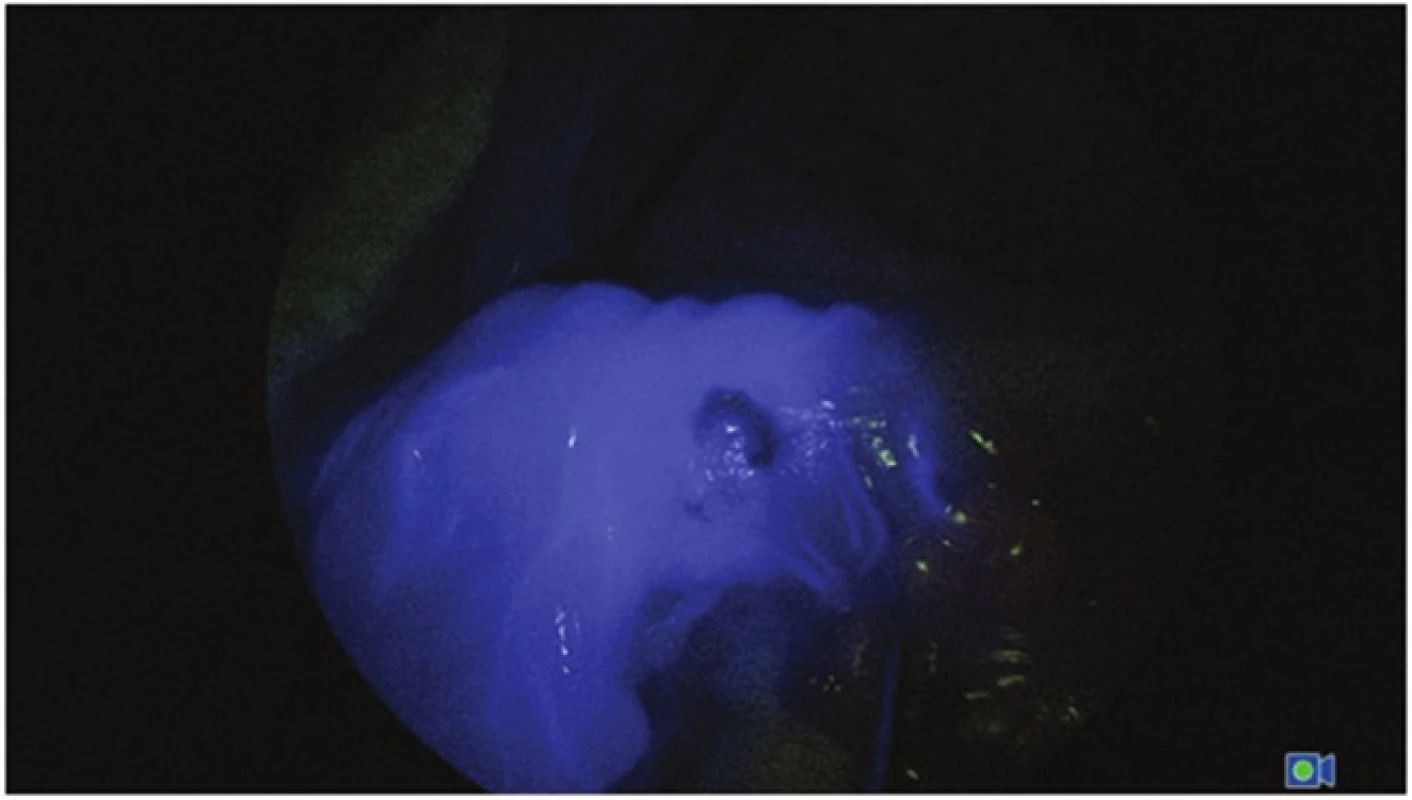
Komplikace v hojení anastomózy byly hodnoceny na základě klinického obrazu pacienta, laboratorních výsledků, fyzikálního vyšetření, endoskopického a/anebo irigografického vyšetření anastomózy a CT vyšetření. U pacientů s totální mezorektální excizí byla na 7. pooperační den standardně vykonána endoskopická kontrola anastomózy a na 30. pooperační kontrolní endoskopie a irigografické vyšetření vodní kontrastní látkou.
Veškeré údaje byly prospektivně zaznamenávány a retrospektivně analyzovány s cílem vyhodnotit incidenci nutnosti změny linie resekce v návaznosti na kvalitu perfuze stěny střevní a zároveň zaznamenání četnosti komplikací v hojení anastomózy.
Výsledky
U všech pacientů byl výkon technicky zvládnutý a nebyla zaznamenána žádná nežádoucí reakce v souvislosti s aplikací ICG. Perfuze stěny střevní byla jako optimální hodnocena u 45 pacientů (90 %) a jako neoptimální, respektive jako přítomnost ischemie v místě označeném k plánované resekci a anastomóze, u 5 operovaných (10 %). Ve všech případech se jednalo o pacienty s karcinomem extraperitoneálního rekta indikovaných k TME, tři muži a dvě ženy. Čtyři z těchto pacientů podstoupili neoadjuvantní chemoradioterapii. Na základě nálezu bylo nutné posunout plánovanou linii resekce v jednom případě o 2 cm, v jednom případě o 3 cm, ve dvou případech o 5 cm a v jednom případě o 6 cm.
Dehiscence anastomózy byla zaznamenána u 4 pacientů (8 %). Ve 3 případech (10,3 %) po TME u pacientů s karcinomem extraperitoneálního rekta, z nichž dva pacienti absolvovali neoadjuvantní onkologickou terapii (Tab. 3). U 2 z těchto pacientů byl v průběhu operace při fluorescenční angiografii nález nedostatečné perfuze stěny střevní v místě plánované anastomózy a resekční linie musela být posunuta orálně. U třetího pacienta byla při transanální revizi anastomózy prokázána dehiscence zadní stěny spojky s nálezem neuzavřených svorek stapleru (svorky tvaru „U“) a jako příčinu vzniku komplikace jsme konstatovali selhání stapleru. Jeden pacient s dehiscencí anastomózy stupně A byl po kontrolním negativním irigografickém vyšetření indikován ke zrušení ileostomie. Dva případy dehiscence stupně B si vyžádaly transanální intervenci (transanálni sutura jednotlivými stehy a v jednom případě i s následnou aplikací podtlakové drenáže). Oba pacienti mají zatím ponechanou protektivní ileostomii.
Tab. 3. Vyhodnocení fluorescenční angiografie a zaznamenaných komplikací v hojení anastomózy Tab. 3: Evaluation of fluorescein angiography and anastomotic complications 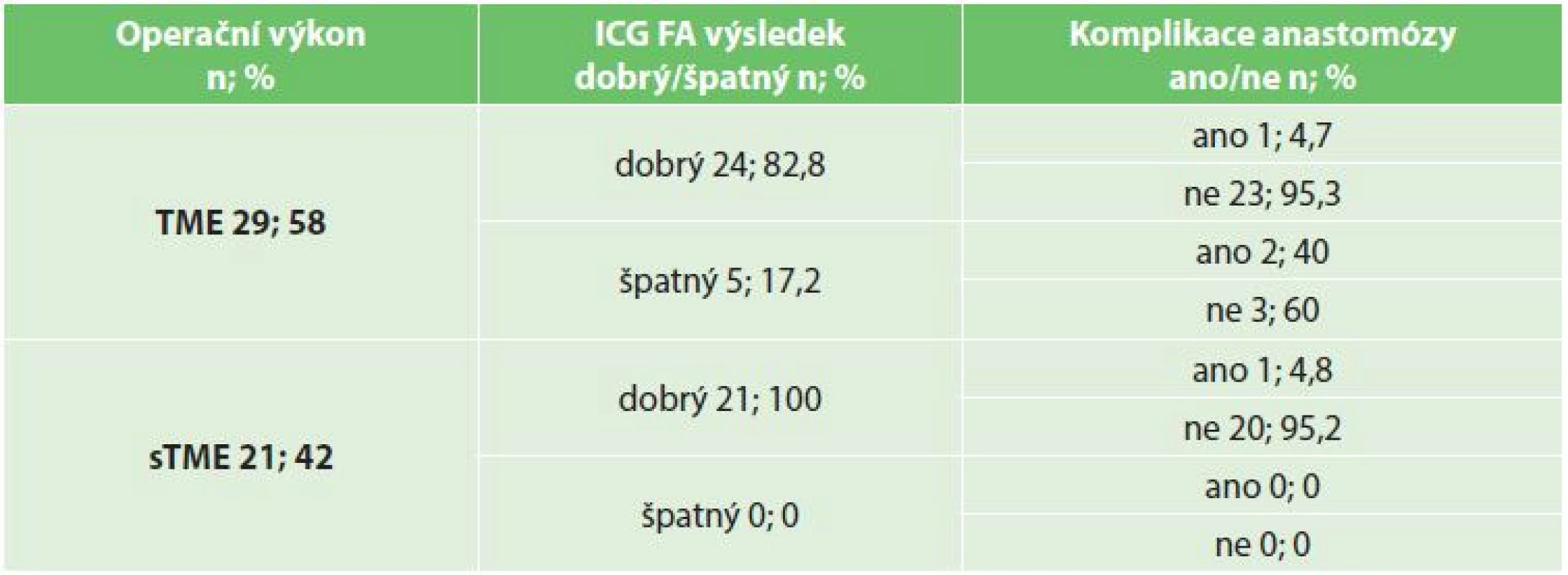
V jednom případě (4,8 %) došlo k dehiscenci anastomózy u 83letého pacienta s karcinomem aborální části sigmoidea, který podstoupil otevřenou resekci sigmoidea a horního rekta s nálezem optimální perfuze při fluorescenční angiografii. Bezprostřední pooperační průběh byl přiměřený. 10. pooperační den však došlo ke změně stavu a celkovému zhoršení klinického obrazu a postupnému rozvoji septického stavu. Pacient byl indikován k reoperaci s nálezem ischemie zbytku levého tračníku. Nález byl řešen resekcí ischemického segmentu tlustého střeva a anastomózy podle Hartmanna. Bylo pokračováno v komplexní resuscitační péči, avšak pacient 12. pooperační den zemřel.
Diskuze
Na základě výsledků získaných v naší prospektivní unicentrické studii a údajů z literatury můžeme konstatovat, že intraoperační mapování mikroperfuze tkání metodou fluorescenční angiografie nitrožilně aplikovanou indocyaninovou zelení v průběhu otevřené, laparoskopické i robotické resekce v oblasti sigmoidea a rekta je metodou bezpečnou, s prakticky nulovým rizikem komplikací a minimální učící křivkou [19].
Změna chirurgického plánu z pohledu určení místa transekce stěny střevní a konstrukce anastomózy je autory publikujícími na dané téma udávána od 7,9 % do 40 % [14,17,19]. V námi publikovaných výsledcích došlo ke změně chirurgického plánu v 10 % případů u pacientů s resekcí sigmoidea a rekta. Jen u 90 % případů bylo plánované místo transekce stěny střevní a anastomózy určeno na základě barevné změny koloritu a hmatné pulzace v mezokolon shodné s místem určeným na podkladě mapování perfuze FA. Podobné výsledky byly zaznamenány i v multicentrické studii PILLAR II z 11 pracovišť v USA. Jafari a kol. v ní referují o změně chirurgické strategie na základě detekce kvality perfuze střevní stěny v 7,9 % případů u laparoskopické resekce v oblasti levého tračníku a rekta [19].
Konstrukce anastomózy na podkladě optimální mikroperfuze může vést k selekci pacientů z pohledu plánu konstrukce protektivní stomie. Ris a kol. referují vyhnutí se založení protektivní ileostomie na základě optimálního nálezu při FA až u 50 % operovaných pacientů s původně plánovanou protekcí [16]. V našem souboru zatím nevedlo využití FA ke změně taktiky při zakládání protektivní ileostomie u pacientů s resekcí extraperitoneálního karcinomu rekta.
Několik studií referuje při použití metody mapování perfuze fluorescenční angiografií snížení incidence anastomotického leaku kolorektálních resekcí na 0 až 4 % [13,16,19]. Tyto výsledky jsou však často limitovány různorodostí prezentovaného souboru, kde jsou do jedné studie zařazeni pacienti s resekcí pravého kolon, levého kolon, ale i rekta. Jafari a kol. ve své studii porovnávající incidenci dehiscence anastomózy u pacientů s robotickou resekcí rekta uvádějí redukci leaku na 6 % v podskupině s FA v porovnání s 18 % v podskupině bez FA [15]. Podobné výsledky prezentují i Gröne a kol. v retrospektivní srovnávající analýze, kde u pacientů s laparoskopickou resekcí rekta a s FA udávají ALR 6 % a u operovaných v předcházejícím období bez FA ALR 15 % [12]. V pilotním souboru z našeho pracoviště je ALR u pacientů s TME a mapováním perfuze 10,3 %, přičemž v historické analýze výsledků laparoskopické TME prezentované na Koloproktologických pracovních dnech v únoru 2015 byl v souboru 329 pacientů s laparoskopickou TME referován ALR 15,8 %.
Závěr
Jednoznačný závěr a vyhodnocení benefitu monitorování perfuze anastomózy na podkladě pilotních zkušeností a výsledků na našem pracovišti ještě není možné v současnosti vyslovit. Je nutné zajistit větší soubor pacientů s následným exaktním vyhodnocením získaných údajů a statistickým srovnáním s historickými výsledky z našeho pracoviště. Avšak na základě údajů publikovaných v recentní světové literatuře je možné se domnívat, že mapování perfuze anastomózovaných segmentů metodou intraoperační fluorescenční angiografie s sebou může přinést snížení incidence dehiscence anastomózy po resekcích tlustého střeva, ale hlavně po resekcích extraperitoneálního rekta. Prozatím publikované údaje, velikost prezentovaných souborů pacientů a relativně špatný design realizovaných studií jsou nepostačující k vyslovení jednoznačných závěrů. V současnosti probíhající studie však mohou v krátkém čase poskytnout jasnější odpovědi na položené otázky a ukázat místo této metody v denní chirurgické praxi.
Použité zkratky:
ALR – Anastomotic Leakage Rate
AV – Anal Verge
BMI – Body Mass Index
CS – Case Series
ETE DS – End to end double stapling anastomóza
FA – Fluorescenční angiografie
ETE HS – End to end hand sew anastomóza
ChSP – Change Surgical Plan
ICG – IndoCyanin Green
LAR – Low Anterior Resection
NIR – Near InfraRed
OS – Observational Study
PCS – Prospective Case Series
PMCS – Prospective Multicentre Case Series
POD – Pooperační den
PPE-SL – Supralevátorová zadní exenterace pánve
RCCS – Retrospective Case Control Study
sTME – Tumor specific mesorectal excision (resekce sigmy a horního rekta)
TaTME – Transanal Total Mesorectal Excision
TME – Total Mesorectal ExcisionKonflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Matej Škrovina, Ph.D.
Mikoviniho 21
010 15 Žilina
e-mail: matej.skrovina@email.cz
Zdroje
1. Kang CY, Halabi WJ, Chaudhry OO, et al. Risk factors for anastomotic leakage after anterior resection for rectal cancer. JAMA Surg 2013;148 : 65–71.
2. Matthiessen P, Hallböök O, Andersson M, et al. Risk factors for anastomotic leakage after anterior resection of the rectum. Colorectal Disease 2004;6 : 462–9.
3. Skrovina M, Straka M, Holaskova E, et al. Colon cancer – evaluation of complications and risks of planned resections. Rozhl Chir 2014;93 : 311–6.
4. Skrovina M, Soumarova R, Kycina R, et al. Anastomotic leakage after laparoscopic total mesorectal excision for low rectal cancer. Videosurgery and other miniinvasive techniques 2011;6 : 5–11.
5. Frye J, Bokey EL, Chapuis PH, et al. Anastomotic leakage after resection of colorectal cancer generates prodigious use of hospital resources. Colorectal Dis 2009;11 : 917–20.
6. Ashraf SQ, Burns EM, Jani A, et al. The economic impact of anastomotic leakage after anterior resection in English NHS hospitals: are we adequatly remunerating them? Colorectal Dis 2013;15:e190–8.
7. Vonlanthen R, Slankamenac K, Breitenstein S, et al. The impact of complications on costs of major surgical procedures: a cost analysis of 1200 patients. Ann Surg 2011;254 : 907–13.
8. Mirnezami A, Mirnezami R, Chandrakumaran K, et al. Increased local recurrence and reduced survival from colorectal cancer following anastomotic leak: systematic review and meta-analysis. Ann Surg 2011;253 : 890–9.
9. Daams F, Wu Z, Lahaye MJ, et al. Prediction and diagnosis of colorectal anastomosis leakage: a systematic review of literature. World J Gastrointest Surg 2014;6 : 14–26.
10. Nachiappan S, Askari A, Currie A, et al. Intraoperative assessment of colorectal anastomotic integrity: a systematic review. Surg Endosc 2014;28 : 2513–30.
11. James DRC, Ris F, Yeung TM, et al. Fluorescence angiography in laparoscopic low rectal and anorectal anastomoses with pinpoint perfusion imaging – a critical appraisal with specific focus on leak risk reduction. Colorectal Dis 2015;17(Suppl. 3):16–21.
12. Gröne J, Koch D, Kreis ME. Impact of intraoperative microperfusion assessment with Pinpoint Perfusion Imaging on surgical management of laparoscopic low rectal and anorectal anastomoses. Colorectal Dis 2015;17(Suppl. 3):22–8.
13. Kudszus S, Roesel C, Schachtrupp A, et al. Intraoperative laser fluorescence angiography in colorectal surgery: a noninvasive analysis to reduce the rate of anastomotic leakage. Langenbeck Arch Surg 2010;395 : 1025–30.
14. Sherwinter DA, Gallagher J, Donkar T. Intra-operative transanal near infrared imaging of colorectal anastomotic perfusion: a feasibility study. Colorectal Dis 2013;15 : 91–6.
15. Jafari MD, Lee KH, Halabi WJ, et al. The use of indocyanine green fluorescence to assess anastomotic perfusion during robotic assisted laparoscopic rectal surgery. Surg Endosc 2013;27 : 3003–8.
16. Ris F, Hompes R, Cunningham C, et al. Near-infrared (NIR) perfusion angiography in minimally invasive colorectal surgery. Surg Endosc 2014 : 28 : 2221–6.
17. Hellan M, Spinoglio G, Pigazzi A, et al. The influence of fluorescence imaging on the location of bowel transection during robotic left-sided colorectal surgery. Surg Endosc 2014;28 : 1695–702.
18. Watanabe J, Ota M, Suwa Y, et al. Evaluation of the intestinal blood flow near the rectosigmoid junction using the indocyanine green fluorescence method in a colorectal cancer surgery. Int J Colorectal Dis 2015;30 : 329–35.
19. Jafari MD, Wexner SD, Martz JE, et al. Perfusion assessment in laparoscopic left-sided/anterior resection (PILLAR II): a multi-institutional study. J Am Coll Surg 2015 : 220 : 82–92e1.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2016 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Posun chirurgie za posledních více než čtyřicet let
- Totální pankreatektomie u maligního onemocnění slinivky břišní − od historie k dnešku
- Experimental Surgery z plzeňského pracoviště
- Jaterní metastázy maligního melanomu – mají resekce nebo radiofrekvenční ablace smysl?
- Fluorescenční angiografie v detekci kvality perfuze anastomózy u resekce sigmoidea a rekta – zhodnocení průběžných výsledků
- Kompletní mezokolická excize u pravostranné hemikolektomie
- Chirurgie hlavových a periferních nervů s atlasem přístupů
- Myxofibrosarkom dutiny břišní
- Perforovaná divertikulitída jejuna
- Recidiva sarkomu retroperitonea
- Evropský pankreatologický klub 2016 – Liverpool
- Ustavení sekce onkochirurgie při České chirurgické společnosti ČLS JEP
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Myxofibrosarkom dutiny břišní
- Totální pankreatektomie u maligního onemocnění slinivky břišní − od historie k dnešku
- Kompletní mezokolická excize u pravostranné hemikolektomie
- Jaterní metastázy maligního melanomu – mají resekce nebo radiofrekvenční ablace smysl?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



