-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
Five-Year Follow up in Patients after Surgery for Clear Cell Renal Carcinoma
Objective:
Evaluation of the five-year follow-up of patients treated for clear-cell renal carcinoma in dependency on its characteristic and extension.Patients’ cohort and methods:
Retrospective analysis of five-year follow-up of 269 patients treated for clear-cell renal carcinoma in dependency on T, N, M and clinical tumor stage; presence of lymphatic and distant metastases, cellular grade and tumor necrosis. Tumor-specific surviving is presented on Kaplan-Meier curves.Results:
Five-year patients surviving with tumor T1, T2 and T3 were 91.8%, 70.7% and 34.6% respectively. Surviving patients without lymphatic metastases was 85%; with metastases was 6.9%. Surviving patients without distant metastases was 84.1%; with metastases was 0%. Surviving of patients with clinical tumor stage I, II, III and IV were 94.6%, 83.8%, 48.7% and 0% respectively. Surviving of patients with tumor cellular grade G1, G2, G3 and G4 were 87.5%, 95.5%, 64.2% and 27.6% respectively. Surviving patients without tumor necrosis was 92.4%; with metastases was 31.9%.Conclusion:
Tumor size and the presence of metastases are very significant factors to patient survival. Histological characteristics as a nuclear grade and a tumor necrosis have been important prognostic factors for the future of the patient. Early diagnosis and aggressive surgical treatment are the most important for the positive course of the disease.Key words:
kidney cancer – prognosis – long-term follow-up
Autoři: J. Pacovsky; J. Košina; L. Holub; P. Navrátil; P. Hušek; M. Broďák
Působiště autorů: Urologická klinika FN a LF UK v Hradci Králové, přednosta: as. MUDr. Miloš Broďák, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 11, s. 689-694.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
Zhodnocení pětiletého přežívání nemocných se světlobuněčným karcinomem ledviny v závislosti na charakteru a rozsahu tumoru.Soubor nemocných a metoda:
Retrospektivní analýza pětiletého sledování 269 nemocných léčených pro světlobuněčný karcinom ledviny v závislosti na T, N a M stadiu nádoru, přítomnosti lymfatických či orgánových metastáz, přítomnosti nekróz karcinomu a histopatologickém stupni malignity. Tumor specifické přežívání vyjádřeno pomocí Kaplanových-Meierových křivek.Výsledky:
Pětileté přežívání nemocných s tumorem T1, T2 a T3 je 91,8 %, 70,7 % a 34,6 % respektive. Přežívání nemocných bez uzlinových metastáz je 85%, s metastázami je 6,9%. Přežívání nemocných bez orgánových metastáz je 94,1%, s metastázami je 0%. Přežívání nemocných s tumorem stadia I, II, III a IV je 94,6 %, 83,8 %, 48,7 % a 0 % respektive. Přežívání nemocných s tumorem G1, G2, G3 a G4 je 87,5 %, 95,5 %, 64,2 % a 27,6 % respektive. Přežívání nemocných s tumorem bez nekrózy nádoru bylo 92,4 %, s nekrózou 31,9 %.Závěr:
Velikost nádoru a jeho diseminace jsou faktory, které významnou měrou ovlivňují prognózu nemocného. Histologická charakteristika (buněčný grade a přítomnost nekróz) hraje též velmi důležitou roli v dalším osudu nemocného. Časná diagnóza karcinomu ledviny a razantní chirurgická léčba rozhodují o příznivém průběhu onemocnění.Klíčová slova:
karcinom ledviny – prognóza – dlouhodobé sledováníÚVOD
Karcinom ledviny patří v častým malignitám v České republice, které tvoří přibližně 2–3 % všech solidních nádorů, muži jsou postiženi přibližně dvakrát častěji než ženy. Podle dostupných dat je zhruba u jedné třetiny nemocných je v době diagnózy zjištěno metastatické onemocnění. V České republice incidence trvale stoupá, v roce 2005 byla 15,68/100 tis. obyvatel. Mortalita se dlouhodobě udržuje na stacionárních hodnotách, v roce 2005 byla v České republice 5,87/100 tis. obyvatel [1, 2, 3].
Ač došlo k rozšíření spektra onkologické léčby o nemocného s renálním karcinomem, stále zásadní roli hraje chirurgický výkon a to v případě lokalizovaného i metastazujícího onemocnění [4, 5, 6]. Z hlediska chirurgického výkonu je důležitý výsledek operace, měřený výskytem lokálních recidiv. Nicméně mnohem důležitější je dlouhodobá a úplná remise onemocnění. Péče o pacienta s maligním onemocněním je týmová práce a v případě léčby metastazujícího karcinomu ledviny jde o spolupráci urologa s onkologem, imunologem a radiologem. Na tomto místě je třeba zdůraznit, že léčba metastazujícího karcinomu ledviny stále zůstává v pozici paliativní, protože doposud neznáme účinnou radikální léčbu diseminovaného onemocnění. Dlouhodobé sledování nemocných je nezbytnou podmínkou včas zahájené a správně vedené následné léčby. Dalším faktorem je naše zpětná vazba a možnosti zlepšení péče o nemocné s renálním karcinomem.
Cílem naší práce je podrobná retrospektivní analýza dat nemocných při pětiletém sledování po operačním výkonu pro světlobuněčný karcinom ledviny. Cílem je ověřit vliv faktorů, které je možné poznat předoperačně, peroperačně a pooperačně a které se podílejí na prognóze nemocných.
MATERIÁL A METODA
Retrospektivní studií jsme hodnotili soubor nemocných, kteří podstoupili operační výkon pro světlobuněčný karcinom ledviny na Urologické klinice FN a LF UK v Hradci Králové v letech 2001 až 2005 a kteří jsou sledovaní na našem pracovišti po dobu minimálně 5 let. V daném období byl proveden operační výkon pro tumor ledviny u 371 nemocného. Z tohoto souboru byli vyřazeni nemocní s jinými histologickými typy než konvenční světlobuněčný karcinom ledviny. Byli vyřazeni nemocní s onkocytomy, papilárními a chromofobními karcinomy [7]. Dále byli ze studie vyřazeni nemocní s neúplnými daty a nemocní, kteří z různých důvodů nejsou nadále sledováni na našem pracovišti (z jiného regionu, změna bydliště během sledování, nespolupracující nemocní).
Jako faktor hodnocení jsme použili tumor-specifickou mortalitu, tzn. hodnotili jsme úmrtí nemocných na generalizaci světlobuněčného karcinomu. Pro sledování byly použity Kaplanovy-Meierovy křivky kumulativního přežívání. Při statistické analýze byl použit chí-kvadrát test pro neparametrická data, hodnota statistické významnosti byla 0,05.
Hodnotili jsme samostatně T, N a M stadium onemocnění a klinické stadium podle TNM klasifikace novelizované v roce 2009 pro karcinom ledviny (Tab. 1, 2) [8]. U T stadia jsme hodnotili pouze T1, T2 a T3 bez dalšího dělení na podskupiny. Stadium T4 jsme záměrně do hodnocení nezařadili, protože data u této skupiny jsou vysoce heterogenní. Část nemocných s tumorem T4 nebyla operována vůbec, část nemocných podstoupila pouze probatorní laparotomii a u některých bylo provedeno pouze parciální paliativní odstranění tumoru nebo jen operační biopsie. U stadia N jsme hodnotili pouze CT nebo histologický nález z retroperitoneálních lymfadenektomií, tedy pouze N0 nebo N+. U stadia M jsme též hodnotili pouze přítomnost či nepřítomnost orgánových metastáz, tedy M0 nebo M+ bez bližší specifikace. Samostatně byl hodnocen histopatologický stupeň malignity karcinomu dle stávající čtyřstupňové škály podle Fuhrmanové [7, 8]. Další faktor, který byl analyzován byla přítomnost či nepřítomnost nekrózy karcinomu jako významného prognostického faktoru [9]. Při hodnocení nebyl brán zřetel na charakter operačního výkonu. V současnosti se rozšířila kriteria pro indikaci nefron-šetřícího výkonu (resekce ledviny či enkapsulace tumoru) [8, 10, 11]. Stejně tak nebyl zohledněn faktor indikace otevřené a laparoskopické operace. V letech 2001 až 2005 byl laparoskopický výkon na našem pracovišti výjimečný, proto jsou tato data z daného období z pohledu vztahu k laparoskopii nehodnotitelná. Všichni nemocní zařazení do hodnoceného souboru tedy podstoupili operaci pro světlobuněčný karcinom. Všechny sledované parametry (TNM, histologie, klinické stadium) jsou hodnoceny v době provedení operace. Pokud byly prokázány uzlinové nebo orgánové metastázy, před nebo při operaci, ale i během sledování, byla zahájena monoterapie interferonem-α, pouze u 3 nemocných byla použita kombinovaná terapie Interferonem-α (INF - α), Interleukinem-2a (IL-2) a 5-fluorouracilem (5-FU) dle Atzpodienova schématu (12). U 2 nemocných byl po selhání imunoterapie INF - α nasazen inhibitor tyrozinkinázy sorafenib (Sutent®).
VÝSLEDKY
V letech 2001 až 2005 bylo na našem pracovišti provedeno 316 operací pro tumor ledviny. Z této skupiny bylo do retrospektivní studie zařazeno 269 nemocných s prokázaným světlobuněčným karcinomem; 166 mužů (61,7 %) a 103 žen (38,3 %). V době operace byla prokázána diseminace procesu (uzlinové či orgánové metastázy) u 36 nemocných (13,4 %). Průměrný věk nemocných byl 61,6 roku, medián 62 roků.
Celkové kumulativní přežívání nemocných v pětiletém období od operace je vyjádřeno Kaplanovou-Meierovou křivkou v grafu 1.
Graf 1. Tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny Tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery 
Vliv velikosti tumoru (vyjádřeno stadiem dle TNM klasifikace) na pětileté tumor-specifické přežívání je vyjádřeno Kaplanovou-Meierovou křivkou v grafu 2. Nemocných s tumorem stadia T1 bylo 171 (63,6 %), s T2 bylo 43 (16 %) a s T3 bylo 55 (20,4 %). Statisticky významný rozdíl mezi T1 a T2 je od 55. měsíce a mezi T2 a T3 je od 7. měsíce.
Graf 2. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na T stadiu tumoru Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on the T stage 
Vliv přítomnosti metastáz v regionálních uzlinám v době operace na dlouhodobé přežívání je prezentováno v grafu 3. Nemocných bez uzlinových metastáz (N0) bylo 240 (89,2%), nemocných s přítomnými metastázami (N+) bylo 29 (10,8 %). Statisticky významný rozdíl v přežívání byl pozorován od 6. měsíce.
Graf 3. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na přítomnosti uzlinových metastáz Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on the presence of lymphatic node metastases 
Vliv přítomnosti orgánových nebo lymfatických metastáz v neregionálních uzlinách v době operace je prezentováno v grafu 4. Nemocných bez přítomnosti vzdálených metastáz (M0) bylo 244 (90,7 %), nemocných s přítomnými vzdálenými metastázami (M+) bylo 25 (9,3 %). Statisticky významný rozdíl v přežívání byl pozorován od 6. měsíce.
Graf 4. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na přítomnosti vzdálených metastáz Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on the presence of distant metastases 
Kumulativní přežívání jednotlivých klinických stadií, do kterých jsou nemocní zařazování na podkladě TNM klasifikace (Tab. 1, Tab. 2) je prezentováno v grafu 5. Ve stadiu I bylo zařazeno 166 nemocných (61,7 %), ve stadiu II bylo 37 nemocných (13,8 %), ve stadiu III bylo 39 nemocných (14,5 %) a ve stadiu IV bylo 27 nemocných (10 %). Statisticky významný rozdíl v přežívání mezi stadiem I a II nebyl prokázán, mezi stadiem II a III byl prokázán od 18. měsíce a mezi stadiem III a IV byl pozorován od 6. měsíce.
Tab. 1. TNM klasifikace renálního karcinomu (revize 2009) Tab. 1. TNM classification of a renal carcinoma (2009 revision) 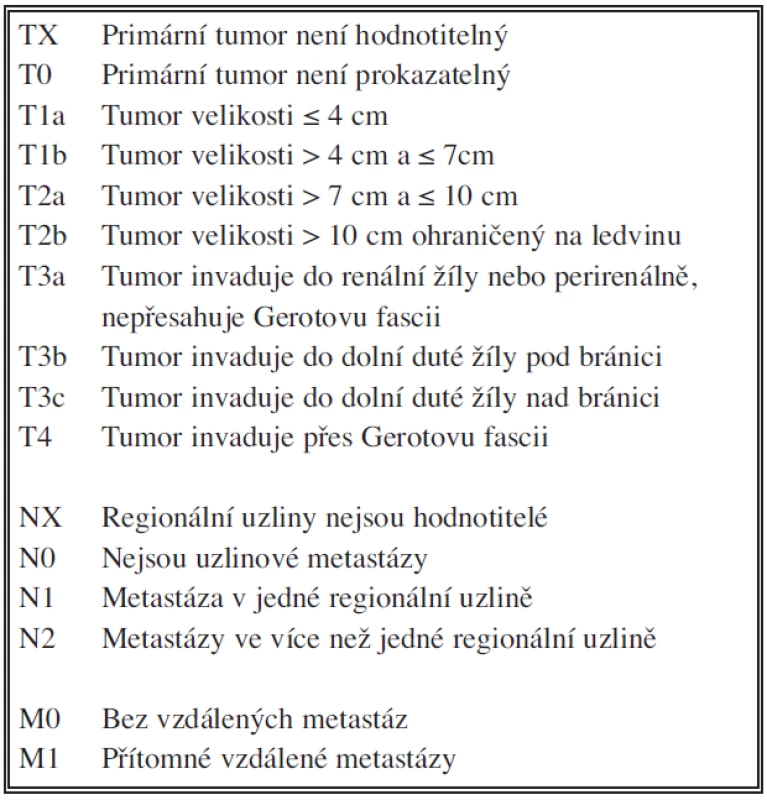
Tab. 2. Klinické stadium renálního karcinomu podle TNM Tab. 2. Clinical stage of a renal Carcinoma according to the TNM classification 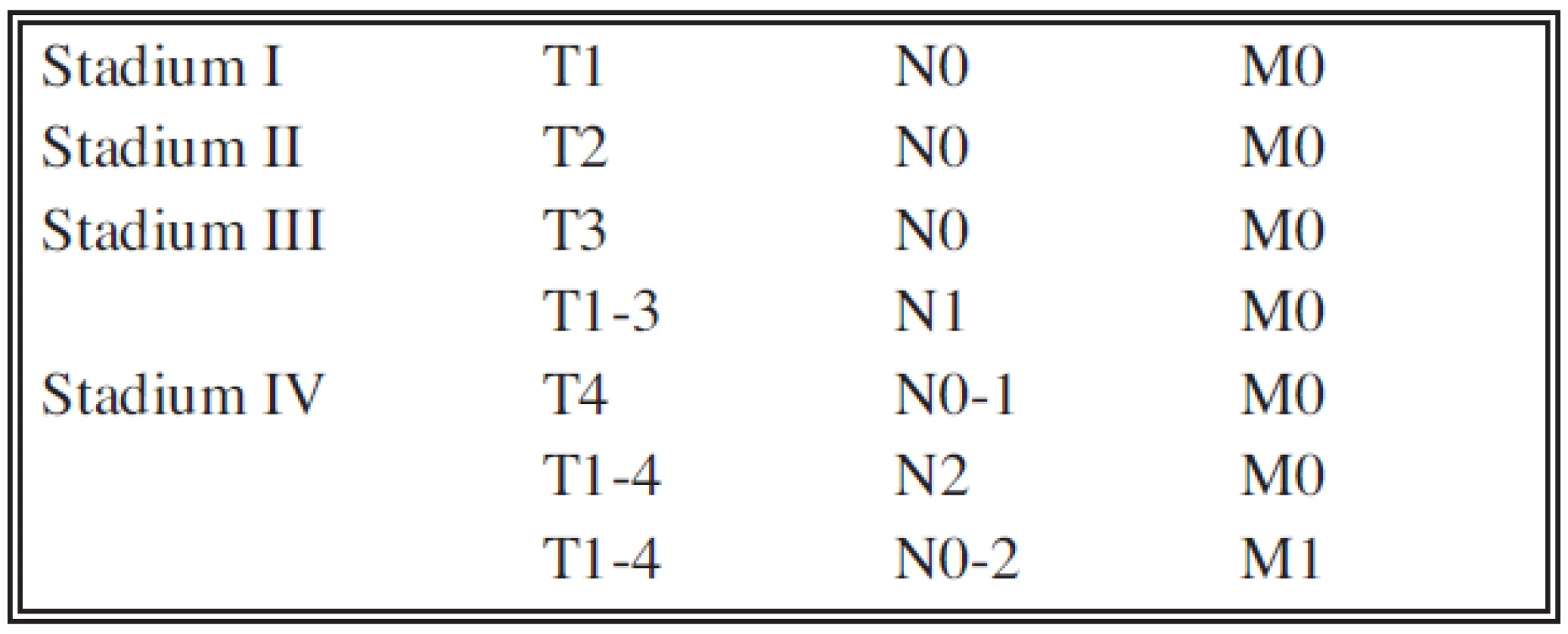
Graf 5. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na klinickém stadiu Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on the clinical stage 
Pro testování vlivu biologických vlastností tumoru na prognózu nemocného byly hodnoceny histopatologické stupně malignity tumoru dle Fuhrmanové a přítomnost nekrózy tumoru. Při hodnocení vlivu histopatologického stupně malignity na tumor specifické přežívání byly testovány všechny 4 stupně. Výsledky jsou prezentované v grafu 6. Stupeň 1 (G1) mělo 11 nemocných, stupeň 2 (G2) mělo 134 nemocných, stupeň 3 (G3) mělo 95 nemocných a stupeň 4 (G4) mělo 29 nemocných. Statisticky významný rozdíl v přežívání mezi nemocnými s tumorem G1 a G2 nebyl prokázán, s tumorem G2 a G3 byl pozorován od 19. měsíce a G3 a G4 zjištěn od 7. měsíce. Vliv přítomnosti nekrózy světlobuněčného karcinomu ledviny na dlouhodobé přežívání nemocných je prezentován v grafu 7. Do skupiny bez nekrózy bylo zařazeno 197 nemocných (73,2 %), do skupiny s nekrózou bylo zařazeno 72 nemocných (26,8 %). Statisticky významný rozdíl v přežívání nemocných byl prokázán od 7. měsíce.
Graf 6. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na histopatologické stupni malignity dle Fuhrmanové Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on histopathologic grade according to Fuhrman 
Graf 7. Kumulativní tumor-specifické přežívání nemocných po operaci pro světlobuněčný karcinom ledviny v závislosti na přítomnosti nekrózy karcinomu Cumulative tumor-specific surviving of patients with Clear Cell Renal Carcinoma after surgery in dependency on tumor necrosis presence 
DISKUSE
Dlouhodobé sledování nemocných nám přináší řadu velmi důležitých informací o možném dalším vývoji onemocnění. To nám pak umožňuje optimalizaci péče o nemocné s tímto onemocněním. Vytipování nemocných s vyšším rizikem progrese onemocnění a jejich zařazení do adekvátní rizikové skupiny nejen snižuje finanční nároky na vynaložená vyšetření, ale i snižuje psychickou zátěž spojenou s každým kontrolním vyšetřením. Na druhé straně nám to umožňuje využití finančně náročnějších vyšetření u indikovaných pacientů s vysokým rizikem progrese.
Podle literárních zdrojů je u cca 30–40 % nemocných, kteří podstupují operační výkon diagnostikována vzdálená metastáza. U dalších 30–40 % nemocných se objeví vzdálené metastázy v průběhu dalšího sledování [13, 14]. Nejčastějšími lokalizacemi metastáz jsou plíce (76 %), uzliny (66 %), skelet (42 %) a játra (41 %). Dalšími možnými místy, kde se objevují metastázy karcinomu ledviny jsou mozek, nadledvina, slinivka a kůže. V našem souboru je výskyt metastáz v době operace výrazně nižší (13,4 %). Důvodem je jistě fakt, že skupina nemocných s tumorem stadia T4, kde je výskyt metastáz nejvyšší, byla pro svou nehomogenitu z našeho souboru vyřazena a nebyla dále analyzována.
Je známým faktem, že časně diagnostikovaný tumor má celkově lepší prognózu. V případě světlobuněčného karcinomu ledviny lze tento fakt plně potvrdit. Naše data jasně prokazují, že velikost tumoru měřená stadiem T podle TNM klasifikace je rozhodující pro další prognózu nemocných. To je plně ve shodě s publikovanými daty [3, 15]. Přítomnost uzlinových či vzdálených orgánových metastáz jsou známkami pokročilého onemocnění se špatnou prognózou. Tito nemocní jsou plně indikováni k následné léčbě, která umožňuje zlepšení perspektivy nemocných. V tomto případě, kdy imunoterapie či biologická léčba navazuje na provedenou nefrektomii, dochází téměř k dvojnásobnému prodlužení života nemocného ve srovnání s podáním léčby bez provedené nefrektomie [6, 16, 17, 18]. Je třeba vždy zvážit přínos razantní náročné léčby oproti zdrženlivějšímu přístupu. Operační výkon (nefrektomie, resekce) mohou ovlivnit celkový stav organismu. Jakýkoliv ablační výkon na ledvinném parenchymu může vést ke zhoršení globální renální funkce, která pak může být i kontraindikací zahájení následné léčby. Může také dojít k vyčerpání biologických rezerv, které potom neumožní pokračování v léčbě. V současnosti jsou již do běžného schématu léčby metastazujícího renálního karcinomu zahrnuty možnosti inhibitory tyrozinkinázy (sunitinib, sorafenib). Dále se používají mTOR inhibitory (mammalian target of rapamycin), popřípadě bevacizumab (monoklonální protilátka proti VEGF – vaskulární endoteliální růstové faktory), jejichž role spočívá v inhibici proteosyntézy a inhibici angioneogeneze [19, 20, 21]. Na tomto místě je třeba ještě jednou připomenout, že v současnosti nemáme v rukou možnost radikální léčby metastazujícího karcinomu ledviny. Vždy jde o léčbu paliativní, jejíž účinnost se pohybuje na hranici 30 %. Jejím smyslem tedy není eradikace metastáz, ale zpomalení progrese onemocnění [19, 20, 21].
Chirurgický výkon na primárním ledvinném nádoru, ale i na vzdálených orgánových metastázách si stále zachovávají čelné místo v léčebném schématu. Pokud tedy chirurgický výkon může být proveden, měl by být indikován. U časně diagnostikovaného odstranitelného nádoru je prognóza nemocného nejlepší. Chirurgické odstranění solitární, respektive resekabilní metastázy má též kurativní účinek. Na druhou stranu je stále diskutovanou otázkou indikace a rozsah lymfadenopatie. V současnosti platí, že lymfadenopatie může být kurativní jen v případě mikrometastáz, u lymfadenopatie ani rozsáhlá lymfadenektomie nemění prognózu nemocného [4, 5, 8].
Role biologických vlastností nádoru v průběhu onemocnění je též nesmírně významná. I na našem souboru nemocných jsme prokázali rozdíly v přežívání nemocných s různými histopatologickými stupni malignity. Histologický stupeň koreluje s biologickou agresivitou tumoru. Podobným způsobem s biologickou agresivitou koreluje i přítomnost nekrózy karcinomu. Je-li nekróza přítomna, jedná se o rychle rostoucí nádor, kdy dochází k nerovnováze mezi rychlostí růstu a novotvorbě cév zjišťující tumoru nutrici [3, 9, 15]. Všechny výše jmenované faktory, které jsme na souboru našich nemocných analyzovali se používají v rozličných prognostických algoritmech. Příkladem může být Mayo Scoring System, který je doporučován v Guidelines European Association of Urology pro rok 2010.
ZÁVĚR
Lokalizovaný karcinom ledviny má velmi příznivou prognózu. Naproti tomu metastazující renální karcinom je onemocnění, jehož možnosti ovlivnění jsou v současnosti značně limitované. Vzhledem k velkému rozpětí možného dalšího průběhu onemocnění je nezbytně nutné důsledné sledování nemocného po provedené operaci. O tom jak intenzivně a jaké prostředky použít při sledování je rozhodují různé prognostické faktory, z nichž některé jsme se pokusili v naší práci zhodnotit.
Velikost nádoru a jeho diseminace jsou faktory, které významnou měrou ovlivňují prognózu nemocného. Histologická charakteristika (buněčný grade a přítomnost nekróz) hraje též velmi důležitou roli v dalším osudu nemocného. Časná diagnóza karcinomu ledviny a razantní chirurgická léčba rozhodují o příznivém průběhu onemocnění.
MUDr. Jaroslav Pacovský, Ph.D.
Bratří Čapků 877
500 03 Hradec Králové
e-mail: pacovsky@fnhk.cz
Zdroje
1. www.svod.cz
2. Kawaciuk, I. Epidemiologie karcinomu ledviny. Urolog. pro Praxi, 2005; 6(6): 248–252.
3. Kawaciuk, I. Prognóza karcinomu ledviny. Praha, Galen, 2005.
4. Flanigan, R. C., Mickisch, G., Sylvester, R., et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: A combined analysis. J. Urol., 2004; 171(3): 1071–1076.
5. Russo, P., Goetzl, M., Simmons, R., et al. Partial nephrectomy: The rationale expanding the indication. Ann. Surg. Oncol., 2002; 9(7): 680–687.
6. Ljunberg, B., Landberg, G., Alamdari, F. I. Factors of importance for prediction of survival in patients with metastatic renal call carcinoma, treated with or without nephrectomy. Scand. J. Urol. Nephrol., 2000; 34(4): 246–251.
7. Hora, M., Hes, O. Histologie nádorů ledvin dospělých. Ces. Urol., 1998; 2(5): 29–32.
8. European Association of Urology Guidelines 2009. Guidelines on Renal Cell Carcinoma. 1–48.
9. Pacovský, J., Broďák, M., Hušek, P., Holub, L., Košina, J., Navrátil, P., Louda, M., Podhola, M. Histologický nález nekrózy světlobuněčného karcinomu ledviny – negativní prognostický faktor. Urolog. pro Praxi, 2010; 11(1): 32–35.
10. Russo, P., Goetzl, M., Simmons, R., et al. Partial nephrectomy: The rationale expanding the indication. Ann. Surg. Oncol., 2002; 9(7): 680–687.
11. Zini, L., Capitanio, U., Jeldres, C., et al. Radical versus partial nephrectomy: effect on overal and noncancer mortality. Cancer, 2008; 115(7): 1465–1471.
12. Atzpodien, J., Schmidt, E., Gertenbach, U., Fornara, P., et al. German Kooperative Renal Carcinoma Chemo-Immunotherapy Trials Group (DGCIN): Adjutant treatment with interleukin-2 and interferon-alpha2a-based chemoimmunotherapy in renal cell Carcinoma post tumour nephrectomy: results of a prospectively randomised trial of the German Kooperative Renal Carcinoma Chemoimmunotharapy Group (DGCIN). Br. J. Cancer, 2005; 92(5): 843–846.
13. Zisman, A., Pantuck, A. J., Wieder, J., et al. Risk group assesment and clinical outcome algorithm to predict the natural of patiens with surgically resectd renal Carcinoma. J. Clin. Oncol., 2002; 20(2): 4559–4566.
14. Vít, V. Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování. Urol. List, 2010; 8(2): 11–15.
15. Kawaciuk, I., Dušek, P., Hyršl, L., Jarolím, L., Janík, V., Schmidt, M., Kaliská, V., Chocholatý, M., Urbanová, M. Rozměr nádoru, staging a grading malignity v prognóze karcinomu ledviny. Ces. Urol., 2005; 9(3): 36–43.
16. Kolombo, I., Poněšický, J., Podšívá, M., Pabišta, R., Porš, J., Kříž, R., Toběrný, M., Černohorský, S., Beňo, P., Kašík, J., Blažej, S., Tobiáš, J., Gronka, L., Bartůněk, M. Pokročilý karcinom ledviny – současné trendy terapie (1. část). Urolog. pro Praxi, 2009; 10(3): 182–189.
17. Kolombo, I., Poněšický, J., Podšívá, M., Pabišta, R., Porš, J., Kříž, R., Toběrný, M., Černohorský, S., Beňo, P., Kašík, J., Blažej, S., Tobiáš, J., Gronka, L., Bartůněk, M. Pokročilý karcinom ledviny – současné trendy terapie (2. část). Urolog. pro Praxi, 2009; 10(4): 218–230.
18. Flanigan, R. C., Mickisch, G., Sylvester, R., et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: A combined analysis. J. Urol., 2004; 171(3): 1071–1076.
19. Escudier, B., Pluzanska, A., Koralewski, P., et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma.: A randomized double-blind phase III trial. Lancet, 2007; 370(9605): 2103–2111.
20. Motzer, R. J., Hutson, T. E., Tomczak, P., et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N. Engl. J. Med., 2007; 356(2): 125–134.
21. Motzer, R. J., Escudier, B., Oudart, S., et al. Efficacy of everolimus in advanced renal cell carcinoma: A double-blind, randomized, placebo-controlled phasde III trial. Lancet, 2008; 372(9637): 449–456.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Rozloučení
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Traumatická atlantoaxiálna rotačná fixácia u dieťaťa
- Intratorakální struma – nediagnostikovaná – přece odoperovaná
- Axilárna disekcia v manažmente chirurgickej liečby invazívneho karcinómu prsníka u postmenopauzálnych pacientok
- Torze omenta – neobvyklá příčina náhlé příhody břišní
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Segmentální absence muscularis propria stěny tračníku – vzácná příčina perforace tračníku v těhotenství
- Mucinózní adenokarcinom apendixu – kazuistika
- Intraoperační radioterapie v multimodalitní léčbě lokálně pokročilého karcinomu rekta
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Lymfatické mapování a biopsie sentinelových uzlin s použitím kombinované metodiky in vivo aplikace Patentblue a radiokoloidu a ex vivo detekce metastatického postižení lymfatických uzlin u kolorektálního karcinomu
- Poranění pánve z pohledu urogynekologie. Souborný referát
- Mapování povrchového žilního systému před a po operaci varixů – literární souhrn specifických aspektů při vyšetřování duplexní sonografií
- Rozloučení
- VÝZNAMNÁ POCTA ČESKÉ CHIRURGII
- Zápis z jednání schůze výboru ČCHS dne 11. 11. 2010
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mucinózní adenokarcinom apendixu – kazuistika
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Torze omenta – neobvyklá příčina náhlé příhody břišní
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



