-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
Biological therapy in women with inflammatory bowel disease during pregnancy
The aim of this article is to objective review available research data regarding the safety of biological therapies during pregnancy and breastfeeding in women with inflammatory bowel disease. Biological therapies appear to be safe in pregnancy, as no increased risk of malformations has been demonstrated. Available clinical results suggest that the efficacy of infliximab and adalimumab in achieving clinical response and maintaining remission in pregnant patients might outweigh the theoretical risks of drug exposure to the fetus. If possible, anti-TNF therapy should be stopped by the end of the second trimester due to transplacental transfer and potential risk for the fetus. The use of infliximab and adalimumab is probably compatible with breastfeeding.
Key words:
adalimumab – breastfeeding – inflammatory bowel disease – infliximab – pregnancy
Autoři: Jana Koželuhová; Karel Balihar; Eva Janská; Lucie Fremundová; Martin Matějovič
Působiště autorů: Gastroenterologické a hepatologické oddělení I. interní kliniky LF UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D.
Vyšlo v časopise: Prakt Gyn 2014; 18(3): 190-194
Kategorie: Gynekologie a porodnictví: Přehledový článek
Souhrn
Předmětem této práce je objektivně posoudit dostupná výzkumná data týkající se bezpečnosti biologické terapie v těhotenství a kojení pacientek s idiopatickými střevními záněty. Biologická léčba se zdá být v graviditě bezpečná bez zvýšeného rizika vrozených malformací. Dostupné klinické údaje naznačují, že účinnost infliximabu a adalimumabu v dosažení klinické odpovědi a udržení remise těhotných pacientek převažuje teoretické riziko ohrožení plodu těmito léky. Terapie anti-TNFα preparáty by měla být, pokud je to možné, ukončena na konci 2. trimestru pro transplacentární přestup a z toho vyplývající riziko pro plod. Užití infliximabu a adalimumabu je pravděpodobně slučitelné s kojením.
Klíčová slova:
adalimumab – idiopatické střevní záněty – infliximab – kojení – těhotenstvíÚvod
Idiopatické střevní záněty (ISZ) jsou chronická zánětlivá onemocnění střev, která se dělí do dvou základních forem: Crohnova nemoc (CN) a ulcerózní kolitida (UC). Jak Crohnova nemoc, tak ulcerózní kolitida postihují zejména mladé nemocné v jejich reprodukčním věku. Mladé ženy s ISZ pochopitelně vyjadřují zájem o vliv jejich základní choroby na fertilitu a průběh těhotenství a také o vliv gravidity na průběh jejich nemoci. Obávají se o vývoj plodu, zajímá je vedení porodu a možnost kojení. Ani v současné době není u pacientek s ISZ výjimkou dobrovolná bezdětnost, která je dána obavou z gravidity, která jim byla v minulosti nepodloženě prezentována jako potencionálně nebezpečná [1,2]. Předmětem zájmu jak lékařů, tak pacientek je samozřejmě také vliv chronické medikace na fertilitu, graviditu a plod. Je třeba se zbavit mýtů, které vedou v neuvážené ukončení terapie ISZ z obavy z rizik na graviditu a plod, a tím vystavení nemocné nebezpečí akutního vzplanutí základní nemoci, které by ve svém důsledku mohlo být pro průběh gravidity a vývoj plodu daleko větším nebezpečím než samotná medikace. Cílem přehledného referátu je detailně zhodnotit bezpečnost léčby podávané pacientkám s ISZ v graviditě se zaměřením na užití biologické terapie. Současně rozebíráme aspekty týkající se léčby idiopatických střevních zánětů ve vztahu k prekoncepčnímu období, graviditě a vlivu na plod vyúsťující v praktická doporučení ve snaze předcházet komplikacím s využitím všech poznatků specializovaného centra pro pacienty s idiopatickými střevními záněty.
Anti-TNFα protilátky v graviditě
Anti-TNFα preparáty, jmenovitě infliximab, adalimumab, golimumab a certolizumab, jsou běžně užívané v léčbě středně těžké až těžké Crohnovy nemoci a ulcerózní kolitidy. Certolizumab není dosud v České republice registrován, ale je třeba se o něm v širším kontextu zmínit. Pro golimumab nejsou zatím dostatečná data týkající se bezpečnosti v graviditě. TNFα je prozánětlivý cytokin, který stimuluje produkci prostaglandinů. V těhotenství se jeho hladina významně zvyšuje a je produkován zejména placentou. TNFα je důležitý v iniciálním stadiu gravidity, kde hraje roli v rozvoji fetálního imunitního systému. Na druhou stranu, TNFα cytokin bývá současně asociován s rozvojem gestačního diabetu, preeklampsií a obezitou [3–5]. Infliximab (IFX) a adalimumab (ADA) jsou IgG1 monoklonální protilátky s Fc komponentou, zatímco certolizumab je Fab fragment IgG1. Imunoglobuliny jsou velké hydrofilní molekuly, které nemohou být přeneseny prostou difuzí a vyžadují aktivní transport skrze placentu cestou specifických receptory zprostředkovaných vazeb [3]. I přes jistou roli TNFα v těhotenství, léčba anti-TNFα protilátkami se zdá být bezpečná v prekoncepčním období a v 1. trimestru gravidity, protože IgG protilátky ještě nepřestupují placentu. Transplacentární IgG transport se odehrává v průběhu 2. trimestru, ale zejména během 3. trimestru. Mateřské imunoglobuliny G poskytují plodu dostatečnou získanou imunitu, dokud nedosáhne vlastního plně funkčního imunního systému [6]. Strukturálně rozdílné anti-TNFα protilátky vykazují rozdílné procento placentárního transferu. Zatímco medián koncentrace IFX v pupečníkové a v krvi novorozence v době porodu dosahuje asi 160 % mediánu koncentrace v krvi matky a hladina ADA je asi 153 %, tak hladina certolizumabu se pohybuje v krvi novorozence a pupečníku pod 4 % [5]. Všechny poznatky týkající se vztahu anti-TNFα protilátek v graviditě a jejich vlivu na plod jsou důležité v dalším managementu biologické terapie pacientek s idiopatickými střevními záněty.
Bezpečnost biologické léčby ISZ v graviditě
Většina léků včetně biologické terapie užívané k léčbě ISZ v graviditě byla shledána bezpečnou a kompatibilní s graviditou i kojením. Všeobecně se jeví, že ukončení trvalé medikace, která je zavedena v rámci udržení remise ISZ, připraví možnost akutního vzplanutí nemoci, což je ve svém důsledku více rizikové pro vývoj gravidity a plod než vlastní medikace [1,2,6–9]. Proto je všeobecně doporučeno provést důkladný pohovor s pacientkou před koncepcí, aby nedošlo k nežádoucím změnám v zavedené léčbě jak samotnou nemocnou, tak jejím lékařem. Je nutné pacientku předem poučit, že každou změnu medikace, ač navrhovanou gynekology či pediatry, je třeba nejdříve prodiskutovat s ošetřujícím gastroenterologem. Australská studie ověřovala znalosti pacientek s ISZ pomocí dotazníku Crohn´s and Colitis Pregnancy Knowledge (CCPKnow) a zjistila, že nízké skóre CCPKnow je asociováno s malou adherencí k terapii v graviditě a že pouze 1/3 nemocných považuje svoji léčbu bezpečnou pro nenarozené dítě [10]. Ukazuje se, že pacientka, která obdrží důkladné vysvětlení problému a má jasný léčebný plán před koncepcí, je více adherentní k zavedené terapii i v těhotenství a z toho vyplývá méně komplikací v graviditě [1].
Všechny anti-TNFα preparáty, jmenovitě infliximab, adalimumab, golimumab a certolizumab, jsou Úřadem pro kontrolu potravin a léčiv Spojených států (US Food and Drug Administration – FDA) klasifikované v graviditě do kategorie B (tab. 1) a podle Evropské organizace pro ISZ (European Crohn´s and Colitis Organisation – ECCO) jako pravděpodobně bezpečné (tab. 2), což značí, že lék ve zvířecích studiích neprokázal riziko pro plod, ale nejsou adekvátní studie u lidí nebo že animální studie vykázaly nežádoucí účinek léku, ale adekvátní a dobře kontrolované studie u těhotných žen tento nežádoucí účinek nepotvrzují v 1. trimestru s možným předpokladem, že se neobjeví ani v dalším průběhu gravidity (tab. 1). Publikované evidence o bezpečnosti anti-TNFα v těhotenství se skládají zejména z kazuistických sdělení a kohortových studií, nicméně recentní rozsáhlá systematická metaanalýza zahrnující 58 publikací s celkovým počtem 472 pacientek léčených v těhotenství biologickou léčbou neprokázala asociaci mezi anti-TNFα preparáty aplikovanými v době gravidity a výskytem vrozených malformací plodu [11] ani zhoršení průběhu těhotenství [9,12,13]. Prospektivní registr PIANO (The Pregnancy of Inflammatory Bowel Disease and Neonatal Outcomes), které do této doby čítá kolem 1 200 těhotných pacientek léčených různými biologickými léky bez nebo v kombinaci s imunosupresivy, hlásí 357 pacientek léčených biologickou terapií, navíc 109 nemocných s ISZ je na kombinované terapii jednoho z anti-TNFα preparátu s azatioprinem. Z biologické léčby užívá 264 gravidních žen s ISZ infliximab, 151 adalimumab a 67 na certolizumab. Předběžná analýza ze září roku 2013 neukázala zvýšený výskyt vrozených malformací, není větší riziko závažných infekcí do 1 roku života, ani rozdíl v porodní výšce či hmotnosti novorozence ve vztahu k výše uvedené léčbě. Ve skupině pacientek léčených kombinací anti-TNFα s azatioprinem je vyšší riziko předčasného porodu ve srovnání s ženami, které nejsou léčené ani jedním z uvedených preparátů. Z hlediska subpopulace ISZ gravidní nemocné s Crohnovou nemocí nevykazují žádné nežádoucí okolnosti ve vztahu k léčbě v průběhu gravidity na rozdíl od žen s ulcerózní kolitidou, u kterých je zaznamenán vyšší výskyt předčasných porodů a nízké porodní hmotnosti novorozence. Zajímavým zjištěním je fakt, že nemocné s ulcerózní kolitidou mají tendenci mít vyšší procento aktivity nemoci než ženy s Crohnovou nemocí [14]. Databáze FDA sledující bezpečnost léků uvádí, že terapie anti-TNFα preparáty může být asociována s výskytem mnohočetných vrozených vad uváděných komplexně jako VACTERL syndrom (vertebral abnormalities, anal atresia, cardiac abnormalities, tracheoeosophagel fistula, esophageal atresia, renal abnormalities, limp abnormalities), jedná se o výskyt mnohočetných vrozených vad týkajících se různých orgánů. Nicméně aby se mohlo hovořit o VACTERL syndromu, musí se najednou objevit minimálně 3 z výše uvedených vrozených malformací, což nebylo nikdy prokázáno u novorozenců žen léčených v graviditě biologickou terapií [6,15].
Tab. 1. Biologická terapie ISZ a riziko v těhotenství – kategorizace léčiva dle FDA 
Tab. 2. Biologická terapie ISZ a riziko v těhotenství – kategorizace léčiva dle ECCO 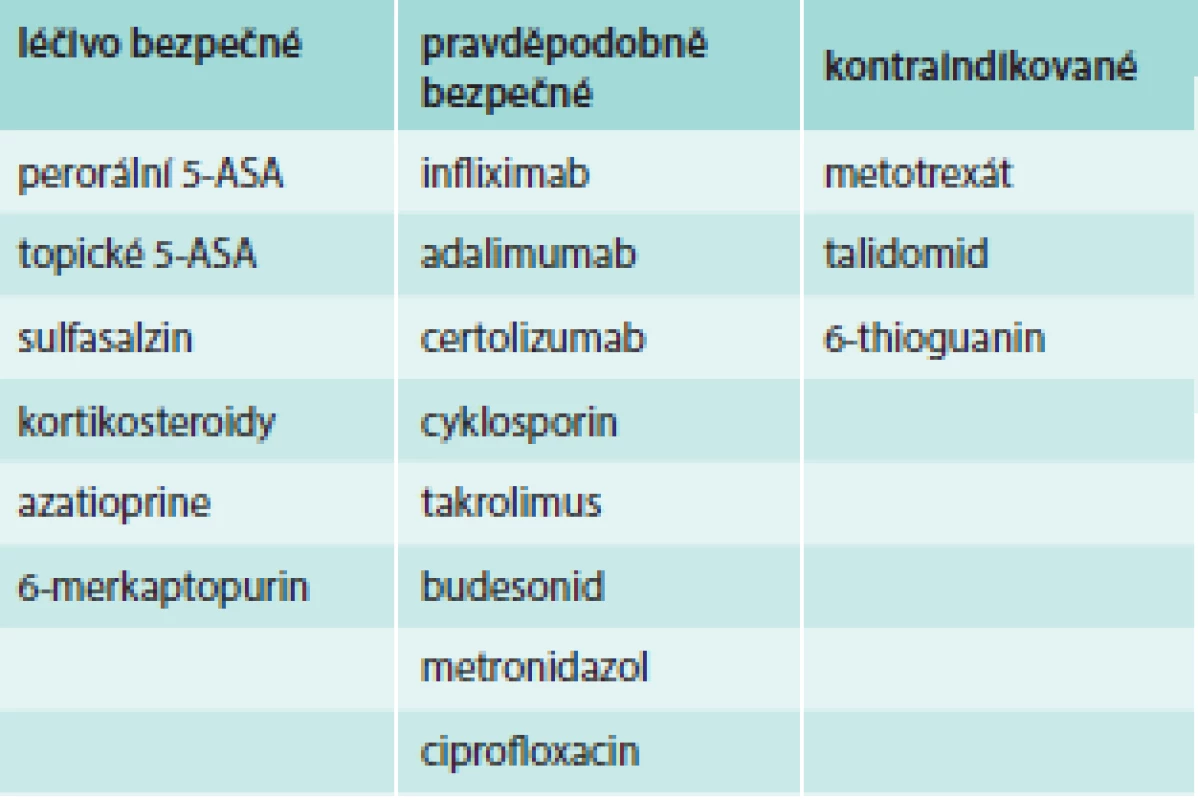
Vedení biologické léčby v graviditě
Jak jsme již uváděli, plod je v děloze vystaven infliximabu (IFX) či adalimumabu (ADA) díky aktivnímu placentárnímu transferu, což může hrát roli ve vývoji jeho imunitního systému a potencovat zvýšené riziko infekce novorozence po porodu. Anti-TNFα preparáty přestupují placentu minimálně již od brzkého 2. a zejména ve 3. trimestru [3]. Existuje pozitivní korelace mezi výší hladiny léku v pupečníkové krvi s délkou gravidity vyjádřenou počtem gestačních týdnů v době poslední expozice, tedy jak dlouho před porodem byla aplikována poslední dávka IFX či ADA [7,16]. V době porodu dosahuje hladina IFX a ADA v pupečníkové krvi a novorozence přibližně 1,5krát vyšší hodnoty, než je zjištěna u matky, a lék je detekovatelný ještě v 6. měsíci věku novorozence [5,16]. Anti-TNFα produkty bez Fc komponenty umožňující aktivní transplacentární přestup, na rozdíl od toho jsou preparáty bez Fc fragmentu přeneseny placentou pasivně. Tyto preparáty, kterým je např. certolizumab, jsou zjištěné v pupečníkové a v krvi novorozence v nepatrném množství [5]. Na základě těchto znalostí se vedou debaty o optimálním načasování anti-TNFα terapie během gravidity. Je jasné, že certolizumab je možné aplikovat po celou dobu gravidity bez vlivu na plod, potažmo novorozence. Není zatím zcela evidentní, kdy ukončit ostatní anti-TNFα preparáty před porodem. Teoretické riziko vlivu léku na plod a novorozence musí převážit riziko imunizace matky, která by po vysazení remisi udržující léčby mohla dospět do významného relapsu ISZ. Relaps, jak již víme, může ohrozit vývoj plodu více než samotná terapie [1,17]. Pokud je nemocná v dlouhodobé hluboké remisi ISZ, někteří autoři doporučují brzké vysazení biologické terapie již ve 20. gestačním týdnu těhotenství [18], v další studii se jako nejspolehlivější interval ukončení zdá být 22.–24. týden gravidity [7]. V ostatních případech je načasování poslední dávky anti-TNFα preparátu nutné tak, aby se mohla pacientka ihned po porodu bezpečně vrátit ke své zavedené terapii bez rizika nežádoucích reakcí. Ideální je ukončení aplikace infliximabu mezi 30.–32. gestačním týdnem a u adalimumabu, s ohledem na jeho kratší poločas, se pokračuje až do 36.–38. týdne gravidity. Změna terapie na certolizumab v průběhu těhotenství se nedoporučuje, pokud žena s ISZ v remisi užívá IFX či ADA, z důvodu placentárního přenosu anti-TNFα na plod [19]. Rozhodnutí o načasování ukončení biologické terapie v těhotenství musí být přísně individuální [2,6,9,20].
Novorozenec a biologická terapie matky v graviditě
Nízké riziko vrozených malformací dětí pacientek léčených biologickými léky již bylo prezentováno. Předběžná data z registru PIANO neukazují na vyšší výskyt závažných infekcí dětí v 1. roce života [12,13]. Dle výsledků jiných autorů neměla biologická léčba sice vliv na poruchy růstu či psychomotorický vývoj dětí, ale dosáhlo se relativně vysokého počtu infekcí a vyšší frekvence použití antibiotik u dětí matek na biologické terapii. Sami autoři spekulují, zda má toto zjištění statistickou významnost zejména vzhledem k nepřítomnosti kontrolní skupiny dětí matek s ISZ neléčených nebo matek bez ISZ [21]. Aplikace anti-TNFα preparáty v těhotenství žen s ISZ má však i praktické důsledky pro jejich dítě. Transfer anti-TNFα protilátek do fetální krve v posledním trimestru gravidity může znamenat pro novorozence během jeho prvních měsíců života potencionální riziko infekce a nežádoucí odpovědi na běžně zavedenou vakcinaci [1,9]. Smutnou připomínkou tohoto faktu je úmrtí zdravého nekojeného novorozence, který byl kalmetizován BCG vakcínou ve 3. měsících života a krátce po té zemřel na těžkou sepsi z důvodu diseminované tuberkulózy. Jednalo se o dítě matky s ISZ léčené po celou dobu gravidity infliximabem [22]. Z tohoto důvodu a s ohledem na znalost vysokých hladin biologických léčiv v krvi novorozenců, byla stanovena jednoznačná doporučení v plánování běžného očkovacího kalendáře dětí narozených matkám s ISZ, které byly v průběhu gravidity léčeny jedním z anti-TNFα preparátů. Očkování vakcínami (rubeola, varicela zooster, rotavirus, poliomyelitida a BCG) musí být posunuto minimálně o 3 měsíce dle ECCO (European Crohn´s and Colitis Organisation) doporučení [2,23]. Avšak v průběhu let a se znalostí dlouhodobého přetrvávání hladin anti-TNFα protilátek v krvi novorozenců, je navrženo odložení vakcinace živými vakcínami až po 6.-7. měsíci života novorozence, do doby, kdy se již předpokládá adekvátní humorální imunitní odpověď [1,6,19,24]. Současná vakcinační strategie s neživými vakcínami není limitována a je možné je aplikovat podle zvyklostí [6,13].
Kojení a biologická léčba
IgA je predominantní imunoglobulin v mateřském mléce a sekrece anti-TNFα protilátek v mléce je velmi limitovaná. Všechny anti-TNFα preparáty, v našich podmínkách tedy infliximab a adalimumab, jsou zjišťovány v mateřském mléce opakovaně pod detekovatelnou hranicí, tedy v zanedbatelném množství. Nebyly zjištěny žádné nežádoucí účinky u dětí kojených matkami na této terapii. Avšak vzhledem k tomu, že se jedná o výsledky prací s malými soubory, musí být terapie kojící matky anti-TNFα preparáty pečlivě monitorována a pokud by bylo možné, je doporučováno měření protilátek v mléce a u novorozenců [2]. V posledních letech však žádné studie neprokázaly vztah mezi kojením a zvýšeným rizikem infekce, poukazují na bezpečnost kojení i v době terapie anti-TNFα preparáty [4,13].
Praktické shrnutí
- vysoká aktivita nemoci má nejvyšší negativní vliv na vývoj plodu a průběh gravidity
- většina léků užívaných v terapii ISZ je bezpečná v těhotenství a laktaci
- infliximab je možné ponechat v graviditě do konce 2. nebo do počátku 3. trimestru
- adalimumab může bezpečně pokračovat v aplikaci do 36.-38. týdne gravidity
- je možné aplikovat terapii anti-TNFα po celou dobu gravidity, pokud to vyžaduje aktivita idiopatického střevního zánětu
- jak v pupečníkové krvi, tak u novorozence jsou vysoké sérové hladiny IFX a ADA, proto by měl být upraven očkovací kalendář novorozence a aplikace živých vakcín by neměla být provedena do 6.–7. měsíce věku dítěte
- není doporučována změna biologického léčiva za jiné v průběhu gravidity z důvodu placentárního transferu
Závěr
Idiopatické střevní záněty postihují často mladé ženy v jejich reprodukčním věku. Pacientky s idiopatickými střevními záněty mají téměř stejnou šanci otěhotnět jako ženy zdravé. Ideální je dosažení klidového stadia ISZ před koncepcí a tuto remisi udržovat po celou dobu těhotenství s ohledem na redukci rizika spontánních abortů a předčasného porodu. Většina ISZ medikace je bezpečně podávána v průběhu gravidity a laktace. Biologická terapie je dobře tolerována, bez vedlejších účinků na průběh těhotenství a plod. Ukončení podávání anti-TNFα terapie v posledním trimestru je ve snaze o snížení hladiny IFX, potažmo ADA v krvi novorozence. Léčebné možnosti v posledních 2 dekádách významně pokročily, zejména na poli biologické terapie. Pro gastroenterology a ostatní lékaře pečující o těhotné ženy s idiopatickými střevními záněty je důležité znát všechna data týkající se biologické terapie ISZ v průběhu gravidity, aby jejich následná doporučení vedla k úspěšnému průběhu těhotenství a narození zdravého dítěte (obr. 1 a 2) Je nutné, aby probíhaly další multicentrické prospektivní studie, jejichž výsledky by měly přinést gastroenterologům informace umožňující optimalizovat terapii těhotných pacientek s idiopatickými střevními záněty.
Obr. 1. Zdravý novorozenec, chlapec narozený pacientce s ISZ v graviditě léčené adalimumabem 
Obr. 2. Zdravý novorozenec, dívka narozená pacientce s ISZ v graviditě léčené infliximabem 
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Otištěno s laskavým svolením autorů, šéfredaktora a redakční rady časopisu Vnitřní lékařství a vydavatelství Facta Medica
Poprvé publikováno ve Vnitř Lék 2014; 60(7–8): 630–634.
MUDr. Jana Koželuhová
kozeluhova@fnplzen.cz
MUDr. Karel Balihar,
MUDr. Eva Jánská
MUDr. Lucie Fremundová
prof. MUDr. Martin Matějovič, Ph.D.
Gastroenterologické a hepatologické oddělení I. interní kliniky LF UK a FN Plzeň
www.fnplzen.cz
Zdroje
1. Ng SW, Mahadevan U. My treatment approach to management of the pregnant patient with inflammatory bowel disease. Mayo Clin Proc 2014; 89(3): 355–360.
2. van der Woude CJ, Kolacek S, Dotan I et al. European evidenced-based consensus on reproduction in inflammatory bowel disease. J Crohns Colitis 2010; 4(5): 493–510.
3. Gisbert JP, Chaparro M. Safety of anti-TNF agents during pregnancy and breastfeeding in women with inflammatory bowel disease. Am J Gastroenterol 2013; 108(9): 1426–1438.
4. Huang VW, Habal FM. From conception to delivery: managing the pregnant inflammatory bowel disease patient. World J Gastroenterol 2014; 20(13): 3495–3506.
5. Mahadevan U, Wolf DC, Dubinsky M et al. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11(3): 286–292.
6. Vermeire S, Carbonnel F, Coulie PG et al. Management of inflammatory bowel disease in pregnancy. J Crohns Colitis 2012; 6(8): 811–823.
7. Bortlik M, Machkova N, Duricova D et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti-TNF-alpha therapy during pregnancy: three-center study. Scand J Gastroenterol 2013; 48(8): 951–958.
8. Dubinsky M, Abraham B, Mahadevan U. Management of the pregnant IBD patient. Inflamm Bowel Dis 2008; 14(12): 1736–1750.
9. Mahadevan U, Cucchiara S, Hyams JS et al. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn’s and Colitis Organisation: pregnancy and pediatrics. Am J Gastroenterol 2011; 106(2): 214–223.
10. Selinger CP, Eaden J, Selby W et al. Inflammatory bowel disease and pregnancy: lack of knowledge is associated with negative views. J Crohns Colitis 2013; 7(6): e206-e213.
11. Nielsen OH, Loftus jr. EV, Jess T. Safety of TNF-alpha inhibitors during IBD pregnancy: a systematic review. BMC Med 2013; 11 : 174.
12. Schnitzler F, Fidder H, Ferrante M et al. Outcome of pregnancy in women with inflammatory bowel disease treated with antitumor necrosis factor therapy. Inflamm Bowel Dis 2011; 17(9): 1846–1854.
13. Yarur A, Kane SV. Update on pregnancy and breastfeeding in the era of biologics. Dig Liver Dis 2013; 45(10): 787–794.
14. Mahadevan U, Martin CF, Sandler RS. PIANO: A 1,000-Patient Prospective Registry of Pregnancy Outcomes in Women with IBD Exposed to Immunomodulators and Biologic Therapy. A special meeting review edition: Highlights in Crohn’s Disease and Ulcerative Colitis: Digestive Disease Week 2012 May 19–22, 2012, San Diego, California. Gastroenterol Hepatol 2012; 8(8 Suppl 5): 1–24.
15. Koren G, Inoue M. Do tumor necrosis factor inhibitors cause malformations in humans. J Rheumatol 2009; 36(3): 465–466.
16. Zelinkova Z, Pierik MJ, Kuipers EJ et al. High intra-uterine exposure to infliximab following maternal anti-TNF treatment during pregnancy. Aliment Pharmacol Ther 2011; 33(9): 1053–1058.
17. Ng SW, Mahadevan U. Management of inflammatory bowel disease in pregnancy. Expert Rev Clin Immunol 2013; 9(2): 161–173.
18. Zelinkova Z, van der Ent C, Bruin KF et al. Effects of discontinuing anti-tumor necrosis factor therapy during pregnancy on the course of inflammatory bowel disease and neonatal exposure. Clin Gastroenterol Hepatol 2013; 11(3): 318–321.
19. Friedman S, Mc Elrath TF, Wolf JL. Management of fertility and pregnancy in women with inflammatory bowel disease: a practical guide. Inflamm Bowel Dis 2013; 19(13): 2937–2948.
20. Mahadevan U. Pregnancy and inflammatory bowel disease. Med Clin North Am 2010; 94(1): 53–73.
21. Bortlik M, Duricova D, Machkova N et al. Impact of anti-tumor necrosis factor alpha antibodies administered to pregnant women with inflammatory bowel disease on long-term outcome of exposed children. Inflamm Bowel Dis 2014; 20(3): 495–501.
22. Cheent K, Nolan J, Shariq S et al. Case Report: Fatal case of disseminated BCG infection in an infant born to a mother taking infliximab for Crohn’s disease. J Crohns Colitis 2010; 4(5): 603–605.
23. Rahier JF, Ben-Horin S, Chowers Y et al. European evidence-based Consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2009; 3(2): 47–91.
24. Rahier JF, Magro F, Abreu C et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2014; 8(6): 443–468.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek EditorialČlánek EMAS HRT Excellence Day
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2014 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Editorial
- Rozhovor s doc. MUDr. Pavlem Strnadem, CSc., předsedou senologické sekce ČGPS ČLS JEP, o roli a úkolech senologie v Česku a o jeho nejnovější publikaci Nemoci prsu v každodenní praxi
- Vulvovaginitis v dětském věku
- Přínosy norgestimátu v kombinované hormonální antikoncepci
- Specifika diabetes mellitus u žen
- Syndrom polycystických ovarií a diabetes mellitus
- Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
- Psychologie je servisní obor – slouží tam, kde je potřeba
- Imunoprofylaxe RhD erytrocytární aloimunizace
- Využití terapeutických materiálů při hojení ran v gynekologii
- Využití terapeutických materiálů při hojení ran v gynekologii
- Jestli jste si nevšimli, tak česká populace začíná vymírat
- EMAS HRT Excellence Day
- In memoriam profesora Evžena Čecha
- Jana Vrbíková, Michael Fanta, Dana Koryntová. Syndrom polycystických ovarií.
- Pavel Strnad. Nemoc prsu v každodenní praxi.
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vulvovaginitis v dětském věku
- Imunoprofylaxe RhD erytrocytární aloimunizace
- Syndrom polycystických ovarií a diabetes mellitus
- Přínosy norgestimátu v kombinované hormonální antikoncepci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



