-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam hyaluronátu v gynekologii a porodnictví
The effect of hyaluronate in gynaecology and obstetrics
Hyaluronate is a nonsulfated glycosaminoglycan which is the most important component of the intercellular matter. Apart from it creating a sort of scaffolding for cells, it also has the ability to bind water and thus contribute to optimizing of tissue hydration. Hyaluronate is actively involved in the immunological processes as a signal molecule and affects the mobility and adhesion of cells within their proliferation and differentiation. These characteristics are used to speed up the healing and epithelization of injuries and inflammations.
Key words:
adhesion – hyaluronic acid – preoperative adhesion prevention – barriers
Autoři: Viktor Križan; Soňa Pánková; Robert Hudeček
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno
Vyšlo v časopise: Prakt Gyn 2012; 16(1): 7-12
Kategorie: Gynekologie a porodnictví
Souhrn
Hyaluronát je nesulfatovaný glykosaminoglykan, který je nejdůležitější složkou mezibuněčné hmoty. Vedle skutečnosti, že pro buňky vytváří jakési lešení, má také schopnost na sebe vázat vodu a přispívat tak k optimalizaci hydratace tkáně. Aktivně se účastní imunologických dějů jako signální molekula a ovlivňuje mobilitu a adhezivitu buněk v rámci jejich proliferace a diferenciace. Tyto vlastnosti se využívají při urychlení hojení a epitelizace poranění a zánětů.
Klíčová slova:
adheze – hyaluronová kyselina – peroperační antiadhezivní prevence – bariéryÚvod
Hyaluronát (kyselina hyaluronová či hyaluronan – HA) je nesulfatovaný glykosaminoglykan, který je nejdůležitější složkou mezibuněčné hmoty. Lidské tělo o hmotnosti 70 kg obsahuje přibližně 15 g této látky, přičemž je neustále obnovována [1].
Vedle všeobecně známé skutečnosti, že pro buňky vytváří jakési lešení, bývá zmiňován v kontextu své schopnosti na sebe vázat vodu a přispívat tak k optimalizaci hydratace tkáně. Aktivně se účastní imunologických dějů jako signální molekula a ovlivňuje mobilitu a adhezivitu buněk v rámci jejich proliferace a diferenciace. Tyto vlastnosti se využívají při urychlení hojení a epitelizace poranění a zánětů (kůže, dutiny ústní, vaginální sliznice, epitelu čípku děložního) [1].
Po chemické stránce se jedná o nevětvený mukopolysacharid složený z β(1,3)-D-glukuronové kyseliny a β(1,4)-N-acetyl-D-glukosaminu v poměru 1 : 1. Rozpouští se ve vodě za vzniku viskoelastického roztoku [1].
Hyaluronát a jeho úloha v lidském těle
V lidském těle je hyaluronát základní stavební jednotkou mezibuněčné matrix. Jeho zvýšená tvorba je ovlivněna celou řadou faktorů a působků, mezi jinými např. transformujícím růstovým faktorem TGFβ1, který podporuje expresivitu mRNA pro HA-syntázu [2]. Ještě výraznější účinek je možné pozorovat při podání destičkového růstového faktoru (platelet derive growth factor – PDGF) a v menší míře i při podání endoteliálního růstového faktoru (endotelial growth factor – EGF) [3]. Nejvyšší zastoupení hyaluronátu v lidském těle je v mezibuněčné hmotě (> 2,5 g/l), pupečníku a synoviální tekutině (2–4 g/l) [1].
Imunitní reakce
HA ovlivňuje zánětlivé a autoimunitní reakce [4]. V in vitro studii byl prokázán příznivý vliv nízkomolekulárního hyaluronátu na aktivaci a maturaci dendritických buněk za přítomnosti zánětu [5].
Regenerace tkání a reepitelizace
HA urychluje regeneraci tkání a reepitelizaci. Je induktorem proliferace fibroblastů a novotvorby kolagenu, zejména typu I a III. Dochází k tvorbě granulační tkáně a rychlejšímu vyplnění chybějící tkáně v místě poranění [1]. V poslední době se objevuje stále více studií zaměřených na využití hyaluronátu u porušené slizniční integrity. Tyto studie vycházejí z dřívějšího pozorování u zvířat, podle nichž HA výrazně usnadňoval hojení a omezoval jizvení [6].
Embryogeneze
Hyaluronát ovlivňuje embryogenezi, jeho přítomnost je velmi důležitá v přípravě endometria na případnou nidaci oplozeného vajíčka [7]. Pro nově vzniklé a diferencované buňky vytváří společně s dalšími molekulami (laminin, fibronektin, heparan-sulfát či kolagen IV) opěrnou síť a současně participuje na udržování stálosti prostředí [1]. Hyaluronát se začal využívat i v metodice umělého oplodnění – PICSI (preselected sperm intracytoplasmic injection), při které se využívá možnosti selekce zralých spermií na základě jejich schopnosti vázat se k hyaluronátovému hydrogelu, protože pouze hlavička zralé spermie nese receptor, který tuto vazbu umožňuje [19].
Kancerogeneze
HA moduluje kancerogenezi, je známo nejméně 14 typů karcinomů, u kterých byla zjištěna zvýšená koncentrace hyaluronátu jak v buňkách samotných, tak i v mezibuněčném stromatu [8]. Není však jasné, zdali jsou tato zjištěná množství hyaluronátu vlastní příčinou nebo spíše až důsledkem některého jiného patologického pochodu.
Angiogeneze
HA zasahuje také do procesu angiogeneze. Zatímco nízkomolekulární HA ji povzbuzuje, vysokomolekulární HA ji naopak inhibuje, a to jak na úrovni ovlivnění migrace, tak i proliferace samotných endoteliálních buněk [9].
Etiologie vzniku srůstů
Srůsty patří mezi nejčastější komplikace abdominálních operací a zejména pak operací v malé pánvi. Postoperačně vzniklé adheze souvisejí s rizikem vzniku obstrukčního ileu nebo chronické pánevní bolesti. Jako další negativní důsledek přítomných srůstů v malé pánvi jsou reprodukční dysfunkce. Jedná se zejména o sekundární sterilitu, nejčastěji na podkladě tubárního faktoru či dyspareunií. Adhezivní proces současně představuje potenciální příčinu obtíží při iterativním operačním vstupu. Zvyšuje riziko morbidity a mortality pacienta i ekonomickou nákladnost invazivního vstupu [10]. Adheze vznikají u 60–90 % pacientek, které absolvovaly velkou gynekologickou operaci. I přes pokrok, který zaznamenaly jednotlivé chirurgické techniky v posledních letech, se zátěž pacienta způsobená komplikacemi souvisejícími s adhezemi nezměnila. Tyto komplikace jsou navíc často nepředvídatelné, mohou se objevit i po mnoha letech po primárním operačním vstupu. Tyto sekundární stavy tak bývají často ošetřovány jinými lékaři nebo specialisty, než těmi, kteří tvořili původní operační tým. I přesto, že etiologie vzniku adhezí v malé pánvi není dosud zcela komplexně odhalena [11], modifikace chirurgických technik ve smyslu minimálně invazivní operativy jednoznačně snižuje riziko vzniku pooperačních srůstů [12]. Globální dopad vzniku adhezí v souvislosti s operačním výkonem na zdravotnický systém jako celek je obrovský a jednoznačně negativní (schéma).
Schéma. Patofyziologické mechanizmy vzniku adhezí 
Adhezivní proces lze definovat jako abnormální spojení mezi tkáněmi a orgány, které může být buď vrozené či získané. Vznik sekundárních adhezí je ve své podstatě posttraumatickou reakcí peritonea. Toto poškození může být buď iatrogenní, v souvislosti s použitou operační technikou, nebo může zahrnovat řadu dalších etiologických faktorů. Mezi ty nejvýznamnější patří působení infekčního agens, iritace peritonea střevním obsahem, lokální ischemizace, podráždění cizím tělesem, jako je šicí materiál, pudr z rukavic apod. Nejrizikovějším obdobím pro vznik srůstů je 3. až 5. postoperační den [11]. Významnou roli v pooperační tvorbě srůstů hraje peritoneum. Je to nejrozsáhlejší serózní membrána v těle, která slouží k minimalizaci tření a usnadňuje volný pohyb abdominálních orgánů v dutině břišní. Podílí se na ochraně proti infekci a na jejím případném ohraničení a lokalizaci. Peritoneum je tvořeno jednoduchou vrstvou buněk mezotelu ležících na submezotelové matrici pojivové tkáně, která obsahuje četné kapiláry a lymfatické kanálky. Povrch peritonea je pak kryt fosfolipidovou vrstvou.
Drobná mikrotraumata peritonea v průběhu operace vedou k narušení peritoneálního mezotelu, který uvolňuje fibrin a řadu dalších prvků, včetně leukocytů a buněk mezotelu. Příčinou následného vzniku adhezí je pak lokální zánětlivá reakce. V důsledku uvolnění histaminu roste permeabilita tkáně, která podporuje rozvoj zánětlivého exsudátu a následnou tvorbu fibrinové matrix [13]. Za normálních okolností je tato destruována pomocí fybrinolytických mechanizmů. Významnou roli v tomto procesu hraje zachování poměru aktivátoru a inhibitoru tkáňového plazminogenu [14].
Možnosti aplikace hyaluronátu v gynekologii a porodnictví
Hyalobarrier gel
Jedná se o 100% kyselinu hyaluronovou, sterilní, průhledný, vysoce viskózní gel, který je biodegradován od 7. dne po peroperační aplikaci. Na trhu je dostupný ve dvou formách pro laparotomické a pro endoskopické výkony.
Klinická účinnost a bezpečnost použití hyaluronové kyseliny byla prokázána multicentrickou studií a prezentována na Světovém endoskopickém kongresu v Bari v roce 2008. Studie zahrnuje soubor 389 pacientek z 11 italských center po endoskopických operačních výkonech v porovnání s kontrolní skupinou bez antiadhezivní prevence. Dvě analýzy proběhly ve skupině laparoskopických výkonů (celkem 79 pacientů) a čtyři analýzy byly provedeny ve skupině hysteroskopických výkonů (celkem 310 pacientek). Výsledky byly zpracovány metaanalyticky. Dále byla provedena kombinovaná metaanalýza nežádoucích účinků (metroragie, teplota, dysmenorea) s frekvencí vyšší než 5 % pomocí Mantelovy-Haenszelovy statistiky. Byl shledán signifikantně nižší výskyt adhezí při užití Hyalobarrier gelu proti kontrolní skupině a nebyl shledán rozdíl ve výskytu nežádoucích účinků mezi sledovanou a kontrolní skupinou [15].
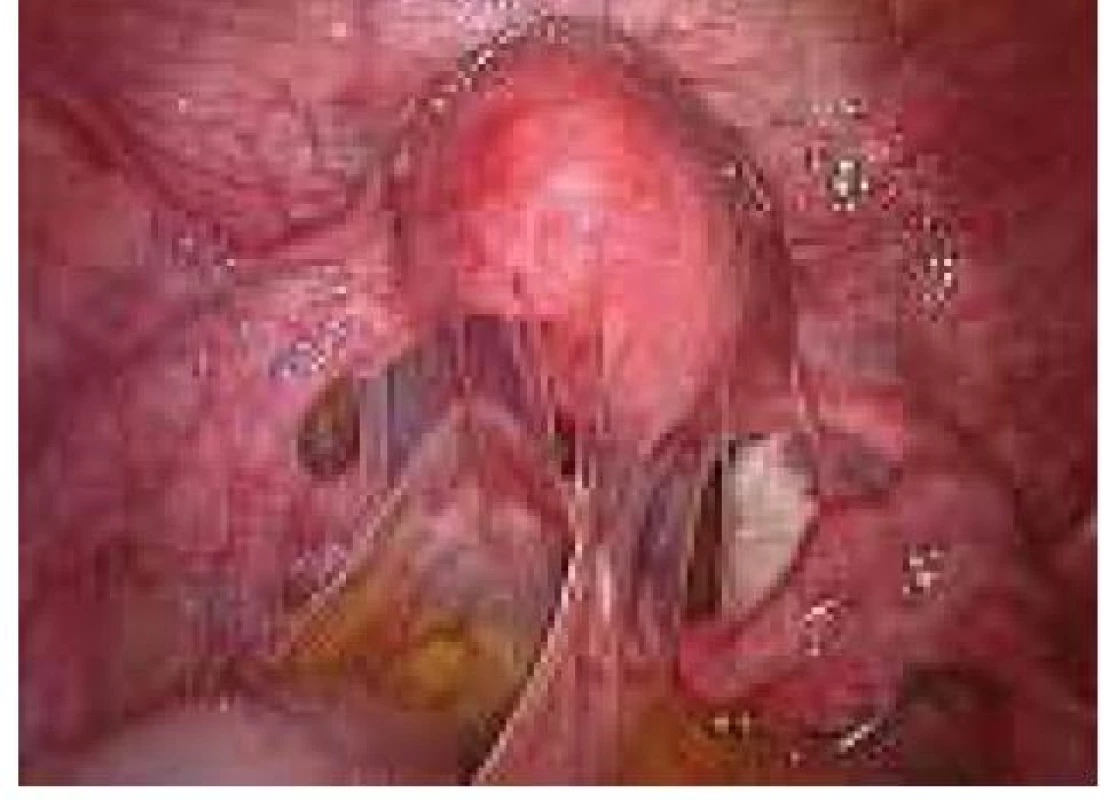
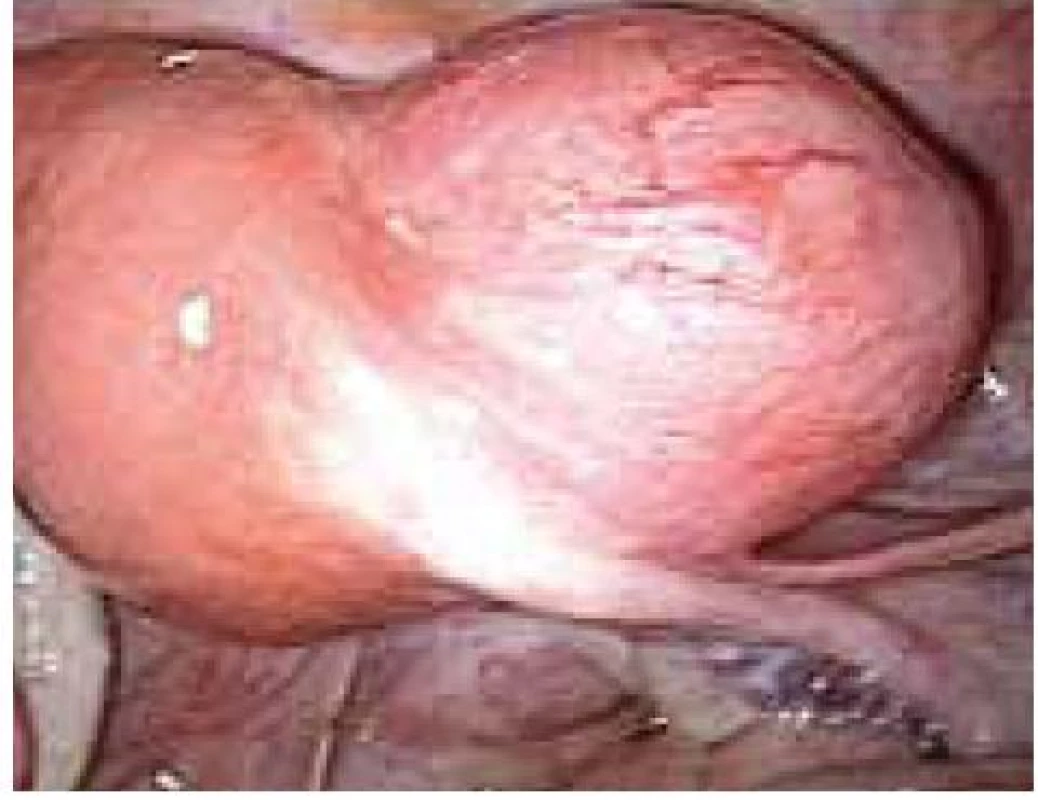
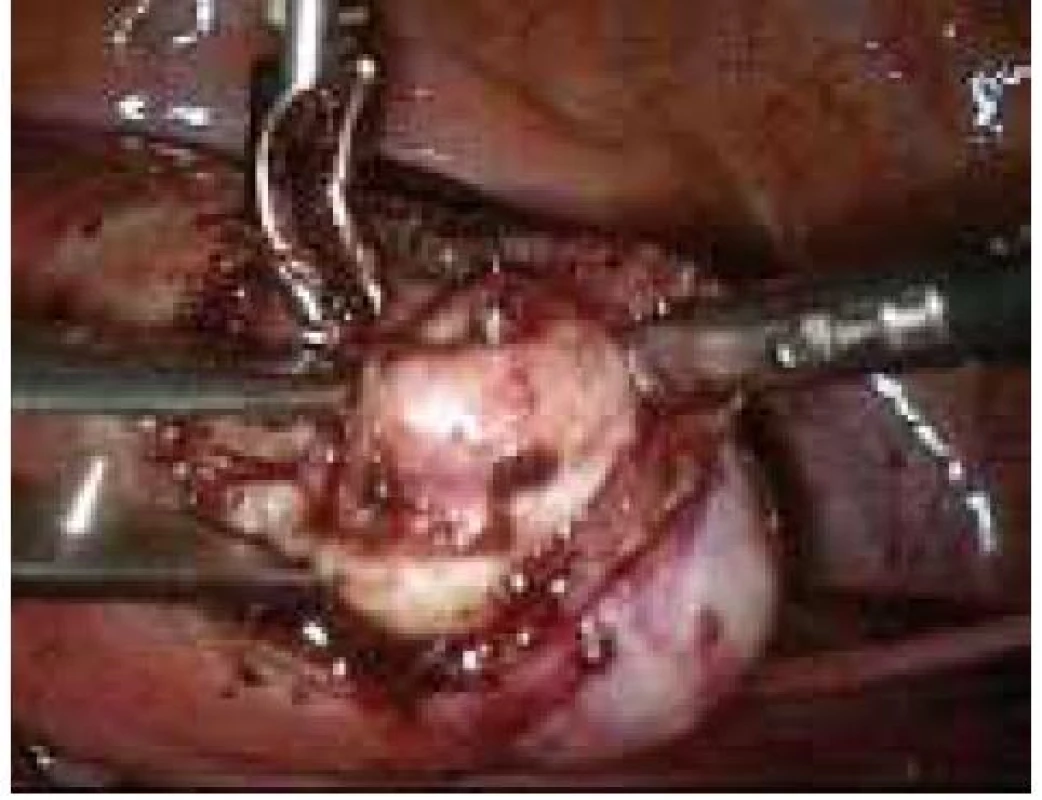
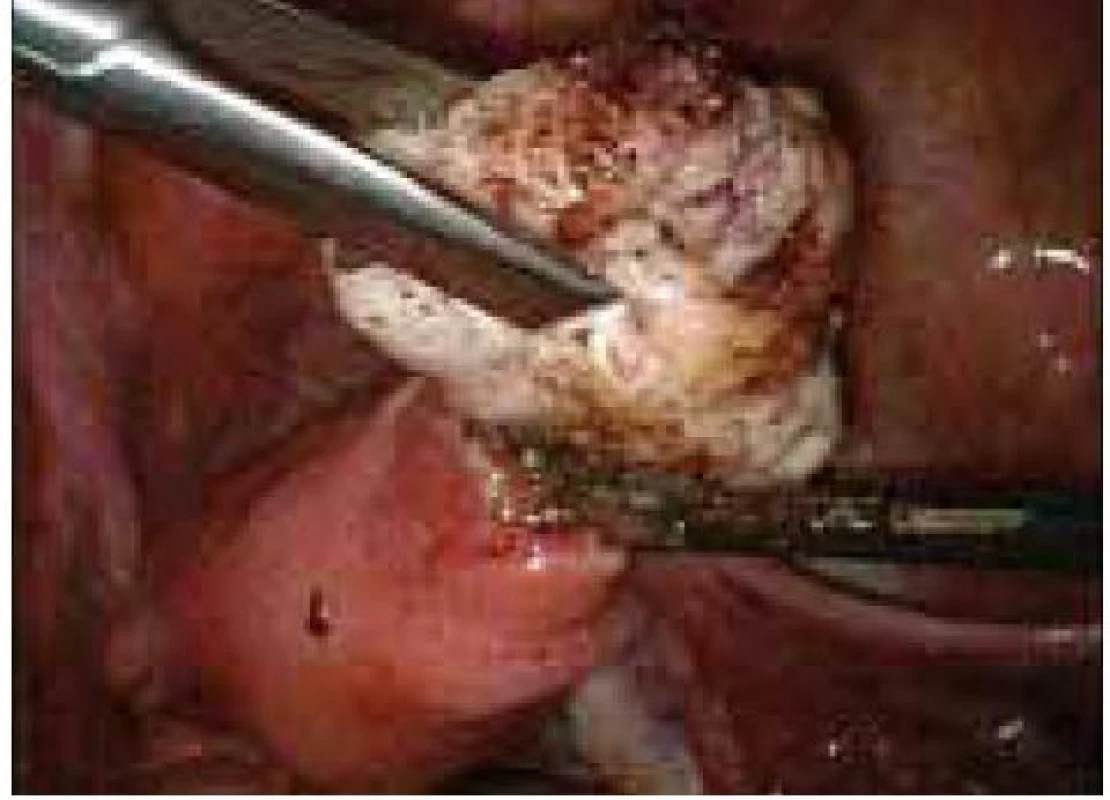
Aplikace hyaluronové kyseliny se provádí v závěru operačního vstupu po dokončení plánovaného výkonu, vždy po pečlivé sanaci krvácení v místě operačního fokusu. Při aplikaci by měla být zachována integrita gelu tak, aby nanášená vrstva gelu kryla oblast operovaného ložiska a zasahovala a překrývala i okolní zdravou tkáň (obr. 1–7).
Obr. 5. Aplikace Hyalobarrier gelu 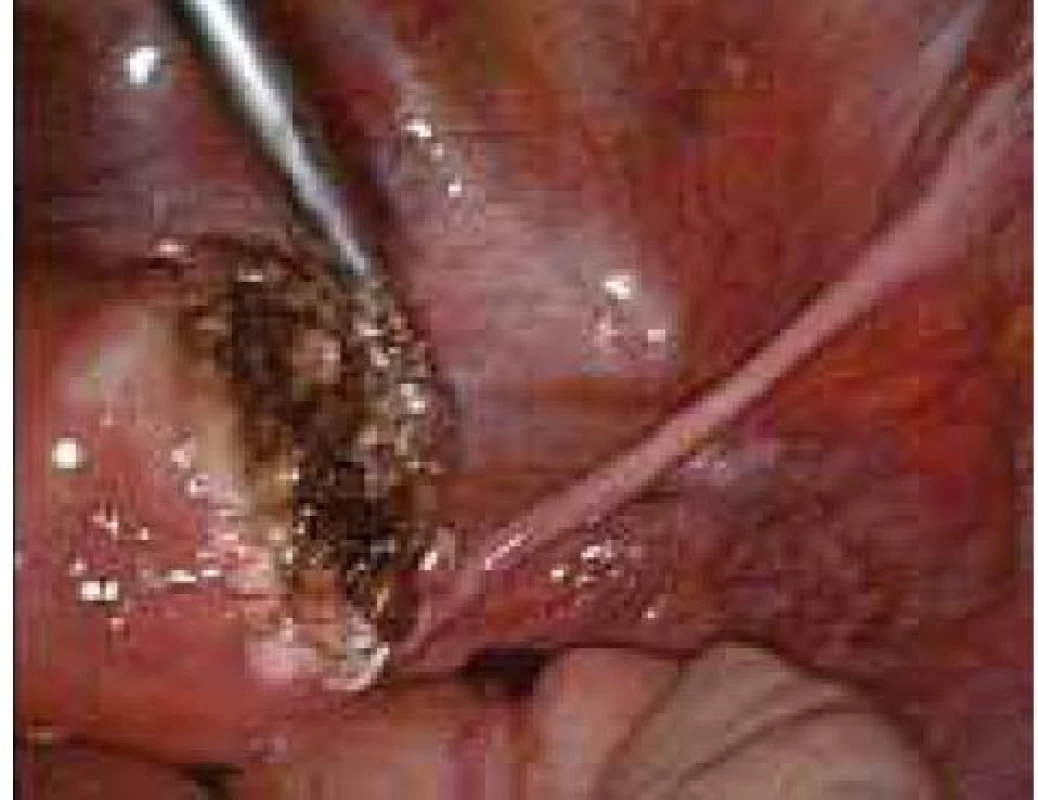
Obr. 6. Aplikace Hyalobarrier gelu 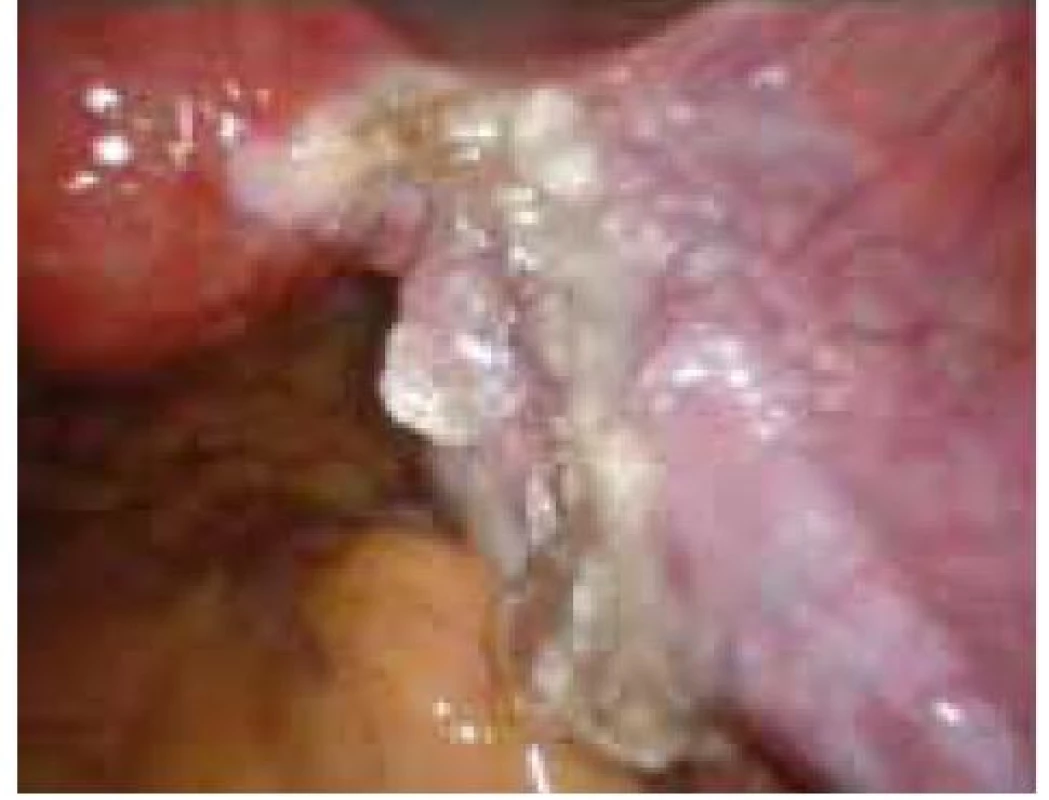
Obr. 7. Aplikace Hyalobarrier gelu 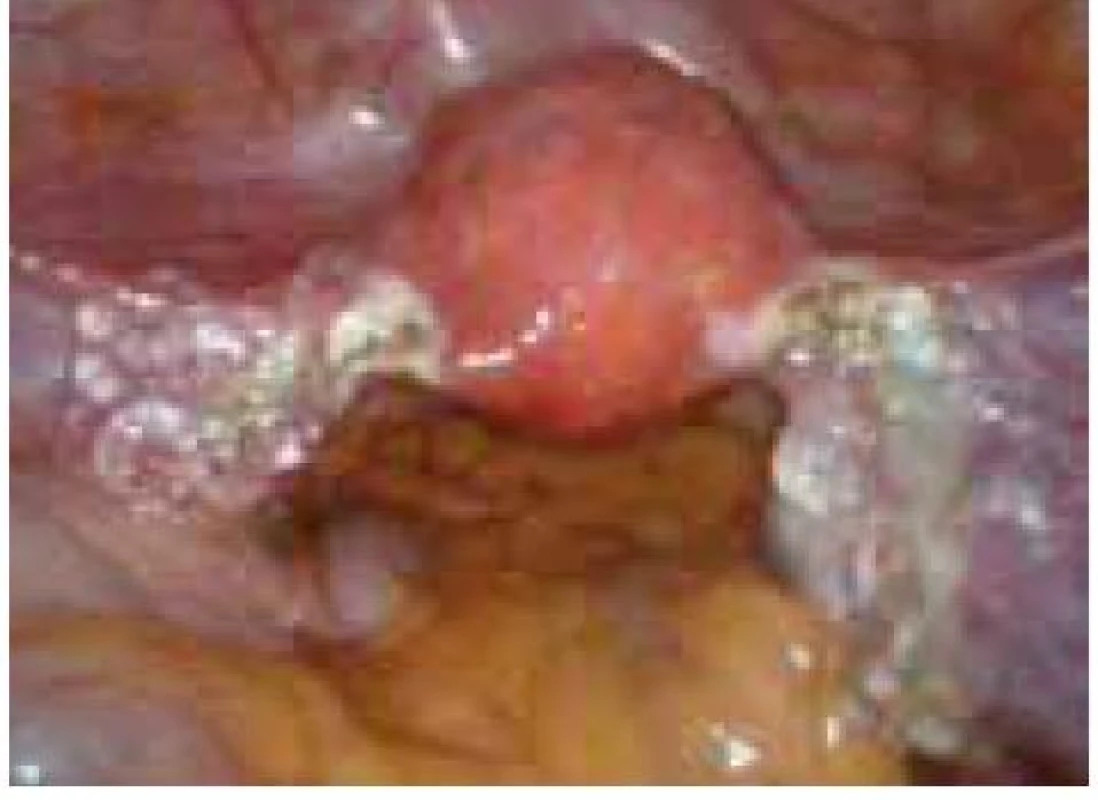
Přehled antiadhezivních prostředků
gely
-
hyaluronová kyselina (Hyalobarrier gel ®)
- zůstává v místě aplikace 7 dnů
- kompletní hydrolýza za 30 dnů
- polyetylén oxid + karboxymetylcelulóza (Oxiplex®/Intercoat®)
- resorpce až 6 týdnů
- hyaluronát sodný + karboxymetylcelulóza (Seprafilm®)
- zůstává v místě aplikace 7 dnů
- kompletní resorpce za 28 dnů
- polyetylenglykol (Spraygel®)
- kompletní hydrolýza během 7 dnů
roztoky
-
4% ikodextrin (Adept ®)
- perzistence minimálně 50 % objemu
- v peritoneální dutině setrvává 3–4 dny
Cicatridina
Používají se také poševní čípky, mast a spray s obsahem kyseliny hyaluronové. Tyto přípravky urychlují a podporují hojení a reepitelizaci po destrukčních a ablačních zákrocích na děložním čípku (excize kličkou, konizace apod), při ektopii cylindrického epitelu na exocervixu ke stimulaci zrání metaplazie, po porodu, po gynekologických operacích a zákrocích, po přeléčeném zánětlivém a mykotickém onemocnění [16,17]. Zlepšují vaginální suchost v postmenopauze, v době kojení a při užívání nízkodávkované antikoncepce, po chemoterapii a radioterapii [18], při léčbě analogy LNRH a antiestrogeny.
Doručeno do redakce: 31. 1. 2012
Přijato po recenzi: 2. 2. 2012
MUDr. Viktor Križan
e-mail: vkrizan@fnbrno.cz
Gynekologicko-porodnická klinika LF MU a FN Brno
www.fnbrno.cz
Zdroje
1. Slíva J, Minárik J. Hyaluronát – nejen pasivní pozorovatel, nýbrž aktivní modulátor imunitních reakcí. New EU Magazine of medicine 2009; 1–2 : 75–78.
2. Tanimoto K et al. Effects of TGF-beta on hyaluronan anabolism in fibroblasts derived from the synovial membráně of the rabbit temporomandibular point. J Dent Res 2004; 83(1): 40–44.
3. Campo GM et al. Differential effect of growth factors on hyaluronan synthese gene expression in fibroblasts exposed to oxidative stress. Biochemistry 2007; 72(9): 974–982.
4. Yamawakki H et al. Hyaluronan receptors involved in cytokine induction in monocytes. Glycobiology 2009; 19(1): 83–92.
5. Termeer CC et al. Oligosaccharides of hyaluronan are potent activators od dendritic cells. J Immunol 2000; 165(4): 1867–1870.
6. Goldstein NA et al. Wound management of the airway mucosa: comparison with skin in a rabbit model. Int J Pediatr Otorhinolaryngol 1998; 45(3): 223–235.
7. Gerecht S et al. Hyaluronic acid hydrogel for controlled selfrenewal and differentiation of human embryonic stem cells. Proc Natl Acad Sci U.S.A. 2007; 104(27): 11298–11303.
8. Toole BP et al. Hyaluronan and tumor growth. Am J Pathol 2002; 161(3): 745–747.
9. Rooney P, Kumar S, Ponting J, Wang M. The role of hyaluronan in tumour neovascularization (review). International Journal of Cancer 1995; 60(5):632–636.
10. Reijnen M et al. Pathophysiology of intraabdominal adhesion and abscess formation, and the effect of hyaluronan. British Journal of Sugery 2003; 90(5): 533–541.
11. Metwally M, Gorvy D, Watson A et al. Hyaluronic acid for adhesion prevention. Fertil Steril 2007; 87(5): 1139–1146.
12. Goldstein NA et al.Wound management of the airway mucosa: comparison with skin in a rabbit model. Int J Pediatr Otorhinolaryngol 1998; 45(3): 223–235.
13. Reijnen M. et al. Pathophysiology of intraabdominal adhesion and abscess formation, and the effect of hyaluronan. British Journal of Sugery 2003; 90(5): 533–541.
14. Weinberger V, Crha I. Hojení peritonea, tvorba adhezí a možnosti jejich prevence. Prakt Gyn 2005; 9(1): 9–12.
15. Mais V, Cirronis MG, Peiretti M et al. Efficacy of auto-crosslinked hyaluronan gel for adhesion prevention in laparoscopy and hysteroscopy: a systematic review and meta-analysis of randomized controlled trials. Eur J Obstet Gynecol Reprod Biol 2012 Jan; 160(1):1–5.
16. Markowska J, Madry R, Markowska A. The effect of hyaluronic acid (Cicatridine) on healing and regeneration of the uterine cervix and vagina and vulvar dystrophy therapy. Eur J Gynaecol Oncol 2011; 32(1): 65–68.
17. Boselli F, Vezzani C, Chiossi G. Terapia topica con acido ialuronico dopo trattamento electtrochirurgico della cervice uterina. La Colposcopia in Italia 2002; 18(2): 25–28.
18. Tea M, Priemer V, Kubista E. Aktuelles: Wirksamkeit und Sicherheit von Hyaluron-Säure-Zäpfchen (Cikatridina(R)) bei der Behandlung hormon - oder chemotherapieinduzierter vaginaler Atrophie bei Mammakarzinompatientinnen. Journal für Fertilität und Reproduktion 2006; 16(2):17–19.
19. Žáková J et al. Nové metody zvyšující úspěšnost asistované reprodukce. Česká gynekologie 2012; 77(2): 139–141.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Úvodní slovo
- Využití fytoestrogenů v gynekologii
- Anafylaxe v těhotenství
- Slovo vydavatele
- Mechanizmus implantace embrya
- Menstruační migréna (migréna bez aury): diagnostika a možnosti hormonální léčby
- Podání transfer-faktoru (IMUNOR) u žen s chronickým vulvovaginálním diskomfortem: výsledky klinické studie
- Novinky v postkoitální kontracepci
- Histopatologická klasifikace karcinomu prsu a její vztah k využitelným modalitám systémové léčby
- Nádorové kmenové buňky u karcinomu ovaria
- Paravaginální hematom: kazuistika
- International Female Care Academy 2012
- Onkogynekologie: senologie
- Význam hyaluronátu v gynekologii a porodnictví
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mechanizmus implantace embrya
- Paravaginální hematom: kazuistika
- Podání transfer-faktoru (IMUNOR) u žen s chronickým vulvovaginálním diskomfortem: výsledky klinické studie
- Menstruační migréna (migréna bez aury): diagnostika a možnosti hormonální léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání