-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
The reasons for severe ovarian hyperstimulation syndrome in patients requiring hospitalisation
Objective:
Prevention and early management of ovarian hyperstimulation syndrome (OHSS) prevents a development of severe forms of the syndrome. Despite this, hospitals frequently admit patients with untreated OHSS following IVF. The aim of the study was to identify the reasons for a development of severe OHSS requiring hospitalization and to establish an effective communication with IVF centres, to protect high-risk patients in the future.Materials and Methods:
We conducted an analysis of the last five-year clinical data (2006–2010) on patients with severe OHSS, ovary size exceeding 10 cm, ascites and at least laboratory signs of haemoconcentration and hypercoagulation treated at the 1st Depatment of Obstetrics and Gynaecology of Commenius University in Bratislava. The data were obtained through an anamnesis, from the medical documentation and, where possible, by communication with an IVF centre.Results:
Between 2006–2010, 17 patients were treated for severe OHSS. The stimulation was performed at 6 different IVF centres in 4 different countries (Slovakia, Czech Republic, Austria and Hungary). Complete information on the stimulation was obtained from the patients, from medical documentation and by consultation with the IVF centre in 9 patients. This information was obtained from the patient and the IVF centre only in 3 patients, no valid medical documentation was available. The information was provided by the patient only in 5 cases, there was no valid medical documentation and no possibility to consult the IVF centre. The most frequent reason for the development of OHSS was an administration of an inadequately high dose of gonadotropins with respect to patient age and risk factors (14 patients). The most frequent error of the cycle management was luteal supplementation performed via HCG (5 cases). OHSS prevention was performed in 7 patients only, the rest (10/17) were not considered to be in a high risk of OHSS. One patient was hospitalized twice for severe OHSS during the data collection period, her case report is included.Conclusion:
The main reason for the development of endangering forms of OHSS was the breach of preventive steps in IVF centres. High responders were not provided with sufficient care. Inadequate cooperation by the patient, frequently declared by the IVF centres, was not proved as the reason for the development of OHSS.Key words:
ovarian hyperstimulation syndrome (OHSS) – assisted reproduction (AR) – in vitro fertilisation (IVF) – controlled ovarian hyperstimulation (COH) – complications – hospitalization
Autoři: L. Maršík; A. Ďurechová; M. Borovský; M. Petrenko; H. Urban
Působiště autorů: Univerzitné pracovisko reprodukčnej medicíny, I. gynekologicko-pôrodnícka klinika, LF UK a UN Bratislava, Slovenská republika
Vyšlo v časopise: Prakt Gyn 2011; 15(3-4): 137-143
Kategorie: Původní práce
Souhrn
Cieľ práce:
Prevencia a včasný manažment ovariálneho hyperstimulačného syndrómu (OHSS) znižujú výskyt jeho závažných foriem na minimum, napriek tomu sa s jatrogénne ohrozenými pacientkami na oddeleniach nemocníc stretávame. Cieľom práce bolo zistiť príčinu rozvoja ťažkých foriem OHSS, ktoré vyžadovali hospitalizáciu, a nájsť taký spôsob komunikácie s IVF centrami, ktorý bude chrániť rizikové pacientky do budúcnosti.Materiál a metodika:
Bola urobená analýza klinického materiálu za posledných 5 rokov (2006–2010). Hodnotené boli pacientky so závažným OHSS, s veľkosťou ovárií nad 10 cm, s ascitom, minimálne s laboratórnymi príznakmi hemokoncentrácie a hyperkoagulácie. Informácie boli získané anamnesticky, zo zdravotnej dokumentácie, a kde to bolo možné, aj prostredníctvom komunikácie s IVF centrom.Výsledky:
V rokoch 2006–2010 bolo na I. gynekologicko-pôrodníckej klinike LF UK v Bratislave hospitalizovaných 17 pacientok pre závažný OHSS. Liečbu absolvovali v 6 IVF centrách zo štyroch krajín (Slovensko, Česko, Rakúsko, Maďarsko). U 9 pacientok sme získali kompletné informácie o priebehu stimulácie zo zdravotnej dokumentácie a priamo z IVF centra, boli len doplnené anamnézou. U 3 pacientok sme informácie získané anamnézou doplnili konzultáciou s IVF centrom, pacientky nemali žiadnu dokumentáciu. U 5 pacientok sme mali údaje len z anamnézy, nebola dostupná zdravotná dokumentácia, konzultácia s IVF centrom neposkytla potrebné údaje alebo bola nemožná. Najčastejšou príčinou rozvoja OHSS bola neúmerne vysoká dávka gonadotropínu vzhľadom na vek a rizikovosť pacientky (14 pacientok), najčastejšou chybou v manažmente cyklu bola luteálna suplementácia prostredníctvom HCG (5 pacientok). Preventívne opatrenia boli realizované len u 7 pacientok, ostatné pacientky (10/17) neboli vyhodnotené ako rizikové. Jedna pacientka bola za uvedené obdobie pre OHSS hospitalizovaná 2krát, uvedená je jej kazuistika.Záver:
Najčastejšou príčinou rozvoja ohrozujúceho OHSS bolo nedodržanie preventívnych opatrení v IVF centre. Nebola venovaná primeraná pozornosť high responderom. Nedostatočná spolupráca zo strany pacientky, často deklarovaná IVF centrom, nebola ako jednoznačná príčina rozvoja OHSS potvrdená.Kľúčové slová:
ovariálny hyperstimulačný syndróm (OHSS) – asistovaná reprodukcia (AR) – in vitro fertilizácia (IVF) – kontrolovaná hyperstimulácia (COH) – komplikácie – hospitalizáciaÚvod
Ovariálny hyperstimulačný syndróm (OHSS) je jatrogénna, potenciálne letálna komplikácia v asistovanej reprodukcii (AR). Vzniká pri kontrolovanej hyperstimulácii ovárií gonadotropínmi. Ide o komplexný patofyziologický dej so zvýšením ovariálnej aktivity, zväčšením ovárií, únikom intravazálnej tekutiny do tzv. tretieho priestoru, ktorý môže vyústiť do zlyhania základných životných funkcií [1–3]. Opakované kontrolované hyperstimulácie, prípadne združené s OHSS, môžu viesť aj k neskorým komplikáciám, napríklad k zníženiu ovariálnej rezervy alebo incidencii malignómov v neskoršom veku [4,5].
Kľúčovým momentom vo vývoji OHSS je podanie choriogonadotropného hormónu (HCG) alebo endogénny HCG pri dosiahnutí gravidity. Je popísaný aj výskyt OHSS pri spontánnej gravidite, je však extrémne zriedkavý [6].
Niektoré patofyziologické mechanizmy vzniku OHSS sú známe, ale stále nepoznáme kľúčový mechanizmus, ktorý by jednoznačne stanovil jeho prevenciu a kauzálnu liečbu. Práve tento stupeň neistoty priniesol viac klasifikačných systémov, ktoré boli postupne revidované. V praxi sa stále používa Golanova klasifikácia z roku 1989, v ktorej je OHSS rozdelený na mierny, stredný a závažný [7]. Navot v roku 1992 navrhol rozlišovať medzi závažným (zväčšené ováriá, ascites a/alebo hydrothorax, hematokrit nad 0,45, leukocyty nad 15 000, oligúria) a život ohrozujúcim, kritickým OHSS (masívny ascites, hematokrit nad 0,55, leukocyty nad 25 000, renálne zlyhávanie, tromboembolické komplikácie a ARDS-adult respiratory distress syndrome) [8]. Rizkova a Aboulgharova klinická klasifikácia OHSS z roku 1999 rozoznáva len mierny a závažný OHSS [9]. Mierny OHSS (abdominálny dyskomfort, nauzea, neprítomné klinické príznaky ascitu, ale viditeľný ascites ultrazvukom, negatívne laboratórne výsledky) prakticky nevyžaduje liečbu, závažný OHSS vždy vyžaduje liečbu. Pri stupni A (dyspnoe, oligúria, nauzea, zvracanie, klinické príznaky ascitu, ale normálne biochemické a hematologické parametre) je možná ambulantná liečba na primerane vybavených pracoviskách, napr. aj v IVF centrách, pri stupni B (zvýraznené príznaky stupňa A plus zmenené laboratórne výsledky v zmysle zvýšeného hematokritu, zvýšených hladín kreatinínu v sére a zvýšených hepatálnych testov) je potrebná hospitalizácia a stupeň C (život ohrozujúci OHSS komplikovaný ARDS, renálnym zlyhaním a tromboembolickými komplikáciami) vyžaduje liečbu na jednotke intenzívnej starostlivosti (JIS) [9]. Klinický význam má aj delenie OHSS na včasný a neskorý [9,10].
Liečba rozvinutého OHSS je prevažne symptomatická a je aj veľmi nákladná, jeho ťažké a komplikované formy môžu pacientku ohroziť na živote, preto je pri kontrolovanej hyperstimulácii najdôležitejšia jeho prevencia. Názory na prevenciu OHSS a na rizikové faktory jeho vzniku nie sú jednotné, ale rešpektovanie všeobecne akceptovaných rizikových faktorov môžeme považovať za prvé a hlavné preventívne opatrenie [11,12]. Najdôležitejšie rizikové faktory pre vznik OHSS podľa Rizka sú v tab. 1 [9].
Tab. 1. Rizikové faktory pre vznik OHSS. 
Rozdelenie prevencie OHSS na primárnu a sekundárnu má viac didaktický ako klinický význam, lebo jednotlivé opatrenia sa vzájomne prelínajú. Rovnako delenie na invazívne a neinvazívne postupy je zaujímavé v prípade, že pracovisko niektoré invazívne postupy techniky robiť nemôže. Napríklad prestimulačná elektrodiatermická (EDK) skarifikácia povrchu ovárií u pacientok s PCOS je primárne opatrenie, ktoré vyžaduje laparoskopické vybavenie. Selektívna alebo unilaterálna aspirácia folikulov pred podaním HCG je sekundárne opatrenie, ktoré môže urobiť každé IVF centrum. Najdôležitejšie klasické primárne a sekundárne preventívne opatrenia pri riziku OHSS podľa Rizka sú v tab. 2 a 3 [9].
Tab. 2. Primárna prevencia OHSS. 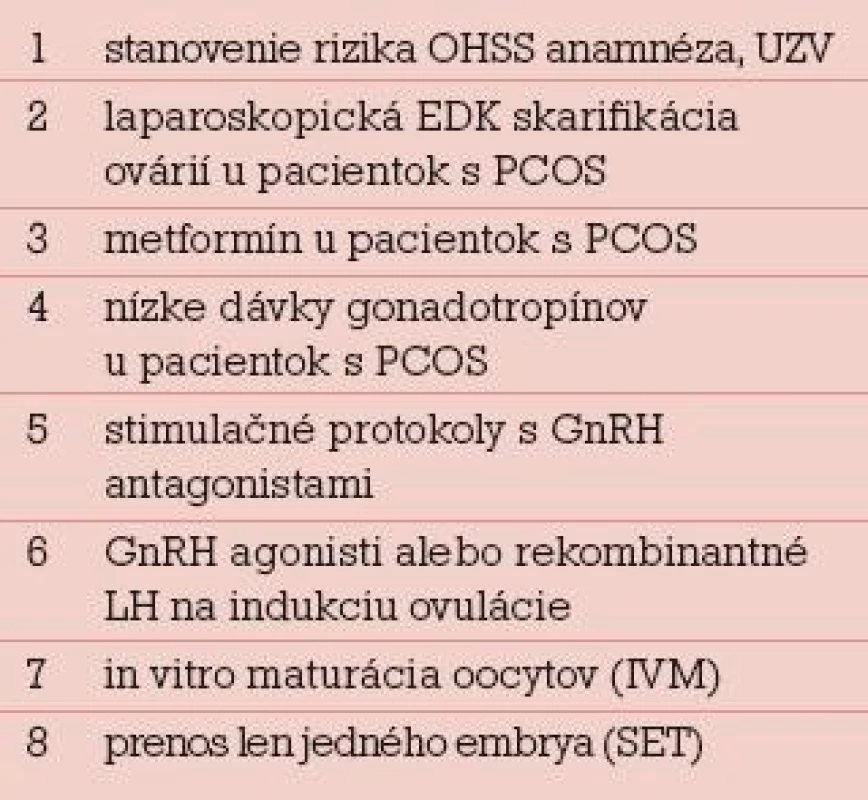
Tab. 3. Sekundárna prevencia OHSS. 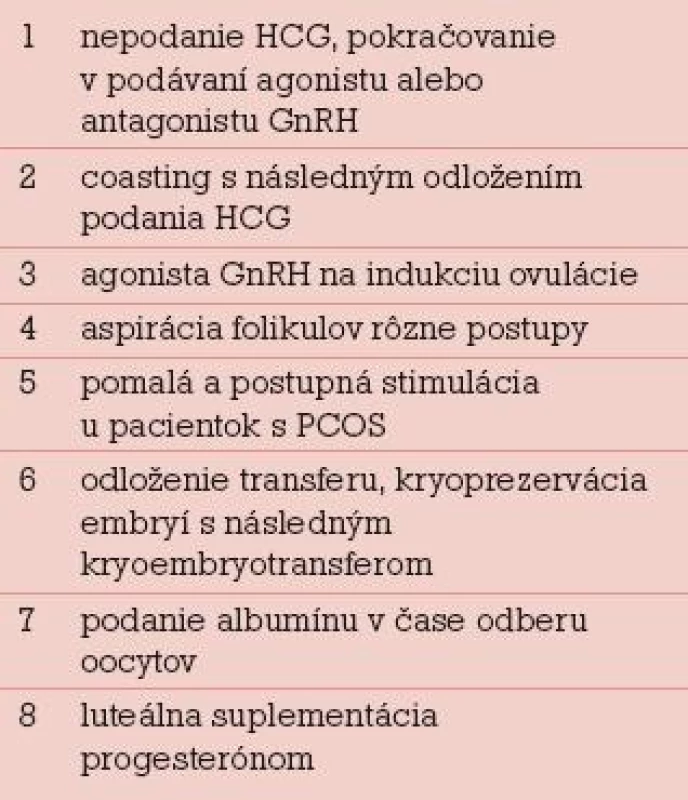
Jednotlivé preventívne opatrenia nie sú dostatočne účinné, IVF pracoviská majú zaužívané kombinované postupy prevencie OHSS pre rizikové pacientky, ktoré na seba nadväzujú a ktoré postupne modifikujú. Po zistení rizikovej pacientky nasleduje voľba stimulačného protokolu s nižšími dávkami gonadotropínov, niekde voľba protokolu s antagonistami GnRH, dôsledný hormonálny a ultrazvukový monitoring stimulácie, pri vysokých hladinách E2 a veľkom počte folikulov coasting, odloženie podania HCG, redukcia dávky HCG, prípadne indukcia ovulácie agonistom GnRH u darkýň oocytov. Po odbere oocytov je možné intravenózne podanie albumínu alebo jeho náhrady a primeraná saturácia tekutinami. Pri veľmi veľkom riziku OHSS je vhodný prenos len jedného embrya alebo úplné zrušenie prenosu a kryokonzervácia všetkých embryí. Pri extrémnom riziku OHSS je potrebné zrušenie cyklu ukončenie podávania gonadotropínov a nepodanie HCG [13–15].
U veľmi rizikových pacientok, hlavne so syndrómom polycystických ovárií (PCOS), je účinnou prevenciouOHSS in vitro maturácia oocytov (IVM). Podávanie nízkomolekulových heparínov (NMH) je nevyhnutná prevencia tromboembolických komplikácií. Na ovplyvnenie cievnej permeability sa po odbere oocytov v posledných rokoch úspešne používajú agonisti dopamínu, hlavne selektívni agonisti (cabergolín, quinagolid) [16–18].
Cieľ práce
Rozvoj OHSS, hlavne jeho závažných foriem, je dôsledkom neadekvátnej stimulácie a nedostatočného využitia preventívnych opatrení. Hlavným cieľom práce bolo zistiť, prečo komplikácia vznikla, čiže nájsť príčinu rozvoja ťažkej formy OHSS, ktorý vyžadoval hospitalizáciu. Zmyslom uvedeného sledovania je predovšetkým ochrana pacientky, preto ďalším cieľom je nájsť taký spôsob komunikácie s IVF centrami, ktorý bude chrániť rizikové pacientky do budúcnosti.
Materiál a metodika
Bola urobená analýza klinického materiálu, postupne boli hodnotené všetky pacientky, ktoré boli hospitalizované na I. gynekologicko-pôrodníckej klinike LF UK a UN v Bratislave s diagnózou ovariálny hyperstimulačný syndróm v rokoch 2006–2010. Do súboru boli zahrnuté pacientky so závažným OHSS, s veľkosťou ovárií nad 10 cm, s klinickými aj ultrazvukovými príznakmi ascitu, minimálne s laboratórnymi príznakmi hemokoncentrácie a hyperkoagulácie. Podľa klasifikačných systémov sa jednalo minimálne o závažné OHSS podľa Navota [8], resp. o závažné OHSS 2. stupňa podľa Rizka [9].
Údaje boli zhromažďované podľa presného kľúča. Na prvom mieste bola podrobná cielená anamnéza. Okrem základnej gynekologickej anamnézy bola zameraná na priebeh stimulácie, dávku a časový sled podávania gonadotropínov, agonistov alebo antagonistov GnRH, indukciu ovulácie, priebeh odberu oocytov, počet získaných oocytov a embryí, počet transferovaných embryí a priebeh po prenose embryí. Cielene boli zisťované všetky podané lieky a iné odporúčania, napríklad pitný režim. Anamnéza bola doplnená alebo korigovaná dostupnou zdravotnou dokumentáciou. Pri každom prípade bol urobený minimálne pokus o kontaktovanie IVF centra, v ktorom prebehla liečba. Aj u závažných stavov bol rozhovor vedený priateľsky a korektne, so snahou získať čo najviac informácií. Cieľom kontaktovania centra bola aj prevencia komplikácií ich liečby v budúcnosti.
Niektoré údaje o rizikových faktoroch, napríklad objem ovárií, počet antrálnych folikulov a hladiny anti-müllerovho hormónu (AMH), boli doplnené dodatočne pri kontrole po liečbe.
Takto získané údaje boli archivované a vyhodnotené za určité časové obdobie, v tomto prípade za posledných 5 rokov.
Výsledky
V rokoch 2006–2010 bolo na I. gynekologicko-pôrodníckej klinike LF UK a UN v Bratislave hospitalizovaných 17 pacientok pre závažný OHSS. Liečbu neplodnosti absolvovali v 6 IVF centrách zo štyroch krajín – Slovensko, Česko, Rakúsko a Maďarsko (tab. 4). Vekové rozpätie súboru bolo 20–33 rokov, jednalo sa o primárne aj sekundárne sterility, indikáciou na liečbu bol andrologický faktor, tubárny faktor a idiopatická sterilita. U 12 pacientok bol použitý dlhý stimulačný protokol s agonistom GnRH, u 5 pacientok súboru krátky stimulačný protokol s antagonistom GnRH [8,9]. Iniciálna dávka gonadotropínu bola 225–450 IU. Indukcia ovulácie bola vo všetkých prípadoch robená dávkou 10 000 IU HCG.
Tab. 4. Hospitalizované pacientky pre OHSS na I. gynekologicko-pôrodníckej klinike LF UK a UN Bratislava v rokoch 2006–2010. 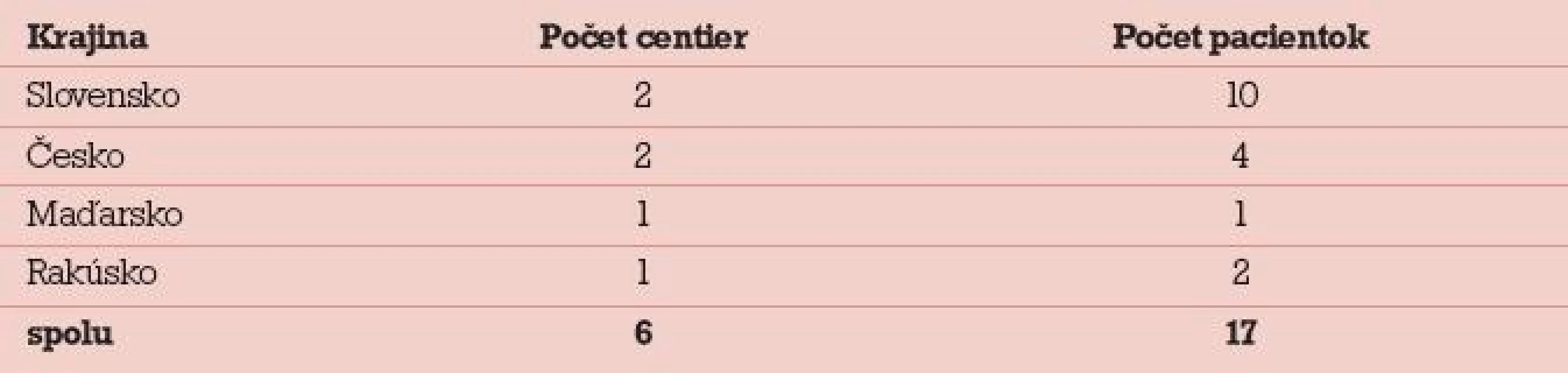
Tab. 5. Pacientky hospitalizované pre OHSS podľa dostupnosti údajov. 
U 9 pacientok sme získali kompletné informácie o priebehu stimulácie aj následnej liečby: pacientky vedeli poskytnúť údaje do podrobnej anamnézy, mali pri sebe valídnu zdravotnú dokumentáciu, komunikácia s IVF centrom bola prospešná, IVF centrum vedelo komentovať možnú príčinu komplikácie, prípadne vyvodilo z komplikácie aj poučenie. Tri pacientky nemali pri sebe zdravotnú dokumentáciu, ale vedeli poskytnúť anamnestické údaje, ktoré boli doplnené konzultáciou s IVF centrom. U 5 pacientok sme mali limitované údaje – len z anamnézy, nebola dostupná zdravotná dokumentácia, konzultácia s IVF centrom neposkytla potrebné údaje alebo bola nemožná.
U každej pacientky súboru bola u nás zistená kombinácia rizikových faktorov pre OHSS. U 9 pacientok s kompletnými údajmi IVF centrum rizikové faktory evidovalo, u 7 z nich realizovali preventívne opatrenia, ktoré ale nezabránili rozvoju OHSS, u 2 pacientok riziko nevyhodnotili ako vysoké. U dvoch pacientok zo 7 bola robená v rámci včasnej liečby punkcia ascitu ambulantne. Zostávajúcich 8 pacientok IVF centrá neevidovali ako rizikové, u 5 pacientok ani nevedeli, že sa u ich klientok OHSS rozvinul. Takže spolu 10 pacientok zo 17 nebolo v IVF centre vyhodnotených ako rizikové.
Zastúpenie rizikových faktorov bolo nasledovné: syndróm polycystických ovárií (10), anamnéza OHSS (2), vysoké hladiny E2 6. deň stimuláciea v čase podania HCG (15), asthenický habitus (2), vek pod 30 rokov (12) a dosiahnutá gravidita (5). Veľký objem ovárií a vysoký počet antrálnych folikulov bol pri kontrole dva mesiace po liečbe potvrdený o 10 pacientok, hladiny AMH boli dodatočne vyšetrené u 5 pacientok, všetky boli vysoké. Údaje o rizikových faktoroch sú v tab. 6.
Tab. 6. Rizikové faktory u hospitalizovaných pacientok pre OHSS. 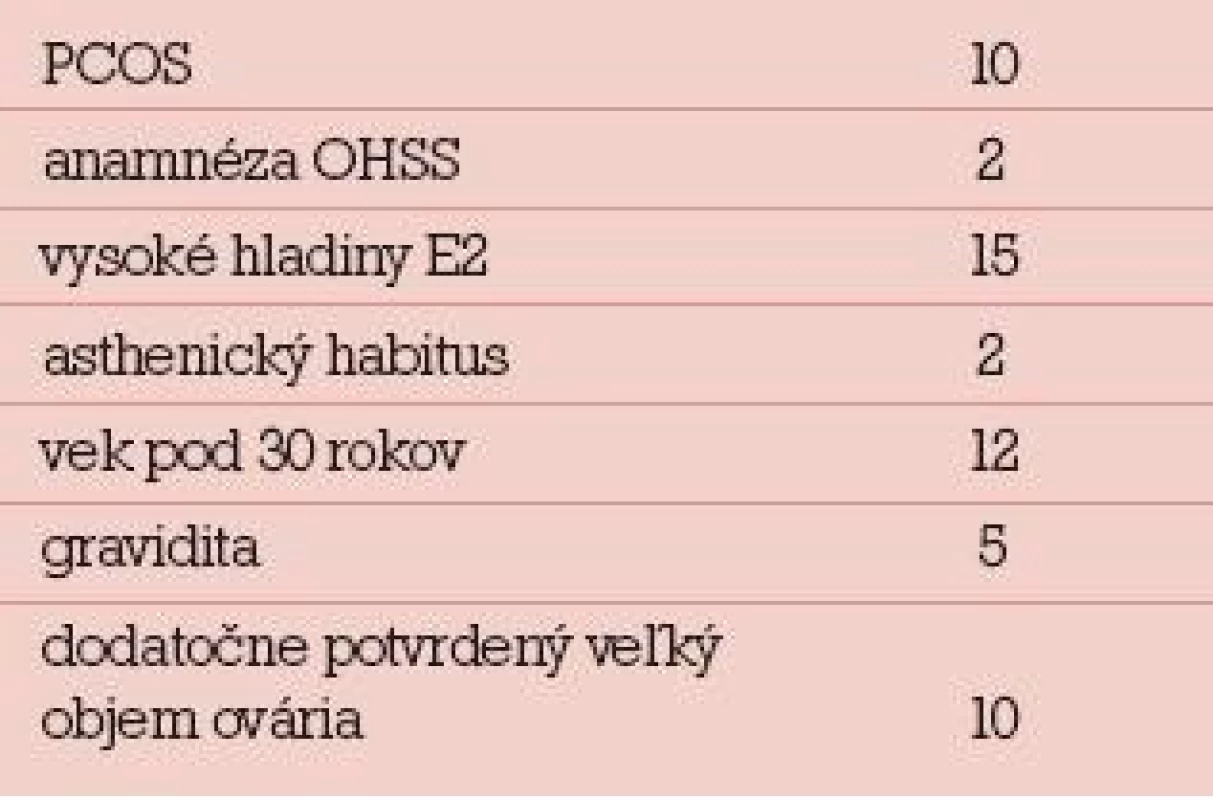
Preventívne opatrenia boli realizované len u 7 zo 17 pacientok, kombinácia preventívnych opatrení len u 5 zo 17 pacientok. Realizované boli nasledovné preventívne opatrenia: albumín intravenózne (3), infúzna liečba ambulantne (3), podávanie nízkomolekulového heparínu (NMH) (3), coasting (2), redukcia dávky gonadotropínu (2), tab. 7. Aj keď infúzna liečba a podávanie NMH sú skôr liečebnou metódou a prevenciou komplikácií rozvinutého OHSS, zahrnuli sme ich do preventívnych opatrení realizovaných IVF centrom. Do preventívnych opatrení sme nezahrnuli včasnú punkciu ascitu pri rozvíjajúcom sa OHSS. Aj keď sa jednalo o rozvinuté OHSS za posledných 5 rokov, ani u jednej hospitalizovanej pacientky sme pri cielenej anamnéze nezistili snahu o in vitro maturáciu oocytov (IVM) alebo podanie agonistov dopamínu.
Tab. 7. Preventívne opatrenia realizované v IVF centre u pacientok následne hospitalizovaných pre OHSS. 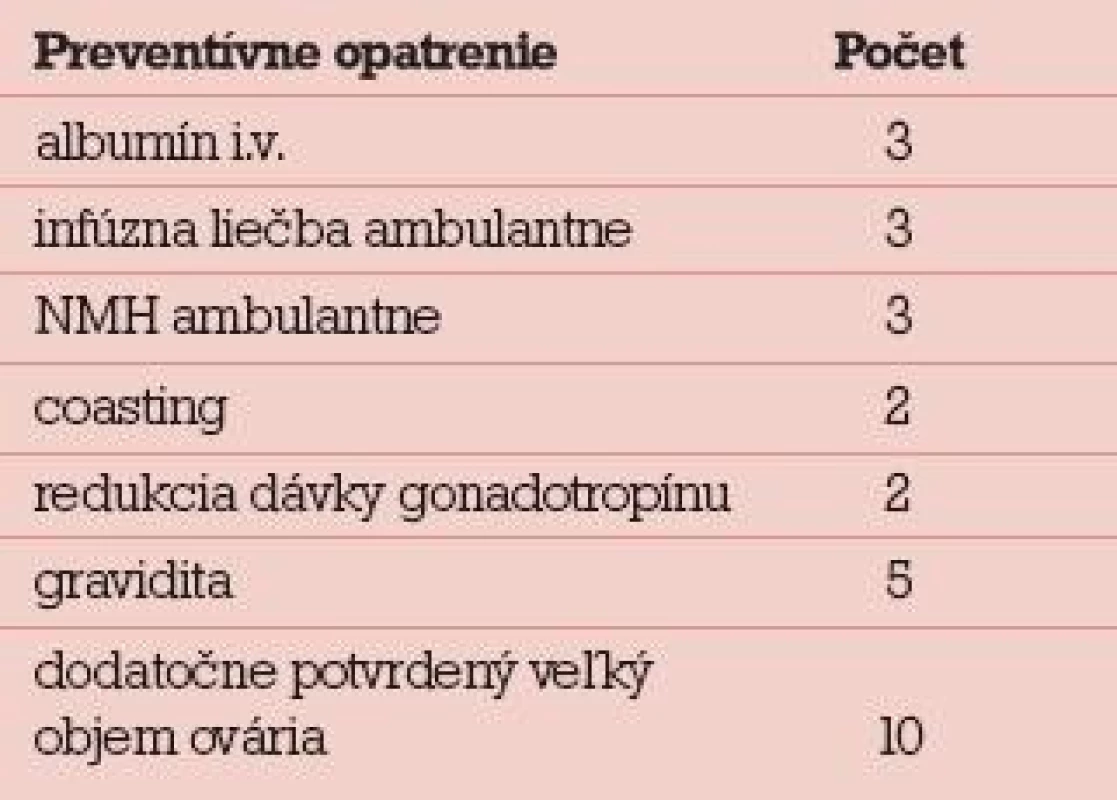
Tým, že IVF centrum nevyhodnotilo svoje pacientky ako rizikové z OHSS, nerealizovalo hlavne primárne preventívne opatrenia, stimulovalo ich ako nerizikové pacientky, čo sa neskôr ukázalo ako chybný postup. Zmyslom hľadania chýb nie je sankcionovanie centra, ale prevencia komplikácií v budúcnosti.
Boli zistené nasledovné chybné postupy, ktoré mohli viesť k celkovej reakcii pacientky v zmysle rozvoja OHSS: neúmerne vysoká dávka gonadotropínu vzhľadom na vek a rizikovosť pacientky (14), použitie HCG na luteálnu suplementáciu (5) luteálna suplementácia bola síce robená progesterónom, ale na zvýšenie úspešnosti bol pridávaný HCG v čase embryotransferu, nerešpektovanie alarmujúcich výsledkov monitoringu počas stimulácie (5), prenos väčšieho počtu embryí (3 a viac) (4) a viacplodová gravidita (4), údaje sú v tab. 8.
Tab. 8. Chybné postupy, ktoré mohli viesť k rozvoju OHSS. 
Pri kontaktovaní IVF centier tieto udávali ako príčinu nezvládnutia liečby s následným rozvojom OHSS aj nedostatočnú spoluprácu pacientky. Udávané boli nasledovné chyby zo strany pacientky (údaj IVF centra//korekcia podľa anamnézy): pacientka si chybne podala vysokú dávku gonadotropínu (2/1), pacientka si zabudla podať antagonistu GnRH (2/1), pacientka si chybne podala vysokú dávku HCG (3/1), pacientka nedodržala pitný režim (10/3), pacientka nekontaktovala včas IVF centrum (12/3). Údaje je potrebné považovať v tomto prípade za limitované pre vysokú mieru subjektivity zo strany IVF centra aj zo strany pacientky, uvedené sú v tab. 9.
Tab. 9. Nedostatočná spolupráca zo strany pacientky. 
Kazuistika
Na ilustráciu závažnosti problematiky je uvedená kazuistika pacientky, ktorá bola opakovane hospitalizovaná pre ťažký OHSS po dvoch rôznych IVF cykloch realizovaných na zahraničnom pracovisku (Rakúsko). Na prípade je zaujímavá aj skutočnosť, že napriek vysokému počtu získaných oocytov s následným OHSS po oboch stimuláciách nebol ani raz realizovaný kryoprogram a pacientka (pár) nemá zamrazené žiadne embryo.
Prvá hospitalizácia v roku 2006
28-ročná pacientka podstúpila IVF program na zahraničnom pracovisku pre andrologický faktor neplodnosti. Na I. gynekologicko-pôrodnícku kliniku bola prijatá pre ťažký OHSS s ascitom a dýchacími ťažkosťami, ktorý sa rozvinul 4 dni po ET. Na hospitalizáciu prišla až 7. deň po ET v zlom stave, do prijatia nebola realizovaná žiadna liečba alebo preventívne opatrenia.
Na stimuláciu bol použitý dlhý sekrečný stimulačný protokol s agoniston GnRH. Denná dávka gonadotropínu bola 150 IU FSH + 150 IU HMG, čiže spolu 300 IU gonadotropínu denne počas celej, pravdepodobne 9-dňovej stimulácie. Pacientka nevie presne dávku HCG, udáva zisk viac ako 20 oocytov, ale nevie počet embryí. Prenesené boli 3 embryá, nebola realizovaná kryokonzervácia embryí. Situáciu komplikuje skutočnosť, že pacientka žiada nekontaktovať lekára IVF centra.
Hospitalizácia trvala tri týždne, boli realizované opakované punkcie ascitu, k zlepšeniu stavu dochádza po forsírovanej diuréze. UZV bola potvrdená intrauterinná gravidita, jeden plod. Pacientka bola do pôrodu na liečbe nízkomolekulovými heparínmi (NMH), spontánne porodila zdravé dieťa v termíne.
Druhá hospitalizácia v roku 2010
Použitý bol rovnaký stimulačný protokol aj denná dávka gonadotropínov (FSH + HMG spolu 300 IU), v rovnakom IVF centre v Rakúsku, prenesené boli 3 embryá, znovu nie sú informácie o kryoprograme ani o celkovom počte embryí.
Závažný OHSS sa rozvinul 6 dní po ET, zvládnutý bol ambulantne v inom IVF centre na Slovensku. Použitá bola infúzna liečba, NMH a opakované punkcie ascitu. UZV bola diagnostikovaná intrauterinná gravidita, gemini biamniales bichoriales.
Pacientka bola odoslaná na hospitalizáciu v 20. týždni gravidity pre slabé krvácanie, príčinou krvácania bola placenta praevia marginalis. Stav sa pri kľudovom režime upravil, ale po novej atake silnejšieho krvácania bola krátkodobo znížená dávka NMH. Následne dochádza k embolizácii do pľúc, pacientka bola preložená na JIS, pri terapeutických dávkach NMH pacientka potráca.
Ďalšia liečba bola úspešná, takže nakoniec až na potrat gemín v II. trimestri „všetko dobre dopadlo“ a 4-ročnédievčatko z prvého IVF cyklu má stále mamu... Ale aj nemuselo mať.
Diskusia
Sedemnásť hospitalizácií pre OHSS za 5 rokov v univerzitnej nemocnici – je to veľa, málo alebo primerane zvyšujúcemu sa počtu IVF cyklov? Staršie štatistiky pripúšťali aj viac ako 10 % komplikácií v zmysle incidencie OHSS, udávaný bol výskyt 1,5–5,4 % závažných foriem OHSS [1,3,8,9]. Dnes sa nám zdá veľa aj 1 % a OHSS už nepovažujeme za taký „horúci“ problém ako v nedávnej minulosti. Najnovšie údaje z EIM (European IVF Monitoring), čiže z európskeho registra ESHRE za rok 2008, uvádzajú výskyt 2 947 OHSS z 356 856 cyklov kontrolovanej hyperstimulácie, čo je incidencia 0,8 %. Dáta boli získané od 30 z 36 respondujúcich krajín [19].
Aj keď rozlišujeme primárnu a sekundárnu prevenciu OHSS, po ich vyčerpaní, resp. zlyhaní nasleduje už liečba rozvinutého OHSS a prevencia komplikácií OHSS, ani v tomto prípade nie je možné urobiť ostrú hranicu medzi prevenciou a liečbou. Napríklad včasná punkcia ascitu je síce liečebným opatrením, ale vzhľadom na to, že priebeh OHSS je menej agresívny a doba liečby kratšia, môžeme ju považovať aj za prevenciu rozvinutia závažnejších, komplikovaných foriem OHSS. Dôležitá je práve včasná realizácia punkcie ascitu, nie až v čase rozvratu vnútorného prostredia [10].
Prof. Malý tiež navrhuje súbor opatrení, ktoré považuje za prevenciu rozvinutia závažnejších foriem OHSS a za najdôležitejšiu považuje ich včasnú realizáciu. Väčšinou sú tieto opatrenia považované za liečbu OHSS. Navrhuje nasledovný algoritmus opatrení: vrátenie tekutiny do cievneho riečiska osmotickou diurézou a napravenie patologickej cievnej permeability agonistami dopamínu, keď rozvoj OHSS pokračuje a ascites sa zväčšuje, je potrebné zabezpečenie cievneho volumu infúziou kryštaloidov a prevencia tromboembolických komplikácií podávaním nízkomolekulového heparínu (NMH), ako posledné, ale včasné opatrenie uvádza punkciu ascitu, ktorú považuje viac za symptomatické opatrenie [20].
U žiadnej z hospitalizovaných pacientok sme nezachytili snahu o niektorú z novších metód prevencie OHSS, aj keď sumarizujeme údaje OHSS za posledných 5 rokov. Konkrétne sa jedná o in vitro maturáciu oocytov (IVM), podávanie agonistov dopamínu a stanovenie rizika OHSS vyšetrením anti-Müllerovho hormónu (AMH).
Alternatívou pri prevencii OHSS je in vitro maturácia oocytov (IVM). Metóda je vhodná pre ťažko stimulovateľné pacientky a pre pacientky s vysokým rizikom OHSS, hlavne pre pacientky so syndrómom polycystických ovárií (PCOS). Pri použití IVM oocytov môžeme pacientky s PCOS bez rizika liečiť bez predošlej prípravy inzulínovými senzitizátormi alebo bez operačnej záťaže pri laparoskopickej skarifikácii ovárií. Pri IVM cykloch nie je nevyhnutná stimulácia gonadotropínmi, väčšinou používame krátku stimuláciu s malou spotrebou gonadotropínov. Podanie bolusovej dávky HCG pred odberom oocytov po krátkej stimulácii môže zlepšiť výsledok liečby bez rizika OHSS. Pre IVM cyklus sa rozhodujeme na začiatku stimulácie u pacientok s rizikom OHSS alebo u pacientok s komplikáciou v IVF programe v anamnéze, ale je možná konverzia cyklu na IVM pri nepriaznivom priebehu stimulácie. Možnosť konverzie cyklu s klasickou kontrolovanou hyperstimuláciou na IVM cyklus umožňuje úspešne a bez rizika dokončiť liečbu aj u takých cyklov, u ktorých by bolo za iných okolnost nevyhnutné stimuláciu zastaviť, napríklad pri extrémnom riziku OHSS [21].
Anti-Müllerov hormón je glykoproteínový dimér, ktorý patrí k skupine transformujúcich faktorov b a má viacero fyziologických funkcií. U dievčat sa produkuje v ováriách, jeho úlohou tvorby primárnych folikulov inhibíciou nadmerného účinku FSH, najvyššie hodnoty sú do veľkosti folikulu 4 mm. Je preto ukazovateľom „folikulárnej“ rezervy, akýmsi laboratórnym obrazom počtu antrálnych folikulov pri UZV vyšetrení. Jeho koncentrácie v sére sa v priebehu cyklu nemenia. V posledných rokoch sa klinicky využíva ako marker ovariálnej rezervy v reprodukčnej medicíne, dá sa využiť na predikciu odpovede ovárií na stimuláciu u poor responderov aj pri riziku OHSS. Jeho vyšetrenie je prínosom hlavne u neobéznych subfertilných pacientok s PCOS, hladiny AMH korelujú so stupňom inzulínovej rezistencie a hladinami androgénov [22,23]. Všetky pacientky s OHSS, u ktorých sme AMH vyšetrili, mali vysoké hladiny nad 3,0 μg/ l, obyčajne okolo 10 μg/ l.
V posledných rokoch sa predsa len darí aj v oblasti OHSS priblížiť ku kauzálnej liečbe a prevencii. Dopamín sa v minulosti úspešne používal pri liečbe kritických foriem OHSS, konkrétne pri renálnom zlyhávaní na zlepšenie renálnych funkcií úpravou cievnej permeability [24]. Selektívni agonisti dopamínových receptorov blokujú fosforyláciu VEGFR-2 (vascular endotelial growth factor), čím signifikantne znižujú cievnu permeabilitu a blokujú rozvoj OHSS. Dokázanie ich bezpečnosti v čase nidácie umožňuje posun ich použitia do preventívnej oblasti [17,18].
Rekombinantný anti-angiogenický faktor PEDF (pigment-epithelium-derived factor), ktorý sa pokladá za antagonistu pro-angiogenického faktora VEGF, bude možno kľúčom ku kauzálnej prevencii a liečbe OHSS. Úspešne bol použitý zatiaľ len v experimente, ale výsledky sa zdajú byť veľmi sľubné [25].
Podľa celkového počtu hospitalizácií nevieme odhadnúť incidenciu OHSS v ktoromkoľvek IVF centre, z ktorého komplikácie „pochádzajú“. Až keď bude veľa hospitalizácií z jedného centra, mohli by sme uvažovať o preverení práce centra, na Slovensku napríklad prostredníctvom Úradu pre dohľad nad zdravotnou starostlivosťou.
V prípade zahraničných centier tiež nie sú vylúčené sankcie, napríklad v rámci Európskej únie, ale akútne postihnutej pacientke nepomôžu. Každé IVF centrum sa snaží mať vysokú úspešnosť a minimálny počet komplikácií, prinesie mu to najlepšiu reklamu a následne spokojné pacientky a vyšší počet cyklov. Preto slušná komunikácia s centrom môže priniesť spresnenie anamnézy a lepšiu šancu na úspešnú liečbu a prevenciu komplikácií u pacientky. Zároveň takáto komunikácia môže priniesť zlepšenie preventívnych opatrení v centre a následne zníženie počtu hospitalizácií po liečbe v danom centre, napríklad ajzavedením nových účinných preventívnych opatrení a jednoduchých a účinných liečebných postupov.
Aj keď stále neexistuje celosvetový konsenzus, ako by mal byť robený dohľad nad asistovanou reprodukciou (AR) a v 35 krajinách zo 162, ktoré sa zapojili do projektu Surveillance 1998–2010, neexistujú pre AR žiadne legislatívne ani dobrovoľné ustanovenia [26], rozvoj techník AR vedie ku vzniku mnohých národných a medzinárodných spoločností a komisií, ktoré etické a legislatívne pravidlá AR ovplyvňujú. Spoločným menovateľom takýchto aktivít môže byť posun z oblasti kontroly úspešnosti a prevencie komplikácií do kvalitatívne vyšších rovín, ktoré prinášajú iné pohľady na hodnotenie výsledkov liečby, okrem klasického “take home baby rate“, počtu transferovaných embryí, percenta viacplodových gravidít a počtu redukcií napríklad aj ovplyvnením reprodukčných strát [27].
Záver
Najčastejšou príčinou rozvoja ohrozujúceho OHSS bolo nedodržanie preventívnych opatrení v IVF centre. Nebola venovaná primeraná pozornosť high responderom. Nedostatočná spolupráca zo strany pacientky, často deklarovaná IVF centrom, nebola ako jednoznačná príčina rozvoja OHSS potvrdená.
Musíme aj do budúcnosti počítať s faktom, že „IVF turistika“ bude ovplyvňovať incidenciu komplikácií asistovanej reprodukcie, vrátane OHSS. V takýchto prípadoch bude pacientky chrániť hlavne slušná komunikácia a bude základom prevencie ďalších komplikácií aj pri nedostatkoch v zdravotnej dokumentácii. Takýto postoj bude určite lepší, ako „hľadanie vinníka“ pri závažnej komplikácii. Zároveň napomôže rýchlejšiemu zavedeniu nových a účinných preventívnych a liečebných postupov v IVF centrách.
Doručeno do redakce: 28. 3. 2011
Přijato po recenzi: 8. 8. 2011
MUDr. Ladislav Maršík, PhD.
Univerzitné pracovisko reprodukčnej medicíny,
I. gynekologicko-pôrodnícka klinika,LF UK a UN Bratislava,
Slovenská republika
laco@marsik.sk
Zdroje
1. Delvigne A, Rozenberg S. Preventive attitude of physicians to avoid OHSS in IVF patients. Hum Reprod 2001; 16(12): 2491–2495.
2. Maršík L, Ďurechová A. Ovariálny hyperstimulačný syndróm – manažment. Gynekol Prax 2004; 2(3): 179–183.
3. Hredzák R, Ostró A, Lazar I. Ovariálny hyperstimulačný syndróm. Lék Listy 2002; 8 : 10.
4. Hudeček R, Ventruba P, Tsompsos KN et al. Incidence of malignancy occurance in patients treated for infertility with assisted reproduction techniques. Helen Jour Obstet Gynecol 2005; 4(5): 251–257.
5. Hudeček R, Ventruba P, Unzeitig V et al. Analysis of ovarian hyperstimulation syndrome development using data mining. Scripta Medica Brno 2005; 78 : 329–340.
6. Bielik P, Bieliková S. Ovariálny hyperstimulačný syndróm pri spontánnej gravidite. Slov Lek 2009; 5–6 : 110–112.
7. Golan A, Ron-El R, Herman A et al. Ovarian hyperstimulation syndrome: an update review. Obstet Gynecol Surv 1989; 44(6): 430–440.
8. Navot D. Practicual Guidelines to Prevention and Management of Ovarian Hyperstimulation Syndrome. Serono Fertility Series 1997; 1 : 59–69.
9. Rizk B. Ovarian hyperstimulation syndrome: epidemiology, pathophysiology, prevention and management. New York: Cambridge University Press 2006 : 7–13, 119–126, 130–184.
10. Maršík L, Ďurechová A, Války J et al. Komplexná ambulantná liečba pacientok s ovariálnym hyperstimulačným syndrómom. Slov Gynek Pôrod 2009; 16 : 18–21.
11. Hredzák R, Toporcerová S, Ostró A et al. Možnosti predikcie reakcie ovárií na stimuláciu v programe IVF. Slov Gynek Pôrod 2003; 10(1): 34–35.
12. Oyesanya OA, Parsons JH, Collins WP et al. Total ovarian volume before human chorionic gonadotrophin administration for ovulation induction may predict the hyperstimulation syndrome. Hum Reprod 1995; 10(12): 3211–3212.
13. Lass A. UK Timing of hCG Group. Monitoring of in vitro fertilization-embryo transfer cycles by ultrasound versus by ultrasound and hormonal levels: a prospective, multicenter, randomized study. Fertil Steril 2003; 80(1): 80–85.
14. Chen ChD, Wu MY, Yang JH et al. Intravenous albumin does not prevent the development of severe ovarian hyperstimulation syndrome. Fertil Steril 1997; 68(2): 287–291.
15. Imoedemhe DA. Prevention of ovarian hyperstimulation syndrome. Reproductive medicine in the twenty-first century. London: Parthenon Publishing Group 2002 : 306–321.
16. Tarlatzis BC, Grimbizis G. Treatment of OHSS: Management of the Patient. Serono Fertility Series 1997; 1 : 71–82.
17. Busso C, Fernández-Sánchez M, García-Velasco JA et al. The non-ergot derived dopamine agonist quinagolide in prevention of early ovarian hyperstimulation syndrome in IVF patients: a randomized, double-blind, placebo-controlled trial. Hum Reprod 2010; 25(4): 995–1004.
18. Alvarez C, Alonso-Muriel I, García G et al. Implantation is apparently unaffected by the dopamine agonist Cabergoline when administered to prevent ovarian hyperstimulation syndrome in women undergoing assisted reproduction treatment: a pilot study. Hum Reprod 2007; 22(12): 3210–3214.
19. de Mouzon J, Goossens V, Bhattacharya Set al. Assisted reproductive technology in Europe, 2008: results generated from European registers by ESHRE. Hum Reprod 2011; 26: i84.
20. Malý Z. OHSS – řešitelná komplikace. Zborník abstraktov: XVIII. kongres Slovenskej gynekologicko-pôrodníckej spoločnosti 2011 : 34–35.
21. Buckett WM, Chian RC, Holzer H et al. Obstetric outcomes and congenital abnormalities after in vitro maturation, in vitro fertilization, and intracytoplasmic sperm injection. Obstet Gynecol 2007; 110(4): 885–891.
22. Nardo LG, Yates AP, Roberts SA et al. The relationship between AMH, androgens, insulin resistance and basal ovarian follicular status in non-obese subfertile women with and without PCOS. Hum Reprod 2009; 24(11): 2917–2923.
23. La Marca A, Broekmans FJ, Volpe A et al. Anti-Mullerian hormone (AMH): what do we still need to know? Hum Reprod 2009; 24(9): 2264–2275.
24. Ferraretti AP, Gianaroli L, Diotallevi L et al. Dopamine treatment for severe hyperstimulation syndrome. Hum Reprod 1992; 7(2): 180–183.
25. Ben-Ami I, Chuderland D, Kaplan-Kraicer R et al. Novel treatment for ovarian hyperstimulation syndrome (OHSS) using pigment epithelium derived factor (PEDF). Hum Reprod 2011; 26: i37–i38.
26. Ventruba P, Mrázek M, Žáková J et al. Etická a legislativní pravidla asistované reprodukce – Surveillance 1998–2010. Prakt Gyn 2010; 14 (Suppl 1): 159.
27. Korbeľ M, Féderová L, Nižňanská Z et al. Reprodukčné straty v Slovenskej republike v rokoch 2007–2009. Prakt Gyn 2010; 14 (Suppl 1): 160.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2011 Číslo 3-4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Úvodní slovo
- Vývoj spontánnych potratov na Slovensku v rokoch 1997–2009
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
- Genetická predikce osteoporózy v klinické praxi
- Prevence postpartální hemoragie u císařského řezu carbetocinem
- Analoga gonadoliberinu v léčbě infertility
- Cílená – biologická léčba karcinomu ovaria
- Vyšetření spermií metodou fluorescenční in situ hybridizace
- Prevence dědičného rizika nádorů prsu a ovaria
- Inhibítory aromatázy v liečbe karcinómu prsníka: prehľad a možné prínosy u žien pred menopauzou
- Sayana – nová tvář klasického depotního medroxyprogesteron acetátu
- Císařský řez, ale jaká anestezie?
- Liečba rekurentného karcinómu ovária
- Operační techniky a legislativní podmínky sterilizace žen v České republice
- Donošená vysoká kornuální gravidita
- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- 13th World Congress on Menopause
- Studie MEGASET prokázala účinnost a snášenlivost přípravku MENOPUR® po ICSI u cyklů s antagonisty GnRH
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- Analoga gonadoliberinu v léčbě infertility
- Donošená vysoká kornuální gravidita
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



