-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Identifikácia markerov proliferačnej aktivity v karcinóme endometria
Identification of proliferation markers in endometrial carcinoma
Endometrium is a specialised tissue characteristic by intravital changes of its morphological appe arance as well as of the expression of different proteins. A total of 60 formalin‑fixed and paraffin‑embedded biopsy tissue samples with proliferative (PE, 10) and secretory (SE, 10) endometrium, endometrio id G1 (ECG1, 10) and G3 (ECG3, 10), serous (SC, 10) and cle ar cell (CCC, 10) endometrial carcinoma (ECa) were evalu ated immunohistochemically (IHC) for the expression of PCNA, Ki - 67 and p53 proteins in the nuclei of endometrial epithelial cells. The expression of PCNA and Ki - 67 was high in PE, with considerable decre ase in SE. In CaE, the ex pression of PCNA and Ki - 67 was high and did not significantly differ from the ex pression in PE and in various histological subsets and grades of ECa. The highest expression of PCNA and Ki - 67 was in the subset of aggressive ECa. The expression of p53 was related only to aggressive (mainly SC and ECG3, less CCC) types of ECa and to the worse clinical behavior of the oncological illnesses. In conclusion, the pro‑teins p53, Ki - 67 and PCNA are important prognostic markers of ECa. Evalu ation of these proteins by IHC is an relatively inexpensive and simple method with implica tions for clinical practice. In ECa there is an incre ased expression of p53. Ki - 67 and PCNA are excellent markers of malignant transformation of endometrial cells espe cially in postmenopa usal period that do not produce under normal conditions (Tab. 1, Fig. 8) [73].
Key words:
endometrial carcinoma – proliferation markers – PCNA – Ki - 67 – p53 – im munohistochemistry – prognostic markers.
Autoři: V. Šišovský; Ľudovít Danihel; P. Babál; M. Palkovič; J. Jakubovský; B. Bučeková; M. Budaj; A. Molnárová
Vyšlo v časopise: Prakt Gyn 2008; 12(4): 236-244
Práce je převzata z časopisu Praktická gynekológi a, 2007; 14(3): 112–120 na základě spolupráce redakcí našich časopisů a dohody o výměně odborných prací.
Souhrn
Endometrium je špecializované tkanivo, ktorého morfologický vzhľad – ako aj prítomnosť mnohých proteínov v ňom – sa ne ustále mení v priebehu biologického veku ženy, počas menštru ačného cyklu a výrazne v nádorových procesoch. Celkom 60 vo formalíne fixovaných a do parafínu zaliatych bioptických tkanivových vzoriek s proliferujúcim (PE, 10) a sekrečným (SE, 10) endometriom, endometrio idným G1 (ECG1, 10) a G3 (ECG3, 10), seróznym (SC, 10) a svetlobunkovým (SvC, 10) karci nómom endometria (CaE) sme vyšetrili imunohistochemicky (IHC) na expresiu pro‑teínu PCNA, Ki - 67 a p53 v jadrách epitelových buniek žliazok endometria. Expresia PCNA a Ki - 67 bola vysoká v PE, s výrazným poklesom v SE. V CaE expresia PCNA a Ki - 67 bola vysoká a zásadne sa nelíšila od expresie v PE a v jednotlivých histolo gických podtypoch a stupňoch CaE, pričom najvyššia expresia PCNA a Ki - 67 bola u agresívnych typov CaE. Expresia p53 mala vzťah len k agresívnemu (najmä SC a ECG3, zriedkavejšie SvC) typu CaE a k horšiemu klinickému priebehu nádorovej choroby. Súhrnne možno konštatovať, že proteíny p53, Ki - 67 a PCNA sú dôležitými znakmi prognózy vývoja CaE. Ich hodnotenie pomocou IHC je pomerne lacnou a jednoduchou metódou s implikáciou pre klinickú prax. V CaE s agresívnym fenoty pom (najmä v SC a ECG3, menej SvC) dochádza k vzostupu expresie p53. Expresia Ki - 67 a PCNA sú výborným markerom malígnej premeny buniek endometria naj mä po menopa uze, ktoré za normálnych okolností Ki - 67 a PCNA netvorí (tab. 1, obr. 8) [73].
Kľúčové slová:
karcinóm endometria – proliferačné markery – PCNA – Ki - 67 – p53 – imunohistochémia – prognostické faktoryÚvod
Výrazne stúpajúci výskyt zhubných nádorov tela maternice žien (American Cancer Society 2000, Jemal et al, 2005, Pleško et al, 1994, Pleško et al, 2003, Redecha et al, 2004) je predmetom záujmu mnohých odborníkov z rôznych vedných odborov. Sú to onkológovia, gynekológovia (Redecha et al, 1996, 2004, 2005, Šuška a Holomáň,1997, Šuška, 2003), molekuloví biológovia a genetici (Weismanová et al, 2002, Repiská et al, 2003, Molnárová et al, 2006), patológovia (Deligdisch a Cohen, 1985, Robboy et al, 1988, 2002, Danihel et al, 1995, 2002, 2003, 2005, Danihel a Breitenecker, 1997, Silverberg et al, 2003, Šišovský et al, 2004, 2006a, 2006b, 2006c, 2006d, 2006e, Šišovský, 2005, Gomolčák et al, 2005, Budaj a Bučeková, 2007a,b). K rozšíreniu poznatkov o tejto malignite výrazne prispievajú patológovia, najmä z hľadiska stanovenia presnej diagnózy.
Karcinóm endometria je najčastejšia invázna neoplázia ženského pohlavného traktu, 4. najčastejšie diagnostikovaný karcinóm v Spojených štátoch amerických a celosvetovo 5. najčastejší karcinóm u žien a má stúpajúci výskyt (American Cancer Society, 2000, Ronnett et al, 2002, Jemal et al, 2005). Vrátane Slovenska, kde ich počet vzrástol podľa Národného onkologického registra SR za posledných 20 rokov (1980 až 2000) takmer o tretinu (Pleško et al, 1994, 2003). Karcinóm endometria sa na Slovensku dotýka každoročne asi 700 žien, pričom asi 200 ich končí fatálne. Imunohistochemická analýza je veľakrát jedným z rozhodujúcich faktorov stanovenia diagnózy a prognózy nádorovej choroby a výrazne ovplyvňuje jej liečbu (Danihel a Porubský, 1991, Danihel et al, 1995, Azumi a Czernobilsky, 2002).
Endometrium je špecializované tkanivo, ktorého morfologický vzhľad, ako aj prítomnosť mnohých proteínov v ňom sa ne ustále mení (Mutter a Ferenczy, 2002). Mení sa v priebehu biologického veku ženy, počas menštru ačného cyklu (Mutter a Ferenczy, 2002) a výrazne v nádorových procesoch (Ronnett et al, 2002). Expresia niektorých proteínov môže byť prvotriednym indikátorom bunkovej diferenciácie, proliferácie a skorým znakom ich malígnej premeny.
Karcinóm endometria (CaE)
CaE pochádza zo žľazových epitelových štruktúr endometria. Má rozličné histopatologické formy (tab. 1). Každá z nich má vlastné špecifické morfologické vlastnosti. Podľa Robboya et al (1988) niektoré formy hyperplázie endometria (HE) a CaE tvoria široké spektrum proliferačných stavov, ktoré predstavujú morfologické a biologické kontinuum, začínajúce hyperpláziou žliaz endometria a končiace adenokarcinómom. Podľa Gusberga (1988) adenokarcinómu endometria možno predísť včasnou liečbou HE. Pozorovania iných dokazujú, že niektoré histologické podtypy (serózny podtyp) CaE nepochádzajú z HE (Ronnett et al, 2002, Silverberg et al, 2003, Danihel et al, 2005).
Tab. 1. Modifikovaná histologická klasifikácia karcinómu endometria, WHO 2003 (Silverberg et al, 2003). 
Patogenéza karcinómu endometria
Existujú snahy opísať prekancerózy CaE analogicky prekancerózam krčka maternice. Postupnosť patogenézy prekanceróz stúpa od jednoduchej HE (na karcinóm sa zmení u 1 – 10 % žien o 2 – 15 rokov) cez komplexnú HE (karcinóm vznikne u 12 – 22 % žien za 1 – 14 r.), atypickú komplexnú HE (progresia do karcinómu u 29 – 100 % žien do 1 – 5 rokov) a cez carcinoma in situ do CaE (Šuška, 2003).
CaE rastie pomerne pomaly. Zväčšuje rozmery tela maternice, potom má sklon k infiltrácii myometria a k rozpadu pre nekrózu (Zavadil a Motlík, 1984, Danihel et al, 2005). Aj malá a atrofická maternica môže ukrývať difúzne do myometria prenikajúci tumor (Wheeler et al, 2000). Má lepšiu prognózu než karcinóm krčka maternice, neskoro metastazuje (Poradovský, 1984). Neskôr sa CaE môže šíriť povrchovým rastom v endometriu, bežne do nižších segmentov maternice, aj do kanála krčka a do myometria (Ronnett et al, 2002, Redecha et al, 2005).
Početné epidemiologické, klinické, histopatologické a molekulovo - biologické a genetické štúdie z posledných rokov poukazujú na odlišnú patogenézu rôznych foriem tejto neoplázie. Predpokladajú sa dve základné formy CaE, typ I a typ II (Bokhman, 1983, Lax, 2004, Liu, 2007). S tým súvisí aj úzky vzťah veku žien k stupňu histologickej diferenciácie malignity, k hĺbke invázie a k rozsahu anatomického šírenia nádoru (Silverberg et al, 2003, Redecha et al, 2005, Liu, 2007).
Typ I CaE sa vyskytuje u mladších žien a žien v perimenopa uze. Je nižšieho malígneho potenciálu, býva dobre diferencovaný, invázia do myometria je často minimálna a invázia do lymfatických priestorov je zriedkavejšia. Vo všeobecnosti má dobrú prognózu. Často súvisí s hyperestrogenizmom a má estrogénové a progesterónové receptory (Lax, 2004). Vzniká v HE (Silverberg et al, 2003), z atypickej HE. Najčastejšou skorou genetickou poruchou je inaktivácia nádorového supresorového génu PTEN spôsobená mutáciou (Mutter et al, 2000), ďalej mutácia v „DNA mischmatch repair genes“ (MLH1, MSH2, MSH6), mikrosatelitová instabilita a mutácia v K - ras a v b - catenin‑e (Lax, 2004). Typ I CaE reprezentuje endometrio idný histologický podtyp CaE (Bokhman, 1983).
Typ II CaE sa vyskytuje u starších žien. Je vyššieho malígneho potenciálu, býva menej diferencovaný, invázia a infiltrácia myometria je hlbšia alebo nádor prerastá a šíri sa do okolia tela maternice a má vyšší sklon k lymfogénnej propagácii (Robboy et al, 1988). Vo všeobecnosti má horšiu prognózu. V anamnéze nie sú dokázateľné vyššie uvedené endogénne rizikové faktory (Anderson et al, 2002), resp. nesúvisí s hyperestrogenizmom a nemá estrogénové a progesterónové receptory (Lax, 2004). Vzniká nezávisle od HE (Silverberg et al, 2003), v prostredí atrofie endometria, z intraepitelového CaE. Najčastejšia skorá genetická porucha je v nádorovom supresorovom géne TP53 (Deligdisch a Cohen, 1985, Lax, 2004), ďalej inaktivácii p16 a e - cadherin‑u, amplifikácia C - erbB - 2 (ERBB2) (Lax, 2004) a je prítomná ane uplo idia. Typ II CaE reprezentuje serózny histologický podtyp CaE (Bokhman, 1983).
V súčasnosti sa uvažuje aj o III. možnej forme CaE. Vo všeobecnosti s biologickými vlastnosťami a správaním sa nachádza niekde na rozmedzí medzi nádormi I. a II. typu. Nesúvisí s hyperestrogenizmom. Vzniká v prostredí atrofie endometria (Sivridis et al, 1988).
Bandera a Boyd (1977) navrhli aj IV. skupinu CaE. Vyskytuje sa u žien s vrodenou dispozíciou k vzniku karcinómu. Vzniká o 15 r. skôr než je všeobecne udávaná pre ostatnú populáciu. Má pomerne dobrú prognózu.
Klasifikácia karcinómu endometria
Modifikovanú verziu súčasnej klasifikácie CaE, na príprave ktorej sa podieľala Svetová zdravotnícka organizácia (WHO) a Medzinárodná spoločnosť gynekologických patológov (International Society of Gynecological Pathologists, ISGYP), uverejnili v AFIP (Armed Forces Institute of Pathology) Atlase nádorovej patológie (Silverberg a Kurman, 1992) a v mnohých odborných publikáciách (Scully et al, 1994, Breitenecker a Lax, 1994, Šuška a Holomáň, 1997, Danihel a Breitenecker, 1997, Šuška, 2003). Poslednú modifikovanú verziu tejto klasifikácie uverejnili v r. 2002 (Ronnett et al, 2002), s miernou úpravou v r. 2003 v klasifikácii WHO v Nádoroch prsníka a ženských pohlavných orgánov „Nádory tela maternice – Epitelové nádory a príbuzné zmeny“ (Silverberg et al, 2003) (tab. 1).
Cieľ práce
Cieľom prezentovanej práce je identifikácia zmien expresie markerov proliferačnej aktivity v epitelových bunkách žliazok imunohistochemickými (IHC) metódami, v korelácii s morfologickým a klinickým nálezom pri CaE.
Materiál a metódy
Celkom 60 bioptických vzoriek endometria (z archívu Ústavu patologickej anatómie Lekárskej fakulty Univerzity Komenského v Bratislave, r. 1994 – 2004) z materníc (od žien vo veku 26 – 86 r.) získaných hysterektómiou alebo kyretovaním endometria (pre krvácanie z maternice alebo nádor zistený sonografiou či výsledok predchádzajúcej biopsie) bolo zahrnutých v tejto štúdii. Vo formalíne fixované a do parafínu zaliate tkanivové vzorky s proliferujúcim (PE, 10×) a sekrečným (SE, 10×) endometriom (ženy vo veku 26 – 45 r.), endometrio idným (EC) G1 (ECG1, 10×) a G3 (ECG3, 10×) (31 – 61 r.), seróznym (SC, 10×) (39 – 86 r.) a svetlobunkovým (SvC, 10×) (60 – 86 r.) histologickým podtypom CaE sme vyšetrili IHC. Expresiu antigénu jadier proliferujúcich buniek (PCNA), antigénu Ki – 67 združeného s proliferáciou buniek (Ki - 67) a nádorového proteínu p53 (p53) v jadrách epitelových buniek žliazok endometria sme detegovali príslušnými monoklonovými protilátkami. Nepriamu metódu s komplexom streptavidínu a biotínu s chrenovou peroxidázou (ABC - Px) a s 3,3’ - diaminobenzidínom ako chromogénom sme použili na vizu alizovanie re akčného produktu (DakoCytomation 2004, Azumi a Czernobilsky, 2002). Nálezy (re akciu protilátok/ expresiu proteínov) sme hodnotili svetelným mikroskopom (Nikon Eclipse E400, Tokyo, Japonsko) semikvantitatívne ako: negatívne – 0, nepravidelne slabo pozitívne (do 5 % buniek) – 0,5, pravidelne slabo pozitívne (> 5 % a < 25 % buniek) – 1, pravidelne stredne silne pozitívne (25 % až 50 % buniek) – 2, pravidelne silne pozitívne (> 50% buniek) – 3. Použité postupy (výber materiálu do súboru) zodpovedali príslušným národným a medzinárodným etickým štandardom (revízia Helsinskej deklarácie z r. 2002) a pravidlám príslušných etických komisi í o právach pacienta (Jakubovský, 2003).
Výsledky
Výsledky hodnotenia expresie PCNA, Ki - 67 a p53 sú zhrnuté v grafe č. 1. Expresia PCNA (obr. 1) a Ki - 67 bola vysoká v PE s výrazným poklesom v SE. V CaE expresia PCNA bola vysoká a takmer rovnaká ako v PE (obr. 1) a zásadne sa v jednotlivých histologických podtypoch a stupňoch CaE nelíšila (obr. 3 a 4), pričom najvyššia miera expresie PCNA súvisela s agresívnym (SC, SvC a ECG3) (obr. 4) typom CaE. Najvyššia expresia Ki - 67 bola u agresívnych typov CaE (najmä SC a ECG3, menej SvC). Expresia p53 mala vzťah len k agresívnemu (najmä SC a ECG3, zriedkavejšie SvC) typu CaE (obr. 6, 7 a 8) a k horšiemu klinickému priebehu nádorovej choroby. V PE (obr. 2), v SE a v ECG1 (obr. 5) sme expresiu p53 nezistili.
Graf 1. Expresia proteínov PCNA, Ki– 67 a p53 v normálnom endometriu a v karcinóme endometria. 
Obr. 1. Pravidelne silne pozitívna expresia PCNA v PE. Komplex streptavidínu a biotínu s peroxidázou (ABC- Px), 100×. 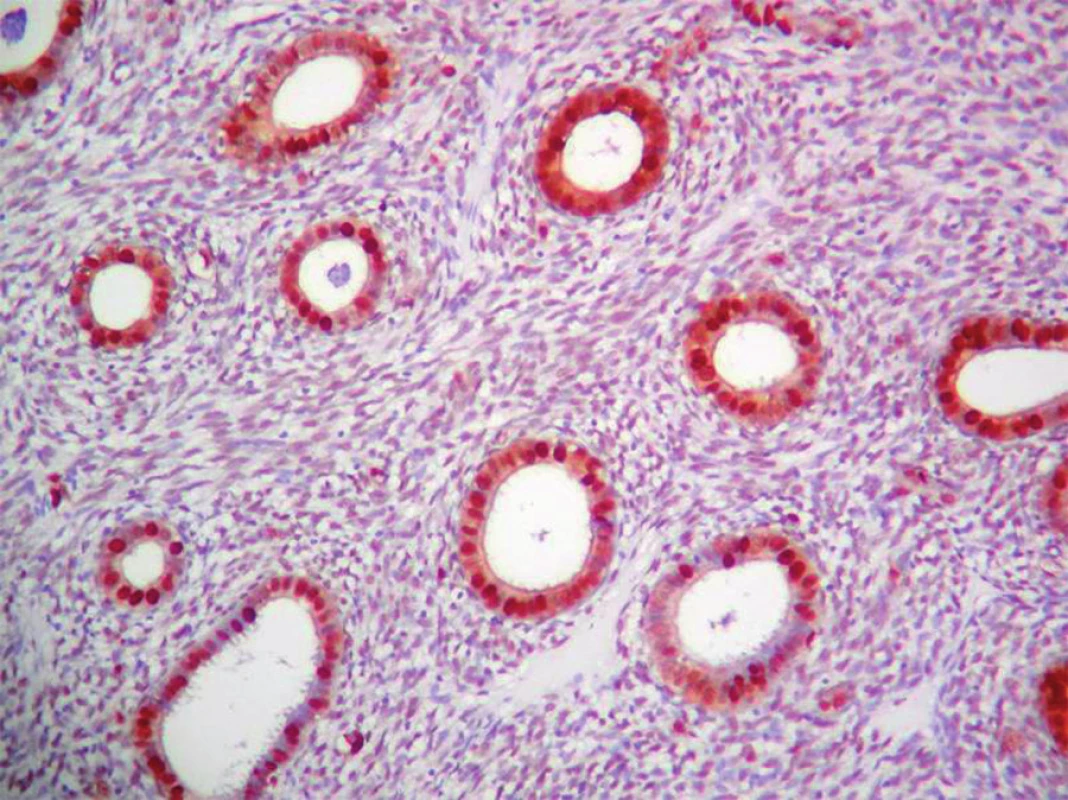
Obr. 2. Neprítomnosť expresie p53 v PE. ABC-Px, 100×. 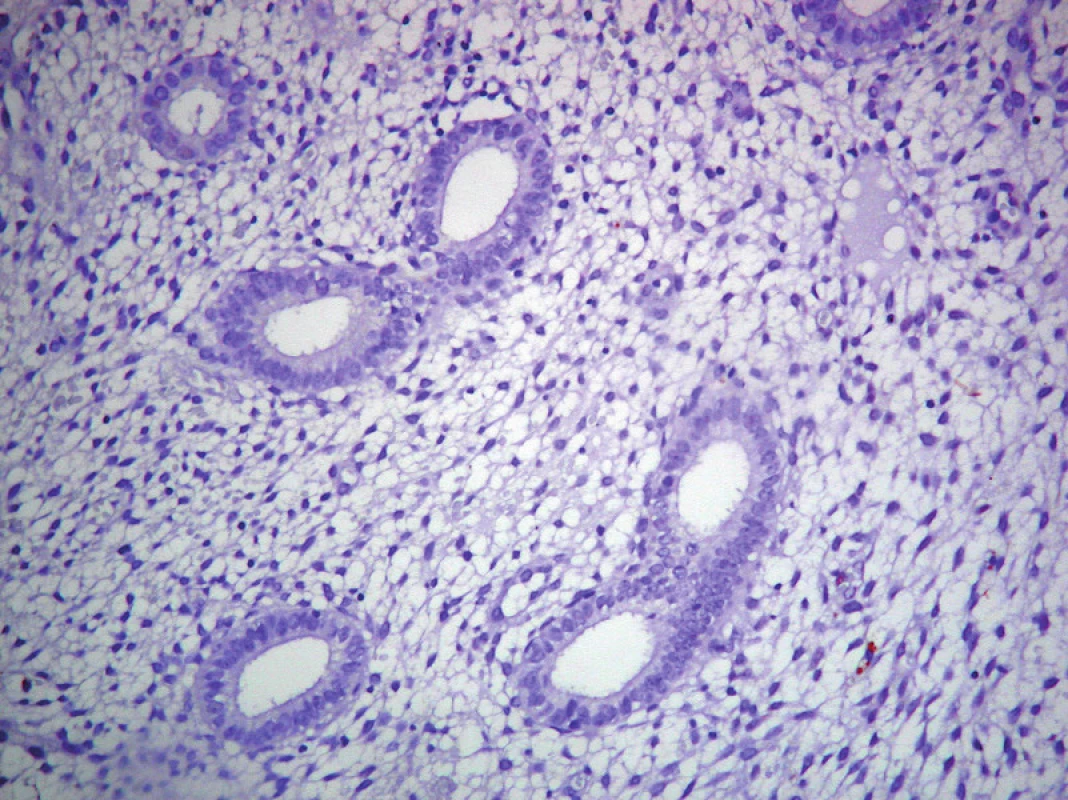
Obr. 3. Pravidelne silne pozitívna expresia PCNA v ECG1. ABC- Px, 100×. 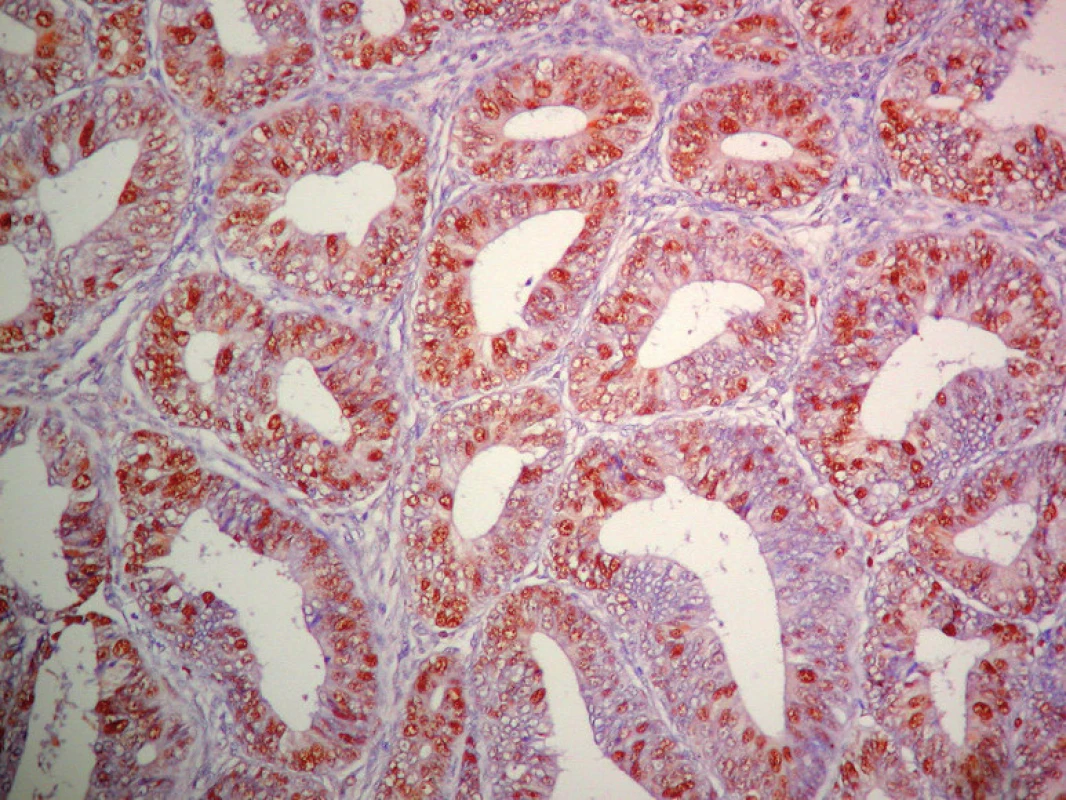
Obr. 4. Detekcia PCNA v SvC. ABC- Px, 100×. 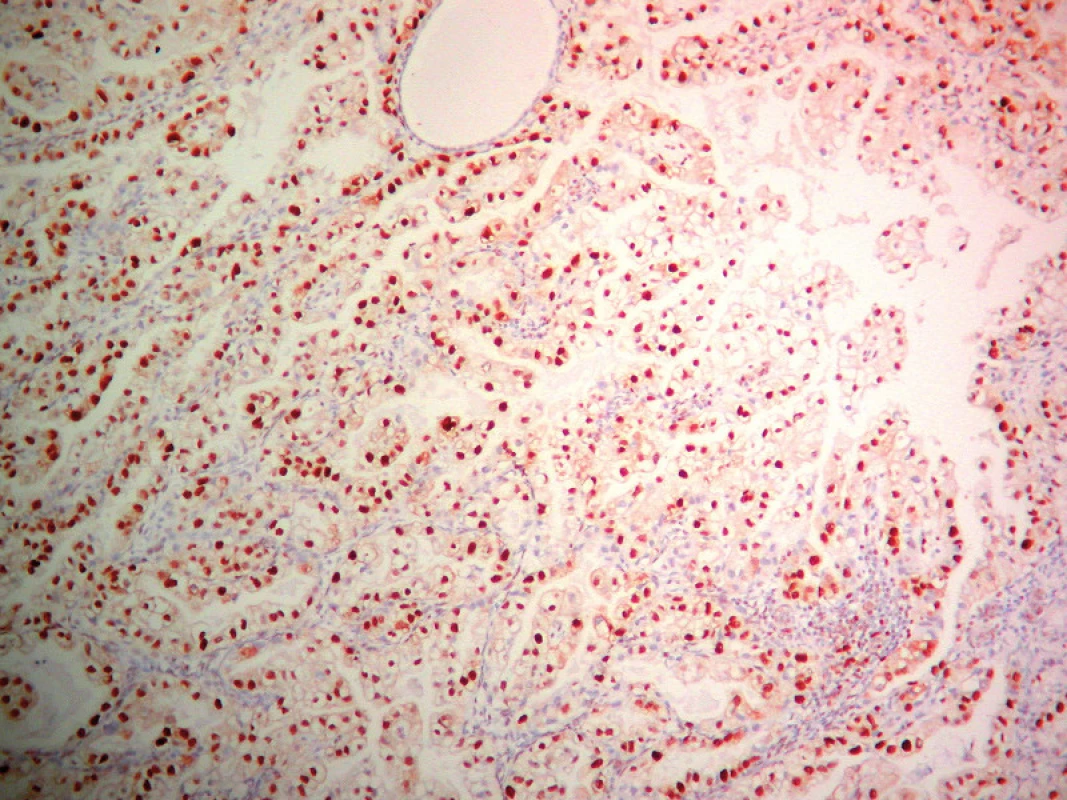
Obr. 5. Neprítomnosť expresie p53 v ECG1. ABC– Px, 100×. 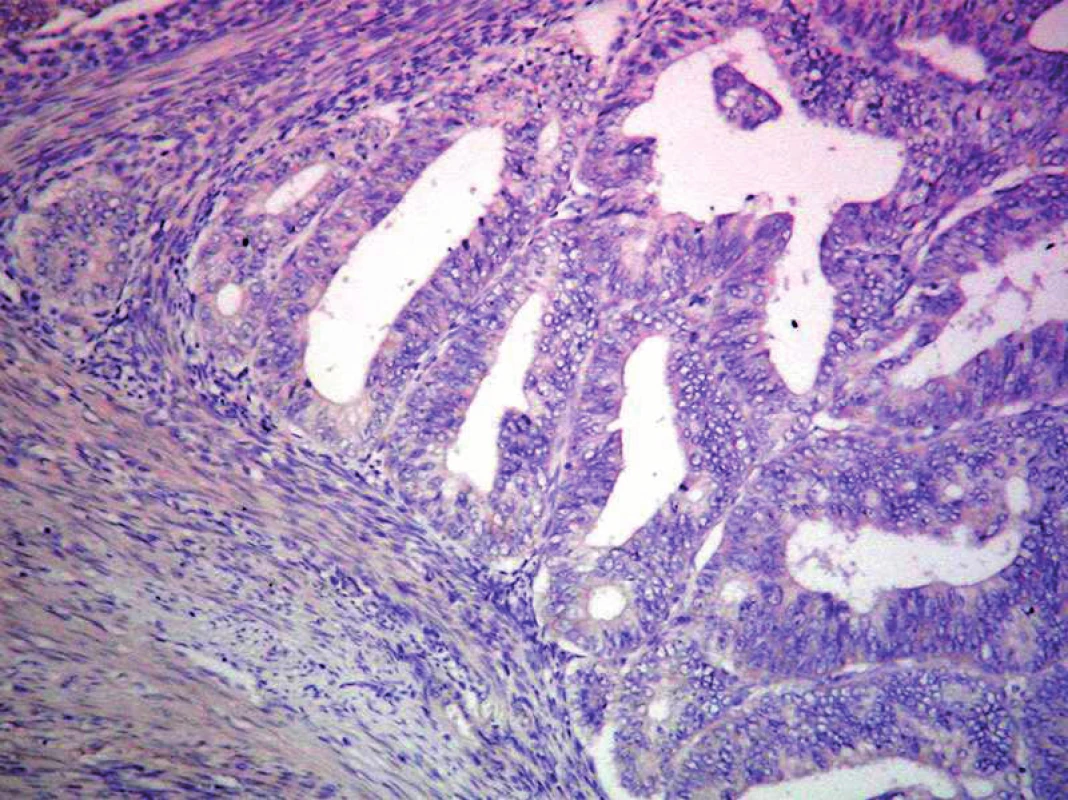
Obr. 6. Detekcia p53 v ECG3. ABC– Px, 100×. 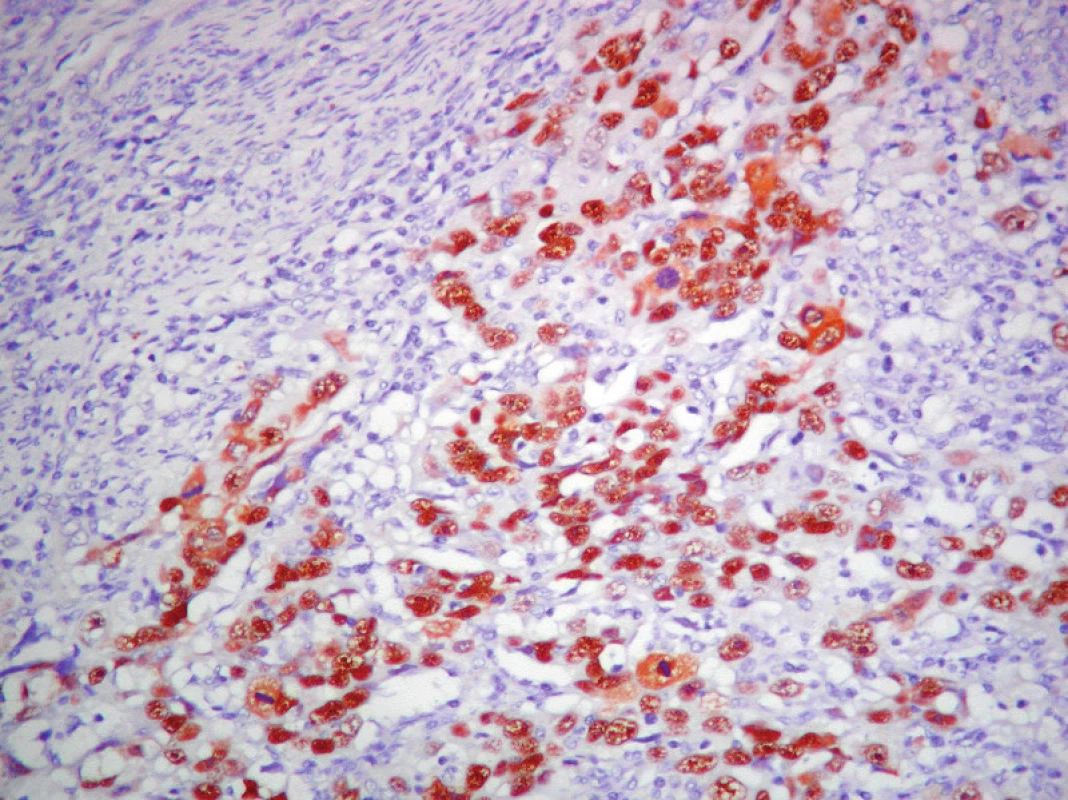
Obr. 7. Pravidelne silne pozitívna expresia p53 v SC (vpravo). Neprítaomnosť expresie p53 v atrofickom cystickom endometriu (vľavo). ABC– Px, 100×. 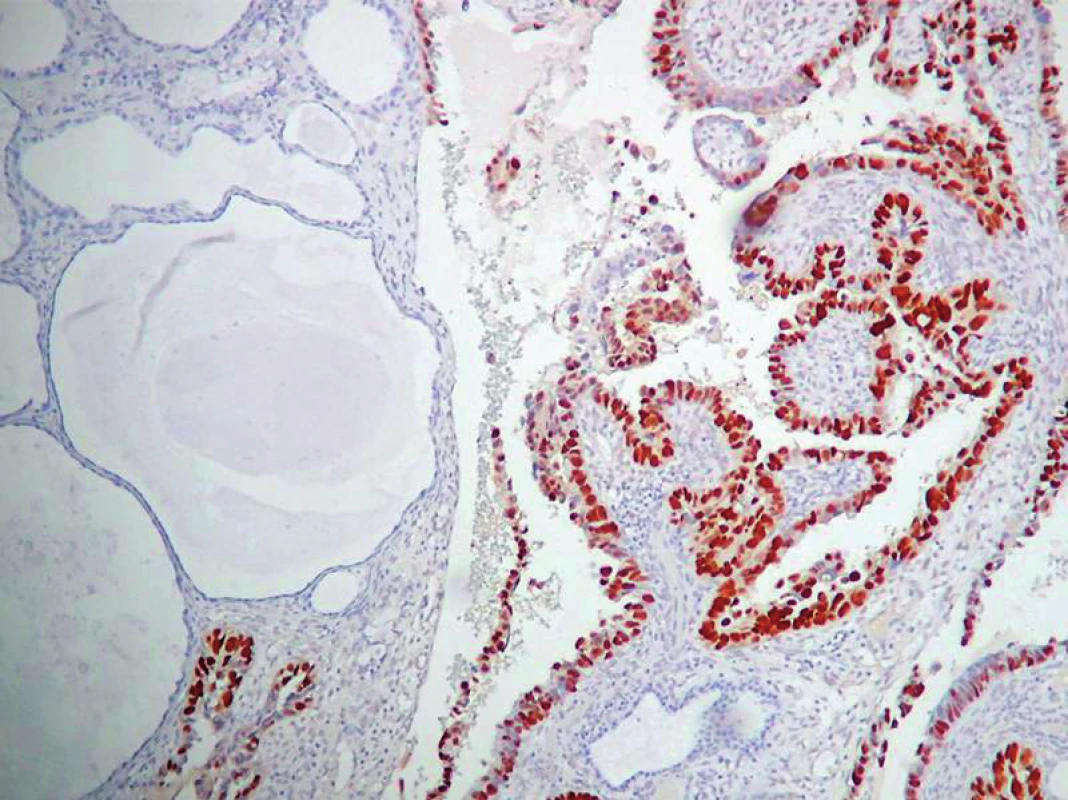
Obr. 8. Detekcia p53 v SvC. ABC– Px, 100×. 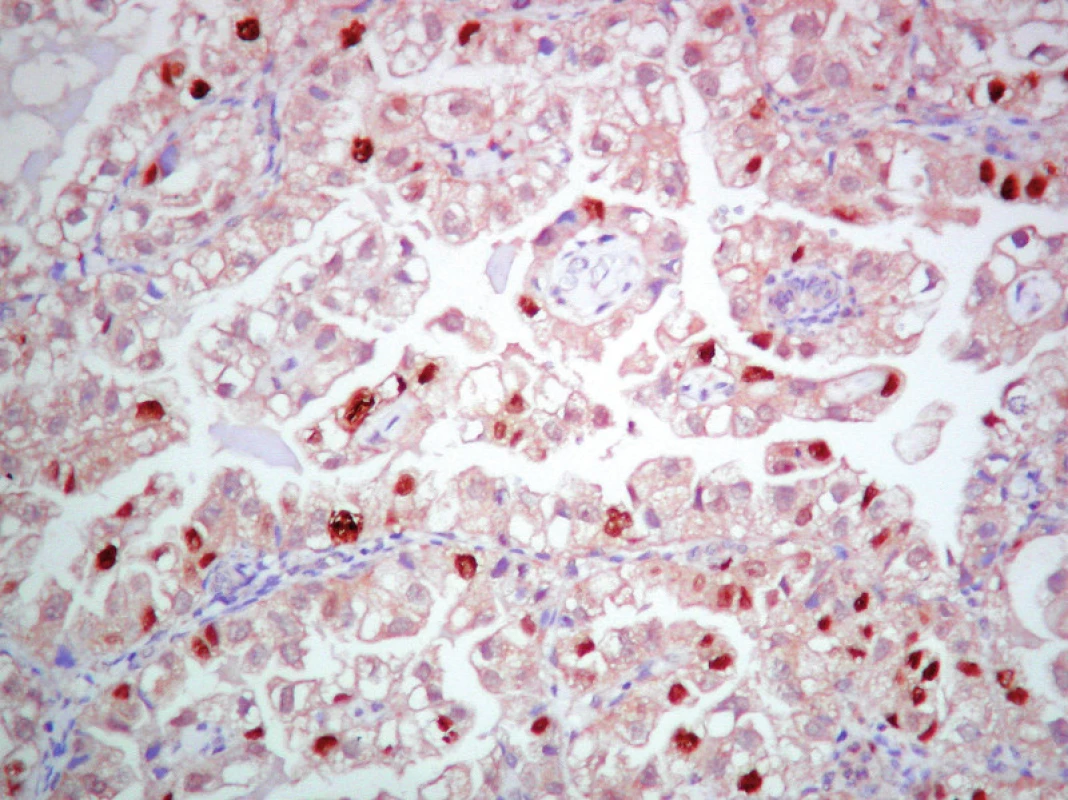
Diskusia
Naše výsledky ukazujú dobrú koreláciu expresie vybraných proteínov s histologickým podtypom a stupňom diferencovania CaE a sú v zhode s inými publikovanými prácami, ktoré hodnotili validitu týchto znakov.
PCNA a Ki - 67 sú proteíny jadier buniek spojené s proliferáciou buniek. Ich expresia nie vždy navzájom koreluje (Azumi a Czernobilsky, 2002). Endometrium pred ovuláciou charakterizuje proliferácia buniek žliaz, strómy a endotelu ciev, maximálny počet buniek endometria syntetizujúcich jadrovú DNA, čo korešponduje s maximálnou aktivitou mitóz (Aronica a Katzenellenbogen, 1991) a s expresiou Ki - 67 (Tabibzadeh, 1990).
Hareyama (1994) opisuje v neskorej fáze PE signifikantne vyšší index PCNA (% jadier s obsahom PCNA) než v skorej fáze PE a než skorej a strednej fáze SE. Tieto nálezy sú podobné s našimi zisteniami, kde expresia PCNA a Ki - 67 v PE bola vysoká, ale v SE došlo k výraznému poklesu expresie PCNA a Ki - 67. Skoré a neskoré fázy PE, resp. SE sme samostatne nehodnotili.
Ito et al (1993) zistili, že v PE expresia PCNA bola signifikantne nižšia než v ECG3. Tieto nálezy sú odlišné od našich zistení, medzi PE a ECG3 sme nezistili žiadnu odlišnosť v expresii PCNA, kde expresia PCNA bola vysoká. Podobné výsledky má aj Hareyama (1994), ktorý v CaE tiež nezistil signifikantne vyšší index PCNA než v PE.
Elhafey et al (2001) tvrdia, že v EC expresia PCNA koreluje s jeho stupňom histologickej diferenciácie a je nižšia než v podtypoch CaE so zlou prognózou (SC a SvC). Chen et al (2001) zistili, že CaE so zlou diferenciáciou alebo v pokročilom klinickom štádiu majú vyššiu expresiu PCNA a sú agresívneho fenotypu, a že expresia PCNA spojená s expresiou ESR/ PGR (receptor pre estrogén/ receptor pre progesterón) má značnú hodnotu v ich prognóze. Tieto zistenia sú do určitej miery podobné s našimi výsledkami, ktoré ukazujú mierne stúpanie expresie PCNA so stupňom histologickej diferenciácie EC a najvyššiu expresiu PCNA v ECG3, v SC a v SvC. Expresiu ESR a PGR sme nezisťovali.
Yu et al (1993) tvrdia, že v CaE nie je jednoduchý vzťah medzi expresiou p53 a PCNA. Väčšina inváznych adenokarcinómov s expresiou p53, ale aj signifikantný počet CaE bez expresie p53 bolo s expresiou PCNA. Naše výsledky korešpondujú s uvedenými, v takmer všetkých CaE expresia PCNA bola výrazná, ale expresiu p53 sme nezistili v ECG1.
Výsledky Ito et al (1997) ukázali, že v SE je expresia Ki - 67 signifikantne nižšia než v PE a než v EC. Ich zistenia našli podporu v našich nálezoch, ktoré ukazujú vysokú expresiu Ki - 67 v PE a jej výrazný pokles v SE, kde bola výrazne nižšia než v ostatných nami sledovaných stavoch.
Ito et al (1997) ďalej v EC zistili signifikantne vyššiu expresiu Ki - 67 než v PE. Tieto nálezy naše zistenia potvrdili len čiastočne; expresia Ki - 67 v PE a v EC sa zásadne neodlišovala.
Lax et al (1998) sa domnievajú, že SC a SvC nezávisia od estrogénov a majú vysoký index Ki - 67 (% jadier obsahujúcich Ki - 67). Na rozdiel od SC, vo SvC zriedkavejšie dochádza k výraznej expresii p53. Preto usudzujú, že patogenéza SvC sa líši od patogenézy EC a SC. Tieto nálezy našli podporu v našich výsledkoch, ktoré ukázali v ECG3 a v SC najvyššiu expresiu Ki - 67, ale v ECG1 a v SvC expresia Ki - 67 bola mierne nižšia. Naše výsledky podporujú výsledky Salvesena et al (1998), ktorí hovoria, že v CaE expresia Ki - 67 koreluje s jeho histologickým podtypom a s FIGO (International Federation of Gynecology and Obstetrics, FIGO) štádiom a že expresia Ki - 67 a štádium anatomického rozsahu tumoru zostáva významným nezávislým faktorom prognózy. Možno predpokladať, že mnohé znaky proliferácie sa objavia a budú mať dôležitú úlohu v prognóze jednotlivých typov CaE.
Kerns et al (1992) a Lodish et al (2004) tvrdia, že normálny (nemutovaný) typ p53 má krátky polčas životnosti a v normálnych tkanivách sa nehromadí. Tvrdenia týchto a utorov podporujú naše zistenia, v PE a v SE sme expresiu p53 nezistili. Poškodený p53 (napr. mutáciou) má dlhší polčas životnosti, stráca tlmivú funkciu na proliferovanie a transformáciu buniek a hromadí sa v bunke, kde môže byť detegovaný IHC (Ronnett et al, 2002). Mutácie génu p53 (TP53) (Okamoto et al, 1991) a p53 sa nachádzajú približne u 10 % všetkých EC, asi v 50 % ECG3 a nie sú známe v ECG1 (Parazzini et al, 1995); tie sme našli ako zvýšenú expresiu p53 v ECG3, ale v ECG1 sa expresia p53 nevyskytla. Toto zistenie sa zhoduje s postavením, ktoré má p53 v progresii, ale nie v iniciovaní EC (Ronnett et al, 2002, Robboy et al, 1988, 2002).
V porovnaní s EC sa relatívne málo vie o SC na molekulovej úrovni. V SC nastáva štatisticky významná porucha génu TP53 v takmer 90 % prípadov. Okrem toho, asi 75 % vnútroepitelových CaE, údajného prekurzora SC, má mutácie TP53 (p53) (Tashiro et al, 1997). Tieto zistenia naznačujú, že v SC sa mutácie TP53 (p53) objavujú relatívne skoro a sú ústredné vo vývine tohto typu tumoru. Na rozdiel od EC, v ktorom TP53 (p53) mutácie sú pomerne nezvyčajné a keď sa vyskytnú, sú hlavne v ECG3 (Parazzini et al, 1995, Tashiro et al, 1997). Tento nález našiel podporu v našich výsledkoch; v SC došlo k najvyššiemu vzostupu expresie p53, o niečo slabšia expresia p53 bola v ECG3. Je teda možné, že mutácia TP53 je dôležitým faktorom v patogenéze SC a zodpovedá za jeho agresívne správanie (So ong et al, 1996). Skutočnosť, že mutácie TP53 (p53) sa vyskytujú najčastejšie v ECG3 a v SC, podporuje teóriu, že ide o nezávislý znak tumorov, ktoré sa správajú agresívne (So ong et al, 1996).
SvC sa správa podobne ako SC (Danihel a Breitenecker, 1997) oproti EC (Sakuragi et al, 2000). Napriek tomu je SvC pravdepodobne odlišný (patogenézou od patogenézy EC aj) od SC na základe významne zriedkavejšej IHC dokázanej expresii p53 (Lax et al, 1998). Táto zmena korešponduje s výsledkom našej analýzy, ktorá ukázala v SvC nižšiu expresiu p53 než v SC.
Elhafey et al (2001) sledovali expresiu PCNA a p53 v PE aj v SE, v EC, v SC a v SvC. Tvrdia, že expresia p53 v EC koreluje so stupňom histologickej diferenciácie CaE a je nižšia než v agresívnych (SC a SvC) podtypoch CaE. Expresia PCNA je podobná expresii p53 v rôznych podtypoch CaE a v EC stupňu histologickej diferenciácie. Naše výsledky ukázali vysokú expresiu p53 v SC, nižšiu v ECG3 a najnižšiu v SvC. Expresia PCNA však bola v týchto troch stavoch silná a rovnaká. Expresia PCNA v SE bola najnižšia zo všetkých nami sledovaných stavov endometria.
Ioffe at al (1998) korelovali expresiu faktorov proliferácie, apoptózy a p53 v PE a v ECG1. Frakciu proliferujúcich buniek (FPB) sledovali pomocou indexu mitóz (MI) a Ki - 67 indexom a sledovali apoptotický index (AI). Zistili, že: MI bol 2,48 % v PE a 0,91 % v CaE. Ki - 67 index bol 38,44 % a 31,7 %. AI bol 1,17 % a 3,31 %. Pomer AI/ MI a AI/ Ki - 67 bol najnižší v PE. V PE expresiu p53 nezistili. V CaE bolo 50 % s expresiou p53. CaE s expresiou p53 malo významne vyšší AI. Usudzujú, že v aktívne proliferujúcich tkanivách, akým je endometrium, FPB nekoreluje s progresiou do malignity. Lepším ukazovateľom progresie sú AI a pomer AI/ FPB. V CaE má expresia p53 vzťah k vysokej FPB a AI.
Expresia p53 a PCNA má hodnotu v prognóze pri CaE (Hamel et al, 1996), pričom p53 je nezávislým faktorom prognózy (So ong et al, 1996). Mutácia a overexpresia p53 v CaE sa všeobecne radia k agresívnemu (najmä SC) typu buniek, k vyššiemu stupňu histologického diferencovania, k hĺbke invázie do myometria a k vyššiemu FIGO štádiu CaE (napr. Khalifa et al, 1994, Lax et al, 1998, Tashiro et al, 1997, Geisler et al, 1996).
Záver
Súhrnne možno konštatovať, že proteíny p53, Ki - 67 a PCNA sú dôležitými znakmi prognózy vývoja CaE. Ich hodnotenie pomocou IHC je pomerne lacnou a jednoduchou metódou s implikáciou pre klinickú prax. S výrazným dopadom na liečbu CaE. Tá, v prípade už rozvinutej malígnej nádorovej choroby, je mimoriadne náročná, či z hľadiska finančného, osobného alebo spoločenského. V CaE s agresívnym fenotypom (najmä v SC a ECG3, menej SvC) dochádza k vzostupu expresie p53. Expresia Ki - 67 a PCNA sú výborným markerom malígnej premeny buniek endometria najmä po menopa uze, ktoré za normálnych okolností Ki - 67 a PCNA netvorí.
Poďakovanie
Táto štúdia bola re alizovaná s podporou (finančným darom) Lions Club International LC Bamberg - Mischelsberg a LC Kremnica a čiastočne grantu UK/ 36/ 2007. Autori ďakujú za technickú spoluprácu laborantkám p. I. Uhnavej, p. V. Chmelíkovej a p. L. Donarovej. Prvý a utor ďakuje za podporu Guvernérovi 2006 – 2007 Lions Club International District D - 122 Česká republika a Slovenská republika p. dipl. Ing. Tiborovi Bučekovi.
MUDr. Vladimír Šišovský, PhD.
prof. MUDr. Ľudovít Danihel, PhD.
prof. MUDr. Pavel Babál, CSc.
MUDr. Michal Palkovič, PhD.
prof. MUDr. Ján Jakubovský, DrSc.
MUDr. Beata Bučeková
Miroslav Budaj
MUDr. Alžbeta Molnárová1
Ústav patologickej anatómie Lekárskej fakulty Univerzity Komenského, Bratislava
1 Oddelenie brachyterapie Kliniky radiačnej onkológie Onkologického ústavu sv. Alžbety, Bratislava
Zdroje
1. American Cancer Society: 2000 cancer statistics. CA Cancer J Clin 2000; 50(1): 1 – 64.
2. Anderson MC et al. Endometrial carcinoma. In: Robboy SJ, Anderson MC, Russell P (eds). Pathology of the Female Reproductive Tract. London: Churchill Livingstone 2002 : 331 – 359.
3. Aronica SM, Katzenellenbogen BS. Progesterone receptor regulation in uterine cells: stimulation by estrogen, cyclic adenosine 3’,5’ - mono - phosphate and insulin‑like growth factor I and suppression by antiestrogens and protein kinase. Endocrinology 1991; 128 : 2045 - 2052.
4. Azumi N, Czernobilsky B. Immunohistochemistry (1251 – 1276). In: Kurman RJ (ed). Bla ustein’s Pathology of the Female Genital Tract. 5. ed. New York: Springer-Verlag 2002 : 1391.
5. Bandera CA, Boyd J. The molecular genetics of endometrial carcinoma. In: Aldaz CM et al (eds). Etiology of bre ast and Gynecological Cancers. Progres in Clinical and Biological Rese arch. New York: Willey - Liss 1977 : 185 – 203.
6. Bokhman N. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15 : 10 – 17.
7. Breitenecker G, Lax S. Tumoren des Corpus uteri einschliesslich der Plazenta (97 – 102). In: Histologische Tumor Klassifikation. Wien, New York: Springer - Verlag 1994 : 432.
8. Budaj M, Bučeková B, (Šišovský V, Danihel Ľ, školitelia). Identifikácia markerov proliferačnej aktivity v karcinóme endometria. 46. fakultná konferencia ŠVOČ. Zborník prác, Bratislava: LF UK a Slovak Academic Press, 2007a: 22 – 25. (Práca ocenená diplomom Dekana LF UK v Bratislave za prácu I. poradia, 1. miesto).
9. Budaj M, Bučeková B, (Šišovský V, Danihel Ľ, Repiská V, mentors). Identification of Proliferation Markers in Correlation with p53 Gene Mutation in Endometrial Carcinoma. 18th Europe an Students Conference. Abstracts. Berlin: October 7th – 11th, 2007b.
10. DakoCytomation: DakoCytomation 2004/ 05 Catalog. Denmark: Glostrup 2004 : 359.
11. Danihel Ľ, Babál P, Porubský J, Zaviačič M, Breitenecker G, Janek Ľ. Imunohistochemické markery v diagnostike nádorov maternice. Bratisl lek Listy 1995; 96(7): 353 – 360.
12. Danihel Ľ, Breitenecker G. Histologická diagnostika nenádorových a nádorových zmien endometria v peri - a postmenopa uze (14 – 41). In: P. Šuška, K. Holomáň (eds). Endometrium v peri - a postmenopa uze. Bratislava: Slovak Academic Press 1997 : 186.
13. Danihel Ľ, Gomolčák P, Korbeľ M, Pružinec J, Vojtaššák J, Janík P, Babál P. Expression of proliferation and apoptotic markers in human placenta during pregnancy. Acta Histochem 2002; 104(4): 335 – 338.
14. Danihel Ľ, Horváth R, Breitenecker G, Hatzibugias I. Súčasná klasifikácia a charakteristika nádorov endometria. Slov gynek por 2003;10(Suppl 1): 14 – 17.
15. Danihel Ľ, Porubský J. Prínos monoklonálnych protilátok v bioptickej diagnostike nádorov. Bratisl lek Listy 1991; 92(9): 460 – 466.
16. Danihel Ľ, Šišovský V, Palkovič M, Hatzibugias D, Hatzibugias I. Karcinóm endometria – histopatologická klasifikácia a charakteristika. Gynekol prax 2005; 3(1): 9 – 12.
17. Deligdisch L, Cohen CJ. Histologic correlates and virulence implications of endometrial carcinoma associated with adenomatous hyperplasia. Cancer 1985; 56(6): 1452 – 1455.
18. Elhafey AS, Papadimitriou JC, El - Hakim MS, El - Said AI, Ghannam BB, Silverberg SG. Computerized image analysis of p53 and proliferating cell nucle ar antigen expression in benign, hyperplastic, and malignant endometrium. Arch Pathol Lab Med 2001; 125(7): 872 – 879.
19. Geisler JP, Wiemann MC, Zhou Z, Miller GA, Geisler HE. p53 as a prognostic indicator in endometrial cancer. Gynecol Oncol 1996; 61 : 245 – 248.
20. Gomolčák P, Danihel Ľ, Šišovský V. E - cadherin, a‑inhibin a calponin – biologicky aktívne látky v štruktúrach trofoblastu. Lojdov histochemický deň. Slovenská histochemická spoločnosť, Ústav patologickej anatómie LF UK, Výskumný ústav srdca SAV. Abstrakty. Bratislava: 2005:. 8.
21. Gusberg SB. Detection and prevention of uterine cancer. Cancer 1988; 62 : 1784 – 1786.
22. Hamel NW, Sebo TJ, Wilson TO, Keeney GL, Roche PC, Suman VJ, Hu TC, Podratz KC. Prognostic value of p53 and proliferating cell nucle ar antigen expression in endometrial carcinoma. Gynecol Oncol 1996; 62(2): 192 – 198.
23. Hareyama H. Proliferative activity of normal endometrial cells, endometrial hyperplasia cells and endometrial cancer cells using the monoclonal antibody to PCNA. Hokkaido Igaku Zasshi 1994; 69(6): 1427 – 1431.
24. Chen YP, Shen M, Chen C. Study on expression of PCNA and estrogen, progesterone receptors in endometrial carcinoma. Hunan Yi Ke Da Xue Xue Bao 2001; 26(2): 123 – 125.
25. Ioffe OB, Papadimitriou JC, Drachenberg CB. Correlation of proliferation indices, apoptosis, and related oncogene expression (bcl - 2 and c - erbB - 2) and p53 in proliferative, hyperplastic, and malignant endometrium. Hum Pathol 1998; 29(10): 1150 – 1159.
26. Ito K, Sasano H, Watanabe K, Ozawa N, Sato S, Yajima A. Immunohistochemical study of PCNA (proliferating cell nucle ar antigen) in normal and abnormal endometrium. Int J Gynecol Cancer 1993; 3(2): 122 – 127.
27. Ito K, Sasano H, Yabuki N, Matsunaga G, Sato S, Kikuchi A, Yajima A, Nagura H. Immunohistochemical study of Ki - 67 and DNA topo isomerase II in human endometrium. Mod Pathol 1997; 10(4): 289 – 294.
28. Jakubovský J. Nekorektnosť vo vedeckom bádaní (424 – 442). In: . Hulín I (ed). Základy vedeckej práce. Bratislava: Slovak Academic Press 2003 : 553.
29. Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafo or A, Fe uer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin 2005; 55(1): 10 – 30. In: CA Cancer J Clin 2005; 55(4): 259.
30. Kerns BJ, Jordan PA, Mo ore MB, Humphrey PA, Berchuck A, Kohler MF, Bast RC Jr, Iglehart JD, Marks JR. p53 overexpression in formalin‑fixed, paraffin‑embedded tissue detected by immunohistochemistry. J Histochem Cytochem 1992; 40(7): 1047 – 1051.
31. Khalifa MA, Mannel RS, Haraway SD, Walker J, Min KW. Expression of EGFR, HER - 2/ ne u, P53, and PCNA in endometrio id, serous papillary, and cle ar cell endometrial adenocarcinomas. Gynecol Oncol 1994; 53 : 84 – 92.
32. Lax SF, Pizer ES, Ronnett BM, Kurman RJ. Cle ar cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki - 67, estrogen, and progesterone receptor expression. Hum Pathol 1998; 29 : 551 – 558.
33. Lax SF. Molecular genetic pathways in various types of endometrial carcinoma: from a phenotypical to a molecular‑based classification. Virchows Arch 2004; 444(3): 213 – 223.
34. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol 2007; 46(1): 6 – 32.
35. Lodish H, Berk A, Matsudaira P et al. Molecular cell biology. 5th Edn. New York: W. H. Freeman and company 2004.
36. Molnárová A, Kováčová E, Majtán J, Fedeleš J, Bieliková E, Cvachová S, Vojtaššák J, Repiská V. Chlamydia and mycoplasma infections during pregnancy and their relationships to orofacial cleft. Biologia 2006; 61(6): 719 – 723.
37. Mutter GL, Ferenczy A. Anatomy and histology of the uterine corpus (383–419). In: Kurman RJ (ed). Bla ustein’s Pathology of the Female Genital Tract. 5 .ed. New York: Springer - Verlag 2002 : 1391.
38. Mutter GL, Lin MC, Fitzgerald JT, Kum JB, Baak JP, Lees JA et al. Altered PTEN expression as a diagnostic marker for the e arliest endometrial precancers. J Natl Cancer Inst 2000; 92 : 924 – 930.
39. Okamoto A, Sameshima Y, Yamada Y, Teshima S, Terashima Y, Terada M, Yokota J. Allelic loss on chromosome 17p and p53 mutations in human endometrial carcinoma of the uterus. Cancer Res 1991; 51(20): 5632 – 5635.
40. Parazzini F, La Vecchia C, Negri E, Moroni S, Chatenoud L. Smoking and risk of endometrial cancer: results from an Italian case - control study. Gynecol Oncol 1995; 56 : 195 – 199.
41. Pleško I et al. Incidencia zhubných nádorov v Slovenskej republike v roku 1990. Bratislava: Aktu al klin Onkol 1994 : 115.
42. Pleško I et al. Incidencia zhubných nádorov v Slovenskej republike 2000. Bratislava: Národný onkologický ústav, Ústav experimentálnej onkológie SAV, Národný onkologický register Slovenskej republiky 2003 : 207.
43. Poradovský K. Nádory ženských pohlavných orgánov (141 – 161). In: A. Ponťuch (ed). Gynekológia a pôrodníctvo. Martin: Osveta 1984 : 404.
44. Redecha M, Korbeľ M, Sasko A. Histologické nálezy endometria pri krvácaní v klimaktériu a séniu. Prakt Gynek 1996; 3 : 61 – 64.
45. Redecha M, Nižňanská Z, Korbeľ M. Klinická charakteristika karcinómu endometria. Gynekol prax 2005; 3(4): 13 – 16.
46. Redecha M, Nižňanská Z, Korbeľ M. Výskyt zhubných nádorov tela maternice na Slovensku v rokoch 1990 – 2000. Gynekol prax 2004; 2(4): 194 – 199.
47. Repiská V, Zummerová A, Miklóši M, Breza J, Böhmer D, Vojtaššák J. Využitie metódy RT‑PCR pri detekcii cirkulujúcich mikrometastáz. Rozhledy v chirurgii 2003; 82(2): 95 – 102.
48. Robboy SJ, Anderson MC, Russell P. Pathology of the Female reproductive tract. London – Edinburg – New York – Philadelphia: Churchill Livingstone 2002 : 929.
49. Robboy SJ, Duggan MA, Kurman RJ. Gynecologic Pathology (942 – 989). In: Rubin E, Farber JL (eds). Pathology. Philadelphia: J. B. Lippincott Company 1988 : 1576.
50. Ronnett BM, Kurman RJ. Precursor Lesion of Endometrial carcinoma (467 – 500). In: Kurman RJ (ed). Bla ustein’s Pathology of the Female Genital Tract. 5 .ed. New York: Springer - Verlag 2002 : 1391.
51. Ronnett BM, Zaino RJ, Ellenson LH, Kurman RJ. Endometrial Carcinoma (501 – 559). In: Kurman RJ (ed). Bla ustein’s Pathology of the Female Genital Tract. 5 .ed. New York: Springer Verlag 2002 : 1391.
52. Sakuragi N, Hareyama H, Todo Y, Yamada H, Yamamoto R, Fujino T, Sagawa T, Fujimoto S. Prognostic significance of serous and Clar cell adenocarcinoma in surgically staged endometrial carcinoma. Acta Obstet Gynecol Scand 2000; 79(4): 311 – 316.
53. Salvesen HB, Iversen OE, Akslen LA. Identification of high - risk patients by assessment of nucle ar Ki - 67 expression in a prospective study of endometrial carcinomas. Clin Cancer Res 1998; 4 : 2779 – 2785.
54. Scully RE, Bonfiglio TA, Kurman RJ, Silverberg SG, Wilkinson EJ. Histologic Typing of Female Genital Tract Tumours (International histological classification of tumours). 2 .ed. New York: Springer - Verlag 1994 : 189.
55. Silverberg SG, Kurman RJ, Nogales F, Mutter GL, Kubik - Huch RA, Tavassoli FA. Epithelial Tumors and Related Lesions (221 – 232). In: F. A. Tavassoli, P. Devilee (Eds) WHO classification of Tumours, Pathology and Genetics, Tumours of the Bre ast and Female Genital Organs. Tumours of the Uterine Corpus. Lyon: IARC Press 2003 : 432.
56. Silverberg SG, Kurman RJ. Tumors of the Uterine Corpus and Gestational Trophoblastic Ddise ase. Atlas of Tumor Pathology. Washington, D. C: 1992. Armed Forces Institute of Pathology (AFIP), 3, Fasc. 3 : 290(232).
57. Sivridis E, Fox H, Huckley CH. Endometrial carcinoma – two or three entities? Int J Gynecol Cancer 1988 : 183 – 188.
58. So ong R, Knowles S, Williams KE, Hammond JG, Wysocki SJ, Iacopetta BJ. Overexpression of p53 protein is an independent prognostic indicator in human endometrial carcinoma. Br J Cancer 1996; 74 : 562 – 567.
59. Šišovský V. Imunohistochemická analýza endometria za fyziologických a patologických stavov. Dizertačná práca. Bratislava: Univerzita Komenského 2005 : 144.
60. Šišovský V, Danihel Ľ, Babál P, Jakubovský J, Porubský J, Palkovič M, Korbeľ M, Hatzibougias D, Hatzibougias I, Bučeková B, Kopáni M. Expresia kyseliny sialovej v endometriu za fyziologických stavov, v hyperplázii endometria a v karcinóme endometria. XIV. vedecká konferencia slovenských a českých patológov s medzinárodnou účasťou. Mojmírovce: Zborník vedeckých prác 2006c.
61. Šišovský V, Danihel Ľ, Babál P, Zaviačič M, Porubský J, Palkovič M, Redecha M, Hatzibougias D, Hatzibougias I, Bučeková B, Biró C. Imunohistochemická analýza expresie vybraných proteínov v endometriu za fyziologických stavov, v hyperplázii endometria a v karcinóme endometria. XIV. vedecká konferencia slovenských a českých patológov s medzinárodnou účasťou. Mojmírovce: Zborník vedeckých prác 2006b.
62. Šišovský V, Danihel Ľ, Jakubovský J, Bučeková B, Babál P. The identification of sialic acid in normal endometrium and in endometrial carcinoma (85). In: Tribulová N, Okruhlicová Ľ (eds). Potential therape utic targets in cardiovascular and other dise ases. Bratislava: VEDA 2006e: 88.
63. Šišovský V, Danihel Ľ, Štvrtina S, Porubský J, Zaviačič M, Redecha M, Korbeľ M, Palkovič M, Bučeková B, Gomolčák P. Angiogenéza v endometriu za fyziologických stavov, v hyperplázii endometria a v karcinóme endometria. XIV. vedecká konferencia slovenských a českých patológov s medzinárodnou účasťou. Mojmírovce: Zborník vedeckých prác 2006a.
64. Šišovský V, Palkovič M, Babál P, Jakubovský J, Porubský J, Bučeková B, Danihel Ľ. The expression of the selected proteins in endometrial carcinoma (79 – 84). In: Tribulová N, Okruhlicová Ľ eEds) Potential therape utic targets in cardiovascular and other dise ases. Bratislava: VEDA 2006d: 88.
65. Šišovský V, Palkovič M, Zeljenková D, Kobzová D, Czirfus A, Balážová K, Michalka P, Jakubovská V, Wsólová L, Jakubovský J. Pôsobenie derivátov organofosfátov na reprodukčné orgány samíc potkanov Wistar. 12. kongres Slovenskej a Českej spoločnosti patológov s medzinárodnou účasťou. Bratislava: Zborník vedeckých prác 2004 : 48.
66. Šuška P, Holomáň K. Endometrium v peri - a postmenopa uze. Bratislava: Slovak Academic Press 1997 : 186.
67. Šuška P. Nádory maternice (182 – 200). In: Šuška P (ed). Vybrané kapitoly z gynekológie. Bratislava: Univerzita Komenského 2003. 254.
68. Tabibzadeh S. Immunore activity of human endometrium: correlation with endometrial dating. Fertil Steril 1990; 54 : 624 – 631.
69. Tashiro H, Isacson C, Levine R, Kurman RJ, Cho KR, Hedrick L. p53 gene mutations are common in uterine serous carcinoma and occur e arly in their pathogenesis. Am J Pathol 1997; 150 : 177 – 185.
70. Weismanová E, Weismann P, Vizváryová M, Lehotská V, Križanová O, Repiská V, Ka ušitz J. New appro ach to human high - risk papillomavirus (HR - HPV) genotyping. Neoplasma 2002; 49(4): 217 – 224.
71. Wheeler DT, Bell KA, Kurman RJ, Sherman ME. Minimal uterine serous carcinoma: Diagnosis and clicopathologic correlation. Am J Surg Pathol 2000; 24 : 797 – 806.
72. Yu CC, Wilkinson N, Brito MJ, Buckley CH, Fox H, Levison DA. Patterns of immunohistochemical staining for proliferating cell nucle ar antigen and p53 in benign and neoplastic human endometrium. Histopathology 1993; 23(4): 367 – 371.
73. Zavadil M, Motlík K. Pohlavní ústrojí ženy (1233 – 1336). In: Bednář B (ed) Patologie III. Praha: Avicenum 1984 : 1856.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2008 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Úvodní slovo
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2008 - Edukační kazuistika
- Edukační kazuistika
- Faktory ovlivňující vaginální eumikrobii
- Chlamydie patogenní pro člověka – význam pro gynekologicko‑porodnickou a urologickou praxi
- Bakteriální vaginóza a význam acidifikace poševního prostředí
- Možnosti paliativní terapie tumoru ovaria
- Možnosti objektivizace akutního klimakterického syndromu
- Identifikácia markerov proliferačnej aktivity v karcinóme endometria
- Program postgraduálního a celoživotního vzdělávání v gynekologii a porodnictví na rok 2009
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bakteriální vaginóza a význam acidifikace poševního prostředí
- Faktory ovlivňující vaginální eumikrobii
- Identifikácia markerov proliferačnej aktivity v karcinóme endometria
- Možnosti paliativní terapie tumoru ovaria
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



