-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRecidivující respirační papilomatóza - nové rizikové faktory
New Risk Factors for Respiratory Papillomatosis
Background:
Recurrent respiratory papillomatosis is caused by human papillomavirus. However, the prevalence of respiratory papillomatosis is much lower than prevalence of human papillomavirus infection. Therefore other factors may contribute to recurrent respiratory papillomatosis. This study investigated whether patients with respiratory papillomatosis are more often infected with herpes simplex virus type 2 and chlamydia trachomatis and whether they more often have laryngopharyngeal reflux.Methods:
The prospective case-control study included 27 patients with recurrent respiratory papillomatosis and 27 patients with no pathology of laryngeal mucosa (control group). Immunohistochemical analysis of pepsin, human papillomavirus, herpes simplex virus type 2, and chlamydia trachomatis was performed in biopsy specimens of laryngeal papillomas and of healthy laryngeal mucosa (control group) obtained during microlaryngoscopy procedures.Results:
Pathologic laryngopharyngeal reflux (pepsin in tissue) was diagnosed in 13/27 (48.1%) patients with papillomatosis and in 0/27 control patients (P < 0.001). Herpes simplex virus type 2 was present in 12/27 (44.4%) patients with papillomatosis and in 1/27 (3.7%) control patients (P = 0.001). Seven specimens were positive for both pepsin and herpes simplex virus type 2. No samples were positive for chlamydia trachomatis. The groups were homogenous.Conclusions:
Laryngopharyngeal reflux and herpes simplex virus type 2 infection could be possible risk factors for recurrent respiratory papillomatosis.Keywords:
recurrent respiratory papillomatosis, human papillomavirus, laryngopharyngeal reflux, herpes simplex virus type 2
Autoři: M. Formánek 1,2; Karol Zeleník 1,2
; R. Tomanová 3; Pavel Komínek 1,2
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku FN Ostrava přednosta prof. MUDr. P. Komínek, Ph. D., MBA 1; Katedra kraniofaciálních oborů, Lékařská fakulta, Ostravská Univerzita vedoucí katedry prof. MUDr. P. Komínek, Ph. D., MBA 2; Ústav patologie FN Ostrava přednostka doc. MUDr. J. Dvořáčková, Ph. D. 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 66, 2017, No. 1, pp. 23-27.
Kategorie: Původní práce
Souhrn
Úvod:
Recidivující respirační papilomatóza (RRP) je chronické virové onemocnění způsobené lidskými papilomaviry (HPV). Prevalence RRP je ale ve srovnání s asymptomatickým nosičstvím HPV v dýchacích cestách velmi nízká. Lze předpokládat, že k aktivaci latentní HPV infekce je nutné působení dalších zatím ne zcela přesně definovaných faktorů. Tyto faktory přispívající k aktivaci infekce mohou být také považovány za rizikové faktory vzniku RRP. Cílem předkládané studie bylo ověřit, zda rizikovými faktory RRP mohou být extraezofageální reflux (EER), herpes simplex virus typ 2 (HSV-2) a chlamydia trachomatis (ChTr).Metody:
Do studie byli zařazeni pacienti s RPP. Kontrolní skupina byla tvořena pacienty s cystou hlasivky bez další patologie v oblasti hrtanu. U obou skupin byly v průběhu direktní mikrolaryngoskopie odebrány bioptické vzorky, u pacientů s RRP papilomy z hlasivek, u kontrolní skupiny sliznice hlasivky z části cysty. Vzorky byly následně hodnoceny imunohistochemicky - přítomnost EER byla stanovena nepřímo pomocí průkazu pepsinu, přítomnost HSV-2, ChTr a HPV přímým průkazem.Výsledky:
Patologický EER byl prokázán pozitivitou pepsinu v biopsii u 13/27 (48,1 %) pacientů s RRP a u žádného pacienta v kontrolní skupině (p < 0,001). Infekce HSV-2 byla přítomna u 12/27 pacientů (44,4 %) s RRP a u 1/27 pacientů (3,7 %) v kontrolní skupině (p = 0,001). Sedm pacientů bylo zároveň pozitivních na EER i HSV-2. ChTr nebyla prokázána u žádného pacienta v obou skupinách. Mimo zastoupení pohlaví byly skupiny homogenní.Závěry:
Je možné považovat EER a koinfekci HSV-2 za další možné rizikové faktory RRP. Uvedené faktory se mohou podílet na aktivaci latentní HPV infekce a způsobit tak počátek onemocnění.Klíčová slova:
recidivující respirační papilomatóza, lidský papilomavirus, extraezofageální reflux, herpes simplex virus 2. typuÚVOD
RRP je chronické virové onemocnění charakterizované vznikem exofyticky rostoucích dlaždicobuněčných papilomů na sliznicích dýchacích a polykacích cest, které postihuje dospělé i děti (obr. 1). Nejčastější lokalizací onemocnění je oblast hrtanu, kde je u dětí nejčastějším benigním nádorovým onemocněním (4).
Obr. 1. Videostroboskopie u 3letého dítěte. 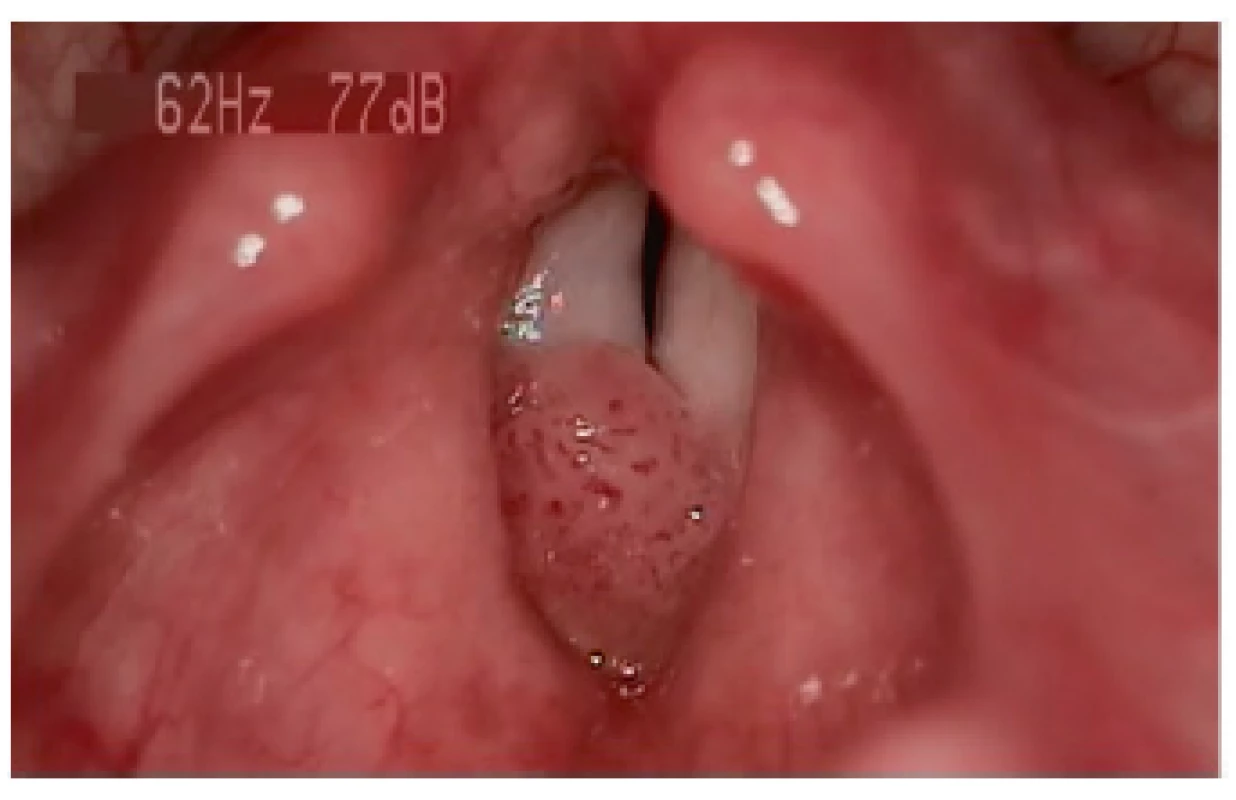
V současnosti je již všeobecně uznávané a mnohokrát potvrzené, že RRP je způsobena HPV. Například dánskou studií byly již v roce 1990 prokázány HPV 6 a 11 pomocí in situ hybridizace u 95 % papilomů v hrtanu (6).
Asymptomatické nosičství HPV je nicméně mnohem vyšší než prevalence samotných patologií (5, 9, 10, 16). HPV infekce probíhá tedy ve většině případů jako latentní. V samotných polykacích a dýchacích cestách je latentní HPV infekce velmi častá a v potenciálním riziku je proto velká část populace. Například v rozsáhlé severoamerické studii Gillisonové a spol., ve které bylo zahrnuto 5579 participantů ve věku 14 - 69 let, byla zjištěna prevalence asymptomatického nosičství HPV v ústní dutině u 6,9 % z nich. Častěji byly postižení muži, sexuálně aktivnější účastníci a kuřáci (2). Dále také Szydlowski a spol. referovali, že HPV bylo přítomno v respiračním traktu u 19,6 % dětí v předškolním věku (16). Rintala a spol. zjistili při testování 3letých zdravých dětí, že HPV mělo v dýchacích cestách 10 % z nich (10).
Pouze u menšiny pacientů s HPV tedy dojde ke vzniku RRP. Lze proto předpokládat, že do patogeneze RRP musí být zapojeny také další faktory, které latentní HPV infekci určitým způsobem aktivují. Tyto faktory přispívající k aktivaci infekce mohou být považovány za rizikové faktory vzniku RRP.
Mezi faktory aktivující latentní HPV infekci řadí Bednář a spol. hlavně pokles imunity, hormonální vlivy a UV záření (1). V případě RRP nelze očekávat působení UV záření, které se z logiky věci uplatňuje převážně v případě kožních lézí. Také další autoři označují jako rizikové faktory RRP imunodeficienci a působení cigaretového kouře (2). Tyto faktory nicméně zdaleka nevysvětlují počátek onemocnění u všech pacientů s RRP. Navíc ani přítomnost aktivního HPV výrazně nestimuluje imunitní odpověď. Proto může být považován také efekt imunodeficience za sporný.
Neustále proto pokračuje snaha o nalezení dalších rizikových faktorů, které by byly zodpovědné za aktivaci latentní HPV infekce. Cílem předkládané studie bylo ověřit, zda rizikovými faktory RRP mohou být extraezofageální reflux (EER), herpes simplex virus typ 2 (HSV-2) a chlamydia trachomatis (ChTr).
METODIKA
Studie probíhala na Klinice otorinolaryngologie a chirurgie hlavy a krku FN Ostrava v období od dubna 2014 do dubna 2016 a byla schválena Etickou komisí FN Ostrava. Podmínkou zařazení pacienta do studie byl podpis informovaného souhlasu.
Do studie onemocnění a kontrol (case-control study) byli zařazeni pacienti s RRP ve věku od 4 do 84 let indikováni k mikrolaryngoskopii pro recidivu papilomů. Diagnóza „recidivující“ papilomatózy byla stanovena v případě, že u pacientů byly v minulosti minimálně 2 mikrolaryngoskopie s odstraněním a histologickým průkazem dlaždicobuněčných papilomů. Do kontrolní skupiny byly zařazeni pacienti s cystou hlasivky podstupující mikrolaryngoskopické odstranění cysty. U obou skupin byly v průběhu mikrolaryngoskopie odebrány bioptické vzorky, u pacientů s RRP papilomy, u kontrolní skupiny sliznice hlasivky (epitel) z mediální části cysty.
Ze studie byli vyloučeni pacienti, kteří byli kontraindikováni k celkové anestezii, pacienti s RRP, kteří podstupovali operační výkon poprvé a pacienti, kteří nesouhlasili se zařazením do studie.
Průkaz
V průběhu mikrolaryngoskopie byly odebrány bioptické vzorky z papilomů, nebo v případě pacientů v kontrolní skupině ze zdravé sliznice mediálně od odstraněné cysty hlasivky. Vzorky byly odeslány na Ústav patologie FN Ostrava a zde hodnoceny imunohistochemicky vždy tím samým patologem. Přítomnost EER byla stanovena nepřímo pomocí průkazu pepsinu ve vzorku, přítomnost HSV-2, ChTr a HPV přímým průkazem. Jako primární protilátka proti pepsinu byla použita protilátka NB100-66518 (Novus Biologicals). Jako primární protilátka k detekci HSV-2 byla použita protilátka 362A-15 (Cell Marque). K průkazu HPV byla použita protilátka Clone K1H8 (Code M3528, DAKO). Jako primární protilátka proti ChTr byla použita protilátka ILM16710C05 (Immunologic).
Statistické zpracování
Data pacientů byla zaznamenána a srovnána mezi skupinami. Mezi sledované ukazatele patřil věk, body mass index (BMI), vystavení tabákovému kouři (aktivní i pasivní), známá imunodeficience, refluxní nemoc jícnu v anamnéze a diabetes mellitus. Dále byla mezi skupinami srovnána zkoumaná data - přítomnost pepsinu, HSV-2, ChTr a HPV v biopsii.
Ke statistickému zpracování dat byl použit software Stata v.13 (Stata Corp., College Station, TX, USA). Pro hodnocení byl použit Pearsonův chí-kvadrát test a Fisherův exaktní test. Statistické testy byly hodnoceny na hladině 5% významnosti.
VÝSLEDKY
Do studie bylo zařazeno 27 pacientů s RRP a 27 pacientů v kontrolní skupině ve věku 4 až 84 let. Ve skupině RRP byli častěji zastoupeni muži (p = 0,014). Průměrný věk pacientů s RRP byl 39,8 let, průměrný věk pacientů v kontrolní skupině byl 43,2 let, nebyl zjištěn významný rozdíl mezi skupinami (p = 0,493). Věkové rozmezí jednotlivých pacientů bylo v každé skupině výrazné - směrodatná odchylka 20,04; respektive 15,98 v kontrolní skupině (obr. 2).
Obr. 2. Věkové rozložení pacientů s RRP (skupina 1) a pacientů v kontrolní skupině (skupina 2). 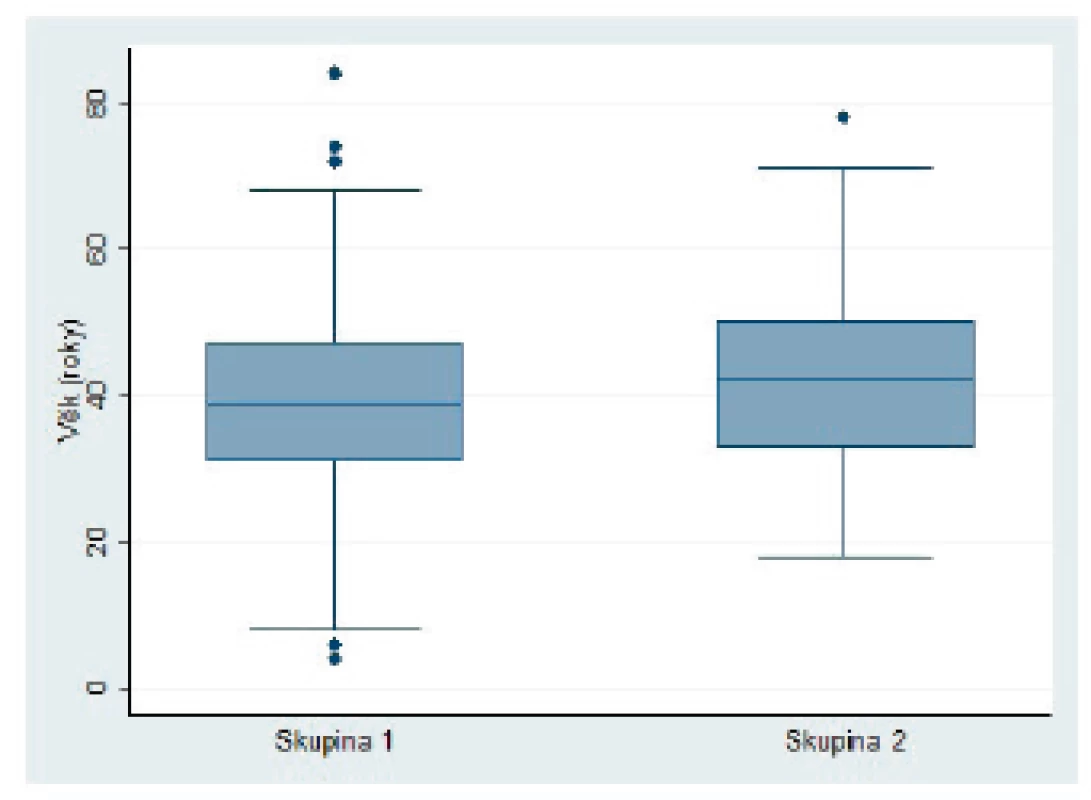
V žádném dalším sledovaném faktoru nebyl zjištěn rozdíl mezi skupinami. Nebyl zjištěn rozdíl v BMI, pozitivitě HIV, imunodeficienci, diabetu mellitu, astma bronchiale, chronické obstrukční plicní nemoci, alergii, refluxní nemoci jícnu ani v aktivním nebo pasivním vystavení pacientů cigaretovému kouři (tab. 1).
Tab. 1. Charakteristika skupin pacientů. 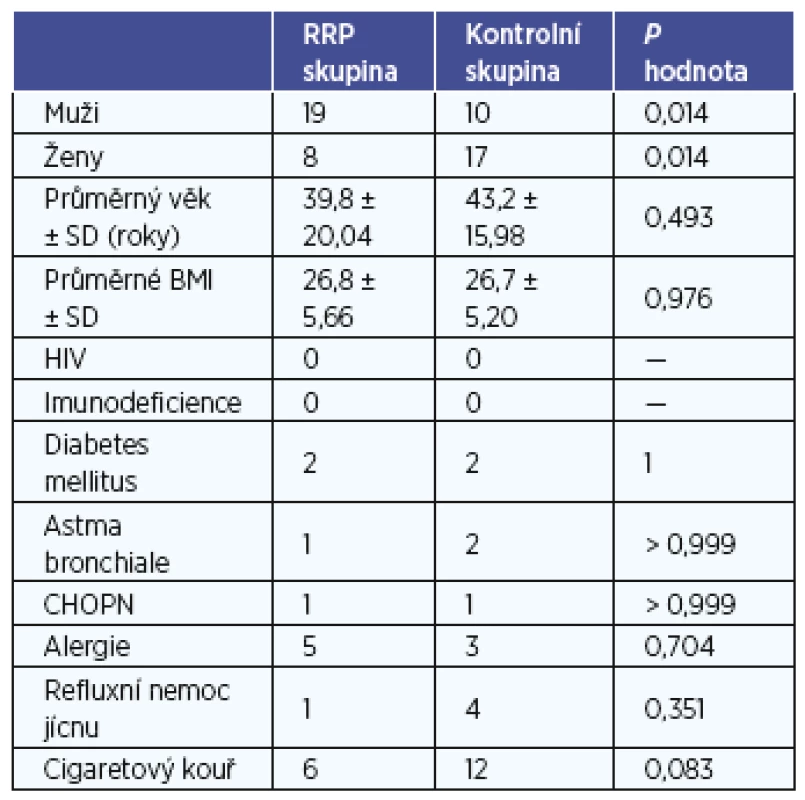
Patologický EER byl prokázán pozitivitou pepsinu v biopsii u 13/27 (48,1 %) pacientů s RRP a u žádného pacienta v kontrolní skupině (p < 0,001). Infekce HSV-2 byla přítomna u 12/27 pacientů (44,4 %) s RRP a u 1/27 pacienta (3,7 %) v kontrolní skupině (p = 0,001). Sedm pacientů s RRP bylo zároveň pozitivních na EER i HSV-2, devět pacientů s RRP nebylo pozitivních na EER ani na HSV-2. ChTr nebyla prokázána u žádného pacienta s RRP ani u žádného pacienta v kontrolní skupině. HPV byl prokázán u všech pacientů s RRP a u 3/27 pacientů (11,1 %) v kontrolní skupině. Dva pacienti v kontrolní skupině s prokázanou přítomností HPV byli kuřáci.
DISKUSE
RRP je chronické virové onemocnění způsobené HPV. Prevalence HPV infekce v dýchacích a polykacích cestách je mnohem vyšší než prevalence samotné RRP. Toto bylo potvrzeno také výsledky naší studie, kdy HPV infekce byla imunohistochemicky prokázána v papilomech u všech pacientů s RRP a ve zdravé sliznici u 11,1 % pacientů v kontrolní skupině.
Musí tedy existovat rizikové faktory, které latentní HPV infekci aktivují. Mezi známé faktory patří imunodeficience a vystavení organismu cigaretovému kouři. Přestože ve zkoumané skupině byly zastoupeny i 4 děti, soubory pacientů byly s výjimkou zastoupení pohlaví statisticky homogenní. U pacientů s RRP nebyla častěji přítomna imunodeficience, ani nebyli častěji vystaveni cigaretovému kouři. Naopak dva pacienti v kontrolní skupině (tedy bez projevů RRP), u kterých byla prokázána pozitivita HPV, byli kuřáci. Aktivace HPV infekce u pacientů s RRP tedy nemůže být vysvětlena pouze těmito faktory. Cílem studie bylo identifikovat další potenciální rizikové faktory RRP. Byly zvoleny EER a koinfekce HSV-2 a ChTr.
Extraezofageální reflux
Hypotéza, že EER by se mohl podílet také na vzniku RRP, vznikla na podkladě výsledků několika starších ne ideálně nastavených studií Hollandeho a McKenny (3, 7). Hlavním nedostatkem uvedených studií je ale fakt, že EER nebyl ve skutečnosti u žádného pacienta s RRP verifikován, nebyly použity uznávané diagnostické metody. Jednalo se pouze o domněnky vyvozené z anamnézy, která mohla pouze svědčit pro EER. V obou případech rovněž nebyla přítomna kontrolní skupina pacientů.
Diagnostika EER a určení podílu EER na nemocech dýchacího traktu u konkrétních pacientů není jednoduché. Průkaz EER v případě RRP je ještě náročnější. Dotazníky zaměřené na odhalení přítomnosti EER (např. Reflux symptom index) jsou převážně cíleny na „hrtanové příznaky“ EER. Tyto příznaky se ale velmi překrývají s příznaky samotné RRP - např. chrapot, nucení na odkašlávání a pocit cizího tělesa v krku mohou být přítomné jak u samotného patologického EER, tak u všech pacientů s RRP. V případě RRP tak dotazníky poskytují velké množství falešně pozitivních výsledků. Také hodnocení známek přítomnosti patologického EER podle endoskopického nálezu na sliznicích hrtanu je přítomností vícečetných papilomů v hrtanu velmi ztíženo, ne-li zcela znemožněno.
Možnými diagnostickými metodami EER u pacientů s RRP tedy zůstává jícnová nebo orofaryngeální pH-metrie, jícnová impedance a průkaz pepsinu přímo v buňkách papilomů. Průkaz pepsinu v tkáních je ve srovnání s ostatními metodami mnohem přesnější, poskytuje informaci o skutečném dlouhodobém efektu EER na tkáně, a tedy o tom, zda je působení refluxu na sliznici relevantní. Imunohistochemické vyšetření pepsinu v papilomech je možné po jejich bioptickém odběru. Pacienti s RRP obvykle podstupují vícečetné chirurgické výkony a biopsie proto není ve většině případů žádný problém. Proto je možné považovat průkaz pepsinu v papilomech za metodu volby v diagnostice EER. Z toho důvodu byla tato nejpřesnější metoda zvolena k diagnostice EER v předkládané studii.
Významný EER byl prokázán u 13/27 (48,1 %) pacientů s RRP a u žádného pacienta v kontrolní skupině (p < 0,001). Hypotéza o vztahu EER a RRP byla takto potvrzena. EER by tedy skutečně mohl být dalším rizikovým faktorem RRP.
Významný EER byl prokázán u 13/27 (48,1 %) pacientů s RRP a u žádného pacienta v kontrolní skupině (p < 0,001), přestože 4 pacienti v kontrolní skupině měli v minulosti prokázán gastroezofageální reflux (nikoliv EER) jícnovou pH metrií. U těchto čtyř pacientů se tedy dostával refluxát nad úroveň dolního jícnového svěrače, nikoliv však nad úroveň horního jícnového svěrače. Nemohl tedy ovlivňovat sliznice hrtanu. Tento fakt je důkazem toho jak důležité je striktně rozlišovat pojmy gastoezofageální reflux a extraezofageální reflux a jak důležité je správně zvolit vhodnou diagnostickou metodu refluxu, abychom byli schopni říci, zda může reflux v dané lokalitě ovlivňovat sliznice a zda je tedy skutečně relevantní.
Hypotéza vztahu EER a RRP byla potvrzena. EER by tedy skutečně mohl být dalším rizikovým faktorem RRP. Zůstává otázkou, jakým mechanismem může EER aktivovat latentní HPV infekci. Lze předpokládat, že by se mohly uplatňovat podobné mechanismy, jaké se uplatňují při vzniku jiných onemocnění, u kterých se předpokládá negativní vliv EER. Nejvýznamnější jsou chronické dráždění a oxidativní stres, které mimo jiné způsobují zvýšenou proliferaci buněk v rámci snahy organismu o reparaci (19).
V případě EER je vždy těžké vybrat správnou skupinu pacientů, u nichž benefit léčby převáží možné nežádoucí účinky. Základem správně indikované terapie je určit pacienty, u kterých je EER relevantní a může se skutečně podílet na vzniku dané patologie. Také z tohoto důvodů je diagnostika stanovením pepsinu v tkáních výhodnější v porovnání s jinými metodami. Lze totiž lépe určit pacienty s EER dlouhodobě působícím na tkáně, a tedy pacienty vhodné k antirefluxní terapii.
Herpes simplex virus typ 2
Zkušenosti z rozsáhlých výzkumů karcinomu děložního čípku, který je obdobně jako RRP také způsoben HPV, opakovaně ukazují, že HSV-2 může zvyšovat riziko vzniku invazivního karcinomu při současné HPV infekci (15, 20).
Bylo zjištěno, že musí dojít k přímému kontaktu virů s povrchem sliznice nebo s narušenou kůží, aby mohlo dojít k iniciaci přenosu infekce HSV-2 (18). Infekce se šíří kapénkami nebo úzkým osobním kontaktem. Primární množení viru se děje na sliznicích očí, ústní dutiny, nosní dutiny, genitálu nebo na kůži (1).
Vzhledem k tomu, že infekce HSV-2 a HPV jsou sexuálně přenosné, není vyloučen společný přenos a společné působení také v hrtanu. Spolupůsobení HSV-2 a HPV v hrtanu nebylo zatím zkoumáno. Předkládaná práce si proto dala za cíl ověřit tuto hypotézu a zjistit, zda by takto mohl být HSV-2 rizikovým faktorem aktivace latentní HPV infekce, a tím také RRP.
HSV-2 byl prokázán u 12/27 pacientů (44,4 %) s RRP a u 1 pacienta (3,7 %) v kontrolní skupině (p = 0,001). Hypotéza o možném vztahu HSV-2 a RRP byla tímto potvrzena. HSV-2 může tedy být dalším potenciálním rizikovým faktorem RRP. Jedná se o první důkaz tohoto možného vztahu. Výrazný rozdíl mezi oběma skupinami je poměrně překvapivý. Nicméně nízká prevalence asymptomatického nosičství HSV-2 odpovídá jeho dosud referované, téměř nulové, asymptomatické prevalenci v ústní dutině (8).
Není zatím jasné, jak k pacientům s prokázanou HSV-2 koinfekcí přistupovat. Teoreticky by v těchto případech mohla být nasazována dříve antivirotická terapie, která je již dnes součástí adjuvantní léčby těžších forem RRP. Účinek by tak mohl být výraznější. Další variantou by mohlo být přidání cílené antivirotické terapie proti herpetickým virům. Vhodný terapeutický postup by měl být jistě ověřen dalšími studiemi.
Chlamydia trachomatis
Dalším faktorem, u kterého může být zvažován jeho vliv na HPV infekci, je ChTr. Nejvíc dat opět pochází ze studií zabývajících se reprodukčním systémem. Výsledky jsou zatím nejednoznačné. Nicméně bylo pozorováno, že ChTr může usnadnit vznik nákazy HPV a také snížit efektivitu odstranění HPV z organismu (11, 14, 17).
Vzhledem k tomu, že infekce ChTr je stejně jako HSV-2 sexuálně přenosná, bylo možné teoreticky předpokládat, že ChTr by mohla ovlivňovat HPV také v oblasti hrtanu. Tento vztah nebyl zatím v žádné studii zkoumán.
Výsledky předkládané studie možný vztah nepotvrdily. Nebyla sledována pozitivita ChTr u žádného pacienta s RRP ani u žádného pacienta v kontrolní skupině. Na základě tohoto výsledku není možné podpořit teorii o možném vztahu ChTr a RRP. Nic nenasvědčuje tomu, že by měla být jejím rizikovým faktorem.
ZÁVĚR
Je možné považovat EER a koinfekci HSV-2 za další rizikové faktory RRP. Uvedené faktory se mohou podílet na aktivaci latentní HPV infekce a způsobit tak počátek onemocnění. V případě EER i HSV-2 se jedná o první skutečné potvrzení, respektive první důkaz jejich možného vztahu k RRP.
Práce byla podpořena MZ ČR - RVO - FNOs/2014.
Adresa ke korespondenci:
MUDr. Martin Formánek
Klinika ORL a chirurgie hlavy a krku
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava - Poruba
e-mail: martin.formanek@fno.cz
Zdroje
1. Bednář, M., Fraňková, V., Schindler, J. et al.: Lékařská mikrobiologie. První vydání. Praha, Triton. 1996. ISBN-10 : 80-2380-297-6.
2. Gillison, M. L., Broutian, T., Pickard, R. K. et al.: Prevalence of oral HPV infection in the United States, 2009-2010. JAMA, 307, 2012, 7, s. 693-700.
3. Holland, B. W., Koufman, J. A., Postma, G. N. et al.: Laryngopharyngeal reflux and laryngeal web formation in patients with pediatric recurrent respiratory papillomas. Laryngoscope, 112, 2002, 11, s. 1926-1929.
4. Hugo, J., Vokurka, M.: Velký lékařský slovník. 9. vydání. Praha, Maxdorf. 2010. ISBN 978-80-7345-202-5.
5. Lang Kuhs, K. A., Gonzalez, P., Struijk, L. et al.: Prevalence of and risk factors for oral human papillomavirus among young women in Costa Rica. J. Infect. Dis., 208, 2013, 10, s. 1643-1652.
6. Lindeberg, H., Johansen, L.: The presence of human papillomavirus (HPV) in solitary adult laryngeal papillomas demonstrated by in-situ DNA hybridization with sulphonated probes. Clin. Otolaryngol. Allied. Sci., 15, 1990, 4, s. 367-371.
7. McKenna, M., Brodsky, L.: Extraesophageal acid reflux and recurrent respiratory papilloma in children. Int. J. Pediatr. Otorhinolaryngol., 69, 2005, 5, s. 597-605.
8. Miller, C. S., Danaher, R. J.: Asymptomatic shedding of herpes simplex virus (HSV) in the oral cavity. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod, 105, 2008, 1, s. 43-50.
9. Rautava, J., Willberg, J., Louvanto, K. et. al.: Prevalence, genotype distribution and persistence of human papillomavirus in oral mucosa of women: A six-year follow-up study. PLoS One, 7, 2012, 8, e42171.
10. Rintala, M. A., Grénman, S. E., Järvenkylä, M. E. et al.: High-Risk types of human papillomavirus (HPV) DNA in oral and genital mucosa of infants during their first 3 xears of life: Experience from the finnish HPV family study. Clin. Infect. Dis., 41, 2005, 12, s. 1728-1733.
11. Safaeian, M., Quint, K., Schiffman, M. et al.: Chlamydia trachomatis and risk of prevalent and incident cervical premalignancy in a population-based cohort. J. Natl. Cancer Inst., 102, 2010, 23, s. 1794-1804.
12. Samoff, E., Koumans, E. H., Markowitz, L. E. et al.: Association of Chlamydia trachomatis with persistence of high-risk types of human papillomavirus in a cohort of female adolescents. Am. J. Epidemiol., 162, 2005, 7, s. 668-765.
13. Shew, M. L., Fortenberry, J. D., Tu, W. et al.: Association of condom use, sexual behaviors, and sexually transmitted infections with the duration of genital human papillomavirus infection among adolescent women. Arch. Pediatr. Adolesc. Med, 160, 2006, 2, s. 151-156.
14. Silins, I., Ryd, W., Strand, A. et al.: Chlamydia trachomatis infection and persistence of human papillomavirus. Int. J. Cancer, 116, 2005, 1, s. 110-115.
15. Smith, J. S., Herrero, R., Bosetti, C. et al.: Herpes simplex virus-2 as a human papillomavirus cofactor in the etiology of invasive cervical cancer. J. Natl. Cancer Inst., 94, 2002, 21, s. 1604-1613.
16. Szydłowski, J., Jonczyk-Potoczna, K., Pucher, B. et al.: Prevalence of human papillomavirus (HPV) in upper respiratory tract mucosa in a group of pre-school children. Ann. Agric. Environ. Med., 21, 2014, 4, s. 822-824.
17. Vriend, H. J., Bogaards, J. A., van Bergen, J. E. A. M. et al.: Incidence and persistence of carcinogenic genital human papillomavirus infections in young women with or without Chlamydia trachomatis co-infection. Cancer Medicine, 4, 2015, 10, s. 1589-1598.
18. Whitley, R. J., Roizman, B.: Herpes simplex virus infections. Lancet, 357, 2001, 9267, s. 1513-1518.
19. Zeleník, K., Čáp, P., Chlumský, J. et al.: Mimojícnové projevy refluxní choroby. První vydání. Havlíčkův Brod: Tobiáš. 2013. ISBN 978-80-7311-138-0.
20. Zhao, Y., Cao, X., Zheng, Y. et al.: Relationship between cervical disease and infection with human papillomavirus types 16 and 18, and herpes simplex virus 1 and 2. J. Med. Virol, 84, 2012, 12, s. 1920-19277.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek IFHNOS World Tour 2016Článek XXII. beskydský ORL denČlánek 3. ORL akademieČlánek Zasedání ORL sekce UEMS
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2017 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Inosin pranobex v léčbě chřipky a dalších respiračních infekcí virové etiologie
-
Všechny články tohoto čísla
- Středoušní rekonstrukce u dětí
- Mikrobiálna kolonizácia horných dýchacích orgánov a imunita u detí s adenoidnými vegetáciami
- Recidivující respirační papilomatóza - nové rizikové faktory
- Overenie vplyvu hyperbarickej oxygenoterapie v liečbe náhlej sezorineurálnej straty sluchu
- Radiografie paranazálních dutin: význam v diagnostice akutní rinosinusitidy a současné možné indikace
- Histologická a histochemická analýza retrakční kapsy pars tensa ušního bubínku u dětí
- Chirurgické komplikácie kochleárnej implantácie na Klinike ORL chirurgie hlavy a krku v skupine prvých 100 implantovaných pacientov
- K osmdesátinám prof. MUDr. Eduarda Zvěřiny, DrSc. FCMA
- Kutvirtova cena 2016 – podmínky soutěže
- IFHNOS World Tour 2016
- 29. mezinárodní kurz endoskopické endonazální chirurgie
- XXII. beskydský ORL den
- Kurz IPVZ – sonografie v otorinolaryngologii
- 3. ORL akademie
- Zasedání ORL sekce UEMS
- Stáž na ORL klinice v Innsbrucku
- Otorinolaryngológia na strednom Slovensku - včera a dnes
- Hluboké krční záněty jako komplikace zánětu hltanu (retrospektivní studie)
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Radiografie paranazálních dutin: význam v diagnostice akutní rinosinusitidy a současné možné indikace
- Hluboké krční záněty jako komplikace zánětu hltanu (retrospektivní studie)
- Histologická a histochemická analýza retrakční kapsy pars tensa ušního bubínku u dětí
- Overenie vplyvu hyperbarickej oxygenoterapie v liečbe náhlej sezorineurálnej straty sluchu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



