-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam PET pro diagnostiku perzistence krčních metastáz po léčbě v rámci záchovného protokolu u pokročilých karcinomů hlavy a krku
Importance of PET for Diagnostics of Persistence of Neck Metastases after Therapy Under the Salvage Protocol in Advanced Head and Neck Carcinomas
In organ preservation protocols the management of neck dissection is still unclear. There is no suitable tool for exclusion of neck metastases persistence. On our group of patients we have assessed the value of PET and CT diagnostics. Our PET results showed high specificity and high positive predictive value. Relatively low negative predictive value did not confirm the possibility for PET being a tool for indication of neck dissection.
Key words:
PET, organ preservation protocol, head and neck cancer, lymphadenopathy, neck metastasis.
Autoři: Z. Horáková
; E. Tóthová
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN, Brno přednosta prof. MUDr. R. Kostřica, CSc.
Vyšlo v časopise: Otorinolaryngol Foniatr, 57, 2008, No. 4, pp. 213-217.
Kategorie: Původní práce
Souhrn
V rámci záchovných protokolů v léčbě lokálně pokročilých karcinomů hlavy a krku zůstává otevřená otázka indikace blokové krční disekce. Neexistuje spolehlivá diagnostika k vyloučení postterapeutické perzistence uzlinových metastáz. Na našem souboru jsme hodnotili přínos PET a CT. Získané výsledky pro PET měly vysokou specificitu a vysokou pozitivní prediktivní hodnotu, naopak relativně nízkou negativní prediktivní hodnotu. Negativní výsledek PET, který spolehlivě nevyloučil perzistenci uzlinových metastáz, neumožnil eliminovat plánovanou blokovou krční disekci.
Klíčová slova:
PET, záchovný protokol, karcinomy hlavy a krku, lymfadenopatie, uzlinové metastázy.ÚVOD
S výjimkou vzdálených metastáz představují lokoregionální metastázy do krčních uzlin u malignit hlavy a krku nejvýznamnější negativní prognostický faktor podstatně zhoršující parametry přežití. Jedna stejnostranná postižená lymfatická uzlina (LU) snižuje přežití o 50 %, kontralaterální nebo bilaterální LU o dalších 25 %. Současným trendem v léčbě pokročilých stadií nádorů hlavy a krku je snaha o minimalizaci morbidity při maximální lokoregionální kontrole. Těmto podmínkám vyhovují tzv. záchovné, neboli orgán šetřící protokoly. Jedná se o konzervativní nechirurgickou onkologickou léčebnou strategii, nejčastěji chemoradioterapii (CHRT), nebo v krajním případě pouze radioterapii (RT), směřovanou na oblast primárního tumoru a svodného lymfatického systému. Při úspěchu léčby se pacient vyhne rozsáhlému chirurgickému zákroku. Nedosáhneme-li touto cestou kompletní remise, přistupujeme k resekci primárního tumoru, a to v jeho původních hranicích, se všemi negativními mutilujícími důsledky (2, 15). Po dosažení kompletní remise primárního tumoru zůstává stále otázkou management lymfatických uzlin. V minulosti se k léčbě LU přistupovalo s větší radikalitou. Bloková krční disekce (BKD) byla tradičně doporučována u všech před léčbou pozitivních (N+) uzlin bez ohledu na terapeutickou odpověď. Tato strategie byla akceptována už od 70. let minulého století. V poslední době je zaznamenán odklon od těchto radikálních postupů. Vzhledem k pokrokům v RT a CHRT dosahuje kompletní remise primárního tumoru i krčních metastáz stále vyšší procento pacientů. Většina po léčbě klinicky negativních LU má v blokovém resekátu korelující negativní histologický nález, také ve skupině pacientů bez BKD klesá procento krčních recidiv. Tyto výsledky by naznačovaly možnost eliminace BKD u vybraných skupin pacientů bez ovlivnění léčebných výsledků; neexistuje však doposud spolehlivé vodítko k jejich selekci. Podmínkou je diagnostická metoda dostatečně senzitivní a specifická k detekci reziduálních metastáz v postradiačně změněném terénu.
METODIKA
Soubor pacientů
Do našeho souboru jsme zařadili 17 pacientů léčených na klinice ORL a chirurgie hlavy a krku ve FN u sv. Anny v Brně. U všech byl diagnostikován dříve neléčený karcinom hlavy a krku v lokálně pokročilém stadiu. Pokročilá, stále však operabilní stadia nádorů, jsou plnou indikací k zařazení do záchovného protokolu. Histologicky byl ve všech případech potvrzen spinocelulární karcinom. Podle lokalizace byly zastoupeny nádory hypofaryngu - 10, orofaryngu - 4, laryngu - 2, epifaryngu - 1. Vždy byly metastaticky postiženy krční uzliny bez nálezu vzdálených metastáz. Dle TNM můžeme sledovaný soubor rozdělit : T2 - 7, T3 - 3, T4 - 7; N1 - 2, N2a - 1, N2b - 7, N2c -7; vždy M0. Věk pacientů v době stanovení diagnózy byl 59 let v průměru (min. 43, max. 74), podle pohlaví byly zastoupeny 2 ženy a 15 mužů.
Většina pacientů byla léčena konkomitantní chemoradioterapií. Tato léčba sestávala ze zevní radioterapie v kurativní dávce 60-70 Gy aplikované na oblasti primárního tumoru a svodného lymfatického systému ve standardní frakcionaci. Konkomitantně s radioterapií byla podána chemoterapie u 12 pacientů - Taxol (2), cDDP (9) nebo Erbitux (1). Pět pacientů nebylo schopných, vzhledem k interkurencím, chemoterapii podstoupit; byla aplikována pouze radioterapie. Po ukončení terapie byl v odstupu 3-4 týdnů hodnocen efekt léčby klinickým vyšetřením a dle CT. Kompletní remise byla konstatována u 14 pacientů, u nichž byla také ověřena histologicky, z probatorní excize. U 3 pacientů nebylo léčbou kompletní remise primárního tumoru dosaženo. V těchto případech bylo indikováno chirurgické řešení. U dvou z nich byla provedena resekce primárního tumoru v původních hranicích a současně blokové krční disekce. Jeden pacient nebyl z interního hlediska doporučené operace schopen. Celý soubor byl před léčbu diagnostikován N+ , a proto byla u všech indikována BKD, která následovala v odstupu 4-25 týdnů od ukončené radioterapie; u 9 pacientů oboustranně, u 6 ipsilaterálně a kontralaterálně byly krční uzliny pouze revidovány a histologicky vyšetřeny izolované uzliny. Jeden pacient operace nebyl schopen. U 16 pacientů bylo tedy provedeno celkem 32 krčních disekcí. Dle klasifikace typů blokové krční disekce bylo 5 komprehenzivních radikálních, 7 komprehenzivních subradikálních typ I-III, 12 selektivních posterolaterálních disekcí a 8 operačních revizí parafaryngeálních prostorů (tab. 1).
Tab. 1. Typy provedených krčních disekcí 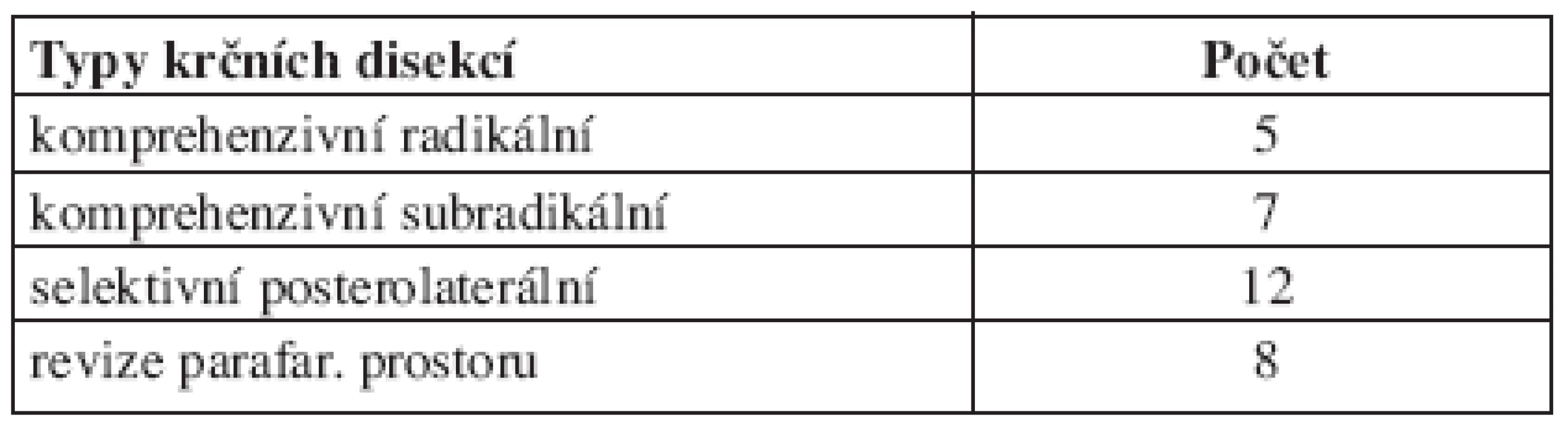
Doba sledování od ukončené terapie byla 12-250 týdnů, v průměru 110 týdnů. V tomto intervalu došlo k recidivě u 6 pacientů, u 3 z nich v oblasti primárního nádoru, u 3 formou vzdálených metastáz, žádná recidiva nebyla zaznamenána v oblasti krčních uzlin. U 8 pacientů došlo k úmrtí, u 6 z nich v souvislosti s nádorovým onemocněním.
DIAGNOSTIKA
Předléčebný staging nádoru (cTNM) byl stanoven pomocí endoskopie, CT, sonografie krku, sonografie břicha, rtg plic. Ke zhodnocení efektu (chemo)radioterapie, tj. ke stanovení yTNM, jsme přistoupili po odeznění bezprostřední postradiační reakce v odstupu cca 4 týdnů od ukončené RT. Provedli jsme endoskopii s probatorní excizí z místa primárního tumoru k histologické verifikaci perzistence, resp. remise nádoru; dále bylo doplněno CT, sono krku a PET. Sono krku a CT s k.l. jsou již standardní, zavedené diagnostické modality. Novinkou v našem diagnostickém algoritmu bylo PET, které těsně předcházelo operaci.
PET vyšetření bylo provedeno v MOÚ v Brně na kameře Siemens E.CAT Accel s LSO krystaly. K vyšetření byla použita 18 F-fluoro-deoxy-glukóza. Provedeno bylo vždy celotělové vyšetření, aplikovalo se průměrně 370 MBq pro standardního 70kilogramového pacienta. PET skeny se hodnotily semikvantitativně pomocí stanovení SUV (standardized uptake value). Za hranici malignity se považovaly hodnoty nad 3. Vždy byla doplněna fúze PET skenů s CT ke zpřesnění zobrazení (obr. 1, obr. 2).
Obr. 1. Solitární ložisko patologického hypermetabolismu glukózy, svědčící o přítomnosti vitální nádorové tkáně (SUV 6,9), se promítá do laterální stěny orofaryngu vlevo. 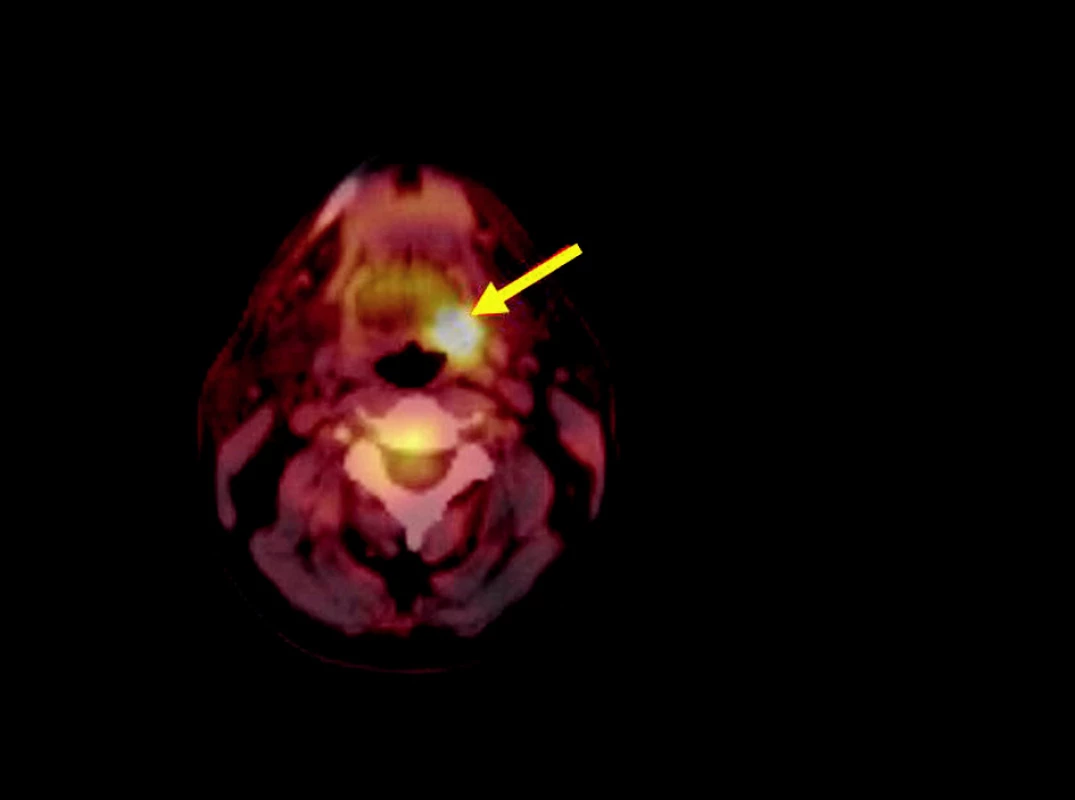
Obr. 2. Fúze CT/PET. Patologické aktivní ložisko se promítá do infiltrace spodiny ústní dutiny a drobnější ložisko do uzliny na krku. 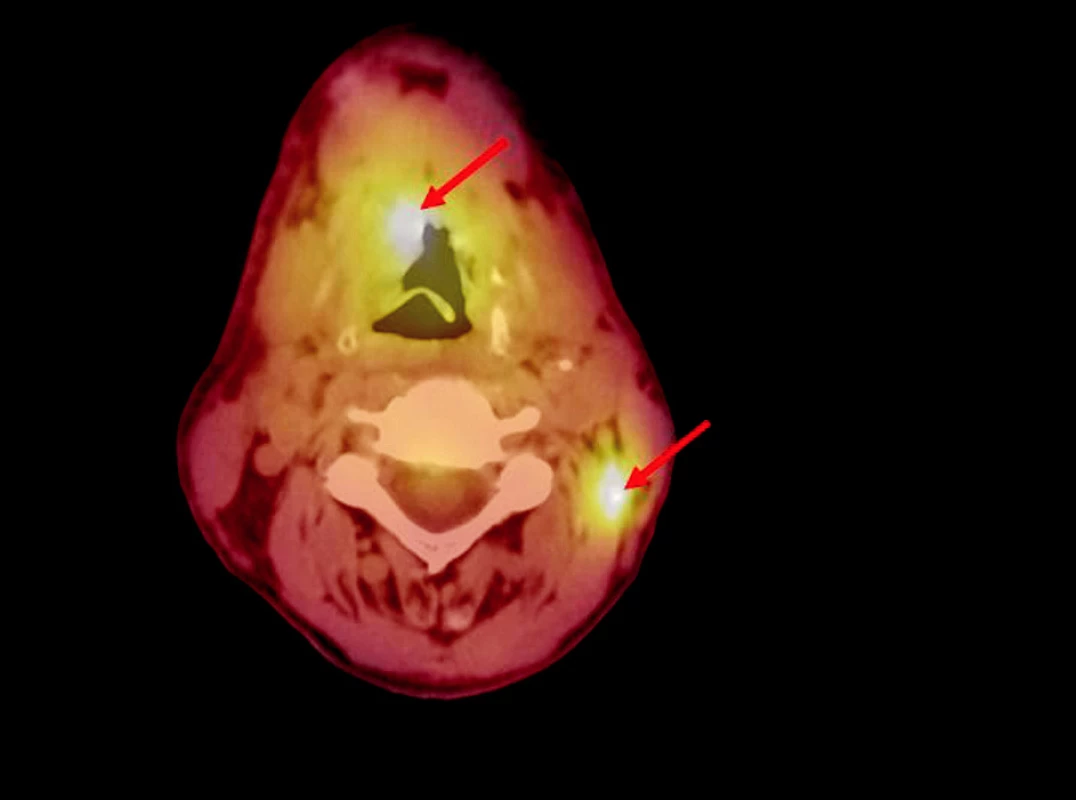
VÝSLEDKY
Cílem naší studie bylo zhodnotit vlastnosti, význam a možnosti využití PET v postterapeutické diagnostice nádorů hlavy a krku. Při rozhodování o nutnosti provedení blokové krční disekce jsme se zaměřili na vyšetření lymfatických uzlin. Výsledky zobrazovacích metod CT a PET byly srovnány s výsledkem postoperační histologie z krčního resekátu. Histologicky byla potvrzena perzistence nádorových buněk v částečně nekroticky změněných metastázách (stále s perzistujícími vitálními nádorovými buňkami) v lymfatických uzlinách v 10 blokových resekátech u 9 pacientů; v jednom případě byla pozitivní histologie oboustranně. U 3 pacientů se jednalo o vícečetné LU.
Ze zobrazovacích metod u CT koreloval nález v 28 případech: 9 bylo skutečně pozitivních, 4 falešně pozitivní, 19 skutečně negativních, 2 falešně negativní. Senzitivita činila 82 %, specificita 83 %, pozitivní prediktivní hodnota 69 % a negativní prediktivní hodnota 90 %.
Výsledky PET ve 27 případech odpovídaly skutečnosti: skutečně pozitivní - 5, falešně pozitivní - 1, skutečně negativní - 22 a falešně negativní - 6. Z těchto výsledků je vypočítána 45% senzitivita, 96% specificita, 83% pozitivní prediktivní hodnota a 78% negativní prediktivní hodnota (tab. 2).
Tab. 2. Parametry zobrazovacích metod. 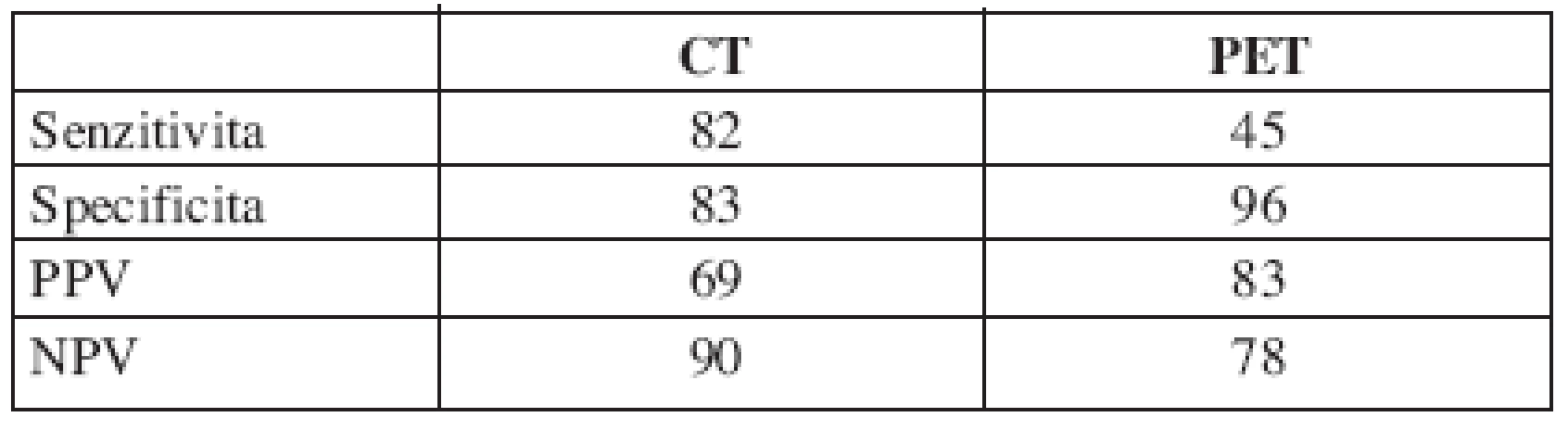
DISKUSE
V léčebném schématu záchovného protokolu mnoho autorů striktně doporučuje provést blokovou krční disekci (BKD) po ukončení léčby k redukci pravděpodobnosti recidivy, zejména s ohledem na skutečnost, že tato recidiva bývá často zachycena v inoperabilním stadiu. Konzervativní názory preferují při známkách remise především malých uzlinových nálezů (N1, N2a) pouze pravidelnou dispenzarizaci, čímž se vyhneme elektivnímu chirurgickému zásahu v čerstvě ozářeném poli (6, 9, 11). Mendenhale (10) uvádí jako dostatečnou léčbu pouze radioterapii (RT) při N1-N3 pro 88-70 % pacientů. Zcela srovnatelné výsledky udává pro RT bez BKD i RT s BDK u pacientů N1, tudíž ani nedoporučuje BKD u těchto nízkých N stadií (10). Někteří autoři preferují pouze sledování místo rutinně prováděné BKD i u větších nálezů (N2,3) při kompletní remisi (10, 11). Brizel (4) potvrdil význam BKD u pacientů s N2-3. Skupina s BKD měla lepší disease-free interval, a to bez ohledu na léčebnou odpověď na CHRT. U pacientů s N1 nepřinesla BKD žádnou výhodu ve zmiňovaných parametrech; klinická a patologická odpověď byla v přísné korelaci, což neplatilo pro N2-3 (4).
Diagnostika kompletní remise v postradiačně změněném terénu je velmi obtížná. Perzistující infiltrát klinicky imponující jako tumor může být podmíněn také otokem, fibrózou, abscesem či hematomem. Fyzikální vyšetření odhalí zvětšené LU až v 85 %, ale samotné zvětšení LU je pouze relativní informací, nemusí zdaleka vždy znamenat metastázu. Ultrazvuková detekce metastatických LU má uváděnou přesnost 70-90 %, senzitivitu a specificitu přes 70 %. Výtěžnost této metody je ovšem závislá na schopnostech a zkušenostech sonografisty. I CT diagnostika LU je založena především na hodnocení jejich velikosti; za pozitivní se považují LU větší než 1 cm (3). Ojiri (13) vyvinul model pro CT kritéria v hodnocení postradiačních LU s vysokou negativní prediktivní hodnotou založený na kombinaci velikosti, homogenity struktury LU a extrakapsulárního šíření (13).
Porušení anatomicko-morfologických struktur vlivem zánětu či otoku způsobuje pokles senzitivity i specificity všech těchto zavedených zobrazovacích metod. V rámci zpřesňování diagnostiky se v poslední době nabízí otázka využitelnosti funkčních zobrazovacích metod vypovídajících o biologické aktivitě tkáně. PET využívá radioizotopy, které jsou navázány na speciálních nosičích. Výsledkem je trojrozměrné zobrazení distribuce nosiče a kvantifikace radioizotopu podle metabolického rozložení v těle. Glc - 2-(18F) fluoro-2-deoxy-D-glc (FDG) se metabolizuje v normálních i nádorových buňkách proporcionálně k metabolismu glukózy. Nádorové buňky mají zvýšený metabolismus glukózy a adekvátně tomu také zvýšeně kumulují její radionuklidem značený analog. Ke kvantifikaci akumulace FDG se vypočítává nejčastěji tzv. standardized uptake volume (SUV). Jde o hodnotu vztaženou na množství podané značené látky a hmotnost pacienta. Získáme bezrozměrné číslo, které lze porovnávat mezi jednotlivými pacienty navzájem. Přínos diagnostiky PET v onkologii ORL oblasti se potvrdil především v několika indikacích. Primární nádor v horním aerodigestivním traktu větší než 1 cm je detekován téměř ve 100 %. Negativní PET 4 měsíce po ukončení RT vysoce pravděpodobně znamená kompletní remisi primárního tumoru, zatímco přetrvávající ložisko zvýšené akumulace znamená suspektní perzistenci. Pro zjištění neznámého prima je PET senzitivnější než CT/MRI a endoskopie, současně PET zobrazí duplexní tumor nebo vzdálené metastázy (1, 17).
Po léčbě dochází v nádorové tkáni ke kombinaci dvou protichůdných metabolických procesů. Akumulace FDG klesá při nekróze nádorových buněk, naopak stoupá při aktivaci energeticky závislých reparačních mechanismů. Akumulace FDG při zánětlivých a reparačních postradiačních procesech je sice signifikantně nižší než u maligní tkáně, přesto může vyvolat falešně pozitivní obraz. Nekróza LU, vysoce specifická pro metastatické postižení, spojená s úbytkem viabilních buněk, může dávat falešně negativní obraz, protože často jen minimum buněk zůstává schopných akumulovat glukózu. V těchto případech je ovšem typický a poměrně jednoznačný obraz na CT/MRI. Nedostatkem PET je nízká anatomická rozlišovací schopnost. Problém lze řešit společným zobrazením nebo dodatečnou fúzí s CT, kde CT skeny poskytují morfologický základ, ve kterém PET zdůrazní funkční změny. Tím se zvyšuje rozlišovací schopnost PET až na 3 mm (7, 8).
Bylo provedeno mnoho v literatuře publikovaných studií hodnotících význam PET pro zhodnocení lymfadenopatie po RT, resp. CHRT. Nayak (11) na svém souboru pacientů s karcinomy hlavy a krku prováděl první vyšetření CT/PET za 2-6 měsíců od ukončení chemoradioterapie, dále á 4 měsíce. Krční disekci indikoval pouze při suspekci na recidivu. V popsané studii mělo CT/PET zobrazení 88% senzitivitu, 91% specificitu, 70% pozitivní prediktivní hodnotu a 97% negativní prediktivní hodnotu. U 86 % pacientů se podařilo eliminovat dříve indikovanou krční disekci (12). Brkovich (5) ve své studii srovnávala výsledky PET po aplikované CHRT u původně pozitivních krčních uzlin. Při srovnání s histologií krčních resekátů získala 75% senzitivitu, 65% specificitu, 33% pozitivní prediktivní hodnotu a 92% negativní prediktivní hodnotu. Za slibnou považovala vysokou negativní prediktivní hodnotu, která by mohla účinně selektovat pacienty, kteří mohou být ušetření BKD (5). Yau (16) hodnotil pacienty po definitivní radioterapii. Při perzistující lymfadenopatii dle CT a pozitivním PET nálezu byla provedena BKD, ostatní pacienti byli pouze observováni. Negativní prediktivní hodnota PET podle těchto výsledků činila 100 %, pozitivní 43 %. PET se uplatnil zejména v predikci negativní histologie při BKD; selektoval skupinu pacientů s lymfadenopatií dle CT a negativním PET, kteří při dispenzarizaci bez BKD neměli diagnostikovanou recidivu. Za optimální načasování považoval 4 měsíce od ukončené léčby (16). Postradiační skeny před eventuální BKD mají podle většiny literárních údajů vysokou negativní prediktivní hodnotu, což se potvrdilo i u pacientů s morfologicky patrnou lymfadenopatií při negativním PET. Kauzální je načasování diagnostiky, s rostoucím intervalem klesá počet falešně negativních zobrazení při sekundárním postradiačním zánětu. Za optimální se pokládá doba 6-8 týdnů, kterou lze považovat za akceptovatelnou prodlevu i z onkologického hlediska.
Na našem souboru jsme k indikaci BKD přistupovali radikálně, plánována byla u všech před léčbou N+ pacientů. Ověřili jsme perzistenci vitálních nádorových buněk v LU u 10 z celkového počtu 32 krčních resekátů, což lze považovat za vysokou hodnotu. Ve většině případů se jednalo o ojedinělé nádorové buňky či jejich shluky v terénu nekrotické metastázy, jen výjimečně byly nalezeny okrsky nádorové tkáně. Otázkou zůstává, jaký je potenciál těchto buněk, zda jsou schopny progredovat do formy lokální recidivy a zda je tudíž BKD nezbytná. Z výsledků PET zobrazení jsme získali nízké hodnoty 45% senzitivity, ale vysokou 96% specificitu; 83% srovnatelné výsledky pozitivní prediktivní hodnoty a 78% výsledky negativní prediktivní hodnoty. PET nemůže být v této situaci vzhledem k nízké senzitivitě doporučována jako jediná diagnostická metoda. Objemově malé okrsky nádorové tkáně v nekrotickém terénu nejsou schopny dostatečně akumulovat radiofarmakum v intenzitě převyšující okolní zánětlivý terén; jsou hodnoceny jako falešně negativní nález. Výhodou je naopak vysoká specifita. Dochází-li k patologickému sycení na PET, je suspicium na nádorovou etiologii lymfadenopatie vysoké, chirurgické řešení je plně indikováno. Naše výsledky nepotvrdily benefit vysoké negativní prediktivní hodnoty, která by nás opravňovala eliminovat blokovou krční disekci v případě negativního nálezu. Nesporným limitem výsledků, které jsme získali, je hodnocení na malém souboru pacientů; k validizaci předpokládáme rozšíření stávajícího souboru. Nicméně dosavadní výsledky ukázaly, že diagnostika perzistujících drobných nádorových ložisek po terapii nebude zařazením PET do diagnostického schématu zásadně ovlivněna ve smyslu selekce pacientů před BKD.
ZÁVĚR
V rámci záchovných protokolů byla při dosažení kompletní remise primárního tumoru po aplikované CHRT, resp. RT, indikována BDK nejen u perzistující lymfadenopatie, ale u všech před léčbou pozitivních uzlin. Tato přísná indikační kritéria k BKD, založená pouze na předléčebné klasifikaci, jsou v poslední době zpochybňována. Detekce perzistence nádorových buněk v časné postradiační fázi zůstává výzvou pro kliniky i radiology. Infiltrát na krku může být také obrazem postradiačních změn, které způsobují pokles senzitivity i specificity etablovaných morfologických zobrazovacích metod, především CT.
PET je metoda založená na principech funkčního zobrazení. V našem souboru pacientů s pokročilými nádory hlavy a krku zařazenými do záchovného protokolu bylo provedeno PET po ukončení CHRT, resp. RT, před plánovanou BKD. Ve shodě s literárními údaji naše výsledky ukázaly nízkou senzitivitu a vysokou specifitu PET. Vysoká pozitivní prediktivní hodnota potvrzuje indikaci k blokové krční disekci; relativně nižší negativní prediktivní hodnota neprokázala potenciál metody k možné selekci pacientů, u kterých lze BKD eliminovat.
MUDr. Zuzana Horáková
KOCHHK FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: zuzana.horakova@fnusa.cz
Došlo 2. 9. 2008
Zdroje
1. Adams, S., Baum, R.: Prospective comparison of PET with conventional imaging modalities. Eur J. Nucl. Med., roč. 25, 1998, s. 1255-1260.
2. Allal, A., Dulguerov, P.: A conservation approach to pharyngeal carcinoma with advanced neck disease: optimizing neck management. Head Neck, 21, 1999, s. 217-222.
3. van der Breckel, M., Stel, H.: Cervical lymph node metastases assessment of radiologic criteria. Radiology, roč., 177, 1990, s. 379-384.
4. Brize, D., Prosnitz, R., Hunter, S.: Necessity for adjuvant neck dissection in setting of concurrent chemoradiation for advanced head and neck cancer. Int. J. Radiation Oncology, 58, 2004, s. 1418-1423.
5. Brkovich, V., Miller, F., Kanad, A.: The role of PET in the management of the N-positive neck in head and neck squamous cell carcinoma after chemoradiotherapy. Laryngoscope, 116, 2006, s. 855-858.
6. Frank, D., Hu, K.: Planned neck dissection after concomitant radiochemotherapy for advanced head and neck cancer. Laryngoscope, 115, 2005, s. 1015-1021.
7. Greven, K., Williams, D.: Serial positron emission tomography scan following radiation therapy. Head Neck, 23, 2001, s. 942-946.
8. Lowe, J., Boyd, J., Dunphy, F.: Surveillance for recurrent head and neck cancer using PET. J. Clinical. Oncology, 18, 2000, s. 651-658.
9. McHam, S., Adelstein, D., Rybicki, L.: Who merits a neck dissection after definitive chemoradiotherapy. Head Neck, 25, 2003, s. 2003-2008.
10. Mendenhall, W., Villaret, D., Amur, R.: Planned neck dissection after definitive radiotherapy for squamous cell carcinoma of the head and neck. Head Neck, 24, 2002, s. 1012-1018.
11. Narayan, K., Crane, C.: Planned neck dissection as an adjunkt to the management of patiens with advanced neck disease with definitive radiotherapy: for some or for all? Head Neck, 21, 1999, s., 606-613.
12. Nayak, J., Walvekar, R., Andrade, R., Daamen, N.: Deferring planned neck dissection following chemoradiation for stage IV head and neck cancer: the utility of PET-CT. Laryngoscope, 117, 2007, s. 2129-2134.
13. Ojiri, H., Mendenhall, W., Stringer, S.: Post RT CT results as a predictive model for the necessity of planned post RT neck dissection. Int. J. Radiation Oncology, 52, 2002, s. 420-428.
14. Praženica P., Horka P., Navara M., Svárovský J., Mikolaj M., Voldřich Z.: Morfológia a funkci ramena po blokových krčných disekciách šetriacich nervus accessorius. Otorinolaryng. a Foniat. /Prague/, 52, 2003, 4, s. 190-194.
15. Wolf, G.: Options for preserving the larynx in patiens with advanced laryngeal and hypopharyngeal cancer. ENT Journal, 80, 2001, s. 897-902.
16. Yau, M., Smith, R., Graham, M., Hoffman, H.: The role of FCG PET in management of neck metastases from head and neck cancer after definitive radiation treatment. In. J. Radiation Oncology Biol. Phys., 63, 2005, s. 1-9.
17. Zimmer, L., Snyderman, C., Fukui, M.: The use of combined PET/CT for lacalizing recurrent head and neck cancer. ENT Journal, 84, 2005, s. 104-110.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek Recenze knihyČlánek Recenze knihyČlánek Recenze knihyČlánek Recenze knihyČlánek AUTORSKÝ REJSTŘÍKČlánek Vestibulární schwannomČlánek Pemphigus vulgarisČlánek Kožní T-lymfom ORL oblastiČlánek Recenze knihČlánek VĚCNÝ REJSTŘÍK
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2008 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Česká slovní audiometrie – vývoj nových testů
- AUTORSKÝ REJSTŘÍK
- Recenze knihy
- Vztah PTA a SRT (Pure Tone Average - průměrná tónová ztráta, Speech Recognition Threshold – hladina srozumitelnosti řeči)
- Recenze knihy
- Chirurgická léčba primárních tumorů orbity
- Recenze knihy
- Fonochirurgická léčba glotické insuficience
- Recenze knihy
- Význam PET pro diagnostiku perzistence krčních metastáz po léčbě v rámci záchovného protokolu u pokročilých karcinomů hlavy a krku
- Prevence záměny stran u operací na ORL klinice FN Ostrava
- Vestibulární schwannom
- Cetuximab v záchovném protokolu lokoregionálně pokročilých karcinomů hlavy a krku: první klinické zkušenosti a možnosti výzkumu v oblasti predikce účinnosti této léčby
- Pemphigus vulgaris
- Sarkoidóza sdružená s papilárním karcinomem štítné žlázy a adenomem příštítného tělíska
- Kožní T-lymfom ORL oblasti
- Recenze knih
- Primární dlaždicobuněčný karcinom frontální dutiny
- XII. kongres mladých otorinolaryngologů
- 7. společný sjezd českých a středoněmeckých ORL lékařů
- Prof. MUDr. Josef Rems, DrSc., 1931 - 2008
- Zápis ze schůze výboru ORL společnosti
- VĚCNÝ REJSTŘÍK
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vestibulární schwannom
- Pemphigus vulgaris
- Vztah PTA a SRT (Pure Tone Average - průměrná tónová ztráta, Speech Recognition Threshold – hladina srozumitelnosti řeči)
- Primární dlaždicobuněčný karcinom frontální dutiny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



