-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinická zkušenost s kabozantinibem u pacientů s metastatickým karcinomem ledviny
Background: Cabozantinib is a tyrosine kinase inhibitor (TKI) that targets vascular endothelial growth factor receptor (VEGFR) as well as MET and AXL. In METEOR study, cabozantinib demonstrated efficacy when compared with everolimus in pacients with metastatic renal cell cancer (mRCC) after previous TKI therapy. Purpose: The determination of efficacy and tolerance of cabozantinib in the second or higher lines of the therapy of mRCC after previous treatment with tyrosinkinase inhibitors. Patients and methods: A total of 45 patients with mRCC were treated in two oncology centers (Regional Hospital Liberec and University Hospital Motol, Prague) in clinical practice. We determined progression free survival (PFS) and overall survival (OS) according to Kaplan-Meier analysis. We performed a multivariate analysis of the risk factors for treatment outcomes (PFS, OS) by Cox regression analysis. All statistics were evaluated at the significance level of α = 0.05. Results: A median of follow-up was 24 months. Median PFS was 8.7 months (95% CI 6.7–19.5), median OS was 21.6 months (95% CI 13.2–not achieved). Parcial remission was described in 42.5% patients, stabilization in 37.8% patients. Progression as the best response was demonstrated in 20% of patients. Regression analysis demonstrated a statistically significant favorable prognostic effect on PFS in patients at older age and patients with longer first-line therapy. The regression analysis demonstrated a statistically significant favorable prognostic effect on OS in patients with Eastern Cooperative Oncology Group (ECOG) performance status 0, patients with longer-first line therapy and patients treated with immunotherapy in the next lines. Grade 3–4 toxicity was described in 37.8% patients. The most common type of toxicity was hypertension. Conclusion: Our analysis demonstrated the efficacy and good tolerance of cabozantinib in with mRCC treated by cabozantinib in second-line therapy.
Keywords:
Angiogenesis – metastases – targeted therapy – clinical practice – renal cell cancer
Autoři: I. Richter 1; D. Šustrová 4; A. Vojkůvková 5; S. Al-Samsam 1; J. Bartoš 1; Jan Dvořák 2; T. Büchler 4
Působiště autorů: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a FTN Praha 2; Fakulta zdravotnických studií, Technická univerzita Liberec 3; Onkologická klinika 2. LF UK a FN Motol, Praha 4; Institut biostatistiky, a analýz, s. r. o., Brno 5
Vyšlo v časopise: Klin Onkol 2024; 37(1): 57-62
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccko202457Souhrn
Východiska: Kabozantinib je inhibitor tyrozinkinázy (tyrosin kinase inhibitor – TKI) proti receptoru pro vaskulární růstový faktor (VEGFR), podobně i MET a AXL. V klinické studii METEOR prokázal u pacientů s metastatickým renálním karcinomem (mRCC) účinnost ve srovnání s everolimem po předchozí léčbě TKI. Cíl: Stanovení účinnosti a tolerance kabozantinibu ve druhé nebo vyšší linii léčby mRCC po předchozí léčbě inhibitory tyrozinkinázy. Pacienti a metody: Celkem bylo hodnoceno 45 pacientů s mRCC léčených ve dvou onkologických centrech (Krajská nemocnice Liberec, Fakultní nemocnice Motol) v klinické praxi. Stanovili jsme přežití bez známek progrese (progression-free survival – PFS) a celkové přežití (overall survival – OS) pomocí Kaplan-Meierovy analýzy a vliv faktorů na léčebné výsledky pomocí regresní analýzy. Statistické zhodnocení bylo provedeno na hladině významnosti α = 0,05. Výsledky: Medián sledování byl 24 měsíců. Medián PFS činil 8,7 měsíce (95% CI 6,7–19,5), medián OS činil 21,6 měsíce (95% CI 13,2–nedosaženo). Parciální remise byla pozorována u 42,5 %, stabilizace onemocnění u 37,8 % pacientů. Primární progrese byla zjištěna u 20 % nemocných. V regresní analýze jsme prokázali prognostický příznivý vliv na prodloužení PFS u pacientů ve vyšším věku a s delším trváním první linie terapie. Regresní analýza dále prokázala příznivý vliv na prodloužení OS u pacientů v lepším celkovém stavu, při delším trvání léčby první linie a u pacientů, u kterých byla po selhání kabozantinibu indikována imunoterapie. Toxicita stupně 3–4 byla pozorována u 37,8 % pacientů, dominoval průjem. Závěr: Naše společná analýza potvrdila účinnost a toleranci kabozantinibu v léčbě druhé a vyšší linie mRCC.
Klíčová slova:
metastázy – cílená léčba – Angiogeneze – karcinom ledviny – klinická praxe
Úvod
Výskyt karcinomu ledviny (renal cell cancer – RCC) v ČR patří dlouhodobě mezi nejvyšší na světě. V roce 2021 byla incidence tohoto onemocnění v ČR 28,88/ 100 000 obyvatel a mortalita 8,64/ 100 000 obyvatel [1]. Přibližně 70 % zhoubných nádorů ledvin představuje světlobuněčný karcinom, který je spojen s poruchou funkce genu von Hippel-Lindau (VHL). Tato dysfunkce je spojena s akumulací faktoru indukovaného hypoxií (hypoxia-induced factor – HIF), v důsledků čehož dochází k analogickým metabolickým jevům jako při hypoxii. Výsledkem je indukce vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF) s následnou stimulací angiogeneze [2]. Mezi další relativně často se vyskytující histologické typy řadíme papilární nebo chromofobní karcinom. Metastatický RCC (mRCC) se v ČR vyskytne u přibližně 700 pacientů ročně. Může být diagnostikován de novo, příp. se metastatické onemocnění objeví po předchozí lokální léčbě i s odstupem mnoha let.
V léčbě mRCC má největší uplatnění systémová terapie. Aktuálně má v první linii nejsilnější doporučení indikace kombinačních režimů založených na podání imunoterapie [3–5]. Zásadním faktorem je stratifikace pacientů do rizikových skupin. V klinické praxi aktuálně nejvíce využíváme stratifikaci podle International mRCC Database Consorcium (IMDC) [6]. I přes významné zlepšení výsledků léčby první linie mRCC značná část pacientů progreduje. Tito nemocní jsou následně indikováni k další linii systémové terapie. Mezi léky s nejvíce prokázanou účinností v této indikaci patří kabozantinib. Jedná se o perorální inhibitor tyrozinkinázy (tyrosin kinase inhibitor – TKI) receptoru pro VEGF (VEGFR) a dalších receptorů (MET, AXL, RET, KIT a FLT3) [7,8]. Preklinické práce prokázaly, že rezistence proti TKI VEGFR je u karcinomu ledviny spojena se zvýšením exprese genů MET a AXL. Toto je následně asociováno s agresivnějším průběhem onemocnění a zhoršením prognózy pacientů [9]. Blokáda receptorů MET a AXL kabozantinibem by tuto rezistenci mohla překonat. Kabozantinib se stal významnou součástí léčby druhé a vyšší linie mRCC na podkladě výsledků prospektivní klinické studie fáze III METEOR. Studie prokázala superioritu kabozantinibu nad everolimem u pacientů, kteří byli v předchozí linii léčeni TKI VEGFR [10].
V ČR jsme začali kabozantinib používat v klinické praxi od roku 2018. V roce 2020 a 2021 jsme publikovali analýzu čtyř onkologických center v ČR u pacientů, kteří byli dříve léčeni TKI VEGFR při mediánu sledování 10,6 a 18,5 měsíce [11,12].
Cílem předkládané práce je retrospektivní zhodnocení léčebných výsledků v souboru pacientů dvou onkologických center při mediánu sledování 24 měsíců.
Pacienti a metody
Retrospektivní zhodnocení pacientů léčených kabozantinibem pro mRCC po předchozí antiangiogenní terapii TKI. Do analýzy byla zapojena dvě onkologická centra – Onkologické oddělení Krajské nemocnice Liberec, a.s., a Onkologická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol. Pacienti byli léčeni od června 2018.
Kabozantinib byl podáván perorálně v jedné denní dávce. Pacienti byli poučeni o nutnosti užívat kabozantinib nalačno. Úvodní dávka kabozantinibu byla standardně 60 mg/ den, dva nemocní zahájili léčbu dávkou 40 mg/ den. Kontroly pacientů probíhaly cyklicky, nejčastěji à 28 dnů. Léčba kabozantinibem byla ukončena v případě progrese onemocnění nebo v případě závažné toxicity. Po ukončení terapie kabozantinibem byla část pacientů léčena další terapií dle výběru ošetřujícího lékaře. Účinnost terapie jsme hodnotili pomocí CT vyšetření s využitím kritérií Response Evaluation Criteria in Solid Tumors, verze 1.1 (RECIST 1.1). Interval vyšetření byl v rozmezí 12–16 týdnů. Toxicita byla hodnocena pomocí Common Terminology Criteria for Adverse Events, verze 5 (CTCAE). V případě toxicity stupně 3–4 byla léčba kabozantinibem přerušena a po úpravě stavu pacienti pokračovali v redukované dávce 40 mg, příp. 20 mg.
Statistická analýza byla provedena pomocí softwaru R (verze 4.1.2). Všechny statistické testy byly hodnoceny na hladině významnosti α = 0,05. Progrese onemocnění byla definována jako událost ukončení terapie z důvodu progrese na zobrazovacím CT vyšetření nebo z důvodu klinické progrese či jako ukončení terapie z důvodu úmrtí. Přežití bez známek progrese (progression-free survival – PFS) bylo definováno jako doba od zahájení terapie kabozantinibem k datu progrese onemocnění nebo k datu poslední kontroly u pacientů bez progrese (cenzorovaná data). Celkové přežití (overall survival – OS) jsme definovali jako dobu od zahájení terapie kabozantinibem k datu úmrtí z jakékoliv příčiny nebo k datu poslední kontroly u žijících pacientů (cenzorovaná data). K výpočtu PFS a OS jsme použili Kaplan-Meierovou analýzu. Pro hodnocení vybraných rizikových faktorů na léčebné výsledky (PFS, OS) jsme použili Coxovu analýzu, jednak univariantní, u vybraných faktorů i multivariantní. Poměr rizik (hazard ratio – HR) byl vypočítán v 95% intervalu spolehlivosti (confidence interval – CI). Hodnoty < 1 představují redukci rizika (prognosticky příznivý vliv), hodnoty > 1 představují prognosticky nepříznivý faktor.
Výsledky
Do retrospektivního hodnocení bylo zahrnuto celkem 45 pacientů. Všichni nemocní byli v první linii léčeni TKI angiogeneze, nejčastěji sunitinibem. Medián sledování pacientů činil 24 měsíců. Charakteristika souboru pacientů je uvedena v tab. 1.
Progrese nastala celkem u 33 (73,3 %) pacientů. Medián PFS činil 8,7 (95% CI 6,7–19,5) měsíce. Jednoleté PFS představovalo 36,4 % (graf 1). K datu hodnocení zemřelo celkem 26 (57,8 %) pacientů. Medián OS činil 21,6 (95% CI 13,2–nedosaženo) měsíce. Jednoleté přežití bylo zaznamenáno u 66,9 % pacientů (graf 2). Při hodnocení léčebné odpovědi nebyl zjištěn ani jeden případ kompletní klinické odpovědi, parciální odpověď byla popsána u 19 (42,2 %) pacientů, stabilizace onemocnění u 17 (37,8 %) pacientů. Celková kontrola onemocnění činila 80 %. Progrese při prvním přešetření byla zjištěna u 9 (20 %) nemocných (tab. 2).
V regresní jednorozměrné analýze vybraných faktorů na prodloužení PFS se jako statisticky významný prediktor ukázal být vyšší věk při zahájení léčby kabozantinibem a delší trvání léčby v první linii (tab. 3). Prognostický příznivý vliv uvedených faktorů na prodloužení PFS potvrdila i vícerozměrná regresní analýza. V regresní jednorozměrné analýze vybraných faktorů na prodloužení OS jsme nenašli žádnou proměnnou, která by byla významným prediktorem prodloužení OS (tab. 4). Vícerozměrný model prokázal příznivý vliv na prosloužení OS u pacientů s vyšším věkem (HR 0,92; 95% CI 0,87–0,97; p = 0,003), celkovým stavem dle Eastern Cooperative Oncology Group (ECOG) = 0 (HR 0,27; 95% CI 0,08–0,92; p = 0,035), s delším trváním léčby v první linii (HR 0,96; 95% CI 0,91–1,00; p = 0,043) a konečně u pacientů následně léčených nivolumabem (HR 0,28; 95% CI 0,10–0,82; p = 0,02).
Toxicita byla popsána celkem u 42 (93,3 %) pacientů. Závažnější toxicitu stupně 3–4 jsme pozorovali u 17 (37,8 %) nemocných. Redukce dávky kabozantinibu z 60 na 40 mg byla popsána u 31 pacientů, u 10 nemocných pak další redukce na 20 mg. Mezi nejčastější projevy toxicity stupně 3–4 patřil průjem, únava, stomatitida a hand-foot syndrom.
Po ukončení terapie kabozantinibem bylo systémovou onkologickou léčbou dále léčeno 17 (37,8 %) pacientů, z toho 15 nemocných bylo indikováno k podání nivolumabu.
Tab. 1. Charakteristika souboru pacientů. 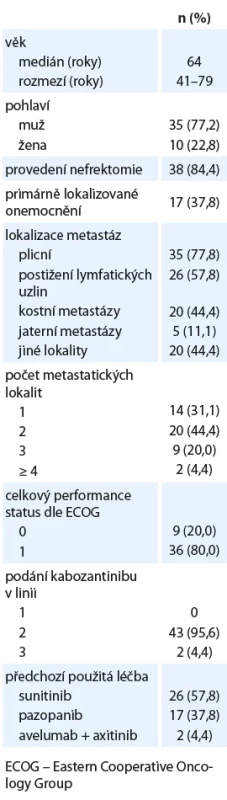
Graf 1. Přežití bez progrese (PFS). 
Tab. 2. Léčebná odpověď pacientů na terapii kabozantinibem. 
Tab. 3. Univariační analýza vybraných faktorů na přežití bez známek progrese. 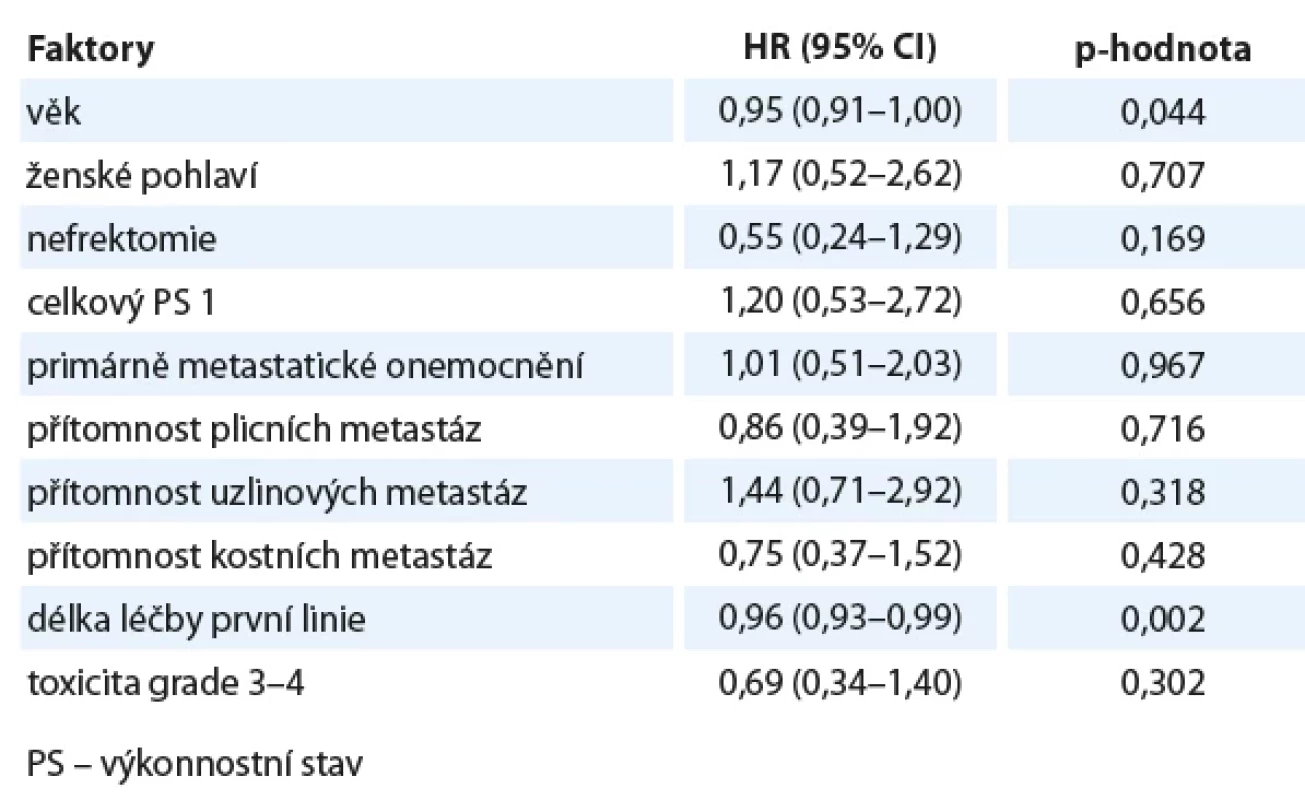
Diskuze
Naše analýza prezentovala výsledky z klinické praxe pacientů s mRCC léčených kabozantinibem po předchozí antiangiogenní terapii TKI. Medián PFS a OS našeho souboru činil 8,7 a 21,6 měsíce. Dosažené výsledky odpovídají hodnotám klinické studie METEOR [10,13]. Bylo publikováno i několik retrospektivních dat hodnotících kabozantinib v léčbě mRCC.
Retrospektivní analýza 96 pacientů z 24 center prokázala podobný medián PFS 8,0 měsíců i procento jednoletého přežití (65 %). V této analýze byla téměř jedna třetina nemocných v horším výkonnostním stavu a zahájila léčbu v redukované dávce. Ve druhé linii bylo léčeno jenom 29 % nemocných, 52 % pacientů bylo léčeno kabozantinibem ve čtvrté a vyšší linii [14]. Další retrospektivní analýza čtyř center u pacientů léčených kabozantinibem ve druhé a vyšší linii prokázala delší medián PFS (12,5 měsíce) i vyšší procento jednoletého přežití (70,4 %) [15]. Asi nejrozsáhlejší retrospektivní analýza CABOREAL hodnotila celkem 410 pacientů z 26 center. V této analýze byla ve druhé linii léčena přibližně čtvrtina pacientů. Více než 40 % nemocných bylo léčeno kabozantinibem až ve čtvrté a vyšší linii. I vzhledem k vysoké předléčenosti tato analýza prokázala kratší medián OS 14,4 měsíce s jednoletým OS 56,5 % v porovnání s registrační studií nebo naší analýzou. Místo PFS studie hodnotila dobu trvání léčby kabozantinibem, která byla 7,6 měsíce. Analýza podskupin pacientů léčených ve druhé linii prokázala medián OS 15,0 měsíce. Kratší hodnota OS může souviset i s prognosticky horší charakteristikou pacientů, kdy 39,3 % mělo výkonnostní stav ECOG ≥ 2). Přibližně 15 % nemocných mělo jiný typ histologie než světlobuněčný karcinom. V analýze byli významněji zastoupeni i pacienti s kostními (55,9 %) nebo mozkovými (16,8 %) metastázami. V této práci byli navíc hodnoceni i nemocní dříve léčení nivolumabem (celkem 190 pacientů). Tato skupina prokázala delší medián OS než pacienti bez předchozího podání nivolumabu (15,4 vs. 13,8 měsíce) [16]. Výsledky této analýzy potvrzují účinnost kabozantinibu jednak u více předléčených pacientů, jednak i po léčbě imunoterapií. Důležitým zjištěním této analýzy bylo pozorování, že nemocní s iniciální dávkou kabozantinibu 60 mg měli delší medián OS než pacienti, kteří zahájili léčbu dávkou nižší (15,4 vs. 11,8 měsíce). Celkem se jednalo o 69,2 % pacientů. V naší analýze jsme zahájili terapii kabozantinibem v dávce 40 mg pouze u dvou pacientů (4,4 %). Důvodem rozdílů v úvodní dávce byla již zmíněná prognosticky horší populace nemocných ve studii CABOREAL. Toto dokazují i naše výsledky v rámci regresní analýzy, kdy jsme delší OS prokázali u pacientů s výkonnostním stavem ECOG 0, dále u pacientů s delším trváním léčby první linie a nakonec i u nemocných následně léčených další linií léčby – imunoterapií. Prodloužení OS u pacientů následně léčených imunoterapií podporují důležitost této léčby v algoritmu terapie pacientů s mRCC. Tento fakt potvrdila i recentně publikovaná analýza dat z registru RENIS [17]. V univariantní analýze jsme prokázali významný vliv na prodloužení PFS u pacientů starších než medián věku při zahájení léčby kabozantinibem (64 let). Podobně i multivariační analýza prokázala u této skupiny pacientů prodloužení OS. Kabozantinib je účinný také u nemocných ve vyšším věku. Analýza klinické studie METEOR hodnotila léčebné výsledky a toleranci podle věkových skupin (< 65; 65–74 a ≥ 75 let). Ve všech skupinách měli nemocní léčení kabozantinibem ve srovnání s everolimem delší PFS i OS. Hodnoty HR byly pro skupinu pacientů ve věku ≥ 75 let nejprůkaznější. Jednalo se ale o nejméně početnou skupinu pacientů (celkem 63 nemocných). U starších pacientů dále analýza prokázala vyšší výskyt toxicity stupně 3–4. Jednalo se hlavně o únavu, arteriální hypertenzi a hyponatremii. Z důvodu vyšší incidence nežádoucích účinků ve vyšším věku byla i častější nutnost redukce dávky kabozantinibu [18]. Výsledky jsou důležitou skutečností, protože karcinom ledviny se vyskytuje převážně ve vyšším věku; více než polovina pacientů je diagnostikována ve věku > 65 let. Vyšší věk pacientů není kontraindikací k terapii kabozantinibem, je ale nutno nemocné poučit o nežádoucích účincích a je nutné časné zahájení podpůrné terapie. Lepší léčebné výsledky v našem souboru u pacientů starších 64 let mohly být výsledkem selekce nemocných, kteří měli lepší celkový stav. U mladších pacientů jsme léčbu indikovali i v případě symptomatického onemocnění, v případě starších nemocných by se mohlo jednat o faktor, kdy terapie kabozantinibem by mohla být spojena s obavou o toleranci.
Další diskutovaná skutečnost je účinnost kabozantinibu u pacientů s kostním metastatickým procesem. Kostní metastázy představují prognosticky nepříznivou lokalizaci metastatického postižení karcinomu ledviny [19,20]. Analýza dat ze studie METEOR prokázala přínos kabozantinibu u pacientů s kostním postižením ve srovnání s everolimem. Medián PFS byl významně prodloužen (7,4 vs. 2,7 měsíce; HR 0,33; 95% CI 0,21–0,51), podobně i medián OS (20,1 vs. 12,1 měsíce; HR 0,54; 95% CI 0,34–0,84). Léčebná odpověď u pacientů léčených kabozantinibem byla 17 %, u pacientů léčených everolimem 0 %. Celkem se jednalo o 23 % všech pacientů léčených kabozantinibem [21]. V našem souboru mělo kostní metastázy 44,4 % pacientů. Vyšší procento souvisí s faktem, že po selhání první linie léčby jsme v případě výskytu kostního metastatického procesu zvažovali podání kabozantinibu před jinou terapeutickou možností. V regresní analýze jsme neprokázali negativní vliv výskytu kostních metastáz na PFS či OS. I ve výše zmíněné studii CABOREAL bylo vyšší zastoupení pacientů s kostními metastázami (55,9 %) bez zhoršení výsledků OS. Publikovaná data demonstrují význam kabozantinibu u pacientů s kostním metastatickým procesem.
Naše analýza volně navazuje na předchozí analýzy terapie kabozantinibem, které jsme v minulosti publikovali [11,12]. Jednalo se o analýzu čtyř onkologických center, aktuálně jsme publikovali výsledky dvou pracovišť. Přínosem analýzy je delší medián sledování (24 měsíců), i ve srovnání s finální analýzou studie METEOR, kde byl medián sledování necelých 18 měsíců [13]. Naše data potvrdila hodnoty mediánu OS v souladu s registrační klinickou studií.
Tab. 4. Univariační analýza vybraných faktorů na celkové přežití. 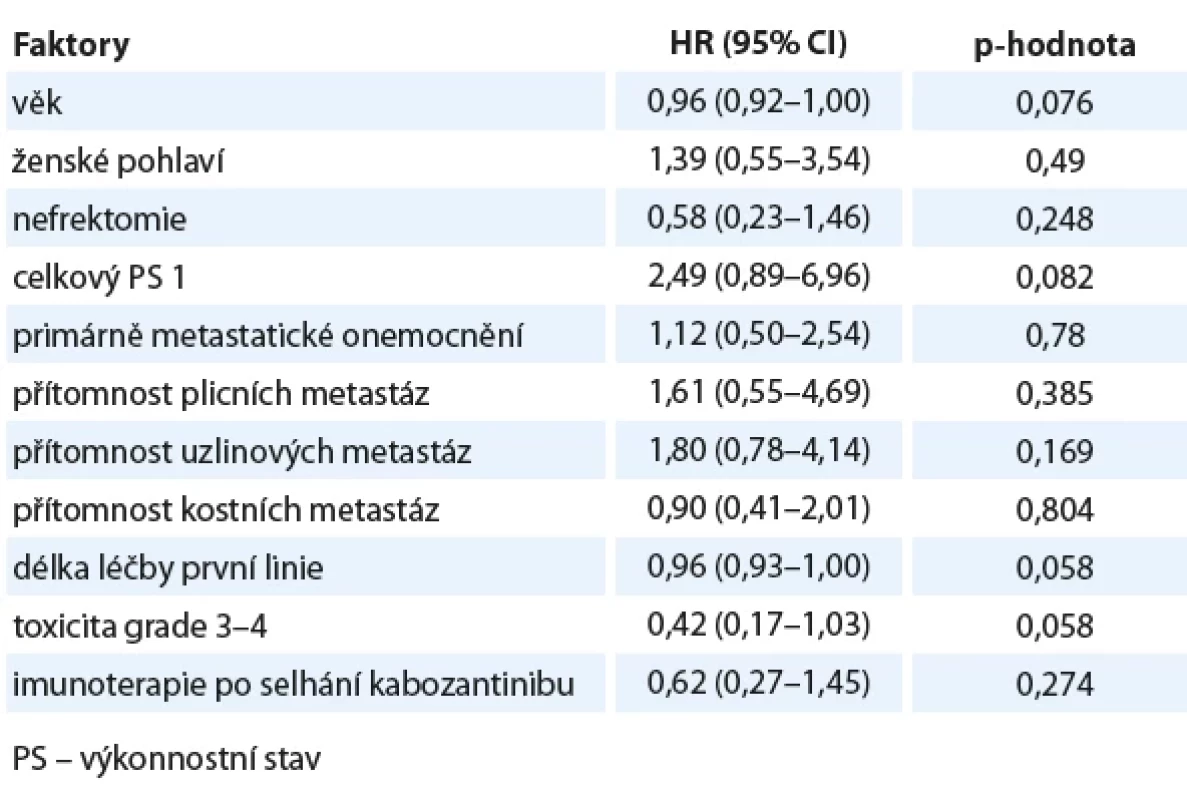
Závěr
Publikovaná data jednoznačně prokázala přínos kabozantinibu v léčebném algoritmu u pacientů s mRCC po předchozí léčbě TKI.
Se změnou léčebných standardů a jasným postavením imunoterapie v první linii léčby mRCC bude mít kabozantinib v budoucnu důležité postavení i u pacientů po selhání imunoterapie. Podobně bude kabozantinib i součástí kombinace s imunoterapií v léčbě první linie mRCC.
doc. MUDr. Igor Richter, Ph.D.
Onkologické oddělení
Krajská nemocnice Liberec, a.s.
Husova 357/10
460 63 LiberecObdrženo/Submitted: 16. 8. 2023
Přijato/Accepted: 4. 1. 2023
Zdroje
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: https:/ / www.svod.cz/ .
2. Kaelin WG Jr. The von Hippel-Lindau tumour suppressors protein: O2 sensing and cancer. Nat Rev Cancer 2008; 8(11): 865–873. doi: 10.1038/ nrc2502.
3. Linkos. Zhoubný novotvar ledviny (C64). [online]. Dostupné z: https:/ / www.linkos.cz/ files/ modra-kniha/ 22/ 872.pdf.
4. Escudier B, Porta C, Schmidinger M et al. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019; 30(5):
706–720. doi: 10.1093/ annonc/ mdz056.5. National Comprehensive Cancer Network. Kidney cancer. Version: 1.2024. [online]. Dostupné z: https:/ / www.nccn.org/ guidelines/ guidelines-process/ transparency-process-and-recommendations/ GetFileFromFileManagerGuid?FileManagerGuidId=8cf963d5-151c-4bb0-bbbf-c057046d13db.
6. Heng DY, Xie W, Regan MM et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 2009; 27(34): 5794–5799. doi: 10.1200/ JCO.2008.21.4809.
7. Yakes FM, Chen J, Tan J et al. Cabozantinib (XL184), a novel MET and VEGFR2 inhibitor, simultaneously suppresse metastasis, angiogenesis, and tumor growth. Mol Cancer Ther 2011; 10(12): 2298–2308. doi: 10.1158/ 1535-7163.MCT-11-0264.
8. Tannir NM, Schwab G, Grunwald V. Cabozantinib: an active novel multikinase inhibitor in renal cell carcinoma. Curr Oncol Rep 2017; 19(2): 14. doi: 10.1007/ s11912-017-0566-9.
9. Zhou L, Liu XD, Sun M et al. Targeting MET and AXL overcomes resistence to sunitinib therapy in renal cell carcinoma. Oncogene 2016; 35(21): 2687–2697. doi: 10.1038/ onc.2015.343.
10. Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373(19): 1814–1823. doi: 10.1056/
NEJMoa1510016.11. Richter I, Poprach A, Zemankova A et al. Patients with metastatic renal cell carcinoma treated with cabozantinib in the Czech Republic: analysis of four cancer centers. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2022; 166(1): 97–104. doi: 10.5507/ bp.2020.055.
12. Richter I, Poprach A, Zemánková A et al. Cabozantinib in the treatment of metastatic renal cell carcinoma – final data analysis from four oncology centers in the Czech Republic. Klin Onkol 2021; 34(5): 392–400. doi: 10.48095/ ccko2021392.
13. Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. Lancet Oncol 2016; 17(7): 917–927. doi: 10.1016/ S1470-2045(16)30107-3.
14. Procopio G, Priscinadaro M, Iacovelli R et al. Safety and efficacy of cabozantinib in metastatic renal-cell carcinoma: real-world data from an Italian managed access program. Clin Genitourinal Cancer 2018; 16(4):
e945–e951. doi: 10.1016/ j.clgc.2018.03.014.15. Bodnar L, Kopczyńska A, Zolnierek J et al. Real-world experience of cabozantinib as second - or subsequent line treatment in patients with metastatic renal cell carcinoma: data from the Polish managed access program. Clin Genitourine Cancer 2019; 17(3): e556–e564. doi: 10.1016/ j.clgc.2019.02.002.
16. Albiges L, Fléchon A, Chevreau C et al. Real-world evidence of cabozantinib in patients with metastatic renal cell carcinoma: results from the CABOREAL Early Access Program. Eur J Cancer 2021; 142 : 102–111. doi: 10.1016/
j.ejca.2020.09.030.17. Poprach A, Kiss I, Stanik M et al. Impact of immunotherapy on real-world survival outcomes in metastatic renal cell carcinoma. Target Oncol 2023; 18(6): 893–903. doi: 10.1007/ s11523-023-01013-0.
18. Donskov F, Motzer RJ, Voog E et al. Outcomes based on age in the phase III METEOR trial of cabozantinib versus everolimus in patients with advanced renal cell carcinoma. Eur J Cancer 2020; 126 : 1–10. doi: 10.1016/
j.ejca.2019.10.032.19. Dai J, Zhang H, Karatsinides A et al. Cabozantinib inhibits prostate cancer growth and prevents tumor – induced bone lesions. Clin Cancer Res 2014; 20(3): 617–630. doi: 10.1158/ 1078-0432.CCR-13-0839.
20. Escudier B, Powles T, Motzer RJ et al. Cabozantinib, a new standard of care for patients with advanced renal cell carcinoma and bone metastases? Subgroup analysis of the METEOR trial. J Clin Oncol 2018; 36(8): 765–772. doi: 10.1200/ JCO.2017.74.7352.
21. Choueiri TK, Hessel C, Halabi S et al. Cabozantinib versus sunitinib as initial therapy for metastatic renal cell carcinoma of intermediate or poor risk (Alliance A031203 CABOSUN randomised trial): progression-free survival by independent review and overall survival update. Eur J Cancer 2018; 94 : 115–125. doi: 10.1016/
j.ejca.2018.02.012.Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Poděkování recenzentům
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2024 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Převodní systém srdeční jako nový rizikový orgán v radioterapii
- Střevní mikrobiota a karcinom pankreatu
- Molekulární podstata mnohočetného myelomu
- Evropský plán boje proti rakovině a Mise rakovina – co nám přináší?
- Hodnocení nádorového mikroprostředí a následné exprese genů u karcinomu ústní dutiny
- Analýza efektu detekce časné clearance ct-DNA při baseline na přežití u pacientů s pokročilým EGFR mutovaným nemalobuněčným karcinomem plic
- Imunohistochemická analýza CD9, CD29 a epitelo-mezenchymové tranzice u triple-negativního karcinomu prsu
- Klinická zkušenost s kabozantinibem u pacientů s metastatickým karcinomem ledviny
- Léčba závislosti na tabáku u onkologických pacientů
- Pokročilé léčebné strategie metastatického kolorektálního karcinomu a karcinomu pankreatu
- MU Dr. Libor Havel (1967–2023)
- Doc. Ing. Čestmír Altaner, DrSc. oslávil vzácne životné jubileum – 90 rokov
- Poděkování recenzentům
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Molekulární podstata mnohočetného myelomu
- Střevní mikrobiota a karcinom pankreatu
- Analýza efektu detekce časné clearance ct-DNA při baseline na přežití u pacientů s pokročilým EGFR mutovaným nemalobuněčným karcinomem plic
- Převodní systém srdeční jako nový rizikový orgán v radioterapii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




