-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
Molecular testing of endometrial carcinoma in real-world clinical practice
Background: Molecular classification has brought significant changes in the management of endometrial cancer (EC). In this article, we aim to analyze our first experience with an implementation of molecular testing into daily clinical practice. Materials and methods: In all newly diagnosed EC, the status of mismatch repair (MMR) and p53 proteins has been evaluated immunohistochemically as a part of the routine histopathological examination since May 2021. In tumors that do not meet clinical criteria for a low risk and those with MMR deficiency or p53 mutation, the molecular genetic testing of the POLE gene is performed as well. Recommendations for adjuvant treatment or follow-up are subsequently made based on the risk of recurrence. Genetic counselling is proposed to all patients with MMR-deficient tumors or family history of cancer. Results: A total of 85 patients with newly diagnosed EC between May 2021 and May 2022 were enrolled in the analysis. The median age was 66 years. The results of molecular testing were as follows: 22 (26%) MMR-deficient, 8 (9%) p53-mutated and none POLE-ultramutated of those 40 tumors with performed POLE sequencing. A total of 46 (51%) patient had a low risk, 2 (2%) intermediate, 14 (16%) high-intermediate and 20 (24%) patients had a high risk of recurrence. Advanced or metastatic diseases were diagnosed in 6 (7%) patients. The median time between surgery and multidisciplinary tumor board decision was 21 days (8–36). A total of 76 (90%) patients underwent the whole treatment plan according to the recurrence risk. At the time of analysis, the results of genetic testing were available in 18 patients and revealed 4 (22%) carriers of a pathogenic variant in any of the genes associated with Lynch syndrome. Conclusion: Molecular testing combining immunohistochemical analyses of MMR and p53 proteins in all newly diagnosed EC patients with sequencing analysis of POLE in those with non-low-risk disease is feasible and does not prolong the time needed for treatment decision.
Keywords:
p53 – endometrial cancer – molecular testing – POLE – mismatch-repair system
Autoři: Markéta Bednaříková 1,2
; J. Hausnerová 3; L. Minář 2; R. Taslerová 3; P. Vinklerová 2; L. Ehrlichová 1; J. Trizuljak 1,4; I. Blaháková 4; D. Princ 5; K. Matulová 3; P. Ovesná 6; O. Slabý 3,4,7; V. Weinberger 2
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Gynekologická a porodnická klinika LF MU a FN Brno 2; Ústav patologie, LF MU a FN Brno 3; CEITEC – Středoevropský technologický institut, MU Brno 4; Masarykův onkologický ústav, Brno 5; Institut biostatistiky a analýz, MU Brno 6; Ústav biologie, MU Brno 7
Vyšlo v časopise: Klin Onkol 2023; 36(3): 215-223
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccko2023215Souhrn
Východiska: Molekulární klasifikace přináší zásadní změny do diagnosticko-léčebného algoritmu u pacientek s karcinomem endometria (endometrial cancer – EC). Cílem sdělení je analýza prvních zkušeností se zavedením molekulárního testování do reálné klinické praxe. Materiál a metody: Od května 2021 je ve FN Brno u všech pacientek s nově diagnostikovaným EC v rámci standardního histopatologického vyšetření stanovován také imunohistochemicky status proteinů p53 a mismatch repair (MMR). U tumorů nesplňujících klinická kritéria pro nízké riziko a vždy při průkazu deficience MMR nebo mutace p53 je prováděno také molekulárně genetické testování genu POLE. U každé pacientky je vyhodnoceno riziko recidivy podle nejnovějších guidelines z roku 2020 a na jeho základě doporučen další postup. Všem pacientkám s MMR-deficientními tumory a/nebo pozitivní rodinnou anamnézou je doporučena také genetická konzultace. Výsledky: Do analýzy bylo od května 2021 do května 2022 zařazeno celkem 85 pacientek s mediánem věku 66 let. MMR-deficientní tumory mělo 22 pacientek (26 %) a p53-mutované tumory 8 pacientek (9 %). U žádné ze 40 pacientek v nenízkém riziku s provedenou analýzou mutačního stavu genu POLE nebyl prokázán ultramutovaný typ tumoru. Celkem 46 (51 %) pacientek mělo v době diagnózy nízké riziko, 2 pacientky (2 %) střední, 14 pacientek (16 %) vyšší střední a 20 pacientek (24 %) vysoké riziko recidivy. Celkem 6 pacientek (7 %) bylo diagnostikováno s pokročilým nebo metastatickým onemocněním. Medián doby od operace po projednání na multidisciplinární komisi byl 21 dní (8–36). Celkem 76 pacientek (90 %) absolvovalo léčbu v plném rozsahu v souladu s rizikem recidivy. Z 18 pacientek s dostupnými výsledky genetického vyšetření byla u 4 (22 %) prokázána hereditární forma onemocnění. Závěr: Racionálně indikované molekulární testování kombinující imunohistochemické analýzy proteinů MMR i p53 u všech pacientek s EC a sekvenační analýzu genu POLE u pacientek v nenízkém riziku recidivy je v běžné praxi proveditelné a neprodlužuje dobu nutnou pro rozhodnutí o adjuvantní léčbě.
Klíčová slova:
p53 – karcinom endometria – molekulární testování – POLE – mismatch repair systém
Úvod
Adenokarcinomy endometria (EC) představují výrazně heterogenní skupinu nádorů s často velmi odlišným biologickým chováním (tab. 1). Zásadní léčebnou modalitou je chirurgický výkon mající význam nejen kurativní, ale také stagingový. Zatímco u pacientek s nízkým rizikem recidivy je samotná operace považována za dostačující výkon, u pacientek nesplňujících kritéria pro nízké riziko je následně indikována adjuvantní léčba ať již ve formě radioterapie, chemoterapie, nebo kombinace obou metod, a to v návaznosti na míru rizika recidivy onemocnění [1]. Mezi základní prognostické parametry definující riziko rekurence patřily až do zavedení nové molekulární klasifikace stadium onemocnění v době diagnózy (tab. 2), histologický typ a přítomnost, nebo absence nádorové lymfangioinvaze (lymphovascular space invasion – LVSI) (tab. 3) [2].
Tab. 1. Histologické typy adenokarcinomu endometria, zjednodušené dělení podle [15]. ![Histologické typy adenokarcinomu
endometria, zjednodušené
dělení podle [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/47922d7c1cb857e2b0dc405d106f1257.png)
Tab. 2. TNM a FIGO klasifi kace karcinomů endometria [16]. ![TNM a FIGO klasifi kace karcinomů endometria [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5ef69898f6b6e253352c036660305f40.png)
FIGO – International Federation of Gynecology and Obstetrics, TNM – primární tumor, regionální lymfatické uzliny Tab. 3. Charakteristiky prognostických skupin pacientek s karcinomem endometria podle doporučení z roku 2016 a 2020 [2,8]. ![Charakteristiky prognostických skupin pacientek s karcinomem endometria podle doporučení z roku 2016 a 2020 [2,8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/58fcef89fbe22d93257a467f3946b872.png)
DOP_2016 – doporučení pro diagnostiku a léčbu karcinomu endometria z roku 2016, DOP_2020 – doporučení pro diagnostiku a léčbu karcinomu endometria z roku 2020, LVSI – nádorová lymfangioinvaze, MMRd – mismatch repair-defi cientní, NSMP – nespecifi cký molekulární profi l, POLEmut – ultramutované tumory s mutací genu POLE, p53abn – p53-mutovaný, R0 – operace s nulovym reziduem Molekulární klasifikace EC byla navržena v roce 2013 na základě výsledků komplexních genomických, transkriptomických a proteomických analýz a rozděluje karcinom endometria do čtyř skupin: 1) ultramutované tumory s patogenní variantou genu POLE; 2) hypermutované mikrosatelitově instabilní tumory; 3) copy-number high tumory většinově s přítomnou patogenní variantou genu TP53; 4) ostatní tumory, tzv. copy-number low. Kromě molekulárně biologických charakteristik se jednotlivé skupiny významně odlišují také svou biologickou povahou. Zatímco ultramutované nádory s patogenní variantou genu POLE mají vynikající prognózu, nádory patřící do skupiny copy-number high mají naopak prognózu nejhorší a skupiny hypermutovaných mikrosatelitně instabilních i copy-number low tumorů vykazují intermediární prognózu [3]. Vzhledem k finanční nákladnosti komplexního genomového profilování, relativně dlouhé době odezvy a stále ještě limitované dostupnosti v běžné klinické praxi byla následně navržena a na nezávislých souborech pacientek validována alternativní metodika molekulárního testování založená na molekulárně genetické sekvenční analýze genu POLE a imunohistochemickém stanovení exprese proteinů MMR (mismatch repair systému, tj. MLH1, MSH2, MSH6 a PMS2) a p53 [4–7].
Na základě robustních dat dokladujících prognostický význam molekulární klasifikace bylo v roce 2020 její stanovování inkorporováno do aktualizace evropských doporučení pro management pacientek s EC (DOP_2020). Tato doporučení definují kritéria pro zařazení pacientek do jednotlivých skupin podle míry rizika recidivy onemocnění jak v situaci, kdy molekulární klasifikace známa není, tak v situaci, kdy jsou výsledky molekulárního testování k dispozici (tab. 3) [8]. Oproti předchozím doporučením z roku 2016 (DOP_2016) přinesla DOP_2020 některé zásadní změny. Vedle modifikace klinických prognostických parametrů (např. přesunutí stadia II z vysokého do vyššího středního rizika) je to především fakt, že průkaz patogenní sekvenční varianty v genu POLE svědčící pro ultramutovaný typ tumoru nebo mutovaný stav genu TP53 zásadním způsobem ovlivňují terapeutický přístup u pacientek s nově diagnostikovaným EC. Nejenom pacientky v klinickém stadiu IA, ale i pacientky ve stadiu IB a II s POLE-ultramutovanými tumory jsou bez ohledu na další parametry zařazeny do skupiny s nízkým rizikem bez nutnosti adjuvantní terapie. Naopak tumory s aberantní expresí p53 (resp. mutací TP53) a prokázanou invazí do myometria jsou i při diagnóze ve stadiu IA bez ohledu na histologický typ zařazeny do skupiny s vysokým rizikem, kdy je standardně doporučena adjuvantní léčba (tab. 3) [8]. V roce 2021 bylo publikováno také společné národní doporučení čtyř odborných společností České lékařské společnosti J. E. Purkyně (ČLS JEP) detailně popisující metodiku molekulárního testování EC v podmínkách ČR [9].
Cílem předkládané práce je analýza prvních zkušeností s prospektivním stanovováním molekulárního testování u pacientek s nově diagnostikovaným EC a vyhodnocení přínosu zavedení molekulární klasifikace do reálné klinické praxe.
Materiál a metody
Od jara roku 2021 je molekulární testování EC ve FN Brno prováděno prospektivně v rámci standardního histopatologického vyšetření vždy, pokud je k dispozici dostatečně reprezentativní vzorek tumoru pro imunohistochemické a molekulárně genetické analýzy. Vyšetření jsou prováděna na vzorcích tumoru odebraných při operaci, fixovaných formaldehydem a zalitých v parafínu (formalin-fixed parafin-embeded – FFPE). Pokud nebyl operační výkon proveden, jsou vyšetření v indikovaných případech doplněna ze vzorků získaných při diagnostickém výkonu.
Proteiny p53 a MMR jsou stanovovány imunohistochemicky (IHC) u všech pacientek s nově diagnostikovaným EC.
Metodika IHC analýzy p53
K imunohistochemické analýze byla použita komerčně dostupná protilátka p53 (klon D0-7, 1 : 200; Agilent, USA) a automatický systém Ventana BenchMark Ultra. Dle míry exprese proteinu je nález hodnocen jako wild type (fokálně slabá disperzní jaderná pozitivita) či mutovaný typ exprese (silná jaderná exprese ve více než 80 % nádorových buněk, nulová jaderná exprese či cytoplazmatická exprese).
Metodika IHC analýzy MMR
K imunohistochemické analýze byly použity komerčně dostupné protilátky MSH2 (klon BSB-147, 1 : 50; BioSB, USA), MLH1 (klon ES05, RTU; Agilent, USA), PMS2 (klon EP51, RTU; Agilent, USA), MSH6 (klon PU29, 1 : 70; Novocastra, Leica Biosystems Newcastle Ltd, Anglie) a automatický systém Ventana BenchMark Ultra. Hodnocení a interpretace výsledků se řídí dle doporučení College of American Pathologists.
Metodika analýzy mutačního stavu genu POLE
Mutační stav genu POLE je vyšetřován u všech tumorů s výjimkou těch, které splňují kritéria pro zařazení do skupiny s nízkým rizikem recidivy, tj. low-grade endometroidní karcinomy s hloubkou invaze do méně než poloviny šířky myometria, bez podstatné LVSI (tab. 3). V případě průkazu MMRd a/nebo p53MUT je mutační stav genu POLE došetřen bez ohledu na klinické parametry, a to pro dořešení případných double či multiple classifiers.
Po identifikaci vhodného FFPE bloku k analýze a zhodnocení procentuálního zastoupení nádorových buněk erudovaným patologem je izolována genomová DNA s podílem nádorové DNA ≥ 50 %. Amplifikace a sekvenční analýza exonů 9–14 genu POLE (dle referenční sekvence NM_006231.4) se řídí aktuálními standardy vydávanými Společností českých patologů ČLS JEP a aktuální verzí National Comprehensive Cancer Network (NCCN) guidelines. Jednotlivé sekvence použitých primerů (Generi Biotech, Česká republika) jsou uvedeny v tab. 4. Nález je hodnocen jako negativní v případě, že nebyla detekována žádná z dosud popsaných patogenních sekvenčních variant genu POLE v exonech 9–14, nebo jako pozitivní v případě, že byla detekována některá z dosud popsaných patogenních sekvenčních variant genu POLE v exonech 9–14.
Tab. 4. Sekvence použitých primerů. 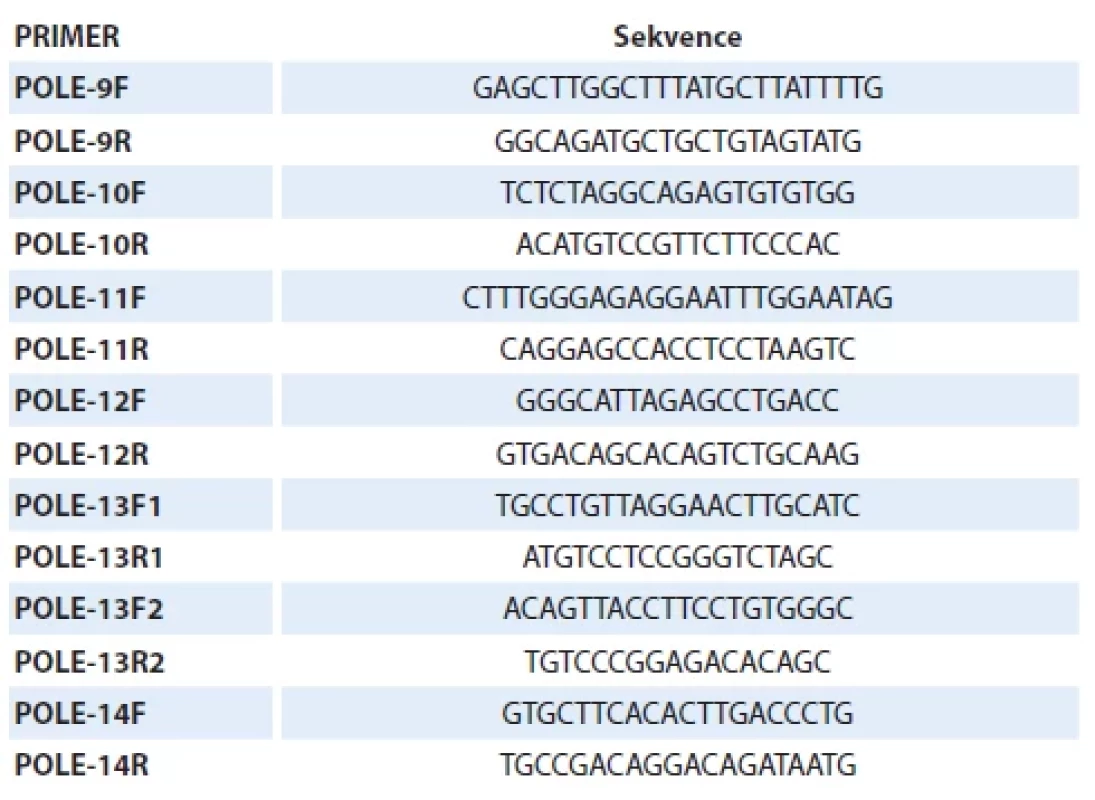
Stanovení molekulárního subtypu EC
Specifikace molekulárního subtypu EC je reportována u tumorů, které mají stanoveny všechny potřebné parametry, tj. status MMR, p53 a mutační stav genu POLE. V souladu s národním doporučením je používána terminologie [9]:
- POLE-ultramutovaný typ tumoru – průkaz známých patogenních variant v exonu 9–14 genu POLE
- MMR-deficientní typ – průkaz deficience MMR a současně POLEwt při jakémkoli statusu p53
- p53-mutovaný typ – p53-aberantní fenotyp a současně MMR proficience i POLEwt
- s nespecifickým molekulárním profilem
Stratifikace pacientek podle míry rizika recidivy
Na základě stagingu, histologického typu, gradingu, stanovení LVSI a výsledků molekulárního testování je pacientka v rámci projednání dalšího postupu na Indikační onkogynekologické komisi (IOGK) zařazena do příslušné rizikové skupiny podle DOP_2020 (tab. 3) [8]. Pokud bylo provedeno kompletní molekulární testování včetně analýzy genu POLE, je definitivní riziko stanoveno na základě DOP_2020 – Molekulární klasifikace známa. V situacích, kdy by případný průkaz patogenní varianty genu POLE neměnil léčebný postup, jako jsou tumory splňující kritéria pro nízké riziko, nebo naopak diseminované tumory v době diagnózy, je riziko stanoveno na základě klinických parametrů (tab. 3).
Kritéria pro indikaci genetické konzultace
Všem pacientkám s MMR-deficientními tumory a/nebo s pozitivní rodinnou anamnézou je v rámci projednání na IOGK doporučena také genetická konzultace k vyloučení hereditární formy onemocnění.
Soubor pacientek
Do analýzy byly zařazeny všechny pacientky Onkogynekologického centra FN Brno s nově diagnostikovaným EC v období květen 2021 – květen 2022. Pro posouzení významu začlenění molekulárního testování do klinické praxe byly pacientky retrospektivně zařazeny do některé z prognostických skupin také podle předchozích doporučení DOP_2016 (tab. 3) a výsledky stratifikací podle jednotlivých doporučení byly porovnány [2].
Statistická analýza
K popisu charakteristik pacientek a tumorů byly použity absolutní a relativní četnost pro kategoriální proměnné a pro spojité medián a mezikvartilové rozpětí. Vzhledem k tomu, že se jednalo o deskriptivní studii, nebylo provedeno žádné statistické testování.
Výsledky
Do analýzy bylo zařazeno celkem 85 pacientek s mediánem věku 66 let, z toho 58 (68 %) v klinickém stadiu I, 7 (8 %) ve stadiu II, 16 (19 %) ve stadiu III a 4 (5 %) ve stadiu IV. Celkem 67 (79 %) pacientek mělo low-grade endometroidní karcinom, 13 (15 %) high-grade endometroidní karcinom a 5 (6 %) non-endometroidní karcinomy (tab. 5). I přes implementaci molekulárního testování byl medián doby od operace po projednání na IOGK 21 dní (8–36).
Tab. 5. Klinické charakteristiky souboru. 
BMI – body mass index, HG – high-grade, IOGK – indikační onkogynekologická komise, IQR – medzikvartilové rozpětí, LG – low-grade, n – počet případů Výsledky molekulárního testování byly následující: celkem 22 pacientek (26 %) mělo MMR-deficientní tumory a 8 pacientek (9 %) p53-mutované tumory. U žádné ze 40 pacientek v nenízkém riziku s provedenou analýzou mutačního stavu genu POLE nebyl prokázán ultramutovaný typ tumoru. U jedné pacientky nebyl vyšetřen status p53 a u dvou pacientek v nenízkém riziku nebyla provedena analýza genu POLE (tab. 6). V obou případech se jednalo o tumory diagnostikované v klinickém stadiu IVB, kdy doplnění molekulárních analýz by nevedlo ke změně terapeutického postupu. Z pohledu zařazení pacientek do skupin dle míry rizika recidivy podle DOP_2020 bylo 46 pacientek (51 %) v nízkém riziku, 2 pacientky (2 %) ve středním, 14 pacientek (16 %) ve vyšším středním a 20 pacientek (24 %) ve vysokém riziku. Celkem 6 pacientek (7 %) bylo diagnostikováno s pokročilým nebo metastatickým onemocněním.
Tab. 6. Výsledky molekulárního testování. 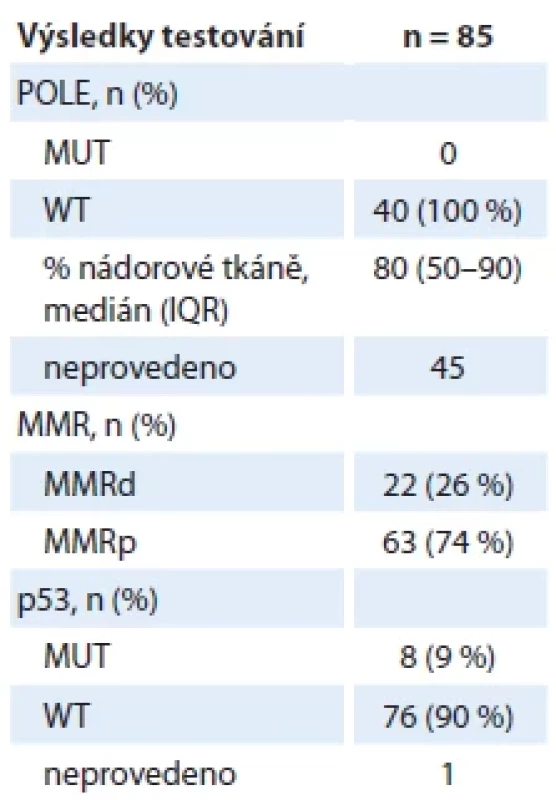
U 76 pacientek (90 %) byl léčebný postup stanoven i dokončen plně v souladu s DOP_2020 podle míry rizika recidivy onemocnění [8]. U jedné pacientky (1 %) musela být doporučená adjuvantní léčba ukončena předčasně z důvodu nepřiměřené toxicity chemoterapie. Pouze u 8 pacientek (9 %) byla výsledná léčebná doporučení modifikována z důvodu celkového stavu nebo vůle pacientky, kdy navzdory riziku recidivy nebyla doporučená adjuvantní chemoterapie nebo radioterapie aplikována.
Při porovnání rozdílů ve stratifikaci pacientek podle míry rizika recidivy na základě DOP_2020 a předchozích DOP_2016 jsou patrné rozdíly v počtech zařazených pacientek prakticky ve všech rizikových skupinách s výjimkou pacientek diagnostikovaných s pokročilým nebo metastatickým onemocněním, kde se kritéria pro zařazení v mezidobí nijak nezměnila (graf 1) [2,8]. K modifikaci rizika oproti dříve užívanému doporučení došlo v našem pilotním souboru celkem u 11 (13 %) pacientek, z toho u 4 (36 %) na základě molekulárních charakteristik (konkrétně průkaz p53-mutovaného tumoru při absenci průkazu MMRd a nemutovaném stavu genu POLE) a u 7 (64 %) pacientek na základě změny v posuzování významnosti některého z klinických parametrů (tab. 7).
Graf 1. Predikce rizika podle DOP_2016 a DOP_2020 [2,8]. ![Predikce rizika podle DOP_2016 a DOP_2020 [2,8].](https://pl-master.mdcdn.cz/media/image_pdf/5bca72cc67fc938211efd94692ba0fce.png?version=1687009369)
Tab. 7. Molekulární klasifi kace karcinomu endometria – přehled publikovaných studií. 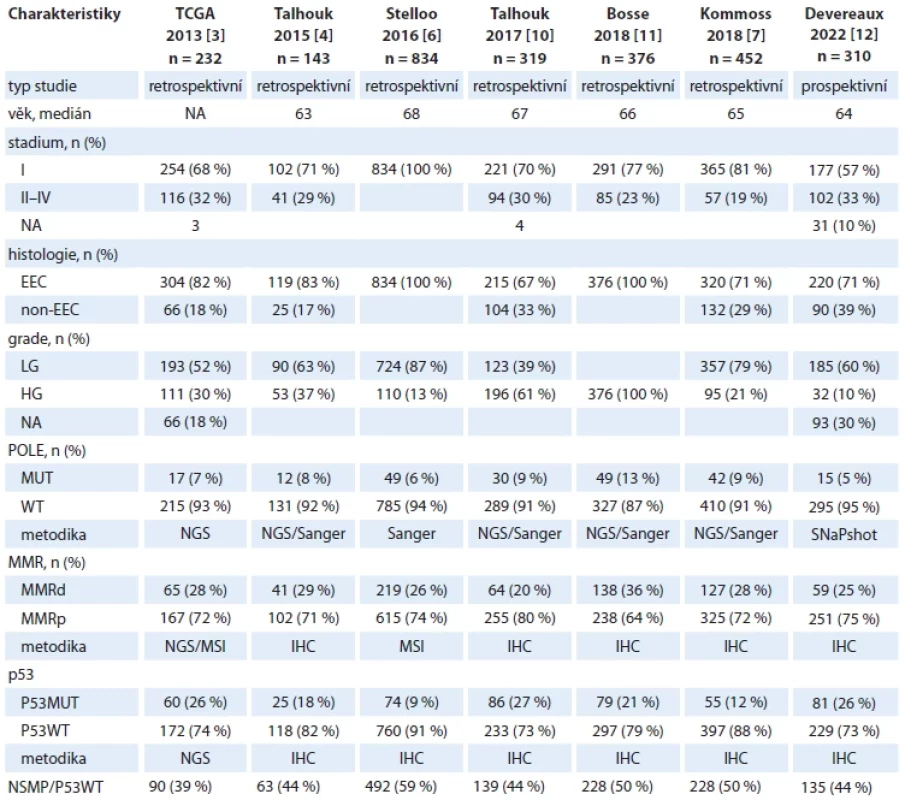
EEC – endometroidní karcinom, HG – high-grade, IHC – imunohistochemie, LG – low-grade, MMR – mismatch-repair system, MMRd – MMR-defi cientní, MSI –mikrosatelitní instabilita, MUT – mutovaný, n – počet, NA – nestanoveno, NGS – sekvenování nové generace, non-EEC – non-endometroidní karcinom, NSMP – s nespecifi ckým molekulárním profi lem, Sanger – analýza metodou Sangerova sekvenování, SNaPshot – single nucleotide polymorphism analyses, WT – wild type Genetická konzultace byla nabídnuta celkem 24 pacientkám z celého souboru – 22 pacientkám na základě průkazu MMR-deficientního tumoru a 2 pacientkám s MMR-proficientními tumory pro rodinnou zátěž. V době analýzy byly známy výsledky genetického vyšetření u 18 pacientek, z nichž u 4 (22 %) bylo prokázáno nosičství patogenní varianty v některém z genů asociovaných s Lynchovým syndromem, u 8 (45 %) byl výsledek negativní a u 6 (33 %) pacientek byla detekována varianta nejasného klinického významu.
Diskuze
Aktualizace DOP_2020 obsahující implementaci molekulární klasifikace přináší zásadní změny do managementu pacientek s nově diagnostikovaným karcinomem endometria [8]. Předkládaná analýza shrnuje pilotní zkušenosti s aplikací těchto doporučení do běžné klinické praxe ve FN Brno. V návaznosti na publikovaná národní doporučení pro molekulární testování u karcinomu endometria jsme se v rámci Mezioborové pracovní skupiny pro onkogynekologii dohodli na algoritmu vyšetření a v průběhu jara 2021 bylo zahájeno molekulární testování jako nedílná součást rutinního histopatologického vyšetření. Námi zvolená metodika molekulárního testování reflektuje klinickou potřebu a vychází z úvahy, že vyšetření mutačního stavu genu POLE není nutné provádět paušálně, protože u pacientek s EC splňujících klinická kritéria pro nízké riziko recidivy nemění případná znalost o ultramutovaném typu tumoru klinický postup, kterým je doporučení dispenzarizace po operačním výkonu bez nutnosti adjuvantní léčby. Vyšetření stavu p53 a MMR indikujeme u všech pacientek s nově diagnostikovaným EC. Průkaz p53-mutovaného typu tumoru totiž automaticky zařazuje pacientku do skupiny s vysokým rizikem, kdy je standardně doporučována adjuvantní léčba ve snaze o redukci rizika recidivy onemocnění. Průkaz MMR-deficientního tumoru sice podle aktuálních doporučení neovlivňuje zařazení pacientky do některé z rizikových skupin, ale umožňuje identifikaci pacientek, u nichž je indikováno další došetření k vyloučení hereditární formy onemocnění. Při zohlednění počtu nových pacientek v našem centru a potřebě rychlého zavedení molekulárního testování jsme se dohodli, že v úvodní fázi budeme status p53 a MMR stanovovat v souladu s národním doporučením imunohistochemicky a mutační stav genu POLE metodou Sangerova sekvenování. Sekvenování nové generace využíváme v současnosti u pacientek s EC při vyčerpaných možnostech standardní systémové léčby podávané s paliativním záměrem, a to v rámci pátrání po eventuální targetovatelné lézi v situacích, kdy je pacientka stále kandidátkou aktivního terapeutického přístupu.
Jak dokladují naše první zkušenosti, námi zvolená metodika je v praxi proveditelná a nijak neprodlužuje dobu nutnou k projednání dalšího postupu v rámci primární léčby u pacientek s nově diagnostikovaným EC (medián doby od data diagnózy do projednání dalšího postupu s výsledky histologie byl v našem souboru 21 dní (tab. 5). Při hodnocení pilotních výsledků v kontextu s dosud publikovanými daty můžeme konstatovat, že věkové složení naší kohorty (medián věku 66 let) i proporcionální rozložení jednotlivých stadií v době diagnózy (68 % diagnostikováno ve stadiu I a 32 % ve stadiu II–IV) odpovídá klinickým parametrům souborů v dosud publikovaných retrospektivních analýzách [3,4,6,7,10,11] i ve vůbec první práci popisující zkušenosti s prospektivním stanovováním molekulární klasifikace u EC [12] (tab. 5 a 8).
Skutečnost, že v našem souboru nebyla zachycena žádná pacientka s ultramutovaným typem tumoru, může být vysvětlena především relativně malou velikostí naší pilotní kohorty v porovnání s velikostí souborů pacientek v rámci dosud publikovaných studií, obzvláště vezmeme-li do úvahy udávanou frekvenci těchto typů tumorů (5–13 %; tab. 8). Podle dosud publikovaných dat se POLE-ultramutované tumory vyskytují především u pacientek s endometroidními tumory, a to u tumorů s vysokým i nízkým gradem. Např. ve studii Stelloo et al. bylo 49 % pacientek s POLE-ultramutovaným typem tumoru ve skupině s nízkým rizikem recidivy [6]. Je tedy evidentní, že řada pacientek s potenciálně POLE-ultramutovaným tumorem nebyla v našem souboru vůbec testována, neboť znalost výsledku testování by nezměnila náš klinický postup. Velký důraz je kladen na dostatečné procentuální zastoupení nádorové tkáně ve vzorku vybraném patologem pro účely Sangerova sekvenování, a to vzhledem k možné limitaci této metody v senzitivitě záchytu patogenních variant. Udávaný detekční limit námi užívané metodiky je 15–20 % mutované alely, tj. nejméně 30–40 % buněk s mutací. Při mediánu 80 % nádorové tkáně ve vzorcích určených k testování POLE v naší pilotní kohortě nepředpokládáme významný podíl falešně negativních výsledků (tab. 6). Navíc výsledky studie Temko et al. dokladují, že somatické patogenní varianty exonukleázové domény genu POLE vznikají velmi časně v průběhu kancerogeneze a jsou detekovatelné již v prekurzorových lézích. Nepředpokládá se tedy významný podíl falešně negativních výsledků při analýze mutačního stavu POLE v důsledku heterogenity tumoru [13].
Relativně nízký podíl pacientek s p53-mutovaným typem tumoru v našem souboru (n = 8, tj. 9 %) je vysvětlitelný zejména nízkým podílem pacientek s non-endometroidními karcinomy, resp. serózními karcinomy (tab. 6). Tato hodnota je v naprosté korelaci s výsledky studie Stelloo et al., ve které byly retrospektivně analyzovány pacientky ze studií PORTEC-1 a PORTEC-2, tj. pouze s endometroidními karcinomy při podílu HG tumorů 13 % (tab. 8).
Podíl pacientek s MMR-deficientními tumory 26 % (tab. 6) je plně v souladu s výsledky dosud publikovaných studií (tab. 8). Vysoký záchyt pacientek s hereditární formou EC při genetickém testování indikovaném na základě průkazu MMR-deficientního tumoru a/nebo rodinné anamnézy (22 %) dokladuje oprávněnost námi zvolených kritérií ke genetické konzultaci i skutečnost, že plošné zavedení testování MMR u všech pacientek s nově diagnostikovaným EC napomáhá identifikovat pacientky s dědičnou dispozicí ke vzniku nádorových onemocnění.
Konkordance mezi skutečně absolvovanou léčbou a léčbou doporučenou v návaznosti na zařazení pacientky do rizikové skupiny podle recentních evropských doporučení s využitím molekulárního testování (89 %) je v našem pilotním souboru vysoká, vyšší než např. v holandské studii posuzující compliance lékařů s aplikací doporučených postupů v běžné klinické praxi [14]. Naše pilotní zkušenosti tak dokladují praktickou realizovatelnost nových doporučení pro management pacientek s EC. Významnost změn, které tato nová doporučení přináší, ilustruje porovnání s predikcí rizika recidivy podle předchozího DOP_2016 (graf 1) [2] a také detailní charakteristika parametrů, které byly důvodem pro změnu ve stratifikaci rizika u jednotlivých případů (tab. 7).
Hlavním kladem naší pilotní studie je skutečnost, že se jedná o první práci svého druhu vyhodnocující pragmatickou implementaci molekulárního testování do běžné klinické praxe u pacientek s nově diagnostikovaným karcinomem endometria, kdy jsou stanovovány parametry p53 a MMR u všech pacientek a mutační stav genu POLE je vyhodnocován pouze u pacientek s nenízkým rizikem recidivy onemocnění. Relativním nedostatkem je velikost souboru podmíněná faktem, že se jedná o pilotní studii vyhodnocující dosavadní zkušenosti před případnou modifikací zavedeného postupu.
Závěr
Pilotní analýza našich zkušeností s implementací molekulárního testování u pacientek s nově diagnostikovaným karcinomem endometria dokladuje, že kombinace imunohistochemických analýz proteinů MMR a p53 u všech pacientek a sekvenační analýzy genu POLE u pacientek v nenízkém riziku je v běžné klinické praxi proveditelné a neprodlužuje dobu nutnou k rozhodnutí o adjuvantní léčbě. Stanovování nových markerů v rámci molekulárního testování pomáhá identifikovat pacientky se špatnou, nebo naopak excelentní prognózou (p53-mutované tumory, resp. ultramutované tumory s patogenní variantou genu POLE), a lépe tak cílit doporučení stran případné adjuvantní léčby. Samotný výsledek analýzy proteinů MMR sice doposud neměl vliv na volbu optimální strategie v rámci primární léčby, nicméně její plošné provádění u všech pacientek s nově diagnostikovaným karcinomem endometria napomáhá v širším kontextu identifikovat ty pacientky, které jsou nosičkami dědičné dispozice ke vzniku nádorových onemocnění.
Dedikace
Podpořeno MZČR-RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Markéta Bednaříková
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: bednarikova.marketa@fnbrno.cz
Obdrženo/Submitted: 29. 1. 2023
Přijato/Accepted: 7. 2. 2023Klin Onkol 2023; 36(3): 215 – 223
Zdroje
1. Modrá kniha České onkologické společnosti. [online]. Dostupné z: https: //www.linkos.cz/lekar-a-multidisciplinarni-tym/personalizovana-onkologie/modra-kniha-cos/aktualni-vydani-modre-knihy/.
2. Colombo N, Preti E, Landoni F et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 (Suppl 6): vi33–vi38. doi: 10.1093/annonc/mdt353.
3. The Cancer Genome Atlas Research Network. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497 (7447): 67–73. doi: 10.1038/nature12113.
4. Talhouk A, McConechy MK, Leung S et al. A clinically applicable molecular-based classification for endometrial cancers. Br J Cancer 2015; 113 (2): 299–310. doi: 10.1038/bjc.2015.190.
5. León-Castillo A, de Boer SM, Powell ME et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: impact on prognosis and benefit from adjuvant therapy. J Clin Oncol 2020; 38 (29): 3388–3397. doi: 10.1200/JCO.20.00549.
6. Stelloo E, Nout RA, Osse EM et al. Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer-combined analysis of the PORTEC cohorts. Clin Cancer Res 2016; 22 (16): 4215–4224. doi: 10.1158/1078-0432.CCR-15-2878.
7. Kommoss S, McConechy MK, Kommoss F et al. Final validation of the ProMisE molecular classifier for endometrial carcinoma in a large population-based case series. Ann Oncol 2018; 29 (5): 1180–1188. doi: 10.1093/annonc/mdy058.
8. Concin N, Matias-Guiu X, Vergote I et al. ESGO/ ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2020; 31 (1): 12–39. doi: 10.1136/ijgc-2020-002230.
9. Dundr P, Cibula D, Doležel M et al. Molecular testing in endometrial carcinoma – joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists. Ceska Gynekol 2021; 86 (4): 264–272. doi: 10.48095/cccg2021264.
10. Talhouk A, McConechy MK, Leung S et al. Confirmation of ProMisE: a simple, genomics-based clinical classifier for endometrial cancer: molecular classification of EC. Cancer 2017; 123 (5): 802–813. doi: 10.1002/cncr.30496.
11. Bosse T, Nout RA, McAlpine JN et al. Molecular classification of grade 3 endometrioid endometrial cancers identifies distinct prognostic subgroups. Am J Surg Pathol 2018; 42 (5): 561–568. doi: 10.1097/PAS.0000000000001 020.
12. Devereaux KA, Weiel JJ, Pors J et al. Prospective molecular classification of endometrial carcinomas: institutional implementation, practice, and clinical experience. Mod Pathol 2022; 35 (5): 688–696. doi: 10.1038/s41379-021-00963-y.
13. Temko D, Van Gool IC, Rayner E et al. Somatic POLE exonuclease domain mutations are early events in sporadic endometrial and colorectal carcinogenesis, determining driver mutational landscape, clonal neoantigen burden and immune response. J Pathol 2018; 245 (3): 283–296. doi: 10.1002/path.5081.
14. Eggink FA, Mom CH, Boll D et al. Compliance with adjuvant treatment guidelines in endometrial cancer: room for improvement in high risk patients. Gynecol Oncol 2017; 146 (2): 380–385. doi: 10.1016/j.ygyno.2017.05.025.
15. Kurman RJ, Carcangiu ML, Herrington CS et al. WHO classification of tumours of female reproductive organs. International Agency for Research on Cancer 2014.
16. Brierley J, Gospodarowicz MK, Wittekind C et al. TNM klasifikace zhoubných novotvarů. [online]. Available from: https: //dwn.alza.cz/ebook/nahled/pdf2/EK34089.
17. Colombo N, Creutzberg C, Amant F et al. ESMO-ESGO-ESTRO consensus conference on endometrial cancer: diag - nosis, treatment and follow-up. Radiother Oncol 2015; 117 (3): 559–581. doi: 10.1016/j.radonc.2015.11.013.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2023 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Waldenströmova makroglobulinemie, monoklonální gamapatie a Dr. Kyle
- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Etnické rozdiely v incidencii zhubných nádorov detí
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Hypoplastická forma myelodysplastické neoplazie
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Kvantitatívne profilovanie génov asociovaných s dráhami vzniku mozgových nádorov
- Psychologická péče reflektující průběh a specifika virové infekce SARS-CoV-2 u onkologických pacientů s oxygenační poruchou – série kazuistik
- Efekt imunoterapie u mladého pacienta s mismatch repair deficientním karcinomem rekta – kazuistika
- Hepatosplenický T-lymfom s přítomností masivní splenomegalie a pancytopenie – kazuistika
- Nová naděje pro pacienty s metastatickým uveálním melanomem
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Hypoplastická forma myelodysplastické neoplazie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



