-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kapecitabin v léčbě análního spinocelulárního karcinomu
Capecitabine in the treatment of anal squamous cell carcinoma
Background: Anal squamous cell carcinoma (ASCC) is a rare tumor; it accounts for about 2% of gastrointestinal tumors. The goal of the treatment is to preserve the anal sphincter and maintain the quality of life; surgical excision is therefore reserved only for very early stages and in vast majority of cases concomitant chemoradiotherapy (CRT) is indicated, i.e. pelvic irradiation and concomitant mitomycin-based chemotherapy. Technological development in the field of radiodiagnostics, nuclear medicine and radiation therapy has improved the disease staging and enabled more gentle treatment. The standard regimen of chemotherapy has been based on the combination of mitomycin C (MMC) with 5-fluorouracil (5-FU) for many years, with high toxicity. Purpose: The administration of 5-FU + capecitabine regimen provided an opportunity to reduce acute haematological toxicity. A prospective randomized phase II trial EXTRA demonstrated the oncological safety and good toxicity profile of oral capecitabine administered instead of 5-FU. The reduction of severe haematological toxicity and oncological non-inferiority of the capecitabine regimen was also demonstrated by other nine analyses presented in this article. Conclusion: Most international guidelines published by societies such as the National Comprehensive Cancer Network, the European Society for Medical Oncology or the European Society for Therapeutic Radiology and Oncology have accepted capecitabine as a safe alternative to 5-FU in the treatment of ASCC and CRT regimen with oral capecitabine becoming the standard. The advantages are: proven excellent treatment results (non-inferiority towards standard regimens), significant reduction of various types of toxicity and the convenience of outpatient oral capecitabine.
Keywords:
anal cancer – concomitant chemoradiotherapy – mitomycin C – capecitabine – 5-fluorouracil
Autoři: Lohynská Radka 1,2; Pechačová Zdeňka 2
Působiště autorů: Onkologická klinika 1. LF UK a FTN, Praha 1; Ústav radiační onkologie 1. LF UK a FN Bulovka, Praha 2
Vyšlo v časopise: Klin Onkol 2022; 35(1): 38-43
Kategorie: Přehledy
doi: https://doi.org/10.48095/ccko202238Souhrn
Východiska: Dlaždicový anální karcinom (anal squamous cell carcinoma – ASCC) patří mezi vzácné nádory; tvoří zhruba 2 % nádorů zažívacího traktu. Cílem léčby ASCC je zachování funkčního análního svěrače a udržení co nejlepší kvality života – chirurgická excize je proto rezervována pouze pro velmi časná stadia a ve většině případů je v léčbě ASCC užívána konkomitantní chemoradioterapie (CHRT) – ozáření tumoru a spádových lymfatik s konkomitantním podáním chemoterapie na bázi mitomycinu v kombinaci s fluoropyrimidiny. Technologický rozvoj v oblasti radiodiagnostiky, nukleární medicíny a radioterapeutických metod umožnil zpřesnění stagingu i šetrnější provádění léčby. Standardním režimem CHRT byla po mnoho let kombinace mitomycinu C (MMC) s 5-fluorouracilem (5-FU), tento režim je však zatížen vysokou toxicitou. Cíl: Zařazení režimu 5-FU + kapecitabin přineslo možnost snížení akutní hematologické toxicity. Prospektivní randomizovaná studie fáze II EXTRA jako první prokázala onkologickou bezpečnost a příznivý profil toxicity perorálního kapecitabinu aplikovaného místo 5-FU. Redukci závažné hematologické toxicity i onkologickou non-inferioritu režimu s kapecitabinem prokázalo dalších 9 analýz, které jsou ve sdělení prezentovány. Závěr: Většina mezinárodních doporučení, jako National Comprehensive Cancer Network, European Society for Medical Oncology, European Society of Surgical Oncology, European Society for Therapeutic Radiology and Oncology, French Intergroup a British National Guidelines, zařadila kapecitabin jako bezpečnou alternativu k 5-FU v léčbě análního karcinomu. Výhodou jsou prokázané výborné léčebné výsledky (non-inferiorita ve srovnání se standardními režimy), významná redukce toxicity i pohodlnost ambulantního podání perorálního kapecitabinu.
Klíčová slova:
anální karcinom – konkomitantní chemoradioterapie – mitomycin C – kapecitabin – 5-fluorouracil
Úvod
Dlaždicový anální karcinom (anal squamous cell carcinoma – ASCC) patří mezi vzácné nádory – tvoří zhruba 2 % nádorů zažívacího traktu. V roce 2018 byla incidence v ČR 1,54/100 000 obyvatel a mortalita činila 0,75/100 000 obyvatel. Incidence mírně narůstá [1]. Častější je výskyt ASCC u žen, nejčastěji bývá diagnostikován ve věku 60–75 let. Zhoubné nádory postihují anální kanál nebo anální okraj (kůže do 5 cm od análního kanálu). V oblasti análního kanálu se mohou vyskytnout i jiné histologické typy, druhý nejčastější je adenokarcinom (10 %) a melanom (< 5 %). Etiologicky se kromě vysoce rizikových papilomavirů uplatňuje vliv kouření a imunosuprese (způsobená věkem, závažnými komorbiditami a stavy po transplantacích orgánů či v souvislosti s přítomností jiné malignity) [2,3].
Cílem léčby ASCC je zachování funkčního análního svěrače s udržením co nejlepší kvality života nejen po léčbě, ale i během kurativní radioterapie (RT) či chemoradioterapie (CHRT). Standardem léčby pokročilejších tumorů je CHRT – ozáření tumoru a spádových lymfatik s konkomitantním podáním chemoterapie (CHT) na bázi fluoropyrimidinů a mitomycinu [4]. Chirurgická excize je vyhrazena pouze pro definovanou podskupinu velmi časných stadií. V paliativních režimech se uplatňuje především fluorouracil v kombinaci s cisplatinou [5] a recentně i imunoterapie [6].
Ačkoli incidence ASCC narůstá, mortalita se nezvyšuje [1], k čemuž přispívá pokrok v podobě technologického rozvoje zobrazovacích metod radiodiagnostiky, nukleární medicíny a v zásadní míře užití přesnějších a šetrnějších technik v radiační onkologii. Zpřesnění vstupního stagingu a stanovení cílových objemů pro radioterapii (RT) umožnilo využití PET/CT [7]. Zlepšení úspěšnosti léčby s dlouhodobým přežitím pacientů s sebou nese potřebu minimalizace toxicity léčby. Detailní definice cílových objemů s implementací moderních metod RT s modulovanou intenzitou svazku (radioterapie s modulovanou intenzitou záření (intensity modulated radiation therapy – IMRT), radioterapie s objemově modulovanou intenzitou (volumetric modulated arc therapy – VMAT) a technika simultánního integrovaného boostu (SIB)) umožnila přizpůsobit výši dávky riziku postižení uzlin (dose painting) a šetřit zdravé tkáně (tzv. organs at tisk) [7]. Individualizace v léčbě zahrnuje i užití vhodných režimů chemoterapie s ohledem na rozsah nádorového postižení, celkový stav a komorbidity pacienta. V současné době je tak při využití recentních poznatků možno radikálně léčit většinu pacientů ambulantně, se zachováním vysoké kvality života nejen v poléčebném období, ale i během vlastní léčby.
Režimy konkomitantní chemoterapie u ASCC
Standardním režimem chemoterapie bylo po dlouhá léta podání 1 či 2 cyklů chemoterapie mitomycin C (MMC) v i.v. dávce 12 mg (10 mg pro 2 cykly) / m2 v dny radioterapie 1 a 29 s kontinuálním i.v. podáním 5-fluorouracilu (5-FU) v dávce 1 000 mg/m2 v dny 1–4 a 29–32 radioterapie [5]. Nežádoucí účinky CHRT jsou hodnoceny podle kritérií Radiation Therapy Oncology Group – RTOG [8]. Mezi nejčastější vedlejší účinky CHRT patří kožní a hematologická toxicita, která u 60 % pacientů dosahuje ≥ G3 dle kritérií RTOG a u části pacientů vede k přerušení RT. Moderní techniky RT umožnily redukci toxicity kožní a gastrointestinální (GIT) bez prodloužení celkové doby léčebného režimu [7]. Závažná hematologická toxicita byla redukována se zavedením nového režimu mitomycin + kapecitabin, jak bude zdůvodněno dále.
Postavení kapecitabinu v režimech konkomitantní chemoterapie u ASCC
Byla provedena řada studií s cílem zhodnotit přínos kapecitabinu v léčbě ASCC (tab. 1).
Tab. 1. Přehled studií srovnávajících chemoradioterapii s konkomitantním podáním režimu MMC s kapecitabinem. 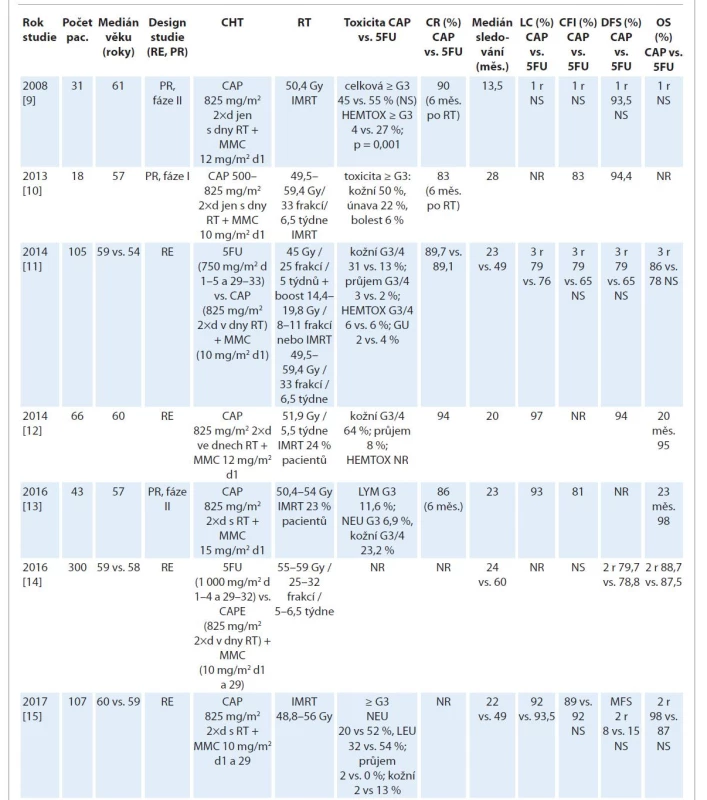
CAP – kapecitabin, cDDP – cisplatina, CFI – interval bez kolostomie, CIV – kontinuální intravenózní aplikace, CR – kompletní remise, d – den, DFS – přežití bez nemoci, 5FU – 5-fluorouracil, G – grade, Gy – Gray, HEMTOX – hematologická toxicita, CHT – chemoterapie, LC – lokální kontrola, LYM – lymfopenie, MMC – mitomycin C, NEU – neutropenie, NR – neuvedeno, NS – nesignifikantní rozdíl, OS – celkové přežití, p – pravděpodobnost, PR – prospektivní, r – rok, RE – retrospektivní, RT – radioterapie, TRO – trombocyty Tab. 1. Přehled studií srovnávajících chemoradioterapii s konkomitantním podáním režimu MMC s kapecitabinem. 
CAP – kapecitabin, cDDP – cisplatina, CFI – interval bez kolostomie, CIV – kontinuální intravenózní infuze, CR – kompletní remise, d – den, DFS – přežití bez nemoci, 5FU – 5-fluorouracil, G – grade, Gy – Gray, HEMTOX – hematologická toxicita, CHT – chemoterapie, LC – lokální kontrola, LYM – lymfopenie, MMC – mitomycin C, NEU – neutropenie, NR – neuvedeno, NS – nesignifikantní rozdíl, OS – celkové přežití, p – pravděpodobnost, PR – prospektivní, r – rok, RE – retrospektivní, RT – radioterapie, TRO – trombocyty Prospektivní randomizovaná studie fáze II EXTRA [9] prokázala onkologickou bezpečnost a příznivý profil toxicity perorálního kapecitabinu aplikovaného místo 5-FU u 31 pacientů. Režim MMC 12 mg/m2 v den 1 s kapecitabinem (825 mg/m2 2x denně ve dnech RT) + RT 50,4 Gy v 28 frakcích během 5,5 týdne vedl u 58 % pacientů k dokončení CHRT dle plánu, bez prodloužení celkové doby léčby či redukce dávky. Průjem G3/4 se vyskytl u 3 % pacientů a neutropenie G3 u 10 % pacientů. Kompletní remise 4 týdny po ukončení RT dosáhlo 77 % pacientů a 16 % mělo parciální odpověď. Při mediánu sledování 14 měsíců se lokální recidiva vyskytla u 10 % pacientů [9].
Studie fáze I analyzovala dávku konkomitantní CHT s kapecitabinem a mitomycinem C u ASCC se SIB-IMRT (59,4 Gy v 33 frakcích / 6,5 týdne na oblast makroskopického postižení a 49,5 Gy v 33 frakcích / 6,5 týdne na elektivní lymfatické oblasti) [10]. MMC byl podán v i. v. dávce 10 mg/m2 (max. 15 mg) v den 1 a kapecitabin byl eskalován v dávkách 500 – –825 mg/m2 2x denně ve dny RT do limitující toxicity. Maximální tolerovaná dávka kapecitabinu byla stanovena na 825 mg/m2 2x denně. Mezi nejčastěji se vyskytující nežádoucí účinky patřila akutní kožní toxicita G ≥ 3 (50 %), únava (22 %) a bolest (6 %). Kompletní remise dosáhlo 83 % pacientů a u 17 % byla zjištěna parciální odpověď. S mediánem sledování 28 měsíců bylo 94,4 % pacientů bez známek progrese onemocnění [10].
Retrospektivní studie se 105 pacienty s kurativní CHRT u ASCC (T2 > 4 cm; T3, T4 N0-1 M0 nebo T1-4 N2-3 M0) srovnávala kontinuální 5-FU (750 mg/m2 v dny 1–5 a 29–33) vs. kapecitabin (825 mg/m2 2x denně ve dny RT) + MMC (10 mg/m2 v den 1) a RT (45 Gy v 25 frakcích na 5 týdnů + po 3 týdnech pauzy boost 14,4–19,8 Gy v 8–11 frakcích na oblast primárního tumoru a postižených uzlin) [11]. Kompletní remise dosáhlo 89,1 % pacientů s 5-FU a 89,7 % s kapecitabinem. Tříletá lokální kontrola byla 76 % s 5-FU a 79 % s kapecitabinem. Tříleté celkové přežití bylo 78 % s 5-FU a 86 % s kapecitabinem. Přežití bez nádoru bylo 65 % s 5-FU a 79 % s kapecitabinem. Analýza tak prokázala stejný účinek kapecitabinu ve srovnání s 5-FU v kombinaci s MMC. Zajímavé bylo hodnocení polymorfizmu genu pro thymidylát syntetázu (TYMS) a genu pro glutathion S-transferázu 1 (GSTT1) ve vztahu k závažné akutní toxicitě. Pacienti s nízkou expresí TYMS měli G3/4 toxicitu (kožní, GIT, genitourinární) 40 vs. 18 % u pacientů s genotypem vysoké exprese TYMS. Genotyp GSTT1 NULL byl také spojen s významně zvýšenou toxicitou (43 % G3/4 akutní kožní toxicita vs. 19 % u pacientů bez NULL genotypu) [11].
Další retrospektivní studie na 66 pacientech s mediánem sledování 20 měsíců popsala efekt CHT s kapecitabinem (825 mg/m2 2x denně ve dnech RT) a MMC (12 mg/m2 v den 1) s RT (medián dávky 51,9 Gy / 5,5 týdne) s dosažením kompletní remise u 94 % pacientů s ASCC [12].
Užití kapecitabinu (825 mg/m2 2x denně během dnů RT) místo 5-FU mělo ve studii fáze II [13] v kurativní kombinované CHRT u ASCC s MMC 15 mg/m2 v den 1 vysokou účinnost podobně jako standardní kombinace s 5-FU. Z 43 pacientů s mediánem follow-up 23,1 měsíce (4–44,4 měsíce) dosáhlo 86 % kompletní remise, 7 % parciální odpovědi a 7 % pacientů mělo progresi v 6 měsících od CHRT. Kolostomie byla zavedena u 18,6 % pacientů. Hlavní závažná akutní toxicita byla kožní G3/4 (23,2 %), a dále se vyskytla lymfopenie G3 (11,6 %) a neutropenie G3 (6,9 %) [13].
Retrospektivní analýza pacientů s ASCC stadia I–III léčených kombinací 5-FU + MMC vs. kapecitabin + MMC s kurativní CHRT 50–54 Gy u 300 pacientů [13] prokázala 2leté přežití bez nemoci 79,7 % pro kapecitabin + MMC (95% CI 71,1–88,3 %) vs. 78,8 % pro 5-FU + MMC (95% CI 73–84,6 %) a 2leté specifické přežití pro ASCC bylo 88,7 % pro kapecitabin + MMC (95% CI 81,8 – –95,5 %) vs. 87,5 % pro 5-FU + MMC (95% CI 82,8–92,2 %). Studie neshledala rozdíly v onkologických výsledcích léčby mezi 5-FU a kapecitabinem a vzhledem k perorálnímu podání kapecitabinu je nový režim pohodlnější a bezpečnější formou CHT bez potenciálních rizik spojených s kanylací centrálního cévního řečiště [14].
Redukce závažné hematologické toxicity s kapecitabinem byla prokázána i v další studii: G3 hematologická toxicita byla zaznamenána u 52 % v rameni s 5-fluorouracilem vs. 20 % v rameni s kapecitabinem [15].
Prospektivní hodnocení výsledků léčby ASCC v národní studii National Health Service ve Velké Británii [16] v roce 2015 proběhlo u 147 pacientů ze 40 center. Celkem 52 pacientů bylo léčeno režimem MMC + kapecitabin (kapecitabin 825 mg/m2 p. o. 2× denně po–pá + MMC 10 mg/m2 i.v. v dny 1 a 29) a 95 pacientů režimem MMC + 5-FU. Studie prokázala onkologickou non-inferioritu režimu s kapecitabinem. Celková toxicita G ≥ 3 byla nižší u kapecitabinu vs. 5-FU (45 vs. 55 %; p = 0,35), z čehož byla signifikantně nižší hematologická toxicita: G3 u kapecitabinu 4 vs. 27 % u 5-FU; p = 0,001 [16].
Kapecitabin jako alternativa 5-FU v CHRT análního karcinomu byl analyzován v retrospektivní studii ze Stanfordu u 68 pacientů [17]. Nebyl shledán rozdíl v 3letém celkovém přežití ani PFS mezi kapecitabinem a 5-FU: 94 vs. 80 % (p = 0,197) a 100 vs. 86 % (p = 0,051). Incidence lokální recidivy byla významně vyšší ve skupině s 5-FU (0 vs. 13 %, p = 0,042). Nesignifikantně kratší interval bez kolostomie byl nalezen ve skupině s 5-FU (97 vs. 87 %, p = 0,133). Toxicity byly mezi oběma skupinami srovnatelné. Nejčastěji se vyskytla akutní kožní reakce (G ≥ 2 u 77 %, bolest anální oblasti 78 % a průjem 56 %) [17].
Srovnání CHRT s cDDP (60–70 mg/m2 každých 21 dní) + kapecitabin (825 mg/m2 2x denně 5 dní v týdnu) místo 5-FU s IMRT u stadia I–III ASCC prokázalo při mediánu sledování 41 měsíců kompletní remise v 6 měsících u 93 % pacientů [18]. Přežití bez nemoci v 1, 2 a 3 letech bylo 89, 87 a 85 % a celkové přežití v 1 a 2 letech bylo 100 a 95 %. Interval bez kolostomie v 1 roce po léčbě byl 90 % a ve 2 letech 88 %. Výskyt akutní toxicity G3/4 byl popsán u 61 % (převážně kožní toxicita 46 % a hematologická toxicita 12 %) [18].
Metaanalýza 6 studií s 218 pacienty prokázala srovnatelný efekt kapecitabinu a 5-FU v kombinaci s MMC v kurativní CHRT nemetastatických ASCC [19]. Dávka kapecitabinu se pohybovala v rozmezí 500–825 mg/m2 2x denně po dobu 5 dní v týdnu během RT. Medián follow-up byl 21,5 měsíce (14–23 měsíců). Kompletní remise dosáhlo 91 % (87–95 %) pacientů. Lokální recidiva se vyskytla v rozmezí 3,2–21,0 %. Kapecitabin byl potvrzen jako onkologicky přijatelná a pro pacienty pohodlnější alternativa infuzního podání 5-FU [19].
Většina mezinárodních doporučení odborných společností, jako jsou National Comprehensive Cancer Network, European Society for Medical Oncology, European Society of Surgical Oncology, European Society for Therapeutic Radiology and Oncology, French Intergroup nebo British National Guidelines, přijala kapecitabin jako bezpečnou alternativu k 5-FU v léčbě ASCC [20–23].
Novým studovaným režimem v kurativní konkomitantní chemoradioterapii je kombinace XELOX-RT s kapecitabinem (825 mg/m2 2x denně v dny 1–5 v týdnu, celkem 6 týdnů) a oxaliplatinou (50 mg/m2 týdně). Studie fáze II pro ASCC stadia II–IIIB [23] byla vzhledem k toxicitě G3 (63 % pacientů) po léčbě prvních 11 pacientů (z 20 celkem) upravena a u dalších 9 pacientů byla v režimu vypuštěna chemoterapie 3. a 6. týden, což vedlo k redukci výskytu G3 toxicity na 22 % pacientů. Nebyl zaznamenán výskyt toxicity G4/5. Kompletní remise dosáhli všichni pacienti. Tříleté přežití bez nemoci bylo 90 %. Redukce chemoterapie v týdnech 3 a 6 neovlivnila onkologickou účinnost léčby [24]. Ačkoli jsou krátkodobé výsledky slibné, je třeba vyčkat dlouhodobějšího potvrzení účinku nového režimu CHT.
Závěr
Konkomitantní CHRT je standardním léčebným postupem u pokročilejších ASCC: je provedeno ozáření tumoru a spádových lymfatik s konkomitantním podáním CHT v kombinaci MMC a fluoropyrimidinu. Na základě výsledků dvou randomizovaných studií fáze II a četných retrospektivních a prospektivních studií se stala standardem konkomitantní CHT kombinace perorálního kapecitabinu s MMC, a to i navzdory tomu, že studie fáze III srovnávající konkomitantní CHRT s 5-FU + MMC vs. kapecitabin + MMC pro lokálně pokročilý ASCC nebyla provedena. Výhodou tohoto režimu jsou prokázané výborné léčebné výsledky (non-inferiorita ve srovnání se standardními režimy), příznivý bezpečnostní profil (bez rizika nefrotoxicity, bez ototoxicity nebo alopecie) s redukcí hematologické a kožní toxicity i pohodlnost ambulantního podání perorálního kapecitabinu. Většina mezinárodních odborných společností proto přijala kapecitabin jako bezpečnou alternativu k 5-FU v léčbě ASCC a zařadila režim CHRT s perorálním kapecitabinem do platných doporučení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Radka Lohynská, Ph.D.
Onkologická klinika
1. LF UK a FTN Praha
Vídeňská 800
140 59 Praha 4
e-mail: radka.lohynska@ftn.cz
Obdrženo/Submitted: 6. 3. 2021
Přijato/Accepted: 30. 5. 2021
Zdroje
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: https: //www.svod.cz/.
2. Šlampa P, Petera J. Radiační onkologie. Praha: Galén Karolinum 2007 : 145–152.
3. Krška Z, Hoskovec D, Petruželka L. Chirurgická onkologie. Praha: Grada 2014 : 565–572.
4. Národní radiologické standardy – radiační onkologie. Věstník Ministerstva zdravotnictví České republiky 2/2016. [online]. Dostupné z: https: //www.mzcr.cz/vestnik/vestnik-c-2-2016/.
5. Modrá kniha České onkologické společnosti. [online]. Dostupné z: https: //www.linkos.cz/lekar-a-multidisciplinarni-tym/personalizovana-onkologie/modra-kniha-cos/aktualni-vydani-modre-knihy/.
6. National Comprehensive Cancer Network. Anal Carcinoma (Version 1.2021). [online]. Available from: https: // www.nccn.org/professionals/physician_gls/pdf/anal.pdf.
7. Lohynská R, Nýdlová A, Drbohlavová T et al. Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu. Klin Onkol 2020; 33 (4): 288–294. doi: 10.14735/amko2020286.
8. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31 (5): 1341–1346. doi: 10.1016/0360-3016 (95) 00060-C.
9. Glynne-Jones R, Meadows H, Wan S et al. Extra – a multicenter phase II study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer. Int J Radiat Oncol Biol Phys 2008; 72 (1): 119–126. doi: 10.1016/j.ijrobp.2007.12.012.
10. Deenen MJ, Dewit L, Boot H et al. Simultaneous integrated boost-intensity modulated radiation therapy with concomitant capecitabine and mitomycin C for locally advanced anal carcinoma: a phase 1 study. Int J Radiat Oncol Biol Phys 2013; 85 (5): e201–e207. doi: 10.1016/j.ijrobp.2012.12.008.
11. Meulendijks D, Dewit L, Tomasoa NB et al. Chemoradiotherapy with capecitabine for locally advanced anal carcinoma: an alternative treatment option. Br J Cancer 2014; 111 (9): 1726–1733. doi: 10.1038/bjc.2014. 467.
12. Thind G, Johal B, Follwell M et al. Chemoradiation with capecitabine and mitomycin-C for stage I–III anal squamous cell carcinoma. Radiat Oncol 2014; 9 : 124. doi: 10.1186/1748-717X-9-124.
13. Oliveira SC, Moniz CM, Riechelmann R et al. Phase II study of capecitabine in substitution of 5-FU in the chemoradiotherapy regimen for patients with localized squamous cell carcinoma of the anal canal. J Gastrointest Cancer 2016; 47 (1): 75–81. doi: 10.1007/s12029-015-9 790-4.
14. Peixoto RD, Wan DD, Schellenberg D et al. A comparison between 5-fluorouracil/mitomycin and capecitabine/mitomycin in combination with radiation for anal cancer. J Gastrointest Oncol 2016; 7 (4): 665–672. doi: 10.21037/jgo.2016.06.04.
15. Goodman KA, Julie D, Cercek A et al. Capecitabine with mitomycin reduces acute hematologic toxicity and treatment delays in patients undergoing definitive chemoradiation using intensity modulated radiation therapy for anal cancer. Int J Radiat Oncol Biol Phys 2017; 98 (5): 1087–1095. doi: 10.1016/j.ijrobp.2017.03.022.
16. Jones CM, Adams R, Downing A et al. Toxicity, tolerability, and compliance of concurrent capecitabine or 5-fluorouracil in radical management of anal cancer with single-dose mitomycin-C and intensity modulated radiation therapy: evaluation of a national cohort. Int J Radiat Oncol Biol Phys 2018; 101 (5): 1202–1211. doi: 10.1016/j.ijrobp.2018.04.033.
17. Pumpalova Y, Kozak MM, von Eyben R et al. Comparison of definitive chemoradiation with 5-fluorouracil versus capecitabine in anal cancer. J Gastrointest Oncol 2019; 10 (4): 605–615. doi: 10.21037/jgo.2019.02.17.
18. Rotundo MS, Zampino MG, Ravenda PS et al. Cisplatin plus capecitabine concomitant with intensity-modulated radiation therapy in non-metastatic anal squamous cell carcinoma: the experience of a single research cancer center. Ther Adv Med Oncol 2020; 12 : 1758835920940945. doi: 10.1177/1758835920940945.
19. Souza KT, Pereira AA, Araujo RL et al. Replacing 5-fluorouracil by capecitabine in localised squamous cell carcinoma of the anal canal: systematic review and meta-analysis. Ecancermedicalscience 2016; 10 : 699. doi: 10.3332/ecancer.2016.699.
20. Benson AB 3rd, Arnoletti JP, Bekaii-Saab T et al. Anal carcinoma, version 2.2012: featured updates to the NCCN guidelines. J Natl Compr Canc Netw 2012; 10 (4): 449–454. doi: 10.6004/jnccn.212.0046.
21. Glynne-Jones R, Nilsson PJ, Aschele C et al. Anal cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25 (Suppl 3): 10–20. doi: 10.1093/annonc/mdu159.
22. Muirhead R, Adams R, Gilbert D. National guidance for IMRT in anal cancer. [online]. Available from: www.analimrtguidance.co.uk.
23. Moureau-Zabotto L, Venderely V, Abromwitz L et al. Anal cancer: French intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SNFCP). Dig Liver Dis 2017; 49 (8): 831–840. doi: 10.1016/j.dld.2017.05.011.
24. Eng C, Jácome AA, Das P et al. A phase II study of capecitabine/oxaliplatin with concurrent radiotherapy in locally advanced squamous cell carcinoma of the anal canal. Clin Colorectal Cancer 2019; 18 (4): 301–306. doi: 10.1016/j.clcc.2019.06.003.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Přehled nejdůležitějších metod léčby keratocystického odontogenního tumoru
- Podtřída imunoglobulinů IgG4 a s ní související patologické stavy aneb jak účinně imitovat nádorové onemocnění
- Rakovina z kapky krve
- Rehabilitácia a pohybová aktivita u pacientov s rakovinou pľúc
- Kapecitabin v léčbě análního spinocelulárního karcinomu
- Praktické aspekty terapie CAR-T lymfocyty
- Cytoredukční radikální prostatektomie u metastatického karcinomu prostaty
- Primární peritoneální karcinom a ovariální karcinom – desetiletá komparativní analýza
- Rychle progredující spinocelulární karcinom plic se skipping mutací MET exonu 14 metastazoval do atypických míst v kostech – kazuistika
- Aktuality z odborného tisku
- Muž s dýmkou, prof. MUDr. Pavel Klener, DrSc., se v dubnu 2022 dožívá 85 let
- Poděkování recenzentům
- Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Praktické aspekty terapie CAR-T lymfocyty
- Rehabilitácia a pohybová aktivita u pacientov s rakovinou pľúc
- Podtřída imunoglobulinů IgG4 a s ní související patologické stavy aneb jak účinně imitovat nádorové onemocnění
- Přehled nejdůležitějších metod léčby keratocystického odontogenního tumoru
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



