-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kognitívne deficity onkologických pacientov s hematologickými malignitami
Cognitive Deficits in Cancer Patients with Haematological Malignancies
Background:
Cognitive deficits are one of the most common adverse effects of chemotherapy (CHT). Previous reports suggest that this is due to the so-called chemo brain syndrome, the symptoms of which manifest mainly as impairments in executive functions, speed of information processing, memory, attention, and motor speed. However, empirical evidence for these manifestations is currently ambiguous.Methods:
The research group consisted of 26 cancer patients with haematological malignancies who had undergone chemotherapy treatment. Cognitive performance was measured by two screening cognitive tests, the Mini-Mental State Examination (MMSE) and the Montreal Cognitive Test (MoCA).Results:
MMSE detected cognitive deficits in 34.6% of patients whereas MoCA identified mild or moderate cognitive impairment in up to 80.7% of patients. The highest error rates were found in tasks focused on memory, attention, spatial orientation, executive functions, and abstraction. Cognitive deficit progressed with age, but not with duration of therapy.Conclusion:
Deficits in cognitive functions occur in a considerable number of patients after CHT, although the diagnosis depends on the sensitivity of the detection method. Screening scales usually provide the first indication of impaired cognitive functioning and may indicate the need for further neuropsychological examination. Early diagnosis of reduced cognitive functions is a prerequisite for effective psychological intervention to help patients cope with the undesirable effects of chemotherapy treatment more quickly.Key words:
chemotherapy – cognitive dysfunction – chemo brain – cognitive screening – neuropsychological tests – psychology
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
4. 7. 2017Accepted:
24. 8. 2017
Autoři: M. Mikulajová; V. Boleková; K. Surová
Působiště autorů: Fakulta psychológie, Paneurópská vysoká škola, Bratislava
Vyšlo v časopise: Klin Onkol 2017; 30(6): 443-451
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2017443Souhrn
Východiská:
Kognitívne deficity sú jedným z najčastejších nepriaznivých dôsledkov liečby chemoterapiou (CHT). Závery klinických štúdií poukazujú na tzv. syndróm chemo brain, ktorého symptómy sa manifestujú najmä v oblasti exekutívnych funkcií, rýchlosti spracovania informácií, pamäti, pozornosti či motorického tempa. Empirická evidencia tohto závažného dôsledku CHT však v súčasnosti nie je jednoznačná.Metódy:
Výskumu sa zúčastnilo 26 onkologických pacientov s hematologickými malignitami, ktorí absolvovali liečbu CHT. Kognitívny výkon bol meraný prostredníctvom dvoch skríningových kognitívnych testov – Mini-Mental State Examination (MMSE) a Montrealský kognitívny test (Montreal cognitive assessment – MoCA).Výsledky:
Kognitívny deficit sme prostredníctvom MMSE zistili u 34,6 % pacientov. Avšak na základe výsledkov v teste MoCA sme identifikovali miernu alebo stredne ťažkú kognitívnu poruchu až u 80,7 % pacientov. Najvyššiu chybovosť sme zistili v úlohách zameraných na pamäť, pozornosť, priestorovú orientáciu, exekutívne funkcie a abstrakciu. Kognitívny deficit progreduje s vekom, ale nie s dĺžkou terapie.Záver:
Deficity v kognitívnych funkciách sa po absolvovaní CHT vyskytujú u nezanedbateľného množstva pacientov, avšak ich diagnostika závisí od citlivosti zvoleného nástroja merania. Skríningové škály poskytujú prvú informáciu o kognitívnom fungovaní pacienta a môžu indikovať potrebu ďalšieho neuropsychologického vyšetrenia. Včasná diagnostika znížených kognitívnych funkcií je predpokladom efektívnej psychologickej intervencie, ktorá napomáha pacientom rýchlejšie sa vyrovnať s nežiaducimi následkami liečby CHT.Key words:
chemotherapy – cognitive dysfunction – chemo brain – cognitive screening – neuropsychological tests – psychologyÚvod
Vývoj nových chemoterapeutík a možností liečby vedie k zníženej úmrtnosti pacientov s rakovinou a tiež k poklesu rizika recidívy ochorenia. Pacienti podstupujúci chemoterapiu (CHT) však aj po ukončení úspešnej liečby často čelia mnohým ťažkostiam a výzvam v každodennom živote. Jedným z najčastejších nepriaznivých dôsledkov CHT je pretrvávajúce oslabenie kognitívnych schopností, ktoré výrazne narúša kvalitu života vyliečených pacientov, komplikuje ich sociálne fungovanie ako aj spätné zaradenie do pracovného života [1].
Narušenie kognitívnych funkcií pacientov po absolvovaní CHT je v zahraničnej literatúre [2–5] nejednotne označované skratkami CRCC (therapy related cognitive changes), CICI (chemotherapy induced cognitive impairment), CRCI (cancer-related cognitive impairment) alebo zjednodušene chemo mozog (chemo brain) či chemo hmla (chemo fog). Tejto závažnej problematike sa venujú aj viacerí českí a slovenskí autori [6,7].
Údaje o výskyte neurokognitívnych porúch, vznikajúcich ako následok onkologických ochorení a liečby sa rôznia, od 16 % až po 75 % pacientov a preživších s malígnymi nádormi ako napr. prsník, hlava a krk, semenníky či kolorektálny karcinóm (colorectal cancer – CRC) [6,8]. Nie je nám známa štúdia, ktorá by špecificky skúmala fenomén chemo brain u pacientov s hematologickou malignitou.
Syndróm chemo brain je charakteristický ľahkým až stredne závažným úbytkom kognitívnych schopností, a to najmä v oblasti pozornosti, pamäti, učenia, rýchlosti spracovania informácií, exekutívnych funkcií, vizuo-priestorových schopností, reakčného času a motorického tempa [8–10]. Metanalýza tridsiatich štúdií [11] poukazuje na oslabenie kognitívneho výkonu najmä v oblasti verbálnej pamäte a exekutívnych funkcií v porovnaní s normatívnymi dátami (d = 0,9) a kontrolnými skupinami (d = 0,6). Kognitívny deficit môže byť krátkodobý a v priebehu 1–2 rokov nastáva jeho zníženie [9,12]. Vo viacerých výskumoch však boli zistené pretrvávajúce zmeny v makroštruktúre mozgu a v kognitívnom výkone v rozmedzí 3–20 rokov po ukončení liečby [13–15].
Patogenéza kognitívneho narušenia v súčasnosti nie je objasnená. Etiológia je zrejme multifaktoriálna, spôsobená interakciou viacerých faktorov, ktoré ovplyvňujú centrálny nervový systém (central nervous system – CNS) a kognitívne schopnosti. Do úvahy prichádza priame neurotoxické poškodenie CNS, zníženie hustoty ciev v hipokampe, genetické predispozície (gén pre apolipoproteín APOEe4), endokrinné poruchy, zmena bunkového metabolizmu, oxidatívny stres a poškodenie DNA, znížená úroveň estrogénu a progesterónu v dôsledku CHT navodenej menopauzy u žien, dysregulácia cytokínov, následné zápalové reakcie a narušenie integrity a štruktúry hematoencefalickej bariéry [8,16–18]. Štrukturálne a funkčné zmeny v mozgu sa prejavia najmä znížením celkového objemu mozgu, ako aj objemu sivej hmoty [14] a zníženou aktivitou v oblasti dorzolaterálneho prefrontálneho kortexu a parahipokampálneho gýru pri riešení kognitívnych úloh [15], a to aj 10–20 rokov po ukončení liečby.
Empirická evidencia v tejto oblasti však nie je jednoznačná. Závery metaanalýz výskumných štúdií [5,19] spochybňujú hypotézu o CHT ako jedinej príčine deteriorácie a poukazujú na vysokú frekvenciu (30–40 %) pacientov, u ktorých bol zistený narušený kognitívny výkon už pred zahájením liečby, a to pravdepodobne v dôsledku samotného ochorenia, operácie v celkovej anestézii [5] alebo psychologických faktorov (napr. emočného distresu, najmä depresie) spôsobujúcich zmeny v kognitívnom fungovaní jednotlivca [8]. Pre nejednotnosť zistení a nedostatočnú objasnenosť faktorov spôsobujúcich narušenie kognitívnych funkcií navrhujú Hermelinková et al [19] nahradiť zaužívaný pojem chemo brain označením crisis brain – mozog v kríze.
Nejednoznačný je tiež súvis subjektívneho hodnotenia pacientov a objektívneho posúdenia neuropsychologickými testami, ktoré často nadhodnocujú ich výkon [15,20,21]. Autori Hutchinson et al prehľadovej štúdie [22] uvádzajú, že vzťah medzi subjektívnym a objektívnym posúdením kognitívneho výkonu sa zistil len v 1/3 empirických štúdií. Zároveň však dodávajú, že aj subjektívne vnímané zhoršenie pamäti či pozornosti ovplyvňuje kvalitu života pacienta a jeho životný štýl. Vnímané oslabenie kognitívnych funkcií môže byť indikátorom psychologického distresu a emočného rozladenia. Subjektívne vnímaný úbytok kognitívnych schopností súvisí s vyčerpaním, úzkosťou, depresiou či prítomnosťou symptómov posttraumatickej stresovej poruchy [18,20,23]. Nesúlad pacientovej výpovede a záverov neuropsychologického vyšetrenia môže byť tiež spôsobený nedostatočnou senzitivitou čí nízkou ekologickou validitou použitých nástrojov merania [24]. Cieľom tejto štúdie je zistiť, či u dospelých pacientov, ktorí aktuálne absolvujú CHT na liečbu hematologickej malignity, sa vyskytuje kognitívny deficit, v akých oblastiach sa najviac prejavuje a ako súvisí s vybranými klinickými údajmi a sociodemografickými charakteristikami pacientov. Príspevkom tiež poukazujeme na potrebu voľby citlivého krátkeho kognitívneho testu zo skríningových nástrojov bežne používaných v diagnostike kognitívnych porúch [25,26].
Materiál a metódy
Výskumný súbor a nástroje merania
Výskumný súbor tvorilo 26 onkologických pacientov, ktorí v čase realizácie výskumu boli liečení CHT na hematologickú malignitu na oddelení Kliniky hematológie a onkohematológie UNLP v Košiciach. Výskumu sa zúčastnilo 8 mužov a 18 žien vo vekovom rozpätí 24–81 rokov. Priemerný vek participantov bol M = 53,5 rokov (SD = 16,23). Rozdiel v priemernom veku mužov (M = 51,75; SD = 9,82) a žien (M = 54,28; SD = 18,59) bol zanedbateľný (p > 0,05; rm = 0,073). Priemerná dĺžka ochorenia (resp. priemerný počet rokov od stanovenia diagnózy po čas administrácie testov) bol 11,8 roka. Z celkového počtu participantov bolo 57,7 % (15 pacientov) diagnostikovaných pred ≤ 1 rokom, 15,4 % pacientov malo diagnostikovanú a liečenú rakovinu 2 roky. Rovnaký podiel participantov bol diagnostikovaný pred 3 rokmi. Dvaja participanti (7,7 %) uviedli dĺžku ochorenia 5 rokov. Vek, v ktorom u pacientov bolo ochorenie diagnostikované, výrazne varioval (21–78). Z celého súboru absolvovalo transplantáciu 30,8 % pacientov. Ukončené základné vzdelanie uviedli dvaja (7,7 % pacientov). Takmer 2/3 pacientov (65,4 %) majú ukončené stredoškolské vzdelanie a 26,9 % pacientov absolvovalo vysokú školu. Polovica participantov bola v čase výskumu v manželskom zväzku. Druhú, rovnako početnú kategóriu tvorili slobodní, rozvedení a ovdovelí participanti. Administrácia dotazníkov zahŕňala oboznámenie s cieľmi výskumu (informovaný súhlas participanta) a vyplnenie dvoch krátkych kognitívnych testov s odstupom 1 dňa.
Test kognitívnych funkcií Mini-Mental State Examination (MMSE) [27] patrí ke štandardným skríningom kognitívnej poruchy u dospelej populácie. Obsahuje desať úloh zameraných na kognitívne funkcie rozdelené do piatich okruhov – časopriestorová orientácia, pamäť (bezprostredná reprodukcia), pozornosť a kalkúlia, krátkodobá pamäť (oddialená reprodukcia), reč, komunikácia a konštrukčné schopnosti. Úlohou participanta je preukázať orientovanosť v čase (aktuálny dátum, deň v týždni, ročné obdobie apod.) a v priestore (kraj, mesto, názov nemocnice a oddelenia apod.), zapamätať a opätovne si vybaviť názvy troch predmetov, opakovane odčítavať číslo v číselnom rade, pomenovať prezentované predmety, zopakovať vetu, vykonať trojstupňový príkaz, prečítať a vykonať písaný príkaz, napísať zmysluplnú vetu a obkresliť prezentovaný obrazec. Administrácia trvá 6–10 min. Teoretické rozpätie bodov je 0–30. Podľa autorov metódy je rozpätie normálnych výkonov v pásme 24–30 bodov. MMSE sa celosvetovo používa ako referenčný test na skríningovú diagnostiku demencie a na základe jeho výsledkov sa vyhodnocujú napr. pomocné vyšetrenia, štádia ochorenia a medikácia. Bartoš a Raisová [25] však konštatujú, že test, i keď sa využíva ako referenčný nástroj, je príliš jednoduchý na zachytenie miernej kognitívnej poruchy a pri stanovenom hraničnom skóre 24 bodov podhodnocuje závažnosť kognitívneho deficitu. MMSE metóda prešla od svojho vzniku početnými overovaniami. U nás [26] sa v súčasnosti používa v štandardizovanej verzii Molloya a Clarnetta [28] s odporúčanými korekciami pre vek a vzdelanie, pričom všeobecne platí rozpätie – normálne výkony 26–30 bodov, mierna kognitívna porucha 20–25 bodov, stredná 10–19 bodov a závažná 0–9 bodov. U osôb nad 80 rokov a tiež u osôb so vzdelaním ≤ 8 rokov je mediánová hodnota skóre 26. Túto verziu metódy sme použili aj v našom výskume. Test neumožňuje diagnostikovať poruchu exekutívnych funkcií, ktoré súvisia s narušením prefrontálneho kortexu, frontoparietálnych a kortiko-subkortikálnych sietí [29]. Škála je vnútorne konzistentná (α = 0,91) a stabilná v čase (r = 0,79) [30]. Celkové skóre v teste koreluje so skóre v Montrealskom kognitívnom teste (Montreal cognitive assessment – MoCA) (r = 0,69, resp. rs = 0,73–0,86; p < 0,001) [31–33] a tiež s dosiahnutým vzdelaním [34].
MoCA slúži na zisťovanie kognitívnych deficitov prostredníctvom siedmi subtestov – vizuálno-priestorové schopnosti a exekutívne funkcie, pomenovanie, pamäť, pozornosť, jazyk, abstrakcia a orientácia [35,36]. Súčasťou administrácie je krátky test cesty, obkresľovanie kocky, test hodín, pomenovanie nakreslených zvierat, oneskorené vybavovanie slov, číselné rady (opakovanie a odpočítavanie), identifikácia písmena, opakovanie viet, hľadanie podobnosti medzi dvojicami slov, zisťovanie verbálnej fluencie a časovo-priestorovej orientácie. Celkové skóre umožňuje orientačne určiť pásmo normálnych výkonov (26–30 bodov), miernu (18–25 bodov), stredne ťažkú (10–17 bodov) a ťažkú kognitívnu poruchu (0–9 bodov). MoCA test je vhodným nástrojom s vysokou senzitivitou a špecificitou (90, resp. 87 % pri hraničnom skóre 26 bodov) na diagnostiku miernej kognitívnej poruchy [31]. Autor škály [35] uvádza dobrú vnútornú konzistenciu škály (α = 0,83) a test-retestovú reliabilitu (r = 0,92; p < 0,001). Výsledné skóre koreluje s dosiahnutým vzdelaním [37].
Porovnanie MoCA a MMSE pri odhaľovaní kognitívneho deficitu u pacientov s Parkinsonovou chorobou bolo predmetom výskumu Bezdíčka et al [32]. Autori použili v oboch testoch rovnakú kritickú hodnotu normálnych výkonov ≥ 26 bodov. Keďže v tomto výskume bola zahrnutá aj kontrolná skupina zdravých dospelých, naše zistenia orientačne porovnáme s výsledkami tejto štúdie.
Výsledky
Teoretické rozpätie v obidvoch administrovaných testoch je 0–30 bodov. Empirické rozpätie v teste MMSE bolo 17–30 (medián 26,56). V teste MoCA žiaden participant nedosiahol najvyšší možný počet bodov (empirické rozpätie – 12–27, medián 19,57). V tab. 1 uvádzame deskriptívnu štatistikupre jednotlivé subtesty oboch dotazníkov.
Reliabilita sumačného indexu v MMSE bola nízka α = 0,502. Hodnota Cronbachovho koeficienta vnútornej konzistencie v MoCA je akceptovateľná (α = 0,691) a porovnateľná s údajmi Bezdíčka et al (α = 0,72) [32]. Zistili sme silný vzťah medzi sumačnými indexami oboch dotazníkov (rs = 0,723, p < 0,001).
Tab. 1. Deskriptívna štatistika testov MMSE a MoCA. 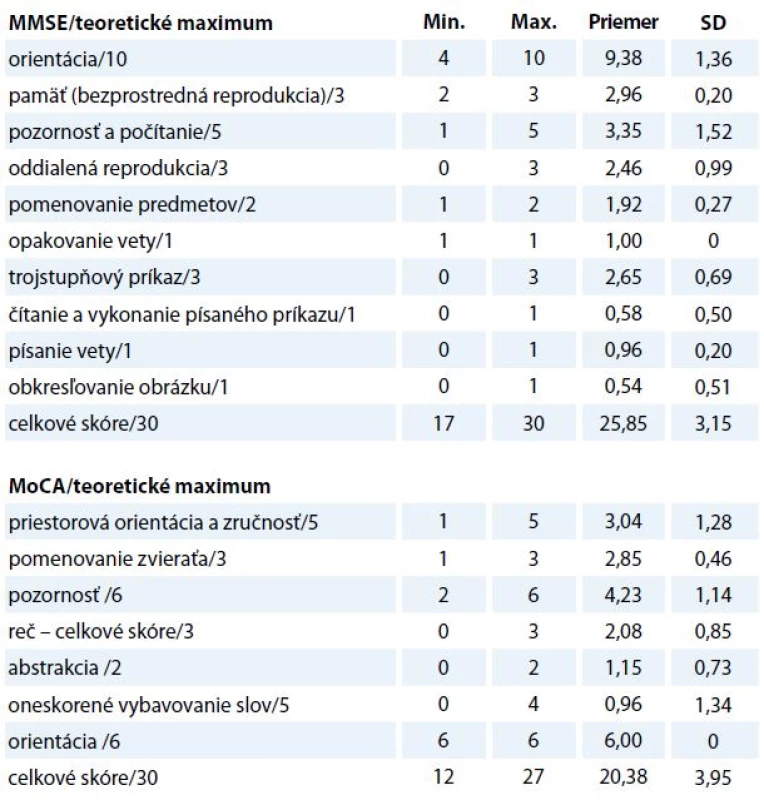
MMSE – Mini-Mental State Examination, MoCA – Montreal cognitive assessment Kognitívny deficit u pacientov s hematologickou malignitou
Rozdelenie participantov do jednotlivých kategórií z hľadiska závažnosti kognitívneho deficitu uvádzame v tab. 2. Na základe celkového skóre v teste MMSE bolo pri použití „tradičnej“ kritickej hodnoty 24 bodov až 76,9 % participantov zaradených do pásma normálnych výkonov. Po aplikácii kritérií Molloya a Clarnetta [28] percento pacientov bez kognitívneho deficitu kleslo na 65,4 %. Miernu kognitívnu poruchu sme zistili u 30,8 % a stredne ťažkú kognitívnu poruchu u 3,8 % participantov.
Na základe celkového skóre v teste MoCA sme zistili mierny kognitívny deficit takmer u 2/3 participantov (61,5 %), zatiaľ čo len piati participanti boli zaradení do pásma normálnych výkonov. U piatich participantov sme zistili stredne ťažkú kognitívnu poruchu.
Tab. 2. Distribúcia participantov podľa výsledného skóre v MMSE a MoCA [27,28,35]. ![Distribúcia participantov podľa výsledného skóre v MMSE a MoCA [27,28,35].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bb3b53e8e83f1bbcf4ba36996582da4e.jpg)
MMSE – Mini-Mental State Examination, MoCA – Montreal cognitive assessment Vzťah kognitívneho výkonu k vybraným sociodemografickým charakteristikám a klinickým údajom
Deskriptívne štatistiky v jednotlivých kategóriách participantov uvádzame v tab. 3 a 4. Muži dosiahli vyššie skóre (medián1 27, resp. 21) ako ženy (medián2 26,43, resp. 19,20), avšak rozdiel bol len veľmi malý v MMSE (rm = 0,123) aj v MoCA (rm = 0,134). Rozdiely medzi participantmi s ukončeným stredoškolským a vysokoškolským vzdelaním boli stredne veľké (rm = 0,32 a rm = 0,353) v prospech druhej skupiny.
Tab. 3. Rozdiely v celkovom skóre v MMSE v závislosti od pohlavia, dosiahnutého vzdelania a absolvovania transplantácie. 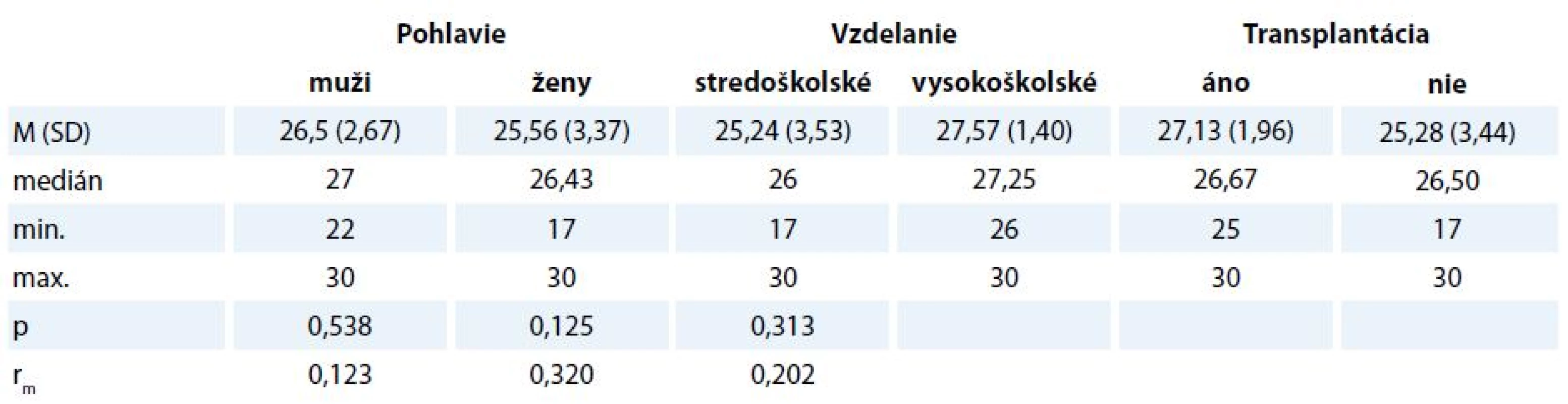
MMSE – Mini-Mental State Examination Tab. 4. Rozdiely v celkovom skóre v MoCA v závislosti od pohlavia, dosiahnutého vzdelania a absolvovania transplantácie. 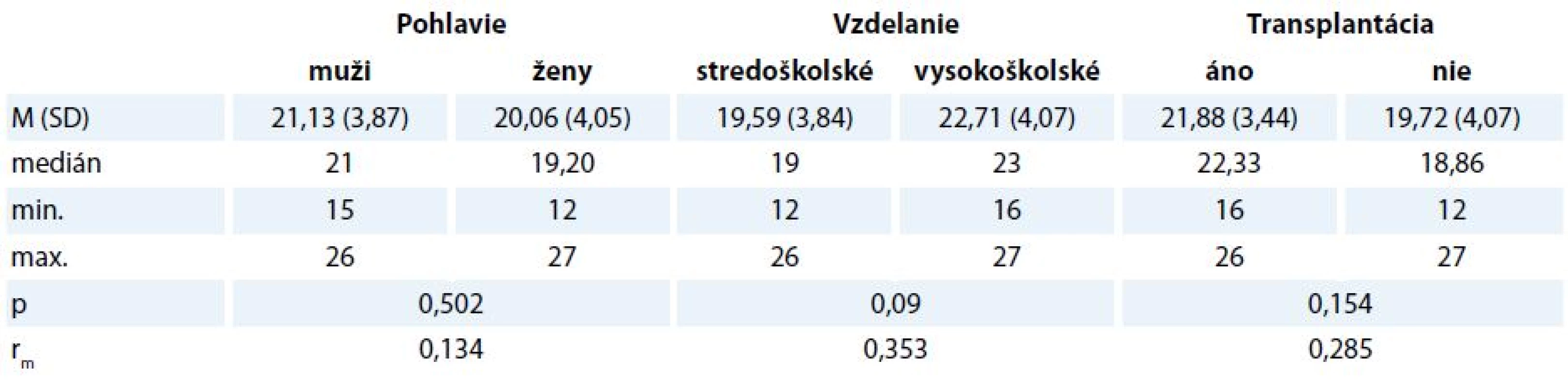
MoCA – Montreal cognitive assessment Celkové skóre v teste MMSE silno koreluje s vekom participantov (rs = –0,449, p < 0,01), avšak nie s dĺžkou ochorenia (rs = 0,029, p > 0,05). So vzrastajúcim vekom klesá tiež výkon v teste MoCA (rs = –0,506, p < 0,01). Vzťah s dĺžkou ochorenia bol opäť zanedbateľný (rs = 0,057, p > 0,05). Hrubé skóre jednotlivých participantov a ich vek uvádzame v grafoch 1 a 2. Z grafu 2 vidíme, že v teste MoCA i pri poklese výkonov s vekom sa kognitívny deficit vyskytuje aj u pacientov mladých a v strednom veku.
V našom súbore bolo 8 z 26 pacientov po transplantácii. Z hľadiska vecnej signifikancie konštatujeme malé rozdiely v kognitívnom deficite v závislosti od absolvovania transplantácie (rm = 0,202 pre MMSE a rm = 0,285 pre MoCA). Participanti, ktorí absolvovali transplantáciu, skórovali vyššie v teste MMSE (medián1 26,67, medián2 26,50) aj v teste MoCA (medián1 22,33, medián2 18,86).
Graf 1. Skóre v MMSE podľa veku participantov. 
MMSE – Mini-Mental State Examination Graf 2. Skóre v MoCA podľa veku participantov. 
MoCA – Montreal cognitive assessment Porovnanie výsledkov MMSE a MoCA
Až 46 % participantov, ktorých sme podľa výkonu v MMSE označili ako kognitívne intaktných (pásmo normálu), boli na základe celkového skóre v teste MoCA zaradení do skupiny s miernou (10 participantov) alebo stredne ťažkou kognitívnou poruchou (2 participanti). U 3 participantov sme zistili stredne ťažkú kognitívnu poruchu v MoCA, avšak len mierny kognitívny deficit v MMSE. Rozdiely medzi distribúciami boli stredne veľké (V = 0,310). Počty participantov v jednotlivých kategóriách uvádzame v tab. 5.
Tab. 5. Distribúcia participantov v kategóriách podľa MMSE a MoCA. 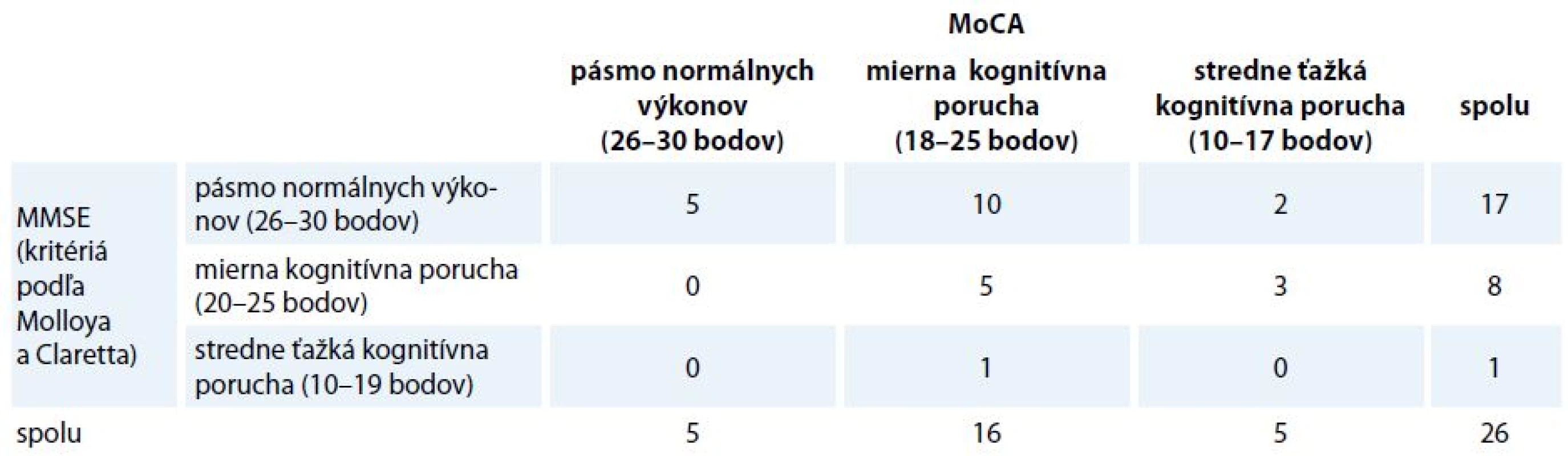
MMSE – Mini-Mental State Examination, MoCA – Montreal cognitive assessment V tab. 6 a 7 uvádzame chybovosť v jednotlivých subtestoch, ktorá je vyjadrená ako percento z celkového počtu participantov (n = 26). Za chybu sme považovali každú stratu bodu v danej dimenzii. Pre orientačné porovnanie uvádzame tiež chybové profily skupiny starších zdravých participantov (n = 34, priemerný vek 68,5 rokov, vekové rozpätie 48–93) z výskumu Bezdíčka et al [32]. V teste MMSE sme zistili najväčšiu chybovosť v subtestoch pozornosť a počítanie (65,4 %), obkresľovanie obrázku (42,3 %) a čítanie a vykonanie písaného príkazu (42,3 %). V teste MoCA žiadny participant nedosiahol plný počet bodov v subteste oddialená reprodukcia, tj. nezopakoval päť zadaných podnetových slov po určitom časovom odstupe. Vysokú chybovosť sme zistili aj v teste hodín (76,9 %), subtestoch abstrakcia (65,4 %), odpočítavanie (57,7 %) a test cesty (53,8 %). Deficity sú teda verbálnej i neverbálnej povahy a zahŕňajú pamäť a logické myslenie, pozornosť a vizuopriestorové schopnosti. V uvedených dimenziách (s výnimkou oddialenej reprodukcie) sme zároveň zistili najväčšie rozdiely v porovnaní so skupinou zdravých participantov z výskumu Bezdíčka et al [32].
Tab. 6. Chybový profil výkonu v MMSE a porovnanie so súborom zdravých participantov z výskumu Bezdíčka et al [32]. ![Chybový profil výkonu v MMSE a porovnanie so súborom zdravých participantov z výskumu Bezdíčka et al [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/90347b2e91ff2d349f1d214b6a1f59fc.jpg)
MMSE – Mini-Mental State Examination Tab. 7. Chybový profil výkonu v MoCA teste a porovnanie so súborom zdravých participantov z výskumu Bezdíčka et al [32]. ![Chybový profil výkonu v MoCA teste a porovnanie so súborom zdravých participantov z výskumu Bezdíčka et al [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/165bf07d66198c5cbfdfca9917bf3e7b.jpg)
MoCA – Montreal cognitive assessment Diskusia
V dôsledku zvyšujúceho sa počtu pacientov, ktorí v minulosti úspešne absolvovali liečbu CHT, sa v posledných dvoch desaťročiach venuje zvýšená pozornosť kvalite života preživších pacientov. Tá je v mnohých prípadoch narušená zmenami nálad, vyčerpanosťou, ale aj oslabením kognitívnych schopností. V našom výskume sme na základe výkonu v teste MoCA zistili kognitívny deficit u 80,7 % participantov. Vysokú chybovosť sme zistili najmä v subtestoch oddialená reprodukcia, počítanie (resp. odpočítavanie), obkresľovanie obrázku, čítanie a vykonanie písaného príkazu a tiež v úlohách zameraných na exekutívne funkcie a abstrakciu. Naše zistenia sú v súlade so závermi zahraničných štúdií, ktoré konštatujú pretrvávajúce zhoršenie pozornosti [10,13], pamäti [38] a exekutívnych funkcií [20]. Podobne v kórejskej štúdii [21] vykazoval vysoký podiel pacientov v MMSE pamäťový deficit (53,7 %) alebo zhoršený výkon v subteste pozornosť (62,9 %).
Rozdiely v úrovni kognitívnych schopností sme vzhľadom na počet pacientov vo výskumnom súbore konštatovali na základe miery vecnej signifikancie. V súlade so zisteniami zahraničných autorov [37], ktorí realizovali výskum kognitívnych schopností v klinickej populácii, sme zistili malé rozdiely v prospech mužov a participantov s ukončeným vysokoškolským vzdelaním. Zistili sme tiež záporný vzťah výkonu v oboch testoch s vekom. Jara-Almonte Edwards et al [39] poukazujú na vysoký výskyt kognitívnej poruchy v heterogénnom súbore 192 onkologických pacientov starších ako 65 rokov, z nich 1/3 mala hematologickú malignitu. Kognitívnu poruchu alebo demenciu identifikovali u 61,5 % a u ďalších 18,2 % miernu kognitívnu poruchu. U našich pacientov kognitívny deficit neprogredoval s dĺžkou ochorenia. Participanti, ktorí absolvovali transplantáciu, dosiahli v testoch vyššie skóre. Rozdiely však boli malé, rovnako ako v štúdii Wefela et al [10], ktorí nezistili vzťah kognitívneho deficitu s demografickými charakteristikami a klinickými údajmi.
Výsledky výskumu interpretujeme s ohľadom na nereprezentatívnosť a veľkosť výskumného súboru, ako aj charakter použitých nástrojov merania. Bežne používané neuropsychologické batérie či skríningové testy vznikli za účelom diagnostiky porúch s odlišným klinickým obrazom (demencia, traumatické poranenie hlavy, cievna mozgová príhoda apod.). Pri ich administrácii u pacientov s rakovinou niektorí autori [20] upozorňujú na riziko chyby II. typu (falošne negatívna diagnóza), a to najmä u ľudí s vysokým premorbídnym kognitívnym výkonom. Mierny pokles v kognitívnom fungovaní u týchto jednotlivcov by mohol byť diagnostikovaný viac citlivými testami, ktoré umožňujú porovnať ich výkon s vekovo a vzdelanostne zodpovedajúcou normou. V našom výskume sme použili dva nástroje merania – bežne využívaný kognitívny skríning MMSE a test MoCA, ktorý umožňuje odhaliť kognitívny deficit aj miernej či strednej závažnosti [31]. MMSE je zameraný najmä na oblasť jazyka a pamäte a je považovaný za zlatý štandard v diagnostike demencie. Neumožňuje však diagnostiku exekutívnych funkcií a abstraktného myslenia [34,40]. Nevýhodou pri diagnostike pacientov po absolvovaní CHT je tiež výrazný efekt stropu, tj. škála nedostatočne diferencuje výkon v hornej polovici a nie je senzitívna na malé zmeny v kognitívnom výkone [33]. Administrácia v porovnaní s MoCA testom (7,4 vs. 14,8 min) je však časovo menej náročná [31]. Naopak MoCA test obsahuje subtesty zamerané na exekutívne funkcie, je vysoko senzitívny (90 %) a dostatočne špecifický (87 %) pri diagnostike miernej kognitívnej poruchy [35], a preto je považovaný za skríningový nástroj vhodný na meranie kognitívneho výkonu u pacientov s rakovinou [41].
Naše výsledky ukázali, že 46 % participantov, ktorí podľa MMSE dosiahli skóre v pásme normy, sa podľa výkonu v teste MoCA zaradili do pásma s miernou alebo až stredne ťažkou kognitívnou poruchou. Porovnaniu senzitivity oboch metód sa venujú aj autori zahraničných výskumov. V kanadskej štúdii [42] zo 40 pacientov s mozgovými metastázami bol zistený kognitívny deficit u 80 % pacientov testom MoCA, avšak len u 30 % pacientov metódou MMSE. Až 71 % pacientov skórujúcich v pásme normy v MMSE vykazovalo v MoCA kognitívny deficit. Podobné výsledky uvádzajú autori singapurskej štúdie [34], v ktorej z 57 pacientov bez identifikovaného kognitívneho deficitu v MMSE až 18 participantov vykazovalo znížený kognitívny výkon v MoCA teste. Väčšiu citlivosť testu MoCA v porovnaní s MMSE u pacientov s Parkinsonovou chorobou preukázali Bezdíček et al [32]. Bartoš a Raisová [25] v Čechách uskutočnili novú štandardizáciu MMSE, na základe ktorej odporúčajú zvýšiť kritickú hodnotu testu na 28 bodov. V budúcnosti by prospešné zistenia v tejto oblasti mohli priniesť najmä longitudinálne výskumy zamerané nielen na mechanizmy vzniku fenoménu chemo brain, ale tiež na tréning a remediáciu pacientov po ukončení liečby [41]. Práve cielený kognitívny tréning môže napomôcť zlepšeniu kognitívnej flexibility, rýchlosti spracovania informácií či verbálnej fluencie [43]. Výzvou budúceho výskumu je tiež voľba vhodných meracích nástrojov a referenčných skupín. Tie väčšinou tvoria zdraví participanti, ktorí nepodstupujú liečbu rakoviny, no nie sú vystavení ani ďalším rizikovým či oslabujúcim faktorom (únava, stres, vyčerpanie) ovplyvňujúcim výkon v kognitívnych úlohách [9]. Zdôrazňuje sa tiež potreba kvalitatívneho výskumu skúseností onkologických pacientov, procesu zvládania a vyrovnávania sa s vnímanými alebo reálnymi zmenami po ukončení liečby [3] a nevyhnutnosť multidisciplinárneho prístupu kombinujúceho neuropsychologické vyšetrenia s použitím neurozobrazovacích metód, počítačovým modelovaním a identifikáciou potenciálnych biomarkerov zvýšeného rizika vzniku kognitívneho deficitu po absolvovaní CHT [44].
Záver
Výsledky nášho výskumu poukazujú na prítomnosť kognitívneho deficitu u onkologických pacientov s hematologickými malignitami po absolvovaní CHT. Skríningové škály (najmä MoCA) poskytujú prvú informáciu o kognitívnom fungovaní pacienta po absolvovaní liečby a môžu indikovať potrebu ďalšieho neuropsychologického vyšetrenia. Včasná diagnostika oslabených kognitívnych funkcií umožňuje zamerať sa na problémové oblasti vyžadujúce podporu či intervenciu a pomáha pacientom rýchlejšie sa vyrovnať s nežiaducimi následkami liečby CHT. Cenné sú aj odporúčania pracovníkov Mayo Clinic [45], ako sa vysporiadať s fenoménom chemo brain. Predpokladom je dôkladná introspekcia pacienta a identifikácia podmienok, za ktorých sa problémy s pamäťou či pozornosťou zhoršujú (napr. únava či hlad). Zlepšenie self-managementu v každodennom živote je možné docieliť pravidelným tréningom kognitívnych schopností v rámci bežných činností alebo cielených cvičení, dôkladnou prípravou, plánovaním a zaznamenávaním si povinností či rozdelením úloh do zvládnuteľných menších celkov. K zmierneniu dopadu ťažkostí v pracovnom živote môže tiež prispieť dodržiavanie zásad psychohygieny, vrátane častých prestávok na oddych a aktívneho pohybu, ale tiež prispôsobenie si pracovného prostredia a eliminácia rozptyľujúcich podnetov a hluku. Uvedené odporúčania sú podľa nášho názoru vhodné aj pre pacientov s hematologickými malignitami. V procese vyrovnávania sa s náročnou situáciou je rovnako dôležité osvojenie si efektívnych stratégií zvládania záťaže, relaxačných techník, zásad správnej životosprávy a nových spôsobov vykonávania každodenných úloh.
Autorky deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. PhDr. Marína Mikulajová, CSc.
Fakulta psychológie
Paneurópska vysoká škola
Tomášikova 20
821 02 Bratislava
e-mail: mmikulajova@gmail.com
Obdrženo: 4. 7. 2017
Přijato: 24. 8. 2017
Zdroje
1. Freeman JR, Broshek DK. Assessing Cognitive Dysfunction in Breast Cancer: What Are the Tools? Clin Breast Cancer 2002; 3 (Suppl 3): S91–S99.
2. Janelsins M, Kesler S, Ahles T et al. Prevalence, mechanisms, and management of cancer-related cognitive impairment. Int Rev Psychiatry 2014; 26 (1): 102–113. doi: 10.3109/09540261.2013.864260.
3. Piacentine LB, Miller JF, Haberlein S et al. Perceived cognitive changes with chemotherapy for breast cancer. Appl Nurs Res 2016; 29 : 9–11. doi: 10.1016/j.apnr.2015. 03.015.
4. Ren X, St Clair DK, Butterfield DA. Dysregulation of cytokine mediated chemotherapy induced cognitive impairment. Pharmacol Res 2017; 117 : 267–273. doi: 10.1016/j.phrs.2017.01.001.
5. Wefel JS, Kesler SR, Noll KR et al. Clinical Characteristics, Pathophysiology, and Management of Noncentral Nervous System Cancer-Related Cognitive Impairment in Adults. CA Cancer J Clin 2015; 65 (2): 123–138. doi: 10.3322/caac.21258.
6. Vasiľková L. Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov. Klin Onkol 2016; 29 (4): 267–273. doi: 10.14735/amko2016267.
7. Vlčková I, Pavelková K, Kepák T et al. Změny v oblasti neurokognitívnych funkcí v důsledku léčby nádorových onemocnění dětí a dospívajících. Klin Onkol 2008; 21 (5): 294–302.
8. Argyriou AA, Assimakopoulos K, Iconomou G et al. Either Called ‘‘Chemobrain’’ or ‘‘Chemofog,’’ the Long-Term Chemotherapy-Induced Cognitive Decline in Cancer Survivors Is Real. J Pain Symptom Manage 2011; 41 (1): 126–139. doi: 10.1016/j.jpainsymman.2010.04.021.
9. Collins B, Mackenzie J, Stewart A et al. Cognitive effects of chemotherapy in post-menopausal breast cancer patients 1 year after treatment. Psychooncology 2009; 18 (2): 134–143. doi: 10.1002/pon.1379.
10. Wefel J, Lenzi R, Theriault RL et al. The Cognitive Sequelae of Standard-Dose Adjuvant Chemotherapy in Women with Breast Carcinoma. Results of a Prospective, Randomized, Longitudinal Trial. Cancer 2004; 100 (11): 2292–2299. doi: 10.1002/cncr.20272.
11. Anderson-Hanley C, Sherman ML, Riggs R et al. Neuropsychological effects of treatments for adults with cancer: A meta-analysis and review of the literature. J Int Neuropsychol Soc 2003; 9 (7): 967–982.
12. Fan HG, Houédé-Tchen N, Yi QL et al. Fatigue, Menopausal Symptoms, and Cognitive Function in Women After Adjuvant Chemotherapy for Breast Cancer: 1-and 2-Year Follow-Up of a Prospective Controlled Study. J Clin Oncol 2005; 23 (31): 8025–8032. doi: 10.1200/JCO.2005.01.6550.
13. Kam Jwy, Brenner Ca, Handy TC et al. Sustained attention abnormalities in breast cancer survivors with cognitive deficits post chemotherapy: An electrophysiological study. Clin Neurophysiol 2016; 127 (1): 369–378. doi: 10.1016/j.clinph.2015.03.007.
14. Koppelmans V, de Ruier MB, van der Lijn F et al. Global and focal brain volume in long-term breast cancer survivors exposed to adjuvant chemotherapy. Breast Cancer Res Treat 2012; 132 (3): 1099–1106. doi: 10.1007/s10549-011-1888-1.
15. de Ruiter MB, Reneman L, Boogerd W et al. Cerebral Hyporesponsiveness and Cognitive Impairment 10 Years After Chemotherapy for Breast Cancer. Hum Brain Mapp 2011; 32 (8): 1206–1219. doi: 10.1002/hbm.21102.
16. Dietrich J, Prust M, Kaiser J. Chemotherapy, cognitive impairment and hippocampal toxicity. Neuroscience 2015; 309 : 224–232. doi: 10.1016/j.neuroscience.2015.06.016.
17. Koppelmans V, Breteler MM, Boogerd W et al. Late effects of adjuvant chemotherapy for adult onset non-CNS cancer; cognitive impairment, brain structure and risk of dementia. Crit Rev Oncol Hematol 2013; 88 (1): 87–101. doi: 10.1016/j.critrevonc.2013.04.002.
18. Li J, Yu L, Long Z et al. Perceived cognitive impairment in Chinese patients with breast cancer and its relationship with post-traumatic stress disorder symptoms and fatigue. Psychooncology 2015; 24 (6): 676–682. doi: 10.1002/pon.3710.
19. Hermelink K, Untch M, Lux MP et al. Cognitive function during neoadjuvant chemotherapy for breast cancer: results of a prospective, multicenter, logitudinal study. Cancer 2007; 109 (9): 1905–1913. doi: 10.1002/cncr.22610.
20. Biglia M, Bounous VE, Malabaila A et al. Objective and self-reported cognitive dysfunction in breast cancer women treated with chemotherapy: a prospective study. Eur J Cancer Care 2012; 21 (4): 485–492. doi: 10.1111/j.1365-2354.2011.01320.x.
21. Oh P. Predictors of cognitive decline in people with cancer undergoing Chemotherapy. Eur J Oncol Nurs. In press 2016.
22. Hutchinson AD, Hosking JR, Kichenadass G et al. Objective and subjective cognitive impairment following chemotherapy for cancer: A systematic review. Cancer Treat Rev 2012; 38 (7): 926–934. doi: 10.1016/j.ctrv.2012.05.002.
23. Lam YCJ, Ng T, Shwe M et al. Trajectory of self-perceived cognitive impairment: A 15-month prospective, longitudinal study in Asian early-stage breast cancer (ESBC) patients. abstract 1543. Eur J Cancer 2015; 51 (Suppl 3): 218–219. doi: 10.1016/S0959-8049 (16) 30633-5.
24. Hermelink K. Chemotherapy and Cognitive Function in Breast Cancer Patients: The So-Called Chemo Brain. J Natl Cancer Inst Monogr 2015; 2015 (51): 67–69. doi: 10.1093/jncimonographs/lgv009.
25. Bartoš A, Raisová M. Testy a dotazníky pro vyšetřování kognitivních funkcí, nálady a soběstačnosti. Praha: Mladá fronta 2015 : 152.
26. Králová M, Cséfalvay Z, Marková J. Kognitívno-komunikačné poruchy pri demencii. Bratislava: Univerzita Komenského v Bratislave 2016.
27. Folstein MF, Folstein SE, McHugh PR. “Mini-Mental State”: A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12 (3): 189–198.
28. Molloy W, Clarnette R. Standardized Mini-Mental State Examination. A User’s Guide. New Grange Press 1999.
29. Rektorová I. Screeningové škály pro hodnocení demence. Neurol praxi 2011; 12 (Suppl G): 37–45.
30. Marioni RE, Chatfield M, Brayne C et al. The reliability of assigning individuals to cognitive states using the Mini Mental-State Examination: a population-based prospective cohort study. BMC Med Res Methodol 2011; 11 : 127. doi: 10.1186/1471-2288-11-127.
31. Aggarwal A, Kean E. Comparison of the Folstein Mini Mental State Examination (MMSE) to the Montreal Cognitive Assessment (MoCA) as a Cognitive Screening Tool in an Inpatient Rehabilitation Setting. Neurosci Med 2010; 1 : 39–42. 10.4236/nm.2010.12006.
32. Bezdíček O, Balabánová P, Havránková P et al. Srovnání české verze Montrealského kognitivního testu s Mini-Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci. Cesk Slov Neurol N 2010; 73/106 (2): 150–156.
33. Helmi L, Meagher D, O’Mahony E et al. Agreement and conversion formula between mini-mental state examination and montreal cognitive assessment in an outpatient sample. World J Psychiatry 2016; 6 (3): 358–364. doi: 10.5498/wjp.v6.i3.358.
34. Dong Y, Sharma VK, Chan BP et al. The Montreal Cognitive Assessment (MoCA) is superior to the Mini-Mental State Examination (MMSE) for the detection of vascular cognitive impairment after acute stroke. J Neurol Sci 2010; 299 (1-2): 15-18. doi: 10.1016/j.jns.2010.08.051.
35. Nasreddine Z, Phillips N, Bédirian V et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. J Am Geriatr Soc 2005; 53 (4): 695–699. doi: 10.1111/j.1532-5415.2005.53221.x.
36. Cséfalvay Z, Marková J. Montreal Cognitive Assessment (MoCA). Slovenská verzia testu. Z. Nasreddine. Verzia 7.1. [online]. Dostupné na: http://www.mocatest.org/.
37. Wu C, Dagg P, Molgat C. A pilot study to measure cognitive impairment in patients with severe schizophrenia with the Montreal Cognitive Assessment (MoCA). Schizophr Res 2014; 158 (1–3): 151–155. doi: 10.1016/j.schres.2014.07.006.
38. Collins B, MacKenzie J, Tasca GA et al. Cognitive effects of chemotherapy in breast cancer patients: a doseresponse study. Psychooncology 2013; 22 (7): 1517–1527. doi: 10.1002/pon.3163.
39. Jara-Almonte Edwards B, Khalil P, Holmes H et al. Cognitive impairment and dementia in older cancer patients. Abstract e269. J Clin Oncol 2016; 34 (Suppl 3).
40. Iconomou G, Mega V, Koutras A et al. Prospective Assessment of Emotional Distress, Cognitive Function, and Quality of Life in Patients with Cancer Treated with Chemotherapy. Cancer 2004; 101 (2): 404–411. doi: 10.1002/cncr.20385.
41. Loh KP, Janelsins MC, Mohile SG et al. Chemotherapy-related cognitive impairment in older patients with cancer. J Geriatr Oncol 2016; 7 (4): 270–280. doi: 10.1016/j.jgo.2016.04.008.
42. Olson RA, Chhanabhai T, McKenzie M. Feasibility study of the Montreal Cognitive Assessment (MoCA) in patients with brain metastases. Supportive Care in Cancer 2008; 16 (11): 1273–1278. doi: 10.1007/s00520-008-0431-3.
43. Kesler S, Hadi Hosseini SM, Heckler C et al. Cognitive Training for Improving Executive Function in Chemotherapy Treated Breast Cancer Survivors. Clin Breast Cancer 2013; 13 (4): 299–306. doi: 10.1016/j.clbc.2013.02.004.
44. Nelson W, Suls J. New Approaches to Understand Cognitive Changes Associated With Chemotherapy for Non-Central Nervous System Tumors. J Pain Symptom Manage 2013; 46 (5): 707–721. doi: 10.1016/j.jpainsymman.2012.11.005.
45. MayoClinic.org. Foundation for Medical Education and Research. [online]. Available from: http://www.mayoclinic.org/.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Role paliativní radioterapie při krvácení lokálně pokročilých nádorů gastrointestinálního traktuČlánek Vliv kortikoterapie na diagnostickou výtěžnost stereotaktické biopsie u nemocných s lymfomem mozkuČlánek Ostropestřec mariánský (Silybum marianum) jako podpůrný fytoterapeutický prostředek v onkologiiČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Minulá a současná praxe chirurgického řešení karcinomu prsu
- Katétrové infekcie krvného prúdu – vieme o nich všetko?
- Molekulární patogeneze testikulárních germinálních nádorů
- Možnosti snížení radikality operací v axile a značení axilárních lymfatických uzlin v rámci terapie karcinomu prsu
- Ostropestřec mariánský (Silybum marianum) jako podpůrný fytoterapeutický prostředek v onkologii
- Role paliativní radioterapie při krvácení lokálně pokročilých nádorů gastrointestinálního traktu
- Vliv kortikoterapie na diagnostickou výtěžnost stereotaktické biopsie u nemocných s lymfomem mozku
- Kognitívne deficity onkologických pacientov s hematologickými malignitami
- Informace z České onkologické společnosti
- The Inclusion of a Gemcitabine + Nab-paclitaxel Regimen as a 2nd Line Treatment for Advanced Pancreatic Cancer – First Experience
- Role adjuvantní radioterapie při léčbě papilárních nádorů pineální oblasti: kazuistika a krátký přehled literatury
- Aktuality z odborného tisku
- Profesor MUDr. Jindřich Fínek, Ph.D., MHA životní jubileum
-
Onkologie v obrazech
Agresivní fibromatóza stěny břišní
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Katétrové infekcie krvného prúdu – vieme o nich všetko?
- Ostropestřec mariánský (Silybum marianum) jako podpůrný fytoterapeutický prostředek v onkologii
- The Inclusion of a Gemcitabine + Nab-paclitaxel Regimen as a 2nd Line Treatment for Advanced Pancreatic Cancer – First Experience
- Možnosti snížení radikality operací v axile a značení axilárních lymfatických uzlin v rámci terapie karcinomu prsu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



