-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
Non-Small Cell Lung Cancer – from Immunobiology to Immunotherapy
Background:
The treatment of early or locally advanced stages of non-small cell lung cancer (NSCLC) is based on surgical resection or radiotherapy. Metastatic disease is always incurable, treatment is palliative, systemic based on chemotherapy or target therapy. NSCLC is the most common cause of cancer-related death worldwide, and new therapeutic approaches are needed. Based on the emerging data on the role of immune system in shaping of tumor outbreak and outcome, immunotherapy is currently in the center of interest of cancer research and therapy of solid cancers including NSCLC. Various anti-cancer vaccination approaches and antigen-independent immunomodulatory drugs are being developed and trialed. The most advanced in terms of approaching clinical practice are the so-called checkpoint inhibitors blocking cytotoxic T-lymphocyte antigen-4 (CTLA-4) or programmed cell death of the protein and its ligand (PD-1, PD-L1). Beside innovative drug development, the field of cancer immunotherapy focuses on the identification and clinical application of effective biomarkers of clinical efficacy and on the evaluation of combinations of immunotherapeutic drugs or with classical anti-cancer approaches, such as chemotherapy, radiotherapy or with targeted therapy.Aim:
In this review, we summarize basic principles of immnobiology of NSCLC in the context of innovative immunotherapeutics, strategy and phase III results of anti-cancer vaccines in NSCLC, results of NSCLC treatment with checkpoint inhibitors, and current challenges in immunotherapy of lung cancers.Key words:
non-small cell lung cancer – immunotherapy – cancer vaccines – drug response biomarkers
This work was supported by MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
10. 6. 2016Accepted:
16. 6. 2016
Autoři: O. Bílek 1,2; L. Bohovicová 1; R. Demlová 2,3; A. Poprach 1; R. Lakomý 1; L. Zdražilová-Dubská 2,4
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 3; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 4
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 4): 78-87
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20164S78Souhrn
Východiska:
Základem léčby časných nebo lokálně pokročilých stadií nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) je chirurgická resekce, event. radioterapie. V případě inoperabilního či metastatického postižení je léčba paliativní systémová. Celosvětově představuje NSCLC nejčastější příčinu úmrtí v souvislosti s nádorovým onemocněním a dlouhodobě vyvstává potřeba nových terapeutických přístupů. Důkazy o úloze protinádorové aktivity imunitního systému vyvolaly v posledních letech nový zájem o imunoterapii, a to i v léčbě NSCLC. Předmětem vývoje a klinického hodnocení jsou různé strategie vakcinace s cílem posílení imunitní odpovědi a antigen-nespecifická imunomodulace. V této oblasti se dostávají do klinické praxe tzv. checkpoint inhibitory blokující inhibiční imunologické synapse jak cytotoxického T lymfocytárního antigenu 4 (CTLA-4) či proteinu programované buněčné smrti a jeho ligandu (PD-1, PD-L1). Mimo vývoj inovativních léčiv je významným cílem v oblasti imunoterapie solidních malignit identifikace a klinická aplikace efektivních biomarkerů odpovědi na protinádorovou imunoterapii a hodnocení přínosu kombinace imunoterapie s klasickými léčebnými metodami jako chemoterapie, radioterapie a s cílenou léčbou.Cíl:
Cílem tohoto sdělení je 1. popsat základní imunobiologii NSCLC v kontextu inovativních imunomodulačních terapeutik, 2. popsat strategii a shrnout terapeutické výsledky protinádorových vakcín u NSCLC z klinických hodnocení fáze III, 3. shrnout výsledky terapie checkpoint inhibitory u NSCLC a 4. nastínit aktuální výzvy v oblasti imunoterapie NSCLC.Klíčová slova:
nemalobuněčný karcinom plic – imunoterapie – protinádorové vakcíny – biomarkery léčebné odpovědiÚvod
Incidence karcinomu plic v ČR je 38/ /100 000 žen a 87/100 000 mužů. Celosvětově představuje nejčastější příčinu úmrtí v souvislosti s nádorovým onemocněním. Základem léčby nemalobuněčného karcinomu (non-small cell lung cancer – NSCLC) stadia I a II je resekční výkon, event. radioterapie, není-li operace indikována. Stadium IIIA je rovněž považováno za operabilní, ale s výrazně horší prognózou nepřesahující 15% 5leté přežití, zvláště při N2 postižení. Adjuvantní chemoterapie je indikována u stadia II a III, přínos u stadia IB zůstává sporný, u stadia IA není žádný. Adjuvantní radioterapie má přínos jen u stadia III s uzlinovým postižením N2. Léčba metastatického bronchogenního karcinomu je paliativní systémová. Analytické možnosti posledních let přinesly zásadní informace o biologii a patofyziologii NSCLC, které svědčí o tom, že molekulární podstata této diagnózy je heterogenní a na základě přítomnosti kauzálních onkogenních mutací/aberací se rozpadá do několika molekulárně definovaných podjednotek [1]. Jednotlivé kauzální aberace se pak stávají cílem protinádorové terapie (tab. 1) [2–34]. V závislosti na přítomnosti aktivačních mutací EGFR či translokace EML4-ALK je volena cílená léčba kinázovým inhibitorem nebo chemoterapií.
Tab. 1. Nejčastější dosud známé aberace u NSCLC jako cíle stávající a potencionální protinádorové terapie. 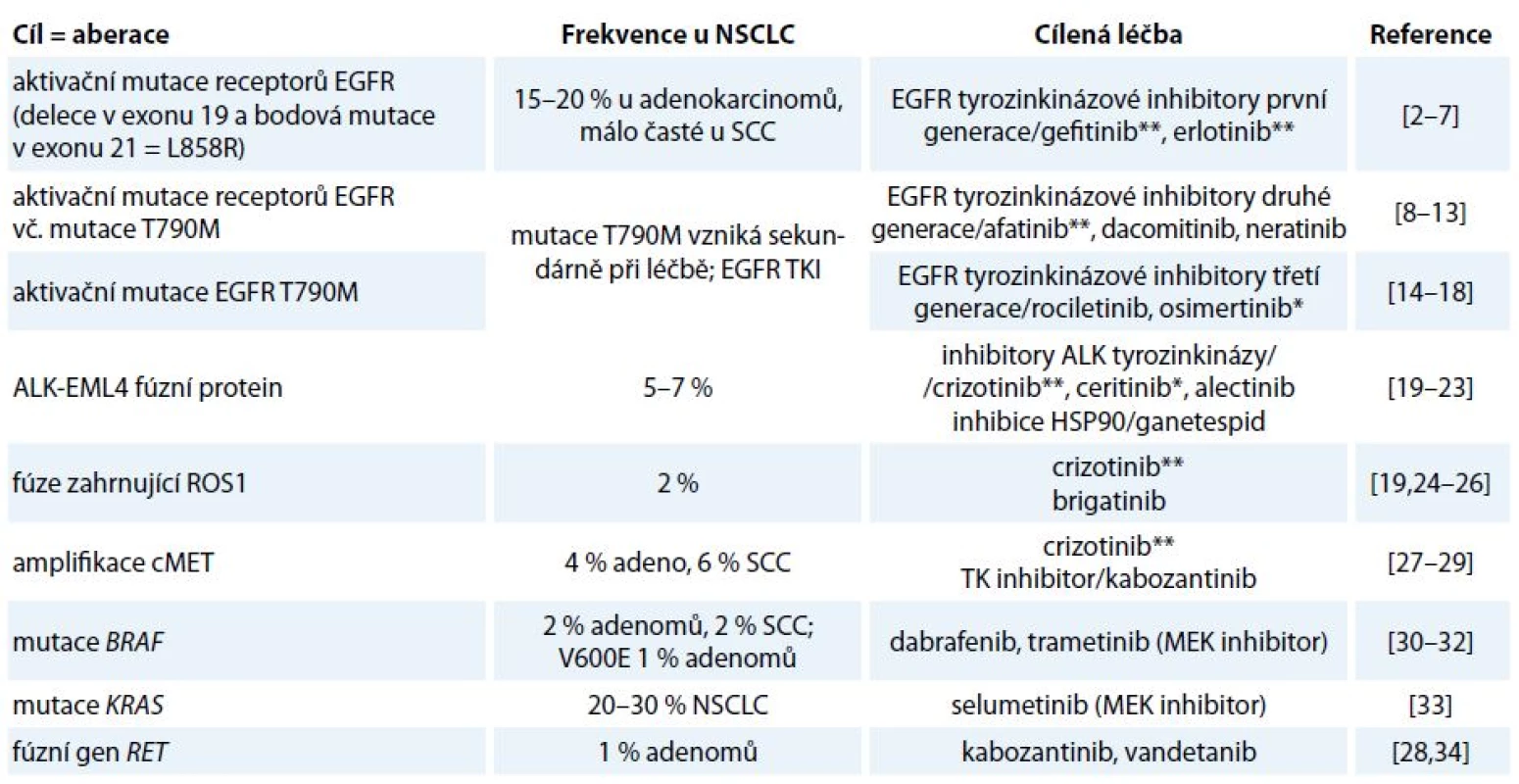
* V současnosti je registrováno pro léčbu NSCLC v rámci EU. ** V současnosti je registrováno pro léčbu NSCLC v rámci EU a současně hrazeno ze zdravotního pojištění v rámci ČR. Imunobiologie NSCLC
Počátky hypotézy předpokládající schop - nost imunitního systému eliminovat či kontrolovat maligní buňky se datují na přelom 19. a 20. století [35–38]. Existuje řada nástrojů imunitního systému, které mohou atakovat maligní buňky; příkladem je generace efektorových T lymfocytů namířených proti nádorovým antigenům (obr. 1) či cytolytická aktivita NK buněk. Na druhou stranu existuje řada imunosupresivních mechanizmů, jimiž může disponovat maligní buňka či spíše nádorové mikroprostředí a které odvrací protinádorovou aktivitu imunitních buněk. Koncept imunitního dohledu nad nádorovým bujením je v dnešní době rozpracován do konceptu nádorové imunoeditace (cancer immunoediting) popisujícího vzájemnou interakci nádorových buněk a imunitního systému. Imunoeditace spočívá ve vývoji protinádorových mechanizmů imunitního systému, ale také prvků úniku nádorových buněk imunitnímu dohledu. Během imunoeditingu se tedy selektují klony nádorových buněk s nižší imunogenicitou nebo s antigenním spektrem, proti němuž nebyla namířena imunitní reakce. Vzájemná interakce nádorových buněk a imunitního systému může být rozdělena do tří fází (3Es), z anglického elimination, equilibrium, escape. Fáze eliminace je charakterizována převahou imunitního dohledu, tedy protinádorovými mechanizmy imunitního systému, které vedou k eliminaci tumoru či efektivní kontrole jeho růstu. V rovnovážné fázi nádorové imunoeditace udržuje imunitní systém maligní tkáň z klinického hlediska v klidovém stadiu (dormancy). Nicméně v nádorové tkáni dochází ke genetickým a epigenetickým změnám a díky konstantnímu selekčnímu tlaku imunitního systému dále progredují klony buněk málo imunogenních, rezistentních k imunitní odpovědi a navozujících imunosupresi, což představuje nádorovou imunoeditaci v pravém slova smyslu. Jako únik/escape se označuje stav, kdy mechanizmy rezistence a navození imunosuprese nádorovými buňkami převládnou, vzniká imunosupresivní nádorové mikroprostředí, dochází k růstu nádoru a ten se začíná klinicky manifestovat. Ke vzniku imunosupresivního nádorového mikroprostředí přispívá celková imunosuprese jedince. Mezi konkrétní imunosupresivní mechanizmy nádoru patří exprese PD-L1 na membránách maligních buněk či antigen-prezentujících buněk (APC) navozující supresi efektorových T lymfocytů. K dalším mechanizmům rozvoje imunologické tolerance patří snížená exprese antigenů, MHC (major histocompability complex) I. třídy a kostimulačních molekul na povrchu nádorových buněk, sekrece cytokinů jako např. TGF-β, která interferuje s vyzráváním dendritických buněk a zvyšuje podíl myeloidních supresorových buněk (myeloid-derived suppresor cells – MDSC) a regulačních T lymfocytů (Tregs) v nádorovém stromatu (obr. 2). Konečně může být příčinou imunologické rezistence odolnost nádorových buněk vůči navození apoptózy CD8 lymfocyty.
Obr. 1. Základní mechanizmus antigen-dependentní stimulace T lymfocytů. Na počátku buněčné (i protilátkové) imunitní odpovědi je internalizace antigenu dendritickou případně jinou antigen-prezentující buňkou (APC), následný rozklad antigenu na malé peptidy a prezentace na povrchu buňky v kontextu proteinů hlavního histokompatibilního komplexu (MHC) I. a II. třídy. Dendritické buňky s antigenním peptidem cirkulují do lymfatických uzlin, po zrání umožní aktivaci naivních T lymfocytů na pomocné (Th1, Th2) CD4+ kostimulační reakcí mezi receptory B7.1 (CD80) a B7.2 (CD86) přítomnými na APC a receptorem CD28 přítomným na Th buňkách. Prezentaci antigenu dendritickou buňkou potencuje signalizace z TLR receptorů pro PAMP molekuly, což vede v dendritické buňce k signalizaci stimulující expresi MHC II i kostimulačních molekul CD80/CD86. Signalizace mezi dendritickou buňkou a T lymfocytech je modulována řadou inhibičních a aktivačních signálů. Mezi aktivační signály dendritických buněk patří mimo CD80/CD86 také OX40L či CD70, jež vazbou na příslušné molekuly na T lymfocytech potencují jejich aktivaci, proliferaci a získání efektorových funkcí. Cross-prezentace antigenů dendritickou buňkou je potencována tzv. licencování (licensing) CD4+ Th lymfocytů se stejnou antigenní specificitou. V procesu licencování se uplatňuje např. signalizace z CD40 po interakci s CD40L Th lymfocytů, která vede k up-regulaci kostimulačních molekul na dendritické buňky a toto potažmo k aktivaci efektorovývh CD8+ cytotoxických T lymfocytů. Sekrece cytokinů jako IL-2 (Th1 lymfocyty), IL-12 (dendritické buňky), IFN-γ (Th1 lymfocyty) usnadňuje aktivaci CD8+ lymfocytů na cytotoxické T lymfocyty, které získávají a) schopnost rozpoznat nádorové buňky, prostřednictvím komplexu peptid – MHC I a b) efektorové funkce k indukci buněčné smrti maligních buněk. Proteiny z usmrcených maligních buněk jsou opět pohlceny APC buňkami, což navozuje antigen-dependentní stimulaci T lymfocytů. 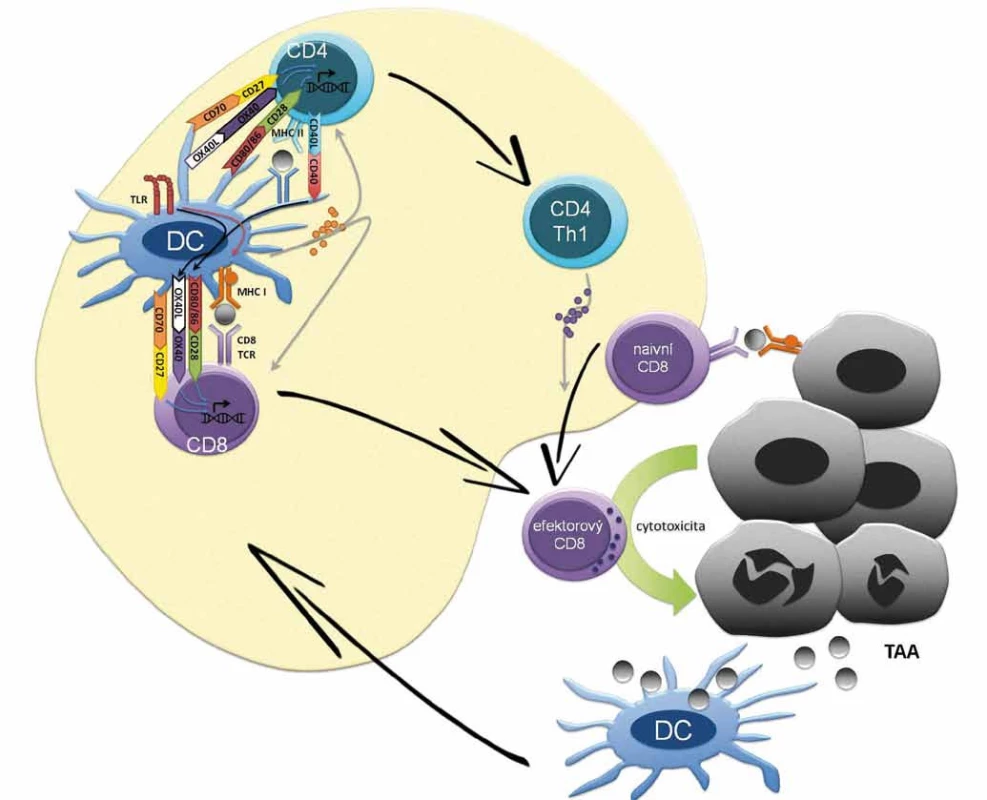
TAA – antigen asociovaný s nádorem, TLR – toll-like receptor, DC – dendritická buňka Obr. 2. Imunomodulační mechanizmy checkpoint inhibitorů v sekundárních lymfatických orgánech a nádorovém mikroprostředí. CTLA-4 (CD152) je exprimována na T lymfocytech a slouží k supresi imunitní reakce. CTLA-4 kompetuje s aktivační molekulou CD28 o vazbu s kostimulačním komplexem dendritických buněk CD80/CD86. Vazba CTLA-4 a CD80/CD86 vede k navození tolerogenní/imunosupresivní signalizace v dendritických buňkách vedoucí k produkci imunosupresivních působků např. TGF-β či IDO. Terapeutické protilátky interferující s vazbou CTLA-4 a CD80/CD86 jsou ipilimumab a tremelimumab. Imunosupresivní systém PD-1/PD-L1 se uplatňuje v potlačení funkce efektorových T lymfocytů v místě zánětu [52]. Povrchová molekula PD-1 (CD279) je exptrimována T, B lymfocyty, NK buňkami, dendritickými buňkami, monocyty. Vazba PD-L1 (CD274) či PD-L2 (CD275) na PD-1 vede ke snížení produkce cytokinů a proliferace a navození apoptózy PD-1+ buněk. PD-L1 je exprimován řadou buněk vč. maligních buněk, fibroblastů asociovaných s nádorem, T regulačních lymfocytů, myeloidních supresorových buněk MDSC či M2 s nádorem asociovaných makrofágů. Terapeuticky se využívá blokace PD-1/PD-L1 vazby, jak prostřednictvím anti-PD-1 mAb (nivolumab, pembrolizumab) tak anti-PD-L1 protilátek (avelumab, atezolizumab, durvalumab). CD27 je stimulační molekula na povrchu T lymfocytů, jejíž interakce s CD70 APC přispívá k antigen-dependentní klonální expanzi a získání efektorových funkcí T lymfocytů. Předmětem klinického hodnocení aktuálně časných fázi je agonista CD27 varlilumab. Signální molekula OX-40 je exprimována na efektorových T lymfocytech. Interakce OX-40 a OX-40L exprimovaného zralými dendritickými buňkami vede k signalizaci důležité pro přežití efektorových T lymfocytů a tvorbu a reaktiveci paměťových T lymfocytů. Na stimulaci OX-40 cílí agonistická protilátka anti-OX-40 či fúzní protein imunoglobulinu a OX-40L; v současnosti v klinických hodnoceních časných fází. CD40 je exprimován na APC a na řadě buněk mimo imunitní systém vč. maligních buněk. Aktivace CD40 stimuluje antigen-prezentační schopnosti dendritických buněk např. prostřednictví upregulace ko-stimulačních molekul CD80/CD86 poskytujících 2. signál pro aktivaci T lymfocytů. Mimo to anti-CD40 agonistické protilátky potencují protinádorvou aktivitu makrofágů a navozují ADCC maligních buněk exprimujících CD40 (popsáno především u hematoonkologických malignit). Předmětem klinického hodnocení jsou agonistické anti-CD40 protilátky a rekombinantní CD-40L. ![Imunomodulační mechanizmy checkpoint inhibitorů v sekundárních lymfatických orgánech a nádorovém mikroprostředí.
CTLA-4 (CD152) je exprimována na T lymfocytech a slouží k supresi imunitní reakce. CTLA-4 kompetuje s aktivační molekulou CD28 o vazbu s kostimulačním komplexem dendritických buněk CD80/CD86. Vazba CTLA-4 a CD80/CD86 vede k navození tolerogenní/imunosupresivní signalizace v dendritických buňkách vedoucí k produkci imunosupresivních působků např. TGF-β či IDO. Terapeutické protilátky interferující s vazbou CTLA-4 a CD80/CD86 jsou ipilimumab a tremelimumab. Imunosupresivní systém PD-1/PD-L1 se uplatňuje v potlačení funkce efektorových T lymfocytů v místě zánětu [52]. Povrchová molekula PD-1 (CD279) je exptrimována T, B lymfocyty, NK buňkami, dendritickými buňkami, monocyty. Vazba PD-L1 (CD274) či PD-L2 (CD275) na PD-1 vede ke snížení produkce cytokinů a proliferace a navození apoptózy PD-1<sup>+</sup> buněk. PD-L1 je exprimován řadou buněk vč. maligních buněk, fibroblastů asociovaných s nádorem, T regulačních lymfocytů, myeloidních supresorových buněk MDSC či M2 s nádorem asociovaných makrofágů. Terapeuticky se využívá blokace PD-1/PD-L1 vazby, jak prostřednictvím anti-PD-1 mAb (nivolumab, pembrolizumab) tak anti-PD-L1 protilátek (avelumab, atezolizumab, durvalumab). CD27 je stimulační molekula na povrchu T lymfocytů, jejíž interakce s CD70 APC přispívá k antigen-dependentní klonální expanzi a získání efektorových funkcí T lymfocytů. Předmětem klinického hodnocení aktuálně časných fázi je agonista CD27 varlilumab. Signální molekula OX-40 je exprimována na efektorových T lymfocytech. Interakce OX-40 a OX-40L exprimovaného zralými dendritickými buňkami vede k signalizaci důležité pro přežití efektorových T lymfocytů a tvorbu a reaktiveci paměťových T lymfocytů. Na stimulaci OX-40 cílí agonistická protilátka anti-OX-40 či fúzní protein imunoglobulinu a OX-40L; v současnosti v klinických hodnoceních časných fází. CD40 je exprimován na APC a na řadě buněk mimo imunitní systém vč. maligních buněk. Aktivace CD40 stimuluje antigen-prezentační schopnosti dendritických buněk např. prostřednictví upregulace ko-stimulačních molekul CD80/CD86 poskytujících 2. signál pro aktivaci T lymfocytů. Mimo to anti-CD40 agonistické protilátky potencují protinádorvou aktivitu makrofágů a navozují ADCC maligních buněk exprimujících CD40 (popsáno především u hematoonkologických malignit). Předmětem klinického hodnocení jsou agonistické anti-CD40 protilátky a rekombinantní CD-40L.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d83a94013d54c522f8ff73be6f440941.jpg)
Treg – regulační T lymfocyt, CAF – fibroblast asociovaný s malignitou, MDSC – myeloidní supresorová buňka, M2 – M2 polarizovaný makrofág Pro rozeznání maligní buňky a efektivní protinádorou odpověď imunitního systému jsou zásadní nádorové neoantigeny, jež jsou produkty translace mutovaných genů, intronových sekvencí, translace z alternativních čtecích rámců, pseudogenů, antisense řetězců, translokovaných genů či genů se začleněným virovým genomem. Množství nádorových antigenů/neoantigenů, které nádorová buňka produkuje, souvisí s množstvím somatických mutací dané buňky a nádory s vysokým podílem somatických mutací jsou více imunogenní v porovnání s nádory s malým množstvím mutací. Obecně nacházíme nejvíce somatických mutací v nádorech, které jsou spojené s fyzikálně, chemicky či biologicky indukovanou kancerogenezí – tj. v maligním melanomu, skvamobuněčném karcinomu plic, bronchogenním adenokarcinomu, karcinomu močového měchýře a malobuněčném karcinomu plic [39]; díky mutagenně podmíněné karcinogenezi jsou tyto typy malignit nejvíce imunodependentní a imunoresponzivní. Z pohledu jednotlivých případů NSCLC je vysoká proporce nádorových neoantigenů spojena s delším celkovým přežitím (overall survival – OS) a naopak heterogenita nádoru ve smyslu přítomnosti více subklonů se specifickým neoantigenním repertoárem je spojena s horším OS [40]. Popsaný mechanizmus pravděpodobně souvisí s klinickým pozorováním lepší léčebné odpovědi na terapii checkpoint inhibice PD-1/PD-L1 u kuřáků s NSCLC oproti nekuřákům s NSCLC [41].
Imunoterapie NSCLC
Z hlediska přístupu je možné obecně rozdělit imunoterapeutické postupy na pasivní a aktivní a dále na antigen-specifické či nespecifické a výsledkem jsou pak čtyři základní subkategorie imunoterapie, do kterých spadá: 1. aktivní nespecifická imunoterapie humorálními působky, která v případě léčby NSCLC cytokiny IL-2 či IFN-α nepřinesla úspěch [42]; 2. pasivní imunoterapie aplikací monoklonálních protilátek cílených proti tumorem-asociovaným antigenům s cílem vyvolání protilátkami indukované cytotoxicity (antibody-dependent cellular cytotoxicity – ADCC). Příkladem tohoto typu protinádorové terapie je herceptin (anti-Her2) či cetuximab (anti-EGFR). Nicméně pro léčbu NSCLC není aktuálně žádný přípravek pasivní imunoterapie registrován; 3. protinádorová vakcinace stimulující protinádorovou imunitní odpověď CD8+ cytotoxických lymfocytů a CD4+ Th lymfocytů proti nádorovým antigenům a tvorbu antigen specifických protilátek. Některé z těchto přístupů jsou ve vývoji a ty, které byly předmětem klinického hodnocení fáze III, jsou popsány v následující podkapitole; 4. modulace imunitního systému bez antigenní specificity, např. stimulace efektorových funkcí T lymfocytů imunomodulačními monoklonálními protilátkami (tzv. checkpoint inhibitory), které jsou v současné době největším předmětem zájmu v oblasti imunoterapie nádorů plic.
Terapeutické protinádorové vakcíny
Jako zdroj antigenů, proti němuž se vyvolá protinádorová imunitní odpověď, mohou sloužit imortalizované nádorové buňky, lyzáty z nádorových buněk, definované nádorové peptidy, které jsou spolu s adjuvans aplikovány onkologickým pacientům. Jako adjuvans jsou používány mikrobiální látky, např. inkompletní Freundovo adjuvans, CpG, cytokiny, jako je GM-CSF, IL-2, IL-12, IFN-α či fosfolipidy a sloučeniny hliníku. Nádorové antigeny mohou být aplikovány přímo či spolu s vektorem, který může zároveň poskytovat imunostimulační kontext. Příkladem jsou virové vektory či dendritické buňky. Mechanizmus účinku protinádorových vakcín předpokládá, že aplikace nádorových antigenů spolu s adjuvans spustí přirozenou imunitní odpověď, tedy správnou prezentaci antigenů prostřednictvím APC efektorovým T lymfocytům, což způsobí cytolýzu nádorových buněk v primárním ložisku i v metastázách. Vývoj protinádorových vakcín je technologicky náročný a nákladný a následně je pak v klinických hodnoceních zpravidla limitovaný počet pacientů, což prakticky znemožňuje identifikaci prediktivních faktorů a subkohort jedinců, kteří by z léčby protinádorovými vakcínami benefitovali. Nicméně některá léčiva typu protinádorových vakcín se dostala do fáze III klinického zkoušení léčby NSCLC.
Tecemotide (L-BLP25)
L-BLP25 je lipozomální vakcína proti antigenu MUC1 exprimovanému u většiny nádorů vč. NSCLC a jeho vysoká exprese je spojena s horší prognózou [43]. Vakcína byla zkoušena ve studii START v léčbě pacientů s neresekabilním NSCLC v klinickém stadiu III po léčbě chemoterapií a radioterapií. U celkového souboru pacientů nebylo dosaženo primárního cíle prodloužení OS. U subpopulace pacientů, kteří absolvovali léčbu v konkomitantní podobě a nikoli sekvenčně, však došlo k signifikantnímu prodloužení mediánu OS (30,8 vs. 20,6 měsíce; HR 0,78; p = 0,016). Analýza nežádoucích účinků nezaznamenala klinicky významné rozdíly mezi léčebnými rameny [44]. Na základě výsledků klinického hodnocení fáze III, které probíhalo v Japonsku (EMR 63325-021) a které neprokázalo efektivitu L-BLP25, byly další zkoušky a vývoj preparátu zastaveny ve prospěch checkpoint inhibitorů.
TG4010 (MVA-MUC1-IL2)
Další vakcínou zaměřenou proti antigenu MUC1 je TG4010. Jejím základem je atenuovaný virový vektor exprimující sekvenci MUC1 a IL-2 [45]. V randomizované studii fáze IIb/III zahrnující 222 dříve neléčených pacientů klinického stadia IIIB/IV byl hodnocen efekt přidání vakcíny k paliativní chemoterapii 1. linie v režimu cisplatina/gemcitabin. V rameni s TG4010 došlo k signifikantnímu prodloužení doby přežití bez progrese (progression-free survival – PFS) (5,9 vs. 5,1 měsíce; HR 0,74; p = 0,019). V mediánu OS však nebylo dosaženo významného rozdílu. Léčba nebyla spojena se závažnými nežádoucími účinky [46].
Melanom asociovaný antigen (MAGE-A3)
MAGE-A3 patří do rodiny tumorspecifických antigenů a je exprimován výlučně nádorovými buňkami. Pozitivita je uváděna v 35–55 % případů NSCLC [47]. Hodnocený imunoterapeutický přípravek využívající imunogenicity tohoto antigenu obsahoval rekombinantní protein MAGE-A3 a komplexní adjuvans AS15. Rozsáhlá studie MARGIT (NCT00480025) neprokázala významné prodloužení PFS proti placebu v adjuvantním podání pacientům klinického stadia IB–III (60,5 vs. 57,9 měsíce; HR 0,970; p = 0,7572). Tolerance léčby byla dobrá, závažné nežádoucí účinky stupně 3, 4 nebyly zaznamenány [48]. Vzhledem k tomu, že adjuvantní podání této vakcíny nevedlo k prodloužení celkového bezpříznakového přežití (disease--free survival – DFS) v porovnání se standardním chemoterapeutickým režimem v adjuvanci, není tato vakcína dále vyvíjena.
Rekombinantní lidský epidermální růstový faktor (CimaVax-EGF)
Antigenně specifická vakcína je tvořená rekombinantním EGF fúzovaným s nosným proteinem a adjuvans. Mechanizmem účinku je tvorba anti-EGF protilátek a tím navození blokace signální dráhy z receptorů EGFR na maligních buňkách. Ve studii fáze III bylo léčeno a sledováno 405 pacientů s NSCLC stadia IIIB/IV pro stanovení benefit maintenence podání CimaVax-EGF po absolvování 1. linie paliativní chemoterapie proti nejlepší podpůrné léčbě. Studie prokázala signifikantní prodloužení mediánu OS oproti nejlepší podpůrné léčbě (12,43 vs. 9,43 měsíce; HR 0,77; p = 0,04). Nežádoucí účinky stupně 3 byly hlášeny u 3,6 % pacientů (nejčastěji bolest hlavy, dušnost, eozinofilie), stupně 4 pozorovány nebyly. Vysoké hladiny EGF před zahájením léčby byly prediktorem léčebné odpovědi [49].
Belagenpumatucel-L
Jedná se o celobuněčnou alogenní vakcínu připravovanou transfekcí čtyř různých buněčných linií odvozených od NSCLC antisense TGF-β2 transgenem a ozářením před aplikací. Mechanizmus účinku je navození imunitní odpovědi proti nádorovým antigenům a potlačení imunosupresivní aktivity nádorového mikroprostředí. Vakcína byla testována v rámci maintenance aplikace pacientům v klinickém stadiu IIIB/IV, u kterých nebyla zaznamenána progrese onemocnění po absolvování 1. linie paliativní chemoterapie na bázi platiny (NCT00676507). V celkovém souboru nebylo prokázáno prodloužení mediánu OS (20,3 vs. 17,8 měsíce; HR 0,94; p = 0,594), ani prodloužení PFS. Benefit v mediánu OS byl pouze u pacientů s jinou histologií než adenokarcinom a u těch, kteří absolvovali radioterapii (28,4 vs. 16,0 měsíce; HR 0,61; p = 0,032). Vakcína byla dobře tolerována, závažné nežádoucí účinky nebyly hlášeny [50].
Racotumomab
Racotumomab je protilátková vakcína, jejímž cílovým antigenem jsou N-glycolilneuraminovou kyselinu (NeuGc) obsahující gangliosidy. Tyto gliolipidy nejsou přítomny na cytoplazmatické membráně normálních lidských buněk, byly však zachyceny u některých typů nádorů vč. NSCLC. Racotumomab je myší protilátka proti NeuGc obsahujícím gangliosidům, která vyvolává tvorbu IgG a IgM protilátek proti těmto epitopům. V rámci testování na myších modelech byla zaznamenána schopnost vyvolání vysoké protinádorové odpovědi. Aktuálně probíhá randomizovaná studie fáze III k ověření léčebného efektu u pacientů ve stadiu pokročilého neresekabilního nebo metastatického NSCLC, u kterých byl zaznamenán minimálně efekt stabilizace onemocnění po absolvování 1. linie paliativní léčby [51].
Nespecifická imunoterapie
Hlavním předmětem zájmu vývoje protinádorové imunoterapie jsou antigen-independentní modulátory imunitního systému, jejichž mechanizmus působení je založen na eliminaci imunosupresivních mechanizmů nádoru a/nebo nespecifické stimulaci imunitní odpovědi (obr. 2) [52]. Nejvíce prozkoumaný a popsaný je mechanizmus působení a klinické výsledky inhibice CTLA-4 a interakce PD-1/PD-L1.
Anti-CTLA-4 protilátky
Ipilimumab
Ipilimumab je humanizovaná IgG1 monoklonální protilátka. V současné době je součástí standardní léčby např. maligního melanomu, kde jsou zaznamenány případy dlouhodobých léčebných odpovědí. Efekt je zkoušen i v rámci jiných diagnóz vč. NSCLC. Výsledky studie fáze II srovnávající efekt přidání ipilimumabu k chemoterapii v kombinaci karboplatina/paclitaxel pacientům se skvamózním NSCLC klinického stadia III/IV prokázaly prodloužení PFS ve skupině s ipilimumabem, a to v případě sekvenčního podání chemoterapie a imunoterapie. Prodloužení mediánu OS nebylo statisticky signifikantní (12,2 vs. 8,3 měsíce; HR 0,87; p = 0,23) [53]. V současné době probíhají studie fáze III hodnotící efekt 1. přidání ipilimumabu k chemoterapii u pacientů s pokročilým skvamózním NSCLC (NCT02279732) a 2. hodnotící efekt přidání ipilimumabu do kombinace s anti-PD-1 protilátkou nivolumabem v 1. linii léčby NSCLC (CheckMate 227, NCT02477826).
Četnost vedlejších účinků ipilimumabu se v registrační studii pro léčbu maligního melanomu s dávkou 3 mg/kg pohybuje kolem 80–90 %. Ve většině případů šlo o mírnou až střední toxicitu (stupeň 1, 2). Závažná (stupeň 3) a život ohrožující toxicita (stupeň 4) byla zaznamenána u cca 20–25 % pacientů. K vedlejším účinkům může dojít již v průběhu infuze nebo po ní. Více obávané jsou však imunitně podmíněné vedlejší účinky (immune related adverse events – ir-AE), které jsou nejčastější a rostou s dávkou. Při dávce 3 mg/kg se objevují až u 60 % pacientů, vážná ir-AE toxicita stupně 3 a 4 byla zaznamenána u 10–15 % pacientů. K nejčastějším ir-AEs patří kožní toxicita (vyrážka, svědění kůže), enterokolitida a průjmy, endokrinopatie (hypofyzitida, tyreoiditida) a elevace jaterních testů. Imunitní systém však může napadnout jakýkoliv orgán v těle (srdce, plíce, ledviny, nervový systém, oči, hematopoetický systém a další). Je třeba důsledný management toxicity léčby [54].
Tremelimumab
Tremelimumab je humanizovaná monoklonální protilátka proti CTLA-4. Ve studii fáze II [55] nebyl prokázán efekt maintenance aplikace proti nejlepší podpůrné péči pacientům s metastatickým NSCLC, u kterých nebyla zaznamenána progrese onemocnění po 1. linii paliativní chemoterapie (NCT02000947). Probíhá studie fáze III ověřující přínos kombinace tremelimumabu s anti-PD-L1 protilátkou darvalumab (MEDI4736) vs. standardní chemoterapie (NCT02352948).
Anti-PD-1, anti-PD-L1 protilátky
Nivolumab
Nivolumab je plně humanizovaná monoklonální IgG4 anti-PD-1 protilátka standardně používaná např. v léčbě maligního melanomu (NCT01721772) [56]. Studie fáze III srovnávaly benefit podání nivolumabu pacientům s metastatickým NSCLC ve 2. linii paliativní léčby proti standardní chemoterapii docetaxelem. Studie CheckMate 017 týkající se skvamózního karcinomu plic prokázala statisticky významné prodloužení PFS a zejména mediánu OS (9,2 vs. 6,0 měsíce; HR 0,59; p = 0,0004). Tato studie neprokázala korelaci mezi přítomností PD-L1 na nádorových buňkách a léčebnou odpovědí (NCT01642004). U adenokarcinomu byl rovněž prokázán léčebný benefit nivolumabu studií fáze III CheckMate 057 (NCT01673867), která srovnávala monoterapii nivolumabem v dávce 3 mg/m2 každé dva týdny s podáním docetaxelu 75 mg/m2 jednou za tři týdny. Monoterapie nivolumabem vedla k prodloužení mediánu OS (12,2 vs. 9,4 měsíce; HR 0,73; p = 0,002), rozdíly v PFS nebyly v celém souboru statisticky významné (medián PFS 2,3 vs. 4,2 měsíce; HR 0,92; p = 0393). U této studie však byla zjevná signifikantní závislost mezi procentuálně vyjádřeným zastoupením PD-L1 na buněčné membráně nádorové buňky a mírou buněčné odpovědi. Na základě údajů o možném zlepšení léčebné odpovědi kombinací anti-CTLA-4 a anti-PD-1 protilátek probíhá studie CheckMate 227 hodnotící efekt v 1. linii paliativní léčby NSCLC (NCT02477826).
Toxicita anti-PD-1 a anti-PD-L1 protilátek je obecně menší než u ipilimumabu. Vážná kožní toxicita stupně 3 a 4 se vyskytuje výjimečně (2 %). Také průjem stupně 3 a 4 je málo častý (1–2 %), podobně jako hepatotoxicita (do 3 %) a vážné endokrinopatie (< 1 %). Na rozdíl od ipilimumabu se ale častěji po anti-PD-1 protilátkách objevuje pneumonitida (< 5 %). Podstatně vyšší četnost ir-AEs byla popsána ve studiích s kombinací anti-PD-1 a anti-CTLA-4 protilátkou (nivolumab + ipilimumab). Zde se výskyt vážných ir-AEs stupně 3 a 4 pohyboval kolem 50 %, s významným zastoupením gastrointestinální toxicity (15 %) a hepatotoxicity (19 %) [54,57].
Pembrolizumab
Jedná se opět o anti-PD-1 protilátku, jejíž účinnost u NSCLC byla hodnocena ve studii fáze III Keynote 010 (NCT01905657). Do studie byli zařazováni pacienti po selhání předchozí 1. linie s platinou a současně s prokázanou expresí PD-L1 min. v 1 % nádorových buněk s randomizací do jednoho ze tří léčebných ramen, pembrolizumab 2 mg/kg, 10 mg/kg nebo standardní rameno s docetaxelem 75 mg/m2 každé tři týdny. OS bylo signifikantně delší v obou ramenech s pembrolizumabem (dávka 2 mg/kg medián OS 12,7 vs. 8,5 měsíce; HR 0,71; p = 0,0008, resp. 10 mg/kg HR 0,61; p < 0,0001). Přítomnost PD-L1 ligandu na nádorových buňkách měla významný vliv na míru léčebné odpovědi s dopadem i na prodloužení OS [58]. U pacientů s přítomností PD-L1 vyšší než v 50 % nádorových buněk byl medián OS 14,9 vs. 8,2 měsíce; HR 0,54; p = 0,0002 v dávce 2 mg/kg a 17,3 vs. 8,2 měsíce; HR 0,5; p < 0,0001 při dávkování 10 mg/kg. FDA udělila pro tuto indikaci v říjnu 2015 na základě publikovaných výsledků tzv. accelerated approval, na evropské úrovni EMA je pembrolizumab v procesu posuzování.
Avelumab
Avelumab je anti-PD-L1 protilátka, ovlivňuje tedy nádorovou buňku a nikoli přímo lymfocyt. Aktuálně probíhají studie Javelin Lung 100 (NCT02576574) a Javelin Lung 200 (NCT02395172) fáze III hodnotící efekt u pacientů s metastatickým NSCLC v 1. a 2. linii léčby. V 1. linii léčby je avelumab v dávce 10 mg/kg jednou za dva týdny srovnáván se standardní chemoterapií na bázi platiny, primárním cílem je hodnocení PFS a sekundárně i celkového přežití. Klinická studie Javelin Lung 200 ve 2. linii léčby hodnotí podání avelumabu oproti standardnímu podání docetaxelu v dávce 75 mg/m2 jednou za tři týdny, primárním cílem je hodnocení OS a první výsledky jsou očekávány ke konci roku 2017. U obou studií je současně prospektivně hodnocena přítomnost PD-L1 v nádoru.
Atezolizumab
Jedná se o anti-PD-L1 protilátku zkoušenou u řady onkologických diagnóz. Recentně publikované výsledky studie POPLAR fáze II prokazují prodloužení OS proti docetaxelu v 2. linii paliativní léčby (OS 12,6 vs. 9,7 měsíce; HR 0,73; p = 0,004). Výsledky byly v korelaci s mírou exprese PD-L1 nádorovou buňkou [59]. Obdobné výsledky přinesla i další studie BIRCH fáze II, kde byla pozorována odpověď na léčbu u 27 % pacientů s vyšší expresí PD-L1 [60]. V současnosti probíhají studie fáze III hodnotící přínos atezolizumabu v 1. linii paliativní léčby ve srovnání se standardní chemoterapií (NCT02409342, NCT02409355), zde jsou první výsledky očekávány v roce 2019.
Výzvy v imunoterapii NSCLC
Nádorová imunologie a imunoterapie maligních onemocnění jsou v současné době v popředí zájmu onkologického výzkumu a podstatné místo zaujímají i v klinické praxi. Z hlediska klasifikace a managementu léčby časnějších stadií maligních onemocnění je významným počinem posledních let koncept imunoskóre/immunoscore, který je nejvíce rozpracován a aktuálně validován u kolorektálního karcinomu [61], nicméně je předmětem klinického výzkumu také u jednotlivých stadií NSCLC [62].
Vzhledem k tomu, že imunoterapie současnosti vstupuje především do léčby pokročilých nádorových onemocnění, jejichž charakteristikou je repertoár imunosupresivních vlastností prostředí nádoru, je nadějí pro pacienty s pokročilými onemocněními identifikace opodstatněných kombinací imunoterapie (stávající protilátky, nové protilátky, vakcíny) se standardními léčebnými modalitami (chemoterapie, radioterapie, cílená léčba), kde se jistě uplatní i „drug repositioning“. Kombinací léčebných metod by mohlo být dosaženo komplementárního, či dokonce synergického působení [63]. Je však nutno zvažovat míru toxicity léčby, např. v případě maligního melanomu sice přinesla kombinace dakarbazinu s ipilimumabem (10 mg/kg) prodloužení OS z 9,1 na 11,2 měsíce, ale závažné nežádoucí účinky stupně 3, 4 byly zaznamenány v 56 % [64]. Při hledání konkomitantních a sekvenčních protinádorových postupů je racionální kombinovat imunoterapii především s terapeutickými postupy dosahujícími léčebného efektu nejen na základě cytotoxických účinků, ale vyvolávajícími i tzv. imunogenní buněčnou smrt, kdy dochází ke stimulaci imunitního systému proti antigenům uvolněným z imunogenně likvidované maligní buňky. Imunogenní buněčnou smrt navozují některá chemoterapeutika, termické ablace či radioterapie. Klinicky pozorovatelnou konsekvencí popsaného způsobu buněčné smrti je abskopální efekt radioterapie vedoucí k regresi nádorového onemocnění i mimo ozařované pole a kombinace radioterapie s checkpoint inhibitory by mohla vést k podpoře tohoto efektu [65]. V souvislosti s kombinací imunoterapie s cílenou léčbou je zmiňována např. podpora vyzrávání dendritických buněk či aktivace a diferenciace T lymfocytů, přičemž četné studie již probíhají [66]. V rámci kombinací se testuje i současné podání checkpoint inhibitorů (tab. 2), jejichž relevance pro klinickou praxi je vzhledem k toxicitě a nákladovosti bez znalosti prediktivního biomarkeru limitovaná.
Tab. 2. Aktuálně probíhající studie fáze III/IV s checkpoint inhibitory u NSCLC. 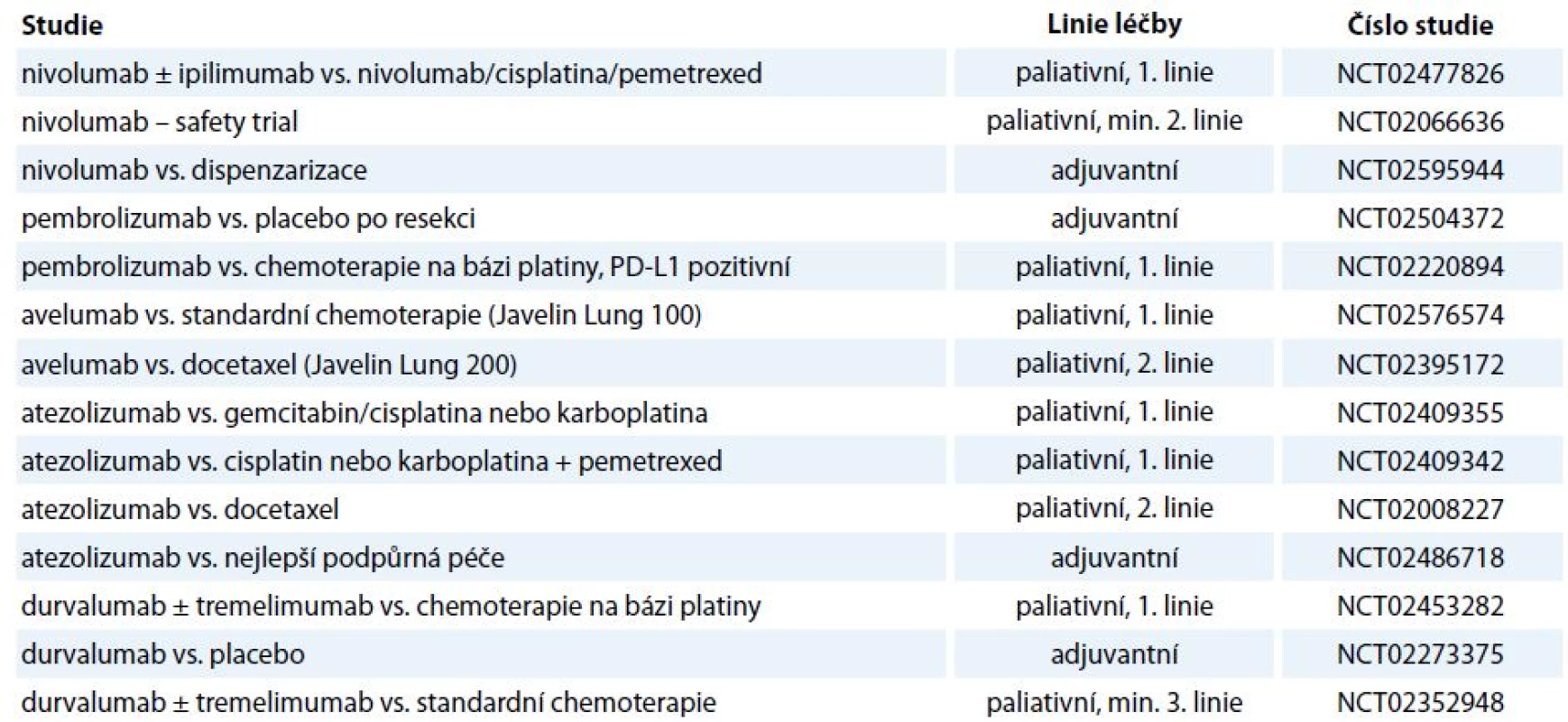
anti-CTLA-4 – ipilimumab, tremelimumab, anti-PD-1 – nivolumab, pembrolizumab, anti-PD-L1 – avelumab, atezolizumab, durvalumab Přestože jsou dosavadní data získaná z klinických hodnocení imunoterapie checkpoint inhibitory povzbudivá ve smyslu dosažení déle trvajících odpovědí u metastatických onemocnění (především u maligního melanomu), je proporce léčených pacientů, u kterých je dosaženo významné dlouhotrvající klinické odpovědi, malá [67]. Podstatnou výzvou je tedy identifikace prediktivních biomarkerů jednotlivých modalit protinádorové imunoterapie. V případě inhibice interakce PD-1/PD-L1 se jako prediktivní biomarker nabízí, v analogii na prediktivní vlastnosti míry exprese Her-2 buňkami karcinomu prsu, kvantifikace míry exprese PD-L1 v maligní tkáni. Ve studiích jako CheckMate 017 hodnotící efekt nivolumabu u skvamózního NSCLC nebyla úloha exprese PD-L1 v maligní tkáni jako prediktoru léčby potvrzena; naopak v případě bronchogenního adenokarcinomu korelovala míra exprese ligandu PD-L1 s mírou léčebného efektu (např. CheckMate 057). Mimo roztříštěnost projektů hodnotících expresi PD-L1 s ohledem na použitý detekční systém (typ diagnostických protilátek, hodnota cut-off, hodnocení exprese na maligních buňkách vs. nádorovém stroma) je podstatným úskalím v ustanovení míry PD-L1 pozitivity jako prediktivního biomarkeru inducibilní exprese tohoto ligandu, jež nemusí být pouze reflexí imunosupresivních vlastností nádorových buněk, ale může být naopak navozena parakrinní stimulací T lymfocytárního infiltrátu [68].
Na příkladu maligního melanomu se ukazuje, že prediktorem léčby checkpoint inhibitory mohou být i cirkulující parametry hodnotitelné z periferní krve, kde jsou významnými biomarkery – mimo hladinu LDH (laktátdehydrogenázy) spojenou s aktivitou onemocnění – také parametry reflektující míru imunosuprese resp. efektorových funkcí imunitního systému, jako je proporce lymfocytů, absolutní počet eozinofilů a monocytů, ale také zastoupení Tregs a MDSC [69,70]. Je racionální předpokládat, že mimo baselinové hladiny parametrů imunitního systému poskytuje určitou informaci o úspěšnosti léčby také dynamika vývoje jednotlivých imunitních parametrů. Tímto způsobem je možné sledovat např. dynamiku efektorových T lymfocytů či jiných leukocytárních subpopulací; při znalosti konkrétního nádorového antigenu (např. v případě peptidových vakcín) je možno sledovat dynamiku T lymfocytární frakce se specificitou k danému antigenu.
Hledání vhodných prediktorů odpovědí na léčbu checkpoint inhibitory je významné nejen z výzkumného hlediska a z hlediska reality klinické praxe s ohledem na optimalizaci efektivity při minimalizaci toxicity léčby, ale rovněž může zásadně přispívat k finanční udržitelnosti těchto terapeutických postupů. Dnes je již více než zřejmé, že pravděpodobně žádný zdravotnický systém, tedy nejen v ČR, nebude schopen absorbovat zvyšující se finanční zátěž spojenou s cílenou protinádorovou terapií vč. nákladné moderní imunoterapie. Pokud je během výzkumu v časných fázích zřejmé, že se bude jednat o inovativní léčivo s významným budoucím finančním dopadem do rozpočtu, a rovněž bude zřejmé, že profitovat z nákladné léčby bude jen určité procento pacientů, je nezbytně nutné, aby klinické studie pozdější fáze III byly designovány již souběžně s vývojem a ověřením diagnostické metody pro stanovení vhodného biomarkeru. Tím by došlo k ideálnímu stavu, kdy případná registrace léčiva bude souběžně doprovázena i „registrací“ diagnostické metody tak, jak je již delší dobu v FDA guidelines [71,72]. Jedním z příkladů takto FDA chválených léčiv s diagnostickým kitem může být olaparib a BRACAnalysis CDxTM nebo crizotinib a VENTANA ALK (D5F3) CDx AssayTM [73]. Přestože nejsou na evropské úrovni zatím tyto validované prediktivní testy při registraci léčiv Evropskou lékovou agenturou vyžadovány, je diskuze na toto téma evropskými regulátory vedena a pravděpodobně se v blízké době stane realitou. Tento způsob regulace inovativních a cílených protinádorových terapeutik patří k těm smysluplnějším a má reálný potenciál povzbudit farmaceutické firmy, aby intenzivněji implementovaly hledání vhodných biomarkerů již během klinického výzkumu nového léčiva, nikoliv až následně retrospektivně při hledání „vhodných podskupin“ pacientů v případě, kdy se neprokáže superiorní efekt hodnoceného léčivého přípravku v celé kohortě testovaných subjektů, případně po registraci léčiva, kdy je identifikace a implementace prediktorů léčby v rozporu s komerčními zájmy držitelů registrací.
Práce byla podpořena grantem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Lenka Zdražilová-Dubská, Ph.D.
Regionální centrum aplikované molekulární onkologie
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: dubska@mou.cz
Obdrženo: 10. 6. 2016
Přijato: 16. 6. 2016
Zdroje
1. Chen Z, Fillmore CM, Hammerman PS et al. Non-small - -cell lung cancers: a heterogeneous set of diseases. Nat Rev Cancer 2014; 14 (8): 535–546. doi: 10.1038/nrc3775.
2. Lee DH, Park K, Kim JH et al. Randomized phase III trial of gefitinib versus docetaxel in non-small cell lung cancer patients who have previously received platinum-based chemotherapy. Clin Cancer Res 2010; 16 (4): 1307–1314. doi: 10.1158/1078-0432.CCR-09-1903.
3. Han JY, Park K, Kim SW et al. First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol 2012; 30 (10): 1122–1128. doi: 10.1200/JCO.2011.36.8456.
4. Mitsudomi T, Morita S, Yatabe Y et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010; 11 (2): 121–128. doi: 10.1016/S1470-2045 (09) 70364-X.
5. Mok TS, Wu YL, Thongprasert S et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361 (10): 947–957. doi: 10.1056/NEJMoa0810699.
6. Zhou C, Wu YL, Chen G et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12 (8): 735–742. doi: 10.1016/S1470-2045 (11) 70184-X.
7. Rosell R, Carcereny E, Gervais R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13 (3): 239–246. doi: 10.1016/S1470-2045 (11) 70393-X.
8. Katakami N, Atagi S, Goto K et al. LUX-Lung 4: a phase II trial of afatinib in patients with advanced non-small-cell lung cancer who progressed during prior treatment with erlotinib, gefitinib, or both. J Clin Oncol 2013; 31 (27): 3335–3341. doi: 10.1200/JCO.2012.45.0981.
9. Janjigian YY, Smit EF, Groen HJ et al. Dual inhibition of EGFR with afatinib and cetuximab in kinase inhibitor-resistant EGFR-mutant lung cancer with and without T790M mutations. Cancer Discov 2014; 4 (9): 1036–1045. doi: 10.1158/2159-8290.CD-14-0326.
10. Sequist LV, Besse B, Lynch TJ et al. Neratinib, an irreversible pan-ErbB receptor tyrosine kinase inhibitor: results of a phase II trial in patients with advanced non-small-cell lung cancer. J Clin Oncol 2010; 28 (18): 3076–3083. doi: 10.1200/JCO.2009.27.9414.
11. Oxnard GR, Arcila ME, Sima CS et al. Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR-mutant lung cancer: distinct natural history of patients with tumors harboring the T790M mutation. Clin Cancer Res 2011; 17 (6): 1616–1622. doi: 10.1158/1078-0432.CCR-10-2692.
12. Reckamp KL, Giaccone G, Camidge DR et al. A phase 2 trial of dacomitinib (PF-00299804), an oral, irreversible pan-HER (human epidermal growth factor receptor) inhibitor, in patients with advanced non-small cell lung cancer after failure of prior chemotherapy and erlotinib. Cancer 2014; 120 (8): 1145–1154. doi: 10.1002/cncr.28561.
13. Lee JS, Hirsh V, Park K et al. Vandetanib versus placebo in patients with advanced non-small-cell lung cancer after prior therapy with an epidermal growth factor receptor tyrosine kinase inhibitor: a randomized, double-blind phase III trial (ZEPHYR). J Clin Oncol 2012; 30 (10): 1114–1121. doi: 10.1200/JCO.2011.36.1709.
14. Sequist LV, Soria JC, Camidge DR. Update to rociletinib data with the RECIST confirmed response rate. N Eng J Med 2016; 374 (23): 2296–2297. doi: 10.1056/NEJMc1602688.
15. Sequist LV, Soria JC, Goldman JW et al. Rociletinib in EGFR-mutated non-small-cell lung cancer. N Eng J Med 2015; 372 (18): 1700–1709. doi: 10.1056/NEJMoa1413654.
16. Cross DA, Ashton SE, Ghiorghiu S et al. AZD9291, an irreversible EGFR TKI, overcomes T790M-mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014; 4 (9): 1046–1061. doi: 10.1158/2159-8290.CD-14-0337.
17. Yver A. Osimertinib (AZD9291) -a science-driven, collaborative approach to rapid drug design and development. Ann Oncol 2016; 27 (6): 1165–1170. doi: 10.1093/annonc/mdw129.
18. Janne PA, Yang JC, Kim DW et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Eng J Med 2015; 372 (18): 1689–1699. doi: 10.1056/NEJMoa1411817.
19. Costa DB, Shaw AT, Ou SH et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases. J Clin Oncol 2015; 33 (17): 1881–1888. doi: 10.1200/JCO.2014.59.0539.
20. Ou SH, Janne PA, Bartlett CH et al. Clinical benefit of continuing ALK inhibition with crizotinib beyond initial disease progression in patients with advanced ALK-positive NSCLC. Ann Oncol 2014; 25 (2): 415–422. doi: 10.1093/annonc/mdt572.
21. Gadgeel SM, Gandhi L, Riely GJ et al. Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer (AF-002JG): results from the dose-finding portion of a phase 1/2 study. Lancet Oncol 2014; 15 (10): 1119–1128. doi: 10.1016/S1470-2045 (14) 70362-6.
22. Li S, Qi X, Huang Y et al. Ceritinib (LDK378): a potent alternative to crizotinib for ALK-rearranged non-small-cell lung cancer. Clin Lung Cancer 2015; 16 (2): 86–91. doi: 10.1016/j.cllc.2014.09.011.
23. Gainor JF, Tan DS, De Pas T et al. Progression-free and overall survival in ALK-positive NSCLC patients treated with sequential crizotinib and ceritinib. Clinical Cancer Res 2015; 21 (12): 2745–2752. doi: 10.1158/1078-0432.CCR-14-3009.
24. Bergethon K, Shaw AT, Ou SH et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30 (8): 863–870. doi: 10.1200/JCO.2011.35.6345.
25. Rosell R, Gettinger SN, Bazhenova LA et al. 1330: Brigatinib efficacy and safety in patients (Pts) with anaplastic lymphoma kinase (ALK) -positive (ALK+) non-small cell lung cancer (NSCLC) in a phase 1/2 trial. J Thorac Oncol 2016; 11 (4 Suppl): S114. doi: 10.1016/S1556-0864 (16) 30245-3.
26. Chin LP, Soo RA, Soong R et al. Targeting ROS1 with anaplastic lymphoma kinase inhibitors: a promising therapeutic strategy for a newly defined molecular subset of non-small-cell lung cancer. J Thorac Oncol 2012; 7 (11): 1625–1630. doi: 10.1097/JTO.0b013e31826baf83.
27. Zou HY, Li Q, Lee JH et al. An orally available small-molecule inhibitor of c-Met, PF-2341066, exhibits cytoreductive antitumor efficacy through antiproliferative and antiangiogenic mechanisms. Cancer Res 2007; 67 (9): 4408–4417.
28. Drilon A, Wang L, Hasanovic A et al. Response to Cabozantinib in patients with RET fusion-positive lung adenocarcinomas. Cancer Discov 2013; 3 (6): 630–635.
29. Padda S, Neal JW, Wakelee HA. MET inhibitors in combination with other therapies in non-small cell lung cancer. Transl Lung Cancer Res 2012; 1 (4): 238–253. doi: 10.3978/j.issn.2218-6751.2012.10.08.
30. Dabrafenib active in rare NSCLC subtype. Cancer Discov 2016; 6 (7). OF4. doi: 10.1158/2159-8290.CD-NB2016-062.
31. Blumenschein GR Jr, Smit EF, Planchard D et al. A randomized phase II study of the MEK1/MEK2 inhibitor trametinib (GSK1120212) compared with docetaxel in KRAS-mutant advanced non-small-cell lung cancer (NSCLC) dagger. Ann Oncol 2015; 26 (5): 894–901. doi: 10.1093/annonc/mdv072.
32. Planchard D, Kim TM, Mazieres J et al. Dabrafenib in patients with BRAF (V600E) -positive advanced non-small - -cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17 (5): 642–650. doi: 10.1016/S1470-2045 (16) 00077-2.
33. Janne PA, Shaw AT, Pereira JR et al. Selumetinib plus docetaxel for KRAS-mutant advanced non-small-cell lung cancer: a randomised, multicentre, placebo-controlled, phase 2 study. Lancet Oncol 2013; 14 (1): 38–47. doi: 10.1016/S1470-2045 (12) 70489-8.
34. Heymach JV, Lockwood SJ, Herbst RS et al. EGFR biomarkers predict benefit from vandetanib in combination with docetaxel in a randomized phase III study of second-line treatment of patients with advanced non-small cell lung cancer. Ann Oncol 2014; 25 (10): 1941–1948. doi: 10.1093/annonc/mdu269.
35. Coley WB. II. Contribution to the Knowledge of Sarcoma. Ann Surg 1891; 14 (3): 199–220.
36. Coley WB. The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. Clin Orthop Relat Res 1893; 1991 (262): 3–11.
37. Ehrlich P. The partial function of cells. (Nobel Prize address given on 11 December 1908 at Stockholm). Int Arch Allergy Appl Immunol 1954; 5 (2): 67–86.
38. Ehrlich P. Address in pathology, on chemiotherapy: delivered before the Seventeenth International Congress of Medicine. Br Med J 1913; 2 (2746): 353–359.
39. Alexandrov LB, Nik-Zainal S, Wedge DC et al. Signatures of mutational processes in human cancer. Nature 2013; 500 (7463): 415–421. doi: 10.1038/nature12477.
40. McGranahan N, Furness AJ, Rosenthal R et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science 2016; 351 (6280): 1463–1469. doi: 10.1126/science.aaf1490.
41. Gettinger SN, Horn L, Gandhi L et al. Overall survival and long-term safety of nivolumab (anti-programmed death 1 antibody, BMS-936558, ONO-4538) in patients with previously treated advanced non-small-cell lung cancer. J Clin Oncol 2015; 33 (18): 2004–2012. doi: 10.1200/JCO.2014.58.3708.
42. Jansen RL, Slingerland R, Goey SH et al. Interleukin-2 and interferon-alpha in the treatment of patients with advanced non-small-cell lung cancer. J Immunother 1992; 12 (1): 70–73.
43. Agrawal B, Gendler SJ, Longenecker BM. The biological role of mucins in cellular interactions and immune regulation: prospects for cancer immunotherapy. Mol Med Today 1998; 4 (9): 397–403.
44. DeGregorio M, Soe L, Wolf M. Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small cell lung cancer (START): a randomized, double-blind, phase III trial. J Thorac Dis 2014; 6 (6): 571–573. doi: 10.3978/j.issn.2072-1439.2014.05.15.
45. Rochlitz C, Figlin R, Squiban P et al. Phase I immunotherapy with a modified vaccinia virus (MVA) ex - pressing human MUC1 as antigen-specific immunother-apy in patients with MUC1-positive advanced cancer. J Gene Med 2003; 5 (8): 690–699.
46. Quoix E, Lena H, Losonczy G et al. TG4010 immunotherapy and first-line chemotherapy for advanced non-small-cell lung cancer (TIME): results from the phase 2b part of a randomised, double-blind, placebo-controll - ed, phase 2b/3 trial. Lancet Oncol 2016; 17 (2): 212–223. doi: 10.1016/S1470-2045 (15) 00483-0.
47. Jang SJ, Soria JC, Wang L et al. Activation of melanoma antigen tumor antigens occurs early in lung carcinogenesis. Cancer Res 2001; 61 (21): 7959–7963.
48. Vansteenkiste JF, Cho BC, Vanakesa T et al. Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small - -cell lung cancer (MAGRIT): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2016; 17 (6): 822–835. doi: 10.1016/S1470-2045 (16) 00099-1.
49. Rodriguez PC, Popa X, Martinez O et al. A Phase III clinical trial of the epidermal growth factor vaccine CIMAvax-EGF as switch maintenance therapy in advanced non-small cell lung cancer patients. Clin Cancer Res 2016; 22 (15): 3782–3790. doi: 10.1158/1078-0432.CCR-15-0855.
50. Giaccone G, Bazhenova LA, Nemunaitis J et al. A phase III study of belagenpumatucel-L, an allogeneic tumour cell vaccine, as maintenance therapy for non-small cell lung cancer. Eur J Cancer 2015; 51 (16): 2321–2329. doi: 10.1016/j.ejca.2015.07.035.
51. Alfonso S, Valdes-Zayas A, Santiesteban ER et al. A randomized, multicenter, placebo-controlled clinical trial of racotumomab-alum vaccine as switch maintenance therapy in advanced non-small cell lung cancer patients. Clin Cancer Res 2014; 20 (14): 3660–3671. doi: 10.1158/1078-0432.CCR-13-1674.
52. Keir ME, Butte MJ, Freeman GJ et al. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol 2008; 26 : 677–704. doi: 10.1146/annurev.immunol.26.021607.090331.
53. Lynch TJ, Bondarenko I, Luft A et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol 2012; 30 (17): 2046–2054. doi: 10.1200/JCO.2011.38.4032.
54. Lakomy R, Poprach A. Side effects of modern immunotherapy and how to solve them in the clinics. Klin Onkol 2015; 28 (Suppl 4): 4S103–4S114. doi: 10.14735/amko20154S103.
55. Zatloukal P, Heo DS, Park K et al. Randomized phase II clinical trial comparing tremelimumab (CP-675,206) with best supportive care (BSC) following first-line platinum-based therapy in patients (pts) with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2009; 27 (Suppl 15): abstr. 8071.
56. Robert C, Long GV, Brady B et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Eng J Med 2015; 372 (4): 320–330. doi: 10.1056/NEJMoa1412082.
57. Topalian SL, Hodi FS, Brahmer JR et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Eng J Med 2012; 366 (26): 2443–2454. doi: 10.1056/NEJMoa1200690.
58. Herbst RS, Baas P, Kim DW et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387 (10027): 1540–1550. doi: 10.1016/S0140-6736 (15) 01281-7.
59. Fehrenbacher L, Spira A, Ballinger M et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387 (10030): 1837–1846. doi: 10.1016/S0140-6736 (16) 00587-0.
60. Besse B, Johnson M, Janne PA. Phase II, single-arm trial (BIRCH) of atezolizumab as first-line or subsequent therapy for locally advanced or metastatic PD-L1-selected non-small cell lung cancer (NSCLC). Ann Oncol 2015; 26 (Suppl 6): 16LBA.
61. Galon J, Mlecnik B, Bindea G et al. Towards the introduction of the ‚Immunoscore‘ in the classification of malignant tumours. J Pathol 2014; 232 (2): 199–209. doi: 10.1002/path.4287.
62. Donnem T, Kilvaer TK, Andersen S et al. Strategies for clinical implementation of TNM-Immunoscore in resected nonsmall-cell lung cancer. Ann Oncol 2016; 27 (2): 225–232. doi: 10.1093/annonc/mdv560.
63. Antonia SJ, Larkin J, Ascierto PA. Immuno-oncology combinations: a review of clinical experience and future prospects. Clin Cancer Res 2014; 20 (24): 6258–6268. doi: 10.1158/1078-0432.CCR-14-1457.
64. Robert C, Thomas L, Bondarenko I et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Eng J Med 2011; 364 (26): 2517–2526. doi: 10.1056/NEJMoa1104621.
65. Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift. J Natl Cancer Inst 2013; 105 (4): 256–265. doi: 10.1093/jnci/djs629.
66. Schilling B, Sucker A, Griewank K et al. Vemurafenib reverses immunosuppression by myeloid derived suppressor cells. Int J Cancer 2013; 133 (7): 1653–1663. doi: 10.1002/ijc.28168.
67. Wolchok JD, Neyns B, Linette G et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 2010; 11 (2): 155–164. doi: 10.1016/S1470-2045 (09) 70334-1.
68. Gowrishankar K, Gunatilake D, Gallagher SJ et al. Inducible but not constitutive expression of PD-L1 in human melanoma cells is dependent on activation of NF-κB. PloS One 2015; 10 (4): e0123410. doi: 10.1371/journal.pone.0123410.
69. Weide B, Martens A, Hassel JC et al. Baseline biomarkers for outcome of melanoma patients treated with pembrolizumab. Clin Cancer Res. In press 2016.
70. Martens A, Wistuba-Hamprecht K, Geukes Foppen M et al. Baseline peripheral blood biomarkers associated with clinical outcome of advanced melanoma patients treated with ipilimumab. Clin Cancer Res 2016; 22 (12): 2908–2918. doi: 10.1158/1078-0432.CCR-15-2412.
71. Hinman LM, Huang SM, Hackett J et al. The drug diag - nostic co-development concept paper: commentary from the 3rd FDA-DIA-PWG-PhRMA-BIO pharmacogenomics workshop. Pharmacogenomics J 2006; 6 (6): 375–380.
72. Fda.gov [homepage on the Internet]. Drug-diagnostic co-development concept paper. U.S. Food and Drug Administration, MD; [updated 2016 June 22; cited 2016 June 23]. Available from: www.fda.gov/downloads/Drugs/ScienceResearch/ResearchAreas/Pharmacogenetics/ucm116689.pdf.
73. Fda.gov [homepage on the Internet]. List of cleared or approved companion diagnostic devices (in vitro and imaging tools). U.S. Food and Drug Administration, MD; [updated 2016 June 22; cited 2016 June 23]. Available from: www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Editorial
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



