-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
Pomalidomide in the Treatment of Relapsed and Refractory Multiple Myeloma
Despite improvements in multiple myeloma therapy, the vast majority of patients continue to suffer relapses. Unfortunately, many patients event. develop disease that is refractory to lenalidomide and bortezomib and have few treatment options. Pomalidomide is a potent second-generation immunomodulatory agent with direct antiproliferative, pro-apoptotic, and antiangiogenic effects, as well as modulatory effects on bone resorption and on the immune system. Pomalidomide exhibited more potent anti-myeloma activity compared with thalidomide and lenalidomide. The optimal starting dose of pomalidomide is 4 mg given orally on days 1–21 of each 28-day cycle and combination with dexamethasone produces synergistic effects. In clinical trials, pomalidomide plus low-dose dexamethasone has shown better responses, progression-free and overall survival than high-dose dexamethasone or pomalidomide alone. Pomalidomide has limited cross-resistance with lenalidomide, and the overall response rates of pomalidomide in lenalidomide/bortezomib dual-refractory patients ranged from 26 to 31%. The most common grade 3 or 4 adverse events are hematologic, consisting of neutropenia, thrombocytopenia and anemia. Pomalidomide was approved by the FDA and the EMA in patients with multiple myeloma who have received at least two prior therapies including lenalidomide and bortezomib and have demonstrated disease progression on their last therapy. We review pomalidomide mechanism of action, clinical trials in relapsed and refractory patients, and novel pomalidomide-based combinations.
Key words:
pomalidomide – multiple myeloma – immunomodulatory agents
This study was supported by grant VEGA No. 1/0906/14.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
5. 6. 2014Accepted:
26. 6. 2014
Autoři: Ľ. Roziaková 1,2; M. Mistrík 1; A. Bátorová 1
Působiště autorů: Klinika hematológie a transfuziológie LF UK a UN Bratislava, Slovensko 1; Ústav patologickej fyziológie, LF UK v Bratislave, Slovensko 2
Vyšlo v časopise: Klin Onkol 2014; 27(5): 318-325
Kategorie: Přehledy
doi: https://doi.org/10.14735/amko2014318Souhrn
Aj napriek pokrokom v liečbe mnohopočetného myelómu, drvivá väčšina pacientov relabuje. Bohužiaľ, u mnohých pacientov sa vyvinie ochorenie, ktoré je refraktérne na podávanie lenalidomidu a bortezomibu, a títo pacienti majú obmedzené možnosti liečby. Pomalidomid je účinná druhogeneračná imunomodulačná látka s priamym antiproliferatívnym, proapoptotickým a antiangiogénnym účinkom, ako aj s modulačným účinkom na kostnú resorpciu a imunitný systém. Pomalidomid má v porovnaní s lenalidomidom a talidomidom výraznejší protimyelómový účinok. Optimálna úvodná dávka je 4 mg perorálne po dobu 21 dní v 28-dňových cykloch a kombinácia s dexametazonom má synergický efekt. V rámci klinických štúdií mal pomalidomid v kombinácii s nízkodávkovaným dexametazonom lepšie liečebné odpovede, dobu bez progresie a celkové prežívanie v porovnaní s vysokodávkovaným dexametazonom alebo monoterapiou pomalidomidom. Pomalidomid má obmedzenú skríženú rezistenciu s lenalidomidom a celkový počet liečebných odpovedí u dvojito refraktérnych pacientov, aj na lenalidomid aj na bortezomib, sa dosahuje u 26 – 31 % pacientov. Medzi najčastejšie nežiaduce účinky 3. a 4. stupňa patrí hematologická toxicita (neutropénia, trombocytopénia a anémia). Pomalidomid bol schválený americkou (FDA) a európskou inštitúciou (EMA) na liečbu pacientov s mnohopočetným myelómom, ktorí už boli liečení bortezomibom aj lenalidomidom a došlo k progresii ochorenia pri poslednej liečbe. V tomto prehľadovom článku sumarizujeme mechanizmus účinku, prehľad klinických štúdií u pacientov s relabujúcim a refraktérnym mnohopočetným myelómom, ako aj nové kombinačné režimy.
Kľúčové slová:
pomalidomid – mnohopočetný myelóm – imunomodulačné látkyÚvod
Mnohopočetný myelóm (multiple myeloma – MM) je druhou najčastejšou hematologickou malignitou, ktorá aj napriek novým liečebným možnostiam zostáva u väčšiny pacientov nevyliečiteľným ochorením. Zavedením kombinácie nových liekov a použitím konsolidačnej a udržiavacej liečby sa podarilo predĺžiť trvanie prvolíniovej odpovede na 4 – 5 rokov [1 – 4]. Avšak aj napriek týmto pokrokom veľa pacientov relabuje. Obdobie remisie sa s každou následnou liečbou postupne skracuje a pacienti, ktorí už vyčerpali liečbu bortezomibom a imunomodulačnými liekmi (talidomid a lenalidomid), majú zlú prognózu s očakávaným mediánom intervalu bez ochorenia 5 mesiacov a mediánom celkového prežívania (overall survival – OS) 9 mesiacov [5]. Preto je neustále potreba zavádzania ďalších nových účinných liečebných modalít.
K pokrokom v liečbe MM prispelo aj zavedenie imunomodulačných látok. Prehľady klinických údajov o talidomide a lenalidomide boli publikované aj v časopise Klinická onkológia [6 – 8]. V tomto prehľadovom článku sa zameriavame na mechanizmus účinku, klinické dáta a odporúčania pre použitie novej imunomodulačnej látky – pomalidomidu, ktorý je od 5. 8. 2013 registrovaný v EU na liečbu relabujúceho/ refraktérneho myelómu u pacientov s aspoň dvomi predchádzajúcimi líniami s lenalidomidom aj bortezomibom, pričom došlo k progresii ochorenia pri poslednej línii.
Mechanizmus účinku pomalidomidu
Pomalidomid je imunomodulačná látka s priamym antimyelómovým a imunomodulačným účinkom a súčasne liekom inhibujúcim podporu stromálnych buniek pre rast nádorových buniek MM (tab. 1). Mechanizmus účinku imunomodulačných látok podrobne spracováva práca autorov Sedlařiková et al [9].
Tab. 1. Mechanizmus účinku pomalidomidu. 
Antimyelómový účinok pomalidomidu sa uskutočňuje cez reguláciu génov, zástavu bunkového cyklu a apoptózu buniek. Upreguláciou expresie tumor supresorového génu p21WAF-1, ktorý inhibuje aktivitu cyklín-dependentnej kinázy 2, dochádza k zástave bunkového cyklu v G1/G0 fáze [10]. Imunomodulačné látky indukujú zníženie C/ EBP-β proteínu, čo vedie k porušenej transkripcii interferón regulačného faktora 4 (IRF4). Downregulácia expresie IRF4 môže zvýšiť citlivosť myelómových buniek na liečbu a zabezpečuje antiproliferatívny účinok [11]. Pro-apoptotický efekt sa uskutočňuje prostredníctvom väzby ligandov TRAIL na príslušné receptory a cez interakcie FAS receptora a ligandu FAS-L s následnou aktiváciou kaspázy 8 [12]. Na pro-apoptotickom účinku sa podieľa aj supresia nukleárneho faktora NF-κB s potlačením produkcie niektorých cytokínov a rastových faktorov (TNF-α, IL-1β, IL-6) [13].
Imunomodulačný efekt pomalidomidu spočíva v urýchlení vyzrievania nediferencovaných T lymfocytov na Th1 lymfocyty s následným uvoľňovaním interleukínu IL-2 a interferónu IFN-γ, ktoré aktivujú NK bunky a dendritické bunky. Pomalidomid zvyšuje cytotoxickú aktivitu NK buniek a bunkami sprostredkovanú cytotoxicitu závislú od protilátky (antibody-dependent cell-mediated cytotoxicity – ADCC) [14,15]. Pomalidomid inhibuje proliferáciu regulačných T lymfocytov, a tým aj ich supresorovú funkciu a súčasne indukuje aktiváciu Rho GTP-ázy so zlepšením formácie T bunkových imunologických synáps [16,17].
Pomalidomid inhibuje väzbu myelómových buniek na stromálne bunky kostnej drene cez downreguláciu sekrécie adhéznych molekúl so súčasným znížením produkcie solubilných rastových faktorov (IL-6, TNF-α) a promótorov angiogenézy (vacsular endothelial growth factor – VEGF). Pomalidomid inhibuje migráciu endotelových buniek a angiogenézu cez zníženie koncentrácie VEGF a hypoxiou indukovaného faktora (HIF-1α) [18 – 20]. Zistilo sa, že pomalidomid má významný vplyv aj na kostnú chorobu cez inhibíciu RANKL (receptor activator of nuclear factor-κB ligand) a transkripčného faktora PU.1, čím zabraňuje resorpcii kosti [21,22]. Downregulácia PU.1, kľúčového transkripčného faktora v granulopoéze in vitro, môže mať za následok neutropéniu pri liečbe pomalidomidom [23]. Pomalidomid má aj protizápalový účinok cez inhibíciu transkripčnej aktivity COX-2 génu, čím redukuje hladinu COX-2 a prostaglandínov [24].
Expresia génu pre cereblon (CRBN) je dôležitý biomarker pre aktivitu a klinickú účinnosť imunomodulačných látok u MM [25]. CRBN je súčasť E3 ubiquitín ligázy, ktorá reguluje opravy, replikáciu a transkripciu DNA. Pomalidomid a lenalidomid majú vyššiu afinitu väzby na CRBN v porovnaní s talidomidom. Dôležitým zistením je antiproliferatívny účinok pomalidomidu v bunkových líniách rezistentných na lenalidomid, u ktorých došlo k zníženiu expresie CRBN proteínu. Kombinácia pomalidomidu s dexametazonom má synergický účinok a zvyšuje citlivosť bunkových línií rezistentných na lenalidomid [26]. In vitro štúdie ukázali, že pomalidomid je 10 - krát účinnejší ako lenalidomid a viac ako 15 000 - krát účinnejší ako talidomid pri inhibícii tumor nekrotizujúceho faktora (TNF-α) [13]. Pri porovnaní imunomodulačných látok, talidomid má výraznejší antiangiogénny efekt s minimálnou imunomodulačnou a pro-apoptotickou aktivitou. Pomalidomid aj lenalidomid majú imunomodulačný aj antiangiogénny účinok [27]. Ukázalo sa, že pomalidomid si ponecháva antimyelómový účinok v bunkových líniách rezistentných na lenalidomid, ale naopak lenalidomid neúčinkuje v bunkových líniách rezistentných na pomalidomid [26,28]. Predpokladá sa, že existujú ešte iné proteíny, ktoré modulujú účinok pomalidomidu, a sú potrebné ešte ďalšie prospektívne práce objasňujúce presný mechanizmus účinku pomalidomidu u pacientov refraktérnych na lenalidomid.
Štruktúra a farmakokinetika pomalidomidu
Pomalidomid, podobne ako lenalidomid, je derivát talidomidu, od ktorého sa odlišuje pridaním aminoskupiny na 4. uhlík izoindolínu. Rozdiely medzi jednotlivými imunomodulačnými látkami zobrazuje tab. 2. Pomalidomid sa dobre vstrebáva po perorálnom podaní a biologický polčas v organizme je približne osem hodín. Metabolizuje sa predovšetkým v pečeni, primárne prostredníctvom enzýmu CYP1A2 a CYP3A4, preto je dôležitá obozretnosť pri súčasnom podávaní liekov, ktoré inhibujú alebo indukujú tieto enzýmy. Medzi silné inhibítory aktivity CYP1A2 patria niektoré chinolóny (ciprofloxacín a enoxacín), ktoré môžu zvýšiť hladinu pomalidomidu a jeho toxicitu. Naopak iné chinolóny (norfloxacín, ofloxacín, levofloxacín a moxifloxacín) majú len minimálny alebo žiadny vplyv na aktivitu CYP1A2 [29]. Naopak fajčenie je silným induktorom CYP1A2 a môže znížiť účinnosť pomalidomidu. Len 2 % aktívnej látky sa vylučujú v nezmenenom stave močom, preto nie je potrebné dávku redukovať u pacientov so zhoršenými renálnymi parametrami [30]. Účinnosť a bezpečnosť pomalidomidu však bola zatiaľ sledovaná len u pacientov s miernym obličkovým postihnutím (kreatinín klírens > 45 ml/ min), pacienti s horšími renálnymi parametrami boli zo štúdie vylúčení. Ďalšie klinické údaje o možnosti podávania pomalidomidu u pacientov s ťažkým renálnym postihnutím (kreatinín klírens < 30 ml/ min) a u dialyzovaných pacientov by mali priniesť výsledky aktuálne prebiehajúcich štúdii MM-008 a MM-013 [31,32].
Tab. 2. Rozdiely medzi jednotlivými imunomodulačnými látkami. 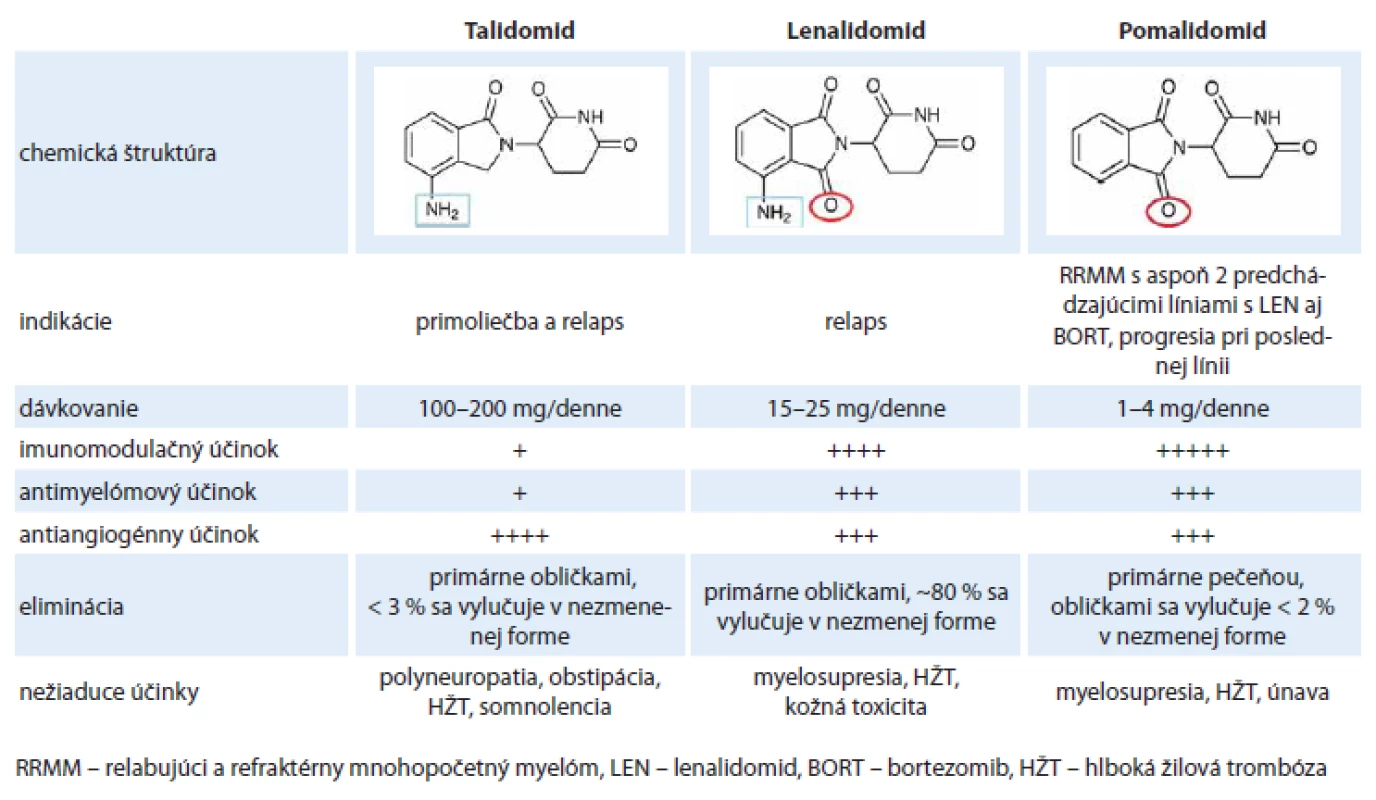
Klinické štúdie
Pomalidomid bol skúmaný vo viacerých klinických štúdiách vo fáze I a II u pacientov s relabovaným a/ alebo refraktérnym mnohopočetným myelómom (RRMM) a v súčasnosti sú už publikované údaje z III. fázy klinickej štúdie, ktorá bola zároveň aj registračnou štúdiou (tab. 3) [33 – 42].
Tab. 3. Prehľad najdôležitejších klinických štúdií s pomalidomidom. 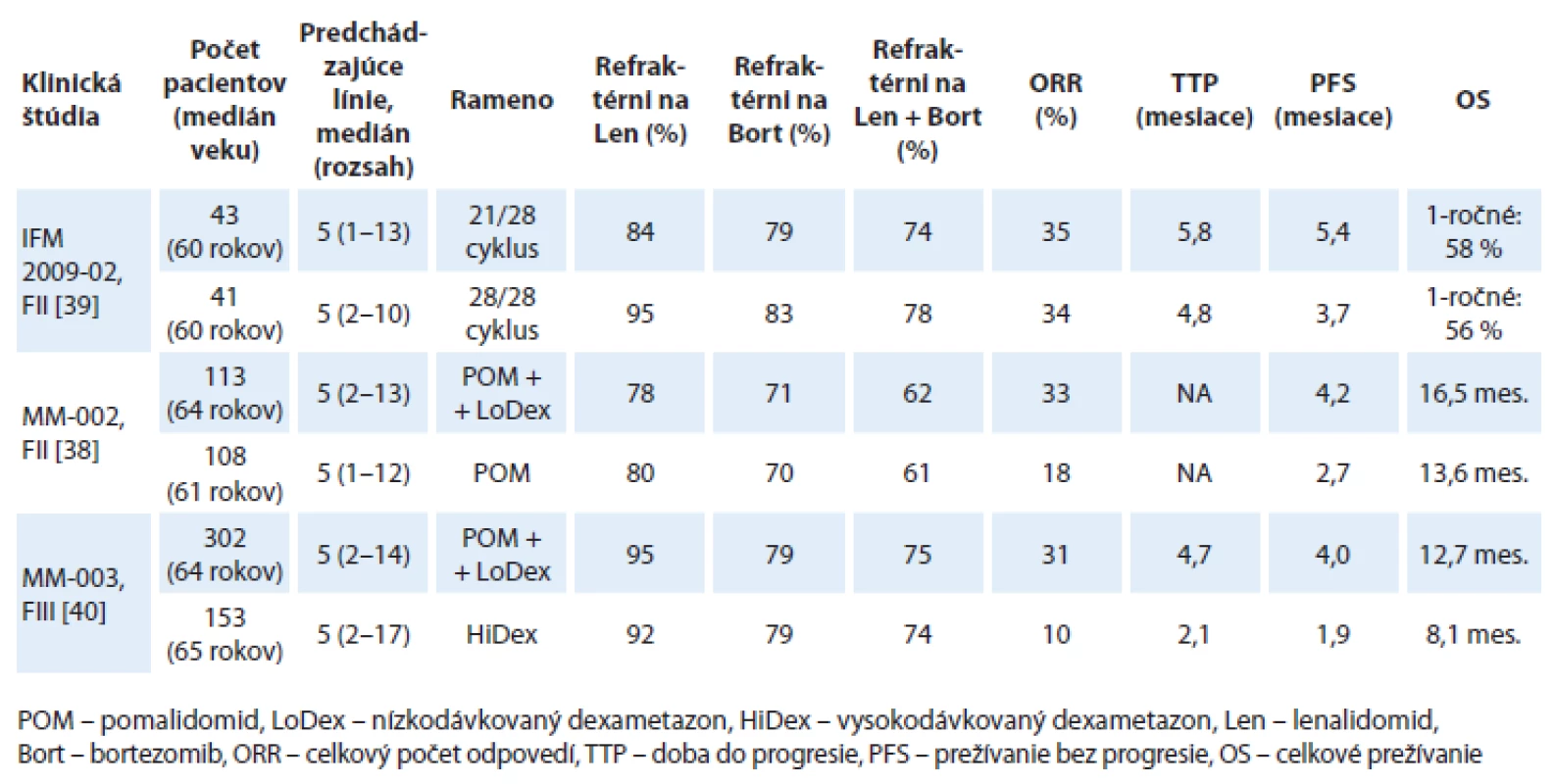
Vo fáze I klinickej štúdie MM-002 bola stanovená maximálna tolerovateľná a bezpečná dávka pomalidomidu na 4 mg p.o. po dobu 21 dní v 28-dňových cykloch [35]. Fáza II tejto klinickej štúdie sledovala účinnosť a bezpečnosť pomalidomidu podávaného v monoterapii alebo v kombinácii s nízkodávkovaným dexametazonom (LoDex) u pacientov s RRMM. Pri mediáne sledovania 14,2 mesiacov sa zistilo, že pomalidomid v kombinácii s LoDex v porovnaní so samotným pomalidomidom signifikantne predĺžil prežívanie bez progresie (progression free survival – PFS: 4,2 vs 2,7 mesiacov; pomer rizika – hazard ratio, HR = 0,68; p = 0,003), OS 16,5 vs 13,6 mesiacov a zvýšil počet celkových odpovedí – overall response rate, ORR (33 vs 18 %; p = 0,013) [38]. Pri porovnaní s novým proteazómovým inhibítorom carfilzomibom, bol v podobnej populácii pacientov s RRMM, zistený celkový počet ORR len 15 % s mediánom OS 11,9 mesiacov [43]. V II. fáze klinickej štúdie IFM 2009 - 02, podávanie pomalidomidu po dobu 28 dní v 28-dňových cykloch nepreukázalo vyššiu účinnosť v porovnaní s podávaním po dobu 21 dní v 28-dňových cykloch (ORR 34 vs 35 %). Navyše schéma s podávaním pomalidomidu po dobu 28 dní si vyžadovala častejšie podávanie rastových faktorov [39].
Nedávno bola publikovaná multicentrická, otvorená, randomizovaná štúdia fáza III (MM-003) porovnávajúca účinnosť a bezpečnosť pomalidomidu v kombinácii s nízkodávkovaným dexametazonom (LoDex) oproti vysokodávkovanému dexametazonu (HiDex) u pacientov s refraktérnym alebo relabujúcim a refraktérnym MM, u ktorých zlyhala predchádzajúca liečba bortezomibom a lenalidomidom. Do štúdie bolo randomizovaných 455 pacientov v pomere 2 : 1 (302 pacientov v ramene pomalidomid + LoDex a 153 pacientov v ramene s HiDex). V kombinácii s pomalidomidom pacienti dostávali LoDex v dávke 40 mg p.o. v deň 1, 8, 15, 22; u pacientov nad 75 rokov bola dávka redukovaná na 20 mg. Vysokodávkovaný dexametazon bol podávaný v dávke 40 mg p.o. v deň 1 – 4, 9 – 12 a 17 – 20. Predbežná analýza sa realizovala po objavení sa 134 úmrtí a po odslepení štúdie prešlo 76 pacientov v ramene s HiDex na liečbu pomalidomidom. Až 95 % pacientov v ramene s pomalidomidom bolo rezistentných na lenalidomid, 79 % na bortezomib a 75 % pacientov bolo rezistentných na obidva lieky. S mediánom sledovania 10 mesiacov sa zaznamenalo v ramene s pomalidomidom a nízkodávkovaným dexametazonom zníženie miery progresie o 52 %. Doba prežívania bez progresie bola v ramene s pomalidomidom a nízkodávkovaným dexametazonom 4,0 mesiaca a v ramene s HiDex bola 1,9 mesiacov (HR = 0,48; 95% CI 0,39 – 0,60; p < 0,001) a doba do progresie (time to progresion – TTP) bola signifikantne dlhšia v ramene s pomalidomidom a LoDex (4,7 vs 2,1 mesiaca; HR = 0,46; 95% CI 0,36 – 0,59; p < 0,0001). U pacientov liečených pomalidomidom a LoDex bolo zistené zlepšené OS (12,7 vs 8,1 mesiacov; HR = 0,74; 95% CI 0,56 – 0,97; p = 0,03). Avšak údaj o OS je podhodnotený, nakoľko v čase analýzy 50 % pacientov zaradených do ramena s HiDex dostávala pomalidomid. Celkový počet odpovedí bol signifikantne vyšší u pacientov s pomalidomidom a LoDex oproti kontrolnému ramenu (31 vs 10 %; odds ratio – pomer pravdepodobností, OR = 4,22; 95% CI 2,35 – 7,58; p < 0,0001) [40]. Celkový počet liečebných odpovedí u dvojito refraktérnych pacientov, aj na lenalidomid aj na bortezomib, bol v klinických štúdiách dosiahnutý u 26 – 31 % pacientov (tab. 4).
Tab. 4. Účinnosť pomalidomidu v kombinácii s nízkodávkovaným dexametazonom u dvojito refraktérnych pacientov (bortezomib aj lenalidomid). 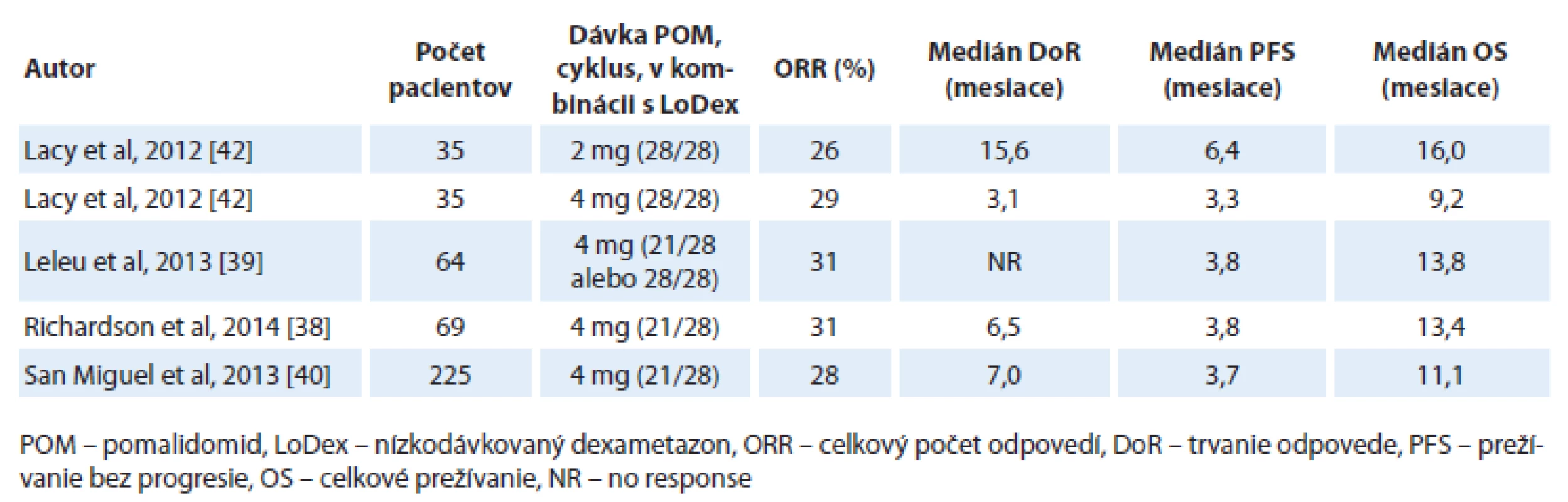
Účinnosť pomalidomidu bola potvrdená aj u pacientov s nepriaznivou cytogenetikou. V klinickej štúdii MM-003, pacienti s nepriaznivými cytogenetickými markermi, ktorí boli liečení pomalidomidom a LoDex, dosiahli lepšie PFS a OS ako pacienti s vysokodávkovaným dexametazonom [44]. V II. fáze klinickej štúdie IFM 2010 - 02 bola účinnosť a bezpečnosť pomalidomidu sledovaná u pacientov s RRMM s pozitivitou del(17p) a/ alebo t(4,14). Pacienti s del(17p) viacej profitovali z podávania pomalidomidu ako pacienti s t(4,14) (TTP 8 vs 3 mesiace; OS nebol dosiahnutý vs 9 mesiacov) [45].
Účinnosť a bezpečnosť pomalidomidu nebola ovplyvnená vekom. Pacienti starší ako 65 rokov mali podobný PFS ako pacienti mladší ako 65 rokov [40]. Podobne boli zistené lepšie výsledky ohľadom kvality života u pacientov liečených pomalidomidom a LoDex oproti pacientom s HiDex [46].
Bezpečnosť
Nežiaduce účinky pomalidomidu a lenalidomidu sú podobné. Medzi najčastejšie patrí myelosupresia. V klinických štúdiách je incidencia 3. a 4. stupňa neutropénie 41 – 65 %, trombocytopénie 19 – 28 % a anémie v rozmedzí 22 – 37 % [38 – 40]. Pneumónia/ infekčné komplikácie a únava boli najčastejšie nehematologické nežiaduce účinky 3. a 4. stupňa. V klinickej štúdii MM-003 boli infekčné komplikácie porovnateľné u pacientov s pomalidomidom a LoDex oproti pacientom s HiDex (30 vs 24 %), febrilná neutropénia sa objavila u 10 % pacientov s pomalidomidom. Substitúciu rastovými faktormi dostalo 43 % pacientov, 67 % pacientov si vyžadovalo prerušenie liečby a 27 % redukciu dávky v ramene s pomalidomidom. Neutropénia sa najčastejšie vyskytovala v priebehu prvých cyklov liečby pomalidomidom. Zo závažných nežiaducich účinkov 5. stupňa sa vyskytovali infekčné komplikácie (5 % v ramene s pomalidomidom vs 11 % v ramene s HiDex) [40].
Pri použití tromboprofylaxie sa venózny tromboembolizmus vyskytol u 2 % pacientov s pomalidomidom a 1 % pacientov s HiDex. Z ostatných nežiaducich účinkov sa u pacientov s pomalidomidom v porovnaní s kontrolným ramenom vyskytovala periférna polyneuropatia akéhokoľvek stupňa (15 vs 11 %, pričom polyneuropatia 3. a 4. stupňa bola v oboch ramenách iba 2 %) [40]. Porovnanie jednotlivých nežiaducich účinkov imunomodulačných liekov sumarizuje tab. 5.
Tab. 5. Najčastejšie nežiaduce účinky pomalidomidu v klinických štúdiách [38–40]. ![Najčastejšie nežiaduce účinky pomalidomidu v klinických štúdiách [38–40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/65e352f3d4967148744416f01ac6c57f.png)
Nové kombinačné režimy s pomalidomidom
V rámci I. a II. fázy klinických štúdií sa pomalidomid skúša u pacientov s RRMM okrem podávania s dexametazonom aj v nových kombináciách.
Pomalidomid sa skúmal spolu s cyklofosfamidom a prednizonom (PCP) u pacientov s RRMM s mediánom 3 prechádzajúcich línií. Celkový počet odpovedí bol 51 % a pri mediáne sledovania 14,8 mesiacov bol dosiahnutý PFS v dĺžke 10,4 mesiacov a 1 - ročné OS bolo 69 %. Medzi najčastejšie nežiaduce účinky patrila cytopénia [47].
Už v predchádzajúcich štúdiách bol potvrdený efekt kombinácie imunomodulačných látok a inhibítorov proteazómu [48]. V klinickej štúdii MM-005 sa sledoval pomalidomid a dexametazon v kombinácii s bortezomibom (PVD) bez dosiahnutia toxicity limitujúcej dávku (DLT) a s dosiahnutým ORR 75 %. Maximálna plánovaná dávka pomalidomidu 4 mg D 1 – 14, bortezomibu 1,3 mg/ m2 D 1, 4, 8 a 11 a dexametazonu 20 mg D 1 – 2, 4 – 5, 8 – 9 a 11 – 12 sa inkorporovala do III. fázy klinickej štúdie MM-007 porovnávajúcej účinnosť PVD vs VD [49]. V II. fáze klinickej štúdie pomalidomidu s carfilzomibom a dexametazonom (Car-Pom-d), ktorú tvorili pacienti refraktérni na podávanie lenalidomidu s mediánom 6 predchádzajúcich línií, sa zistil ORR 64 % [50]. Medzi najčastejšie nežiaduce účinky patrila hematologická toxicita a polyneuropatia 1. a 2. stupňa u 32 – 43 % pacientov [49,50].
Klaritromycín má imunomodulačný účinok v dôsledku downregulácie IL-6 a aktivácie NK buniek a súčasne má aj pro-apoptotický efekt. Pridanie klaritromycínu k pomalidomidu zvýši jeho antimyelómový efekt. V II. fáze klinickej štúdie kombinácia pomalidomidu, klaritromycínu a dexametazonu, u pacientov s mediánom 5 prechádzajúcich línií a refraktérnych na lenalidomid aj bortezomib, dosiahla ORR 56 % s rýchlym nástupom odpovede po 1 – 2 cykloch [51].
Autori Berenson et al sledovali účinnosť kombinácie pomalidomidu s lipozomálnym doxorubicínom. Celkový počet odpovedí u pacientov s mediánom 5 predchádzajúcich línií bol 34,5 % [52].
V súčasnosti prebiehajú ďalšie klinické štúdie s pomalidomidom aj v iných indikáciách ako MM, napr. u pacientov vo fibrotickom štádiu myeloproliferatívnych neoplázií, Waldenströmovej makroglobulinémie, systémovej amyloidózy, na liečbu graft vs host disease, ako aj u pacientov s nehematologickými ochoreniami ako je sarkóm a systémová skleróza s intersticiálnym pľúcnym procesom.
Záver a odporúčania pre prax
Praktické odporúčania pre liečbu pomalidomidom boli nedávno publikované v časopise Leukemia [53]. Pomalidomid je registrovaný na liečbu relabujúceho/ refraktérneho myelómu u pacientov s aspoň dvomi predchádzajúcimi líniami s lenalidomidom aj bortezomibom, pričom došlo k progresii ochorenia pri poslednej línii.
Dávkovanie
Optimálna dávka je 4 mg p.o. po dobu 21 dní v 28-dňových cykloch a synergický efekt sa potvrdil pri podávaní spolu s dexametazonom (u pacientov do 75 rokov v dávke 40 mg 1-krát týždenne a u pacientov nad 75 rokov v dávke 20 mg 1-krát týždenne). Dĺžka podávania pomalidomidu nie je zatiaľ stanovená, v rámci klinických štúdií sa podáva až do objavenia sa progresie ochorenia alebo neakceptovateľnej toxicity. Liečba by sa nemala zahájiť u pacienta s absolútnym počtom neutrofilov pod 1 000/ µl a pri počte trombocytov pod 75 000/ µl pri menej ako 50% infiltrácii kostnej drene (KD) alebo pod 30 000/ µl pri viac ako 50% infiltrácii KD plazmatickými bunkami. Krvný obraz by mal byť kontrolovaný každé 1 – 2 týždne počas prvých 8 týždňov liečby, ďalej v mesačných intervaloch. V prípade cytopénie je potrebná redukcia dávky s možným podaním rastových faktorov G-CSF v dávke 300 µg/ kg 3 po sebe nasledujúce dni D 22 – 24 v rámci 28-dňového cyklu. U pacientov s ľahkou až stredne ťažkou renálnou insuficienciou, ani u pacientov nad 65 rokov nie je potrebná úprava dávky [53].
Profylaktické opatrenia
U vysokorizikových pacientov sa odporúča antibiotická profylaxia, najmä počas prvých troch mesiacov liečby, a u veľmi vysokorizikových pacientov (neutropénia a/ alebo predchádzajúce infekcie) by mala byť profylaxia podávaná počas celej liečby pomalidomidom. V rámci profylaxie sú vhodné antibiotiká ako trimetoprim-sulfametoxazol, penicilín, amoxicilín, chinolóny a ďalšie [54,55]. Pri použití chinolónov treba uprednostniť tie, ktoré majú minimálny alebo žiadny vplyv na CYP1A2. V rámci tromboprofylaxie sa u pacientov so štandardným rizikom (žiadny rizikový faktor) odporúča aspirín a u pacientov s vysokým rizikom (aspoň jeden rizikový faktor) sa odporúča tromboprolyfaxia nízkomolekulovým heparínom v profylaktickom dávkovaní minimálne po dobu štyroch mesiacov s následným prehodnotením rizika [56,57].
Na základe dostupných výsledkov klinických štúdií je pomalidomid účinný imunomodulačný liek u pacientov s RRMM. Sú však potrebné ešte ďalšie klinické štúdie na určenie optimálneho času zahájenia liečby pomalidomidom, vhodného kombinačného režimu, ako aj dĺžky jeho podávania s cieľom zlepšiť celkové prežívanie pacientov s MM a prispieť k otázke vyliečiteľnosti tohto ochorenia.
Táto práca bola podporená grantom VEGA č. 1/0906/14.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ľubica Roziaková, Ph.D.
Klinika hematológie a transfuziológie
LF UK a UN Bratislava
Nemocnica sv. Cyrila a Metoda
Antolská 11
851 07 Bratislava-Petržalka
Slovensko
e-mail: lubica.roziakova@gmail.com
Obdrženo: 5. 6. 2014
Přijato: 26. 6. 2014
Zdroje
1. Attal M, Lauwers ‑ Cances V, Marit G et al. Lenalidomide maintenance after stem ‑ cell transplantation for multiple myeloma. N Engl J Med 2012; 366(19): 1782 – 1791. doi: 10.1056/ NEJMoa1114138.
2. McCarthy PL, Owzar K, Hofmeister CC et al. Lenalidomide after stem ‑ cell transplantation for multiple myeloma. N Engl J Med 2012; 366(19): 1770 – 1781. doi: 10.1056/ NEJMoa1114083.
3. Palumbo A, Hajek R, Delforge M et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. N Engl J Med 2012; 366(19): 1759 – 1769. doi: 10.1056/ NEJMoa1112704.
4. Rossi A, Mark T, Jayabalan D et al. BiRd (clarithromycin, lenalidomide, dexamethasone): an update on long term lenalidomide therapy in previously untreated patients with multiple myeloma. Blood 2013; 121(11): 1982 – 1985. doi: 10.1182/ blood ‑ 2012 ‑ 08 ‑ 448563.
5. Kumar SK, Lee JH, Lahuerta JJ et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter International Myeloma Working Group study. Leukemia 2012; 26(1): 149 – 157. doi: 10.1038/ leu.2011.196.
6. Hájek R, Plonková H, Gumulec J. Thalidomide in the treatment of multiple myeloma: focus on combination with bortezomib. Klin Onkol 2013; 26(3): 163 – 169.
7. Holánek M, Hájek R. The use of lenalidomide in the treatment of multiple myeloma. Klin Onkol 2010; 23(2): 67 – 72.
8. Roziaková L, Mistrík M. Lenalidomide maintenance therapy in patients with multiple myeloma. Klin Onkol 2013; 26(3): 186 – 190.
9. Sedlarikova L, Kubiczkova L, Sevcikova S et al. Mechanism of immunomodulatory drugs in multiple myeloma. Leuk Res 2012; 36(10): 1218 – 1224. doi: 10.1016/ j.leukres.2012.05.010.
10. Escoubet ‑ Lozach L, Lin IL, Jensen ‑ Pergakes K et al. Pomalidomide and lenalidomide induce p21 WAF ‑ 1 expression in both lymphoma and multiple myeloma through a LSD1 - mediated epigenetic mechanism. Cancer Res 2009; 69(18): 7347 – 7356. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 08 ‑ 4898.
11. Li S, Pal R, Monaghan SA et al. IMiD immunomodulatory compounds block C/ EBPβ translation through eIF4E down ‑ regulation resulting in inhibition of MM. Blood 2011; 117(19): 5157 – 5165. doi: 10.1182/ blood ‑ 2010 ‑ 10 ‑ 314278.
12. Mitsiades N, Mitsiades CS, Poulaki V et al. Apoptotic signaling induced by immunomodulatory thalidomide analogs in human multiple myeloma cells: therapeutic implications. Blood 2002; 99(12): 4525 – 4530.
13. Corral LG, Haslett PA, Muller GW et al. Differential cytokine modulation and T cell activation by two distinct classes of thalidomide analogues that are potent inhibitors of TNF‑alpha. J Immunol 1999; 163(1): 380 – 386.
14. Hayashi T, Hideshima T, Akiyama M et al. Molecular mechanisms whereby immunomodulatory drugs activate natural killer cells: clinical application. Br J Haematol 2005; 128(2): 192 – 203.
15. Reddy N, Hernandez ‑ Ilizaliturri FJ, Deeb G et al. Immunomodulatory drugs stimulate natural killer ‑ cell function, alter cytokine production by dendritic cells, and inhibit angiogenesis enhancing the anti‑tumour activity of rituximab in vivo. Br J Haematol 2008; 140(1): 36 – 45.
16. Galustian C, Meyer B, Labarthe MC et al. The anti‑cancer agents lenalidomide and pomalidomide inhibit the proliferation and function of T regulatory cells. Cancer Immunol Immunother 2009; 58(7): 1033 – 1045. doi: 10.1007/ s00262 ‑ 008 ‑ 0620 ‑ 4.
17. Xu Y, Li J, Ferguson GD et al. Immunomodulatory drugs reorganize cytoskeleton by modulating rho GTPases. Blood 2009; 114(2): 338 – 345. doi: 10.1182/ blood ‑ 2009 ‑ 02 ‑ 200543.
18. Lu L, Payvandi F, Wu L et al. The anti‑cancer drug lenalidomide inhibits angiogenesis and metastasis via multiple inhibitory effects on endothelial cell function in normoxic and hypoxic conditions. Microvasc Res 2009; 77(2): 78 – 86. doi: 10.1016/ j.mvr.2008.08.003.
19. Dankbar B, Padró T, Leo R et al. Vascular endothelial growth factor and interleukin‑6 in paracrine tumor ‑ stromal cell interactions in multiple myeloma. Blood 2000; 95(8): 2630 – 2636.
20. Gupta D, Treon SP, Shima Y et al. Adherence of multiple myeloma cells to bone marrow stromal cells upregulates vascular endothelial growth factor secretion: therapeutic applications. Leukemia 2001; 15(12): 1950 – 1961.
21. Anderson G, Gries M, Kurihara N et al. Thalidomide derivative CC ‑ 4047 inhibits osteoclast formation by down ‑ regulation of PU.1. Blood 2006; 107(8): 3098 – 3105.
22. Bolzoni M, Abeltino M, Storti P et al. The immunomodulatory drugs lenalidomide and pomalidomide inhibit multiple myeloma‑induced osteoclast formation and RANKL/ OPG ratio in myeloma microenvironment targeting the expression of adhesion molecules. Blood (ASH Annu Meet Abstr) 2010; 116: abstr. 448.
23. Pal R, Monaghan SA, Hassett AC et al. Immunomodulatory derivatives induce PU.1 down ‑ regulation, myeloid maturation arrest, and neutropenia. Blood 2010; 115(3): 605 – 614. doi: 10.1182/ blood ‑ 2009 ‑ 05 ‑ 221077.
24. Ferguson GD, Jensen ‑ Pergakes K, Wilkey C et al. Immunomodulatory drug CC ‑ 4047 is a cell‑type and stimulus ‑ selective transcriptional inhibitor of cyclooxygenase 2.J Clin Immunol 2007; 27(2): 210 – 220.
25. Broyl A, Kuiper R, van Duin M et al. High cereblon expression is associated with better survival in patients with newly diagnosed multiple myeloma treated with thalidomide maintenance. Blood 2013; 121(4): 624 – 627. doi: 10.1182/ blood ‑ 2012 ‑ 06 ‑ 438101.
26. Rychak E, Mendy D, Miller K et al. Overcoming resistance: the use of pomalidomide (Pom) and dexamethasone (Dex) in re‑sensitizing lenalidomide (Len)‑resistant multiple myeloma (MM) cells. Haematologica 2011; 96 : 126.
27. Quach H, Ritchie D, Stewart AK et al. Mechanism of action of immunomodulatory drugs (IMiDS) in multiple myeloma. Leukemia 2010; 24(1): 22 – 32. doi: 10.1038/ leu.2009.236.
28. Lopez ‑ Girona A, Mendy D, Ito T et al. Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide. Leukemia 2012; 26(11): 2326 – 2335. doi: 10.1038/ leu.2012.119.
29. Robson RA. The effects of quinolones on xanthine pharmacokinetics. Am J Med 1992; 92 (Suppl 4A): 22S – 25S.
30. Hoffmann M, Kasserra C, Reyes J et al. Absorption, metabolism and excretion of [14C]pomalidomide in humans following oral administration. Cancer Chemother Pharmacol 2013; 71(2): 489 – 501. doi: 10.1007/ s00280 ‑ 012 ‑ 2040 ‑ 6.
31. Matous J, Siegel DS, Duong HK et al. MM ‑ 008: a phase 1trial evaluating pharmacokinetics and tolerability of pomalidomide + low‑dose dexamethasone in patients with relapsed/ refractory multiple myeloma and renal impairment. Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 5393.
32. Clinicaltrials.gov [homepage on the Internet]. ClinicalTrial.gov. A service of the U.S. National Institutes of Health. [cited 2014 May 31]. Available from: http:/ / clinicaltrials.gov/ .
33. Schey SA, Fields P, Bartlett JB et al. Phase I study of an immunomodulatory thalidomide analog, CC ‑ 4047, in relapsed or refractory multiple myeloma. J Clin Oncol 2004; 22(16): 3269 – 3276.
34. Streetly MJ, Gyertson K, Daniel Y et al. Alternate day pomalidomide retains anti‑myeloma effect with reduced adverse events and evidence of in vivo immunomodulation. Br J Haematol 2008; 141(1): 41 – 51. doi: 10.1111/ j.1365 ‑ 2141.2008.07013.x.
35. Richardson PG, Siegel D, Baz R et al. Phase 1 study of pomalidomide MTD, safety, and efficacy in patients with refractory multiple myeloma who have received lenalidomide and bortezomib. Blood 2013; 121(11): 1961 – 1967. doi: 10.1182/ blood ‑ 2012 ‑ 08 ‑ 450742.
36. Lacy MQ, Hayman SR, Gertz MA et al. Pomalidomide (CC4047) plus low‑dose dexamethasone as therapy for relapsed multiple myeloma. J Clin Oncol 2009; 27(30): 5008 – 5014. doi: 10.1200/ JCO.2009.23.6802.
37. Lacy MQ, Hayman SR, Gertz MA et al. Pomalidomide (CC4047) plus low dose dexamethasone (pom/ dex) is active and well tolerated in lenalidomide refractory multiple myeloma (MM). Leukemia 2010; 24(11): 1934 – 1939. doi: 10.1038/ leu.2010.190.
38. Richardson PG, Siegel DS, Vij R et al. Pomalidomide alone or in combination with low‑dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014; 123(12): 1826 – 1832. doi: 10.1182/ blood ‑ 2013 ‑ 11 ‑ 538835.
39. Leleu X, Attal M, Arnulf B et al. Pomalidomide plus low dose dexamethasone is active and well tolerated in bortezomib and lenalidomide ‑ refractory multiple myeloma: Intergroupe Francophone du Myelome 2009 - 02. Blood 2013; 121(11): 1968 – 1975. doi: 10.1182/ blood ‑ 2012 ‑ 09 ‑ 452375.
40. San Miguel J, Weisel K, Moreau P et al. Pomalidomide plus low‑dose dexamethasone versus high‑dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM ‑ 003): a randomised, open ‑ label, phase 3 trial. Lancet Oncol 2013; 14(11): 1055 – 1066. doi: 10.1016/ S1470 ‑ 2045(13)70380 ‑ 2.
41. Lacy MQ, Allred JB, Gertz MA et al. Pomalidomide plus low‑dose dexamethasone in myeloma refractory to both bortezomib and lenalidomide: comparison of 2 dosing strategies in dual ‑ refractory disease. Blood 2011; 118(11): 2970 – 2975. doi: 10.1182/ blood ‑ 2011 ‑ 04 ‑ 348896.
42. Lacy MQ, Kumar SK, LaPlant BR et al. Pomalidomide plus low‑dose dexamethasone (pom/ dex) in relapsed myeloma: long term follow up and factors predicing outcome in 345 patients. Blood (ASH Annual Meeting Abstracts) 2012; 120: abstr. 201.
43. Siegel DS, Martin T, Wang M et al. A phase 2 study of single‑agent carfilzomib (PX ‑ 171 - 003 - A1) in patients with relapsed and refractory multiple myeloma. Blood 2012; 120(14): 2817 – 2825. doi: 10.1182/ blood ‑ 2012 ‑ 05 ‑ 425934.
44. Dimopoulos MA, Weisel KC, Song KW et al. Final analysis, cytogenetics, long‑term treatment, and long‑term survival in MM ‑ 003, a phase 3 study comparing pomalidomideţlow‑dose dexamethasone (POM+LoDEX) vs high‑dose dexamethasone (HiDEX) in relapsed/ refractory multiple myeloma (RRMM). Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 408.
45. Leleu X, Karlin L, Macro M et al. Pomalidomide plus low‑dose dexamethasone in relapsed or refractory multiple myeloma (RRMM) with deletion (del)17p and/ or translocation t(4;14). Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 689.
46. San Miguel J, Weisel KC, Moreau P et al. Quality of life improvements for pomalidomide+low‑dose dexamethasone (POM+LoDEX) in relapsed and refractory MM (RRMM). Clin Lymphoma Myeloma Leuk (IMW Annu Meet Abstr) 2013; 13 (Suppl 1): abstr. 430.
47. Larocca A, Montefusco V, Bringhen S et al. Pomalidomide, cyclophosphamide and prednisone for relapsed/ refractory multiple myeloma: a multicenter phase 1/ 2 open label study. Blood 2013; 122(16): 2799 – 2806. doi: 10.1182/ blood ‑ 2013 ‑ 03 ‑ 488676.
48. Kumar S, Flinn I, Richardson PG et al. Randomized, multicenter, phase 2 study (EVOLUTION) of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma. Blood 2012; 119(19): 4375 – 4382. doi: 10.1182/ blood ‑ 2011 ‑ 11 ‑ 395749.
49. Richardson PG, Hofmeister CC, Siegel D et al. mm ‑ 005: a phase 1 trial of pomalidomide, bortezomib, and low‑dose dexamethasone (pvd) in relapsed and/ or refractory multiple myeloma (RRMM). Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 1969.
50. Shah JJ, Stadtmauer EA, Abonour R et al. Phase I/ IIdose expansion of a multi‑center trial of carfilzomib and pomalidomide with dexamethasone (car ‑ pom ‑ d) in patients with relapsed/ refractory multiple myeloma. Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 690.
51. Mark TM, Boyer A, Rossi AC et al. Clapd (clarithromycin, pomalidomide, dexamethasone) therapy in relapsed or refractory multiple myeloma. Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 1955.
52. Berenson JR, Hilger JD, Klein L et al. Pomalidomide, dexamethasone and pegylated liposomal doxorubicin for patients with relapsed/ refractory multiple myeloma: results from a phase 1/ 2 trial. Blood (ASH Annu Meet Abstr) 2013; 122: abstr. 3218.
53. Dimopoulos MA, Leleu X, Palumbo A et al. Expert panel consensus statement on the optimal use of pomalidomide in relapsed and refractory multiple myeloma. Leukemia. In press 2014. doi: 10.1038/ leu.2014.60.
54. Ludwig H, Miguel JS, Dimopoulos MA et al. International Myeloma Working Group recommendations for global myeloma care. Leukemia 2014; 28(5): 981 – 992. doi: 10.1038/ leu.2013.293.
55. Flowers CR, Seidenfeld J, Bow EJ et al. Antimicrobial prophylaxis and outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2013; 31(6): 794 – 810. doi: 10.1200/ JCO.2012.45.8661.
56. Palumbo A, Rajkumar SV, Dimopoulos MA et al. Prevention of thalidomide ‑ and lenalidomide‑associated thrombosis in myeloma. Leukemia 2008; 22(2): 414 – 423.
57. Leleu X, Rodon P, Hulin C et al. MELISSE, a large multicentric observational study to determine risk factors of venous thromboembolism in patients with multiple myeloma treated with immunomodulatory drugs. Thromb Haemost 2013; 110(4): 844 – 851. doi: 10.1160/TH13 ‑ 02 ‑ 0140.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Soutěž o nejlepší práciČlánek Prof. Žaloudík šedesátiletýČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Soutěž o nejlepší práci
- Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
- Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii
- Úloha CDK12 v iniciaci a rozvoji nádorů a její klinické konsekvence
- Informace z České onkologické společnosti
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta
- Neobvyklá nádorová infiltrace ušního lalůčku
- Těm, které by to mohlo zajímat – fotodiagnostika a fotodynamická léčba
- Aktuality z odborného tisku
- Prof. Žaloudík šedesátiletý
- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



