-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mutace genu EGFR u pacientů s pokročilým NSCLC
EGFR Mutations in Patients with Advanced NSCLC
Background:
Molecular targeted therapy based on tyrosine kinase inhibitors, directed at the epidermal growth factor receptor (EGFR) is one of novel options for management of NSCLC. EGFR gene mutations, exon 19 deletions and exon 21 point mutations (L858R) are good predictors of response to EGFR-TKI treatment. The aim of this study was to assess the incidence of EGFR mutations in a large cohort of Europeans with advanced NSCLC and subsequently to evaluate their impact on the effect of EGFR-TKI treatment.Patients and Methods:
In total, 613 patients with advanced stage NSCLC (IIIB, IV) were genetically tested. The effect of treatment was evaluated in 410 patients treated with EGFR-TKI. Survival was evaluated using Kaplan-Meier method, and statistical comparison was performed using log-rank test.Results:
EGFR mutations were detected in 73 (11.9%) patients. Exon 19 deletions were detected in 49 patients, exon 21 point mutations (L858R) were detected in 22 patients, and both mutation types were detected in 2 patients. An increased incidence of EGFR mutations among patients with adenocarcinoma (14.9% vs 7.8%, p = 0.008), women (20.2% vs 7.1%, p < 0.001) and nonsmokers (29.9% vs 7.0%, p < 0.001) was demonstrated. Sixty patients with EGFR mutation and 350 patients with wild-type EGFR were treated with EGFR-TKI. Median PFS in patients harboring EGFR mutation was 7.2 vs 2.0 months in patients harboring wild-type EGFR (p < 0.001), median OS in patients harboring EGFR mutation was 14.5 vs 7.5 months in patients harboring wild-type EGFR (p = 0.019).Conclusion:
The incidence of EGFR mutations in the studied population, their increased incidence among patients with adenocarcinoma, women and non-smokers correlated with data previously published. Results of survival analysis in patients treated with EGFR-TKI confirmed high potential of EGFR mutations to predict good effect of the EGFR-TKI treatment. Genetic testing in patients with NSCLC should be a standard part of diagnostic proceduresKey words:
NSCLC – EGFR gene – EGFR protein – protein kinase inhibitors – EGFR mutation – molecular targeted therapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
10. 1. 2012Accepted:
24. 2. 2012
Autoři: O. Fiala 1; M. Pešek 2; J. Fínek 1; F. Brůha 2; Z. Bortlíček 3; J. Krejčí 4; L. Benešová 5; M. Minárik 5
Působiště autorů: Onkologické a radioterapeutické oddělení, FN Plzeň 1; Klinika TRN, FN Plzeň 2; Institut biostatistiky a analýz, MU Brno 3; Klinika pneumologie a hrudní chirurgie, FN Na Bulovce Praha 4; Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, Praha 5
Vyšlo v časopise: Klin Onkol 2012; 25(4): 267-273
Kategorie: Původní práce
Souhrn
Východiska:
Léčba tyrozinkinázovými inhibitory, které blokují aktivaci kaskády receptoru pro epidermální růstový faktor (EGFR-TKI), představuje jednu z nových modalit léčby pokročilého NSCLC. Mutace genu EGFR, delece na 19. exonu a bodová mutace na 21. exonu (L858R) jsou prediktorem dobré odpovědi na léčbu EGFR-TKI. Zmapovali jsme incidenci mutací genu EGFR u pacientů s pokročilým NSCLC v naší populaci a posoudili jejich vliv na efekt léčby EGFR-TKI.Soubor pacientů a metody:
Genetické vyšetření (delece na 19. exonu a bodová mutace na 21. exonu) bylo provedeno u 613 pacientů s pokročilým NSCLC (stadium IIIB, IV). Efekt léčby (PFS, OS) EGFR-TKI byl hodnocen u 410 pacientů léčených EGFR-TKI. Přežití bylo hodnoceno metodikou podle Kaplana-Meiera a statistické srovnání bylo provedeno log-rank testem.Výsledky:
Mutace genu EGFR byla prokázána u 73 (11,9 %) pacientů, 540 pacientů bylo nositeli wild-type EGFR genu. Delece na 19. exonu byla zjištěna u 49 pacientů, bodová mutace na 21. exonu (L858R) byla zjištěna u 22 pacientů, obě mutace byly zjištěny u 2 pacientů. Byl prokázán zvýšený výskyt mutací genu EGFR u pacientů s adenokarcinomem (14,9 % vs 7,8 %, p = 0,008), žen (20,2 % vs 7,1 %, p < 0,001) a nekuřáků (29,9 % vs 7,0 %, p < 0,001). Šedesát pacientů s mutací genu EGFR a 350 pacientů s wild-type EGFR genem bylo léčeno EGFR-TKI. Medián PFS při léčbě EGFR-TKI u pacientů s mutací EGFR činil 7,2 vs 2,0 měsíce u pacientů s wild-type EGFR (p < 0,001), medián OS u pacientů s mutací EGFR činil 14,5 vs 7,5 měsíce u pacientů s wild-type EGFR (p = 0,019).Závěr:
Výskyt mutací genu EGFR u NSCLC v naší populaci i jejich zvýšený výskyt u pacientů s adenokarcinomem, žen a nekuřáků koreluje s daty, která byla publikována v literatuře. Výsledky analýzy přežití u pacientů léčených EGFR-TKI potvrzují vysoký potenciál aktivačních mutací EGFR pro predikci dobrého efektu léčby EGFR-TKI.Klíčová slova:
NSCLC – EGFR gen – EGFR protein – tyrozinkinázové inhibitory – EGFR mutace – molekulárně cílená léčbVýchodiska
Karcinom plic zaujímá přední místa v incidenci i mortalitě nádorových onemocnění, a to jak celosvětově, tak i v České republice. Nemalobuněčný karcinom plic (NSCLC) je nejčastějším histologickým typem, který představuje více než 80 % všech plicních karcinomů. Léčba pokročilých stadií NSCLC je velmi obtížná i přes nepochybně významné pokroky zaznamenané v posledních letech. K prodloužení přežití pacientů s pokročilým stadiem NSCLC významně přispívá zavedení molekulárně cílené léčby tyrozinkinázovými inhibitory, které blokují aktivaci kaskády receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR). Mechanizmus účinku EGFR tyrozinkinázových inhibitorů (EGFR-TKI) spočívá v inhibici fosforylace tyrozinkinázové domény, která je lokalizována na intracelulární části receptoru. V léčbě NSCLC jsou běžně užívány dva EGFR-TKI, erlotinib (Tarceva®) a gefitinib (Iressa®). Význam mutací genu EGFR jako prediktoru dobré odpovědi na léčbu EGFR-TKI byl poprvé popsán autory Lynchem a Paezem v roce 2004 [1,2] a následně byl potvrzen řadou dalších prací, včetně velkých klinických studií [3–13]. Delece na 19. exonu a bodové mutace na 21. exonu (L858R) představují více než 90 % všech mutací genu EGFR a jsou standardně testovány [14]. Mutace genu EGFR se nachází cca u 10–15 % pacientů kavkazské populace, výskyt je nejvyšší u žen, nekuřáků a pacientů s adenokarcinomem [15–18]. Cílem předkládané práce bylo zmapovat incidenci mutací genu EGFR v naší populaci na relativně velkém souboru geneticky vyšetřených pacientů s pokročilým NSCLC a posoudit vliv těchto mutací na efekt léčby EGFR-TKI.
Soubor pacientů a metody
V letech 2002–2011 bylo provedeno genetické vyšetření na přítomnost mutace genu EGFR celkem u 613 pacientů s cytologicky nebo histologicky verifikovaným NSCLC. Jednalo se o pacienty s pokročilým stadiem NSCLC (sta-dium IIIB, IV). Souhrnná charakteristika souboru vyšetřených pacientů je uvedena v tab. 1.
Tab. 1. Charakteristika souborů pacientů geneticky vyšetřených a léčených EGFR-TKI. 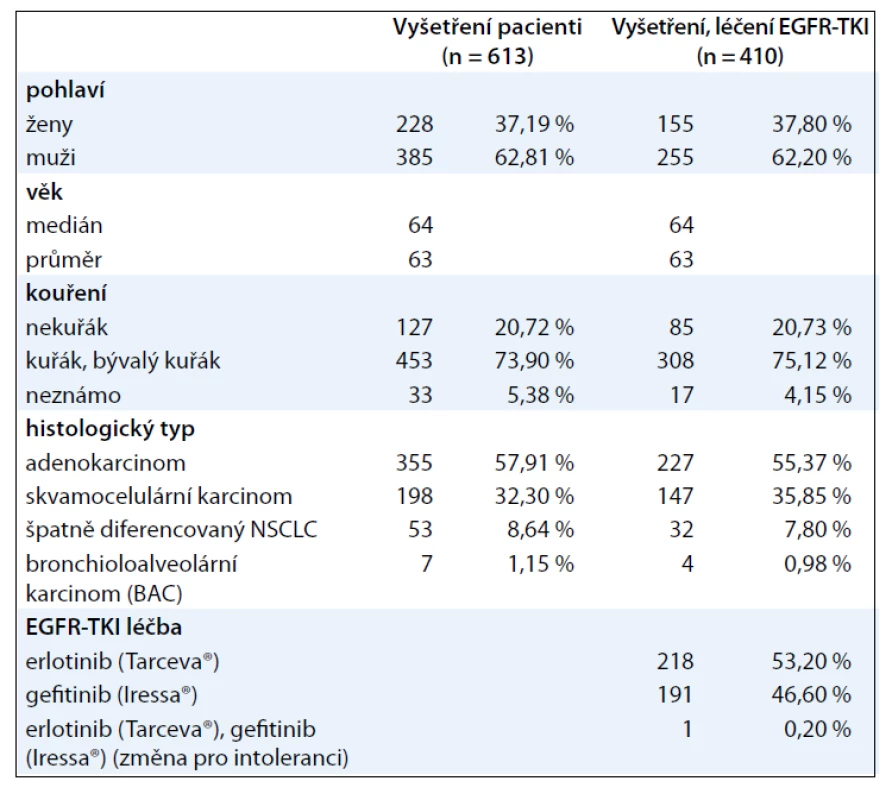
Vzorky tumorózní tkáně byly získávány v průběhu bronchoskopického vyšetření, případně jako resekáty. Vzorky byly procesovány buď jako cytologické nátěry, nebo formalínem fixované bločky. Oblasti nádorových buněk byly vždy viditelně označeny. U vzorků s nízkým poměrem nádorových buněk k buňkám nenádorovým byly nádorové buňky selektivně extrahovány metodou laserové mikrodisekce s použitím přístroje PALM Microlaser (Carl Zeiss MicroImaging GmbH, Německo). Genomová DNA byla izolována pro mutační analýzu standardní kolonkovou metodou s použitím kitu JetQuick tissue kit (Genomed, G.m.b.H, Loehne, Německo). Přítomnost EGFR delecí v exonu 19 genu EGFR byla detekována pomocí fragmentační analýzy. Bodové mutace v exonu 21 genu EGFR byly analyzovány použitím vysoce citlivé metody denaturační kapilární elektroforézy. Tato metoda je založena na kapilárně-elektroforetické separaci heteroduplexů za podmínek jejich částečné denaturace. Fragmentační analýza a denaturační kapilární elektroforéza byly prováděny na 96-kapilárním sekvenátoru (MegaBACE 1000, GE Biosciences, New Jersey, USA) vybaveném robotickým podavačem vzorků Caddy 1000 (Watrex Praha, Praha, Česká republika) umožňujícím automatický provoz analyzátoru.
Při statistickém hodnocení incidence mutací ve vybraných skupinách pacientů byl užit Fischerův exaktní test. Z celkového počtu geneticky vyšetřených pacientů bylo celkem 433 pacientů léčeno EGFR-TKI (erlotinib nebo gefitinib, u 1 pacienta došlo ke změně preparátu z důvodu intolerance), z toho u 410 léčených pacientů byl v době analýzy dat hodnotitelný léčebný efekt. Souhrnná charakteristika souboru léčených pacientů je uvedena v tab. 1. Přežití pacientů bylo hodnoceno metodikou podle Kaplana-Meiera a srovnání přežití bylo provedeno log-rank testem.
Výsledky
Mutace genu EGFR byla prokázána celkem u 73 vyšetřených pacientů (11,9 %), 540 pacientů bylo nositeli wild-type EGFR genu. Delece na 19. exonu byla zjištěna u 49 pacientů (8,0 %), bodová mutace na 21. exonu (L858R) byla zjištěna u 22 pacientů (3,6 %), obě mutace byly zjištěny u 2 pacientů (0,3 %), viz graf 1. Ve skupině pacientů s prokázanou mutací genu EGFR bylo 53 pacientů s adenokarcinomem, 16 pacientů se skvamocelulárním karcinomem, 3 pacienti se špatně diferencovaným NSCLC a 1 pacient s bronchioloalveolárním karcinomem (BAC), 27 mužů, 46 žen, 32 pacientů s pozitivní kuřáckou anamnézou a 38 celoživotních nekuřáků. Mutace genu EGFR byla prokázána u 14,9 % pacientů s adenokarcinomem a u 7,8 % pacientů s jiným histologickým typem NSCLC (graf 2). Rozdíl ve výskytu EGFR mutací mezi adenokarcinomem a jinými histologickými typy NSCLC byl statisticky signifikantní (p = 0,008). EGFR mutace byla prokázána u 7,5 % pacientů se skvamocelulárním karcinomem (graf 3). EGFR mutace byla prokázána u 20,2 % žen a u 7,1 % mužů (graf 4). Rozdíl ve výskytu EGFR mutací mezi oběma pohlavími byl statisticky signifikantní (p < 0,001). EGFR mutace byla prokázána u 29,9 % nekuřáků a u 7,0 % pacientů s pozitivní kuřáckou anamnézou (graf 5). Rozdíl byl statisticky signifikantní (p < 0,001).
Graf 1. Graf 1. Výskyt mutací genu EGFR a jejich jednotlivých typů u pacientů s NSCLC. 
Graf 2. Výskyt mutací genu EGFR a jejich jednotlivých typů podle histologického typu NSCLC. 
Graf 3. Výskyt mutací genu EGFR a jejich jednotlivých typů u pacientů se skvamocelulárním typem NSCLC. 
Graf 4. Výskyt mutací genu EGFR a jejich jednotlivých typů podle pohlaví. 
Graf 5. Výskyt mutací genu EGFR a jejich jednotlivých typů podle kuřáctví. 
Medián přežití bez známek progre-se (PFS) při léčbě EGFR-TKI u pacientů s mutací genu EGFR činil 7,2 měsíce a u pacientů s wild-type EGFR genem činil 2,0 měsíce (graf 6). Rozdíl v PFS mezi oběma skupinami byl statisticky signifikantní (p < 0,001). Medián celkového přežití (OS) od zahájení léčby EGFR-TKI u pacientů s mutací genu EGFR činil 14,5 měsíce, u pacientů s wild-type EGFR genem činil 7,5 měsíce (graf 7). Rozdíl v OS mezi oběma skupinami byl statisticky signifikantní (p = 0,019). Následně byla provedena subanalýza přežití pacientů podle dvou nejčastějších histologických typů NSCLC (adenokarcinom a skvamocelulární karcinom). U pacientů s adenokarcinomem (včetně BAC), s mutací genu EGFR (n = 43) činil medián PFS 10,2 měsíce a medián OS 17,7 měsíce oproti pacientům s wild-type EGFR genem (n = 188), kde činil medián PFS 1,9 měsíce (graf 8A) a medián OS 7,5 měsíce (graf 9A); rozdíly v PFS (p < 0,001) i OS (p = 0,010) mezi oběma skupinami byly statisticky signifikantní. U pacientů se skvamocelulárním karcinomem s mutací genu EGFR (n = 15) činil medián PFS 4,7 měsíce a medián OS 6,8 měsíce oproti pacientům s wild-type EGFR genem (n = 132), kde činil medián PFS 2,1 měsíce (graf 8B) a medián OS 7,8 měsíce (graf 9B); rozdíly v PFS (p = 141) ani OS (p = 0,749) mezi oběma skupinami nebyly statisticky signifikantní.
Graf 6. Srovnání přežití bez známek progrese (PFS) mezi pacienty s mutací genu EGFR a pacienty s <em>wild-type</em> EGFR genem. 
Graf 7. Srovnání celkového přežití (OS) od zahájení léčby EGFR-TKI mezi pacienty s mutací genu EGFR a pacienty s <em>wild-type</em> EGFR genem. 
Graf 8. Srovnání PFS mezi pacienty s mutací genu EGFR a pacienty s <em>wild-type</em> EGFR genem podle dvou nejčastějších histologických typů NSCLC (A: adenokarcinom vs B: skvamocelulární karcinom). 
Graf 9. Srovnání OS mezi pacienty s mutací genu EGFR a pacienty s <em>wild-type</em> EGFR genem podle dvou nejčastějších histologických typů NSCLC (A: adenokarcinom vs B: skvamocelulární karcinom). 
Diskuze
Mutace genu EGFR byla prokázána celkem u 11,9 % geneticky vyšetřených pacientů. Mutace byly častěji zjištěny u pacientů s adenokarcinomem (14,9 % vs 7,8 %, p = 0,008), žen (20,2 % vs 7,1 %, p < 0,001) a nekuřáků (29,9 % vs 7,0 %, p < 0,001). Výsledky námi provedené studie ukazují častější výskyt mutací genu EGFR u pacientů se skvamocelulárním karcinomem (7,5 %), než je popisován v literatuře (cca 3,4 %) [19]. Tento rozdíl je zřejmě částečně ovlivněn faktem, že u geneticky testovaných pacientů se skvamocelulárním karcinomem se nejednalo o zcela neselektovanou populaci a genetické vyšetření bylo preferenčně provedeno u žen, nekuřáků nebo pacientů s nižší kuřáckou zátěží. Na druhou stranu i s přihlédnutím k tomuto faktu je výskyt EGFR mutací u pacientů se skvamocelulárním karcinomem relativně vysoký. Velkých studií, které by se zabývaly výskytem mutací genu EGFR u pacientů se skvamocelulárním karcinomem na neselektované evropské populaci, je stále relativně málo. U pacientů nesoucích mutaci genu EGFR bylo dosaženo významně delšího PFS než u pacientů nesoucích wild-type EGFR gen (7,2 vs 2,0 měsíce, p < 0,001). U pacientů nesoucích EGFR mutaci bylo dosaženo i významně delšího OS (14,5 vs 7,5 měsíce, p = 0,019). Subanalýza přežití pacientů léčených EGFR-TKI zaměřená na význam histologického typu NSCLC ukázala, že pacienti s adenokarcinomem (včetně BAC), kteří jsou nositeli mutace genu EGFR, z léčby profitují významně lépe než pacienti nesoucí wild-type EGFR genotyp (PFS: 10,2 vs 1,9 měsíce, p < 0,001; OS: 17,7 vs 7,5 měsíce, p = 0,010). Oproti tomu u pacientů se skvamocelulárním karcinomem, kteří jsou nositeli mutace genu EGFR, nebyl prokázán statisticky významně lepší efekt léčby EGFR-TKI ve srovnání s pacienty nesoucími wild-typeEGFR genotyp (PFS: 4,7 vs 2,1 měsíce, p < 0,141; OS: 6,8 vs 7,8 měsíce, p = 0,749). Tyto výsledky tak zpochybňují prediktivní potenciál mutací genu EGFR u pacientů se skvamocelulárním karcinomem. Na podobné výsledky upozornili v minulosti Shukuya et al v publikované metaanalýze [20]. Jednoznačné vysvětlení pro toto zjištění v současné době neexistuje, ale jako možná hypotéza se nabízejí alterace (mutace, amplifikace) genu PI3KCA kódujícího podjednotku PI3K proteinu, který je součástí kaskády startované aktivací EGFR [21], a mohou tak být důvodem rezistence k léčbě cílené na EGFR kaskádu [22]. Tyto genetické alterace se u epidermoidního karcinomu vyskytují výrazně častěji v porovnání s adenokarcinomem [21,23,24].
Závěr
Incidence mutací genu EGFR v naší populaci i jejich zvýšený výskyt u pacientů s adenokarcinomem, žen a nekuřáků dobře korelují s daty, která byla dosud publikována v literatuře. Vyšší incidence mutací genu EGFR u pacientů se skvamocelulárním karcinomem je zřejmě ovlivněna faktem, že se nejednalo o zcela neselektovanou populaci vyšetřených pacientů s tímto histologickým subtypem NSCLC. Analýza přežití pacientů při léčbě EGFR-TKI ukázala významně lepší profit z léčby EGFR-TKI u pacientů nesoucích aktivační mutace genu EGFR, zejména neskvamózního histologického typu NSCLC. U takto geneticky determinované skupiny pacientů s pokročilým NSCLC se volba molekulárně cílené léčby EGFR-TKI v první linii jeví jako jednoznačně nejlepší. Tyto výsledky rovněž korelují s daty publikovanými v literatuře. Genetické testování na přítomnost aktivační mutace genu EGFR je nezbytnou součástí diagnostiky NSCLC a jeho výsledky mají zásadní dopad na volbu optimální onkologické léčby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Fiala
Onkologické a radioterapeutické oddělení
FN Plzeň
Alej Svobody 80
304 60 Plzeň-Lochotín
e-mail: fiala.o@centrum.cz
Obdrženo: 10. 1. 2012
Přijato: 24. 2. 2012
Zdroje
1. Lynch TJ, Bell DW, Sordella R et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004; 350(21): 2129–2139.
2. Paez JG, Jänne PA, Lee JC et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 2004; 304(5676): 1497–1500.
3. Gandhi J, Zhang J, Xie Y et al. Alterations in genes of the EGFR signaling pathway and their relationship to EGFR tyrosine kinase inhibitor sensitivity in lung cancer cell lines. PLoS One 2009; 4(2): e4576.
4. Minárik M, Benešová L, Belšánová B et al. Vliv mutací genů EGFR a KRAS na prognózu přežití u pacientů s nemalobuněčným karcinomem plic, léčených inhibitory tyrosin-kináz (srovnání výsledků léčby gefitinibem a erlotinibem). Stud Pneumol Phtiseol 2009; 69(3): 96–104.
5. Eberhard DA, Johnson BE, Amler LC et al. Mutations in the epidermal growth factor receptor and in KRAS are predictive and prognostic indicators in patients with non--small-cell lung cancer treated with chemotherapy alone and in combination with erlotinib. J Clin Oncol 2005; 23(25): 5900–5909.
6. Bonanno L, Schiavon M, Nardo G et al. Prognostic and predictive implications of EGFR mutations, EGFR copy number and KRAS mutations in advanced stage lung adenocarcinoma. Anticancer Res 2010; 30(12): 5121–5128.
7. Liu HP, Isaac Wu HD, Chang JW et al. Prognostic implications of epidermal growth factor receptor and KRAS gene mutations and epidermal growth factor receptor gene copy numbers in patients with surgically resectable non--small cell lung cancer in Taiwan. J Thorac Oncol 2010; 5(8): 1175–1184.
8. Zhu CQ, da Cunha Santos G, Ding K et al. Role of KRAS and EGFR as biomarkers of response to erlotinib in National Cancer Institute of Canada Clinical Trials Group Study BR.21. J Clin Oncol 2008; 26(26): 4268–4275.
9. Hirsch FR, Varella-Garcia M, Bunn PA Jr et al. Molecular predictors of outcome with gefitinib in a phase III placebo-controlled study in advanced non-small-cell lung cancer. J Clin Oncol 2006; 24(31): 5034–5042.
10. Douillard JY, Shepherd FA, Hirsh V et al. Molecular predictors of outcome with gefitinib and docetaxel in previously treated non-small-cell lung cancer: data from the randomized phase III INTEREST trial. J Clin Oncol 2010; 28(5): 744–752.
11. Cappuzzo F, Ciuleanu T, Stelmakh L et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol 2010; 11(6): 521–529.
12. Brugger W, Triller N, Blasinska-Morawiec M et al. Biomarker analyses from the phase III placebo-controlled SATURN study of maintenance erlotinib following first--line chemotherapy for advanced NSCLC. J Clin Oncol 2009; 27 (Suppl): 15. Abstract 8020.
13. Pesek M, Benesova L, Belsanova B et al. Dominance of EGFR and insignificant KRAS mutations in prediction of tyrosine-kinase therapy for NSCLC patients stratified by tumor subtype and smoking status. Anticancer Res 2009; 29(7): 2767–2773.
14. Gazdar AF. Activating and resistance mutations of EGFR in non-small-cell lung cancer: role in clinical response to EGFR tyrosine kinase inhibitors. Oncogene 2009; 28 (Suppl 1): S24–S31.
15. Zhang Z, Stiegler AL, Boggon TJ et al. EGFR-mutated lung cancer: a paradigm of molecular oncology. Oncotarget 2010; 1(7): 497–514.
16. Sequist LV, Bell DW, Lynch TJ et al. Molecular predictors of response to epidermal growth factor receptor antagonists in non-small-cell lung cancer. J Clin Oncol 2007; 25(5): 587–595.
17. Gandara DR, Lara PN Jr, Mack P et al. Individualizing therapy for non-small-cell lung cancer: a paradigm shift from empiric to integrated decision-making. Clin Lung Cancer 2009; 10(3): 148–150.
18. West H, Lilenbaum R, Harpole D et al. Molecular analysis-based treatment strategies for the management of non-small cell lung cancer. J Thorac Oncol 2009; 4 (9 Suppl 2): S1029–S1039.
19. Forbes SA, Bhamra G, Bamford S et al. The Catalogue of Somatic Mutations in Cancer (COSMIC). Curr Protoc Hum Genet 2008; Chapter 10: Unit 10.11.
20. Shukuya T, Takahashi T, Kaira R et al. Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports. Cancer Sci 2011; 102(5): 1032–1037.
21. Yamamoto H, Shigematsu H, Nomura M et al. PIK3CA mutations and copy number gains in human lung cancers. Cancer Res 2008; 68(17): 6913–6921.
22. De Roock W, Claes B, Bernasconi D et al. Effects of KRAS, BRAF, NRAS and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010; 11(8): 753–762.
23. Kawano O, Sasaki H, Endo K et al. PIK3CA mutation status in Japanese lung cancer patients. Lung Cancer 2006; 54(2): 209–215.
24. Lee SY, Kim MJ, Jin G et al. Somatic mutations in epidermal growth factor receptor signaling pathway genes in non--small cell lung cancers. J Thorac Oncol 2010; 5(11): 1734–1740.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Soutěž o nejlepší práciČlánek Klinický registr RENISČlánek Liga proti rakovině
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Soutěž o nejlepší práci
- Význam mikroprostředí kostní dřeně v patogenezi mnohočetného myelomu
- CT kolonografie – přehled vývoje metodiky a indikací
- Dlouhé nekódující RNA a jejich význam u nádorových onemocnění
- Léčba histiocytózy z Langerhansových buněk kladribinem dosáhla u 9 z 10 dospělých pacientů dlouhodobé kompletní remise
- Porovnávanie histologických typov primárnych a korešpondujúcich recidivujúcich bazocelulárnych karcinómov kože
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii
- Jaký je prognostický význam molekulárně genetických faktorů u karcinomu endometria?
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Paratestikulárny mezotelióm v mladom veku. Kazuistika
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Klinický registr RENIS
- Prim. MU Dr. Vladimír Koza zemřel
- Prof. MUDr. Zdeněk Dienstbier, DrSc., zemřel
- Liga proti rakovině
- Onkologie v obrazech: Liposarcoma retroperitonei permagnum
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- CT kolonografie – přehled vývoje metodiky a indikací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



