-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Our Experience with Analysis of the PTEN Gene in Patients Suspected of Having Cowden Syndrome
Backgrounds:
Cowden syndrome (CS) is a rare autosomal dominant disorder with an increased risk of breast, thyroid and uterine cancer development. The International Cowden Consortium has defined strict diagnostic criteria for individuals and families suspected of having CS. Patients and methods: We analyzed the genomic DNA of 16 patients by sequencing analysis and MLPA (multiplex ligation-dependent probe amplification) method.Results:
We found germline mutations, c.825_840del, resp. c.438delT, in 2 patients. Both patients fulfilled strict diagnostic criteria. The other patients, except one, who did not fulfil the criteria, did not harbour any pathogenic mutation. Patients not fulfilling strict diagnostic criteria were included in the study according to major CS criteria but not pathogenic.Conclusion:
Our results and information from relevant articles show that strict international criteria are well established and analysis of „CS-like“ patients has no significant prognostic meaning.Key words:
Cowden syndrome – breast cancer – thyroid cancer – hamartomas – mucocutaneous lesions
Autoři: P. Vasovčák 1; L. Foretová 2; A. Puchmajerová 1; M. Šenkeříková 3; J. Martínek 4; A. Křepelová 1
Působiště autorů: Ústav biologie a lékařské genetiky, FN Motol a 2. LF UK, Praha 1; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 2; Oddělení lékařské genetiky, FN Hradec Králové 3; Oddělení hepatogastroenterologie, IKEM, Praha 4
Vyšlo v časopise: Klin Onkol 2010; 23(2): 111-114
Kategorie: Původní práce
Souhrn
Východiská:
Cowdenovej syndróm (CS) je vzácne autozomálne dominantné ochorenie so zvýšeným rizikom vzniku rakoviny prsníka, štítnej žľazy a maternice. Medzinárodné Cowdenovej konzorcium definovalo striktné diagnostické kritériá pre jednotlivcov aj rodiny s podozrením na CS. Súbor pacientov a metódy: Analyzovali sme genomovú DNA 16 pacientov prostredníctvom sekvenačnej analýzy a metódou MLPA (multiplex ligation ‑ dependent probe amplification).Výsledky:
U dvoch pacientov sme našli zárodočné mutácie, c.825_840del, resp. c.438delT. Oba pacienti spĺňali prísne diagnostické kritériá. Ostatní pacienti, s výnimkou jedného, ktorí nespĺňali tieto kritériá, neboli nositeľmi žiadnej patogénnej varianty. Pacienti nespĺňajúci striktné diagnostické kritériá boli do štúdie zaradení na základe symptómov, ktoré patria medzi veľké kritériá CS, ale nie patognomické.Záver:
Naše výsledky a informácie získané z odborných publikácií naznačujú, že striktné medzinárodné kritériá sú dobre definované a analýza tzv. CS‑like pacientov nemá veľký prognostický význam.Kľúčové slová:
Cowdenovej syndróm – rakovina prsníka – rakovina štítnej žľazy – hamartómy – mukokutánne lézieÚvod
Cowdenovej syndróm (OMIM 158350), ochorenie s odhadovanou frekvenciou výskytu 1 : 200 000, sa vyznačuje mnohopočetnými benígnimi hamartómamy, ktoré sa najčastejšie vyskytujú v koži, štítnej žľaze, prsníkoch, gastrointestinálnom trakte a mozgu [1 – 2]. Príčinou tohto ochorenia sú zárodočné mutácie génu PTEN (OMIM 601728) nachádzané u 80 % pacientov s CS [2]. Stanovenie diagnózy CS býva problematické kvôli variabilnej expresivite a pleiotropii tohto ochorenia. Medzi patognomické znaky CS patria mukokutánne lézie, nachádzané u 99 % pacientov pred 30. rokom života [3]. Rakovina prsníka a štítnej žľazy sú dve najčastejšie malignity spojené s týmto syndrómom. Patria medzi veľké kritériá spoločne s rakovinou maternice a makrocefáliou. Celoživotné riziko rakoviny prsníka u žien s CS je 25 – 50 %, v porovnaní s 11 % všeobecnej populácie. Celoživotné riziko rakoviny štítnej žľazy je 10 % u mužov aj žien. Z histologického hľadiska ide najčastejšie o folikulárny, výnimočne papilárny karcinóm štítnej žľazy. Riziko rakoviny endometria sa odhaduje na 5 – 10 % [4 – 5].
Kritériá CS prevzaté z NCCN sú každoročne aktualizované
NCCN v.1.2009
Patognomické kritériá:
- Lhermittovo ‑ Duclosovo ochorenie, LDD (dysplastický gangliocytóm mozočku)
- mukokutánne lézie
- trichilemómy (v oblasti tváre a hlavy)
- akrálne keratózy
- papilómy pier a bukálnej sliznice
Veľké kritériá:
- rakovina prsníka
- nemedulárny karcinóm štítnej žľazy
- makrocefália (nad 97. percentilom)
- rakovina maternice
Malé kritériá:
- benígne nálezy štítnej žľazy (adenómy, struma, uzly)
- mentálna retardácia (IQ pod 75)
- gastrointestinálne hamartomatózne polypy
- fibrocystické ochorenie prsníkov
- lipómy
- fibrómy
- genitourinárne nádory (hlavne karcinóm obličky)
- genitourinárne malformácie
- fibroidy maternice
Diagnostické kritériá pre jedinca s podozrením na CS:
- ktorékoľvek patognomické kritérium (LDD a/ alebo mukokutánne lézie)
- mukokutánne lézie samostatne ak:
- 6 a viac tvárových papuliek, z kto-rých minimálne 3 musia byť trichilemómy
- kožné tvárové papulky a ústna slizniční papilomatóza
- ústna slizničná papilomatóza a akrálne keratózy
- 6 a viac palmoplantárnych keratóz
- dve alebo viac veľkých kritérií (jedno musí byť makrocefália)
- jedno veľké a minimálne tri malé kritériá
- štyri a viac malých kritérií
Diagnostické kritériá pre jedincov v rodinách s potvrdeným CS:
- patognomické kritérium
- jedno veľké s alebo bez malého kritériá
- dve malé kritériá
- anamnéza BRRS (Bannayan ‑ Riley ‑ Ruvalcaba syndrómu)
Súbor pacientov a metódy
Celkovo bolo analyzovaných 16 pacientov (15 žien a 1 muž) s podozrením na CS (tab. 1). Traja pacienti spĺňali diagnostické kritériá. Ostatní boli zaradení do štúdie na základe symptómov patriacich medzi hlavné diagnostické kritériá CS, ale nespĺňali striktné operačné kritériá stanovené medzinárodným CS konzorciom. Pacienti nespĺňajúci CS kritériá boli zaradení na základe výskytu rakoviny prsníka a/ alebo nemedulárneho karcinómu štítnej žľazy. Boli bez mukokutánnych lézií a/ alebo makrocefálie. Osem žien pred zaradením do nášho súboru bolo negatívne testovaných na BRCA1 a BRCA2 mutácie.
Tab. 1. Pacienti s podozrením na CS. 
GIT – gastrointestinálny trakt, k. p. – karcinóm prsníka, k. šž. – karcinóm šťítnej žľazy, t. t. – testikulárny tumor, mat. – maternálna, * – pacienti spĺňajúci kritériá, ? – vek v čase diagnózy neudaný Všetci pacienti podpísali informovaný súhlas s genetickým vyšetrením. Ich DNA bola izolovaná z periférnej krvi prostredníctvom izolačného kitu (Gentra). Genomová DNA bola amplifikovaná primermi prekrývajúcimi všetkých deväť kódujúcich exónov. Po prečistení PCR produktov purifikačným kitom (Bioline) bola prevedená sekvenačná reakcia s BigDye Terminator v3.1 sekvenačným kitom a automatická analýza pomocou 3100 - Avant genetického analyzátora (ABI). Vzorky s negatívnym výsledkom boli potom analyzované metódou MLPA, kitom SALSA MLPA KIT P225 - A1 PTEN (MRC Holland) na odhalenie prípadných veľkých prestavieb génu PTEN.
Výsledky
Zo 16 nepríbuzných pacientov, u ktorých bola uskutočnená mutačná analýza génu PTEN, sme našli zárodočné mutácie u dvoch z nich. Obaja spĺňali prísne diagnostické kritériá.
Prvým pozitívne testovaným pacientom bol 36-ročný muž, ktorý už bol publikovaný, a je nositeľom zárodočnej mutácie c.825_840del (obr. 1A) [6]. Do nemocnice bol prijatý pre opakované žalúdočné záchvaty a tam bol podrobený gastrointestinálnemu vyšetreniu, ktoré odhalilo mnohopočetné polypy. Histologické vyšetrenie potvrdilo hyperplastické a hamartomatózne polypy v žalúdku a taktiež zápalové polypy a adenómy v hrubom čreve. Ďalej bola diagnostikovaná glykogénna akantóza, rozsiahla papilomatóza pier, tri plantárne keratózy a makrocefália (obr. 2). Ultrasonografia štítnej žľazy odhalila niekoľko uzlov. Struma a karcinóm neboli potvrdené. Otec probanda bol bez klinických príznakov CS a matka spáchala samovraždu v 33 rokoch. Pacient nemá žiadnych súrodencov a je bezdetný.
Obr. 1. Sekvenačný elektroforeogram: A – posunová mutácia v 8. exóne (delécia 16 nukleotidov), B – delécia T v 5. exóne. 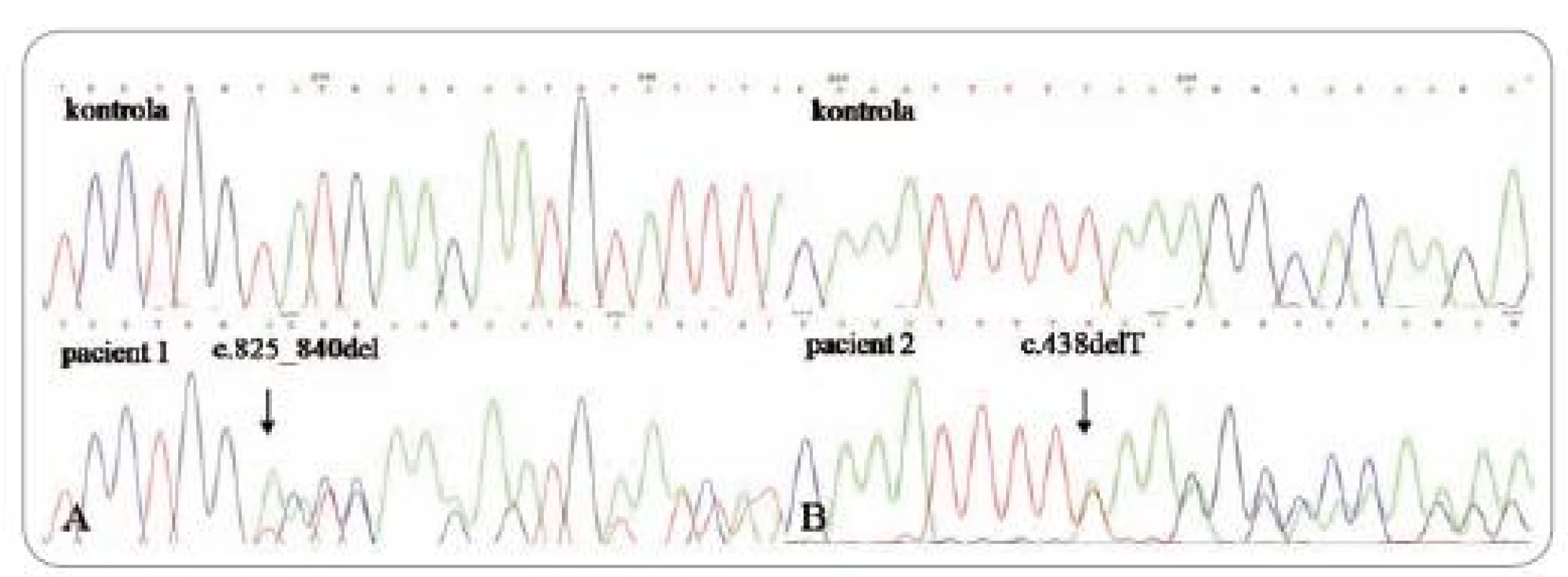
Obr. 2. Pacient 1: A – rozsiahla papilomatóza pier, B – akrálne keratózy, C – makrocefália, D – polypóza žalúdka, E – histologický preparát hyperplastického polypu žalúdka, F – glykogénna akantóza. 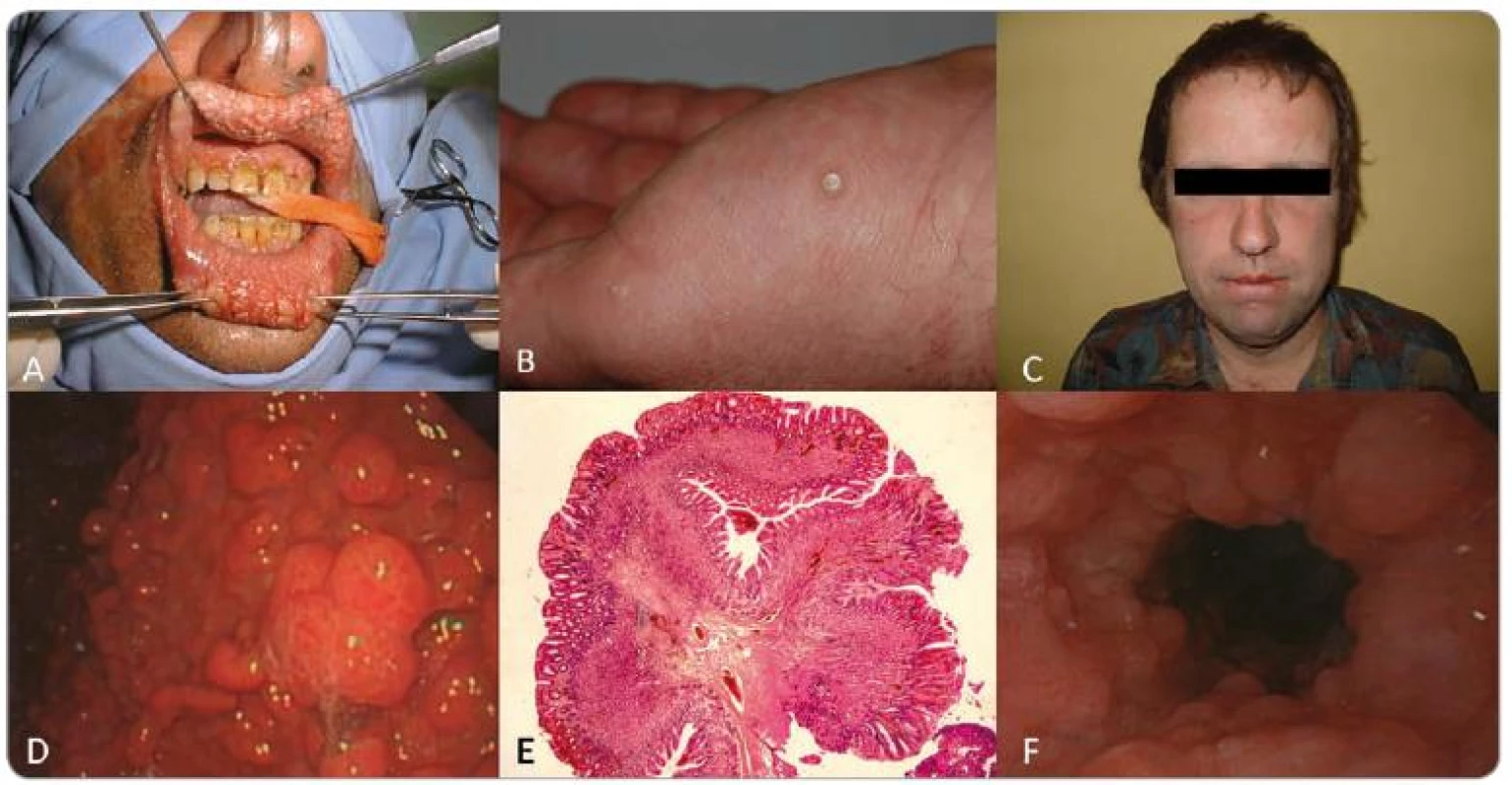
Ďalším pozitívne testovaným pacientom bola 55-ročná žena, u ktorej smezistili zárodočnú mutáciu c.438delT (obr. 1B) (sub. Familial Cancer). Do 34 rokov, keď bola u nej zistená struma, nemala žiadne vážnejšie ochorenie. O 9 rokov neskôr podstúpila hysterektómiu pre myomatózu a adnexektómiu pre adenopapilokarcinóm ľavého vaječníka. O dva roky neskôr bola vykonaná strumektómia a histologické vyšetrenie potvrdilo makrofolikulárny adenóm v ľavom laloku a uzavretý nádor v pravom laloku. V 54 rokoch jej pre folikulárny karcinóm bola kompletne odstránená štítna žľaza. Ako 49-ročná bola hospitalizovaná kvôli epileptickým paraxyzmálnym záchvatom. CT vyšetrenie mozgu ukázalo ľavostrannú frontálnu léziu, ktorá bola chirurgicky odstránená a klasifikovaná patológom ako benígny meningeóm. Pacientka bola opakovane chirurgicky liečená kvôli rekurencii meningeómu a zhoršujúcemu sa stavu v 53 a 57 rokoch. Komplexné vyšetrenie pri prvotnej detekcii meningeómu odhalilo mnohopočetné polypy v žalúdku, duodene a hrubom čreve. Histologicky boli klasifikované ako hyperplastické zápalové polypy a tubulovilózne a vilózne adenómy (obr. 3). V 57 rokoch, po niekoľkých predchádzajúcich biopsiach s negatívnym nálezom, bol u nej potvrdený adenokarcinóm v hyperplastickom polype žalúdka. O rok neskôr bol zistený aj agresívne rastúci synchrónny adenokarcinóm anorekta a sigmoidea. Bola vykonaná Milesova operácia. Pacientka zomrela mesiac po zákroku kvôli pooperačným komplikáciám. O rodičoch a súrodencoch pacientky sa nám nepodarilo získať žiadne informácie. Syn, ktorý je bez príznakov CS, bol negatívne testovaný.
Obr. 3. Pacient 2: histologické preparáty: A – folikulárny karcinóm šťítnej žľazy, B – meningeóm, C – hyperplastický polyp žalúdka s adenokarcinómom, D – tubulárny adenokarcinóm hrubého čreva 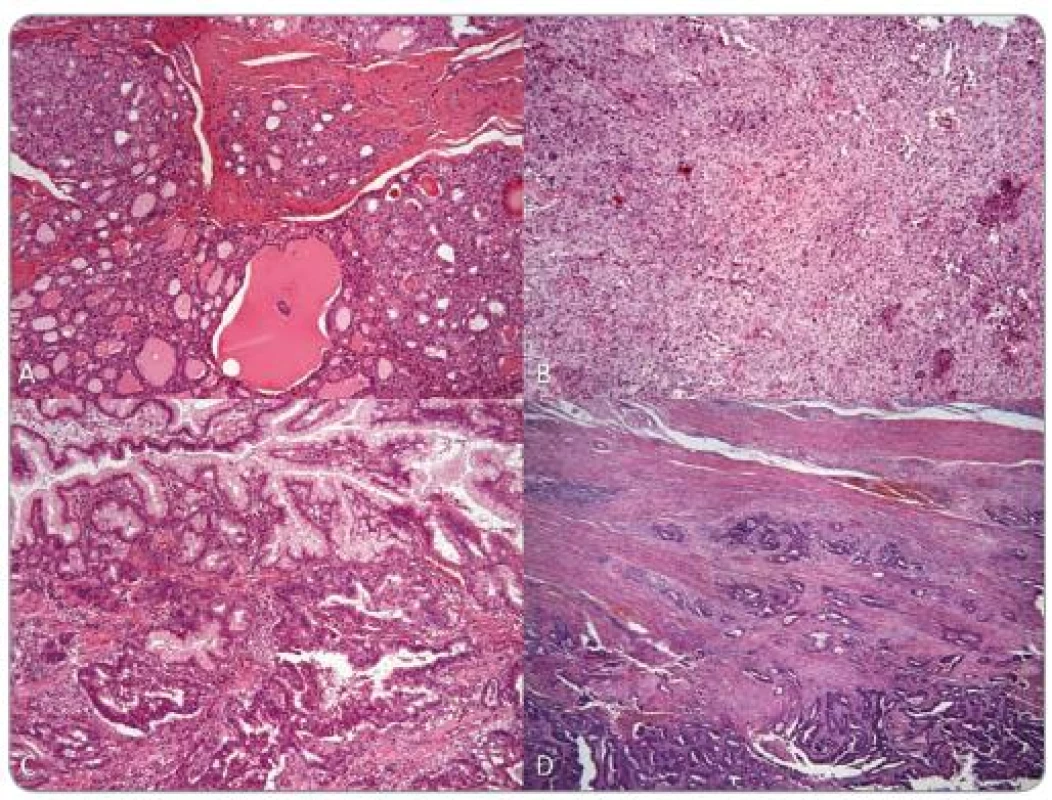
Ďalší pacienti, s výnimkou pacientky, u ktorej bol diagnostikovaný karcinóm prsníka v 31 rokoch a verukoidné lézie (nepodarilo sa zistiť počet ani lokalizácia), boli výlučne ženy s karcinómom prsníka a/ alebo štítnej žľazy bez ďalších symptómov typických pre CS. Makrocefália alebo kožné zmeny u týchto pacientiek neboli zaznamenané alebo táto informácia nebola dostupná. Nakoľko tieto kožné zmeny môžu byť veľmi diskrétne, poprípade prehliadané z dôvodu, že sa bežne vyskytujú aj u zdravých jedincov populácie, bolo ich zaradenie do súboru odôvodnené. Na druhej strane, metaanalýzou všetkých dostupných článkov zaoberajúcich sa problematikou CS sme zistili, že bol zaznamenaný len jediný prípad pacienta s CS bez mukokutánnych lézií a LDD [7]. V súlade s literatúrou mutácie génu PTEN sa v rodinách s rakovinou prsníka, resp. štítnej žľazy, nachádzajú vzácne [7 – 10]. Marsh et al uskutočnili mutačnú analýzu 64 nepríbuzných v „CS‑like“ rodinách, kde aspoň jeden člen rodiny mal nemedulárny karcinóm štítnej žľazy a druhý minimálne karcinóm prsníka v akomkoľvek veku. Testovali taktiež pacientov s rakovinou prsníka alebo štítnej žľazy spoločne s ďalším kritériom CS, avšak bez spĺňajúcich CS kritérií. V jednom prípade našli zárodočnú mutáciu (c.209T > C) u 31-ročného pacienta s karcinómom štítnej žľazy, ktorého matka mala diagnostikovaný adenokarcinóm prsníka v 49 a 53 rokoch. Obaja boli bez kožných lézií a makrocefálie [7].
Na základe našich výsledkov a informácií získaných z relevantných publikácií môžeme povedať, že u pacientov bez patognomických kritérií, hlavne mukokutánnych lézií, spoločne s niektorým s ďalších kritérií CS, má analýza génu PTEN mizivú úspešnosť záchytu zárodočných mutácií. Z tohto dôvodu detailné klinické vyšetrenie jedinca s podozrením na CS, zvlášť akýchkoľvek mukokutánnych lézií, je mimoriadne dôležité a malo by byť uvedené pri odporúčaní na genetické vyšetrenie.
Práca bola podporená MZOFNM2005.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.RNDr. Peter Vasovčák
Ústav biologie a lékařské genetiky
FN Motol a 2. LF UK
V Úvalu 84
150 06 Praha 5
e-mail: pevas78@centrum.cz
Zdroje
1. Lloyd KM 2nd, Dennis M. Cowden‘s disease. A possible new symptom complex with multiple system involvement. Ann Intern Med 1963; 58 : 136 – 142.
2. Nelen MR, van Staveren WC, Peeters EA et al. Germline mutations in the PTEN/ MMAC1 gene in patients with Cowden disease. Hum Mol Genet 1997; 6(8): 1383 – 1387.
3. Eng C. PTEN: one gene, many syndromes. Hum Mutat 2003; 22(3): 183 – 198.
4. Starink TM, van der Veen JP, Arwert F et al. The Cowden syndrome: a clinical and genetic study in 21 patients. Clin Genet 1986; 29(3): 222 – 233.
5. Waite KA, Eng C. Protean PTEN: form and function. Am J Hum Genet 2002; 70(4): 829 – 844.
6. Vasovcak P, Krepelova A, Puchmajerova A et al. A novel mutation of PTEN gene in a patient with Cowden syndrome with excessive papillomatosis of the lips, discrete cutaneous lesions, and gastrointestinal polyposis. Eur J Gastroenterol Hepatol 2007; 19(6): 513 – 517.
7. Marsh DJ, Dahia PL, Caron S et al. Germline PTEN mutations in Cowden syndrome‑like families. J Med Genet 1998; 35(11): 881 – 885.
8. Chen YM, Ott DJ, Wu WC et al. Cowden‘s disease: a case report and literature review. Gastrointest Radiol 1987; 12(4): 325 – 329.
9. Tsou HC, Teng DH, Ping XL et al. The role of MMAC1 mutations in early ‑ onset breast cancer: causative in association with Cowden syndrome and excluded in BRCA1 - negative cases. Am J Hum Genet 1997; 61(5): 1036 – 1043.
10. Ueda K, Nishijima M, Inui H et al. Infrequent mutations in the PTEN/ MMAC1 gene among primary breast cancers. Jpn J Cancer Res 1998; 89(1): 17 – 21.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Onkologové využívají komunikační systém pro videokonference
- Vakcinace proti lidskému papillomaviru v ČR
- Zápis ze schůze výboru České onkologické společnosti dne 23. 3. 2010 v Plzni
- In memoriam – za doc. MU Dr. Zdeňkem Churým, CSc.
- Linhartová V.Kapitoly z dějin Masarykova onkologického ústavu v Brně.Brno: Masarykův onkologický ústav 2010. 91 s. ISBN 978-80-86793-14-6.
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



