-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
Monitoring the Effectiveness of Surgical Treatment of Malignant Pleural Effusions
Backgrounds:
Recurrent pleural effusion occured in 10% of cancer patients. Repeated thoracocentesis or drainage may be complicated by pneumothorax, haemothorax or pleural cavity infection. Thoracoscopic talc poudrage is one of the most effective pleurodesis technique in patients with malignant pleural effusions. The effectiveness of such pleurodesis is reaching the 70 to 90%. This surgical approach also allows to take a biopsy for histological verification of the process. An effort to predict the success rate of chemical pleurodesis on the basis of the body’s general inflammatory reaction rate, which is determined by the dynamics of values of humoral and cellular inflammatory parameters in both serum and in pleural effusion. Patients: In the period 6/2008–12/2009 we applied biotalcum to 14 patients with malignant pleural effusions. The group of patients consisted of 10 male patients and 4 female patients of average age 71 years. Indication to include patients in the group was a second or further thoracic puncture, shortening of the interval between interventions, estimated time of survival > 3 months and the possibility of operation under selective pulmonary ventilation. Method: We performed the collection of pleural effusion and blood serum at 12-hour intervals. The first collection was performed preoperatively before biotalcum application, and then during the time of losses from thoracic drainage bigger than 150 ml in 24 hours. The duration of thoracic drainage was 4 days ± 1 day. The success of the treatment was observed by ultrasound scan before drainage removal; during the first three months always at intervals of 1 month and then after 3 and 6 months, depending on the progression of a disease. Results: No reccurence occured when the P-CRP (pleural) and S-CRP (serum) ratio exceeded 60 % during the first 48 hours after pleurodesis. On the other hand, when the ratio fall bellow 30-35 %, the effusion relapsed frequently. Conclusion: The P-CRP/S-CRP ratio as a promising marker of talc pleurodesis effectiveness and monitoring both P-CRP and S-CRP levels is inexpensive and acceptable method for clinical practice. The pleural effusion caused by malignant mesothelioma appeares to be resistant to talc pleurodesis.Key words:
malignant pleural effusion – thoracoscopy – biotalcum – CRP
Autoři: P. Habal 1; J. Manďák 1; J. Šimek 1; M. Štětina 1; K. Jankovičová 2; K. Kondělková 2; J. Krejsek 2
Působiště autorů: Kardiochirurgická klinika, Univerzita Karlova v Praze 1; Ústav klinické imunologie a alergologie LF a FN v Hradci Králové 2
Vyšlo v časopise: Klin Onkol 2010; 23(2): 99-103
Kategorie: Původní práce
Souhrn
Východiska:
Recidivující pleurální výpotky doprovázejí asi 10 % maligních onemocnění. Opakované hrudní punkce či drenáže mohou být komplikovány pneumotoraxem, hemotoraxem nebo infekcí pleurální dutiny. Aplikace práškové formy biotalku torakoskopicky patří k nejefektivnějšímu paliativnímu způsobu léčby. Úspěšnost se pohybuje kolem 70 – 90 %. Výhodou je i možnost odběru materiálu k histologické verifikaci procesu. Snahou je předpovědět úspěšnost chemické pleurodézy na základě míry celkové zánětlivé reakce organizmu, jež udává dynamika hodnot humorálních a buněčných zánětlivých parametrů jak v séru, tak v pleurálním výpotku. Soubor pacientů: V období 6/ 2008 až 12/ 2009 jsme aplikovali biotalek u 14 nemocných s maligním pleurálním výpotkem. Soubor tvořilo 10 mužů a 4 ženy průměrného věku 71 let. Indikace k zařazení byla nutnost druhé a další hrudní punkce, zkracující se interval mezi intervencemi, prognóza předpokládané doby přežití > 3 měsíce a možnost operace v selektivní plicní ventilaci. Metoda: Odběr pleurálního výpotku a krevního séra jsme prováděli ve 12hodinových intervalech. První odběr peroperačně před aplikací biotalku, dále po dobu trvání ztrát z hrudního drénu větším než 150 ml za 24 hod. Doba hrudní drenáže byla 4 dny ± 1 den. Úspěšnost léčby jsme sledovali pomocí UZ vyšetření před odstraněním drénu, po dobu prvních 3 měsíců vždy v intervalu 1 měsíc a dále po 3 a 6 měsících v závislosti na vývoji onemocnění. Výsledky: Pokud byl poměr hodnot pleurálního CRP (P‑CRP) a sérového CRP (S‑CRP) větší než 60 %, k recidivám nedošlo, pokud byl jen okolo 30 %, výpotek recidivoval. Závěr: Sledování efektivity pomocí vzestupu CRP je jednoduché a pro praxi vhodné. Signifikantní vzestup je v intervalu 24–48 hod. Z malého souboru plyne, že recidivující výpotky u mezoteliomu pleury jsou metodou neovlivnitelné. Dílčí výsledky v oblasti buněčné imunity ukazují, že zánětlivá reakce je časnější.Klíčová slova:
maligní pleurální výpotek – torakoskopie – talkáž – CRPÚvod
Recidivující pleurální výpotky představují svízelnou komplikaci řady chorob. Jedná‑li se o komplikace zánětlivých onemocnění plic a pleury, lze předpokládat, že po zvládnutí základní choroby dojde i k odeznění tvorby pleurálního výpotku. Nejčastěji se jedná o parapneumonické výpotky při zánětlivém postižení plic. Incidence těchto výpotků i přes dobře vedenou cílenou antibiotickou léčbu se pohybuje okolo 15 %.
Komplikovanější bývají výpotky, které se tvoří buď při primárním nádorovém postižení plic a pleury, nebo důsledkem metastatického postižení plicního parenchymu, viscerální či parietální pleury.
Naší snahou, často bohužel jen paliativní, je zamezit opakované tvorbě výpotku tím, že se eliminuje anatomický prostor mezi listy viscerální a parietální pleury. K tomu slouží řada metod od chirurgického odstranění nástěnné pleury (pleurektomie) až po aplikaci různých chemických látek, např. colimicinu, tetracyklinu, bleomycinu, či talku nebo bio-talku. Cílem léčby je navození aseptické pleuritidy, která jako každá zánětlivá reakce vyvolá jak celkovou, tak i místní kaskádu zánětlivých reakcí [1].
Důsledkem toho je vytvoření adheze obou listů pohrudnice se zánikem pleurálního prostoru. Nejefektivnější cestou aplikace se jeví užití videotorakoskopie, při které jednak můžeme před vlastní aplikací látky odebrat celou řadu biologického materiálu pro případné upřesnění diagnostiky základní choroby, jednak příslušnou chemickou látku cíleně aplikovat. I přesto nebývá léčba přibližně u 20 % pacientů z mnoha důvodů úspěšná.
Materiál a metodika
Za 18 měsíců jsme ošetřili 14 nemocných (10 mužů a 4 ženy) s průměrným věkem 71 let, kteří byli v různé etapě adjuvantní chemoterapie nebo radioterapie (tab. 1). Kritériem zařazení nemocného k torakoskopickému výkonu byla recidiva výpotku po druhé a další punkci, zkracující se interval mezi punkcemi a cytologický průkaz maligních buněk v punktátu. Důležitá je prognóza předpokládané doby přežití, která by měla být min. 3 měsíce.
Tab. 1. Soubor nemocných v sledovaném období. 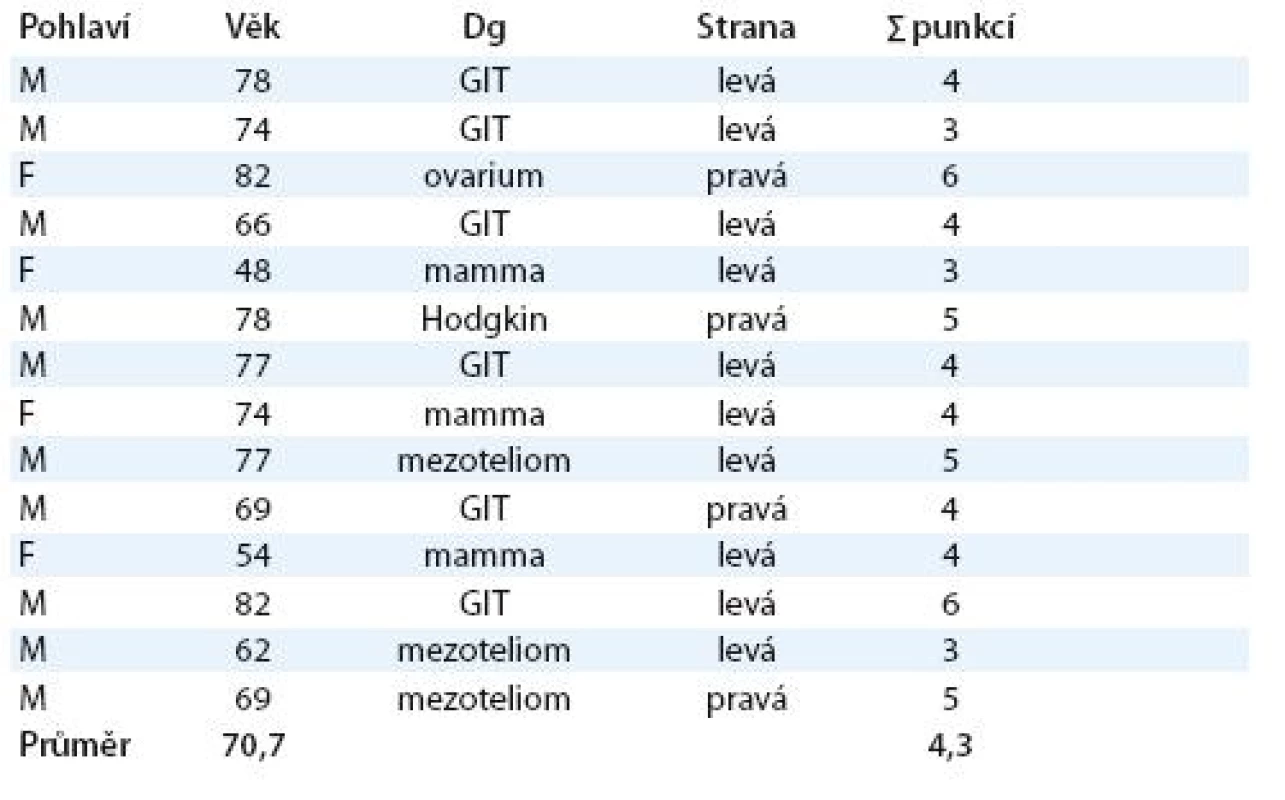
M (male) – muž, F (female) – žena Aplikaci biotalku jsme provedli pomocí videotorakoskopie v doporučované dávce 5 g [2]. Insuflace biotalku do pleurální dutiny se provádí jednoduchým zařízením pomocí portu 10 mm, kterým se před ukončením výkonu zavede hrudní drén. Používali jsme silikonový drén 28 F, jenž byl fixován pomocí převlečeného kroužku k pokožce nemocného. Tato fixace nám umožňuje snadnější manipulaci – povytahování – v průběhu léčby. Drén byl vždy napojen na uzavřený drenážní systém s možností navození kontrolovaného podtlaku. Po celou dobu založené drenáže jsme udržovali kontrolovaný podtlak do hodnoty – 20 cm H2O. V počátku léčby – první 4 hod po výkonu – byl systém napojen jen na spádovou drenáž a až poté jsme postupně v průběhu dalších 4 hod zapojili aktivní odsávání. Tento algoritmus je poměrně důležitý jako prevence vzniku možné komplikace – reexpanzního plicního edému.
Odběr pleurálního výpotku a krevního séra jsme prováděli ve 12hodinových intervalech vždy v 6.00 a 18.00 hod. První odběr peroperačně před aplikací biotalku a další po dobu trvání odpadů z hrudního drénu v množství 150 ml a více za 24 hod. Průměrná doba hrudní drenáže byla 4 dny ± 1 den.
Úspěšnost a efektivitu léčby jsme sledovali pomocí UZ vyšetření pleurální dutiny standardně přístrojem Toshiba Xario s použitím konvexní sondy 2 – 5 MHz, a to před odstraněním hrudní drenáže, po dobu prvních 3 měsíců vždy v intervalu 1 měsíc a dále po 3 a 6 měsících v závislosti na vývoji základního maligního onemocnění.
Výsledky
U všech nemocných došlo k vzestupu sledovaných parametrů S‑CRP i P‑CRP. Maximum hodnot bylo v období 12 – 48 hod. Na základě výsledků jsme soubor rozdělili podle poměru P‑CRP (pleurální C ‑ reaktivní protein) ku S‑CRP (sérový C ‑ reaktivní protein) do 2 skupin. V první skupině 11 nemocných došlo k výraznému vzestupu hodnot CRP v pleurálním výpotku tak, že poměr P‑CRP ku S‑CRP byl větší než 60 % (graf 1). Recidivu výpotku jsme zaznamenali 3krát, a to v průběhu 2. a 3. měsíce sledování. Ukázalo se, že u těchto 3 nemocných došlo po počátečním vzestupu P‑CRP v průběhu 24–36 hod k jeho prudkému poklesu v čase sledování, i když poměr P‑CRP/ S‑CRP dosahoval 32 % (graf 2).
Graf 1. Závislost průměrných hodnot S-CRP a P-CRP při úspěšně vyvolané pleurodéze. 
S-CRP – sérový C-reaktivní protein, P-CRP – pleurální C-reaktivní protein Graf 2. Závislost průměrných hodnot S-CRP a P-CRP při recidivě výpotku. 
S-CRP – sérový C-reaktivní protein, P-CRP – pleurální C-reaktivní protein V druhé skupině 3 nemocných jsme ve dvou případech museli provést opakované intervence hrudní punkcí i hrudní drenáží. Třetí nemocný zemřel po 2 měsících na progresi základní maligní choroby.
V této skupině 3 nemocných byl poměr P‑CRP ku S‑CRP menší než 30 % (graf 3). Množství výpotku v pleurální dutině v čase sledování udává tab. 2.
Graf 3. Závislost průměrných hodnot S-CRP a P-CRP při neúspěšně vyvolané pleurodéze. 
S-CRP – sérový C-reaktivní protein, P-CRP – pleurální C-reaktivní protein Tab. 2. Množství tekutiny při UZ kontrolách (ml). 
M (male) – muž, F (female) – žena, HD-ex – objem výpotku v době ukončení drenáže, ?? – na kontrolu se nedostavil, + – exitus letalis, * – nová hrudní intervence (punkce, drenáž), xx – v průběhu monitor. Diskuze
Kontinuální tvorba výpotků způsobuje nemocnému metabolický a minerálový rozvrat, který se nejen spolupodílí na rozvoji kachexie, ale postupně komprimuje plicní parenchym. Důsledkem toho je nárůst dušnosti. Pokud komprese parenchymu trvá delší dobu, dochází ke vzniku plicní atelaktázy a nemocný je ohrožován vznikem zánětlivého onemocnění plicního parenchymu. Opakovanými jednorázovými evakuacemi hrudními punkcemi může dojít k řadě iatrogenních komplikací, jako např. vznik pneumotoraxu. Není ani vzácností vznik hemotoraxu při poranění interkostálních cév u často kachektických onkologických nemocných. Hrozí také zavlečení infekce do pleurálního prostoru se vznikem empyému u nemocných s výrazně oslabenou imunitou buď důsledkem vlastní maligní choroby, nebo i v důsledku chemoterapie či radioterapie.
Příčinou tvorby výpotku je až v 77 % případů malignita [3]. Průkaz maligního charakteru výpotku může být první manifestací malignity. Z výše uvedeného vyplývá nutnost rozdělení výpotků na maligní a paramaligní. Paramaligní výpotek není způsoben maligním pleurálním rozsevem, ale jeho vznik je v přímé souvislosti nejčastěji s primárním plicním nádorem nebo maligním onemocněním mezihrudí a má transsudativní charakter [4]. V těchto případech se ani nedoporučuje provádět cytologii punktátu [5]. U ostatních výpotků, které mají vždy charakter exsudátu, je nutné vyvinout veškerou snahu prokázat jejich skutečný původ. Například v sérii 96 pacientů, kteří měli maligní výpotek, byla u 44 (46 %) jeho detekce prvním znakem přítomnosti karcinomu [6]. Výsledky rozboru rozsáhlých studií ukazují, že hlavní příčinou maligního výpotku jsou metastázy nádorů plic, prsů, vaječníků, žaludku a lymfomy [7]. Tři čtvrtiny diagnóz maligních výpotků připadají na karcinom plic, prsu a lymfom [8]. Karcinom prsu je celkově druhou nejčastější příčinou tvorby maligní pleurální efuze. Uvádí se, že u 7–11 % pacientů s karcinomem prsu postihne v průběhu choroby metastatický rozsev na pleuru. Z těchto pacientů je ve 43 % výpotek první manifestací choroby [9].
Hlavní mechanizmy tvorby výpotku u maligního onemocnění:
- přímá invaze pleurálního povrchu maligním procesem díky hematogennímu, lymfatickému nebo kontinuálnímu šíření malignity;
- invaze nádoru do lymfatického systému, zejména do mediastinálních a hilových uzlin s blokádou lymfatické cirkulace;
- obstrukce bronchu maligním nádorem se vznikem atelektázy a s tvorbou výpotku „e vacuo“;
- nádorová stenóza bronchu vyvolá vznik obstruktivní pneumonie či pneumonitidy s tvorbou reaktivního výpotku;
- dráždivý vliv radio ‑ nebo chemoterapie na pleuru s následnou tvorbou exsudátu;
- hypoproteinemie či srdeční selhávání v souvislosti s terapií anebo celkovým stavem pacienta.
Závěr
Snahou je předpovědět úspěšnost chemické pleurodézy na základě míry celkové zánětlivé reakce organizmu, jež udává dynamika hodnot humorálních a buněčných zánětlivých parametrů jak v séru, tak v pleurálním výpotku. Z prvních výsledků studie se zdá, že sledování efektivity pomocí vzestupu CRP jako jednoho z parametrů zánětlivé reakce organizmu je jednoduché a prospěšné. Efekt signifikantního vzestupu se ale dostavuje s určitou latencí. Další dílčí výsledky naší pilotní studie v oblasti buněčné imunity ukazují, že zánětlivá reakce je časnější a přesněji detekovatelná, a to i s ohledem na různé příčiny vzniku recidivujících výpotků. Naším cílem je vytvoření algoritmu sledování buněčné odpovědi tak, abychom mohli úspěšnost léčby predikovat přesněji a dříve.
Z našeho malého souboru také plyne, že recidivující výpotky u maligní formy mezoteliomu pleury jsou touto metodou léčby pravděpodobně neovlivnitelné.
Jistě lze polemizovat o tom, zda nestačí aplikovat látku ve vodném roztoku zavedeným hrudním drénem. Tak se v řadě případů postupuje, i když účinnost navozené pleurodézy oproti naší metodě je zhruba poloviční. Vysvětlujeme si to tím, že jednak pod kontrolou zraku můžeme dobře evakuovat veškerou tekutinu uloženou ve srůstech, jednak práškovou formu látky lze lépe distribuovat v celém pleurálním prostoru. Indikace nemocných vhodných k našemu zákroku je v kompetenci onkologa, který vždy musí stanovit prognózu nemocného a také anesteziologa, jenž musí zvážit únosnost selektivní plicní ventilace.
Práce podpořena Výzkumným záměrem MZO 00179906.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Petr Habal
Kardiochirurgická klinika
FN v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: phabal@seznam
Zdroje
1. Volanakis JE. Human C ‑ reactive protein: expression, structure, and function. Mol Imunol 2001; 38 : 189 – 197.
2. Colt HG. Thoracoscopic management of malignant pleural effusions. Clinics in Chest Med 1995; 16(3): 505 – 518.
3. Marel M, Zrůstová M, Šťastný B. The incidence of pleural effusion in a well‑defined region: epidemiologic study in central Bohemia. Chest 1993; 104 : 1486 – 1489.
4. Marel M, Fila L. Diferenciální diagnostika a léčba maligních pleurálních výpotků. Klin Onkol 2001; 1(zvl. č.): 16 – 19.
5. Assi Z, Caruso JL, Herndon J et al. Cytologically proved malignant pleural effusions: distribution of transudates and exudates. Chest 1998; 113 : 1302 – 1304.
6. Chernow B, Sahn SA. Carcinomatous involvement of the pleura: An analysis of 96 patients. Am J Med 1977; 63 : 695 – 702.
7. Ruckdeschel JC. Management of malignant pleural effusion. Semin Oncol 1995; 22 : 58 – 62.
8. Vargas FS, Teixeira LR. Pleural malignancies. Curr Opin Pulm Med 1996; 2 : 335 – 340.
9. Ryan CJ, Rodgers RF, Unni KK. The outcome of patients with pleural effusions of indeterminate cause at thoracotomy. Mayo Clin Proc 1981; 56 : 145 – 149.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Onkologové využívají komunikační systém pro videokonference
- Vakcinace proti lidskému papillomaviru v ČR
- Zápis ze schůze výboru České onkologické společnosti dne 23. 3. 2010 v Plzni
- In memoriam – za doc. MU Dr. Zdeňkem Churým, CSc.
- Linhartová V.Kapitoly z dějin Masarykova onkologického ústavu v Brně.Brno: Masarykův onkologický ústav 2010. 91 s. ISBN 978-80-86793-14-6.
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



