-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
Autoři: M. Šachlová 1; L. Foretová 2
Působiště autorů: Gastroenterologická ambulance, Masarykův onkologický ústav, Brno2 Oddělení epidemi ologi e a genetiky nádorů, Brno 1
Vyšlo v časopise: Klin Onkol 2009; 22(6): 296-297
Kategorie: Aktuality v onkologii
Screeningové programy jsou určeny k rozpoznání kolorektálního karcinomu (KRCA) u jedinců s nízkým populačním rizikem onemocnění. Dispenzární programy KRCA se používají u rizikových skupin tohoto onemocnění, tj. u osob s pozitivní osobní anamnézou onemocnění kolorekta nebo u osob s rodinnou anamnézou KRCA či adenomu, s familiární adenomatózní polypózou (FAP), hereditárním nepolypózním kolorektálním karcinomem (HNPCC). Dispenzární programy jsou formulovány nejednotně a často modifikovány podle místních zvyklostí. Už v roce 1999 byl v ČR publikován první návrh ke sledování, další revidovaný návrh je z roku 2005 [1–3]. Český návrh vycházel z předchozích směrnic Americké gastroenterologické asociace z roku 1997 a 2003. Za zmínku stojí i fakt, že v roce 2006 byla poprvé publikována nová doporučení dispenzarizace po endoskopické polypektomii a po resekci KRCA jako první společný dokument multidisciplinární expertní skupiny US Multi Society Task Force a Americké onkologické společnosti [4–7]. To, že vznikla 3. revize v průběhu 10 let, potvrzuje skutečnost, že směrnice pro dispenzarizaci a screening představují dynamický proces.
Dobře definované hereditární syndromy (s dědičnou monogenní dispozicí) kolorektálního karcinomu (familiární adenomatózní polypóza a hereditární nepolypózní kolorektální karcinom – Lynchův syndrom) tvoří asi 10% všech případů. Většinu kolorektálních karcinomů tvoří tzv. sporadický karcinom (50–60%) a familiární (s rodinným výskytem, bez prokázané příčiny) (20–30%) (obr. 1). Odhaduje se, že nejméně 10% dospělých osob v civilizovaných zemích má jednoho příbuzného prvního stupně postiženého kolorektálním karcinomem [8].
Obr. 1. Výskyt kolorektálního karcinomu (odhad). FAP – familiární adenomatózní polypóza, HNPCC – hereditární nepolypózní kolorektální karcinom. 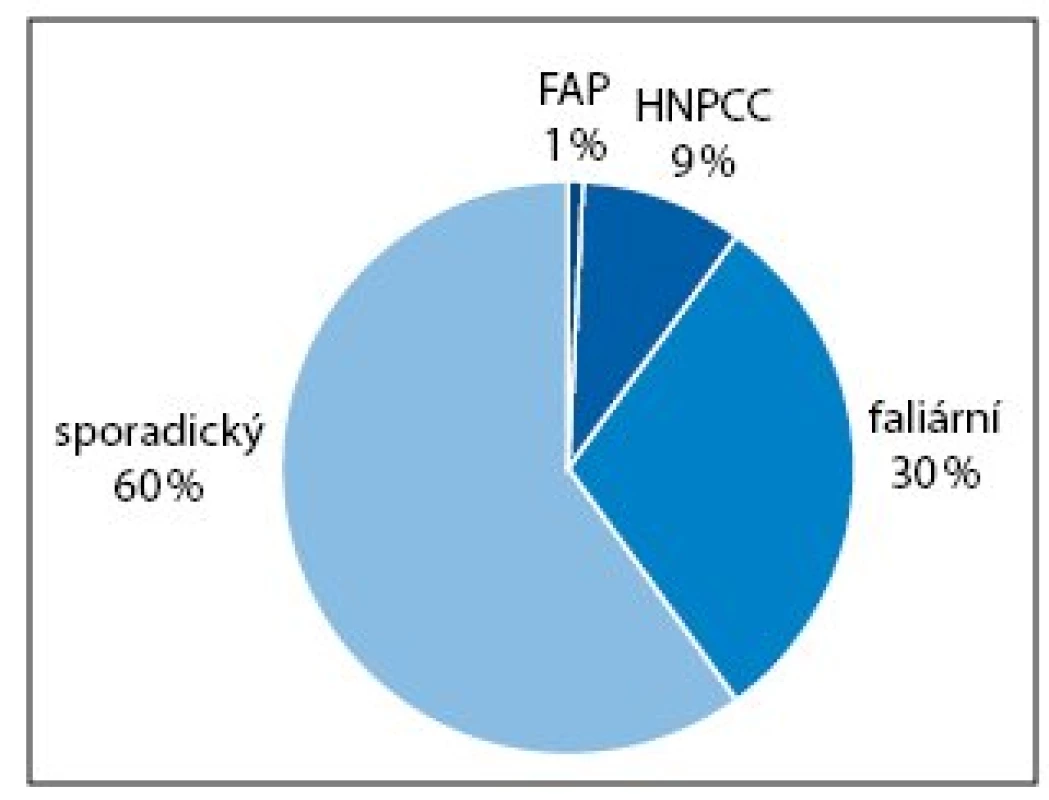
Je zajímavé, že výraznější familiární asociace byla zjištěna pro lokalizaci KRCA v proximální a distální lokalizaci. Při rektální lokalizaci byl vztah méně výrazný [8]. Z klinické praxe je známo, že ženy s anamnézou karcinomu prsu nebo gynekologického karcinomu mají i vyšší riziko karcinomu kolorektálního.
Riziko se stupňuje počtem postižených příbuzných a také jejich mladším věkem v době diagnózy [10] (tab. 1). V rodinách s výskytem nádoru u dvou a více příbuzných v linii, kde alespoň u jednoho byl nádor diagnostikován pod 50 let, by měla být doporučena genetická konzultace. Testování by mělo být provedeno i u nádoru kolorekta ve věku pod 35 let bez rodinné anamnézy.
Tab. 1. Odhadovaná empirická rizika dle rodinné anamnézy – podle Hodgsona [9]. ![Odhadovaná empirická rizika dle rodinné anamnézy – podle Hodgsona [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/dfa355f5b361443db4faf64d3e747a6d.png)
Původní dispenzární program doporučoval jednotný postup pro všechny osoby s familiárním výskytem „nesyndromového typu“: screeningový program s úvodním testem na okultní krvácení ve stolici se začátkem od 40 let věku. Zařazení do dispenzárního programu bylo zvlášť zdůrazňováno u jedinců, v jejichž rodinách se vyskytl KRCA ve věku nižším než 55 let nebo adenom pod 60 let věku [1]. Rozdílné hodnoty relativního rizika vedly k doporučení podle příbuzenského stupně.
- Při postižení jednoho příbuzného 1. stupně KRCA nebo adenomovými polypy ve věku pod 60 let nebo dvou příbuzných 1. stupně jakéhokoliv věku: kolonoskopie v pětiletém intervalu od 40 let věku nebo od věku o 10 let nižšího, v němž byla stanovena diagnóza nejčasnějšího KRCA v rodině.
- Při postižení jednoho příbuzného 1. stupně KRCA nebo adenomem ve věku 60 let a vyšším nebo dvou příbuzných 2. stupně KRCA: program průměrného rizika od věku 40 let.
- Při postižení jednoho příbuzného 2. stupně nebo jakéhokoliv počtu příbuzných 3. stupně (prarodiče, bratranci a sestřenice): program jako u osob s průměrným rizikem.
Dne 12. 6. 2008 se v Lékařském domě v Praze v rámci XII. onkogenetického dne sešla onkogenetická skupina Společnosti lékařské genetiky a České onkologické společnosti a projednávala přípravu dispenzarizačních návrhů pro hereditární nádorové syndromy. Předkládáme vybraný diskutovaný návrh pro osoby s familiárním výskytem nádoru kolorekta.
Doporučený protokol preventivního sledování u osob s vyšším rizikem kolorektálního karcinomu dle rodinné anamnézy (HNPCC nebylo potvrzeno genetickým testováním, nebo testování nebylo provedeno pro nesplnění kritérií, neplatí pro FAP)
Základní doporučení:
- Test na okultní krvácení ročně 10 let před nejnižším věkem výskytu nádoru v rodině a dále ročně mezi kolonoskopiemi. Při makroskopickém výskytu krve ve stolici provedení kolonoskopie okamžitě, test na okultní krvácení neprovádět.
- Kolonoskopie ve dvou až pětiletých intervalech (pětiletý interval u normálního kolon, u benigních změn 2–3 roky dle typu změn, jako je četnost a velikost adenomů, dysplastické změny), začátek 5–10 let před nejnižším věkem výskytu nádoru v rodinné anamnéze.
- U rodin, které splňují Amsterdamská kritéria a pravděpodobnost dědičnosti je vysoká, je vhodné dodržovat doporučení jako u HNPCC – viz navržená pravidla, uveřejněná v roce 2009 [11].
Závěr
Potřebujeme doporučené postupy? Určitě ano. Skupina osob se zvýšeným rizikem KRCA musí být sledována. Je však potřeba postupy sjednotit tak, aby dispenzarizace splnila svůj účel a současně aby tyto osoby nebyly zbytečně vyšetřovány a stigmatizovány. Stále více se v medicíně prosazuje koncepce Evidence Based Medicine, tzn. lékařství založené na důkazech, proto i návrhy dispenzarizace se musí opřít o dostupné literární údaje. Z literatury je známo, že asi 25% diagnostických a terapeutických výkonů nelze zdůvodnit, a lze je proto považovat za nadbytečné a zbytečně nákladné [12].
Je potřeba sjednotit postupy mezi odbornými společnostmi a jednotlivými specialisty. Pak můžeme společně vyvíjet i tlak na jednání s pojišťovnou a výsledky dispenzarizace vyhodnocovat. Je zapotřebí na toto téma diskutovat v rámci široké odborné společnosti a přijmout konsenzus k jednotnému postupu.
Doporučený návrh sledování by měl být jednoduchý především pro praktické lékaře, kteří mají provádět celkové preventivní prohlídky po dvou letech u svých registrovaných osob a hodnotit i rizika rodinné anamnézy. Každý člověk v běžném riziku bez klinických problémů by měl absolvovat test na okultní krvácení od 50 do 54 let věku 1krát za rok a dále v 55 letech buď screeningovou kolonoskopii 1krát za 10 let, nebo test na okultní krvácení 1krát za 2 roky. V případě vyššího rizika by měl lékař navrhnout výše uvedenou dispenzarizaci nebo indikovat genetickou konzultaci. Stejně tak i všichni onkologové, kteří léčí pacienty s kolorektálním nádorem, by měli být schopni zhodnotit vhodnost genetické konzultace, riziko onemocnění pro další členy rodiny a doporučit preventivní sledování. Pacient by měl dostat do rukou informaci pro své příbuzné o vhodných preventivních opatřeních. Stačí jen krátký jednoduchý text.
Pacientů s nádory kolorekta přibývá, jejich příbuzní mají zvýšené empirické riziko onemocnění a je na lékařích, zda jim jednoduchou radou umožní se účinně bránit.
MUDr. Milana Šachlová, CSc. et Ph.D.
Gastroenterologická ambulance
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: sachlova@mou.cz
Zdroje
1. Frič P, Zavoral M. Sekundární prevence kolorektálního karcinomu (Aktuální přehled). Endoskopie 2001; 10 : 39 – 42.
2. Frič P, Zavoral M. Sekundární prevence kolorektálního karcinomu se zřetelem k vysokorizikovým skupinám. Postgrad Med 2005; 7 : 240 – 243.
3. Frič P, Zavoral M. Dispenzární programy vysokorizikových skupin kolorektálního karcinomu.Česká a slov.gastroenterologie 2006; (60) 5 : 199 – 200.
4. Winawer SJ, Fletcher RH, Miller L et al. Colorectal cancer screening clinical quidelines and rationale. Gastroenterology 1997; 112 : 594 – 642.
5. Winawer SJ, Fletcher RH, Rex D et al. Colorectal cancer screening and surveillance: clinical quidelines and rationale ‑ update based on new evidence. Gastroenterology 2003; 124 : 544 – 560.
6. Winawer SJ, Zauber AG, Fletcher RH et al. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi‑Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006; 130 : 1872 – 1885.
7. Winawer SJ, Kahi CJ, Levin B et al. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and the US Multi‑Society Task Force on Colorectal Cancer. Gastroenterology 2006; 130 : 1865 – 1871.
8. Burt RW, Peterson GM. Familial colorectal cancer. Diagnosis and management. In: Young P, Rozen P, Levin B. Prevention and Early Detection of Colorectal Cancer. Philadelphia: W. B. Saunders Comp 1996 : 171 – 194.
9. Hodgson SV, Foulkes WD, Eng Ch et al. A Practical Guide to Human Cancer Genetics. Cambridge University Press 2007.
10. Jablonská M et al. Kolorektální karcinom, časná diagnóza a prevence. 1. vyd. Praha: Grada 2000 : 303 – 311.
11. Plevová P, Novotný J, Šachlová M et al. Hereditární nepolypózní kolorektální karcinom, Klin Onkol 2009; 22 (Suppl): 12 – 16.
12. Woolf SH. Practice quidelines: a new reality in medicine. Arch Intern Med 1990; 115 : 1811 – 1818.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2009 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Editorial
- Komentár k vývoju konceptu prognostických faktorov chronickej lymfocytovej leukémie: Cesta od prognostických faktorov k prediktorom liečebnej odpovede
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Viditelnost na ultrasonografii jako nejsilnější prediktor invazivity u duktálních karcinomů in situ v retrospektivní studii
- Hodnota zobrazenia 18- FDG PET/ CT u pacientov s atypickým metastatickým karcinómom – kazuistika: 18- FDG PET/CT pri kolorektálnych karcinómoch
- Resekce pankreatu pro metastázy karcinomu ledviny
- Způsob života u onkologických pacientů – jak a kdy ho měnit?
- Klub onkologických juniorů
- Chirurgie karcinomu prsu v České republice
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
- Klinické databáze – rozmar, nebo nutnost
- Zápis ze schůze výboru České onkologické společnosti dne 6. 11. 2009 na MOÚ Brno
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



