-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLaboratorní aspekty systémové AA amyloidózy
Laboratory aspects of systemic AA amyloidosis
The aim of the communication is to remind the issue and the clinical significance of selected laboratory parameters used in the diagnosis and monitoring of patients with AA amyloidosis. Correct typing of amyloid masses, exclusion of AL type of amyloidosis, and in particular the clarification of the underlying disease are among the most important aspects in the diagnosis of disease. An essential prerequisite in the treatment of AA amyloidosis is a control of underlying process with a reduction of amyloidogenic serum amyloid A levels.
Keywords:
AA amyloidosis, serum amyloid A, laboratory examination.
Autoři: T. Pika 1; Z. Heřmanová 2; P. Flodrová 3
Působiště autorů: Hematoonkologická klinika, LF UP a FN Olomouc 1; Ústav imunologie, LF UP a FN Olomouc 2; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 3
Vyšlo v časopise: Klin. Biochem. Metab., 25, 2017, No. 2, p. 56-58
Souhrn
Cílem sdělení je připomenout problematiku a klinický význam stanovení vybraných laboratorních parametrů využívaných v diagnostice a sledování nemocných s AA amyloidózou. Správná typizace amyloidových mas, vyloučení AL typu amyloidózy a zejména objasnění základního onemocnění patří mezi stěžejní aspekty v diagnostice onemocnění. Základním předpokladem léčby AA amyloidózy je redukce hladin amyloidogenního sérového amyloidu A.
Klíčová slova:
AA amyloidóza, sérový amyloid A, laboratorní vyšetření.Úvod
Amyloidózy představují heterogenní skupinu onemocnění charakterizovanou ukládáním amyloidu. Jako amyloid je nazýván insolubilní bílkovinný materiál fibrilárního charakteru zaujímající konformaci β-skládaného listu, který je poměrně odolný vůči proteolýze. Amyloidové masy jsou extracelulárně deponovány v tkáních, což vede k jejich dezorganizaci a úbytku normálních buněčných elementů s následným narušením funkce orgánů. Jedná se o dynamický, progredující proces. Doposud bylo identifikováno více než 30 různých amyloidogenních proteinů. V zásadě rozlišujeme amyloidózu podle rozsahu postižení na systémovou a lokalizovanou; podle charakteru přenosu pak na získané a hereditární typy. Většina typů systémových amyloidóz je spojena s multiorgánovým postižením. Nejčastějším typem je AL amyloidóza, patřící do skupiny monoklonálních gamapatií resp. plazmocelulárních dyskrázií. Onemocnění je charakterizované extracelulární depozicí insolubilních fibril tvořených fragmenty nebo kompletními molekulami monoklonálních lehkých řetězců imunoglobulinů produkovaných klonální plazmocelulární populací. AA (dříve nazývaná sekundární) amyloidóza patří mezi méně časté onemocnění [1-3].
Etiologie a patogeneze AA amyloidózy
Etiologickým činitelem amyloidových depozit u sekundární amyloidózy (AA) je sérový amyloid A (SAA). Celosvětově AA amyloidóza dosahuje až 40 % ze všech typů amyloidóz, v našich podmínkách představuje 4 až 7 %. AA amyloidóza doprovází chronické zánětlivé autoimunitní onemocnění, obvykle obtížně kontrolované léčbou (revmatoidní artritis, Bechtěrevova choroba či nespecifické střevní záněty), dále chronické infekční onemocnění (osteomyelitida, tuberkulóza) a může být přítomna i u nádorových onemocnění (Castlemanova choroba, lymfomy). V západních zemích se s AA amyloidózou setkáváme nejčastěji u zánětlivých artritid, naopak v rozvojových zemích se objevuje u chronických infekcí. AA amyloidóza může provázet i řadu tzv. autoinflamatorních syndromů. Jedná se o soubor onemocnění s genetickým podkladem, které jsou charakterizovány opakovanými epizodami febrilních stavů se zánětlivým postižením kůže, kloubů, očí či gastrointestinálního traktu. Mezi nejčastější typy patří familiární středozemní horečka (FMF), syndrom nadprodukce IgD (HIDS), syndrom deficitu receptoru 1 pro tumor nekrotizující faktor (TRAPS) a další [4-7]. V našem souboru osmi nemocných diagnostikovaných na našem pracovišti byly nejčastější příčinou AA amyloidózy zánětlivé artritidy a nespecifické střevní záněty (Tabulka 1). U těchto pacientů byl SAA vyšetřen na analyzátoru BN II s využitím komerční soupravy N Latex SAA firmy Siemens. Naměřené hodnoty SAA se pohybovaly v rozsahu 3,6 až hodnota nad 206 mg/l.
Tab. 1. Underlying disease in 8 patients with AA amyloidosis from our department 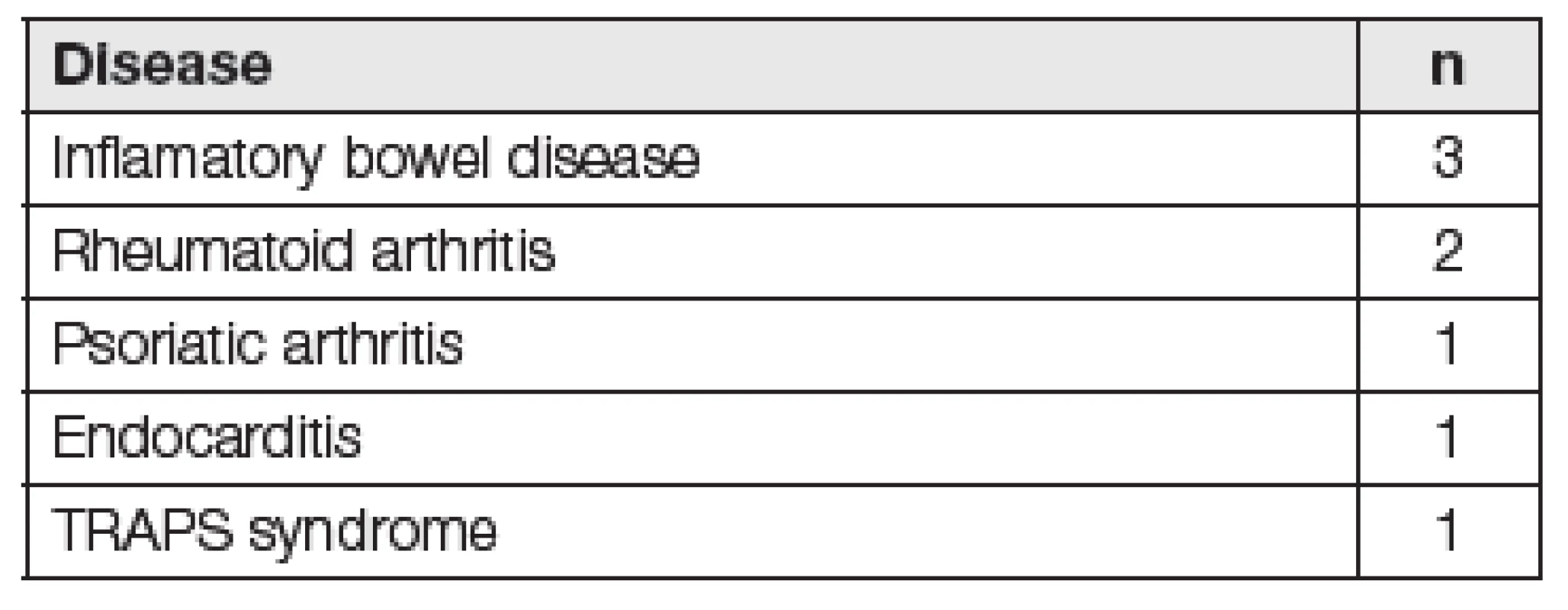
Sérový amyloid A patří mezi proteiny akutní fáze. Jedná se skupinu apolipoproteinů asociovaných s lipoproteinem o vysoké denzitě (HDL), které jsou syntetizovány hepatocyty pod vlivem transkripční regulace prozánětlivými cytokiny, zejména tumor nekrotizujícím faktorem (TNF), interleukinem 1 a 6. Mezi fyziologické úlohy SAA patří transport cholesterolu do jater, chemotaxe imunitních buněk do místa zánětu a indukce enzymů podílejících se na degradaci extracelulární matrix. Medián hladin SAA u zdravých dárců je cca 3 mg/l, nicméně během akutní fáze zánětu hladiny SAA strmě stoupají. SAA je v tkáních internalizován makrofágy, dochází k proteolytickému štěpení a následnému uvolnění amyloidogenních peptidů do extracelulárního prostoru. Samotné trvalé zvýšení hladin není pro rozvoj AA amyloidózy dostačující, neboť AA amyloidózou trpí pouze malá část nemocných se zánětlivým onemocněním. Přesné mechanismy patogeneze nejsou doposud zcela známy, nicméně jako jeden z dalších faktorů se jeví izotyp genů pro SAA. U člověka jsou přítomny čtyři SAA geny, které se nacházejí na 11. chromozomu. SAA1 a SAA2 geny jsou zodpovědné za akutní fázi zánětlivé odpovědi, SAA3 je pseudogen a SAA4 je exprimován konstitučně. SAA1 gen má tři alely SAA1.1, SAA1.3 a SAA1.5, definované substitucí aminokyselin v pozicích 52 a 57 molekuly. SAA2 má dvě alely – SAA2.1 a SAA2.2. Výskyt jednotlivých alel se liší mezi populacemi a může mít vliv na hladiny SAA v krvi, odlišný poločas degradace, závažnost onemocnění a odpověď na léčbu. Studie v japonské populaci naznačují, že SAA1.3 je více pro-amyloidogenní nežli SAA1.1 izotyp. Naopak u kavkazských nemocných s juvenilní artritidou a AA amyloidózou, byla zjištěna zvýšená exprese SAA1.1 [8, 9].
Pro stanovení hladin SAA bývá nejčastěji užíváno imunonefelometrických technik, horní hranice normy v séru je přibližně 6,4 mg/l. Obdobně jako CRP (C - reaktivní protein), stanovení a sledování hladin SAA je užitečné pro diagnostiku a monitorování aktivity zánětlivých procesů. Stanovení SAA je více vypovídající než CRP u virových infekcí, rejekčních epizod u recipientů transplantované ledviny (zejména imunosuprimovaní nemocní) a u nemocných s cystickou fibrózou léčených kortikoidy. V případě zánětlivých artritid, SAA vykazuje užší korelaci s aktivitou onemocnění ve srovnání se sedimentací erytrocytů a CRP. Současné stanovení SAA a CRP může zvýšit diagnostickou senzitivitu u infekcí. U nemocných s AA amyloidózou je podstatná redukce hladin SAA zásadní ke stabilizaci amyloidových mas a zlepšení průběhu onemocnění.
Klinický obraz a diagnostika
Dominantní klinickou manifestací AA amyloidózy je postižení ledvin s excesivní proteinurií. Nefrotický syndrom bývá přítomen u více než 50 % nemocných v době diagnózy onemocnění, 75 % nemocných mají různý stupeň renální nedostatečnosti, přičemž progrese do stádia nutnosti léčby hemodialýzou bývá přibližně u poloviny nemocných. Mezi další postižené orgány patří slezina a nadledviny, avšak obvykle bez projevů adrenální insuficience. Na rozdíl od AL amyloidózy je srdeční postižení spíše raritní (2-3 %) [6].
Pro samotné stanovení diagnózy AA amyloidózy je zcela nezbytný odběr tkáně s histologickým průkazem a následnou typizací amyloidových mas. Vzhledem k dominujícímu orgánovému postižení bývají často necílené biopsie užívané v diagnostice AL amyloidózy (podkožní tuk, biopsie rekta) nediagnostické, a proto bývá morfologická diagnóza AA amyloidózy stanovena z biopsií orgánů, nejčastěji ledvin. Základní morfologickou metodou průkazu amyloidu je speciální barvení Konžskou červení vykazující charakteristickou birefringenci s dichroismem v polarizovaném světle, přičemž lze využít také metodu imunofluorescence. Průkaz depozice AA amyloidu je nejčastěji prováděn metodou nepřímé imunohistochemie. Metoda je založena na principu reakce protilátky s antigenem - epitopem SAA se standardním znázorněním technikou avidinbiotin komplexu na řezech formalínem fixovaných tkání zalitých v parafinových bločcích. V případě imunofluorescence se zpracovává nativní - zmrazená nefixovaná tkáň a protilátky jsou značeny fluorochromem. V současnosti však již mnohá pracoviště používají pokročilých technik vizualizace a typizace amyloidových mas, a to včetně elektronové mikroskopie či technik hmotnostní spektrometrie. Typizace amyloidových mas a vyloučení AL formy amyloidózy je tedy zásadní.
Spektrum laboratorních vyšetření využívaných v diagnostice etiologie AA amyloidózy
Důkladná osobní a rodinná anamnéza spolu s fyzikálním vyšetřením často usnadní lékaři diferenciálně diagnostickou rozvahu a napomůže výběru adekvátních laboratorních a zobrazovacích metod. Pomineme-li problematiku infekčních onemocnění, nejčastější příčinu AA amyloidózy představují v našich podmínkách zánětlivé artropatie a nespecifické střevní záněty. Mezi základní laboratorní vyšetření patří stanovení sedimentace erytrocytů (FW), C - reaktivního proteinu, vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů, analýza renálních parametrů včetně proteinurie, iontogramu a jaterních testů. K vyloučení monoklonální gamapatie (pokud není vyloučena možnost AL amyloidózy) je nezbytné doplnění analýzy proteinů séra a moči elektroforézou spolu s imunofixací a stanovením hladin volných lehkých řetězců imunoglobulinu. Stanovení hladin polyklonálních imunoglobulinů umožní posoudit míru parézy humorální aktivity či naopak hyperprodukci polyklonálních imunoglobulinů (hepatopatie, kolagenózy či Castlemanova choroba). Hyper-IgD syndrom, který bývá spojen s vysokými hladinami imunoglobulinu D, patří do skupiny periodických febrilních stavů. Genetickým podkladem je mutace v genu pro mevalonát kinázu.
V případě nespecifických střevních zánětů bývají často pozitivní protilátky proti myeloperoxidáze cytoplazmy neutrofilů (pANCA) u ulcerózní kolitidy, či protilátky proti Saccharomyces cerevisiae (ASCA) u Crohnovy choroby. Zásadní je však endoskopické vyšetření s bioptickým průkazem afekce stěny trávicí trubice. U zánětlivých artropatií je na místě stanovení hladin revmatoidního faktoru a protilátek proti cyklickému citrulinovanému peptidu (anti –CCP). Ankylozující spondylitida bývá spojena s antigenem HLA B27. V případě systémového lupus erythematodes, vaskulitid a jiných kolagenóz je na místě analýza anti dsDNA (protilátky proti dvouspirálové DNA), ANCA, ANA (antinukleární) a ENA (protilátky proti extrahovatelným nukleárním antigenům) protilátek. V současnosti je v diagnostice navíc běžně užíváno zobrazovacích metod, v případě pozitronové emisní tomografie i se zobrazením metabolické aktivity tkáně (Obr. 1). V případě podezření na možnost onemocnění ze skupiny autoinflamatorních stavů, je na místě doplnění genetického vyšetření.
Fig. 1. <sup>18</sup>F-FDG - PET/CT scan in patient with inflammatory bowel disease; <sup>18</sup>F-FDG uptake in the entire colon 
Závěr
AA amyloidóza představuje vzácnou, ale závažnou komplikaci chronických zánětlivých či nádorových onemocnění. Určení etiologie primárního patologického procesu patří mezi zásadní aspekty v diagnostice a diferenciální diagnostice onemocnění. Základem léčby je odstranění příčiny či alespoň důkladná kontrola procesu vedoucího k zvýšení hladin SAA v oběhu. Ačkoliv v našich podmínkách představují hlavní skupinu nemocných s AA amyloidózou pacienti se zánětlivými artropatiemi, je možné konstatovat, že v současnosti, s rozvojem moderních diagnostických a léčebných metod, se míra výskytu aktivního, léčebně refrakterního onemocnění snižuje. Účinná léčba vedoucí k potlačení aktivity zánětu a zlepšení kontroly onemocnění bývá spojena se zlepšením klinického stavu a delším přežitím nemocných s AA amyloidózou.
S podporou grantu IGA MZ CR 15-31156A.
Do redakce došlo 10. 4. 2017
Adresa pro korespondenci
MUDr. Tomáš Pika, Ph.D.
Hematoonkologická klinika,
Fakultní nemocnice Olomouc
I. P. Pavlova 6,
775 20 Olomouc
Email: tomas.pika@seznam.cz
Zdroje
1. Sipe, J. D., Benson, M. D., Buxbaum, J. N. et al. Amy-loid fibril protein nomenclature: 2010 recommendations from the nomenclature committe of International Society of Amyloidosis. Amyloid, 2010, 17, p. 101-104.
2. Merlini, G., Bellotti, V. Molecular mechanisms of amyloidosis. N. Engl. J. Med., 2003, 349, p. 583-596.
3. Merlini, G., Seldin, D. C., Gertz, M. A. Amyloidosis: pathogenesis and new therapeutic options. J. Clin. Oncol., 2011, 29, p. 1924-1933.
4. de Asúa, D. R., Costa, R., Galván, J. M., Filigheddu, M. T., Trujillo, D., Cadinanos, J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin. Epidemiol., 2014, 6, p. 369 – 377.
5. Joss, N., McLaughlin, K., Simpson, K., Boulton-Jones, J. M. Presentation, survival and prognostic markers in AA amyloidosis. Q. J. Med., 2000, 93, p. 535 – 542.
6. Lachmann, H. J. Secondary, AA, amyloidosis. In Gertz, M. A. et al. Amyloidosis: Diagnosis and treatment. New York: Springer Humana Press, 2010, p. 179 – 189.
7. Ryšavá, R. AA amyloidóza. In Ryšavá, R. Systémové amyloidózy a jejich léčba. Praha: Maxdorf, 2013, p. 27 – 45.
8. Westermark, G. T., Fändrich, M., Westermark, P. AA amyloidosis: pathogenesis and targeted therapy. Annu Rev Pathol., 2015, 10, p. 321 – 344.
9. Kuroda, T., Wada, Y., Nakano, M. Diagnosis and treatment of AA amyloidosis with rheumatoid Arthritis: State of the art. In Sarantseva, S. Amyloidosis – Mechanisms and prospects for therapy. In Tech. ISBN: 978-953-307-253-1. 2011, p. 43 – 62.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2017 Číslo 2- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
-
Všechny články tohoto čísla
-
Projekt MED PED v České republice
Make Early Diagnosis – Prevent Early Deaths in Medical Pedigrees - Projekt MedPed v České republice
- Laboratorní aspekty systémové AA amyloidózy
- Obtížně interpretovatelné nálezy elektroforéz a imunofixací u pacientů s mnohočetným myelomem po autologní transplantaci
- Programy externího hodnocení kvality v čase harmonizace výsledků laboratorních vyšetření
- Rabdomyolýza vyvolaná nadměrnou svalovou zátěží – častá příčina chybné diagnózy
- 23 případů metforminem indukované metabolické laktátové acidózy
- POCT a diabetes - potřeba komplexních a aktuálních informací
-
Projekt MED PED v České republice
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rabdomyolýza vyvolaná nadměrnou svalovou zátěží – častá příčina chybné diagnózy
- 23 případů metforminem indukované metabolické laktátové acidózy
- Projekt MedPed v České republice
- Obtížně interpretovatelné nálezy elektroforéz a imunofixací u pacientů s mnohočetným myelomem po autologní transplantaci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



