-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení k využití nádorových markerů v klinické praxi
Autoři: Valík D. (editor) 1; M. Nekulová 1; L. Zdražilová Dubská 1; Springer D. (editor) 2; I. Malbohan 2; Zima T. (editor) 2; O. Topolčan 3; R. Fuchsová 3; Š. Svobodová 3
Působiště autorů: Masarykův onkologický ústav Brno 1; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN Praha 2; Oddělení nukleární medicíny imunoanalytická laboratoř FN Plzeň- Bory a Centrální laboratoř pro imunoanalýzu LF UK a FN Plzeň 3
Vyšlo v časopise: Klin. Biochem. Metab., 22 (43), 2014, No. 1, p. 22-39
České společnosti klinické biochemie (ČSKB ČLS JEP)
České onkologické společnosti (ČOS ČLS JEP)
České společnosti nukleární medicíny (ČSNM ČLS JEP) - sekce imunoanalytických metodSouhrn
Nádorovým markerem rozumíme substanci přítomnou v nádoru nebo produkovanou nádorem nebo hostitelem jako odpověď na přítomnost tumoru. Tuto substanci lze využít k diferenciaci nádoru od normální tkáně, nebo uvažovat o přítomnosti tumoru na základě analýzy tělesných tekutin. Substanci lze měřit kvalitativně nebo kvantitativně metodami chemickými, imunologickými nebo metodami molekulární biologie.
V současnosti se většina používaných solubilních nádorových markerů stanovuje v séru. Nádorové markery nevykazují příliš velkou preanalytickou variabilitu. V určitých případech mohou být výsledky analýzy ovlivněny některými postupy klinického vyšetřování; např. pro stanovení prostatického specifického antigenu (PSA) má být odebrána krev nejdříve 48 hod po rektálním vyšetření prostaty, ovlivnit jeho hladinu může i jakákoliv manipulace s prostatou včetně jízdy na kole nebo sexuální aktivity. Kontaminace vzorku slinami nebo potem může znehodnotit stanovení antigenu skvamózních buněk (SCCA) nebo CA 19-9. Neuron-specifická enoláza (NSE) je při hemolýze významně uvolňována z erytrocytů, oddělení séra od krevních elementů je třeba provést nejpozději do 1 hod po odběru.
Vzhledem k širokému spektru nádorových onemocnění neexistuje univerzální nádorový marker. Obdobně senzitivita (správný záchyt nemocných) při dostatečné specificitě (správná negativita u lidí bez nádorového onemocnění) nedosahuje ideálních 100 %. Nezvýšená koncentrace nádorového markeru není tedy ještě důkazem nepřítomnosti maligního onemocnění, naopak pozitivní výsledek nemusí nutně znamenat přítomnost zhoubného nádoru.
Screening a primární diagnostika - vzhledem k poměrně nízké diagnostické senzitivitě a specificitě není většina nádorových markerů vhodná k tomuto účelu u asymptomatických vyšetřovaných. U symptomatických nemocných nebo u skupin pacientů s vysokým rizikem vývoje nádorového onemocnění lze použít vyšetření některých nádorových markerů ke screeningu choroby.
Rozsah onemocnění - vysoká hodnota nádorového markeru v séru může upozornit na nesprávně určené nižší stadium choroby (např. susp. generalizace u hodnot PSA >100 µg/l).
Prognóza - určení prognózy onemocnění není podstatnou rolí solubilních nádorových markerů. Značný význam má AFP a hCG u germinativních tumorů, určitý význam má hodnota CEA u kolorektálních karcinomů, případně β2mikroglobulin u myelomů.
Sledování průběhu choroby - je hlavní indikací těchto vyšetření. Vzestup hladin nádorových markerů představuje včasné upozornění, které předchází klinickou diagnózu návratu choroby.
Účinek terapie - sledování účinku terapie pomocí nádorových markerů je významnou indikací vyšetření solubilních nádorových markerů (Tabulka 1). Vzhledem k různým biologickým poločasům jednotlivých markerů je nutno správně volit intervaly odběrů krve k vyšetření tak, aby se skutečně postihl efekt terapie, nikoli pouze tzv. “lysis fenomén”, tj. prudké zvýšení koncentrace markeru jako důsledek cytolýzy po bezprostředním působení protinádorové terapie.
Frekvence vyšetření - Pro frekvenci vyšetřování platí kritéria doporučená WHO a podle zkušeností kliniků i statistiků hodnotících dynamiku změn nádorových markerů ve vztahu ke klinickému průběhu choroby je třeba dodržovat doporučenou frekvenci vyšetření (Tabulka 2).
Při hodnocení vyšetření je třeba zvážit další faktory, které by mohly přispět k falešné pozitivitě výsledku (Tabulka 3 a 4). Jsou to především zvýšené hladiny nádorových markerů v důsledku jejich produkce u nemaligních onemocnění, nebo při poruchách jejich vylučování (zejména při zhoršené funkci jater nebo ledvin).
Pro většinu nádorových markerů je znám biologický poločas v séru, který je velmi rozdílný (Tabulka 5); proto je třeba jej při hodnocení změn časového průběhu hladin zvažovat.Jako signifikantní bývají posuzovány tyto změny hladin nádorových markerů:
a) bez terapie (v klinické remisi):
stoupající trend koncentrace ve třech následných odběrech i v hladinách do cut-off značí recidivu, resp. progresi,b) během terapie:
nárůst o více než 25 % značí progresi onemocnění, pokles více než 50 % parciální remisi (kompletní remise však nemůže být hodnocena pouze pomocí změn v hladinách markerů).Účel: účelem tohoto doporučení je pomoci lékařům a pracovníkům klinických laboratoří se orientovat v racionálním používání nádorových markerů v klinické praxi.
Zdroje: toto doporučení rámcově vychází z dokumentů publikovaných ASCO, NACB a EGTM (www.asco.org, www.nacb.org, www.egtm.eu). Doporučení dále zohledňuje dlouhodobé zkušenosti autorů s používáním nádorových markerů v péči o onkologického pacienta.
Limitace: Toto doporučení není myšleno jako náhrada úsudku ošetřujícího lékaře, stejně tak nemůže postihnout všechny možné situace, jež mohou nastat v klinické praxi. Odpovědností ošetřujícího lékaře je zajistit konkrétnímu pacientovi adekvátní péči.
Obsah
Souhrn
Pojmy
- Biologická povaha nádorových markerů
- Preanalytické aspekty
- Vlastní laboratorní analýza
- Zdroje interference
- Interpretace
- Charakteristika jednotlivých klinicky významných nádorových markerů a specifické doporučení k jejich používání v klinické praxi
- 6.1. Solubilní nádorové markery
- 6.1.1. Markery vyšetřované z krve
CEA (karcinoembryonální antigen)
AFP (α-1-fetoprotein)
hCG (lidský choriový gonadotropin)
CA 19-9
CA 15-3
CA 125
HE4 (Human Epididymal Protein 4)
PSA (prostatický specifický antigen), fPSA (volná frakce PSA)
CA 72-4
S-100 beta
NSE (neuron-specifická enoláza)
SCCA (antigen skvamózních buněk)
CYFRA 21-1 (fragment cytokeratinu 19)
TPA, TPS (tkáňový polypeptidový /specifický/ antigen)
TK (thymidinkináza)
CgA (Chromogranin A)
P1NP (N-terminální propeptid prokolagenu typu 1)
ICTP (C – Telopeptid kolagenu typu I )
B2M (β2-mikroglobulin)
Feritin
LD (laktátdehydrogenáza)
Kalcitonin
TG (tyreoglobulin)
ProGRP (Pro-Gastrin-Releasing Peptid)
Tumor M2-PK (IPK, nádorový izoenzym pyruvátkinázy)
Inhibin
ACTH a ACTH-like substance - 6.1.2. Markery vyšetřované z krve i z moče
Monoklonální imunoglobuliny
Kyselina vanilmandlová (VMA), katecholaminy a metanefriny - 6.1.3. Markery vyšetřované z moče
Kyselina 5-hydroxyindoloctová (5-HIAA - 6.1.4. Markery vyšetřované ze stolice
Hemoglobin ve stolici
- 6.1.1. Markery vyšetřované z krve
- 6.2. Tkáňové a buněčné markery
- 6.2.1. DNA ploidie
- 6.2.2. Cirkulující buněčné elementy
Cirkulující nádorové buňky
Cirkulující endotelové buňky (CEC) a cirkulující endoteliální prekursory (EPC)
- 6.1. Solubilní nádorové markery
Přílohy
Tabulka 1 Solubilní nádorové markery vhodné pro monitorování průběhu choroby a účinnosti terapie
Tabulka 2 Frekvence vyšetřování NM
Tabulka 3 Zvýšené hladiny nádorových markerů u nemaligních onemocnění
Tabulka 4 Pozitivita nádorových markerů u benigních onemocnění
Tabulka 5 Biologický poločas nádorových markerů v cirkulaci
Tabulka 6 Požadavky na kvalitu při validaci metod, vnitřní a externí kontrole kvality dle NACB
Literatura
Pojmy
analytická nejistota (pro lékaře) - nejistota výsledku měření představuje interval, v němž se nachází skutečný výsledek měření s deklarovanou měrou pravděpodobnosti
IQC - vnitřní kontrola kvality
epitop - vazebné místo protilátky
lead time - čas, který uplyne od první měřitelné elevace nádorového markeru do doby detekce návratu choroby pomocí zobrazovacích nebo jiných diagnostických technik
MEN - mnohočetné endokrinní neoplasie
rebaselining - paralelní analýza stejného vzorku pacienta předchozí a novou technologií za účelem zjištění korelace výsledků na klinickém materiálu
grading - stupeň diferenciace nádoru
staging choroby - určení stadia choroby
prognóza choroby - předpověď chování choroby u konkrétního pacienta
predikce efektu terapie - předpověď pravděpodobné odezvy pacienta na konkrétní léčbu
ROC křivka - rozhodovací operační křivka udávající vztah mezi sensitivitou a specificitou vyšetření
sensitivita - správná pozitivita u jedinců s chorobou
specificita - správná negativita u jedinců zdravých
1. Biologická povaha nádorových markerů
Nádorovým markerem rozumíme substanci přítomnou v nádoru nebo produkovanou nádorem nebo hostitelem jako odpověď na přítomnost tumoru. Tuto substanci lze využít k diferenciaci nádoru od normální tkáně, nebo uvažovat o přítomnosti tumoru na základě analýzy tělesných tekutin. Substanci lze měřit kvalitativně nebo kvantitativně metodami chemickými, imunologickými nebo metodami molekulární biologie. Mezi markery produkované tumorem patří enzymy (např. LD, NSE, PSA, thymidinkináza - TK), imunoglobuliny nebo jejich fragmenty či podjednotky (monoklonální imunoglobuliny, tzv. “paraproteiny”), hormony (např. hCG, PTH, ACTH, kalcitonin, gastrin, prolaktin, norepinefrin, epinefrin), fragmenty komplexních glykoproteinů, (např. CA19-9, CA15-3, CA125), fragmenty cytokeratinů (TPA, TPS, CYFRA21-1), onkofetální antigeny (AFP, CEA), molekuly receptorové povahy (estrogenový a progesteronový receptor, receptor pro interleukin 2, HER2/neu a EGF, cirkulující buněčné elementy (cirkulující nádorové buňky, cirkulující endotelové buňky a cirkulující endotelové prekursory) a cirkulující fragmenty nukleových kyselin (zejména DNA a miRNA). Mezi přirozené funkční proteiny reagující zvýšením koncentrace v některém tělesném biologickém materiálu patří v séru/plazmě feritin, nebo C-reaktivní protein (vzdáleně do této kategorie patří i jev sedimentace erytrocytů) a hemoglobin ve stolici. Mimo obvyklé aplikace klasických (solubilních) nádorových markerů se zdají být jako nádorové markery klinicky užitečné i některé genetické abnormality, a to především pro specifikaci abnormality nádorových buněk určující způsob léčby. Jde jednak o přímou detekci somatických mutací v DNA tumoru, proteinové produkty onkogenů (např. her2, c-myc, c-fos, k-ras, c-kit, braf, alk, src), změny v jejich posttranslačních modifikacích v maligní tkáni nebo o “nové” genetické změny v maligní buňce (např. chromosomální rearrangement bcr-abl) nebo detekci velkých mutací v tumor supresorových genech (BRCA1, BRCA2, p53).
2. Preanalytické aspekty
V současnosti se většina používaných solubilních nádorových markerů stanovuje v séru. Jde obvykle o štěpy velkých molekulárních komplexů, a proto nevykazují nádorové markery příliš velkou preanalytickou variabilitu. Pro správnou interpretaci změn v hladinách markerů, zejména při dlouhodobém sledování nemocných s nádorovými chorobami, je třeba vyloučit možné rušivé faktory, které by mohly stanovení ovlivnit už ve fázi preanalytické. V určitých případech mohou být výsledky analýzy ovlivněny některými postupy klinického vyšetřování; např. pro stanovení prostatického specifického antigenu (PSA) má být krev odebrána nejdříve 48 hod po rektálním vyšetření prostaty. Jeho hladinu může ovlivnit i jakákoliv manipulace s prostatou včetně jízdy na kole nebo sexuální aktivity. Kontaminace vzorku slinami nebo potem může znehodnotit stanovení antigenu skvamózních buněk (SCCA) nebo CA 19-9. Neuron-specifická enoláza (NSE) je při hemolýze významně uvolňována z erytrocytů, oddělení séra od krevních elementů je třeba provést nejpozději do 1 hod po odběru. Hemolýza nad 300 mg/l falešně zvyšuje výsledek stanovení NSE a LD.
Příprava tkání k analýze tkáňových nádorových markerů se řídí standardními operačními postupy spádové bioptické laboratoře. Nádorovou tkáň určenou k vyšetření je třeba co nejrychleji doručit do laboratoře, aby se minimalizovala autolýza do okamžiku fixace materiálu. DNA pro účely vyšetření genetických markerů se izoluje dostupnými soupravami certifikovanými pro in vitro diagnostiku.
3. Vlastní laboratorní analýza
Měření hladiny nádorového markeru je třeba provádět pomocí technologie určené k in vitro diagnostice, kalibrované dle pokynů dodavatele technologie. Metodika musí být v souladu s Nařízením vlády č. 453/2004 Sb. ze dne 7. července 2004 v platném znění, kterým se stanoví technické požadavky na diagnostické zdravotnické prostředky in vitro a pravidelně sledována vnitřní kontrolou kvality. Pracoviště by mělo rámcově plnit požadavky normy ISO15189, tj. minimálně disponovat příslušně kvalifikovaným personálem znalým problematiky a pravidelně se účastnit procesu externího hodnocení kvality. K vyšetření koncentrace nádorových markerů jsou obvykle používány metody imunoanalýzy, případně se měří enzymové aktivity (LD, TK).
Potřeba dlouhodobého sledování pacienta se zhoubným onemocněním vyžaduje, aby se technologie stanovení pro daný marker konjunkturálně neměnila. Z tohoto důvodu by měla být laboratoř schopna zajistit dlouhodobě výsledek o pokud možno stejné analytické nejistotě a vysoké reprodukovatelnosti. Pokud je změnu technologie měření nutné v praxi realizovat, je třeba nejprve provést srovnávací sérii měření na dostatečném množství konkrétních pacientských vzorků pomocí obou souprav, aby laboratoř získala data o chování nové soupravy v konkrétních podmínkách (tzv. rebaselining). Po změření těchto dat je laboratoř archivuje dle svých zvyklostí a postupů. Vede-li změna analytické metody ke změně hodnoty cut-off, pak je třeba ji s účinností od konkrétního data implementovat do praxe a informovat indikující lékaře. Situaci nelze řešit tak, že laboratoř začne používat metodu novou, kterou „koriguje“ numerickým koeficientem (faktorem) na hodnoty metody předchozí.
Analýza tkáňových nádorových markerů a DNA se řídí standardními operačními postupy příslušné histologické a genetické laboratoře.
4. Zdroje interference
Níže popsané analytické chyby mohou způsobit jak falešné snížení, tak falešné zvýšení stanovené hladiny analytu.
K obvyklým typům analytických interferencí patří:
- a) zkřížená reaktivita strukturálně podobných molekul
Jde o inherentní vlastnost imunologických metod, které prakticky nikdy nedocílí naprosté specifity protilátky vzhledem k zachycované analyzované molekule. Molekuly nejčastěji užívaných nádorových markerů jsou velmi odlišné, proto se tato interference vyskytuje pouze výjimečně. Používáním monoklonálních protilátek je toto riziko výrazně sníženo. Je odpovědností výrobce IVD imunoanalytické metody, aby informoval uživatele o zdrojích možné interference v příbalovém letáku soupravy. Na druhé straně si musí být uživatelé jisti, že se s možností zkřížené reaktivity u soupravy seznámili.
- b) hook efekt způsobený vysokou koncentrací markeru (high-dose hook effect)
Jde o stav, kdy velmi vysoká koncentrace analytu překročí vazebnou schopnost pevné tj. imunoafinitní fáze. Výrobce soupravy by měl s tímto typem interference počítat a jasně definovat lineární dynamický rozsah měření dané soupravy, resp. technologie. Tento problém se vyskytuje pouze u jednokrokových metod, u dvoukrokových metod je tento problém řešen vloženým promytím. Laboratoře by měly mít k dispozici protokol, jenž řeší možnost výskytu tohoto jevu, periodicky provádět sledování linearity měření, a tak přezkoumávat na vlastních klinických vzorcích horní mez stanovitelnosti analytu. Typickým příkladem možnosti výskytu tohoto jevu je vysoká hladina hCG u choriokarcinomu.
- c) přenos analyzovaného markeru mezi vzorky, tzv. carry-over
Jde o „technologický“ jev daný nedokonalým očištěním pipetovacích systémů analytické technologie aktuálně analyzovaného vzorku od zbytků vzorku předchozího s vysokou koncentrací analytu. Současné moderní imunoanalytické systémy již tento problém mají většinou účinně vyřešen, obvykle užitím zvláštních pipetovacích špiček pro každý vzorek. U manuálních metod, např. destičkových ELISA je třeba věnovat dostatečnou pozornost pečlivosti pipetování (kontaminace špiček, apod.)
- d) interference heterofilních a lidských anti-myších protilátek (HAMA)
Lidské heterofilní protilátky jsou endogenní imunoglobuliny, jež reagují s druhově odlišnými imunoglobuliny (myšími nebo králičími) jak in vivo, tak in vitro. Tradiční Paul-Bunnelova reakce je právě založena na aglutinaci nespecifického antigenu králičího původu (Forsmanův antigen) sérem pacienta v akutní fázi infekční mononukleózy obsahujícím právě tyto „heterofilní“ protilátky. Většinou se objevují u patologickch stavů spojených s polyklonální aktivací imunitního systému, typicky primoinfekce EB virem, nebo u procesů spojených s autoimunitou, kde typickým příkladem je revmatoidní faktor. Lidské anti-myší protilátky jsou imunoglobuliny, které specificky reagují s epitopy myších imunoglobulinů a mohou se v tělních tekutinách objevit zejména jako důsledek reakce organismu na myší bílkoviny, podané např. za účelem diagnostiky nebo terapie (humanizované protilátky např. bevacizumab, trastuzumab) nebo předchozí imunizace pacienta stykem s hlodavci. Mechanismus interference heterofilů nebo HAMA protilátek spočívá buď v přemostění vazebného místa pro ligand, kdy se protilátka chová jako pozitivní interferent, v blokaci primární nebo sekundární protilátky (obvykle negativní interference), nebo v přednostním vychytání antigenu před jeho vazbou na primární protilátku navázanou na pevnou fázi. Je primárně odpovědností výrobce analytického systému řešit tento typ interference, nicméně v praxi k němu může poměrně často docházet. Nejjednodušším postupem ověření klinickému stavu neodpovídající naměřené hodnoty je stanovení téhož analytu, nejlépe z téhož vzorku (zkumavky, alikvotu) jinou imunoanalytickou technologií, jelikož pravděpodobnost výskytu téhož interferujícího jevu s rozdílnými protilátkami použitými jiným výrobcem je velmi malá. Pokud laboratoř nemá takovou možnost k dispozici, lze provést ředění vzorku v sérii alespoň čtyř měření – není-li výsledek měření lineární, jde pravděpodobně o interferenci. Další postupy, jak ověřit přítomnost heterofilů nebo HAMA protilátek existují (precipitace imunoglobulinů nebo jejich extrakce pomocí imunoafinitních kolon, sorpce pomocí proteinů A, G, apod.), jejich provedení je ale většinou nad rámec činnosti klinických laboratoří, a tak je vhodnější se obrátit na specializovaná pracoviště.
5. Interpretace
Vzhledem k širokému spektru nádorových onemocnění neexistuje univerzální nádorový marker. Obdobně senzitivita (správný záchyt nemocných) při dostatečné specificitě (správná negativita u lidí bez nádorového onemocnění) nedosahuje ideálních 100 %. Nezvýšená koncentrace nádorového markeru není tedy ještě průkazem nepřítomnosti maligního onemocnění, naopak pozitivní výsledek nemusí nutně znamenat přítomnost zhoubného nádoru. Vztah senzitivity a specificity markerů vyjadřuje ROC křivka (Receiver Operating Characteristics). Senzitivita se nejčastěji udává jako hodnota při 95% specificitě.
Při interpretaci vyšetření solubilních nádorových markerů v klinické praxi se řídíme následujícími pravidly:
Screening - vzhledem k poměrně nízké diagnostické senzitivitě a specificitě není většina nádorových markerů vhodná k tomuto účelu u asymptomatických vyšetřovaných. Problematiku zavedení screeningu karcinomu prostaty u mužů nad 50 let řeší dlouhodobě nejen odborné společnosti, ale i zdravotní pojišťovny, zatím bez dosažení názorové shody. Screening kolorektálního karcinomu pomocí vyšetření okultního krvácení, tj. pomocí volného hemoglobinu přítomného ve stolici, se v současnosti doporučuje, avšak za použití vyspělejších a spolehlivějších imunologických souprav. Tyto soupravy jsou jednak certikované pro IVD a jednak řeší komfort a možnou kontaminaci při práci s biologickým vzorkem. Mamografický screening karcinomu prsu a cytologický screening karcinomu čípku děložního patří mezi významné nástroje záchytu onemocnění v časném stádiu, ale jeho provádění nesouvisí s vyšetřováním solubilních biologických markerů a není tedy součástí tohoto doporučení. U symptomatických nemocných nebo u skupin pacientů s vysokým rizikem vývoje nádorového onemocnění lze použít vyšetření některých nádorových markerů ke screeningu choroby. Jako příklad lze uvést screeningové vyšetřování kalcitoninu v rodinách s výskytem medulárního karcinomu štítné žlázy, nebo vyšetření CA 15-3 spolu se zobrazovacími metodami, dnes nejlépe MRI, v rodinách s mutacemi v genech BRCA1 a BRCA2.
Primární diagnostika - podobně jako pro screening onemocnění nejsou existující nádorové markery často vhodné ani pro primární diagnostiku z důvodů analogických. Výjimky jsou podezření na germinální nádory (hCG), chorioepiteliom, nádory testes nebo diferenciální diagnostika jaterních lézí, vč. lézí ložiskových (AFP).
Diferenciální diagnostika - V zahraničí je často diskutována otázka využití kombinace CEA, NSE a cytokeratinů pro diferenciální diagnostiku karcinomů plic a u neuroendokrinních nádorů využití chromograninu A.
Staging - tímto pojmem rozumíme posouzení anatomického rozsahu onemocnění. U některých markerů např. CA 125, CA 19-9 korelace mezi závažností onemocnění a jeho výší neexistuje. Naopak vysoká hodnota nádorového markeru v séru může někdy upozornit na nesprávně určené nižší stadium choroby (např. susp. generalizace u hodnot PSA >100 µg/l).
Prognóza - určení prognózy onemocnění není podstatnou rolí solubilních nádorových markerů. Značný význam má AFP a hCG u germinálních tumorů, určitý význam má hodnota CEA u kolorektálních karcinomů, případně beta2mikroglobulin u myelomu.
Sledování průběhu choroby - je hlavní indikací těchto vyšetření. Vzestup hladin nádorových markerů představuje včasné upozornění, které předchází klinickou diagnózu návratu (rekurence) choroby, tzv. “lead time”.
Účinek terapie - Sledování účinku terapie pomocí nádorových markerů je významnou indikací vyšetření solubilních nádorových markerů (Tabulka 1). Vzhledem k různým biologickým poločasům jednotlivých markerů je nutno správně volit intervaly odběrů krve k vyšetření tak, aby se skutečně postihl efekt terapie, nikoli pouze tzv. “lysis fenomén”, tj. prudké zvýšení koncentrace markeru jako důsledek cytolýzy po bezprostředním působení protinádorové terapie.
Tab. 1. Solubilní nádorové markery vhodné pro monitorování průběhu choroby a účinnosti terapie 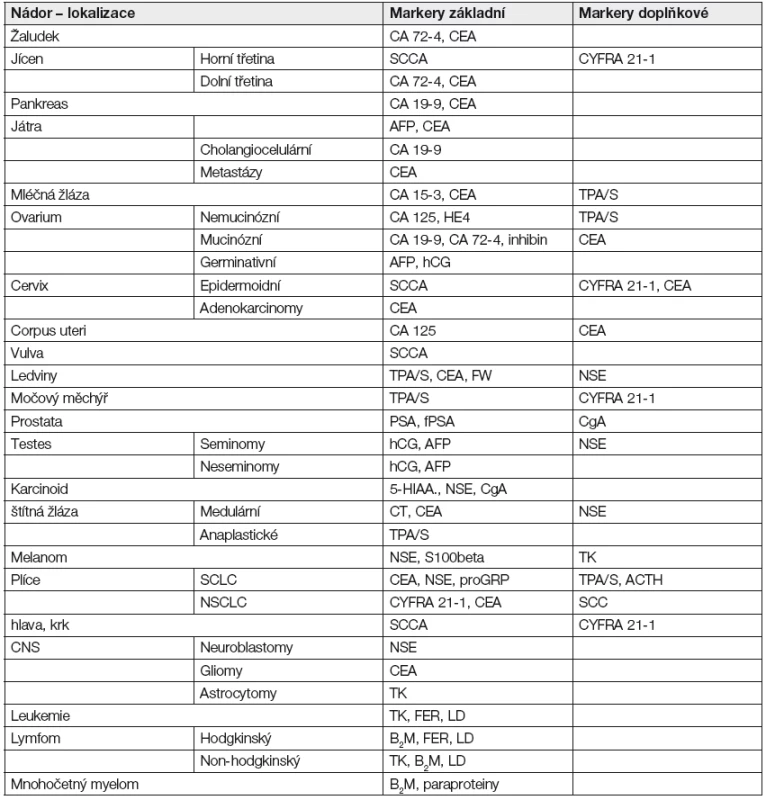
Frekvence vyšetření - Pro frekvenci vyšetřování platí kritéria doporučená WHO a podle zkušeností kliniků i statistiků hodnotících dynamiku změn nádorových markerů ve vztahu ke klinickému průběhu choroby je třeba dodržovat doporučenou frekvenci vyšetření. Je vhodné vyšetřit hladinu tumorových markerů před chirurgickým výkonem, aby bylo možné posoudit radikalitu výkonu při měření hladin markeru po výkonu. V průběhu primární terapie může onkolog zvolit monitoring odpovědi na léčbu pomocí vhodného solubilního nádorového markeru v intervalu kratším než jeden měsíc. Po ukončení první linie chemoterapie se obvykle doporučují tyto intervaly – intervaly dle klinických kontrol, tj. obvykle 1-2 měsíce v prvních 6 měsících po primární terapii, 2 měsíce ve druhé polovině roku, v první polovině následujícího roku každé 3 měsíce, po 1,5 roce a v dalších letech od primární terapie 1x za 6 měsíců. Koncentrace nádorového markeru má být dále vyšetřena: před nasazením terapie, po ukončení terapie (podle poločasu markeru, obvykle 3.-4. týden), při změně terapie, dále i při nejasném průběhu nemoci. Při nálezu zvýšené hodnoty se doporučuje v co nejkratší době provést opakování odběru kvůli potvrzení nálezu. Po potvrzení je vhodné zkrátit intervaly vyšetřování, aby se zjistil případný stoupající trend. Frekvence vyšetřování solubilních nádorových markerů je shrnuta v Tabulce 2.
Tab. 2. Frekvence vyšetřování nádorových markerů 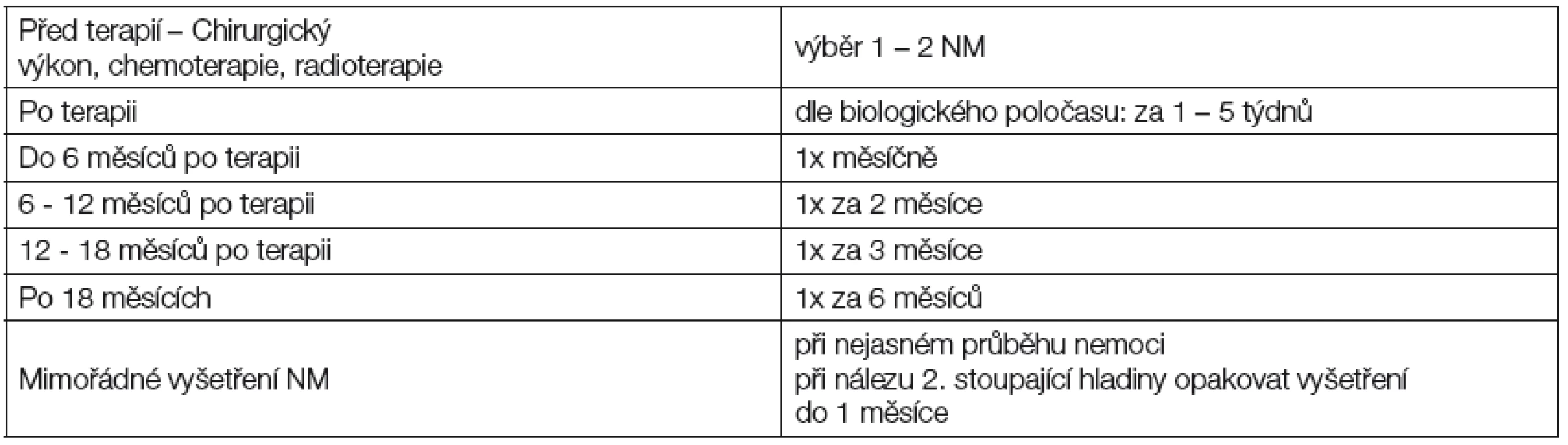
Pro sledování průběhu léčby a monitorování terapie se doporučuje využívat těch nádorových markerů, které daný typ nádoru produkuje (např. případ karcinomu prsu, který byl před zahájením léčby bez elevace CA15-3, ale se zvýšenými hladinami CEA, je vhodné sledovat pomocí tohoto markeru). Při restagingu onemocnění (např. vznik vzdálených metastáz) je vhodné stanovit hladiny markerů, které nebyly primárně zvýšeny, avšak jsou relevantní pro daný typ onemocnění. Při hodnocení vyšetření je třeba zvážit analytické interference a biologické faktory, které by mohly přispět k falešné pozitivitě výsledku (Tabulka 3 a 4). Jde především o zvýšené hladiny nádorových markerů v důsledku jejich produkce u nemaligních onemocnění, nebo při jejich poruchách (zejména při zhoršené funkci ledvin nebo jater, srdečním selhávání apod.). U takovýchto stavů je nutné zvážit, zda vůbec NM vyšetřovat.
Tab. 3. Zvýšené hladiny nádorových markerů u nemaligních onemocnění 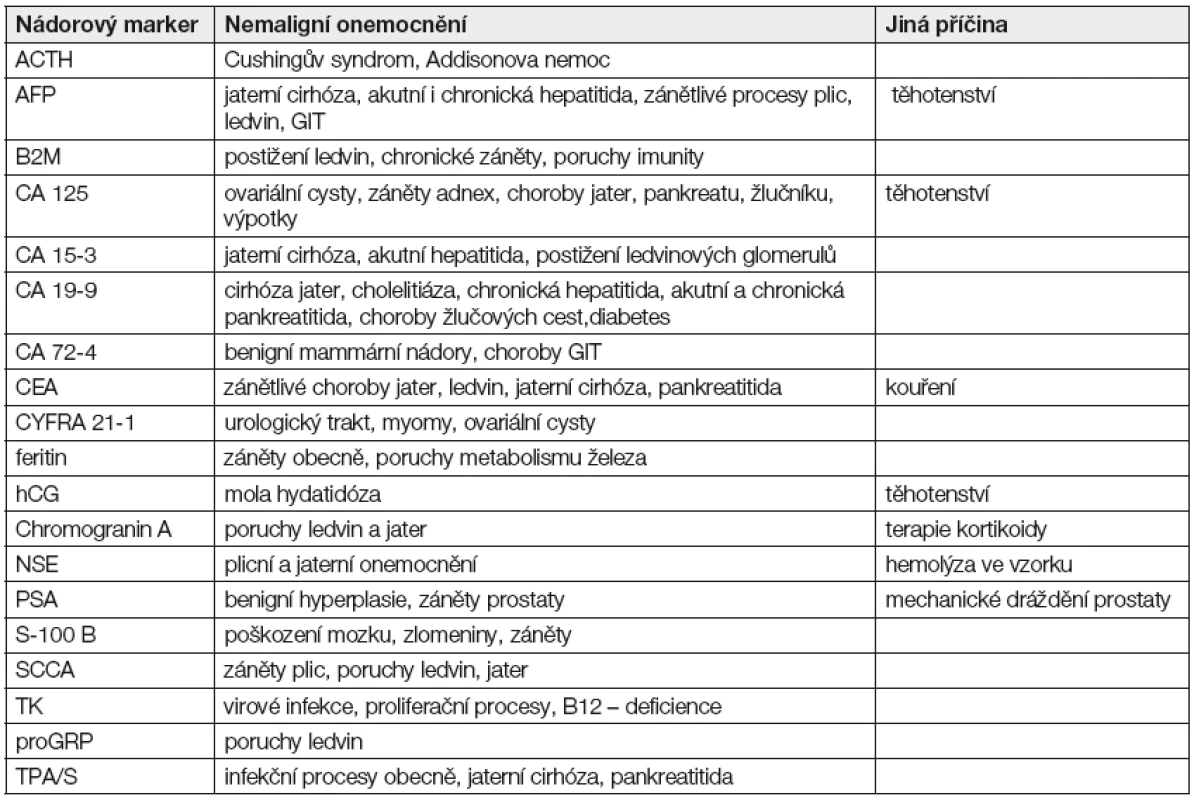
Tab. 4. Pozitivita nádorových markerů u benigních onemocnění 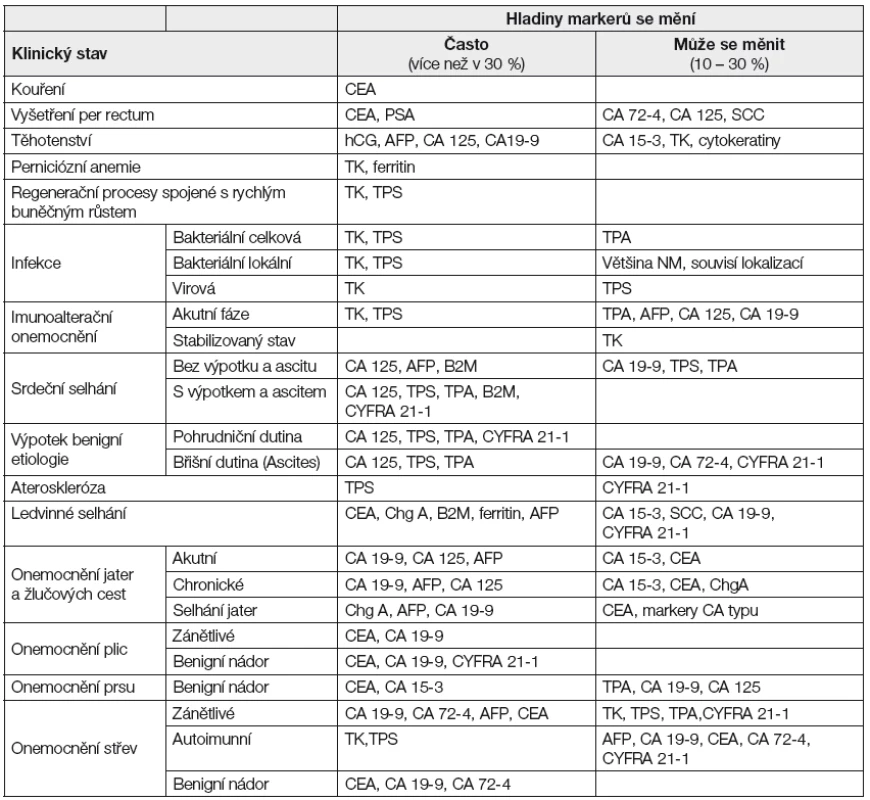
Při sledování dynamiky hladiny nádorových markerů (např. po chirurgickém odstranění tumoru) je nutné zvažovat také stabilitu markeru v cirkulaci (Tabulka 5).
Tab. 5. Biologický poločas nádorových markerů v cirkulaci 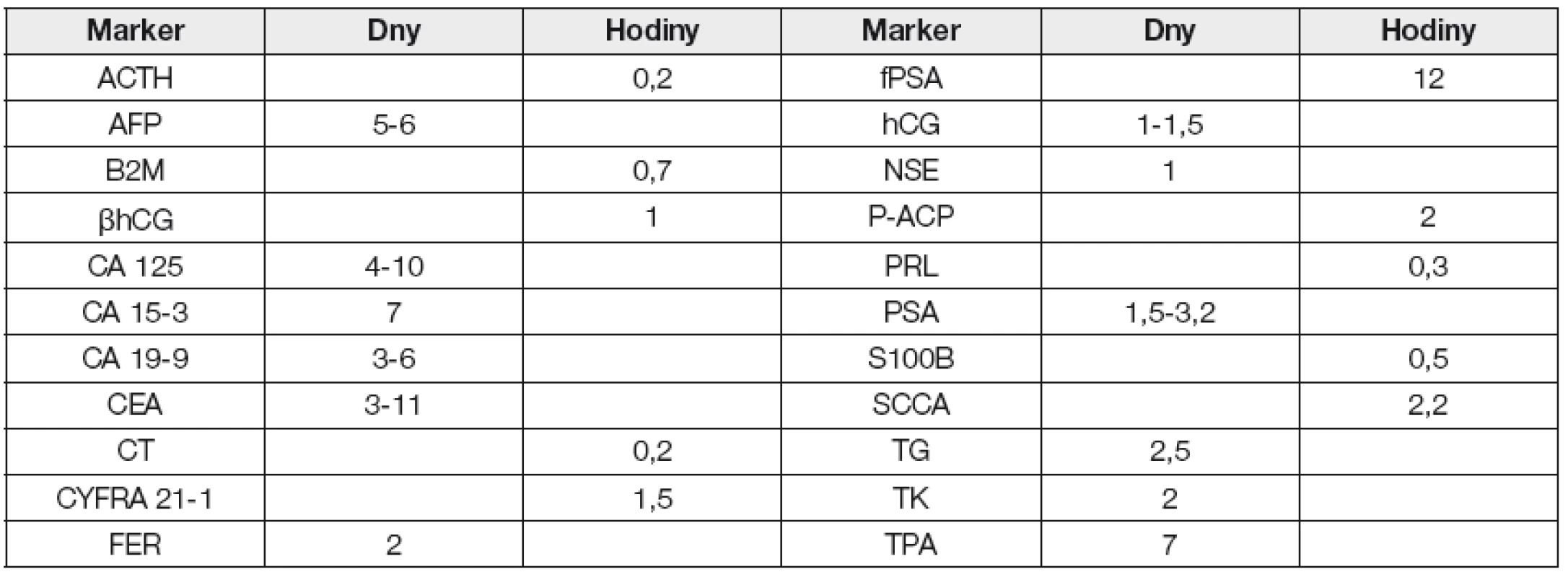
Jako signifikantní bývají posuzovány tyto změny hladin nádorových markerů: a) bez terapie (v klinické remisi): stoupající trend koncentrace ve třech následných odběrech i v hladinách do cut-off značí recidivu, resp. progresi, b) během terapie: nárůst o více než 25 % značí progresi onemocnění, pokles více než 50 % parciální remisi. Kompletní remise však nemůže být hodnocena pouze pomocí změn v hladinách markerů a je ji třeba vždy hodnotit s ohledem na výsledky přešetření zobrazovacími metodami.
Tab. 6. Požadavky na kvalitu při validaci metod, vnitřní a externí kontrole kvality dle NACB 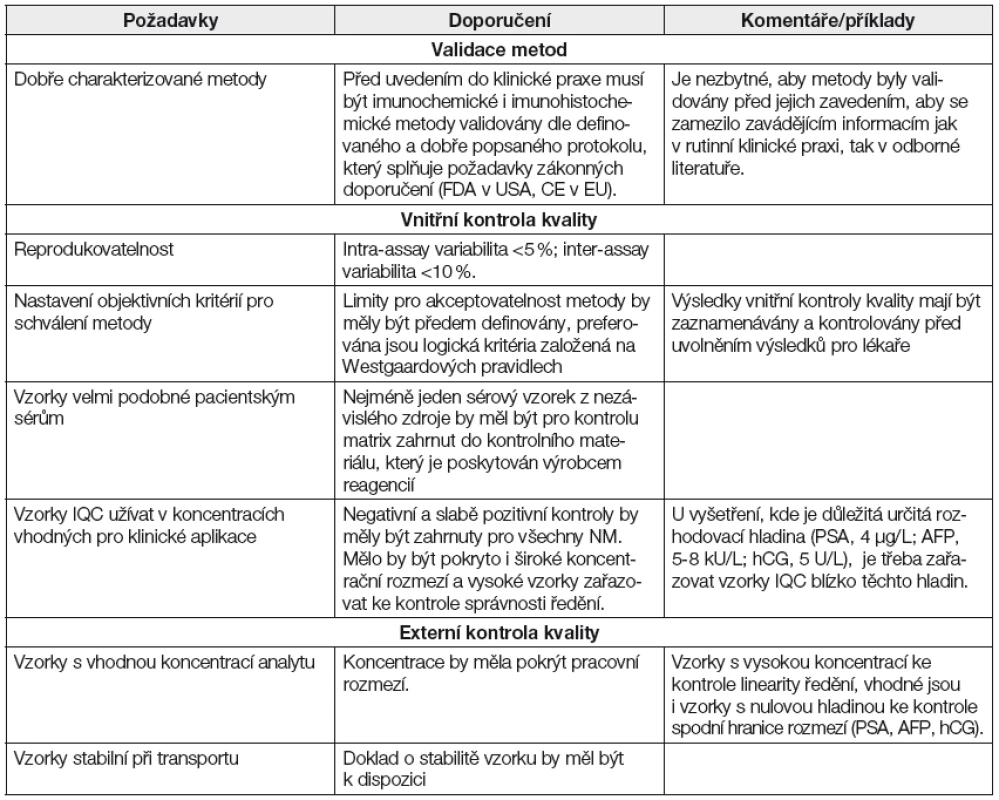
6. Charakteristika jednotlivých klinicky významných nádorových markerů a specifické doporučení k jejich používání v klinické praxi
Hodnoty cut-off obsažené v tomto doporučení jsou obvyklými hodnotami používanými klinicky pro detekci rekurence choroby; přes veškerou snahu o metodickou standardizaci se hodnoty cut-off mohou lišit dle užívané metodiky.
6.1. Solubilní nádorové markery
Pro vyšetření solubilních nádorových markerů se provádí zpravidla odběr krve, případně sběr moči či odběr vzorku stolice či mozkomíšního moku. V případě stanovení z krve je vyšetřovaným materiálem sérum nebo plazma, přičemž pokud není dále uvedeno jinak, jsou hladiny stanovených analytů v obou materiálech identické.
6.1.1. Markery vyšetřované z krve
CEA (karcinoembryonální antigen)
Jde o onkofetální glykoprotein s vysokým obsahem sacharidů o molekulové hmotnosti 180–200 kDa. Za fyziologických podmínek je CEA produkován ve vyvíjejícím se embryu. V dospělosti je omezeně syntetizován epiteliálními buňkami střevní sliznice, žaludku a bronchů. CEA patří do imunoglobulinové genové rodiny; podílí se pravděpodobně na procesu adheze a metastazování buněk.
Hodnocení: obvyklá hodnota cut-off je kolem 5,0 µg/l.
Doporučené použití pro klinické účely: Pro screening i diagnostiku maligního onemocnění nelze CEA použít. CEA produkují karcinomy zažívacího traktu, plic (adenokarcinomy), mléčné žlázy, nádory ženských pohlavních orgánů (mucinózní adenokarcinomy), endometriální nádory i nádory děložního těla, karcinomy močového měchýře, ledvin, diferencované karcinomy prostaty a testikulární teratomy. Předoperační hodnoty CEA > 40 µg/l jsou charakteristické pro kratší interval bezpříznakového přežití nemocných s karcinomem mléčné žlázy. Na základě předoperačních hodnot lze posoudit možnost radikálního zásahu u kolorektálního karcinomu. Monitorování průběhu onemocnění a odpovědi na léčbu patří k základním využitím CEA. Hodnoty vyšší než 10 µg/l znamenají obvykle progresi maligního procesu. Koncentrace vyšší než 50 µg/l svědčí s vysokou pravděpodobností o jaterních nebo kostních metastázách. Pro nádory zažívacího traktu se obvykle pohybuje senzitivita při návratu onemocnění pro kolorektální karcinom kolem 60 %, pro nádory žaludku asi 50 %. Pokles hodnot CEA po chirurgickém zákroku může poskytnout údaj o úspěšnosti terapie, podobně lze hodnotit efekt chemo - či radioterapie, pokud byly hodnoty před terapií zvýšené.
Zvýšení CEA v séru lze také pozorovat u benigních nebo premaligních lézí jako jsou jaterní cirhóza, Crohnova choroba, střevní polypy, onemocnění plic, ledvin, žlučníku, pankreatitida, benigní onemocnění prsu, dále u kuřáků a alkoholiků.
AFP (α-1-fetoprotein)
AFP je onkofetální glykoprotein, produkovaný v embryonálním žloutkovém vaku a ve fetálních játrech. V séru matky, kam přechází přes placentu, je důležitým ukazatelem fyziologického vývoje těhotenství. V dospělém zdravém organismu je syntéza AFP omezena na minimum. Významná je především jeho role transportní (vazba steroidů, některých těžkých kovů, bilirubinu, mastných kyselin, retinoidů, drog, antibiotik apod.).
Hodnocení: obvyklá hodnota cut-off je kolem 10 µg/l.
Doporučené použití pro klinické účely: Screening maligního procesu pomocí AFP v séru je vhodný pouze u symptomatických nemocných s jaterní cirhózou nebo podezřením na germinativní nádory varlat (nesestouplé varle, nádory testes u sourozence – dvojčete). Monitorování průběhu onemocnění patří k základním využitím AFP. Pro hepatocelulární karcinom je AFP markerem první volby (senzitivita u neléčeného onemocnění je až 80 %) Tento karcinom je také jediným nádorem, kde je možné stanovit diagnózu bez bioptické verifikace – pokud je nalezen typický obraz pomocí zobrazovacích metod současně s vysokou hladinou AFP. U germinálních nádorů ovariálních i testikulárních je senzitivita rovněž vysoká: pro čisté embryonální nádory a u nádorů žloutkového vaku dosahuje hodnot až 80 %, u teratomů pouze 20 %, obvykle chybí v seminomech a choriokarcinomech. Exprese AFP u nádorů zažívacího traktu je pozorována asi u jedné pětiny nemocných.
Nemaligními příčinami zvýšené hladiny AFP v séru většinou bývají akutní virová i chronická hepatitida, cirhóza jater a těhotenství.
hCG (lidský choriový gonadotropin)
Jde o glykoprotein tvořený dvěma rozdílnými podjednotkami: α (14,5 kDa) a β (22,2 kDa). In vivo může docházet k disociaci jednotek α a β, β-složka může být dále štěpena na močový gonadotropinový peptid (β-core fragment).
Hodnocení: obvyklá hodnota cut-off je kolem 10 IU/l.
Doporučené použití pro klinické účely: V závislosti na použitém detekčním systému je stanovení specifické pro celkový β-hCG (tj. intaktní hormon-dimer + volná podjednotka β), pro intaktní hCG (dimer bez volné podjednotky β), pro volnou podjednotku β nebo pro β-core fragment (stanovení v moči). Screening maligního procesu pomocí hCG v séru lze provádět u symptomatických osob, např. při podezření na germinální nádory varlat s retencí varlat v anamnéze. Stanovení má význam pro zhodnocení stadia onemocnění, pro potvrzení histologické charakterizace nádorů testes a choriokarcinomů a pro jejich monitorování. Senzitivita pro neseminomy je asi 50 %, pro seminomy 10–20 %, pro choriokarcinomy téměř 100 %, pro další lokalizace nádorů (pankreas, GIT, plíce, mléčná žláza, ledviny, močový měchýř) je do 20 %.
Zvýšené hladiny hCG v séru mohou způsobovat fyziologické i patologické stavy v těhotenství, myomy a ovariální cysty.
CA 19-9
Vyskytuje se jako glykolipid ve tkáni nebo mucin v séru. Obsahuje determinanty lidské krevní skupiny sialyl-Lewis (a). Kolem 5-10 % populace tento antigen netvoří.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/l.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy maligního onemocnění není vhodný, a to ani pro nádory pankreatu, kde dosahuje tento marker vysoké senzitivity (až 70-90 %) i výrazně vysokých hodnot v séru (až 106 kU/l). Exponenciální nárůst koncentrací v séru (nad 104 kU/l) je obvykle známkou vzdálených metastáz. Vysokou senzitivitu dosahuje tento marker i podle závažnosti onemocnění zvláště u karcinomů pankreatu, dále u nádorů kolorekta (18-58 %), u cholangiocelulárních karcinomů (22-49 %), u nádorů žlučových cest (55-79 %) a žaludku (25-60 %). Koncentrace CA 19-9 korelují dobře s efektem terapie. Mucinózní karcinomy ovaria mohou taktéž produkovat CA 19-9.
Značně zvýšené hladiny CA19-9 v séru působí cholestáza, ale i benigní a zánětlivá onemocnění žaludku, střeva, pankreatu a jater.
CA 15-3
Jde o antigen polymorfního epiteliálního mucinu PEM neboli MUC1. V dospělosti je syntetizován v epiteliálních buňkách vývodů mléčné žlázy, slinných žláz a bronchů. Alternativou stanovení CA 15-3 je stanovení antigenu CA 27.29, což je odlišný epitop téhož epiteliálního mucinu.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/l.
Doporučené použití pro klinické účely: Stanovení nelze použít pro screening nemocných s karcinomem prsu a stanovení této diagnózy vyjma vybrané skupiny pacientů a jejich rodin z indikace genetika. Koncentrace CA 15-3 korelují se stadiem onemocnění. Hlavní využití CA15-3 je v monitorování nemocných s karcinomem prsu. Při 90 % specificitě dosahuje senzitivita u neléčených nemocných pouze 20-40 %, u metastazujících nádorů až 80 %. Relaps onemocnění bývá charakterizován senzitivitou CA 15-3 dosahující 60-90 %. Jeho „lead time“ umožňuje předpovědět návrat onemocnění s předstihem několika měsíců před některými zobrazovacími metodami. Dynamika změn po terapii obvykle koreluje s terapeutickým efektem.
Nemaligní onemocnění, zvyšující hladinu CA 15-3 v séru zahrnují benigní onemocnění prsu, benigní onemocnění trávicího ústrojí, jaterní cirhózu, akutní a chronickou hepatitidu, chronickou renální insuficienci, chronickou bronchitidu či pneumonie.
CA 125
Jde o heterogenní glykoprotein s vysokým obsahem sacharidů. Je produkován fetálními epiteliálními tkáněmi coelomového původu. V dospělém věku může být omezeně syntetizován v normálním epitelu tkáně vejcovodů, bronchů, endometria, cervixu, ale i v mezotelu pleury, perikardu a peritonea.
Hodnocení: obvyklá hodnota cut-off je kolem 35 kU/l.
Doporučené použití pro klinické účely: CA 125 je exprimován u 80 % karcinomů ovarií serózního (nemucinózního) typu. Senzitivita v dalších gynekologických nádorech je nižší. Produkce CA125 u karcinomů mléčné žlázy, pankreatu, plic, žlučových cest reflektuje obvykle postižení pleury a peritonea. Zvýšená hladina CA 125 byla prokázána u hepatocelulárního karcinomu. Vyšetření hladiny CA125 za účelem screeningu karcinomu ovarií je prováděn pouze v případě rodinné predispozice. Stanovení CA 125 je vhodné pro potvrzení stadia choroby. Nárůst koncentrace CA 125 může předcházet klinickou diagnózu o 1–8 měsíců. Po odstranění primárního tumoru klesá koncentrace CA 125 o 75–90 % během prvního týdne, do 2–3 týdnů se hodnoty normalizují. Přetrvávající vysoké hodnoty mohou být indikací k „second look“ operaci.
Zvýšené hladiny CA 125 v séru způsobené nemaligním onemocněním obvykle zahrnuje jakékoli dráždění serózních blan, dále chronická onemocnění jater, peritonitidu, benigní onemocnění ovarií a endometria, leiomyom nebo selhání ledvin.
HE4 (Human Epididymal Protein 4)
Je produkován ve vysokých koncentracích u pacien-tek s karcinomem vaječníků. HE4 vykazuje vysokou senzitivitu v časných (st. I/II) stádiích onemocnění.
Hodnocení: obvyklá hodnota cut-off je 50 pmol/l pro premenopauzální ženy a kolem 80 pmol/l pro postmenopauzální ženy.
Doporučené použití pro klinické účely: Až třetina žen s maligním nádorem, u nichž není zvýšena hladina CA 125 má zvýšenou koncentraci HE4, a to především u endometroidních a serózních karcinomů ovária. Je–li tento marker použit samostatně k detekci nádorů vaječníků, vykazuje nejvyšší senzitivitu (při vysoké specificitě) ze všech známých biomarkerů ovariálního karcinomu, při použití v kombinaci s ostatními markery (zejména CA 125) se senzitivita panelu zvyšuje. Nárůst hodnot HE4 lze využít také ke sledování průběhu choroby u pacientek s ovariálním karcinomem, její progrese a sledování účinnosti terapie, resp. návratu onemocnění.
PSA (prostatický specifický antigen), fPSA (volná frakce PSA)
PSA je serinová proteináza umožňující zkapalnění seminální tekutiny, čímž usnadňuje pohyb spermií. PSA má enzymovou aktivitu chymotrypsinu. V séru je PSA inaktivován vazbou na α1-antichymotrypsin, méně na α2-makroglobulin. Určitý podíl PSA v séru se vyskytuje ve volné podobě.
Hodnocení: cut-off se mění v závislosti na věku – do 50 let = 2,5 µg/l, do 60 let = 3,5 µg/l, do 70 let = 4,5 µg/l, starší = 6,5 µg/l. Pro odlišení malignity a benigní hyperplazie prostaty při hodnotách celkového PSA 4-20 µg/l se stanovuje poměr mezi fPSA a PSA. Frakce fPSA/PSA bývá u maligního nádoru 0-15 %, hraniční hodnoty jsou 15-20 %, u benigního onemocnění nad 20 %.
Doporučené použití pro klinické účely: Význam screeningu karcinomu prostaty pomocí sérového PSA u asymptomatických mužů je diskutabilní, lze jej provádět u starších mužů se symptomy poruch močových cest, ev. s rodinnou zátěží. Pro odlišení benigní hyperplasie od karcinomu se stanovuje poměr volného a celkového PSA (u benigních hyperplasií je vyšší - nad 20). Zvýšení PSA o více než 0,75 µg/l ročně ve třech po sobě jdoucích vyšetřeních znamená 90% pravděpodobnost karcinomu prostaty. Hladiny PSA nad 30 µg/l mohou signalizovat i vzdálenější metastázy. Přetrvávající zvýšené koncentrace v séru po radikální prostatektomii znamenají buď přítomnost zbytkové choroby či lokální návrat. Monitorování má význam rovněž při terapii - pokles PSA obvykle koreluje s délkou přežití.
Příčinou zvýšené hladiny PSA v séru bývá též předchozí digitální rektální vyšetření prostaty, předchozí biopsie prostaty, transuretrální resekce nebo jiné mechanické dráždění prostaty. Z nemaligních onemocnění je zvýšení pozorováno u hyperplasie prostaty nebo prostatitidy.
CA 72-4
Antigen CA 72-4 (Tumor-asociovaný antigen, TAG 72) je definovaný jako epitop mucinu reagující se dvěma monoklonálními protilátkami. Fyziologicky je produkován v žaludku, jícnu a pankreatu vyvíjejícího se plodu.
Hodnocení: obvyklá hodnota cut-off je kolem 7,0 kU/l.
Doporučené použití pro klinické účely: CA 72-4 se používá pro monitorování maligních nádorů horního GIT a mucinového typu ovariálního karcinomu. CA 72-4 je nevhodný pro screening a stanovení diagnózy maligního procesu horního GIT. Jeho hladina koreluje s přítomností vzdálených metastáz. Užívá se k monitorování průběhu onemocnění především u karcinomu žaludku. Příčiny zvýšení CA72-4 v séru u nemaligních chorob obvykle zahrnují jaterní cirhózu, akutní pankreatitidu, chronickou bronchitidu, vředovou chorobu žaludku a zánětlivá onemocnění GIT.
S-100 beta
Vyskytuje se jako homo - nebo heterodimer tvořený z podjednotek α a β. S-100 beta protein byl poprvé popsán v centrálním nervovém systému. V nervové tkáni (v gliálních a Schwanových buňkách) se nachází především S-100 β-β dimer. Složení (α–α) mají např. příčně pruhované svaly.
Hodnocení: obvyklá hodnota cut-off je kolem 0,1 µg/l.
Doporučené použití pro klinické účely: Melanomy jsou charakteristické obsahem β–podjednotky tohoto proteinu. Přítomnost této formy S-100 beta v séru svědčí pro jeho invazivitu. V dysplastických névech je naopak prokazována především α–podjednotka. Pro screening a diagnostiku se neužívá, je vhodný pro monitorování nemocných s maligním melanomem. U metastatického onemocnění bývají přítomny vysoké koncentrace tohoto markeru, rovněž senzitivita při metastatickém procesu je až 80 %. Koncentrace měřené před primární terapií mají vysokou prognostickou hodnotu. Pozitivní hodnoty lze nalézt i u mozkových maligních nádorů ektodermálního původu. Zvýšené hladiny S-100 beta v séru mohou být způsobeny i akutním poškozením mozku, kostními zlomeninami, zánětlivým a infekčním onemocněním.
NSE (neuron-specifická enoláza)
Jde o izoenzym enolázy (2-fosfo-D-glycerát hydrolyáza, EC 4.2.1.11), který katalyzuje přeměnu 2-fosfoglycerátu na fosfoenolpyruvát. Fyziologicky jej produkuje nervová a plicní tkáň plodu, v dospělosti je jeho výskyt v normálním stavu vázán především na neurony.
Hodnocení: obvyklá hodnota cut-off je kolem 15 µg/l.
Doporučené použití pro klinické účely: Vzhledem k obsahu NSE v červených krvinkách a destičkách je třeba provést oddělení krevních elementů do jedné hodiny od odběru. NSE není vhodná pro screening a stanovení diagnózy maligního procesu. Pro pacienty s neuroblastomy a malobuněčným karcinomem plic (SCLC) má stanovení NSE prognostický význam. Zvýšené hodnoty NSE u neléčených nemocných se SCLC se mohou vyskytovat až u 80 % případů. Monitorování průběhu onemocnění je vhodné především u SCLC, neuroblastomů, meduloblastomů, retinoblastomů, dále „apudomů“ (starší termín pro skupinu karcinoidů, feochromocytomů), u nádorů ledvin, ev. i u seminomů, melanomu a prostaty. Nejvyšší hodnoty bývají popisovány u dobře diferencovaných ganglioneuroblastomů a ganglioneuromů. Senzitivita při rozsevu onemocnění u SCLC bývá až 80 %.
Příčiny zvýšení NSE v séru nemaligních lézí zahrnují plicní onemocnění nebo jaterní choroby.
SCCA (antigen skvamózních buněk)
je definován jako složka směsného antigenu TA-4, prokázaném v séru u pacientek s karcinomem čípku děložního. Byly identifikovány dva homologní proteiny SCC1 a SCC2. Tyto antigeny byly charakterizovány jako serin proteinázové inhibitory, tzv. serpiny. Marker je výrazně citlivý na kontaminaci slinami nebo potem během preanalytické fáze.
Hodnocení: obvyklá hodnota cut-off je kolem 1,5 µg/l.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy se neužívá. Vysoké hodnoty u neléčených nemocných s karcinomem cervixu jsou prognosticky významné pro odhad dalšího vývoje onemocnění. Monitorování průběhu onemocnění pomocí SCCA se provádí především u pacientů s nádory orofaciální oblasti, epidermoidních nádorů plic, děložního čípku, těla dělohy, endometria, vulvy a vaginy.
Příčiny zvýšení SCCA v séru u nemaligních lézí zahrnují nemaligní gynekologická a plicní onemocnění, kožní nebo jaterní choroby.
CYFRA 21-1 (fragment cytokeratinu 19)
Jde o solubilní fragment cytokeratinu 19. Předpokládá se, že jeho výskyt v séru nemocných s maligními nádory může souviset se smrtí buňky apoptózou či nekrózou. Vzhledem ke specifickému výskytu tohoto cytokeratinu v epiteliálních buňkách skvamózního (epidermoidního) typu má CYFRA 21-1 vyšší orgánovou specificitu než ostatní cytokeratinové markery TPA nebo TPS.
Hodnocení: obvyklá hodnota cut-off je kolem 3,3 µg/l.
Doporučené použití pro klinické účely: Pro screening a stanovení diagnózy maligního procesu nelze toto vyšetření použít. Jeho hladina obvykle koreluje se stadiem onemocnění. Monitorování průběhu onemocnění a především monitorování úspěšnosti terapie je hlavní oblastí využití tohoto markeru. Senzitivita u epidermoidních karcinomů plic se pohybuje kolem 55 %, u velkobuněčných karcinomů a adenokarcinomů plic je nižší (35 a 28 %). Význam má rovněž pro sledování nemocných s karcinomem močového měchýře (senzitivita asi 30 %) a epidermoidních nádorů cervixu (spolu s SCCA) a nádorů oblasti hlavy a krku.
Příčin zvýšení hladiny CYFRA 21-1 z nemaligních příčin je celá řada a zahrnují jaterní cirhózu, chronické onemocnění ledvin, astma bronchiale, infekce respiračního traktu a další.
TPA, TPS (tkáňový polypeptidový /specifický/ antigen)
TPA je polypeptid ze solubilních fragmentů cytokeratinů typu středních filament (cytokeratin 8, 18, a 19). Antigen s velice podobnou charakteristikou, definovaný na podkladě reaktivity s jinou monoklonální protilátkou byl nazván TPS (tkáňový polypeptidový specifický antigen odpovídající cytokeratinu 18).
Hodnocení:
obvyklá hodnota cut-off TPS je kolem 140 U/l
obvyklá hodnota cut-off TPA je kolem 75 U/l
Doporučené použití pro klinické účely: Jde o velmi nespecifické nádorové markery, jejichž užití v klinické praxi poslední dobou klesá. TPA/S měl být „univerzálním“ nádorovým markerem vhodným především pro monitorování a hodnocení účinnosti terapie. Je markerem s nejvyšší senzitivitou pro sledování nemocných s karcinomem močového měchýře. Vyšetření tohoto markeru nelze použít pro screening, diagnózu a staging onemocnění. Lze jej případně využít pro monitorování nemocných s nádory prsu, plic, GIT a ledvin. Dynamika jeho změn při terapii je obvykle rychlejší než u markerů diferenciačního typu.
Nespecificky je TPA/S v séru zvýšen při některých onemocněních jater (cirhóza, hepatitida), rovněž tak u infekčních onemocnění.
TK (thymidinkináza)
TK patří k enzymům syntézy DNA, charakteristickým pro proliferující tkáň.
Jde o ATP: thymidin-5-fosfotransferázu (EC 2.7.1.21), která existuje v eukaryotických buňkách ve dvou izoenzymech: TK1 (fetální TK) a TK2 („dospělá“ TK). Fetální izoenzym je vázán na proces buněčného dělení a je lokalizován v cytoplasmě. Izoenzym TK2 je naopak přítomen v mitochondriích a jeho aktivita je stabilní v průběhu celého buněčného cyklu. TK katalyzuje přeměnu thymidinu na thymidinmonofosfát, čímž je umožněna syntéza DNA náhradní cestou. Za fyzio-logických podmínek je TK intenzivně syntetizována především v játrech během vývoje plodu, po porodu se syntéza zpomaluje. V séru převažuje fetální forma (95 % z celkového množství).
Hodnocení: obvyklá hodnota cut-off je kolem 9 U/l.
Doporučené použití pro klinické účely: Jde o biomarker proliferace. Některá cytostatika blokují základní („de novo“) syntézu DNA (methotrexát, 5-fluorouracil); následně je stimulována aktivita enzymů náhradní cesty a TK vykazuje falešnou pozitivitu. Vyšetření je třeba provádět před nasazením uvedené chemoterapie.
Pro screening a stanovení diagnózy nelze stanovení TK použít. U hematologických malignit (především u akutní leukemie nebo nehodgkinských lymfomů) koreluje aktivita TK se závažností onemocnění. Monitorování průběhu onemocnění a úspěšnosti terapie je hlavní oblastí využití tohoto markeru. Zvýšení sérové TK bývá pozorováno rovněž u maligního melanomu, nádorů štítné žlázy, případně dalších solidních nádorů.
Zvýšení hladiny TK v séru z nemaligních příčin zahrnuje respirační viroinfekty s lymfocytární aktivací, zánětlivá onemocnění plic a trávicího ústrojí, infekce EB virem, cytomegaloviry nebo herpesviry a revmatická a obecně autoimunitní onemocnění.
CgA (Chromogranin A)
Chromogranin je kyselý glykoprotein vyskytující se v sekrečních granulích normálních i neoplastických neuroendokrinních tkáních. Vhodnějším materiálem k vyšetření CgA je plazma, hodnoty v séru se mohou lišit od hodnot měřených v plazmě. Zároveň je poměrně velký rozdíl mezi hodnotami získanými soupravami rozdílných výrobců. Z tohoto důvodu je pro účely sledování pacienta pomocí CgA zásadní použití jednoho typu vyšetřovaného materiálu a soupravy.
Hodnocení:
obvyklá hodnota cut-off pro plazmu je kolem 35 µg/l
obvyklá hodnota cut-off pro sérum je 98,1 µg/l
Doporučené použití pro klinické účely: CgA vykazuje nejvyšší senzitivitu u nemocných s neuroendokrinními malignitami při srovnání s dosud užívanými metodami stanovení NSE nebo 5-hydroxyindoloctové kyseliny v moči. Senzitivita průkazu návratu choroby pro karcinoidy se pohybuje kolem 70-90 %. CgA vykazuje korelaci se změnami odpovídajícími vývoji onemocnění (progrese, stabilizace, kompletní remise). Cirkulující CgA byl prokázán i u sporadických gastroenteropankreatických neuroendokrinních tumorů i u dědičných mnohočetných endokrinních neoplasií typu 1 (MEN), u dětských neuroblastomů i u neuroendokrinní diferenciace karcinomu prostaty nereagujících na hormonální léčbu.
Zvýšené hladiny chromograninu A v séru či plasmě najdeme při terapii kortikoidy, poruchách ledvin a jater.
P1NP (N-terminální propeptid prokolagenu typu 1)
Prokolagen typu 1 je syntetizován fibroblasty a osteoklasty a je složen z N-terminálních a C-terminálních propeptidů. Při konverzi prokolagenu na kolagen jsou tyto propeptidy štěpeny specifickými proteázami a následně jsou začleněny do matrix kostí. Stanovení P1NP je využíváno při léčbě osteoporózy a diagnostice kostního rozsevu solidních tumorů a mnohočetného myelomu.
Hodnocení: obvyklá hodnota cut-off pro maligní kostní lézi je u mužů do 65 µg/l, u žen do 74 µg/l.
Doporučené použití pro klinické účely: P1NP (prokolagen typu 1 N terminální propeptid) spolu s β–CTX (β-CrossLaps, C-terminální telopeptid), jsou doporučovány v diagnostice kostního rozsevu i hodnocení efektu terapie u různých solidních tumorů, nejčastěji karcinomu prostaty, zejména v terapii bisfosfonáty. Je vhodným markerem jak pro monitorování anabolické terapie (teriparitid, stroncium ranelát), tak také pro antiresorpční terapii (bisfosfonáty, kalcitonin, HRT ). V prvním případě by úspěšná léčba měla být doprovázena 40% a vyšším zvýšením hladin P1NP oproti výchozí hodnotě u sledovaného pacienta. Naopak v případě antiresorpční léčby by mělo dojít k více než 40% poklesu hodnot oproti bazální hladině P1NP (IOF – International Osteoporosis Foundation, doporučuje tento analyt pro monitorování antiresorpční léčby). Doporučený interval monitoringu je 6 měsíců.
ICTP (C – Telopeptid kolagenu typu I )
ICTP je koncová, nehelikální část kolagenu typu I. Jde o části peptidových řetězců, spojených pomocí vazeb (cross-links). Vylučuje se ledvinami, jejichž zhoršená funkce (filtrace pod 50 ml/min) ovlivňuje sérovou koncentraci ICTP.
Hodnocení: obvyklá hodnota cut-off je kolem 5,3 µg/l.
Doporučené použití pro klinické účely: Senzitivita tohoto markeru pro osteolytické metastázy se pohybuje mezi 70 – 80 % při 90% specificitě vyšetření. U metastáz karcinomu prostaty bývá udávána senzitivita ICTP o něco nižší (převažující typ kostních metastáz je osteo-plastický, tedy převažuje novotvorba kosti). Z nemaligních procesů je ICTP zvýšen u revmatoidní artritidy, při imobilizaci pacienta a onemocnění ledvin. Doporučený interval monitoringu je 6 měsíců.
B2M (β2-mikroglobulin)
B2M tvoří extracelulární doménu lidského leukocytárního antigenu HLA I. třídy. Je přítomen téměř ve všech buňkách kromě erytrocytů a trofoblastických buněk.
Hodnocení: obvyklá hodnota cut-off je kolem 2,4 mg/l.
Doporučené použití pro klinické účely: Stanovení nelze použít pro screening a diagnostiku maligního onemocnění. B2M je zvýšen u systémového onemocnění B-lymfocytárního systému, u mnohočetného myelomu, chronické lymfocytární leukemie a nehodgkinských lymfomů B-lymfocytárního původu. K určitému zvýšení B2M v případě rozsevu onemocnění dochází i u solidních karcinomů.
Zvýšené hladiny B2M v séru se vyskytují zejména u poruch funkce ledvin a chronických zánětlivých autoimunitních onemocnění.
Feritin
Jde o protein podílející se na regulaci homeostázy železa. Za fyziologických podmínek je feritin produkován retikuloendoteliálními buňkami sleziny, jater a kostní dřeně.
Hodnocení: cut-off pro premenopauzální ženy je 150 µg/l, pro muže a postmenopauzální ženy je 400 µg/l.
Doporučené použití pro klinické účely: Jeho význam jako nádorového markeru v poslední době klesá. Koncentrace feritinu v séru jsou závislé na věku a pohlaví. Snížení hladiny feritinu ukazuje na anémii z nedostatku železa. U hematologických malignit koreluje obvykle jeho hladina se závažností onemocnění a stanovení feritinu se využívá pro monitorování průběhu onemocnění a především monitorování terapie. Feritin je zvýšen především u akutní myeloblastické leukemie, hodgkinského i nehodgkinského lymfomu a mnohočetného myelomu, nespecifické zvýšení provází nádory mammy, maligní melanomy a testikulární nádory.
Nemaligními příčinami zvýšení hladiny feritinu v séru jsou zejména akutní onemocnění nebo poruchy metabolismu železa (hemochromatóza nebo předávkování železem), nespecifické jaterní léze.
LD (laktátdehydrogenáza)
Jde o enzym tvořený dvěma rozličnými polypeptidovými řetězci, které formují 5 izoenzymů. Na zvýšení LD u maligních onemocnění se podílí zejména izoenzym 1 a 2, u solidních nádorů i ostatní izoenzymy.
Hodnocení: není jednotná hladina cut-off; nález je informativní při posouzení změny katalytické koncentrace LD mezi dvěma časově odlišenými odběry. U dětí je hodnota LD vyšší. Laboratořím se doporučuje používat jako cut-off hodnotu horní meze jejich vlastního referenčního intervalu. V průběhu některých maligních chorob je možné pozorovat enormní zvýšení katalytické koncentrace LD.
Doporučené použití pro klinické účely: je vhodným doplňkovým markerem zejména pro monitorování nemocných s diferencovanými lymfocytárními i histiocytárními typy nehodgkinských lymfomů, leukémií, ale i solidních nádorů (testikulárních a jiných).
Kalcitonin
Je produkován za normálních okolností C-buňkami (tj. parafolikulárními buňkami) štítné žlázy. Kalcitonin je odštěpen z velkého prekurzorového proteinu prokalcitoninu před sekrecí do extracelulárního prostředí. Stimulem pro sekreci je hyperkalcémie.
Hodnocení: obvyklá hodnota cut-off je pro ženy 17 ng/l, pro muže 26 ng/l
Doporučené použití pro klinické účely: Diagnosticky se stanovení kalcitoninu používá zejména u nádorů C-buněk štítné žlázy, tzn. při medulárním karcinomu štítné žlázy, včetně výskytu tohoto tumoru v rámci MEN syndromu. Stanovení kalcitoninu se rovněž využívá při pentagastrinovém testu, kdy osoby s medulárním karcinomem tyreoidey mají po aplikaci pentagastrinu větší vzestup kalcitoninu než osoby zdravé.
TG (tyreoglobulin)
Tyreoglobulin je glykosylovaný a jodovaný protein, který je velmi silným autoantigenem. Je tvořen 2 identickými podjednotkami. Tyreoglobulin se užívá především jako nádorový marker po odstranění štítné žlázy při sledování terapie u dobře diferencovaných nádorů štítné žlázy.
Ke stanovení Tg je doporučeno užívat pouze metody, které jsou kalibrovány na mezinárodní standard CRM - 457.
Hodnocení: obvyklá hodnota cut-off v závislosti na použité metodě je kolem 40 µg/l.
Doporučené použití pro klinické účely: Patologicky zvýšené hladiny TG jsou charakteristické pro různé maligní onemocnění štítné žlázy, především dobře diferencovaný folikulární a papilární karcinom. Při vyšetření tyreoglobulinu je vhodné zároveň stanovit i anti-TG protilátky, které mohou interferovat při stanovení. Indikací k vyšetření je také přítomnost plicních a kostních metastáz z nejasného zdroje a existence patologických zlomenin – v těchto případech jsou hodnoty výrazně zvýšené. Stanovení TG se doporučuje pro sledování pacientů po odstranění štítné žlázy pro karcinom.
Zvýšené hladiny TG v séru nalezneme u Graves-Basedowovy choroby, eufunkční nodózní strumy, v graviditě a u zánětů štítné žlázy.
ProGRP (Pro-Gastrin-Releasing Peptid)
Je prekurzorem GRP (Gastrin-Releasing Peptide). GRP je neuropeptid produkovaný CNS a neuroendokrinními tkáněmi gatrointestinálního a dýchacího traktu a prostaty, jeho exprese je popsána u SCLC. Fyziologickou funkcí GRP je stimulace sekrece tkáňových hormonů (např. gastrin, somatostatin aj.) a účast v homeostatických mechanismech (regulace tělesné teploty, vazodilatace v respirační soustavě aj.) GRP má malou stabilitu (poločas 2 minuty) pro praktické použití k detekci SCLC se hodí jeho prekurzor – ProGRP.
Hodnocení: obvyklá hodnota u benigních onemocnění: 2 – 60 pg/ml, u NSCLC a ostatní tumorů do 100 pg/ml (s výjimkou pacientů s poruchou funkce ledvin), u SCLC při normální funkci ledvin: > 100 pg/ml.
Doporučené použití pro klinické účely: ProGRP má význam v diferenciální diagnostice malobuněčných a nemalobuněčných karcinomů plic. Pro SCLC má vysokou specificitu a senzitivitu (47-86 %). Exprese ProGRP u SCLC není závislá na stádiu onemocnění a stoupá již v jeho časných fázích, takže stanovení tohoto markeru má význam pro časnou detekci tumoru u rizikových pacientů. Další využití ProGRP je ve sledování průběhu choroby, účinnosti terapie a odhalení recidivy.
Tumor M2-PK (IPK, nádorový izoenzym pyruvátkinázy)
Izoenzym pyruvátkinázy (Tumor M2-PK) patří mezi klíčové enzymy glykolýzy (E.C.2.7.1.40). Nádorový izoenzym existuje jako homodimer na rozdíl od nemaligních forem, které tvoří homotetramery. Pro stanovení je nutno použít EDTA nebo citrátovou plasmu z důvodu možného uvolnění tohoto izoenzymu z lymfocytů.
Hodnocení: obvyklá hodnota cut-off je kolem 30 kU/l.
Doporučené použití pro klinické účely: Jde o relativně nový marker, je o něm poměrně málo dat v literatuře. O použití tohoto markeru lze uvažovat u těch lokalizací onemocnění, kde nejsou jiné vhodné solubilní markery k dispozici. Tumor M2-pyruvátkináza byla prokázána u nemocných s karcinomem varlat, ledvin, plic, prsu, pankreatu a tlustého střeva. Příčiny zvýšené hladiny Tumor M2-PK v séru zahrnují zánětlivá onemocnění, virové infekce nebo poruchy ledvin.
Inhibin
Jde o heterodimerický glykoprotein, který je složen z A-podjednotky a jedné ze dvou možných R-podjednotek, (3A nebo 3B, spojených disulfidickým můstkem). V tělních tekutinách u člověka se vyskytují volné A-podjednotky. Syntéza a sekrece dimerického inhibinu A a B je omezena na reprodukční systém (ovaria, testes a fetoplacentární jednotka. Sérový inhibin je ovariální hormon, který se podílí na regulaci fertility a jeho hladina se po menopauze snižuje na nedetekovatelnou hladinu.
Hodnocení: obvyklá hodnota cut-off je kolem 0,25 U/ml
Doporučené použití pro klinické účely: Inhibin A je považován za vhodný nádorový marker pro sledování mucinózních a granulomatózních ovariálních karcinomů, kde je jeho senzitivita až 100%. Zvýšené hodnoty inhibinu lze zjistit i u většiny benigních nádorů vaječníků, serózních i jiných ovariálních nádorů. U neovariálních nádorů pak hladina inhibinu není zvýšená nad 0,25 U/ml. Hladina inhibinu se po chirurgickém zákroku snižuje k normálu do 8 dnů.
ACTH a ACTH-like substance
Kortikotropní hormon (ACTH, adrenokortikotropin), je jednoduchý polypeptid o 39 aminokyselinách. Sekvence prvních 24 aminokyselin je dostačující pro biologickou aktivitu hormonu. ACTH je syntetizován v bazofilních buňkách přední hypofýzy. Pro toto stanovení je vzhledem k cirkadiánnímu rytmu třeba provést odběr ráno mezi 06 : 00-10 : 00 hodinou do předchlazené (ale nenamražené!) zkumavky s EDTA (jako na pro krevní obraz), zkumavka se bezprostředně stočí v chlazené centrifuze. Získaná plazma se oddělí a zamrazí, v tomto stavu ji lze odeslat k analýze.
Hodnocení: referenční rozmezí je obvykle 10-60 ng/l; jde o fyziologicky se vyskytující hormon, není proto definována hodnota cut-off pro návrat choroby.
Doporučené použití pro klinické účely: Stanovení plazmatického ACTH je užitečné při studiích abnormalit osy hypotalamus-hypofýza-nadledviny, a to jak při odhalování příčiny nadměrné produkce kortizolu (Cushingův syndrom), tak i jeho nedostatečné sekrece (např. Addisonova nemoc). Stanovení může být použito rovněž při výskytu neuroendokrinních nádorů, např. u malobuněčného plicního karcinomu, kde se často podílí na paraneoplastických jevech.
6.1.2 Markery vyšetřované z krve i z moče
Monoklonální imunoglobuliny
Tyto abnormální imunoglobuliny, používá se i starší termín „paraproteiny“, jsou produkovány proliferujícím klonem plazmatických buněk, případně B-lymfoidních buněk. Volné lehké řetězce přecházejí do moče glomerulární filtrací jako tzv. Bence-Jonesova bílkovina, jež byla historicky prvním objeveným solubilním nádorovým markerem.
Hodnocení: Screening a kvantifikace monoklonálních imunoglobulinů se provádí pomocí elektroforézy sérových bílkovin. Typ nově zachyceného monoklonál-ního proteinu se určuje pomocí imunofixace; identifikuje se těžký řetězec (IgG, IgA, IgM, specializované laboratoře IgD příp. IgE) a typ lehkého řetězce (kappa či lambda). Monoklonální proteiny se mohou vyskytovat ve formě celých imunoglobulinů, lehkých řetězců či méně často těžkých řetězců. Kvantifikaci paraproteinu a jeho typ laboratoř poskytuje lékaři spolu se slovní interpretací nálezu. Za výrazné zvýšení či snížení hladiny monoklonálního proteinu se považuje změna o více než 10 g/l. Změna do 5 g/l se považuje za nevýznamnou.
Doporučené použití pro klinické účely: Stanovení monoklonálního imunoglobulinu je hlavní indikací elektroforézy sérových bílkovin. Příčinami výskytu monoklonálních proteinů v séru či moči jsou mnohočetný myelom (nejčastěji IgG a IgA), Waldenströmova makroglobulinémie (IgM, více než 30 g/l), jiná B-lymfoproliferace (některé lymfomy či chronická lymfocytární leukémie), amyloidóza, tzv. MGUS (monoclonal gammapathy of undetermined significance) zahrnující idiopatický benigní výskyt (zpravidla do 10 g/l, ve vyšším věku) či preneoplastický výskyt paraproteinů, maligní tumory (klonální produkce proteinů), lymfotropní virózy (poly až oligoklonální přechodná lymfoproliferace). Zvýšená bílkovina v moči při vyloučení jiných příčin je indikací k elektro-foréze moči. Při vyšetření moči na bílkovinu pomocí testačních proužků pracujících na principu tzv, “proteinové chyby“ indikátoru je třeba pamatovat na to, že výsledek může být falešně negativní v přítomnosti globulinů, tedy i jejich lehkých řetězců. Zvýšené hodnoty imunoglobulinů v séru při vyloučení jiných příčin jsou indikací k elektroforéze sérových bílkovin. Pro monitorování odpovědi na léčbu u myelomu nebo plazmocytomu se vyšetření séra a moče provádí každé 3 měsíce; po vymizení paraproteinu pak follow-up každých 6-12 měsíců, jeho nevymizení po léčbě ukazuje na reziduální chorobu. Záchyt monoklonálního imunoglobulinu v séru je vhodné doplnit vyšetřením moči a naopak a vyšetření opakovat v kontextu nálezu a klinického stavu. U pacientů mladších 50 let se doporučuje sledování dynamiky množství monoklonálního imunoglobulinu každé 3 měsíce, ve vyšším věku pak ročně. Opakovanou typizaci monoklonálního imunoglobulinu imunofixací se doporučuje provádět pouze při změně migrace paraproteinu při elektroforéze, nově zachyceného zvýšení sérového imunoglobulinu nebo znovu za 1 až 2 roky od původní typizace.
Kyselina vanilmandlová (VMA), katecholaminy a metanefriny
Vanilmandlová kyselina vzniká v organizmu při metabolizmu katecholaminů (adrenalinu, noradrenalinu). Katecholaminy jsou tvořeny dření nadledvin a uvolňují se do oběhu jako odpověď na fyzický či psychický stres. Katecholaminy jsou společným názvem pro dopamin, noradrenalin a adrenalin a jejich metabolity. Z chemického hlediska jde o alkylaminoderiváty o-dihydroxybenzenu (pyrokatecholu).
Zvýšené množství VMA v krevní plazmě či moči se vyskytuje u nádorů produkujících katecholaminy (neuroendokrinní nádory - feochromocytom, neuroblastom). Dnes je nahrazováno nejčastěji stanovením metanefrinů, které jsou v současné době považovány za nejlepší indikátor zvýšené neuroendokrinní aktivity.
Hodnocení: VMA - obvyklá hodnota cut-off je kolem 75 µmol/l. Hodnocení katecholaminů závisí na konkrétním analytu, metodě a analyzovaném materiálu; indikující lékař se řídí hodnotami laboratoře, kam odeslal materiál k vyšetření.
Doporučené použití pro klinické účely: při diagnostice a sledování úspěšnosti léčby hormonálně aktivních neuroektodermálních tumorů – u dětí s nálezem nádoru v břiše při podezření na neuroblastom a u osob s příznaky zvýšeného vylučování katecholaminů (záchvatovitě zvýšený tlak krve, bušení srdce, těžké bolesti hlavy, pocení) při podezření na feochromocytom.
Stanovení VMA se provádí v moči sbírané za 24 hodin. Dva dny před sběrem a v den sběru moče pacient nesmí jíst ovoce a zeleninu, výrobky z nich, kávu, čaj, výrobky s vanilkovým cukrem, čokoládu, některé léky (sulfonamidy, odvodňující léky, acetylsalicylovou kyselinu, methyldopu, jodové preparáty), vadí RTG ozařování.
Přesnější je přímé stanovení zvýšeného množství katecholaminů v krvi.
6.1.3. Markery vyšetřované z moče
Kyselina 5-hydroxyindoloctová (5-HIAA)
Je svalovým stimulantem, primárním metabolitem serotoninu, který je vylučován močí. Velké množství serotoninu může být produkováno karcinoidními tumory, které se mohou tvořit v zažívacím traktu na slepém střevě nebo na plicích.
Hodnocení: obvyklá hodnota do 50 µmol/24h
Doporučené použití pro klinické účely: Při sledování léčby karcinoidního tumoru (zde je markerem volby CgA) znamená snížení hladin 5-HIAA úspěšnost léčby. Nezměněné či zvyšující se hodnoty pak znamenají ne-úspěšnou léčbu. Ke stanovení se požívá vzorek moče z 24 hodinového sběru, 2 dny před sběrem a během sběru je třeba dodržovat dietu bez kofeinu, nikotinu, alkoholu, ovoce apod. Vliv má těhotenství, stres, deprese a řada léků (alfa-methyldopa, inhibitory MAO, antiparkinsonika, sulfonamidy, antibiotika, diuretika, salicyláty, benzodiazepiny, efedrin, paracetamol)
6.1.4. Markery vyšetřované ze stolice
Hemoglobin ve stolici
Hemoglobin je funkční bílkovina zajišťující transport kyslíku z plic do periferních tkání. Fyziologicky se vyskytuje ve formě tetrameru o dvou shodných proteinových podjednotkách alfa a beta s centrálně umístěnou molekulou hemu obsahující železo. Přítomnost hemoglobinu ve stolici je indikátor krvácení do střeva či konečníku a využívá se pro screening kolorektálního karcinomu. V současnosti se upouští od testů využívajících pseudoperoxidázové reakce hemu („hemokult“) pro jejich nízkou spolehlivost. Pro stanovení hemoglobinu se používají imunoanalytické metody detekující bílkovinnou složku hemoglobinu. Stanovení hemoglobinu se provádí v rámci screeningu kolorektálního karcinomu schváleného vyhláškou MZ ČR u asymptomatických osob nad 50 let.
Kritickým krokem při vyšetření hemoglobinu ve stolici je odběr vzorku prováděný pacientem a pro spolehlivost testu je zásadní, aby byl pacient podrobně poučen.
Hodnocení: obvyklá hodnota cut-off je 75 ng/ml
Doporučené použití pro klinické účely: Přítomnost globinové složky hemoglobinu ukazuje na možnou přítomnost karcinomu a dle citlivosti zvoleného přístupu může odhalit také prekancerózy; zvýšené hodnoty jsou indikací ke koloskopii. Představitel ČSKB při Komisi pro screening kolorektálního karcinomu při MZ ČR doporučuje jeden test kvantitativní metodou, která má zajištěnu externí kontrolu kvality. Zjištěná hladina hemoglobinu koreluje s rizikem nádorového onemocnění. Při pozitivním nálezu se doporučuje provedení kolonoskopie; bez odkladu v případě vysokých hodnot. U hraničního nálezu je možné laboratorní vyšetření zopakovat ve více vzorcích.
6.2. Tkáňové a buněčné markery
Za tkáňové a buněčné markery považujeme ty, které jsou vázány na vlastní neoplastickou tkáň, ať již v solidním tumoru nebo v cirkulujících maligních buňkách v případě hematoonkologických malignit. Tyto markery se využívají především pro diagnózu, často jsou prognostickým či prediktivním znakem.
V tomto doporučení se zabýváme pouze některými specifickými aspekty vyšetření tkáňových a buněčných markerů a to těmi, které nespadají do odbornosti histopatologie (např. vyšetření nádorové tkáně metodou imunohistochemie pro stanovení exprese povrchových a intracelulárních proteinů, metodou FISH pro stanovení početních změn genů, molekulárně genetickými metodami pro stanovení somatických mutací v maligních buňkách), cytologie (např. hodnocení stěru z čípku děložního, přítomnost maligních buněk v tělních tekutinách (např. moč, mozkomíšní mok, BAL apod.), hematologie (např. přítomnost maligních buněk v periferní krvi, kostní dřeni včetně minimální reziduální choroby apod.) či laboratorní genetiky (např. stanovení chromozomálních translokací).
6.2.1. DNA ploidie
U nádorových buněk je možné pozorovat odchylky od normálního počtu chromozomů. Aneuploidii je možné stanovit na základě cytometrického vyšetření obsahu DNA v nádorové tkáni. Takto je možné vyšetřovat čerstvou, zamraženou nebo parafínovanou tkáň. DNA se barví propidium iodidem a analyzuje na průtokovém cytometru.
Hodnocení: Hodnotí se zastoupení buněk v G1/G0 fázi (2n), v G2/M fázi (4n) a buněk syntetizujících DNA v S-fázi, které je ukazatelem rychlejšího růstu nádorové populace. V některých případech je možné zachytit klon nádorových buněk, který má aneuploidní počet chromozomů. Toto vyšetření slouží k doplnění nálezu patologa/histologa.
Doporučené použití pro klinické účely: Aneuploidie a tetraploidie koreluje s horší prognózou u karcinomu prostaty. Aneuploidie je také asociována s kratším přežitím u karcinomu střeva a mozkových nádorů. Diploidie je spojena s horší prognózou v případě neuroblastomu.
6.2.2 Cirkulující buněčné elementy
Cirkulující nádorové buňky
Maligní buňky cirkulují v periferní krvi pacientů se solidními nádory. Je možné je detekovat na základě přítomnosti nukleových kyselin; stanovení na základě průkazu DNA je vhodné především u nádorů se specifickými genetickými abnormalitami (detekce fúzních genů, mutace Ras, či p53) častěji se provádí stanovení na základě qrt-PCR mRNA, kdy je cílový transkript exprimován specificky v nádorových buňkách (gen pro CEA, AFP, tyrozinázu).
Hodnocení: Cirkulující nádorové buňky je možné detekovat metodami molekulární biologie a pomocí průtokové cytometrie, většinou na základě exprese povrchových znaků epiteliálních buněk nebo adhezivních molekul (EpCAM). Před tuto metodu je možné předřadit koncentrační krok založený na izolaci buněk pomocí paramagnetických částic.
Doporučené použití pro klinické účely: Jde o postupy nové, vhodné spíše pro specializovaná pracoviště. Množství nádorových buněk cirkulujících v periferní krvi se zdá být prognostickým faktorem a ukazatelem progrese a rozsahu onemocnění, především u melanomu, karcinomu prsu, prostaty a kolorekta.
Cirkulující endotelové buňky (CEC) a cirkulující endoteliální prekursory (EPC)
Nádorová angiogoneze/neovaskularizace umožňuje růst nádoru. Angiogenezi přímo v nádoru je možné stanovit na základě hodnocení denzity kapilár ve tkáni a na úrovni systémové je možné detekovat řadu aktivátorů např. VEGF, bFGF, IL-8, EGF nebo inhibitorů (angiostatin, endostatin, trombospondin) angiogeneze, které se do periferní krve uvolňují z nádoru. Aktivaci angiogeneze lze hodnotit na základě přítomnosti endoteliálních buněk v cirkulaci.
Hodnocení: Průtokovou cytometrií na základě exprese specifických povrchových markerů (CD146, CD31, VEGF-R2, CD105) je možné detekovat různé buněčné subsety včetně aktivovaných endoteliálních buněk, zralých endoteliálních buněk, a endoteliálních progenitorů odvozených z kostní dřeně.
Doporučené použití pro klinické účely: I když jde zatím spíše o metody vhodné pro specializovaná pracoviště, má hodnocení parametrů angiogeneze narůstající význam především díky novým protinádorovým terapeutikům – inhibitorům angiogeneze např. bevacizumab, sunitinib.
Datum: 1. 4. 2013
prof. MUDr. Tomáš Zima, DrSc., MBA
předseda ČSKB ČLS JEP
prof. MUDr. Jiří Vorlíček, CSc.
předseda ČOS ČLS JEP
prof. MUDr. Ondřej Topolčan, CSc.
předseda imunoanalytické sekce ČSNM ČLS JEP
Zdroje
1. Fateh-Moghadam, A., Stieber, P. Tumormarker und ihr sinnvoller Einsatz. J. Hartman Verlag GmbH, 1991.
2. Clamp, A., Danson, S., Nguyen, H., Cole, D., Clemons, M. Assessment of therapeutic response in patients with metastatic bone disease. Lancet Oncol, 2004, 5, p. 607-616.
3. Diamandis, E. P. et al. Tumor markers: physiology, pathobiology, technology and clinical application, Washington, AACC Press, 2002, p. 542.
4. International Germ Cell Cancer Collaborative Group (IGCCCG). International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin. Oncol., 1997, 15, p. 594-603.
5. Soletormos, G., Semjonow, A., Sibley, P. E. C., Lamerz, R., Petersen, P. H., Albrecht, W., Bialk, P., Gion, M., Junker, F., Schmid, H.-P. et al. Biological Variation of Total Prostate-Specific Antigen: A Survey of Published Estimates and Consequences for Clinical Practice. Clin. Chem., 2005, 51, p. 1342-1351.
6. Zima T. et al. Laboratorní diagnostika, 2. vydání, Galén, Karolinum Praha 2007, p. 379-389
7. Wu, J.T. Circulating tumor markers of new millenium: targer therapy, early detection and prognosis. Washington: AACC Press, 2002, 173.
8. Choi, J. S., Min, J. S. Significance of postoperative serum level of carcinoembryonic antigen (CEA) and actual half life of CEA in colorectal cancer patients. Yonsei Med. J., 1997, 38(1), p.1-7.
9. Yoshikawa, T., Takano, M., Kita, T., Kudoh, K., Sasaki, N., Kato, M., Watanabe, A., Miyamoto, M., Goto, T., Furuya, K. Normal serum CA125 half-life and normal serum nadir CA125 level in patients with ovarian cancers. Eur J Gynaecol. Oncol., 2012, 33(3), p. 269-73.
10. Murray, M. J., Nicholson, J. C. α-Fetoprotein. Arch. Dis. Child. Educ. Pract. Ed., 2011, 96(4), p.141-7. doi: 10.1136/adc.2011.213181. Epub 2011 May 25.
11. Yoshimasu, T., Maebeya, S., Suzuma, T., Bessho, T., Tanino, H., Arimoto, J., Sakurai, T., Naito, Y. Disappearance curves for tumor markers after resection of intrathoracic malignancies. Int. J Biol. Markers, 1999, 14(2), p. 99-105.
12. Brändle, E., Hautmann, O., Bachem, M., Kleinschmidt, K., Gottfried, H. W., Grünert, A., Hautmann, R. E. Serum half-life time determination of free and total prostate-specific antigen following radical prostatectomy - a critical assessment. Urology, 1999, 53(4), p. 722-30.
13. Ghanem, G., Loir, B., Morandini, R., Sales, F., Lienard, D., Eggermont, A., Lejeune, F., EORTC Melanoma Group. On the release and half-life of S100B protein in the peripheral blood of melanoma patients. Int J Cancer., 2001, 94(4), p. 586-90
14. Wolf, A. M. D, Wender, R. C., Etzioni, R. B., Thompson, I. M., D’Amico, A. V., Robert J. Volk R.J, Brooks D.D, Dash C, Guessous I, Andrews K, DeSantis C, Smith R.A: American Cancer Society Guideline for the Early Detection of Prostate Cancer Update 2010, CA CANCER J CLIN., 2010, 60, p. 70–98.
15. Sturgeon, C. M., Diamandis, E. P. Use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers. Laboratory medicine practice guidelines. 2009, The American Association for Clinical Chemistry
16. Kalfeřt, D., Ludvíková, M. Nádorové markery u dlaždicových karcinomů hlavy a krku. Onkologie, 2012, 6(5), www.onkologiecs.cz
17. Sturgeon, C. M., Diamandis, E. P. Use of tumor markers in liver, bladder, cervocal, and gastric cancers. Laboratory medicine practice guidelines. 2010, The American Association for Clinical Chemistry
18. Bidart, J. M., Thuillier, F., Augereau, C., Chalas, J., Daver, A., Jacob, N., Labrousse, F., Voitot, H. Kinetics of serum tumor marker concentrations and usefulness in clinical monitoring. Clin. Chem., 1999, 45(10), p. 1695-707.
19. http://www.cskb.cz/res/file/KBM-pdf/2011/2011-1/dop-thyreo.pdf
20. Plebani, M. HE4 Study Group. HE4 in gynecological cancers: report of a European investigators and experts meeting. Clin. Chem. Lab. Med., 2012, 50(12), p. 2127-36.
Doporučení bylo zpracováno s využitím projektové podpory:
1. Projekt velkých infrastruktur pro výzkum BBMRI_CZ, LM 2010004 zaměřeného na vytvoření sítě biobank pro onkologický výzkum v České republice
2. Projekt Regionální centrum aplikované molekulární onkologie, RECAMO CZ.1.05/2.1.00/03.0101
3. Institucionální podpora – Projekt dlouhodobého koncepčního rozvoje výzkumné organizace – MZ ČR RVO-VFN64165
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2014 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Možná úskalí při laboratorním vyšetřování pacienta s hematologickým onemocněním
- Možnost predikce závažnosti akutní pankreatitidy stanovením adipokinů (adiponektinu, FGF-21 a A-FABP) při přijetí
- Doporučení k využití nádorových markerů v klinické praxi
- Nová doporučení k diagnóze a klasifikaci chronických ledvinových onemocnění
- Odhad glomerulární filtrace u pacientů s diabetem
- Provádění všeobecného prenatálního screeningu vrozených vývojových vad
- prof. MUDr. Miroslav Engliš, DrSc.
-
eGFR a problémy interpretace rovnic CKD-EPI
Krátké sdělení - datové rozšíření a komentář k článku „Estimated glomerular filtration rate in diabetic patients“ autorů Šálek, T. a Ponížil, P.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení k využití nádorových markerů v klinické praxi
-
eGFR a problémy interpretace rovnic CKD-EPI
Krátké sdělení - datové rozšíření a komentář k článku „Estimated glomerular filtration rate in diabetic patients“ autorů Šálek, T. a Ponížil, P. - Možnost predikce závažnosti akutní pankreatitidy stanovením adipokinů (adiponektinu, FGF-21 a A-FABP) při přijetí
- Provádění všeobecného prenatálního screeningu vrozených vývojových vad
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



