-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Situace a trendy v zastoupení genotypů viru hepatitidy C v populaci injekčních uživatelů drog
Current Situation and Trends in the Hepatitis C Virus Genotype Distribution among Injecting Drug Users in the Czech Republic
Study objectives:
To map the current distribution of hepatitis C virus genotypes among injecting drug users (IDUs) in the Czech Republic and to compare the results with the previously reported data.Material and Methods:
Of 766 injecting drug users (IDUs) tested in the Remedis hepatology centre, Prague, in 2005 – 2007, 459 (60 %) were anti-HCV positive, with viral replication detected by PCR in 326 (71 %) of seropositives. PCR products from a randomly selected representative sample of 222 patients were analyzed by sequencing the NS5B region to determine HCV genotypes. Demographic and epidemiological data of the probands were collected by means of an interviewer-assisted questionnare survey.Results:
Of 222 study subjects, mostly long-term IDUs, including 154 (69 %) males, mean age of 27 years, 131 (61 %) reported opiates and 74 (35 %) metamphetamine as their favourite drugs. Genotypic analysis found genotype 1, the most common one, in 168 (75.5 %) subjects, with slight predominance of subtype 1a, detected in 90 (40.5 %) subjects, over subtype 1b, identified in 78 (35 %) subjects, while genotype 3 was revealed in 52 (23.5 %) IDUs and showed a significant increase in 2007 compared to 2006. The comparison with the control data obtained 5 years earlier showed a substantial rise in the prevalence of genotype 3, previously rare in Czech IDUs, and a significantly increased proportion of subtype 1a among genotype 1 strains. Other genotypes reported from other European countries remain rare in the Czech Republic.Conclusions:
Significant changes were found in the distribution and dynamics of HCV genotypes in the Czech Republic over the last years that are consistent with the changing route of HCV transmission in which injecting drug use currently plays the major role.Key words:
hepatitis C - IDU - HCV genotypes.
Autoři: L. Krekulová 1; V. Řehák 1; O. Strunecký 2; V. Němeček 2
Působiště autorů: Remedis, s. r. o., Praha 1; Národní referenční laboratoř pro virové hepatitidy, Státní zdravotní ústav, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 2, s. 84-89
Souhrn
Cíl práce:
zjistit aktuální situaci v zastoupení genotypů viru hepatitidy C u injekčních uživatelů drog (IDU) v České republice a srovnat zjištěné výsledky s dříve publikovanými daty.Materiál a metodika:
v letech 2005 – 2007 bylo v hepatologické poradně zdravotnického zařízení Remedis v Praze vyšetřeno 766 pacientů, z nich 459 (60 %) bylo anti-HCV pozitivních, u nich byla ve 326 případech metodou PCR prokázána virová replikace (71 % séropozitivních). Z tohoto souboru byl náhodně vybrán reprezentativní vzorek 222 pacientů, jejichž PCR produkty byly sekvenovány v NS5B oblasti a následně byla provedena genotypová analýza. Demografické a epidemiologické charakteristiky probandů byly zjišťovány pomocí dotazníku vyplněného při asistovaném interview.Výsledky:
z 222 pacientů bylo 154 (69 %) mužů, průměrný věk souboru byl 27 let, jako preferovanou drogu uvedlo 131 (61 %) osob opiáty, 74 (35 %) metamfetamin, téměř výhradně se jednalo o mnohaleté injekční uživatele. Genotypová analýza prokázala nejvyšší zastoupení genotypu 1 u 168 osob (75,5 %), s mírnou převahou subtypu 1a u 90 (40,5 %) oproti 1b 78 (35 %) osob, genotyp 3 se uplatnil v 52 (23,5 %) případech, meziročně se ve sledovaném období statisticky významně zvýšil výskyt genotypu 3 v roce 2007. Ve srovnání s historickou kontrolou v období před 5 lety došlo k zásadnímu nárůstu genotypu 3, který se u IDU v České republice vyskytoval velmi vzácně, vysoce významně též vzrostl podíl subtypu 1a oproti 1b. Ostatní genotypy popisované v ostatních evropských zemích zůstávají v našich podmínkách nadále raritní.Závěry:
byly prokázány významné změny a dynamika v zastoupení genotypů v posledních letech, které odpovídají změně způsobu přenosu, nyní v převážné míře prostřednictvím IDU.Klíčová slova:
hepatitida C - IDU - genotypy HCV.Rozšíření infekce virem hepatitidy typu C (HCV) dosáhlo pandemických rozměrů. V industrializovaných zemích se charakter epidemie v posledních 20 letech mění ve smyslu nárůstu incidence v populaci injekčních uživatelů drog (IDU) a zásadního snížení až eliminace dříve významného iatrogenního přenosu [2].
V České republice je riziková populace IDU v podstatě jedinou rizikovou skupinou, ve které přetrvává významný výskyt této infekce, séroprevalence anti-HCV protilátek u uživatelů drog je 35 %, v hlavním městě Praze se pohybuje mezi 40 - 50 % [13].
Ačkoliv je tato hodnota v dolní části intervalu výskytu v západoevropských zemích (30 až 90 %), jedná se o velmi významnou skupinu závažně nemocných osob s potenciálem dalšího šíření infekce [7]. Z analýzy meziročního hlášení případů evidovaných v systému EPIDAT vyplývá pokračující mírný nárůst nově hlášených případů infekcí, který je však částečně způsoben zpřesněním hlášení a dohledáváním nediagnostikovaných případů zejména u IDU v posledních letech.
V České republice přetrvává jisté specifikum v zastoupení jednotlivých užívaných drog, kdy na rozdíl od zbytku světa převažují uživatelé metamfetaminů (pervitinu), kteří tvoří přibližně 2/3 problémových uživatelů drog. Zbývající třetinu představují uživatelé substancí z kategorie opioidů. Ve světě je poměr uživatelů stimulancií versus opioidů obvykle obrácený [1, 12].
Význačnou vlastností viru hepatitidy typu C je genetická heterogenita. Srovnáním nukleotidových sekvencí v NS5 oblasti bylo definováno 6 základních genotypů, které jsou dále členěny na subtypy podle míry genetické diverzity [11]. Genotypizace HCV napomáhá ve výzkumu a sledování epidemiologie této choroby, význam má i v přesném cílení protivirové terapie [3,5].
Se změnou způsobu přenosu HCV infekce z dříve v ČR převážně iatrogenního na přenos prostřednictvím IDU lze očekávat i změnu ve výskytu jednotlivých genotypů a subtypů [4]. Meziroční srovnání výskytu genotypů ve větším vzorku pacientů v dané oblasti umožňuje posoudit trendy a změny ve vývoji této infekce [9].
Ve vyspělých zemích se v rizikové skupině IDU vyskytuje ve zvýšené míře genotyp 3a subtyp 1a [6, 10].
V ČR byla provedena pilotní studie genotypového zastoupení v letech 1998 – 2000, kdy výskyt genotypu 3 byl zaznamenán pouze ve 3 případech z 52 (6 %) testovaných IDU, v běžné populaci (neuživatelů drog) se nevyskytoval vůbec [4]. Subtyp 1a se u uživatelů vyskytoval ve 14 z 52 (27 %) případů zatímco v běžné populaci pouze v 7 z 39 (14 %), popsané rozdíly byly statisticky významné.
Tato práce charakterizuje výskyt jednotlivých variant HCV ve skupině infikovaných injekčních uživatelů drog v kontextu jejich demografických charakteristik, míry a způsobů rizikového chování. Dále srovnává nově zjištěné zastoupení genotypů (v letech 2005 - 2007) se situací popsanou v letech 1998 - 2000) [4].
Materiál a metody
Studovaná skupina
V časovém úseku od ledna 2005 do prosince 2007 byla všem nově registrovaným klientům v hepatologické poradně Remedis v Praze, kteří udali rizikový faktor užívání psychoaktivních látek, nabídnuta účast v epidemiologické, neintervenční studii. Pacienti tohoto zařízení se rekrutují z obyvatel hlavního města Prahy (72 %), Středočeského kraje (21 %), méně pak z ostatních krajů republiky. Do studie byli zařazeni výhradně občané České republiky.
Demografické a epidemiologické charakteristiky souboru byly zjišťovány pomocí dotazníku, který byl vyplněn při asistovaném interview v den registrace pacienta, údaje byly dále zpřesněny a verifikovány odběrem podrobné anamnézy v jiný den. Studie byla schválena Etickou komisí, pacienti byli zařazeni s jejich písemným informovaným souhlasem.
Laboratorní vyšetření
V době registrace v poradně byli všichni klienti vyšetřeni standardním způsobem včetně rutinních laboratorních testů, které zahrnovaly stanovení sérových hodnot AST, ALT, ALP, GMT a bilirubinu. Vzhledem k anamnéze rizikového chování byly u všech subjektů vyšetřeny sérologické markery virových hepatitid A, B, C a protilátky proti HIV1 a 2. Tato vyšetření byla prováděna komerčními ELISA testy (HAV-IgM Assay, HAV-Total Assay, Monolisa AgHBs-Plus, Monolisa anti-HBs 3.0 a Monolisa antiHCV-Plus, version 2, BioRad, SA).
Stav HIV protilátek byl vyšetřován opět pomocí ELISA testů (Genscreen, HIV-1/2 – version 2, Biorad). Séra anti-HCV pozitivních pacientů, nebo pacientů s podezřením na čerstvě akvírovanou HCV infekci byla dále vyšetřena na přítomnost HCV RNA v krevním séru RT-PCR metodou (Amplicor HCV, Roche Molecular Systems). U klientů, kteří souhlasili se zařazením do klinické studie, podepsali informovaný souhlas a absolvovali vstupní odběry, byla část séra zbývající po centrifugaci uskladněna při teplotě -70° C až do doby sekvenace.
Genotypová analýza
Virová RNA byla extrahována soupravou QIAamp Viral RNA Mini Kit (Qiagene) z 240 μl séra. Extrahovaná virová RNA byla transkribována pomocí random hexamer primerů (Invitrogen) reverzní transtriptázou AMV (Roche) při 40°C po dobu 60 min. Transkribovaná DNA byla amplifikována polymerázovou řetězovou reakcí (PCR) s použitím primerů v pozici nt 8145-8546 v NS5B oblasti HCV o délce 401nt (SV542as 5ę-GGA GGG GCG GAA TAC CTG GTC ATR GCY TCC GTR AA a SV360s 5ę-CTT CTC ATA TGA CAC CCG CTG YTT YGA, SV361s 5ę - CTT CTC ATA TGA CAC CCG WTG CTT YGA) (Viazov S. osobní sdělení) a Taq polymerázy (Invitrogen). Teplota nasednutí primerů (annealing) byla 55°C.
Přečištění před sekvenční PCR bylo provedeno soupravou QiaQuick 96 PCR Purification Kit (Qiagene). Pro dvě sekvenční reakce PCR byly použity stejné primery jako pro PCR SV542as, a směs SV360s, SV361s s podmínkami podle standardního protokolu BigDye 3.1 terminator reaction mix (Applied Biosystems). Produkt byl přesrážen 70% ethanolem a octanem sodným. Sekvenace se prováděla na sekvenátoru ABI 3100 Avant, sekvenovaná data byla zpracována pomocí programu Seqscape 2.0 (Applied Biosystems). Výsledné sekvence jednotlivých pacientů byly seřazeny programem ClustalW pod programem Bioedit 7.0.9, kde proběhla i vizuální kontrola sekvencí. Fylogenetická analýza byla provedena programem MEGA metodou neighbour joining. Genotypy byly odečítány z fylogenetického stromu ze shluků definovaných pomocí nukleotidových sekvencí HCV se známým genotypem převzatých z databáze Genbank.
Výsledky
V letech 2005 – 2007 bylo v ambulantním zdravotnickém zařízení Remedis v Praze nově registrováno a vyšetřeno 766 pacientů, kteří uvedli, že v době registrace či dříve užívali drogy. Ve více než 98 % případů se jednalo o injekční užívání drog. Celkem 459 (60 %) nově vyšetřených pacientů bylo anti-HCV pozitivních. Celkem byla ve 326 případech prokázána virová replikace metodou polymerázové řetězové reakce (HCV PCR), u 71 % séropozitivních tedy byla prokázána replikující forma HCV infekce. Pro účely této studie byl náhodně vybrán reprezentativní vzorek 222 viremických pacientů, jejichž PCR produkty byly následně sekvenovány v oblasti NS5B virového genomu.
Z 222 pacientů bylo 154 mužů (69 %) a 68 žen (31 %). Průměrný věk byl 27 let (rozmezí 17-46), u mužů 27,8, u žen 25,4. Dotazník hodnotitelně vyplnilo 218 osob. Pouze 3 osoby (ve všech případech se jednalo o ženy) z celého souboru infikovaných udaly užívání drog jiným, než injekčním způsobem.
Jako hlavní (celoživotně preferovanou) drogu uvedlo 131 (61 %) osob opiáty – téměř výhradně se jednalo o heroin. Látky ze skupiny stimulancií uvedlo 74 (34,5 %) osob – mimo jediný případ kokainu šlo o metamfetaminy (pervitin). Jiné drogy (THC, halucinogeny a rozpustidla) uvedlo jako preferovanou drogu cca 5 % osob.
Velmi důležitým parametrem charakterizujícím rizikové chování je věk první injekční aplikace, kdy 55 (25,5 %) osob uvedlo injekční aplikaci ve věku 15 let či nižším. Do 18 let věku pak poprvé injekčně aplikovalo již 47,5 % osob studovaného souboru. Medián začátku injekční aplikace byl 18 let.
Doba užívání drog byla u 158 (73,5 %) osob delší než 5 let s mediánem doby užívání 9 let. Doba vlastního injekčního užívání, po kterou kumulativně narůstá riziko infekce HCV, byla u 120 (56 %) osob delší než 5 let. Pouze 39 (18 %) osob udalo v době svého aktivního užívání frekvenci injekční aplikace nižší, než 1 krát denně, převažuje tedy každodenní, obvykle vícečetná aplikace opiátu s krátkým poločasem účinku.
HCV patří mezi 3 nejčastější krví přenosné choroby, v ČR má aktuálně nejvýznamnější podíl ve výskytu chorob s tímto způsobem přenosu. Tabulka 1 uvádí sérologické parametry souboru – záchyt markerů infekce hepatitidami B, C a HIV.
Tab. 1. Sérologické nálezy hepatitid B, C a HIV Table 1. HBV, HCV and HIV seropositivity 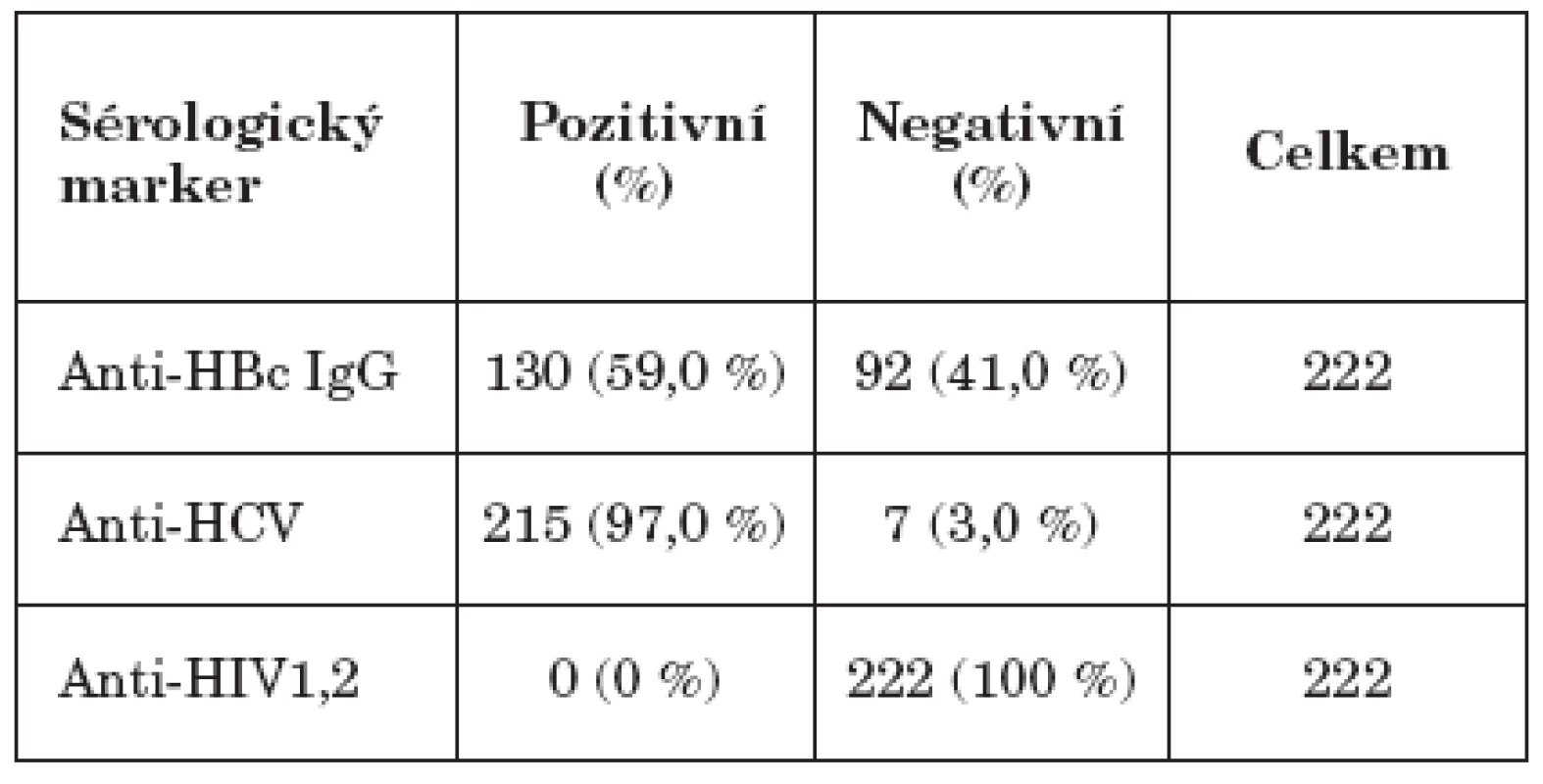
U 97 % (215 z 222) testovaných viremických probandů byla zjištěna přítomnost anti-HCV protilátek, přičemž 7 osob bylo viremických při negativní anti-HCV protilátce. Vzhledem k tomu, že všech 7 osob následně sérokonvertovalo v anti-HCV protilátce, jednalo se v těchto případech o záchyt akutní HCV infekce.
Zastoupení jednotlivých genotypů HCV ve studovaném souboru popisuje tabulka 2. Evidentní je převažující zastoupení genotypu 1 u 168 (75,5 %) pacientů s mírnou převahou subtypu 1a oproti subtypu 1b, genotyp 3 se vyskytl u 52 (23,5 %) osob v obvyklém subtypu 3a.
Tab. 2. Přehled zastoupení jednotlivých genotypů a subtypů HCV (2005-2007) Table 2. Distribution of HCV genotypes and subtypes, 2005-2007 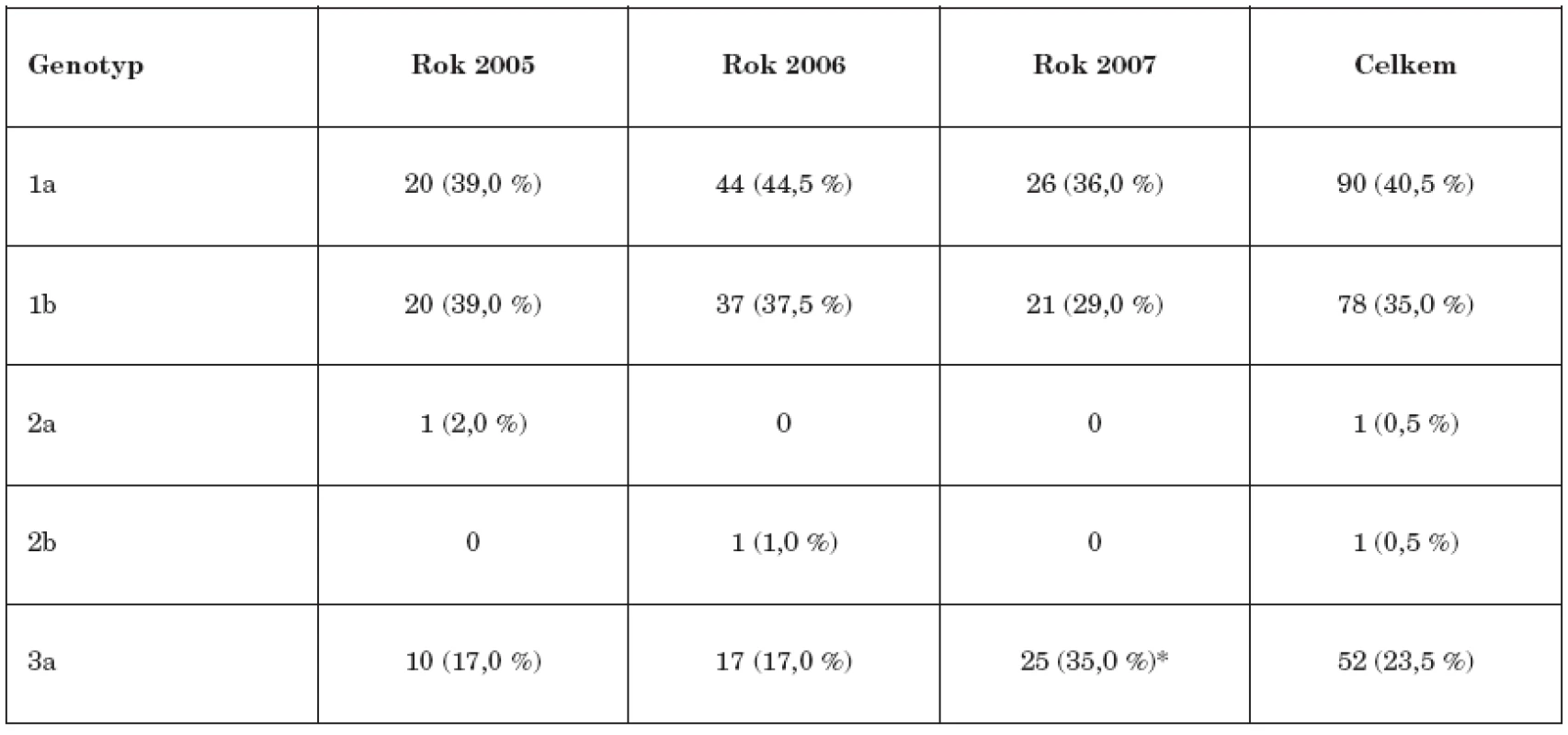
* statisticky významný nárůst, p=0,02 * statistically significant increase, p=0.02 Meziroční rozdíly (2005-2007) v zastoupení jednotlivých genotypů nebyly statisticky významné s výjimkou statisticky významné meziroční změny (2007) u genotypu 3.
Ve srovnání s historickou kontrolou z let 1998-2000 v tabulce 3 je významný zjištěný nárůst subtypu 1a oproti subtypu 1b [4]. Zásadní změna nastala ve výskytu genotypu 3, dříve v populaci IDU v ČR zcela raritnímu. Zastoupení v méně než čtvrtině případů je však nadále relativně nízké ve srovnání se situací v jiných evropských zemích.
Tab. 3. Srovnání genotypového zastoupení HCV s historickou kontrolou Table 3. Comparison of HCV genotype distribution in 2005- 2007 and 1998-2000 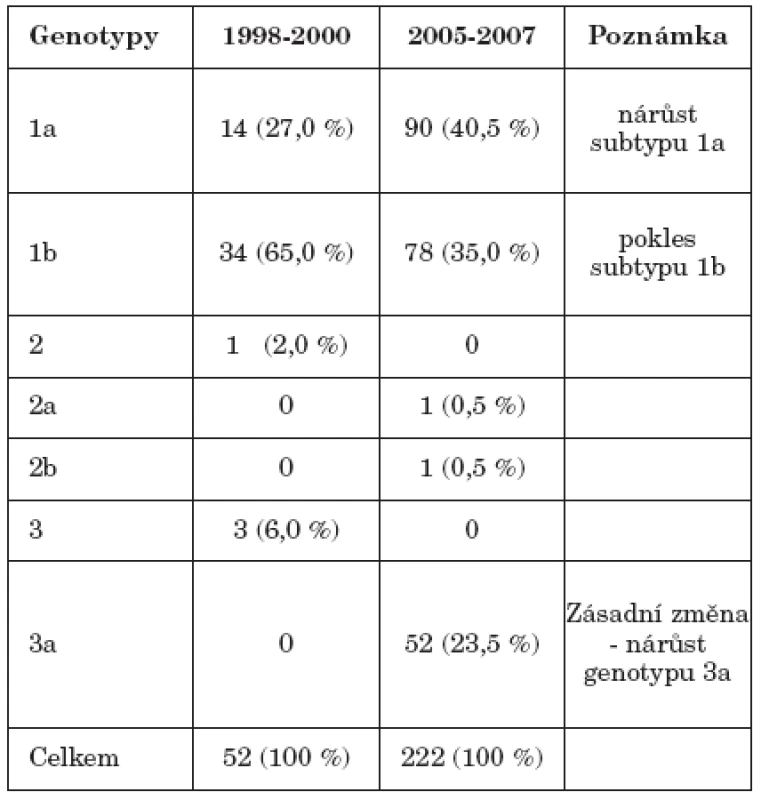
Diskuse
Velmi vysoká prevalence HCV infekce (60 %) ve studované populaci částečně odráží specifickou situaci v hlavním městě Praze, jedná se však o selektovanou populaci vysoce rizikových osob, které vyhledaly či byly doporučeny k vyšetření na specializovaném pracovišti. Převažují muži, u kterých byl zaznamenán i vyšší průměrný věk, což koreluje s hodnotami obdobných souborů z jiných pracovišť. Téměř výhradně se jednalo o injekční uživatele drog.
V tomto souboru bylo zaznamenáno poněkud odlišné zastoupení hlavní (preferované) drogy, kdy převažovaly opiáty v kontrastu s celostátní statistikou citovanou v úvodu této práce, kde vedou metamfetaminy (pervitin). Pro upřesnění je třeba uvést, že významná část uživatelů s udanou preferencí opiátů v některé fázi své drogové kariéry užívala metamfetaminy. V tomto souboru např. 30 % subjektů preferujících opiáty uvedlo jako první užívanou drogu pervitin. V individuální drogové kariéře uživatelů často zaznamenáváme počáteční užívání pervitinu a posléze přechod na opiáty, případně i kombinaci obou substancí. Určitou roli v této diferenci může též hrát odlišný způsob sběru dat (formulace dotazů), kdy v této práci je zachycena celoživotní preference, nikoliv aktuálně užívaný druh drogy.
Zásadním faktorem přispívajícím k šíření krví přenosných infekcí je injekční aplikace drog. Klíčovým parametrem k posouzení rizikovosti injekční aplikace je sdílení jehel, stříkaček a dalších tzv. parafernálií (lžička, voda k ředění drogy, vatové filtry apod.). Informovanost o rizicích přenosu HCV infekce prostřednictvím stříkaček a jehel mezi uživateli je relativně vysoká. Parafernália, pro přenos HCV obdobně riziková, však za riziková považuje pouze menšina uživatelů. Používání vždy nové stříkačky a jehly, resp. používání výhradně vlastních uvedlo 94 (44%) osob, více než polovina z hodnocených připustila více či méně frekventní sdílení aplikačních nástrojů. Sdílení parafernálií však uvedlo 176 (82 %) osob, dalších 13 (6 %) uvedlo, že neví, zda ke sdílení došlo. Z vyhodnocení kombinace odpovědí vyplývá, že přes 70 % osob, které sice nesdílejí stříkačky ani jehly, je přesto exponováno riziku přenosu HCV prostřednictvím parafernálií.
V tabulce 1 uvedené sérologické markery infekce hepatitidami B, C a HIV odrážejí anamnézu vysoce rizikového chování významnou prevalencí HBV infekce, resp. sérologických známek kontaktu s ní. V naprosté většině se jedná o inaparentní infekci proběhlou v minulosti, řada pacientů prodělanou HBV infekci v anamnéze vůbec neuvedla. Případů s prokázanou aktivní infekcí – HBsAg pozitivních, příp. i HBV DNA pozitivních bylo v souboru pouze 8 (2,9%) což odpovídá předpokládanému výskytu přechodu této infekce do chronicity u imunokompetentních dospělých osob. (Možnost suprese HBV infekce při koinfekci HBV/HCV vybočuje z rámce této studie a proto ji nediskutujeme.)
Nepřítomnost HIV infekce odpovídá zatím stacionárnímu, relativně velmi nízkému výskytu HIV v rizikové skupině uživatelů drog v ČR, velmi nízký počet zdrojů infekce v této skupině a zjevně nízký průnik s ostatními rizikovými skupinami pro tuto infekci se spolupodílejí na přetrvávání tohoto příznivého stavu.
Meziroční rozdíly (2005-2007) v zastoupení jednotlivých genotypů nebyly statisticky významné s výjimkou nárůstu genotypu 3 v roce 2007. Ačkoliv v souhrnném vyjádření při srovnání s historickou kontrolou nadále významně převažuje genotyp 1, což odpovídá předchozím publikovaným zjištěním, vysoce významný je zjištěný nárůst subtypu 1a oproti subtypu 1b. Tento trend kopíruje situaci v jiných vyspělých zemích, kde subtyp 1a u uživatelů drog již v současnosti převažuje. Dramatická změna byla zachycena ve výskytu genotypu 3, jehož významný nárůst v populaci IDU je odrazem změny způsobu přenosu. Podíl na méně než čtvrtině zachycených případů v ČR je však nadále významně nižší než v zemích s delší historií injekčního užívání drog. Příčina vyšší frekvence přenosu genotypu 3 prostřednictvím IDU nebyla doposud přesvědčivě objasněna.
Závěry
V posledních letech došlo v České republice ke statisticky významnému nárůstu v zastoupení genotypu 3 a subtypu 1a. Tento rozdíl je patrný zejména ve srovnání s historickou kontrolou z let 1998 – 2000.
Nadále vysoce převažuje genotyp 1, který tvoří více než 75 %. Výskyt jiných genotypů než 1 a 3 je nadále raritní a neobvyklý, často souvisí s anamnézou užívání drog v zahraničí či přímým kontaktem s importovanou infekcí.
Studovaný soubor je plně reprezentativní pro Prahu a Středočeský kraj, odkud pocházela většina účastníků studie. Vzhledem k tomu, že se tato oblast podílí více než polovinou na výskytu problémového užívání drog v České republice, lze získané výsledky, s respektováním možné odchylky, aplikovat celostátně.
V souladu s celostátní statistikou mírně narůstá věk injekčních uživatelů, mírně se též zvyšuje podíl žen. Ve srovnání s jinými vyspělými zeměmi však věk našich uživatelů zůstává významně nižší. Velmi nízký je i věk první, obvykle vysoce rizikové, injekční aplikace. Zde nadále zůstává nevyužitý prostor k prevenci.
Grantová podpora: IGA9044-3/2006 a NIH5-R01A1056319-05
Do redakce došlo 8. 1. 2009
Dr. V. Řehák
Vladimírova 10
140 00 Praha 4 – Nusle
e-mail: rehak@vratislav.cz
Zdroje
1. Czemy, L., Kubicka, L., Nociar, A. Drug Scene in the Czech Republic and Slovakia during the Period of Transformation. Eur Addict Res, 2002,8,159-165.
2. Esteban, J.I., Sauleda, S., Quer, J. The changing epidemiology of hepatitis C virus infection in Europe. J Hepatol 2008,48(1),148-162.
3. Fried, M.W., Shiffman, M.L., Reddy, K.R. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002,347(13),975-982.
4. Krekulova, L., Rehak, V., Madrigal, N., Johnson, M., Killoran, P., Riley. L.W. Genotypic and epidemiologic characteristics of hepatitis C virus infection among recent injection drug user and nonuser populations, Clin Infect Dis 2001,33,1435-1438.
5. Manns, M.P., McHutchison, J.G., Gordon, S.C., Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001,358(9286),958-965.
6. Morice, Y., Cantaloube, J.F., Beaucourt, S., Barbotte, L., et al. Molecular epidemiology of hepatitis C virus subtype 3a in injecting drug users. J Med Virol 2006,78,1296–1303.
7. Roy, K., Hay, G., Andragetti, R., Taylor, A., et al. Monitoring hepatitis C virus infection among injecting drug users in the European Union: a review of the literature. Epidemiol Infect 2002,129,577–585.
8. Shepard, C.W., Finelli, L., Alter, M.J. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis 2005,5,558–567.
9. Schroter, M., Zollner, B., Laufs, R., Feucht, H.H. Changes in the prevalence of hepatitis C virus genotype among injection drug users: a highly dynamic process. J Infect Dis 2004,190,1199–1200.
10. Schroter, M., Zollner, B., Schafer, P., Reimer, A., et al. Epidemiological dynamics of hepatitis C virus among 747 German individuals: new subtypes on the advance. J Clin Microbiol 2002,40,1866–1888.
11. Simmonds, P., Holmes, E.C., Cha, T.A., et al. Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region. J Gen Virol 1993,74(Pt 11),2391-2399.
12. Wiessing, L. European drugs agency highlights trends in drug use and problems affecting drug users. Euro Surveill 2005,10,E051215.
13. Zabransky, T., Mravcik, V., Korcisova, B., Rehak, V. Hepatitis C Virus Infection among Injecting Drug Users in the Czech Republic - Prevalence and Associated Factors. European Addiction Research 2006,12,151-160.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2009 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- SDĚLENÍ Z ČLS JEP Společné prohlášení České lékařské společnosti Jana Evangelisty Purkyně a Asociace inovativního farmaceutického průmyslu O spolupráci mezi lékařskou odbornou veřejností a inovativním farmaceutickým průmyslem
- Životní jubileum doc. MUDr. Otto Lochmanna, CSc.
- K 85. narozeninám prof. MUDr. Vladislava Potužníka, DrSc.
- Recenze
- Nové možnosti očkování proti chřipce
- TEST Z IMUNOLOGIE
- Zprávy z internetu
- Laboratórna diagnostika toxoplazmózy
- Genotypová heterogenita viru hepatitidy C (HCV) u dárců krve v ČR
- Vliv náhlých změn teploty a tlaku vzduchu na úmrtnost v ČR
- Situace a trendy v zastoupení genotypů viru hepatitidy C v populaci injekčních uživatelů drog
- Borrelia burgdorferi s.l. v klíšťatech na ostravských haldách
- Alimentární přenos klíšťové encefalitidy v České republice (1997–2008)
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratórna diagnostika toxoplazmózy
- TEST Z IMUNOLOGIE
- Vliv náhlých změn teploty a tlaku vzduchu na úmrtnost v ČR
- Genotypová heterogenita viru hepatitidy C (HCV) u dárců krve v ČR
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



