-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sitosterolémie: klinická, biochemická a molekulárně genetická charakteristika 3letého chlapce s významnou hypercholesterolémií
Sitosterolemia: clinical, biochemical and molecular characteristics in a 3 years old boy with marked hypercholesterolemia
Background:
Sitosterolemia is a rare, autosomal recessive inherited disorder of lipid metabolism, associated with an abnormal transport of plant sterols in a small intestine and a liver due to malfunction of a transport protein ABCG5/ABCG8. Disorder is associated with significant hyperphytosterolemia and also with hypercholesterolemia in most pediatric patients, tuberous and tendinous xanthomas, hemolytic anemia, macrothrombocytopenia, abnormal bleeding, splenomegaly, premature atherosclerosis, arthritis, failure to thrive and hepatopathy. A rare finding of normocholesterolemia and normal levels of phytosterols in breastfed infants might result in a delay in diagnosis. Patients with sitosterolemia respond well to a low cholesterol and a low plant sterol diet in combination with ezetimibe therapy. Here, we report clinical, biochemical and molecular genetic data of a boy with sitosterolemia.Case report:
3 years old boy has been monitored since 7 months of age for hypercholesterolemia (16–25.6 mmol/l), found accidentally. Family history was negative. Since one year of age a failure to thrive was documented, weight/lenght ratio dropped from 75th to 8.8th percentile. At the age of 20 months laboratory tests showed significantly increased levels of serum sitosterol (13 times above normal level) and campesterol (4 times above normal level). Molecular genetic analysis revealed compouned heterozygosity for a previously described pathogenic mutation p.Arg446* and another, up to now unpublished, probably pathogenic variant p.Arg419Cys in the ABCG5 gene. Both parents were confirmed as healthy mutation carriers.Conclusion:
We presented the first Czech patient with sitosterolemia carrying mutations in ABCG5. Patient is on a low-cholesterol and a low-plant sterol diet and ezetimibe therapy. During 16 months of therapy, level of total cholesterol and also of LDL cholesterol almost normalized and serum concentration of plant sterols decreased significantly. Therefore, sitosterolemia should be considered in the differential diagnosis of severe hypercholesterolemia in children.Key words:
sitosterolemia, phytosterolemia, hypercholesterolemia, ABCG5, non-cholesterol sterols, failure to thrive
Autoři: M. Floriánková 1; Z. Urbanová 1; Š. Bláhová 1; M. Pencová 1; J. Hyánek 2; L. Tichý 3; L. Fajkusová 3; T. Freiberger 4; T. Honzík 1
Působiště autorů: Klinika dětského a dorostového lékařství 1. LF UK a VFN, Praha 1; Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha 2; Centrum molekulární biologie a genové terapie, FN Brno 3; Centrum kardiovaskulární a transplantační chirurgie, Brno 4
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (8): 495-503.
Kategorie: Kazuistika
Souhrn
Úvod:
Sitosterolémie je vzácné, autozomálně recesivně dědičné onemocnění, způsobené abnormním transportem fytosterolů ve střevě a játrech při poruše transportního proteinu ABCG5/ ABCG8. Projevuje se významnou hyperfytosterolémií, u dětí většinou i hypercholesterolémií, xantomy, hemolytickou anémií, makrotrombocytopenií, abnormální krvácivostí, splenomegalií, předčasnou aterosklerózou, artritidou, neprospíváním, hepatopatií. Výjimečný nález normální cholesterolémie při hyperfytosterolémii komplikuje diagnostiku, stejně tak nález normální hladiny fytosterolů u kojených dětí. Pacienti se sitosterolémií dobře reagují na dietu s restrikcí cholesterolu a fytosterolů v kombinaci s léčbou ezetimibem. Předkládáme výsledky klinických, biochemických a molekulárně genetických analýz u našeho pacienta se sitosterolémií.Kazuistika:
Tříletý chlapec je sledován od 7 měsíců věku pro hypercholesterolémii (16–25,6 mmol/l), zjištěnou náhodně. Rodinná anamnéza byla negativní. Od 1 roku věku došlo k propadu v hmotnostně-délkovém poměru ze 75. na 8,8. percentil. Ve věku 20 měsíců byly zjištěny významně zvýšené sérové hladiny sitosterolu (13x nad normu) a kampesterolu (4x nad normu). Molekulárně genetická analýza prokázala, že pacient je složeným heterozygotem pro dříve popsanou patogenní mutaci p.Arg446* a dosud nepublikovanou, pravděpodobně patogenní variantu p.Arg419Cys v genu ABCG5. Oba rodiče jsou zdraví přenašeči.Závěr:
U 3letého chlapce byla potvrzena diagnóza sitosterolémie s mutacemi v genu ABCG5. Jde o první potvrzený případ sitosterolémie v ČR. Chlapec je v současnosti léčen nízkocholesterolovou a nízkofytosterolovou dietou a ezetimibem. Během 16 měsíců léčby se téměř normalizovala hladina celkového cholesterolu a LDL cholesterolu, významně poklesla koncentrace fytosterolů. Sitosterolémii je potřeba brát v úvahu v rámci diferenciální diagnostiky závažné hypercholesterolémie u dětí.Klíčová slova:
sitosterolémie, fytosterolémie, hypercholesterolémie, ABCG5, noncholesterolové steroly, neprospíváníÚVOD
Sitosterolémie (MIM# 210250) je autozomálně recesivně dědičné onemocnění s celosvětovou prevalencí <1 : 1 000 000 [1]. Je vázáno na mutace v jednom z tandemových genů pro membránové proteiny (ATP binding cassette transporters, ABC) – ABCG5 (sterolin-1, MIM# 605459) nebo ABCG8 (sterolin-2, MIM# 605460), které tvoří obligátně heterodimerický transportní mechanismus umožňující exkreci sterolů z hepatocytů a epitelových buněk žlučníku do žluče nebo z enterocytů do střevního lumen, se zvýšenou afinitou k noncholesterolovým sterolům [1, 2]. Defekt v ABCG5/ABCG8 genu vede ke zvýšené absorpci noncholesterolových sterolů ve střevě, ke snížení jejich exkrece žlučí a tím k extrémnímu zvýšení plazmatických/sérových hladin fytosterolů. Zatímco u zdravých jedinců se vstřebává méně než 5 % přijatého sitosterolu, při sitosterolémii je to 15–60 % a hladina sitosterolu může být i 30–100x zvýšená [2, 3].
Narušení transportu fytosterolů způsobuje změny i v absorpci a exkreci cholesterolu. Funkce intestinální ABCG5/G8 je rozhodující pro úroveň reverzního transportu cholesterolu (RCT) a fekální exkreci neutrálních sterolů [4]. Protože fytosteroly soutěží s cholesterolem o vazbu ve smíšených micelách, dochází při poruše funkce ABCG5/G8, současně se snížením návratu fytosterolů do tenkého střeva, k umocnění resorpce cholesterolu [1]. V hepatocytech ABCG5/G8 umožňují exkreci až 75 % cholesterolu do žluče [4]. Hyperfytosterolémie vede u dospělých k útlumu syntézy cholesterolu de novo, u dětí může být tato regulace nekompletní díky nízkému příjmu fytosterolů.
Do klinického obrazu a laboratorních abnormalit sitosterolémie patří šlachové a podkožní xantomy, hemolytická anémie, makrotrombocytopenie, abnormální krvácení, splenomegalie, předčasná ateroskleróza, artritida, neprospívání a hepatopatie [2, 5]. U dětí je kromě hyperfytosterolémie většinou přítomna i hypercholesterolémie. U kojených dětí však může být hladina fytosterolů normální nebo jen lehce zvýšená a k výraznější elevaci může dojít až se zařazením příkrmů [5, 6]. Nízkocholesterolová a nízkofytosterolová dieta přináší výrazný efekt, přesto je k normalizaci cholesterolémie nutná kombinace s léčbou ezetimibem, případně cholestyraminem [5, 7]. Hladiny fytosterolů zůstávají i při důsledné dietě a kombinované léčbě alespoň mírně zvýšené. V našem sdělení předkládáme výsledky klinických, biochemických a molekulárně genetických analýz u prvního českého pacienta se sitosterolémií.
POPIS PŘÍPADU
Chlapec se narodil z druhé gravidity, fyziologického průběhu, v termínu, spontánně, s porodní hmotností 2980 g a délkou 49 cm. Bezprostřední poporodní adaptace byla dobrá. Třináctý den byl chlapec hospitalizován pro urosepsi. Při kontrolním vyšetření v nefrologické poradně byla v 7 měsících věku zachycena hypercholesterolémie 16 mmol/l (norma 2,6–4,2), potvrzená kontrolou (18 mmol/l). Proto byl chlapec odeslán ve věku 10 měsíců do lipidové poradny. Hladina cholesterolu byla u matky, otce a staršího sourozence v normě.
Ve věku 19 měsíců byl pacient odeslán na naši kliniku. Vážil 9,75 kg (3,9. p.) a měřil 80,5 cm (19. p.), hmotnostně-délkový poměr byl na 8,8. percentilu [8]. Od 1 roku došlo u chlapce k výraznému propadu hmotnostně-délkového poměru – ve 12 měsících vážil 9 kg (12. percentil) a měřil 70 cm (1,4. percentil), proporčně byl na 75. percentilu (graf 1). Psychomotorický vývoj byl v normě, chlapec neměl hepatosplenomegalii, xantomy ani xantelasmata. Hladina celkového cholesterolu dosahovala 25,6 mmol/l, LDL cholesterolu 23,2 mmol/l (norma 1,2–3,8), HDL cholesterolu 2,13 mmol/l (norma 1,0–1,17) a triacylglycerolů (TAG) 0,48 mmol/l (norma 1,0–1,64) (graf 2a). Lipoprotein Lp(a) byl zvýšen na 1,4 g/l (norma 0,05–0,3). Lehce zvýšená byla aktivita AST (0,78 μkat/l, norma <0,63) a CK (4,2 μkat/l, norma <2,23). Neprokázali jsme anémii, hladina i objem trombocytů a koagulační parametry byly v normě. Vyloučili jsme hypotyreózu, celiakii i deficit aktivity lysosomální kyselé lipázy. Molekulárně genetická analýza genu pro LDLR a PCSK9 neprokázala mutaci a vyloučila tak homozygotní familiární hypercholesterolémii. Pacient je homozygotem pro alelu ε3 genu APOE.
Graf 1. Vývoj hmotnostně-délkového poměru u pacienta se sitosterolémií (CAV 1991). 
Graf 2a. Změny plazmatických koncentrací cholesterolu, HDL, LDL a TAG (triacylglycerolů) u pacienta se sitosterolémií před zahájením léčby, v průběhu léčby dietou a při léčbě dietou v kombinaci s ezetimibem. 
Negativní rodinná anamnéza a tíže hypercholesterolémie vedly k podezření na autosomálně recesivně dědičnou hypercholesterolémii či sitosterolémii. Stanovení hladiny sérových necholesterolových sterolů skutečně prokázalo výrazně zvýšené hladiny sitosterolu (86,8 µmol/l, norma 6,2–6,8), kampesterolu (41,5 µmol/l, norma 9,4–10,3), latosterolu (13,6 µmol/l, norma 4,6–5,1) a desmosterolu (7,1 µmol/l, norma 2,4–2,7) (graf 2b). Hladina sitosterolu byla zvýšená i u obou rodičů (otec 21,7 a matka 10,3 µmol/l), u otce byla zvýšená i hladina kampesterolu (12,8 µmol/l). Na biochemické úrovni tak byla u chlapce prokázána sitosterolémie, kterou následně potvrdilo i molekulárně genetické vyšetření. Chlapec byl určen jako složený heterozygot pro jednu patogenní, dříve popsanou mutaci p.Arg446*, a jednu pravděpodobně patogenní variantu p.Arg419Cys v genu ABCG5. U obou nalezených sekvenčních variant byla kauzalita posouzena s využitím specifických kritérií publikovaných americkými odbornými společnostmi [9].
Graf 2b. Změny plazmatických koncentrací noncholesterolových sterolů u pacienta se sitosterolémií před zahájením léčby, v průběhu léčby dietou a při léčbě dietou v kombinaci s ezetimibem. 
V době stanovení diagnózy ve stravě chlapce převažovalo z 80 % mateřské mléko, příjem komplementární výživy byl nízký (z důvodu odmítání dítětem), chlapec trpěl obstipací. Příjem dietárního cholesterolu byl 110–200 mg/den (11,3–20,5 mg/kg), příjem fytosterolů 250–285 mg/den (25,6–29,2 mg/kg). Energetický příjem byl 760–1250 kcal (78–128 kcal/kg/den, doporučený příjem 90 kcal/kg/den).
Rodiče byli edukováni ve vedení nutričního záznamu a podávání stravy s obsahem cholesterolu do 200 mg/den a fytosterolů do 150 mg/den. Ordinována byla suplementace LC PUFA. Compliance v dietních opatřeních byla dobrá, s až přílišnou restrikcí cholesterolu (100–154 mg/den, tzn. 9,5–15 mg/kg), fytosterolů (8–20 mg/den), celkového tuku (18–30 g/den) a energie (795–920 kcal/den, tzn. 76–87 kcal/kg).
Po potvrzení diagnózy sitosterolémie byla ve věku 20 měsíců zahájena léčba ezetimibem v dávce 5 mg/den s pokračováním v dietě. Po 3 týdnech léčby došlo jen k mírnému snížení hladiny cholesterolu (19,3 mmol/l) a fytosterolů (sitosterol 58,9 µmol/l, kampesterol 27,9 µmol/l), dávka ezetimibu byla proto zvýšena na 10 mg/den. Po 3 týdnech léčby dávkou 10 mg ezetimibu denně byl pokles cholesterolémie již významný (celkový cholesterol 10,2 mmol/l, tzn. 40 % počáteční hladiny, LDL cholesterol 7,9 mmol/l, 34 % vstupní hladiny). Sitosterol poklesl na 33,5 µmol/l (39 % vstupní hodnoty), kampesterol na 18,6 µmol/l (45 % vstupní hodnoty), poklesla také hladina latosterolu na 8,4 µmol/l (62 % vstupní hodnoty) a desmosterolu na 4,5 µmol/l (63 % vstupní hladiny) (grafy 2a,b).
Protože došlo k dalšímu prohloubení propadu v percentilových grafech, byl doporučený příjem cholesterolu zvýšen na 200–250 mg/den a doporučen minimální příjem 1000 kcal/den. Po 16 měsících terapie ezetimibem v kombinaci s dietou je hladina cholesterolu 5,0 mmol/l, HDL cholesterolu 2,0 mmol/l, LDL cholesterolu 2,2 mmol/l a triacylglycerolů 1,6 mmol/l. Hladina sitosterolu i kampesterolu již dále neklesala, hladina latosterolu klesla na 5,2 µmol/l (38 % vstupní hladiny) a hladina desmosterolu na 4,1 µmol/l (58 % vstupní hladiny) (grafy 2a,b).
Po zvýšení energetického příjmu dochází postupně k mírnému zlepšení hmotnostního přírůstku – ve věku 3 let váží chlapec 12,4 kg (4,5. p.) a měří 92 cm (7,3. p.), což odpovídá 13. proporčnímu percentilu (graf 1).
POUŽITÉ METODY
Antropometrické parametry byly hodnoceny pomocí SW Kompendium pediatrické auxologie 2005 s metodikou podle CAV 1991 a 2001.
Nutriční monitoring: Příjem cholesterolu, celkové energie, tuků, proteinů a sacharidů byl hodnocen pomocí SW Nutriservis Proffesional (http://www.nutriservis.cz/cs/). Příjem fytosterolů byl hodnocen podle databáze Self Nutrition Data (nutritiondata.self.com/foods).
Stanovení noncholesterolových sterolů bylo provedeno za pomoci plynové chromatografie a hmotnostní spektrometrie (metodika v modifikaci Theunissen et al.) na Finnigan Mat 120B s vnitřním standardem epicoprostenalem (CV <10 %) [10].
Molekulárně genetické vyšetření kódujících sekvencí genů LDLR, PCSK9 a APOE bylo provedeno pomocí metody sekvenování nové generace (NGS) s využitím komerčního kitu ADH MASTR v2 (Multiplicom; Niel, Belgie). Pro vyloučení rozsáhlých delecí a duplikací v genu LDLR bylo použito metody Multiplex ligation-dependent probe amplification (MLPA) (probe mix P062-D2). Analýza genů ABCG5/8 proběhla metodou přímého sekvenování všech kódujících oblastí. Pro hodnocení dopadu nalezených sekvenčních variant na funkci příslušných proteinů byly použity predikční softwarové nástroje PolyPhen2 (http://genetics.bwh.harvard.edu/pph2/), SIFT (http://sift.jcvi.org/), Mutation Taster (http://www.mutationtaster.org/) a SNPs3D (http://www.snps3d.org/).
DISKUSE
Klinické projevy
Pacienti se sitosterolémií jsou fenotypicky heterogenní skupinou (tab. 1), jsou známy případy s asymptomatickým průběhem [2, 6, 11, 12], ale i pacienti s úmrtím v první dekádě života [11, 13]. Významné rozdíly v klinické manifestaci a laboratorních parametrech nacházíme i mezi příbuznými prvního stupně se stejnými mutacemi [11, 12, 14, 15].
Tab. 1. Klinické příznaky a laboratorní data 20měsíčního chlapce se sitosterolémií v porovnání se skupinou pacientů popsaných v literatuře. 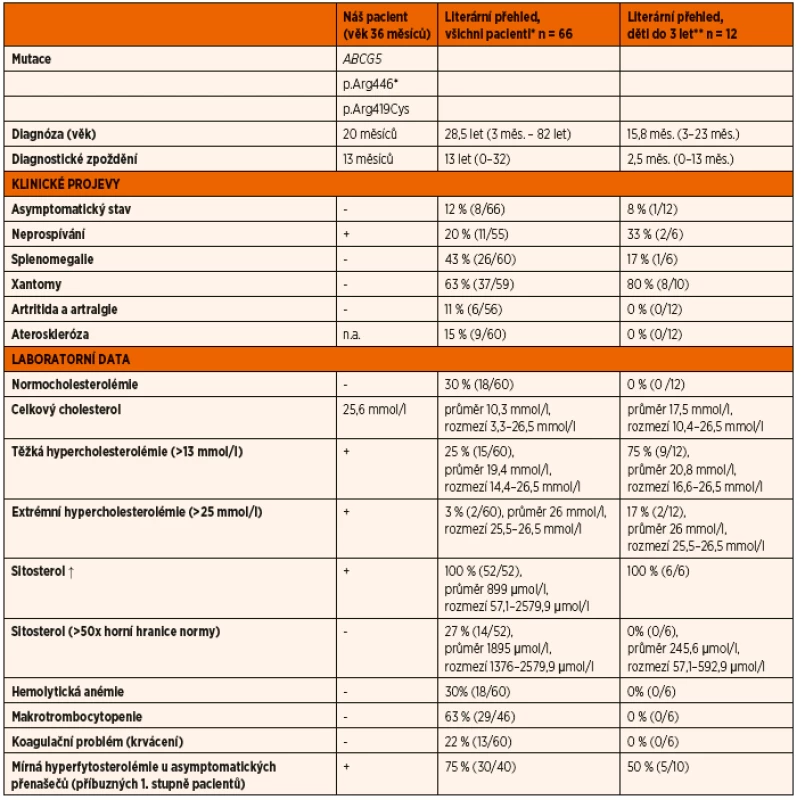
n.a. – nelze aplikovat (nedostupná data) * (5, 9, 11–19, 21–26, 28, 29, 38–48) ** (16, 23–25, 38, 40, 44–46, 49) Xantomy jsou přítomny u více než poloviny pacientů (63 %), obvykle se rozvíjejí před 10. rokem života (ve věku 3 měsíců až 19 let) a jsou často prvním klinickým projevem sitosterolémie [6, 16]. Velmi časté jsou projevy trombocytopenie (63 % případů) a hemolytické anémie (30 % případů), které mohou být rovněž prvními nebo jedinými příznaky sitosterolémie s první manifestací ve věku 3 měsíců až 50 let [16, 17]. Splenomegalie je přítomná u 43 % pacientů se sitosterolémií. Bolesti kloubů a artritidy se vyskytují u 11 % pacientů, první projevy jsou popsány mezi 1. a 23. rokem života [18, 19]. K postižení kloubů dochází vlivem ukládání xantomatózních plaků v kloubech, popsán je i nález spinálních xantomů, způsobujících kompresi míchy [13, 20]. Projevy aterosklerózy má 15 % pacientů se sitosterolémií, a to od těžké aterosklerózy koronárních tepen vedoucí k úmrtí v 5 letech věku po aterosklerózu projevující se tzv. a. subclavia steal syndromem v 50 letech věku s dožitím 82 let. Cévní mozkové příhody při sitosterolémii popisovány nejsou. U 20 % pacientů se sitosterolémií je přítomno neprospívání nebo hmotnostní úbytek (ve věku 19 měsíců až 19 let) ještě před zahájením léčby, u 2 dětských pacientů je neprospívání popsáno až jako důsledek diety. Příčina slabé korelace mezi genotypem a fenotypem není dosud objasněna, významný vliv je přisuzován dietním faktorům [5, 13].
Asymptomatičtí jedinci se sitosterolémií (12 % pacientů) jsou diagnostikováni nejčastěji z řad příbuzných symptomatických pacientů nebo náhodně [13, 14, 20], což vede k domněnce, že prevalence sitosterolémie může být vyšší, než je odhadováno, zejména v menších a uzavřenějších populacích (prevalence sitosterolémie 0,3 % u obyvatel ostrova Kosrae v Mikronésii s nosičstvím mutace v ABCG8 u 14 % dospělé populace; 4 % přenašečů v populaci Amish a 8 % přenašečů mezi americkými Hutterity) [14, 22].
U našeho pacienta byly i přes těžkou hypercholesterolémii klinické projevy mírné, nebyla přítomna xantelasmata ani xantomy, bolesti kloubů, abnormální krvácivost ani splenomegalie, přítomno bylo pouze neprospívání. Příčinou velmi mírné symptomatologie by mohly být poměrně nízké hladiny fytosterolů v porovnání s ostatními pacienty.
Laboratorní nález
Při sitosterolémii je přítomna výrazně zvýšená hladina fytosterolů, zejména sitosterolu. Hladina sitosterolu může být i více než 30–100násobně nad normou, která je v ČR 6,2–6,8 µmol/l. Průměrná hladina u 52 popsaných případů (tab. 1) byla 899 µmol/l s rozmezím 57,1–2579,9 µmol/l. U výlučně kojených dětí může být hladina fytosterolů v normě nebo jen lehce zvýšená (díky minimálnímu obsahu fytosterolů v mateřském mléce) a k výraznější elevaci dochází až po zavedení komplementární stravy, což může působit diagnostické obtíže [6, 20]. Náš pacient měl ve věku 19 měsíců při 80% výživě mateřským mlékem hladinu sitosterolu 86,8 µmol/l, což je druhá nejnižší popsaná hladina u pacienta se sitosterolémií. Hladina fytosterolů u našeho pacienta před léčbou byla dokonce nižší než hladina fytosterolů u většiny pacientů při terapii dietou a ezetimibem či cholestyraminem. Nejnižší hladinu sitosterolu před léčbou (57,1 µmol/l) měla 11měsíční rumunská dívka kavkazského původu s jednou stejnou mutací (p.Arg446*/p.Gln16*) v genu ABCG5, jejíž strava byla také tvořena z 80 % mateřským mlékem [23]. Naproti tomu 15měsíční korejská dívka s jednou stejnou mutací (p.Arg446*/p.Met302Asnfs*82) měla na výživě tvořené z 80 % mateřským mlékem hladinu sitosterolu 466,6 µmol/l a kampesterolu 292,5 µmol/l [6]. Kampesterol a další fytosteroly jsou při sitosterolémii rovněž zvýšeny, avšak nedosahují tak vysokých hodnot jako sitosterol [6]. Kampesterol u našeho chlapce byl 41,5 µmol/l. U našeho pacienta byly zvýšené rovněž hladiny latosterolu a desmosterolu, i když mírněji než u ostatních popsaných případů. U obou rodičů byla mírně zvýšená hladina fytosterolů, což ukazuje na částečnou ztrátu funkce ABCG5/8 i při nosičství jedné patogenní alely. Mírně zvýšené hladiny fytosterolů jsou u asymptomatických přenašečů mezi příbuznými 1. stupně pacientů se sitosterolémií přítomny v 50–75 % případů (tab. 1).
Zatímco u dospělých bývá hladina cholesterolu v normě nebo jen lehce zvýšená, u dětí je většinou hladina cholesterolu výrazně zvýšená, může dosahovat i 40 mmol/l. Hladina cholesterolu u našeho pacienta před léčbou (25,6 mmol/l) je druhou nejvyšší popsanou hodnotou, nejvyšší hypercholesterolémie (39,5 mmol/l) je popsána u 11měsíční rumunské dívky s jednou stejnou mutací [23]. Příčina hypercholesterolémie u dětí se sitosterolémií není dosud objasněná, jako možná příčina je zvažován (zejména u kojených dětí) nízký obsah fytosterolů v dietě a nižší hladiny fytosterolů v plazmě/séru. U dospělých pacientů bylo zjištěno, že vysoká hladina zejména kampesterolu a stigmasterolu indukuje supresi syntézy a aktivity LDL receptorů v játrech zprostředkovanou transkripčními faktory SREBP (sterol regulatory element binding protein) [2, 6]. U dospělých osob je také oddělena regulace exprese LDL-R a 3-hydroxy-3-methylglutaryl-CoA reduktázy (HMG CoA), přičemž v játrech dochází ke zvýšení exprese LDL-R při snížení syntézy HMG CoA reduktázy a ostatních enzymů, účastnících se syntézy cholesterolu [16, 24, 25]. Tento mechanismus může být u malých dětí se sitosterolémií díky nízkému příjmu fytosterolů nekompletní, což může vést k vážné hypercholesterolémii [6]. U kojených dětí k extrémním hladinám cholesterolu přispívá také vyšší dietární příjem cholesterolu oproti dětem vyživovaným umělou mléčnou výživou (mateřské mléko obsahuje 90–150 mg cholesterolu na litr, umělá mléčná výživa 0–4 mg/l).
Typické změny v krevním obraze – hemolytická anémie se stomatocytózou a makrotrombocytopenie – souvisí s extrémně zvýšenou hladinou fytosterolů [26, 27]. Jejich přítomnost spolu s odlišnostmi v rodinné anamnéze umožňuje diferenciálně diagnosticky odlišit sitosterolémii od heterozygotní (HeFH) či především homozygotní (HoFH) familiární hypercholesterolémie [5]. Fytosteroly se včleňují do membrány trombocytů, vznikají mikročástice s exponovaným fosfatidylserinem a zvýšeným množstvím povrchově vázaného fibrinogenu při výrazně snížené povrchové expresi jeho receptoru integrinu aIIbb3, dochází ke zvýšené aktivaci Ca-aktivované proteázy calpainu, k úbytku slaminu A (FlnA) a GPIbA kódované α-podjednotky receptoru pro von Willebrandův faktor na povrchu destiček. To vede k tvorbě makrotrombocytů se zhoršenou adhezí a k prodloužení krvácivosti [27, 28]. Stomatocyty vznikají kumulací fytosterolů na vnitřní membráně erytrocytů, přesný mechanismus není znám [27]. Náš pacient neměl hemolytickou anémii ani makrotrombocytopenii, naopak byla přítomna trombocytóza, která je popisována i u 2 dalších pacientů ve věku 3 a 23 měsíců [16]. Příčinou absence hematologických změn u našeho pacienta může být relativně nízká hladina fytosterolů ve srovnání s ostatními případy, vliv by mohl mít i nízký věk – u kojenců a batolat se sitosterolémií jsou i při vysokých hladinách fytosterolů popisovány jen trombocytóza a v 1 případě nižší hladiny hemoglobinu. Hemolytická anémie a makrotrombocytopenie se popisuje až u pacientů ve věku 7 a více let.
Hepatopatii nacházíme u 12 % pacientů, u většiny je přítomna pouze mírná elevace ALT a AST. Pouze ve 2 případech byla popsána těžká hepatopatie, u jednoho pacienta až s cirhózou s nutností transplantace jater a s následným poklesem hladiny fytosterolů na úroveň přenašečů [18].
Diagnostika onemocnění
Diagnóza sitosterolémie by měla být zvážena u všech pacientů s xantomy, xantelasmaty, hemolýzou, makrotrombocytopenií, u pacientů (zejména dětských) s těžkou hypercholesterolémií, dobře reagující na nízkocholesterolovou dietu a sekvestranty žlučových kyselin a nereagující na léčbu statiny, zejména pokud rodiče jsou normocholesterolemičtí, a u pacientů s předčasnou aterosklerózou [2, 5]. Průměrný věk pacientů při prvním záchytu je 15,1 let (3 měsíce až 50 let, medián 13 let), průměrný věk při stanovení diagnózy sitosterolémie je 28,5 let, s rozpětím 3 měsíce až 82 let a mediánem 21,5 let (tab. 1), přičemž diagnostické zpoždění je průměrně 13,3 let (0 měsíců až 32 let, u 31 % pacientů bylo vysloveno podezření na sitosterolémii již při prvním záchytu). Před 3. rokem věku je diagnostikováno 10 % pacientů (celkem 6 dětí ve věku 3–23 měsíců, našemu pacientovi byla sitosterolémie diagnostikována ve věku 20 měsíců).
Genetika
Zatímco u většiny z popsaných případů sitosterolémie v asijské populaci byly detekovány mutace v genu ABCG5, v populaci kavkazského původu dominují mutace v genu ABCG8 [16, 29]. V našem případě byly ale nalezeny u chlapce kavkazského původu dvě mutace v genu ABCG5. Mutace p.Arg446* již byla v souvislosti se sitosterolémií popsaná, a to u 15měsíční korejské dívky a její 5leté sestry [6], u 11měsíční rumunské dívky [23] a rovněž u 10leté íránské dívky, jejího bratra a matky [15]. Varianta p.Arg419Cys u pacienta se sitosterolémií dosud publikována nebyla, ovšem byly popsány jiné dvě mutace postihující stejnou aminokyselinu – p.Arg419His [30] a p.Arg419Pro [3, 31]. Frekvence alely nesoucí variantu p.Arg419Cys je v obecné populaci velmi nízká (na hladině 10-5 (http://exac.broadinstitute.org)) a predikční in silico nástroje označily tuto variantu jako patogenní. Genetická analýza obou rodičů potvrdila, že se u pacienta mutace nachází ve vzájemné pozici trans. Na základě výše uvedených skutečností je možno považovat obě varianty za kauzální pro sitosterolémii u našeho pacienta.
Léčba
Pacienti se sitosterolémií velmi dobře reagují na dietu s omezením příjmu cholesterolu a fytosterolů. Omezit je třeba jak živočišné tuky, tak rostlinné oleje včetně margarínů, obilné klíčky, ořechy, semena, avokádo, ale také měkkýše. Dosažení a především udržení dobré compliance je ovšem často problematické [16]. U našeho pacienta byla compliance od počátku velmi dobrá, avšak i přes přísnou restrikci fytosterolů a cholesterolu v dietě byl pokles jejich hladin v séru nedostačující (cholesterol klesl během 1 měsíce o 19 %, LDL o 21 %, TAG o 10 %, HDL stoupl o 2,3 %, hladiny fytosterolů byly znovu kontrolovány až po 3 týdnech užívání 5 mg ezetimibu). Jak potvrzuje i náš případ, samostatná dietoterapie není při sitosterolémii dostačující [6, 17] k dosažení uspokojivých hladin cholesterolu a fytosterolů, je nutná kombinace s ezetimibem, případně sekvestrantem žlučových kyselin. Lékem první volby je ezetimib, který omezuje internalizaci komplexu NPC1L1-cholesterol (NPC1L1 – Niemann-Pick C1 like 1 transporter) do enterocytu pomocí vezikulární endocytózy. Předmětem výzkumu je rovněž vliv ezetimibu na aminopeptidázu N v enterocytech (APN), zvažována je funkce ezetimibu jako blokátoru endocytózy na membránových mikrodoménách bohatých na cholesterol, mechanismus vlivu APN na střevní absorpci cholesterolu je také předmětem výzkumu [32]. Dalším lékem s velmi dobrým efektem je cholestyramin, který je však často staršími dětmi odmítán a má často nežádoucí gastrointestinální účinky [16]. U malých dětí může být efekt ezetimibu nedostatečný nebo zpomalený – u dospělých se obvykle cholesterolémie normalizuje během 2–8 týdnů léčby [33], u dětí nad 2 roky během několika měsíců [2, 16] a u dětí do 2 let věku je popisován ještě pomalejší efekt [6, 16]. U těchto pacientů je vhodné zvážit kombinovanou léčbu ezetimibem a cholestyramiem [2]. Příčina sníženého efektu ezetimibu u kojenců a batolat není objasněna, v úvahu přichází nezralost glukuronidačního systému [2, 16, 34]. Efekt statinů (inhibitorů HMG CoA reduktázy) je u sitosterolémie obvykle minimální vzhledem k tomu, že aktivita HMG CoA reduktázy je u nich již maximálně snížena [35]. U našeho pacienta došlo k normalizaci cholesterolémie během 13 měsíců léčby ezetimibem. Hladiny fytosterolů poklesly signifikantně, přestože jsou stále zvýšené (sitosterol 4,9x a kampesterol 1,8x nad normou). Doporučeným cílem léčby je dosažení hladiny sitosterolu <1 mg/dL (24,1 µmol/l) [5], přesto jsou terapeutické hladiny fytosterolů u našeho pacienta nejnižší z dosud popsaných případů.
K léčbě projevů, spojených se sitosterolémií, byly v několika případech s částečným úspěchem využity také chirurgické zákroky předtím, než došlo ke stanovení správné diagnózy – částečná resekce ilea vedoucí ke zvýšení střevních ztrát žlučových kyselin [24, 36], splenektomie při splenomegalii a abnormální krvácivosti bez zjištěné příčiny (před stanovením diagnózy) [37]. U jednoho pacienta byla indikována transplantace jater pro těžkou hepatopatii s rozvojem cirhózy. Diagnóza sitosterolémie byla stanovena až po transplantaci, na základě postransplantační úpravy laboratorních parametrů autoři usuzují na to, že rozhodující význam má u sitosterolémie funkce jaterních ABCG5/8, která dokáže kompenzovat nedostatečnou funkci ABCG5/8 v enterocytech [17].
ZÁVĚR
U 3letého chlapce byla potvrzena diagnóza sitosterolémie s dosud nepublikovanou mutací p.Arg419Cys v ABCG5. Jde o první potvrzený případ sitosterolémie v ČR. Po 16 měsících léčby nízkocholesterolovou a nízkofytosterolovou dietou a ezetimibem se téměř normalizovala hladina celkového cholesterolu a LDL cholesterolu, významně poklesla koncentrace fytosterolů.
Podpořeno: MZ ČR – RVO VFN64164, AZV ČR 16-29084A a 15-28277A.
Došlo: 9. 8. 2017
Přijato: 18. 9. 2017
Korespondující autor:
Doc. MUDr. Tomáš Honzík, Ph.D.
Klinika dětského a dorostového lékařství
1. LF UK a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: tomas.honzik@vfn.cz
Zdroje
1. Nghiem-Rao TH, Patel SB. Investigating sitosterolemia to understand lipid physiology. Clin Lipidol 2013; 8 (6): 649–658.
2. Yoo EG. Sitosterolemia: a review and update of pathophysiology, clinical spectrum, diagnosis, and management. Ann Pediatr Endocrinol Metab 2016; 21 : 7–14.
3. Lee MH, Lu K, Hazard S, Yu H, et al. Identification of a gene, ABCG5, important in the regulation of dietary cholesterol absorption. Nat Genet 2001 Jan; 27 (1): 79–83.
4. Dikkers A, de Boer JF, Groen AK, et al. Hepatic ABCG5/G8 overexpression substantially increases biliary cholesterol secretion but does not impact in vivo macrophage-to-feces RCT. Atherosclerosis 2015; 243 : 402–406.
5. Merkens LS, Myrie SB, Steiner RD, et al. Sitosterolemia. Gene Reviews. NCBI Bookshelf online [http://www.ncbi.nim.nih.goc/books//NBK131810/] cit. 3. 5. 2017.
6. Park JH, In Hyuk Ch, Dong Hyun K, et al. Sitosterolemia presenting with severe hypercholesterolemia and intertriginous xanthomas in a breastfed infant: Case report and brief review. J Clin Endocrinol Metab 2014 May; 99 (5): 1512–1518.
7. Escolà-Gil JC, Quesada H, Julve J, et al. Sitosterolemia: Diagnosis, investigation, and management. Curr Atheroscler Rep 2014; 16 : 424.
8. Krásničanová H, Lesný P. Kompendium pediatrické auxologie 2005. 1. vyd. Praha: Mladá fronta, 2013 (CD-ROM).
9. Richards S, Aziz N, Bale S, et al. ACMG Laboratory Quality Assurance Committee: Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015 May; 17 (5): 405–424.
10. Hyanek J, Pehal F, Dubska L, et al. Lathosterol and noncholesterol sterols in routine use for the differentiation and monitoring of dietary and drug induced treatment of hypercholesterolemias in children and adolescents. J Nutr Ther 2014; 3 : 1–12.
11. Wang J, Joy T, Mymin D, et al. Phenotypic heterogenity of sitosterolemia. J Lipid Res 2004; 45 : 2361–2367.
12. Fausto AGC, García JRG, Madero LEWL, et al. Two novel mutations in the ABCG5 gene, c.144 -1G.A and c.1523 delC, in a Mexican family with sitosterolemia. J Clin Lipidol 2016; 10 : 204–208.
13. Beaty TH, Kwiterowich PO Jr, Khoury MJ, et al. Genetic analysis of plasma sitosterol, apoprotein B and lipoproteins in a large Amish pedigree with sitosterolemia. Am J Hum Genet 1986; 38 : 492–504.
14. Sehayek E, Yu HJ, von Bergmann K, et al. Phytosterolemia on the island of Kosrae: founder effect for a novel ABCG8 mutation results in high carreer rate and increased plasma plant sterol levels. J Lipid Res 2004; 45 : 1608–1613.
15. Mannucci L, Guardamagna O, Bertucci P. et al. Beta-sitosterolemia: a new nonsense mutation in the ABCG5 gene. Eur J Clin Invest 2007; 37 : 997–1000.
16. Niu D-M, Kah-Wai CH, Ju-Hui H, et al. Clinical observations, molecular genetic analysis, and treatment of sitosterolemia in infants and children. J Inherit Metab Dis 2010; 33 : 437–443.
17. Melenotte C, Carri A, Serratrice J, et al. Sitosterolemia: A new station in a Mediterranean patient. J Clin Lipidol 2014; 8 : 451–454.
18. Miettinen TA. Phytosterolemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. Eur J Clin Invest 1980; 10 : 27–35.
19. Togo M, Hashimoto Y, Iso-O N, et al. Identification of a novel mutation for phytosterolemia. Genetic analyses of 2 cases. Clin Chim Acta 2009; 401 : 165–169.
20. Liebeskin A, Wilson DP. Sitosterolemia in the Pediatric Population. NCBI Endotext [https://www.ncbi.nlm.nih.gov/books/NBK395586] cit. 6. 6. 2017.
21. Kwiterovich PO Jr, Bachorik PS, Smith HH, et al. Hyperapolipoproteinemia in two families with xanthomas and phyto-sterolemia. Lancet 1981; 1 : 466–469.
22. Chong JX, Ouwenga R, Anderson RL, et al. A population-based study of autosomal-recessive disease-cusing mutations in a founder population. Am J Hum Genet 2012; 91 : 608–620.
23. Rios J, Stein E, Shendure J, et al. Identification by whole-genome resequencing of gene defect responsible for severe hypercholesterolemia. Hum Mol Genet 2010; 19 : 4313–4318.
24. Nguyen LB, Shefer S, Salen G, et al. A molecular defect in hepatic cholesterol biosynthesis in sitosterolemia with xanthomatosis. J Clin Invest 1990 Sep; 86 (3): 923–931.
25. Patel SB, Honda A, Salen G. Sitosterolemia: exclusion of genes involved in reduced cholesterol biosynthesis. J Lipid Res 1998; 39 : 1055–1061.
26. Rees DC, Iolascon A, Carella M, et al. Stomatocytic haemolysis and macrothrombocytopenia (Mediterranean stomatocytosis/macrothrombocytopenia) is the haematological presentation of phytosterolaemia. Br J Haematol 2005; 130 (2): 297–309.
27. Falet H. Sitosterolemia: platelets on high-sterol diet. Blood 2013; 122 (1): 100–108.
28. Kanaji T, Kanaji S, Montgomery RR, et al. Platelet hyperreactivity explains the bleeding abnormality and macrothrombocytopenia in a murine model of sitosterolemia. Blood 2013; 122 (15): 2732–2742.
29. Lu K, Lee M-H, Hazard S, et al. Two genes that map to the STSL locus cause sitosterolemia: genomic structure and spectrum of mutations involving sterolin-1 and sterolin-2, encoded by ABCG5 and ABCG8 respectively. Am J Hum Genet 2001; 69 : 278–290.
30. Wang G, Wang Z, Liang J, et al. A phytosterolemia patient presenting exclusively with macrothrombocytopenia and stomatocytic hemolysis. Acta Haematol 2011; 126 (2): 95–98.
31. Lee MH, Lu K, Patel SB. Genetic basis of sitosterolemia. Curr Opin Lipidol 2001b; 12 (2): 141–149.
32. Ballantyne CM. Clinical Lipidology: A Companion to Braunwald´s Heart Disease. 2nd ed. Elsevier Inc. 2015 : 1–568.
33. Salen G, von Bergmann K, Lütjohann D, et al. Ezetimibe effectively reduces plasma plant sterols in patiens with sitosterolemia. Circulation 2004 Mar 2; 109 (8): 966–971.
34. Davis HR Jr, Zhu LJ, Hoos LM, et al. Niemann-Pick C1 Like 1 (NPC1L1) is the intestinal phytosterol and cholesterol transporter and a key modulator of whole-body cholesterol homeostasis. J Biol Chem 2004 Aug 6; 279 (32): 33586–33592.
35. Salen G, Starc T, Sisk CM, et al. Intestinal cholesterol absorption inhibitor ezetimibe added to cholestyramine for sitosterolemiaand xanthomatosis. Gastroenterology 2006 May; 130 (6): 1853–1857.
36. Nguyen LB, Shefer S, Salen G, et al. The effect of abnormal plasma and cellular sterol content and composition on low density lipoprotein uptake and degradation by monocytes and lymphocytes in sitosterolemia with xanthomatosis. Metabolism 1988 Apr; 37 (4): 346–351.
37. Zhaoyue W, Lijuan C, Yanhua S, et al. Specific macrothrombocytopenia/hemolytic anemia associated with sitosterolemia. Am J Hematol 2014 Mar; 89 (3): 320–324.
38. Berge KE, Tian H, Graf GA, et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2000; 290 (5497): 1771–1775.
39. Bhattacharya AK, Connor WE. Beta-sitosterolemia and xanthomatosis. A newly described lipid storage disease in two sister. J Clin Invest 1974; 53 : 1033–1043.
40. Hubacek JA, Berge KH, Cohen JC, et al. Mutations in ATP-cassette binding proteins G5 (ABCG5) and G8 (ABCG8) causing sitosterolemia. Hum Mutat 2001 Oct; 18 (4): 359–360.
41. Katayama T, Satoh T, Yagi T, et al. 19-year-old man with myocardial infarction and sitosterolemia. Intern Med 2003; 42 : 591–594.
42. Kaya Z, Niu D-M, Yorulmaz A, et al. A Novel mutation of ABCG5 gene in a Turkish boy with phytosterolemia presenting with macrothrombocytopenia and stomatocytosis. Pediatr Blood Cancer 2014; 61 : 1457–1459.
43. Keller S, Prechtl D, Aslanidis CH, et al. Increased plasma plant sterol concentrations and a heterozygous amino acid exchange in ATP binding cassette transporter ABCG5: A case report. Eur J Med Genet 2011; 54: e458–e460.
44. Ono S, Matsuda J, Siato A, et al. Case report: A case of sitosterolemia due to compound heterozygous mutations in ABCG5: clinical features and treatment outcomes obtained with colestimide and ezetimibe. Clin Pediatr Endocrinol 2017; 26 (1): 17–23.
45. Renner C, Connor WE, Steiner RD, et al. Sitosterolemia presenting as pseudohomozygous familiar hypercholesterolemia. Clin Med Res 2016 Jun; 14 (2): 103–108.
46. Tada H, Kawashiri M, Noguchi T, et al. A novel method for determining functional LDL receptor activity in familial hypercholesterolemia: application of the CD3/CD28 assay in lymphocytes. Clin Chim Acta 2009; 400 : 42–47.
47. Webb TN, Ramratnam M, Evans RW, et al. Atherosclerotic renal artery stenosis as a cause of hypertension in an adolescent patient. Pediatr Nephrol 2014; 29 : 1457–1460.
48. Neff AT. Sitosterolemia´s stomatocytosis and macrothrombocytopenia. Blood 2012 Nov; 120 : 4283.
49. Yamamoto T, Matsuda J, Dateki S, et al. Numerous intertriginous xanthomas in infant: A diagnostic clue for sitosterolemia. J Dermatol 2016; 43 : 1340–1344.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Věcný rejstříkČlánek Talasemické syndromy
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Věcný rejstřík
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
- Současné možnosti měření funkce destiček u novorozenců
- Talasemické syndromy
- Talasémie a hemoglobinové varianty u dětí
- Změny obsahu bílkoviny v mateřském mléce po předčasném porodu
- Zevně sekretorická insuficience pankreatu u dětí se syndromem horní mezenteriální arterie – Wilkieho syndrom: následné ovlivnění metodou chirurgického zákroku
- Mozgový absces – zriedkavá, ale závažná infekcia v detskom veku
- Sitosterolémie: klinická, biochemická a molekulárně genetická charakteristika 3letého chlapce s významnou hypercholesterolémií
- Chronický zánět středního ucha v dětském věku
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Talasemické syndromy
- Chronický zánět středního ucha v dětském věku
- Mozgový absces – zriedkavá, ale závažná infekcia v detskom veku
- Talasémie a hemoglobinové varianty u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



