-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hereditární karcinomy štítné žlázy a jejich molekulární diagnostika
Hereditary thyroid carcinoma and its molecular diagnostics
Thyroid carcinoma is the most common malignancy of the endocrine system and its incidence is still growing. The majority of thyroid tumors occur in sporadic form, however, some are inherited in families. The carcinomas can be divided into two groups according to the types of thyroid cells. Medullary thyroid carcinoma is derived from parafollicular C-cells. 20 - 25% of medullary thyroid carcinomas are inherited in multiple endocrine neoplasia type 2 syndromes. Genetic causes are activated by germ-line mutations in the RET proto-oncogene, which are transmitted autosomal, dominantly. At present the routine genetic screening and presymptomatic treatment (i.e. prophylactic total thyreoidectomy) on the basis of genotype-phenotype correlation has already been developed. The second group consists of carcinomas derived from follicular cells of thyroid that can be divided into differentiated (papillary and follicular) and nondifferentiated (anaplastic and poorly differentiated) ones. Also in this group 5-15% of carcinomas are cases of different familial syndromes (Gardner, Cowden, Werner syndromes and Carney complex) or only simple familial papillary thyroid carcinoma. Although the genetic basis of inherited cancer syndromes are mostly known (APC, PTEN, PRKAR1α and WRN genes), the cause of nonsyndromic familial papillary thyroid carcinoma is still under investigation, several predisposition genetic loci are recognized.
Keywords:
Medullary thyroid carcinoma – MEN2 syndrome – thyroid carcinoma – genetics – RET-proto-oncogene
Autoři: Šárka Dvořáková; Eliška Václavíková; Vlasta Sýkorová; Tereza Hálková; Běla Bendlová
Působiště autorů: Oddělení molekulární endokrinologie, Endokrinologický ústav, Praha
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 2, p. 81-86
Kategorie: Přehledový článek
Souhrn
Karcinomy štítné žlázy jsou nejčastější malignitou endokrinního systému a jejich incidence stále vzrůstá. Většina nádorů štítné žlázy se vyskytuje sporadicky, nicméně některé se dědí v rodinách. Podle buněk původu můžeme karcinomy rozdělit na dvě skupiny. Do první skupiny patří medulární karcinom štítné žlázy vycházející z parafolikulárních C-buněk. 20 - 25 % medulárních karcinomů štítné žlázy je dědičných v rámci syndromů mnohočetné endokrinní neoplázie typu 2. Genetickou příčinou jsou aktivující zárodečné mutace v RET proto-onkogenu, které se dědí autozomálně dominantně. V současné době je již zavedeno rutinní genetické testování a presymptomatická léčba v podobě profylaktické totální tyreoidektomie, která je načasována na základě genotypově-fenotypové korelace. Druhou skupinou karcinomů jsou karcinomy pocházející z folikulárních buněk štítné žlázy, které se dále dělí na diferencované (papilární a folikulární) a nediferencované (anaplastický a nízce diferencovaný). I zde je 5-15 % karcinomů dědičných, a to buď v rámci různých dědičných syndromů (Gardnerův, Cowdenův, Wernerův, Carneyho komplex), nebo jen jako samostatný familiární papilární karcinom štítné žlázy. Ačkoliv u dědičných rakovinných syndromů je genetická podstata již většinou známá (APC, PTEN, PRKAR1α a WRN geny), příčina nesyndromického familiárního papilárního karcinomu štítné žlázy se zatím zkoumá, nicméně již bylo objeveno několik slibných genetických lokusů.
Klíčová slova:
medulární karcinom štítné žlázy – MEN2 syndrom - karcinom štítné žlázy – genetika – RET proto-onkogenKarcinomy štítné žlázy, ačkoliv představují jen 1,5 % všech malignit, jsou nejčastější endokrinní malignitou (až 95 % endokrinních malignit). Postihují 3krát častěji ženy než muže a jejich incidence ne ze zcela objasněných příčin neustále výrazně stoupá. Karcinomy štítné žlázy rozdělujeme podle původu buněk, ze kterých jsou odvozeny, na medulární karcinomy štítné žlázy (MTC) vycházející z parafolikulárních C-buněk a na karcinomy odvozené od folikulárních buněk, tedy tzv. nemedulární karcinomy štítné žlázy. Sem patří nejčastější diferencované karcinomy - papilární karcinom (PTC) a folikulární karcinom štítné žlázy (FTC) (schéma 1). Většina diferencovaných karcinomů má poměrně dobrou prognózu, na rozdíl od nediferencovaného anaplastického karcinomu štítné žlázy (ATC), který je ale velmi vzácný (1).
Schéma 1. Diagram rozdělení karcinomů štítné žlázy a jejich poměrné zastoupení. 
Karcinomy štítné žlázy se většinou vyskytují sporadicky, vzácně jako familiární onemocnění. Familiární formy medulárního karcinomu štítné žlázy (FMTC) představují asi 20 - 25 % případů MTC. Familiární medulární karcinom je obvykle součástí mnohočetné endokrinní neoplázie typu 2 (MEN2A, MEN2B), nebo se v rodinách vyskytuje samostatně jako prostý FMTC. Familiární formy nemedulárních karcinomů štítné žlázy (FNMTC) představují 5 - 15 % těchto karcinomů odvozených z folikulárních buněk. Je to velmi heterogenní skupina dědičných onemocnění zahrnující jak tumory asociované s různými syndromy, tak tumory nesyndromické. Ačkoliv genetická podstata familiárních forem MTC je dobře charakterizována, velmi málo je známo o genetických predispozicích k familiárním PTC a FTC.
FAMILIÁRNÍ MEDULÁRNÍ KARCINOM ŠTÍTNÉ ŽLÁZY (FMTC)
Medulární karcinom štítné žlázy (MTC) je vzácný kalcitonin-produkující nádor vycházející z parafolikulárních C-buněk, které pocházejí z neurální lišty. Zatímco většina pacientů s MTC má sporadickou formu, u 20 - 25 % pacientů se vyskytuje forma dědičná, která je klasifikována do tří klinických subtypů – syndromů mnohočetné endokrinní neoplázie typů 2A a 2B (MEN2A a MEN2B) a familiární MTC (FMTC) bez přidružených lézí. U syndromu MEN2A (či též Sippleova syndromu) se v rodinách kromě MTC vyskytuje i feochromocytom a hyperparatyreoidismus. Syndrom MEN2B je kromě MTC spojen též s výskytem feochromocytomu, navíc jsou přítomny další neuroendokrinní charakteristiky včetně slizničních ganglioneuromů a marfanoidního habitu. Feochromocytom bývá bilaterální a vícečetný. Prostá forma FMTC je definována jako výskyt MTC bez dalších lézí u více než 10 příbuzných starších 50 let (tab. 1). Histopatologie dědičných forem MTC je stejná jako u sporadického MTC, s výjimkou bilaterality a mnohočetnosti tumorů (2,3). MTC metastazuje především do plic, jater a kostí.
Tab. 1. Rozdělení subtypů familiárního MTC a jejich klinické projevy. 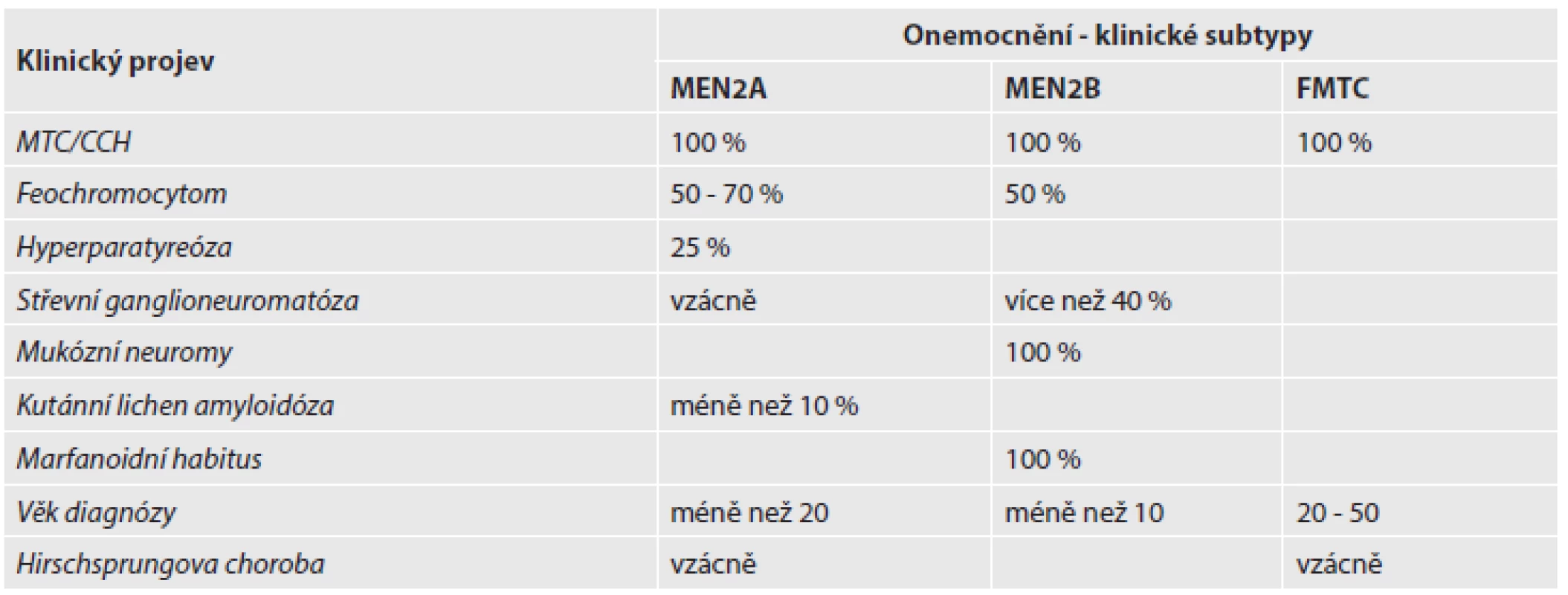
CCH - C-buněčná hyperplázie, FMTC – familiární MTC, MEN2A – mnohočetná endokrinní neoplázie typu 2A, MEN2B - mnohočetná endokrinní neoplázie typu 2B, MTC – medulární karcinom štítné žlázy Vazba familiárních forem MTC s lokusem na 10. chromozom byla popsána již v roce 1990. Brzy nato se ukázalo, že genetickou příčinou dědičných forem MTC jsou zárodečné mutace v RET (REarranged during Transfection) proto-onkogenu, který je lokalizován právě na 10. chromozomu (10q11.2). Tento gen má 21 exonů (60 kb) a kóduje transmembránový tyrozinkinázový receptor s klíčovou úlohou v buněčném růstu, diferenciaci a přežívání buněk. Transkript je dlouhý 5659 párů bází a je překládán do 1114 aminokyselinového proteinu. RET receptor má v extracelulární části čtyři kadherinu podobné domény a doménu bohatou na cystein, dále transmembránovou doménu a v intracelulární části tyrozinkinázovou doménu. Aktivace RET proteinu je velmi přísně regulovaný tkáňově specifický proces. RET stimuluje několik signálních drah, např. MAPK signální dráhu zahajující buněčný cyklus, či PI3K/AKT dráhu, která reguluje buněčnou motilitu a přežívání buněk (4).
Mutace RET genu spojené s MTC jsou aktivující, tzn. že aktivují přenos signálu bez přítomnosti ligandu či jakékoliv další regulace, čímž spustí nádorové bujení. Typ mutace RET genu silně koreluje s klinickými projevy a s agresivitou onemocnění. Familiární formy MTC se dědí autozomálně dominantně s vysokou penetrancí, ale s různou expresivitou. V současné době je známo více než 140 variant RET genu, polovina z nich je patogenních, ostatní jsou buď benigní (polymorfismy) nebo varianty s neznámou funkcí. 98 % mutací v rodinách s MEN2A postihuje 10. a 11. exon (hlavně kodón 634), zatímco u FMTC jsou mutace více rozmístěné v cysteinově bohaté oblasti (10., 11., 13. a 14. exon). Mutace v kodónu 634 koreluje s výskytem feochromocytomu, hyperparatyreoidismu a kutánní lichenoidní amyloidózou. Mutace v 10. a 11. exonu způsobí dimerizaci dvou mutovaných proteinů a tím dochází ke konstitutivní aktivaci RET proteinu bez ohledu na stimulaci ligandem. Mutace v 10. exonu (kodóny 609, 611, 618 a 620) mohou být spojeny i s Hirschsprungovou chorobou, kde naopak tyto mutace působí inaktivačně na nervová ganglia ve střevě. U MEN2B se většina zárodečných mutací nalézá v 16. exonu v kodónu 918 (95 %), méně pak v 15. exonu v intracelulární tyrozinkinázové doméně RET genu. U více než 50 % těchto pacientů s MEN2B dochází k onemocnění v důsledku zárodečných mutací vzniklých de novo. Tyto mutace pravděpodobně mění substrátovou specificitu RET kinázy, způsobující fosforylaci neobvyklých intracelulárních proteinů (5).
Díky tomu, že genetická podstata familiárních forem MTC je již dobře známá, včetně genotypově-fenotypové korelace, využívá se rutinně DNA diagnostika a je možný a dostupný presymptomatický screening jedinců v riziku onemocnění. DNA analýzu se doporučuje provést u rizikových osob co nejdříve. V naší laboratoři provádíme molekulárně-genetické vyšetření jak ze zárodečné DNA z krve tak ze somatické DNA z nádorové tkáně. Nalezení zárodečné mutace v RET genu u pacienta pomůže identifikovat i příbuzné pacienta, kteří mutovanou alelu zdědili a u kterých se s velkou pravděpodobností MTC vyvine. Na základě pozitivního záchytu mutace (i bez přítomnosti jakýchkoliv klinických projevů) je doporučena profylaktická totální tyreoidektomie (TTE). Dle aktuálních mezinárodních doporučení a na základě genotypově-fenotypických korelací byly mutace rozděleny dle své agresivity do skupin s doporučením, v jakém věku pacienta by měla být provedena profylaktická operace, aby zabránila vzniku onemocnění (tab. 2).
Tab. 2. Riziko MTC a načasování profylaktické totální tyreoidektomie podle doporučení ATA (American Thyroid Association) z roku 2009. 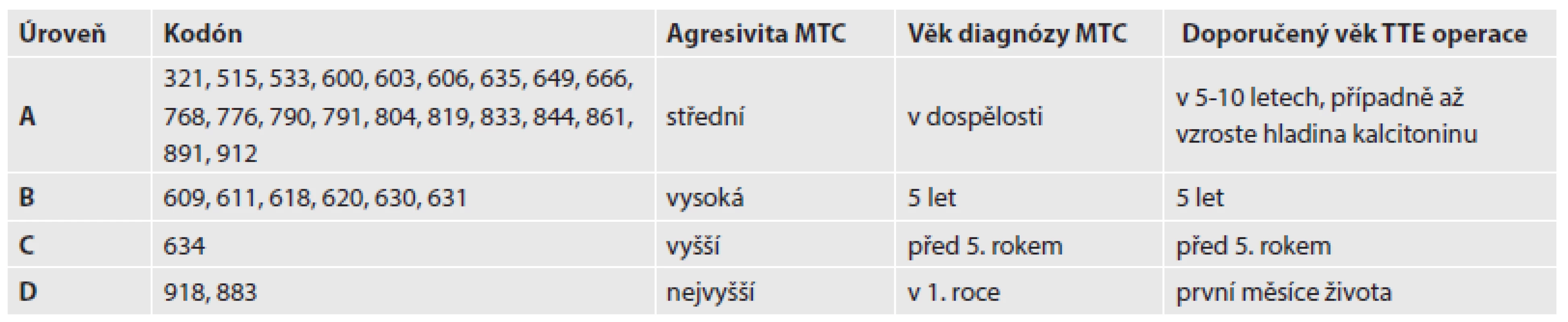
MTC – medulární karcinom štítné žlázy, TTE – totální tyreoidektomie Díky známé genetické příčině bylo také možné vyvinout cílenou léčbu. Nová léčiva působí jako inhibitory tyrozinkináz (TKI) – vandetanib, motesanib, cabozantinib, sorafenib, sunitinib, axitinib, imatinib (6,7). Některá z nich již úspěšně ve světě prošla klinickými testy a jsou uznána jako účinná léčiva pro metastazující a pokročilý MTC (vandetanib a cabozantinib), jiná jsou v různých fázích klinických testů. TKI jsou malé syntetické molekuly, které imitují adenosintrifosfát (ATP), kompetují s ním o vazebná místa tyrozinkinázy a tím inhibují přenos signálu dále do buňky. Buď působí selektivně jen proti určitým tyrozinkinázám nebo jako multikinázové inhibitory. Donedávna při pokročilém nebo metastatickém MTC byla nabízena jen paliativní léčba, protože chemoterapie i radioterapie byly neúčinné. Tato cílená molekulární terapie je určena zejména těmto pacientům. Inhibitory proteinkináz mohou indukovat částečné zlepšení nebo stabilizaci růstu nádoru. Zajímavé je, že je určitá souvislost mezi genetickou změnou v RET proto-onkogenu a účinností léčiva. Např. vandetanib působí lépe na MTC se somatickou mutací Met918Thr, ale naopak hůře se zárodečnou mutací v kodónu 804 RET proto-onkogenu. Naopak sorafenib působí i na nádory s mutací v kodónu 804. Zdá se, že cabozantinib je nejefektivnějším inhibitorem pro MEN2A a vandetanib pro MEN2B pacienty. Tato data potvrzují, jak je důležité znát genetickou podstatu každého MTC, aby mohlo být použito té nejúčinnější specifické léčby podle detekované mutace. Musíme však pamatovat na to, že tyto TKI, které se používají jako chronická terapie, také interagují s fyziologickými funkcemi a způsobují tak mnoho vysoce toxických vedlejších účinků a endokrinních dysfunkcí (8).
FAMILIÁRNÍ NEMEDULÁRNÍ KARCINOM ŠTÍTNÉ ŽLÁZY (FNMTC)
Nemedulární karcinomy štítné žlázy jsou odvozeny z folikulárních buněk a představují 90 % všech nádorů štítné žlázy. Většina PTC a FTC je sporadických, jen asi 5 - 15 % případů je familiárních, kdy 2 a více příbuzných má diagnostikovaný karcinom štítné žlázy. Uvádí se, že FNMTC je agresivnější, mnohočetný, bilaterální, s extratyreoidální invazí, s predispozicí k metastázám do lymfatických uzlin. U familiárních forem bývá onemocnění diagnostikováno v nižším věku, dochází k častější rekurenci onemocnění a doba přežití pacientů je kratší oproti sporadickým případům (9,10).
Familiární formy karcinomů odvozených od folikulárních buněk se dělí na základě klinicko-patologických dat do dvou skupin. První skupinu tvoří FNMTC, které jsou součástí familiárních tumorových syndromů charakterizovaných převahou netyreoidálních nádorů, jako např. zvýšený výskyt FNMTC u rodin postižených familiární adenomatózní polypózou (FAP). Druhou skupinu tvoří familiární nesyndromický PTC, kde mají 3 a více rodinných příslušníků NMTC. Do první skupiny patří Gardnerův syndrom, Cowdenův syndrom, Carneyho komplex, Wernerův syndrom a dále méně známé Pendredův syndrom, syndrom McCune-Albrightové a Peutz-Jeghersův syndrom (tab. 3). Do druhé skupiny patří čistý familiární PTC (fPTC) s nebo bez oxyfilie (Hürthleho buňky), fPTC s papilárním renálním karcinomem, fPTC s polynodózní strumou. Histologický subtyp u FNMTC je hlavně PTC, výjimečně FTC. Ženy mají FNMTC 2-3x častěji než muži. Zajímavé je, že u některých syndromů jsou rozdílné patologické morfologické charakteristiky oproti sporadickým PTC a FTC. Znalost FNMTC a jejich histopatologie může tak dovolit diagnostikovat určitý familiární nádorový syndrom.
Tab. 3. Rozdělení a charakteristika syndromických FNMTC. 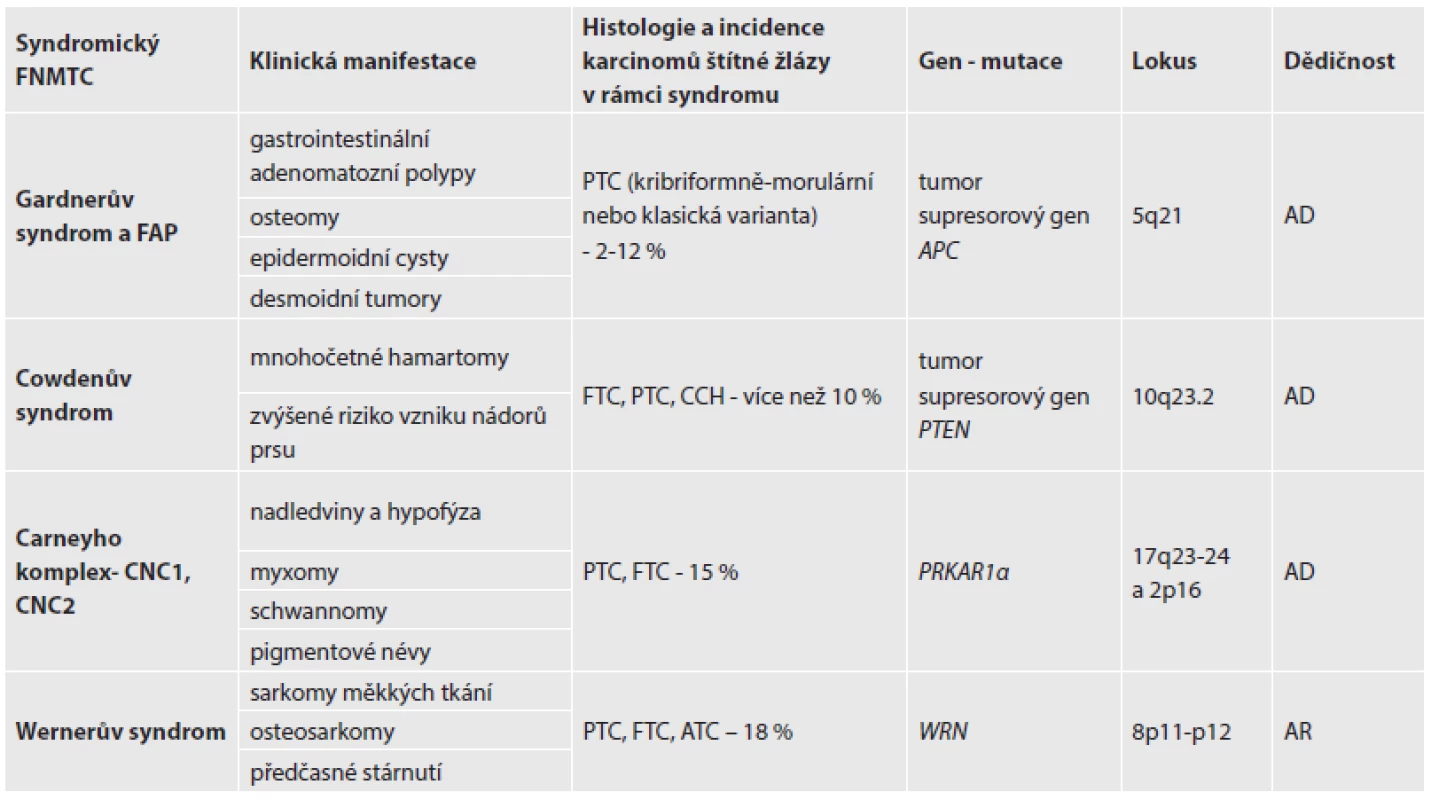
AD – autozomálně dominantní, APC – adenomatózní polypózní coli, AR – autozomálně recesivní, CCH – C-buněčná hyperplázie, FAP – familiární adenomatózní polypóza, FTC – folikulární karcinom štítné žlázy, PRKAR1α – regulační podjednotka typu 1 alfa proteinkinázy A, PTC – papilární karcinom štítné žlázy, PTEN – fosfatázový a tenzinový homolog, WRN – Werner Genetické příčiny FNMTC syndromů nejsou tak dobře definovány jako u MTC. Mnoho pacientů s těmito syndromy má susceptibilní geny, které zvyšují riziko vzniku karcinomu štítné žlázy. Bylo nalezeno několik predispozičních lokusů s vysokým stupněm genetické heterogenity. Screening FNMTC může dovolit včasnější detekci, správnou léčbu a zlepšit další péči o pacienty a jejich rodiny. Na druhou stranu familiární predispozice pro FNMTC a jejich molekulárně genetická charakteristika je teprve na začátku zkoumání (11).
Syndromický FNMTC
Gardnerův syndrom
Gardnerův syndrom je vzácné hereditární nádorové onemocnění. Jedná se vlastně o variantu daleko častější familiární adenomatózní polypózy (FAP), což je autozomálně dominantně dědičný syndrom, pro nějž je typický výskyt gastrointestinálních adenomatozních polypů. Pacienti mají ve střevě a rektu tisíce adenomů, které mohou přecházet do kolorektálních karcinomů, dále mají gastrické polypy a polypy v duodenu. U Gardnerova syndromu bývají navíc přítomny i manifestace mimo intestinální trakt, jako osteomy, dentální abnormality, epidermoidní cysty, desmoidní tumory, kongenitální hypertrofie retinálního pigmentu, hepatoblastom, meduloblastom a papilární karcinom štítné žlázy. PTC se rozvine asi u 2 - 12 % pacientů s FAP, přičemž rizikovou skupinou pro vznik PTC jsou hlavně mladé ženy do 35 let, u nichž je riziko PTC až 160x vyšší než u běžné populace. Riziko syndromického PTC u pacientů s FAP je asi 10x vyšší než je riziko vzniku sporadického PTC u běžné populace. PTC u pacientů s FAP bývá bilaterální, multifokální a vzniká v nižším věku. Histologicky se od sporadických PTC liší - je přítomna kribriformní (morulární) varianta PTC, která je velmi vzácná u sporadického PTC (0,1 - 0,2 %), ale velmi častá právě u pacientů s FAP (90 %). Tento typ PTC jen vzácně metastazuje a prognóza je příznivá. Avšak celková prognóza pacientů s tímto syndromem, i přes velké preventivní úsilí lékařů, není dobrá, riziko malignity je vysoké a málokdo se dožije více než 50 let věku.
Příčinou FAP a tedy i Gardnerova syndromu je nepatřičná aktivace Wnt signalizační dráhy způsobená nejčastěji zárodečnými či somatickými mutacemi v tumor supresorovém genu APC (adenomatous polyposis coli) (5q21), méně často mutacemi genu kódujícího β-katenin, který je klíčový pro přenos Wnt signálu do buněčného jádra. Wnt signalizace se podílí na procesech jako je dělení, diferenciace, migrace a apoptóza buněk a hraje významnou roli zejména v embryonálním vývoji. APC gen je ubikvitárně exprimovaný v normální tkáni a je negativním regulátorem Wnt signalizační dráhy. Při aktivaci této dráhy nedochází k degradaci β-kateninu v cytoplazmě, ale β-katenin se přesouvá do jádra a aktivuje transkripci cílových genů. Mutace APC genu vedou ke vzniku zkráceného proteinu, který postrádá vazebné místo pro β-katenin a tak β-katenin nemůže být degradován. Inaktivací tumor supresorového genu APC dochází mimo jiné k iniciaci kolorektální neoplázie. Kolorektální tumory s intaktním APC genem obsahují naopak aktivační mutace β-kateninu měnící funkčně fosforylační místa. Byla popsána řada různých typů zárodečných mutací v genu APC a zajímavé je, že u pacientů, u kterých se rozvinul PTC, se vyskytují jiné mutace APC genu než u pacientů bez PTC (12).
Cowdenův syndrom
Cowdenův syndrom je komplexní choroba, charakterizovaná mnohočetnými hamartomy. Cowdenův syndrom se u 90 % jedinců manifestuje do 20 let věku, během třetí dekády života se u většiny pacientů vyvíjejí kožní léze (13). Typické jsou právě kožní a slizniční projevy (hamartomatózní léze, papilomy rtů a sliznic, aj.), někdy je přítomna makrocefalie, tricholemomy, hamartomy prsu a střeva. Pacienti mají zvýšené riziko vzniku karcinomu prsu, dělohy a štítné žlázy (FTC či PTC). Postižení štítné žlázy je diagnostikováno až u dvou třetin pacientů, vyskytují se zde benigní i maligní onemocnění, převládá folikulární adenom nebo polynodózní struma (50 - 67 %), FTC (10 - 15 %), méně často je diagnostikován PTC. Nádory jsou multifokální a bilaterální. Protože je syndrom spojen s vysokou incidencí tyreoidální patologie, je nutný sonografický screening štítné žlázy a někdy i doporučení profylaktické TTE.
Příčinou onemocnění jsou mutace v tumor supresorovém genu PTEN (fosfatázový a tensinový homolog), který je lokalizován na 10. chromozomu (10q23.2). Autozomálně dominantní dědičné zárodečné mutace jsou detekovány u 80 - 85 % pacientů, kompletní ztrátu exprese genu PTEN vykazuje 63 % pacientů a 38 % heterozygotní ztrátu exprese genu PTEN.
Carneyho komplex
Carneyho komplex je autozomálně dominantní dědičný syndrom klinicky charakterizovaný mnohočetnými myxomy, kožními a slizničními pigmentovými lézemi (lentiginózní pigmentace a epiteloidní modré névy). Mimokožní příznaky zahrnují srdeční myxomy, schwannomy, ale i postižení endokrinních orgánů (postižení nadledvin, hypofýzy, štítné žlázy, varlat) či zažívacího traktu. Mezi pacienty jsou velké rozdíly v expresivitě různých symptomů (14). Z endokrinologických abnormalit jsou nejčastěji diagnostikovány primární Cushingův syndrom (hyperkorticismus) a akromegalie (adenom hypofýzy secernující růstový hormon). Riziko tumoru štítné žlázy je nízké, avšak přítomnost tyreoidálního uzlu je velmi častá, hlavně jsou nalézány mnohočetné adenomatozní uzly a folikulární adenomy. Karcinomy štítné žlázy, a to PTC nebo FTC, se vyskytují asi u 15 % pacientů s Carneyho komplexem (11).
Carneyho komplex je i geneticky heterogenním onemocněním. Většina případů je klasifikována jako typ 1 (CNC1) a je spojena s mutací genu kódujícího regulační podjednotku proteinkinázy A typu 1α (PRKAR1α) (17q22-24). U typu 2 (CNC2) se nachází mutace na chromozomu 2p16, kde ještě nebyl identifikován kandidátní gen, ale předpokládá se, že je tam kódován regulátor genomové stability (15). PRKAR1α gen obsahuje 11 exonů a bylo nalezeno již 117 různých mutací rozmístěných po celém tomto genu. Jde o heterozygotní inaktivující zárodečné bodové mutace či malé delece. Tyto mutace vedou k tvorbě kratšího defektního proteinu a sekundární somatická změna nalézána v nádoru je ztráta normální alely, proto se PRKAR1α gen řadí k tumor supresorovým genům. Avšak ve 20 % familiárních CNC nejsou tyto mutace nalézány. U nich byly nově detekovány zárodečné inaktivující mutace ve dvou fosfodiesterázových genech PDE8B (5. chromozom) a PDE11A (2. chromozom), které redukují enzymovou aktivitu těchto fosfodiesteráz a tím zvyšují produkci cAMP a aktivují ubikvitární signální dráhu proteinkinázy A regulující různé buněčné funkce, mimo jiné proliferaci a diferenciaci buněk.
Wernerův syndrom
Wernerův syndrom patří mezi syndromy předčasného stárnutí (adultní progerie). Je to autozomálně recesivní onemocnění pojivové tkáně. Pacienti mívají sarkomy měkkých tkání a osteosarkomy. První projevy nemoci bývají patrné v pubertě, typicky se syndrom rozvíjí ve 3. dekádě života. Pacienti mají choroby vyššího věku jako diabetes, osteoporózu, vaskulární nemoci či maligní tumory. U 18 % pacientů s Wernerovým syndromem se rozvine maligní onemocnění štítné žlázy (PTC a FTC). Pacienti mají 3x větší riziko FTC a 6x větší riziko ATC, proto se doporučuje sonografický screening těchto pacientů.
U pacientů s Wernerovým syndromem jsou mutace nalézány ve WRN genu (8p11-p12). Tento gen kóduje protein, který je DNA helikázou a zároveň má i exonukleázovou aktivitu. Je důležitý při opravách a replikacích DNA. Vlivem mutací pravděpodobně dochází k vytvoření nestabilního genomu. Uvažuje se i o vlivu helikázy na tvorbu inaktivních forem telomeráz, které slouží k ochraně konečných částí chromozomů (16).
Nesyndromický FNMTC
FNMTC je nyní samostatná klinická jednotka a zahrnuje všechny familiární karcinomy štítné žlázy pocházející z folikulárních buněk bez dalších symptomů a bez známých příčin ze životního prostředí (radiační expozice krku či jodový deficit). Tyto familiární formy představují 3 - 10 % všech karcinomů štítné žlázy. Pacienti mají nižší věk při stanovení diagnózy, karcinomy jsou bilaterální, mnohočetné, mohou být zdánlivě smíšené PTC a FTC a mají horší prognózu než sporadické. Diagnóza je stanovena jen na základě rodinné historie, kde 3 a více příbuzných členů rodiny má karcinom štítné žlázy v nepřítomnosti dalšího symptomu. Na familiární predispozici také může ukazovat diagnóza PTC u mužů a u dětí. Příbuzní jsou ve zvýšeném riziku vzniku i benigního onemocnění včetně folikulárního adenomu, Hashimotovy tyreoiditidy a polynodózní strumy.
Je to geneticky heterogenní skupina. Onemocnění se pravděpodobně dědí autozomálně dominantně s nekompletní penetrancí a variabilní expresivitou. Nejspíše se nejedná o postižení jednoho genu, ale o polygenní etiologii. Hledání genetických susceptibilních lokusů u FNMTC začalo zhruba před 10 lety. U samostatného familiárního PTC je zajímavé, že na rozdíl od sporadických PTC není nalézána somatická mutace genu BRAF. Zatím bylo objeveno několik kandidátních genů a potenciálních lokusů, většinou se jedná o ojedinělé záchyty v rodinách. Některé mutace a polymorfismy těchto genů pravděpodobně hrají roli i u sporadických forem (např. FOXE1). Vazebné analýzy identifikovaly 3 různé chromozomální regiony, které mohou nést susceptibilní gen pro FNMTC (tab. 4) (17).
Tab. 4. Rozdělení nesyndromického FNMTC a kauzální geny. 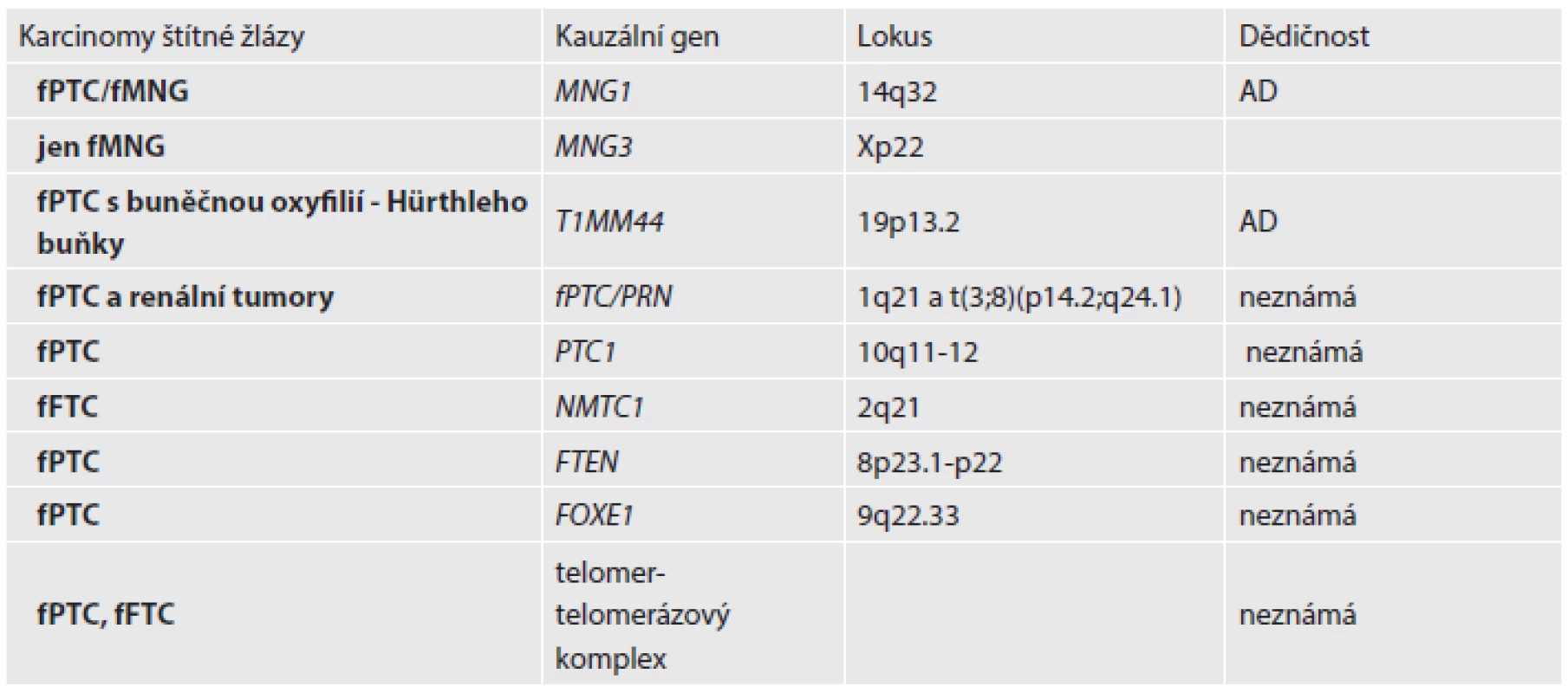
PTC – papilární karcinom štítné žlázy, FTC – folikulární karcinom štítné žlázy, AD – autozomálně dominantní, MNG – polynodózní struma, T1MM44 - translokáza vnitřní mitochondriální membrány homolog 44 Existují také familiární formy nádorů štítné žlázy s Hürthleho buňkami. Hürthleho buňky, nebo-li onkocyty, či oxyfilní buňky, jsou charakterizovány cytoplazmatickou akumulací nadbytečných mitochondrií s abnormální morfologií. Nádory jsou multifokální a jsou spojeny s nižším věkem diagnózy. V rámci jedné rodiny jsou nalézány benigní i maligní tumory. Téměř všechny histologické typy benigních a maligních nádorů štítné žlázy mají i varianty s Hürthleho buňkami. Pouze u ATC není popsána tato varianta, pravděpodobně kvůli rychlému dělení buněk, které neumožňuje akumulaci mitochondrií. Zdá se, že dědičnost onkocytárních nádorů je autozomálně dominantní. Za onemocnění je zodpovědný specifický lokus na 19. chromozomu (19p13.2), v němž se pravděpodobně nachází tumor supresorový gen. Ze 14 kandidátních genů v tomto regionu byly nalezeny 2 nové varianty TIMM44 (translokáza vnitřní mitochondriální membrány homolog 44). Dále jsou nalézány mutace a delece v mitochondriální DNA kódující proteiny oxidativní fosforylace (OXPHOS) (18).
ZÁVĚR
Familiární formy karcinomů štítné žlázy (FMTC a FNMTC) jsou vzácná onemocnění a představují jen zlomek v celkové incidenci karcinomů štítné žlázy. Důležité je poznat genetickou podstatu těchto nádorových onemocnění, nejen z hlediska objasnění patogeneze, ale také proto, aby mohl být nabídnut molekulárně genetický screening pro rodinné příslušníky a případně určena vhodnost profylaktické totální tyreoidektomie pro osoby v riziku. V tomto ohledu je FMTC unikátním modelem pro včasnou prevenci a léčbu nádorů. Odhalením RET proto-onkogenu a zavedením rutinního genetického testování mutací RET genu u MTC pacientů se povedlo zlepšit a individualizovat léčbu těchto pacientů. Včasný profylaktický zákrok u rizikových osob s detekovanou aktivující mutací RET genu zabrání rozvoji nádorového onemocnění. Bohužel toto není zatím možné nabídnout u FNMTC, kde molekulární genetická analýza je teprve v začátcích. Zatím je klasifikace FNMTC založena na klinicko-patologických datech, ze kterých pak vychází molekulární genetika a hledá vhodné kandidátní geny a lokusy. Díky masivnímu zavádění nových technologií v DNA analýze (např. sekvenování nové generace) lze předpokládat, že brzy budou objeveny další rizikové molekulární markery a bude možné zpřesnit klinickou diagnostiku a nabídnout také cílenou léčbu pro tyto rodiny i v podobě profylaktické totální tyreoidektomie. Pak by bylo možné zavést obdobný management léčby u FNMTC jako u FMTC.
Grantová podpora:
Práce byla podpořena granty IGA MH CZ NT/13901-4 a MH CZ 00023761.
Adresa pro korespondenci:
RNDr. Šárka Dvořáková, Ph.D.
Oddělení molekulární endokrinologie
Endokrinologický ústav
Praha 1, 11694
tel.: 224905301, fax: 224905325
e-mail: sdvorakova@endo.cz
Zdroje
1. Bendlová B, Dvořáková Š, Sýkorová V, Václavíková E, Hálková T. Nádory štítné žlázy – molekulárně genetické příčiny a možnosti cílené léčby. Čas Lék čes 2012; 151 : 123-127.
2. Lodish M. Multiple endocrine neoplasia type 2. In: Stratakis CA, ed. Endocrine Tumor Syndromes and Thein Genetics. Bethesda, Md.: Frontiers of Hormone Research, editor AB Grossman, vol. 41, 2013 : 16-29.
3. Moore SW, Zaahl M. The Hirschsprung‘s-multiple endocrine neoplasia connection. Clinics (Sao Paulo) 2012; 67 Suppl 1 : 63-67.
4. Wagner SM, Zhu S, Nicolescu AC, Mulligan LM. Molecular mechanisms of RET receptor-mediated oncogenesis in multiple endocrine neoplasia 2. Clinics (Sao Paulo) 2012; 67 Suppl 1 : 77-84.
5. Raue F, Frank-Raue K. Genotype-phenotype correlation in multiple endocrine neoplasia type 2. Clinics (Sao Paulo) 2012; 67 Suppl 1 : 69-75.
6. Schlumberger M, Massicotte MH, Nascimento CL, Chougnet C, Baudin E, Leboulleux S. Kinase inhibitors for advanced medullary thyroid carcinoma. Clinics (Sao Paulo) 2012; 67 Suppl 1 : 125-129.
7. Bendlová B, Dvořáková Š, Sýkorová V, Hálková T, Václavíková E. Genetika nádorů štítné žlázy a jejich molekulárně cílená léčba. Onkologie 2011; 5(6): 325-328.
8. Ferreira CV, Siqueira DR, Ceolin L, Maia AL. Advanced medullary thyroid cancer: pathophysiology and management. Cancer Manag Res 2013; 5 : 57-66.
9. Imyanitov EN, Byrski T. Systemic treatment for hereditary cancers: a 2012 update. Hered Cancer Clin Pract 2013; 11(1): 2.
10. Albright F, Teerlink C, Werner TL, Cannon-Albright LA. Significant evidence for a heritable contribution to cancer predisposition: a review of cancer familiality by site. BMC Cancer 2012; 12 : 138.
11. Nosé V. Familial thyroid cancer: a review. Mod Pathol 2011; 24 Suppl 2: S19-S33.
12. Mazeh H, Sippel RS. Familial nonmedullary thyroid carcinoma. Thyroid 2013; 23(9): 1049-1056.
13. Morrison PJ, Atkinson AB. Genetic aspects of familial thyroid cancer. Oncologist 2009; 14(6): 571-577.
14. Kacerovská D, Michal M, Šíma R, Grossmann P, Kazakov DV. Carneyho komplex. Cesk Patol 2011; 47(4): 192-197.
15. Espiard S, Bertherat J. Carney Complex. In: Stratakis CA, ed. Endocrine Tumor Syndromes and Thein Genetics. Bethesda, Md.: Frontiers of Hormone Research, editor AB Grossman, vol. 41, 2013 : 50-62.
16. Son EJ, Nosé V. Familial follicular cell-derived thyroid carcinoma. Front Endocrinol (Lausanne) 2012; 3 : 61.
17. Bauer AJ. Clinical behavior and genetics of nonsyndromic, familial nonmedullary thyroid cancer. In: Stratakis CA, ed. Endocrine Tumor Syndromes and Their Genetics. Bethesda, Md.: Frontiers of Hormone Research, editor AB Grossman, vol. 41, 2013 : 141-148.
18. Máximo V, Lima J, Prazeres H, Soares P, Sobrinho-Simões M. The biology and the genetics of Hurthle cell tumors of the thyroid. Endocr Relat Cancer 2012; 19(4): R131-R147.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2014 Číslo 2-
Všechny články tohoto čísla
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Pokroky v aplikované molekulární patologii a prediktivní diagnostice (1.)
- Je třeba hájit zájmy patologie!
- MONITOR aneb nemělo by vám uniknout, že...
- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Molekulární patologie plicních karcinomů
- Gastrointestinální stromální tumor (GIST): pokroky do roku 2013
- Doc. MUDr. Ľudovít Lauko, CSc. sedemdesiatročný.
- Hereditární karcinomy štítné žlázy a jejich molekulární diagnostika
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
- Využití archivovaných parafínových bločků s formalinem fixovanou tkání (FFPE) pro molekulárně genetickou analýzu u difuzního velkobuněčného lymfomu (DLBCL)
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



