-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
How to improve the histopathological diagnosis of hepatocellular benign affections (adenoma versus focal nodular hyperplasia) in daily practice?
Adenomas of the liver and focal nodular hyperplasia (FNH) are benign hepatocellular affection and their distinguishing in a needle biopsy sample and sometimes also in a surgical specimen causes often a problem. Although it might seem that the differentiation of the benign conditions is of a low value for the clinicians and also for the patients, the opposite is true. The risk of life-threatening bleeding and risk of the malignant transformation of adenomas leads to request accurate diagnosis of these conditions. New genetic methods followed by immunohistochemical detection of several antigens enables more accurate distinction not only of the two main groups of FNH and adenomas, but allows also to distinguish subsets of adenomas with varying risk of malignant transformation. Therefore, to determine the subtype of adenoma represents now essential part of a biopsy diagnosis. Identification of the subsets of adenomas allows an individualized treatment with resection in high-risk forms and, on the other hand, allows avoiding liver resection in the case of small liver mass with a low risk of malignant transformation.
Keywords:
liver adenoma – FNH – histopathology – malignant transformation
Autoři: Eva Honsová 1; Alena Lodererová 1; Halima Gottfriedová 2
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha 1; Klinika hepatogastroenterologie, Transplantcentrum IKEM, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 4, p. 149-152
Kategorie: Přehledový článek
Souhrn
Adenomy jater a fokální nodulární hyperplazie (FNH) představují benigní hepatocelulární afekce jater a jejich rozlišení v jehlové biopsie a někdy i v resekátu bývalo často velmi problematické. Přestože by se mohlo zdát, že rozlišování benigních afekcí nemá pro klinika a tím i pro pacienta valný význam, opak je pravdou. Riziko život ohrožujícího krvácení a riziko maligního zvratu u adenomů vede k požadavku přesné diagnostiky těchto afekcí. Využití genetických metod a na ně navazujících imunohistochemických průkazů umožňuje nejen přesnější odlišení obou hlavních skupin FNH a adenomů, ale dovolí i odlišit podskupiny adenomů s různým rizikem maligního zvratu. Proto je v současnosti určení subtypu adenomu nezbytnou součástí bioptické diagnózy. Identifikace podskupiny následně umožňuje individualizovanou léčbu s resekcí u vysoce rizikových forem a na druhé straně umožňuje rozhodnutí vyhnout se resekci jater v případě malého ložiska s nízkým rizikem maligní transformace.
Klíčová slova:
adenom jater – fokální nodulární hyperplazie – histopatologie – maligní transformaceMezi benigní hepatocelulární afekce jsou zařazovány adenomy a fokální nodulární hyperplasie (FNH). Oba typy lézí se ve velké většině případů vyvíjejí v jinak normálních játrech. V posledních letech byly upřesněny molekulárně genetické charakteristiky obou afekcí, které významně zlepšily morfologickou diagnostiku a zpřesnily odlišení těchto lézí nejen na úrovni zobrazovacích metod, ale i v resekátech a jehlových biopsiích (1,2).
Hepatocelulární adenomy byly podle fenotypu, který odpovídá molekulárním charakteristikám, rozčleněny do 4 skupin. O klasifikaci přednesené v rámci Evropského kongresu v září 2012 v Praze orientačně už informoval v tomto časopise prof. Ehrmann (3). Jednotlivé subtypy se liší rizikem maligního zvratu, proto je v současnosti určení subtypu nezbytnou součástí bioptické diagnózy. Identifikace podskupiny následně umožňuje individualizovanou léčbu s resekcí u vysoce rizikových forem a na druhé straně umožňuje rozhodnutí vyhnout se resekci jater v případě malého ložiska s nízkým rizikem maligní transformace.
Klasická FNH není již od 80. let považována za nádor, spíše se zdá, že jde o odpověď jaterní tkáně na arteriální malformaci, která představuje vývojovou vrozenou anomálii (4).
HEPATOCELULÁRNÍ ADENOM
Hepatocelulární adenomy (HCA) jsou poměrně vzácné nádory jater, které se nejčastěji objevují u žen v produktivním věku s déle trvajícím užíváním antikoncepce. Před érou používání hormonální antikoncepce šlo o prakticky neznámé tumory. Na tento vztah poprvé upozornil Baum v r. 1973 a poté ho ověřilo několik dalších studií (5). Dalšími rizikovými faktory především u mužů jsou obezita a diabetes mellitus (DM) a také užívání anabolických steroidů. Vyšší riziko vzniku HCA mají též pacienti s některými vzácnými metabolickými poruchami, jako je glykogenóza, tyrosinemie nebo galaktosemie.
HCA tvoří obvykle solitární ložisko různých rozměrů od několika milimetrů po 15 i 30 cm. Většina tumorů je dnes objevena náhodně, během vyšetření z nejrůznějších jiných důvodů. Komplikace HCA mohou být velmi závažné, včetně život ohrožujících stavů zvl. u tumorů větších než 5 cm. Jde jednak o krvácení do tumoru a okolní jaterní tkáně (nádor nemá vazivové pouzdro) a protože cca 10 % nádorů je pendulujících může být krvácení následováno rupturou s hemoperitoneem. Podceňovat nelze ani maligní zvrat, který se v různých studiích pohybuje okolo 15 % případů. Pacienti s HCA jsou obvykle mladí, v produktivním věku a rozhodování o terapeutickém přístupu není vždy jednoduché. Většina center resekuje adenomy větší než 4 - 5 cm, pokud to dovolují anatomické poměry, a dále adenomy u žen plánujících graviditu, protože chování adenomů v graviditě je nepredikovatelné a případná ruptura je zatížena více než 50% mortalitou pro matku i pro plod. Další problematickou oblast představují vícečetné HCA, kde terapeutické rozhodování je ještě komplikovanější, zvl. jsou-li postiženy oba jaterní laloky; arbitrárně jsou případy, kde je ložisek nad 10 klasifikovány jako tzv. adenomatóza.
Makroskopický a mikroskopický obraz
Makroskopicky adenomy tvoří uzly různé velikosti, nažloutlé tříslovité barvy, odlišující se od okolní tkáně, ale neohraničené vazivovým pouzdrem.
Na úrovni HE jsou HCA charakterizovány trámci hepatocytů bez plně vyvinutých portálních polí, tj. bez žlučovodů. V okrscích vaziva leží anomální svalové arterie a někdy též žilní větve, event. tenkostěnné cévy (obr. 1). Uspořádání hepatocytů je v jedno nebo dvouřadých trámcích, klasické žlučovody chybějí, ale duktulární proliferace může být přítomná (obr. 2). Hepatocyty mají různý stupeň steatózy, ve tkáni je různý stupeň zánětlivé celulizace a dilatace sinusů.
Obr. 1. Adenom jater. Svalová arterie mimo portální pole obklopená řídkou smíšenou zánětlivou celulizací (HE, objektiv 40x). 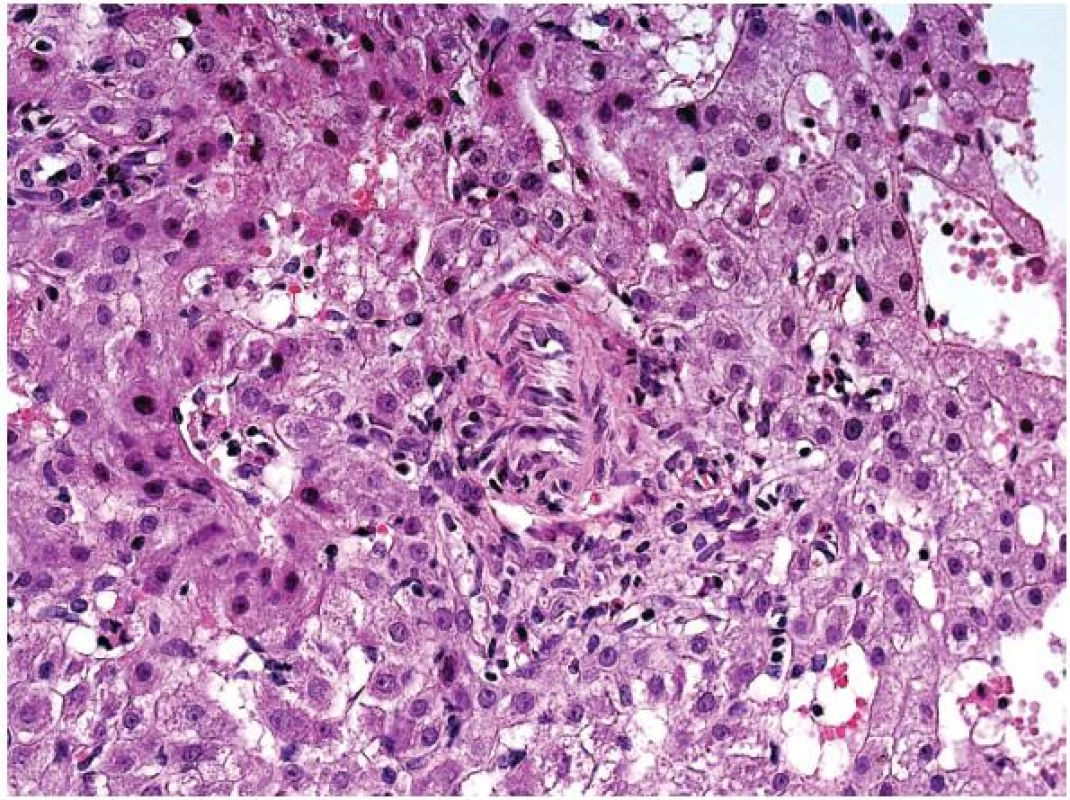
Obr. 2. Adenom jater. Skupina silnostěnných cév v jaterní tkáni mimo portální pole. Fokálně duktulární proliferace malého rozsahu (šipky). Chybí žlučovod, který by v normálním port. poli odpovídal kalibrem arterii (Srel, objektiv 40x). 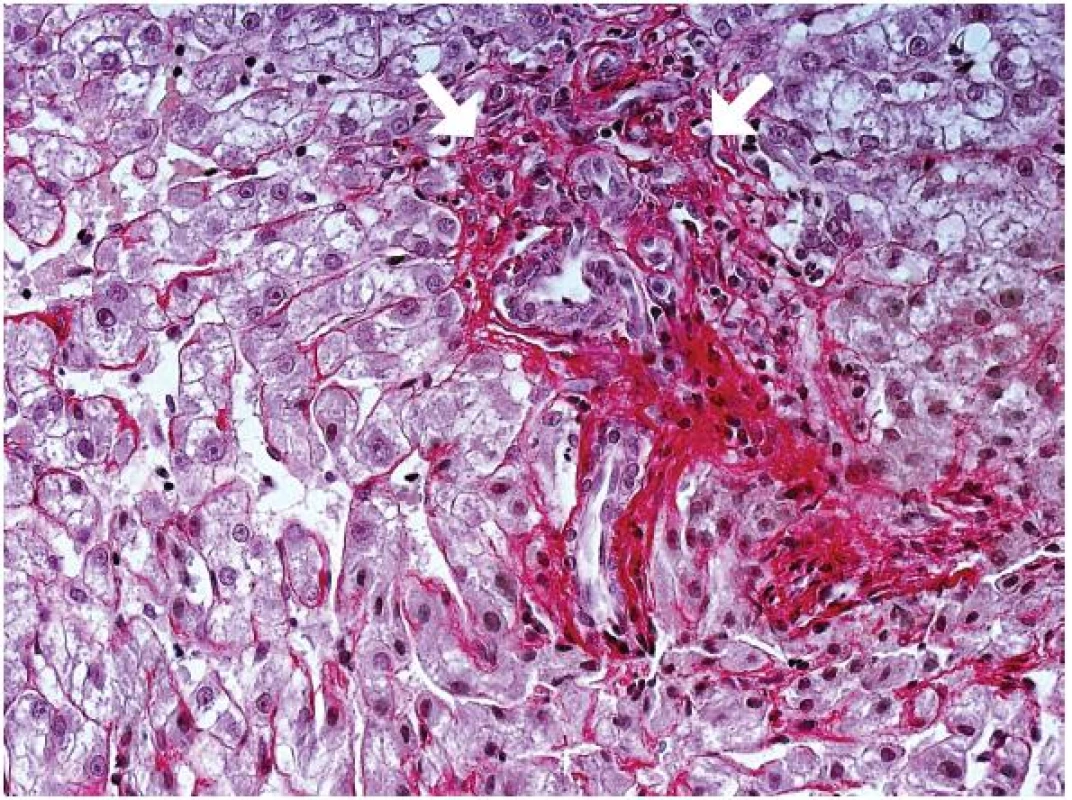
Molekulární klasifikace HCA vedla k vytvoření 4 subtypů, které se liší morfologickými i klinickými charakteristikami, včetně rizika maligního zvratu (6-7). Současně lze tyto tumory klasifikovat s využitím imunohistochemie bez přímého použití molekulárních metod.
GENOTYPICKÁ KLASIFIKACE HCA
Skupina 1: HNF1α inaktivovaný HCA (H-HCA)
Gen TCF1/HNF1A kóduje „hepatocyte nuclear factor 1α“, který ovlivňuje diferenciaci hepatocytů. Inaktivace genu u tohoto typu adenomu jsou bi-alelické a somatické (více než 90 %). Heterogenní zárodečné mutace HNF1A jsou příčinou familiárního non-inzulin dependentního DM u mladých pacientů (typu MODY3) a pacienti s jednou germinální a jednou somatickou mutací mají vedle MODY3 i adenomatózu jater.
H-HCA představuje 35 - 40 % ze všech adenomů jater a objevuje se téměř výhradně u žen.
Diagnóza adenomu této podskupiny je vysoce suspektní již na úrovni HE. Ve většině případů je v ložisku steatóza, hepatocyty nemají cytologické atypie a mezi okrsky hepatocytů jsou četné „nepárové“ svalové arterie, místy doprovázené žílami s minimem vaziva v okolí (žlučovody chybí). Současně v adenomu není zánětlivá celulizace.
V diagnostice se využívá chybění exprese L-FABP (liver fatty acid binding protein), který je cílovým proteinem transkripce HNF1 a zcela chybí v hepatocytech tohoto typu adenomu. V okolních normálních hepatocytech je vždy difuzní exprese (obr. 3). Hranice pozitivního a negativního průkazu je tak jednoznačná, že umožní definovat nepravidelné okraje často lobulárně uspořádaného tumoru.
Obr. 3. Imunohistochemický průkaz L-FABP v játrech je difúzní a jeho vymizení je důležitým diagnostickým znakem H-HCA. 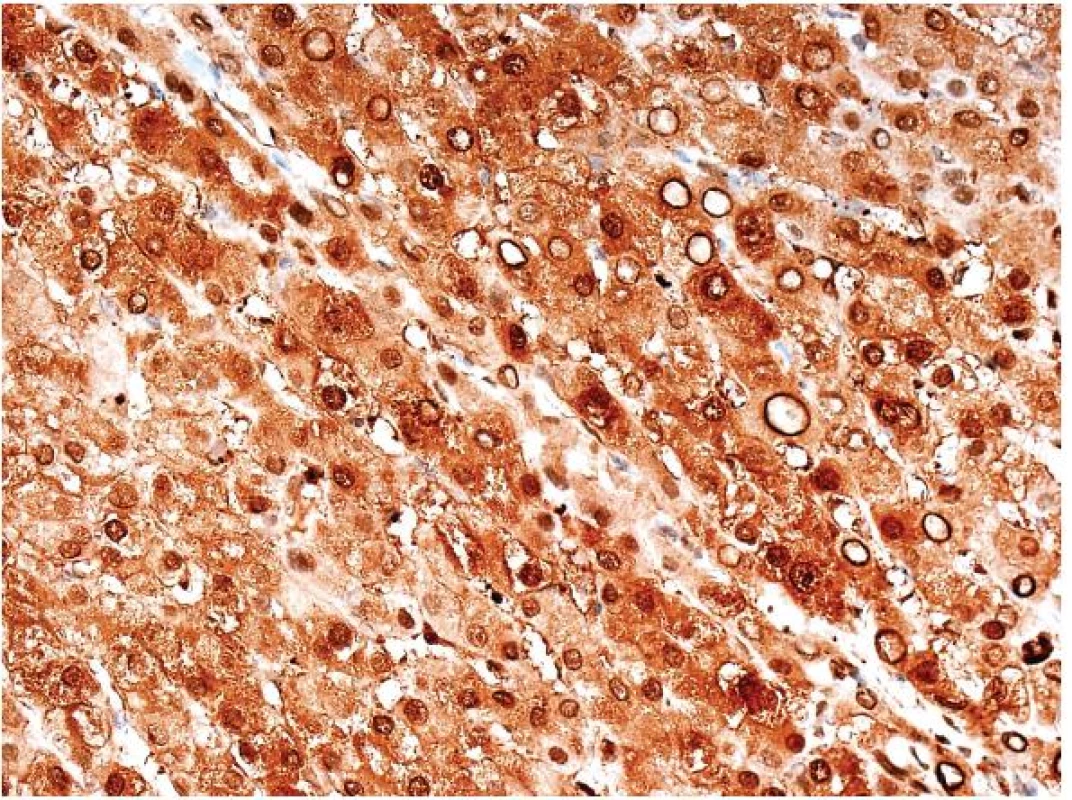
Negativní průkaz L-FABP potvrzuje diagnózu H-HCA.
Skupina 2: HCA s aktivací β-cateninu (b-HCA)
Mutace aktivující β-catenin se objevuje u cca 10 - 15 % HCA a navíc u 10 % zánětlivého HCA (viz další skupina).
V diagnostice na úrovni HE bývá minimum steatózy, jsou nukleární atypie a architektura rosetovitých formací, což vyvolává diferenciálně diagnostické rozpaky při odlišení od hepatocelulárního karcinomu (HCC).
K zařazení se používá průkaz β-cateninu a glutamin syntetázy (GS). Glutamin syntetáza je cílovým genem pro β-catenin (GS katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky). V normálních játrech je cytoplazmatická exprese GS lokalizovaná pouze v centrolobulární oblasti, zatímco exprese β-cateninu je normálně membránová a difúzní (obr. 4, 5). V nádoru se změní exprese β-cateninu na jadernou a pozitivní průkaz GS se rozšíří a je plošný. HCA v této kategorii představují vysoké riziko maligní transformace do HCC. Někteří autoři se domnívají, že tumory v této kategorii již představují dobře diferencované HCC (8).
Obr. 4. Imunohistochemický průkaz glutamin syntetázy v normálních játrech zaujímá 1 až 2 řady hepatocytů centrolobulárně. Rozšíření mimo tuto oblast by mělo být následováno průkazem β-cateninu. 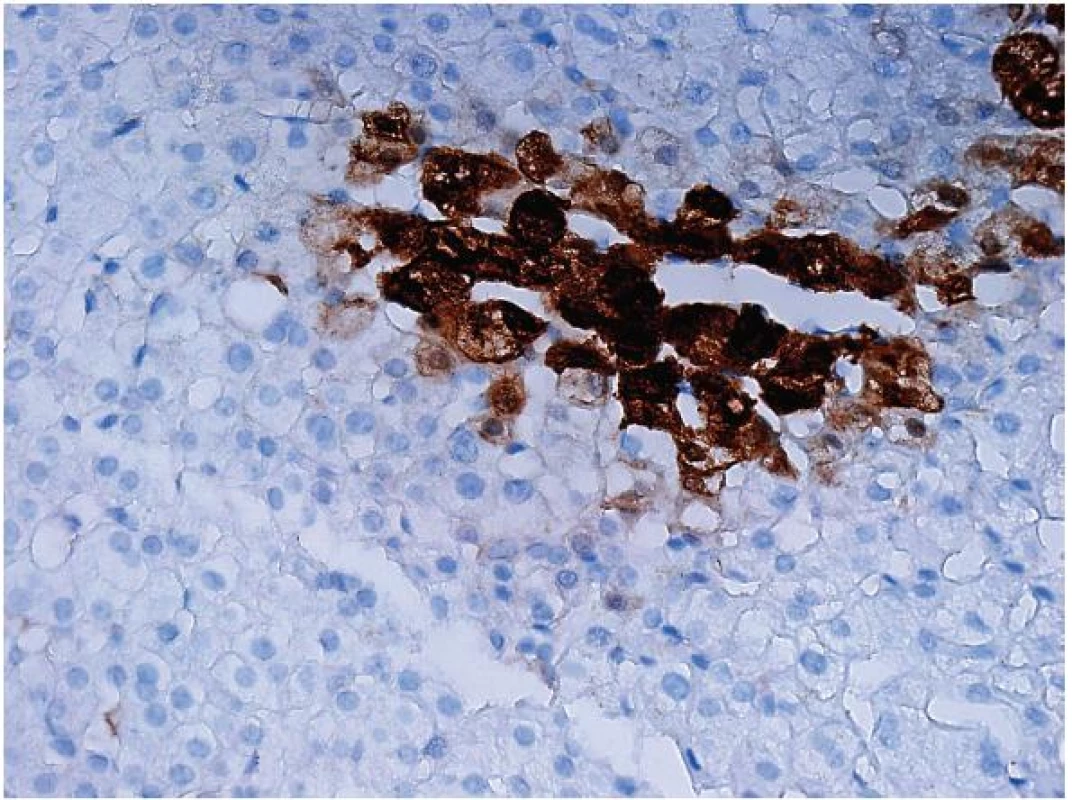
Obr. 5. Imunohistochemický průkaz β-cateninu s normální membránovou pozitivitou. 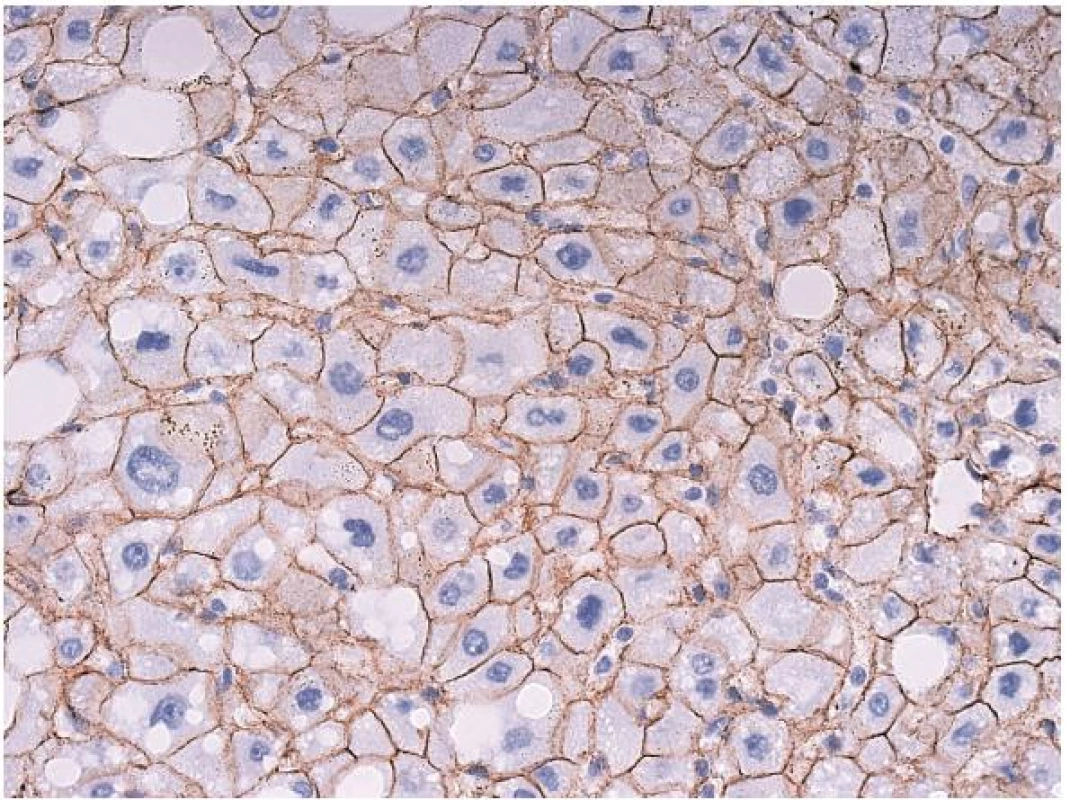
Skupina 3: zánětlivý HCA (I-HCA)
Tento typ adenomu představuje 40 - 50 % z celkového počtu. Jde o nejčastější variantu HCA vyskytující se u mužů. Část z těchto případů spadala dříve do podskupiny FNH tzv. teleangiektatické formy. Tato varianta často neměla centrální jizvu, na druhé straně její mikroskopické uspořádání s dilatovanými sinusy, nepárovými arteriemi a hemoragiemi stavělo afekci na pomezí mezi FNH a adenom. Pozdější genetické studie s průkazem klonality vedly k reklasifikování jednotky, která je nyní považována za adenom a prakticky vždy spadá do podskupiny I-HCA. Pacienti s touto formou nádoru jsou často obézní, kuřáci s kladným vztahem k alkoholu. Pacienti mají známky tzv. zánětlivého syndromu, včetně vysokých hladin sérum reaktivního proteinu (CRP). Na pozadí afekce jsou genetické mutace ovlivňující gen interleukinu 6 (> 60 %), který kóduje gp130, součást IL-6 receptoru. Mutace vede k aktivaci receptoru, což následně indukuje odpověď s produkcí proteinů akutní fáze zánětlivé odpovědi v hepatocytech. Toho se s úspěchem využívá v morfologické diagnostice. Nádorové buňky jsou difúzně SAA (serum amyloid A) pozitivní (obr. 6), bez ohledu na rozsah zánětlivé celulizace ve tkáni.
Obr. 6. Imunohistochemický průkaz (SAA) s cytoplazmatickou pozitivitou v buňkách I-HCA, s ostrou hranicí negativního průkazu (červeně) v okrsku nenádorové tkáně v okraji vzorku (SAA, objektiv 20x). 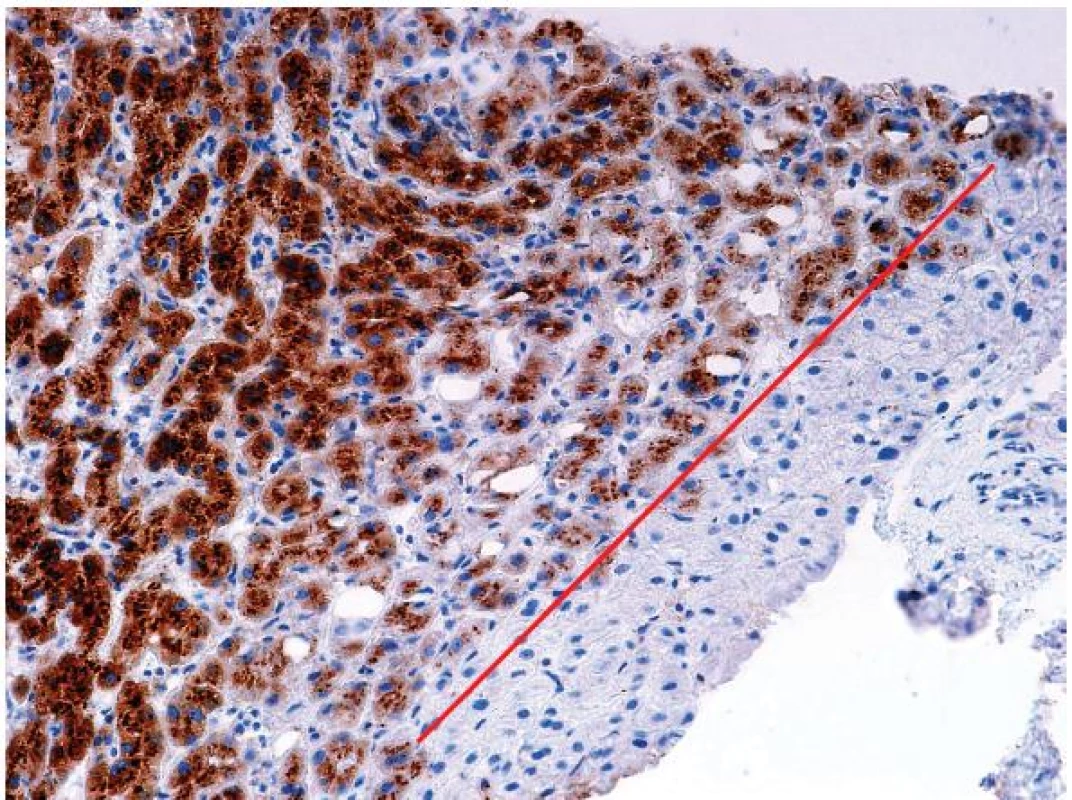
Jak již uvedeno ve skupině 2, cca 10 % HCA se zánětlivými charakteristikami má také pozitivní průkaz β-cateninu a tato podskupina (I-HCA s pozitivním průkazem β-cateninu) sdílí s předchozí kategorií vysoké riziko maligního zvratu.
Skupina 4: blíže nespecifikovaný HCA
Tato skupina představuje méně než 10 % HCA a jsou zde zařazeny případy, které nespadají do žádné z předchozích kategorií (negativní průkaz L-FABP, β-cateninu i SAA); navíc jsou zde zařazeny tumory s rozsáhlým krvácením nebo nekrózou, které neumožňují seriózní hodnocení imunohistochemických průkazů.
FOKÁLNÍ NODULÁRNÍ HYPERPLAZIE (FNH)
Jde o afekci, která je cca 10x častější než adenom a představuje po hemangiomu druhou nejčastější benigní lézi jater. Obvykle postihuje ženy (8 : 1) mezi 20 - 50 lety. Makroskopicky jde o dobře ohraničený uzel bez pouzdra, s centrální jizvou. V současnosti není FNH považována za nádor, ale za regenerativní odpověď tkáně na arteriální malformaci, která představuje vývojovou vrozenou anomálii. To podporují dlouho známá pozorování FNH vyskytující se spolu s hereditární teleangiektazií (Osler - Weber - Rendu) a hemangiomy v játrech (9).
Makroskopický a mikroskopický obraz
Typickou FNH tvoří tuhé oproti okolí dobře ohraničené ložisko bez vazivového pouzdra. Na řezu je centrální jizva, která obsahuje kromě vaziva aberantní silnostěnné cévy různého kalibru. Jizva se paprsčitě rozbíhá do periferie a vazivová septa oddělují uzly hepatocytů. Tomu odpovídá i mikroskopický obraz, kdy léze napodobuje vazivovými septy s duktulární proliferací na jejich periferii morfologii fokální cirhózy v necirhotických játrech. Z resekátu lze většinu případů diagnostikovat poměrně snadno, pokud jsou vyvinuté typické výše popsané charakteristiky. Pokud vyšetřujeme jehlovou biopsii, může být situace komplikovanější, protože nemáme přehled přes celou afekci a zastižena nebývá jizva, ale periferie afekce, pokud máme štěstí tak s vazivovými septy. Velmi přínosná je detekce GS, která je ve FNH mapovitá (obr. 7). Exprese β-cateninu je normální (tj. membránová).
Obr. 7. Mapovitá exprese glutamin syntetázy ve FNH (GS, objektiv 40x). Průkaz β-cateninu bude mít v případě FNH normální membránovou pozitivitu. 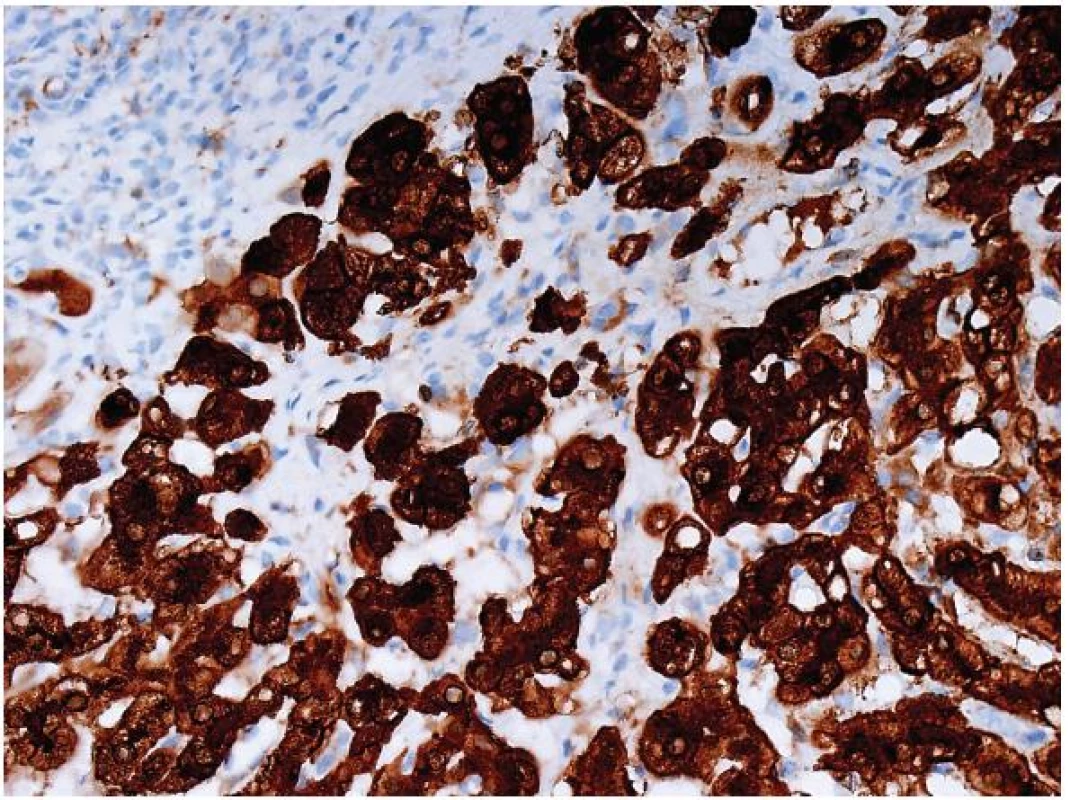
DIFERENCIÁLNÍ DIAGNOSTIKA
Většinu adenomů a FNH v resekátech lze s využitím imunohistochemických metod spolehlivě klasifikovat. Větší problémy znamená stejná diagnostika v jehlových biopsiích. Jedním z takových notoricky známých problémů je masivní steatosa. To je stav, kdy výsledky většiny imunohistochemických reakcí s cytoplazmatickými antigeny budou nejisté a často v diferenciální diagnostice nepomohou. Problematické také může být hodnocení morfologie z těsné blízkosti ložiska, kdy vlastní léze není zastižena.
Pokud jde o interpretaci GS, jakákoli abnormální pozitivita GS by měla vést k detekci exprese β-cateninu (v normálních játrech se GS exprimuje v jedné nebo dvou řadách hepatocytů centrolobulárně). V případě β-cateninu, je jakákoli jaderná pozitivita (bez ohledu na to, kolik jader je pozitivních) považována za pozitivní výsledek. V případech HCA s aktivací β-cateninu vždy v diferenciální diagnostice zvažujeme dobře diferencovaný HCC a provádíme průkaz glypicanu-3 (pozitivní průkaz glypican-3 potvrdí diferencovaný HCC).
Vždy je s výhodou, pokud je ve vyšetřovaném vzorku úsek okolní jaterní tkáně, protože automaticky slouží jako kontrola pro detekci imunohistochemických markerů.
ZÁVĚR
Upřesněné charakteristiky HCA a FNH zlepšily možnosti jejich odlišení nejen na úrovni zobrazovacích metod, ale i v resekátech a v jehlových biopsiích. FNH není považována za nádor, ale za regenerativní odpověď tkáně na arteriální malformaci, která představuje vývojovou vrozenou anomálii. HCA byly podle fenotypu, který odpovídá molekulárním charakteristikám, rozčleněny do 4 skupin, které se liší rizikem maligního zvratu. Proto je v současnosti určení subtypu nezbytnou součástí bioptické diagnózy. Zařazení do subtypů lze provést na základě detekce imunohistochemických markerů. Současně je třeba mít na paměti, že stejně jako v jiných případech i zde nelze diagnózu postavit izolovaně na průkazu jednoho imunohistochemického markeru, ale vždy je nezbytné brát na zřetel komplexní morfologii a též klinické údaje.
PODĚKOVÁNÍ
Práce byla podpořena: MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, PhD.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Zdroje
1. Bioulac-Sage P, Laumonier H, Couchy G, et al. Hepatocellular adenoma management and phenotypic classification: the Bordeaux experience. Hepatology 2009; 50 : 481-489.
2. Rebouissou S, Bioulac-Sage P, Zucman-Rossi J. Molecular pathogenesis of focal nodular hyperplasia and hepatocellular adenoma. J Hepatol 2008; 48 : 163-170.
3. Ehrmann J. Novinky v hepatopatologii. Cesk Patol 2013; 49 : 24.
4. Wanles IR, Mawdsley C, Adams R. On the pathogenesis of focal nodular hyperplasia of the liver. Hepatology 1985; 5 : 1194-1200.
5. Baum JK, Bookstein JJ, Holtz F et al. Possible association between benign hepatomas and oral contraceptives. Lancet 1973; 2 : 926-929.
6. Bioulac-Sage P, Cubel G, Balabaud C, Zucman-Rossi J. Revisiting the pathology of resected benign hepatocellular nodules using new immunohistochemical markers. Seminars in Liver Disease 2011; 31 : 91–103.
7. S. Van Der Borght, L. Libbrecht, A. Katoonizadeh et al. Nuclear β-catenin staining and absence of steatosis are indicators of hepatocellular adenomas with an increased risk of malignancy. Histopathology 2007; 51 : 855–856.
8. Evason K, Grenert J, Ferrell L, Kakar S. Atypical hepatocellular adenoma-like neoplasms with β-catenin activation show cytogenetic alterations similar to well-differentiated hepatocellular carcinomas. Hum Pathol 2013; 44(5): 750-758.
9. Wanless IR, Gryfe A. Nodular transformation of the liver in hereditary hemorrhagic telangiectasia. Arch Pathol Lab Med 1986; 110 : 331.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2013 Číslo 4-
Všechny články tohoto čísla
- Metodika molekulárně patologické diagnostiky - díl druhý
- Diagnostika neurodegenerací je detektivní práce
- MONITOR aneb nemělo by vám uniknout, že...
- Fluorescenční in situ hybridizace na histologických řezech
- Laserová mikrodisekce a její praktické aplikace
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Mucinózny adenokarcinóm (neintestinálneho typu) vzniknutý v zrelom cystickom teratóme vaječníka - kazuistika
- Eozinofilná dysplázia krčka maternice asociovaná s infekciou HPV 6 – kazuistika a prehľad literatúry
- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Fluorescenční in situ hybridizace na histologických řezech
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



