-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laparoskopická resekce tumoru solitární ledviny
Laparoscopic partial nephrectomy of solitary kidneys
Kolář J, Stránský P, Pitra T, Bartoš Veselá A, Ferda J, Hes O, Hora M. Laparoscopic partial nephrectomy of solitary kidneys.
Aim: To evaluate laparoscopic partial nephrectomies (LPN) of solitary kidneys performed at our Department and to compare the data with, and the results of, their open counterparts in the literature.
Material and methods: A retrospective analysis of patients who underwent LPN of solitary kidney during the years 2007–2020.
Results: In the time period 1/2007–5/2020 our Department conducted a total of 592 LPN with 10 cases (1.7 %) of solitary kidney resections (for comparison – in the same time frame 42 open solitary kidney resections (5.8 %) were conducted from a total of 725 open partial nephrectomies). The average age of patients who were indicated for LPN of a solitary kidney was 66 years (56–77 years). In the past, eight of them underwent contralateral nephrectomy due to tumour, in one case the kidney was functionally-solitary and in another there was an agenesis of the kidney. The duration of laparoscopy was on average 91 minutes (55–155 minutes), the hilum was clamped in 7 cases, in which the average warm ischemia time lasted for 12 minutes (7–23 minutes). The average size of the tumour indicated for laparoscopy was 22.7 mm (12–35 mm), the highest RENAL nephrometry score was 7a. Among histological findings there were 9 cases of clear cell renal cell carcinomas (8× pT1a, 1× pT3a), in one case a papillary renal cell carcinoma (pT1a) was diagnosed. Positive surgical margin (pR1) was found in one case. Once, a conversion to open surgery was required in order to achieve oncological radicality. In the immediate aftermath of the surgery there was no major decline in renal function. To date, there has been no need to apply renal replacement therapy in case of renal failure. In all surgeries including the postsurgical period no complications occurred. During the follow-up (average 51 months) there was no local recurrence of the tumour, once metastatic disease was described four months after the surgery.
Conclusion: In the time period 1/2007–5/2020 we conducted a total of 52 solitary kidney partial nephrectomies with laparoscopic approach in 10 cases (19.2 %). In the hands of a skilled surgeon LPN of solitary kidney represents, in specific cases, a safe alternative to open surgery.
Keywords:
laparoscopy – Partial nephrectomy – renal tumour – solitary kidney – warm ischemia time
Autoři: Jiří Kolář 1; Petr Stránský 1; Tomáš Pitra 1; Adriena Bartoš Veselá 1; Jiří Ferda 3; Ondřej Hes 2; Milan Hora 1
Působiště autorů: Urologická klinika LF UK a FN Plzeň 1; Šiklův ústav patologie LF UK a FN Plzeň 2; Klinika zobrazovacích metod LF UK a FN Plzeň 3
Vyšlo v časopise: Ces Urol 2021; 25(2): 120-130
Kategorie: Originální práce
Souhrn
Kolář J, Stránský P, Pitra T, Bartoš Veselá A, Ferda J, Hes O, Hora M. Laparoskopická resekce tumoru solitární ledviny.
Cíl: Zhodnotit výsledky laparoskopických resekcí (LR) tumorů solitárních ledvin provedených na našem pracovišti a tyto následně porovnat s výsledky resekcí otevřených a s daty udávanými v literatuře.
Materiál a metoda: Retrospektivní hodnocení souboru pacientů, kteří podstoupili LR tumoru solitární ledviny v letech 2007–2020.
Výsledky: V časovém období 1/2007–5/2020 bylo na našem pracovišti provedeno celkem 592 LR ledvin, z toho v deseti případech (1,7 %) se jednalo o resekci ledviny solitární. Otevřených resekcí bylo ve stejném časovém období u solitární ledviny provedeno 42 (5,8 %) z celkem 725 otevřených parciálních nefrektomií. Průměrný věk pacientů indikovaných k LR solitární ledviny byl 66 let (56–77 let). Osm z deseti nemocných bylo v minulosti po kontralaterální nefrektomii pro tumor, jednou se jednalo o funkčně solitární ledvinu a v jednom případě o agenezi ledviny. Laparoskopický výkon trval v průměru 91 minut (55–155 minut), hilus byl klampován celkem v 7 případech, kdy průměrná doba teplé ischemie byla 12 minut (7–23 minut). Průměrná velikost tumoru při LR byla 22,7 mm (12–35 mm), nejvyšší hodnota RENAL nefrometrického skóre 7a. Histologicky byl v 9 případech popsán světlobuněčný renální karcinom (8× pT1a, 1× pT3a), v jednom případě se jednalo o karcinom papilární (pT1a). Resekční okraj (pR1) byl pozitivní 1×. Jedenkrát byla provedena konverze v resekci otevřenou pro dosažení onkologické radikality výkonu. Bezprostředně po výkonu nedošlo u žádného nemocného k významnému poklesu renálních funkcí ve srovnání s předoperačními hodnotami. Do současné doby nebylo nutné u žádného z deseti pacientů použít náhradu funkce ledvin pro renální selhávání. Všechny výkony včetně pooperačního období se obešly bez komplikací. V rámci dispenzarizace (průměrná doba sledování 51 měsíců) nebyla zaznamenána žádná lokální recidiva v místě resekce, u jedné nemocné byla čtyři měsíce po výkonu popsána generalizace renálního karcinomu.
Závěr: V časovém úseku 1/2007–5/2020 jsme provedli celkem 52 resekcí solitárních ledvin, z toho v 10 případech (19,2 %) laparoskopicky. LR tumoru solitární ledviny je ve vybraných indikacích a v rukách zkušeného operatéra bezpečnou alternativou resekci otevřené.
Klíčová slova:
laparoskopie – nádor ledviny – Resekce ledviny – solitární ledvina – teplá ischemie
ÚVOD
Chirurgické řešení tumoru solitární ledviny je oproti resekci u zdravé kontralaterální ledviny výkon riziko vější. Na jedné straně je cílem onkologická radikalita a na straně druhé zachování dostatečného objemu funkčního renálního parenchymu bez nutnosti, byť dočasné, náhrady funkce ledvin. Dříve preferovaný otevřený přístup může být ve vybraných indikacích a v rukou zkušeného operatéra nahrazen metodou miniinvazivní – laparoskopicky či asistovaně roboticky. Prezentujeme soubor pacientů, kteří na našem pracovišti podstoupili laparoskopickou resekci tumoru solitární ledviny.
MATERIÁL A METODY
V nemocničním systému byly vyhledány resekce tumorů solitárních ledvin, které byly na našem pracovišti provedeny v časovém období 1/2007–5/2020. Tyto byly statisticky zpracovány se zaměřením na výkony laparoskopické. Mezi hodnocené parametry patřila doba operace, doba teplé ischemie, krevní ztráta během výkonu, pooperační komplikace a doba hospitalizace. Stran tumoru byla hodnocena jeho komplexita dle RENAL nefrometrického skóre a velikost na předoperačních zobrazovacích vyšetřeních. Ke sledování vývoje funkce ledvin byl použit odhad glomerulární filtrace (eGFR) dle rovnice CKD-EPI. Hodnocena byla eGFR před výkonem v rámci předoperačního vyšetření (náběry v rozmezí 1–20 dní před operací), dále hodnota po resekci ledviny (rozmezí 1–4 dny po výkonu) a poslední známá hodnota v rámci dlouhodobého sledování (rozmezí 10–113 měsíců po operaci).
VÝSLEDKY
V časovém období 1/2007–5/2020 bylo na našem pracovišti provedeno celkem 592 LR ledvin, z toho v 10 případech (1,7 %) se jednalo o resekci ledviny solitární. Pro srovnání jsme ve stejném časovém období provedli 725 otevřených resekcí ledvin, ve 42 případech (5,8 %) ledvin solitárních. Od 6/2020 provádíme miniinvazivní resekce ledviny asistovaně roboticky (systém daVinci Xi), ze 42 robotických resekcí provedených do konce 2/2021 se 2 jednalo o ledvinu solitární. Tito dva nemocní nejsou do práce zavzati.
Průměrný věk pacientů indikovaných k laparoskopickému výkonu u solitární ledviny byl 66 let (rozmezí 56–77 let). Osm nemocných bylo v minulosti po kontralaterální nefrektomii pro tumor (časový odstup mezi výkony na kontralaterálních ledvinách byl v průměru 9 let; rozmezí 1 měsíc – 15 let), jednou se jednalo o funkčně solitární ledvinu (obrázek 1) a v jednom případě o agenezi ledviny (obrázek 2).
Obr. 1. MR břicha, koronární řez. Tumor funkčně solitární levé ledviny cT1a (14 mm) RENAL skóre 5a. Řešeno laparoskopickou resekcí bez klampování hilu
Fig. 1. MRI of the abdomen, coronal plane. Tumor of the left functional-solitary kidney cT1a (14 mm) RENAL score 5a. Laparoscopic partial nephrectomy with zero ischemia time was performed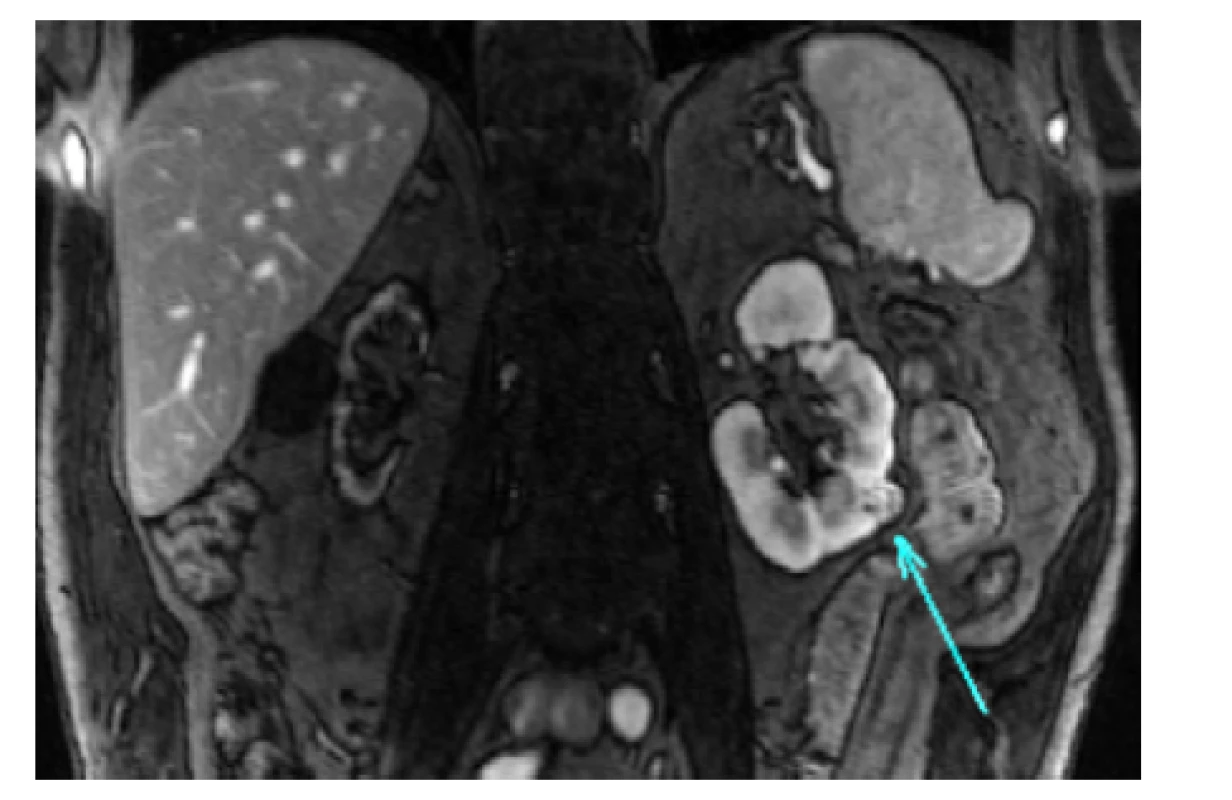
Obr. 2. CT, koronární řez. Tumor pravé ledviny cT1a (34 mm) RENAL skóre 5×, vlevo ageneze ledviny. BMI 42. Řešeno laparoskopickou resekcí s nulovou ischemií
Fig. 2. CT scan, coronal plane. The tumor of the right kidney cT1a (34 mm) RENAL score 5×, agenesis of the left kidney. BMI 42. Laparoscopic partial nephrectomy with zero ischemia time was performed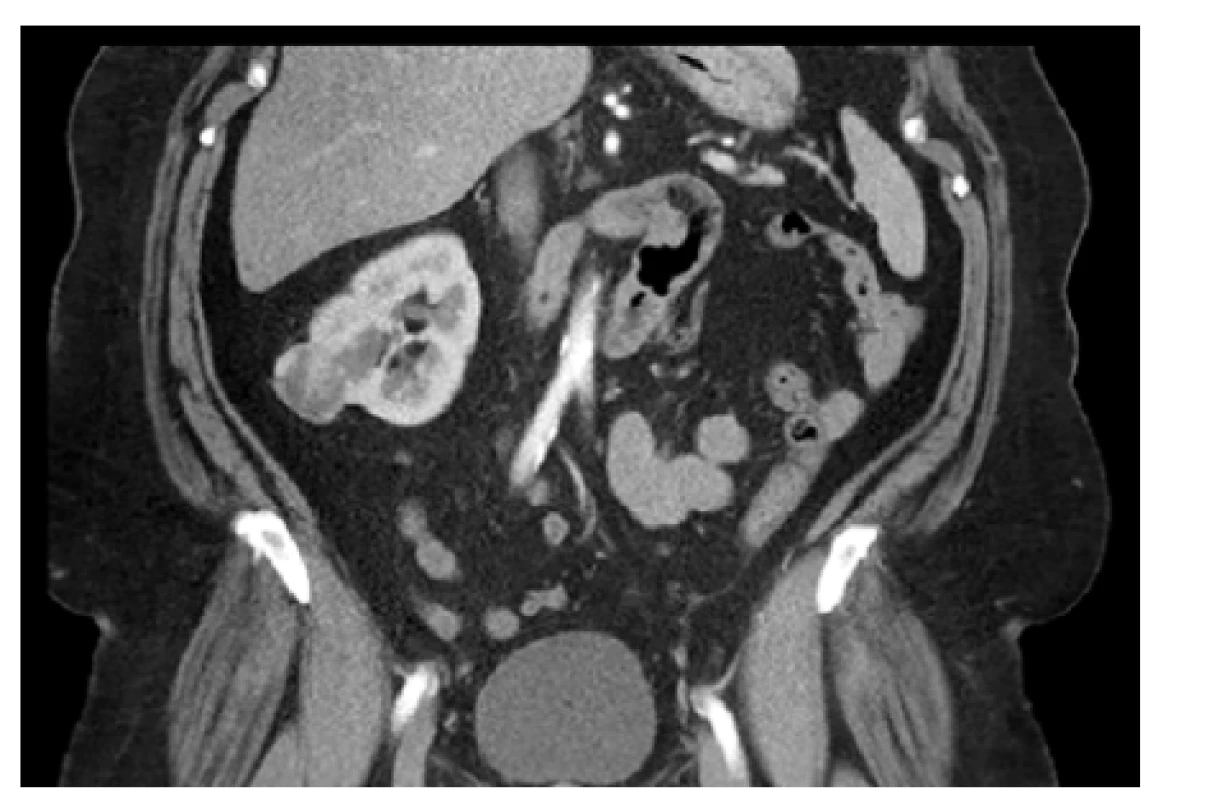
Laparoskopický výkon v průměru trval 91 minut (rozmezí 55–155 minut), ve 4 případech byla zároveň provedena i ablace cysty a v jednom případě ipsilaterální laparoskopická adrenalektomie. Hilové cévy byly klampovány celkem v 7 případech (70 %), přičemž průměrná doba teplé ischemie byla 12 minut (rozmezí 7–23 minut). Bez peroperačního klampování hilových cév byla LR provedena ve 3 případech (30 %), vždy se jednalo o tumory převážně exofytické a méně komplexní (Renal skóre 5a, 5a, 5x). Peroperační ultrasonografie byla využita u 7 z 10 resekcí, u zbývajících tří výkonů nebyla laparoskopická ultrasonografická sonda na našem pracovišti ještě k dispozici (sondu používáme od roku 2014). Peroperační ultrasonografie napomohla k ozřejmení rozsahu a hloubky invaze tumoru před jeho resekcí a ve dvou případech umožnila na základě dopplerometrického vyšetření selektivní arteriální clamping (obrázek 3). V jednom případě byla k vizualizaci zóny ischemie aplikována indocyaninová zeleň (ICG – indocyanine green). Roztok ICG (Verdye®) získáváme zředěním jedné ampule (25 mg) v 10 ml rozpouštědla na vodní bázi, následně aplikujeme 2,5 mg ICG nitrožilně, fluorescenční efekt je pozorovatelný již v první minutě po aplikaci (obrázek 4). Spodina po resekci byla v šesti případech ošetřena bipolární koagulací, resekční okraje byly vždy sešity pokračovacím stehem kotveným klipy. Hemostatický materiál (Surgicel®) byl na suturu aplikován ve dvou případech.
Obr. 3. Využití perioperační ultrasonografie při laparoskopické resekci tumoru solitární ledviny
Fig. 3. The usage of perioperative ultrasonography during a laparoscopic partial nephrectomy of solitary kidney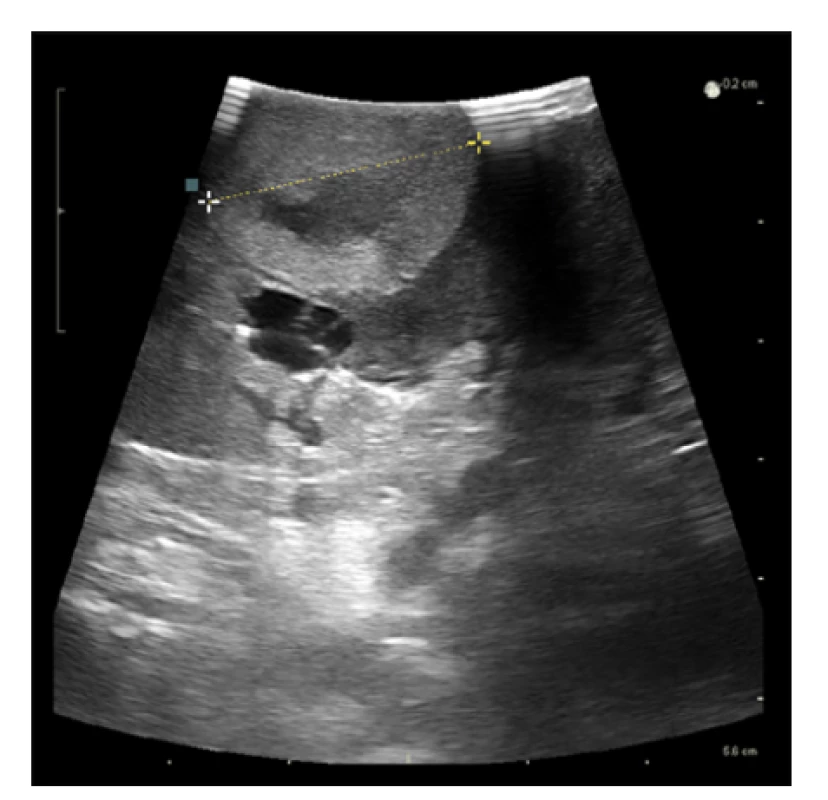
Obr. 4. Využití ICG (indocyaninové zeleně) k verifikaci ischemie při selektivním klampování větve renální arterie
Fig. 4. The application of ICG (indocyanine green) to verify the ischemia during a selective renal artery clamping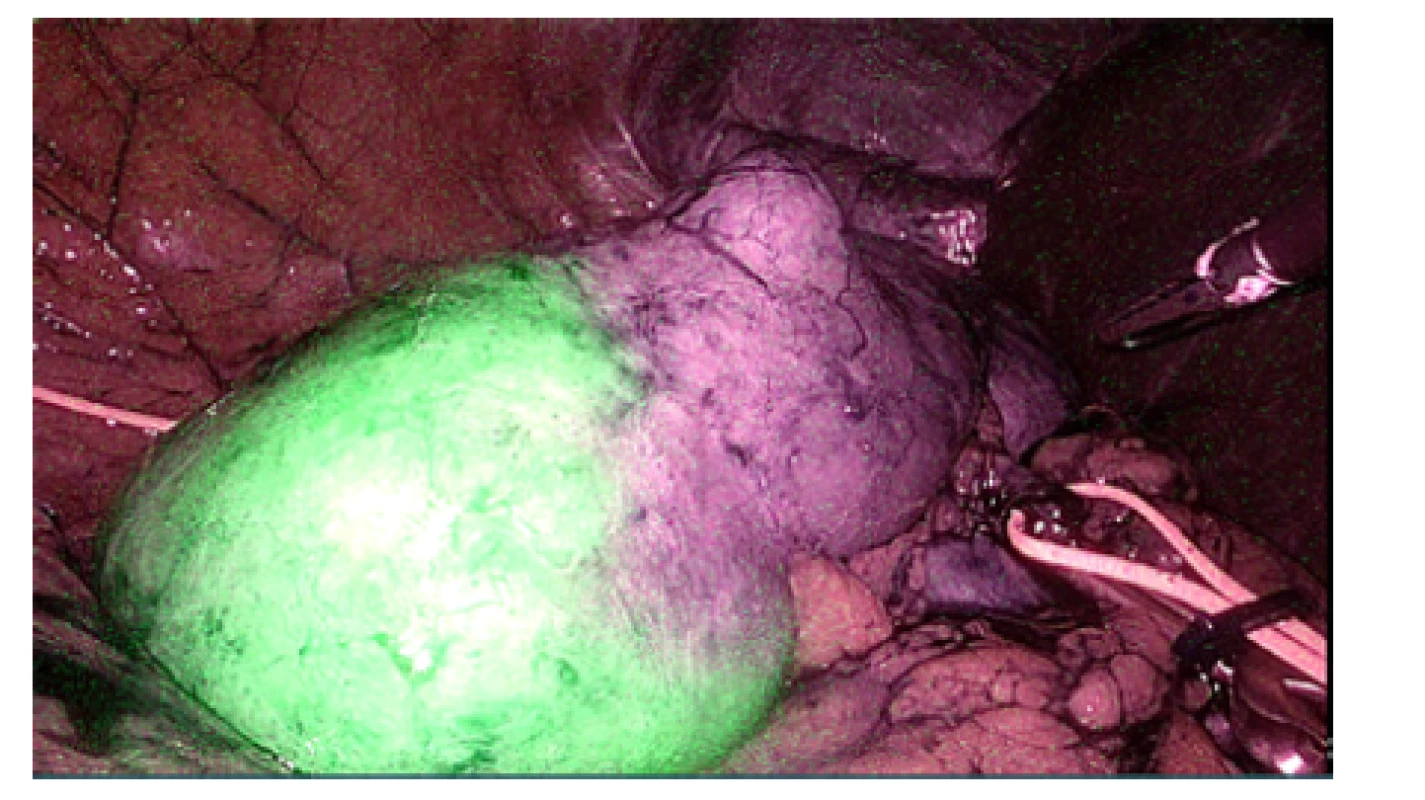
Histologicky byl v devíti případech popsán světlobuněčný renální karcinom (8x pT1a, 1x pT3a) a v jednom případě karcinom papilární (pT1a). V 1 z 10 preparátů byl popsán pozitivní resekční okraj, pacienta nadále pouze sledujeme a je bez recidivy onemocnění. U jediného výkonu bylo nutno přistoupit ke konverzi v resekci otevřenou, aby byla dosažena onkologická radikalita (makroskopicky pozitivní resekční okraj). Všechny ostatní výkony včetně pooperačního období se obešly bez komplikací. Výsledky včetně porovnání s resekcemi otevřenými shrnují tabulky 1 a 2. Četnost a závažnost komplikací byla v souboru resekcí otevřených vyšší než u laparoskopických. Po otevřené resekci solitární ledviny bylo ve dvou případech nutné provedení selektivní arteriální embolizace na intervenčním pracovišti pro krvácení v místě resekce. U čtyř nemocných bylo pro urinózní únik nutné zavést ureterální stent, z toho v jednom případě jsme pro následné infekční komplikace museli provést nefrektomii a pacient se tak stal arenálním.
Tab. 1. Porovnání laparoskopické a otevřené resekce tumoru solitární ledviny
Tab. 1. A comparison of laparoscopic and open solitary kidney partial nephrectomy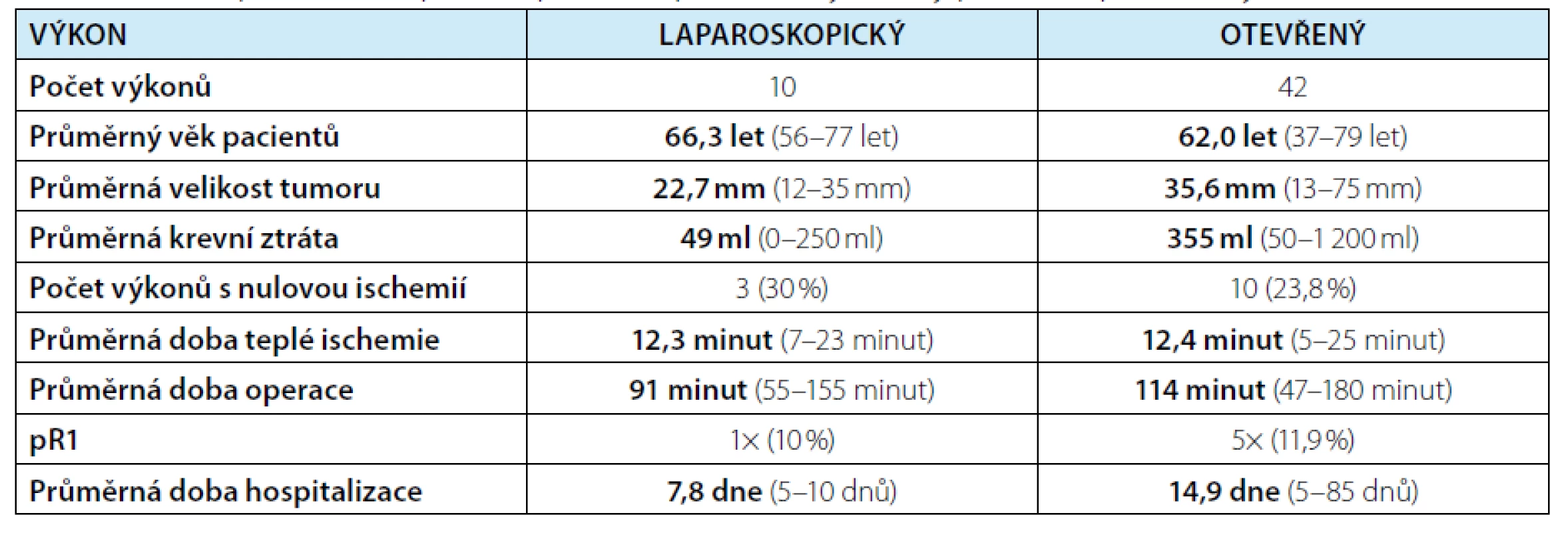
Tab. 2. Porovnání RENAL nefrometrického skóre u otevřené a laparoskopické resekce tumoru solitární ledviny
Tab. 2. A comparison of RENAL nephrometry score of open and laparoscopic solitary kidney partial nephrectomy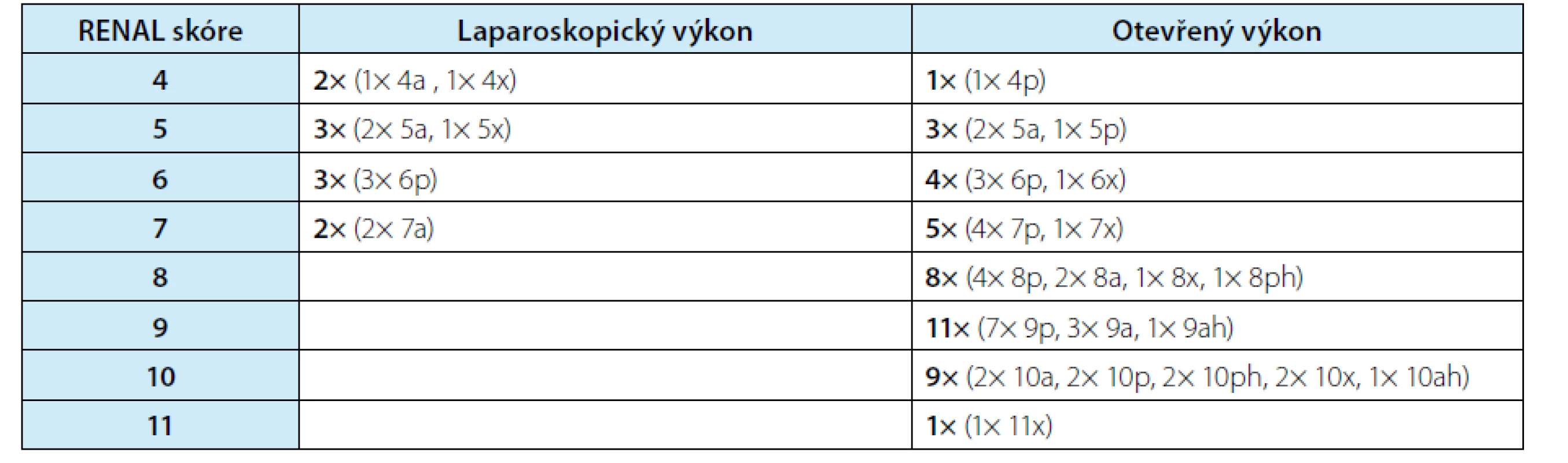
Vliv resekce na renální funkce po LR ukazuje tabulka 3. Z výsledků mimo jiné vyplývá, že u žádného nemocného nedošlo v pooperačním období ani v rámci dlouhodobého sledování ke zhoršení eGFR o více než 1 stupeň dle klasifikace stadií chronického onemocnění ledvin (CKD) dle KDIGO (Kidney Disease Improving Global Outcomes). Do současné doby nebylo nutné u žádného z 10 pacientů použít náhradu funkce ledvin pro renální selhávání. V rámci souboru nemocných po otevřené resekci byla u dvou pacientů po výkonu nezbytná přechodná hemodialýza, renální funkce se poté částečně zreparovaly a další dialýza nebyla indikována. V dalším období po výkonu bylo nutné pro zhoršování renálních funkcí zahájení chronické hemodialýzy u čtyř nemocných po otevřené operaci, jeden z nich poté podstoupil transplantaci ledviny.
Tab. 3. (A) Stadia chronického onemocnění ledvin (CKD) upraveno dle KDIGO, 2013. (B) Charakteristika pacientů a jejich rozdělení do stadií onemocnění ledvin dle eGFR vypočítané z rovnice CKD-EPI (soubor laparoskopických resekcí tumoru solitární ledviny)
Tab. 3. (A) Stages of chronic kidney disease (CKD), modified from KDIGO, 2013. (B) Description and division of the patients into CKD stages based on eGFR CKD-EPI (laparoscopic solitary kidney partial nephrectomies)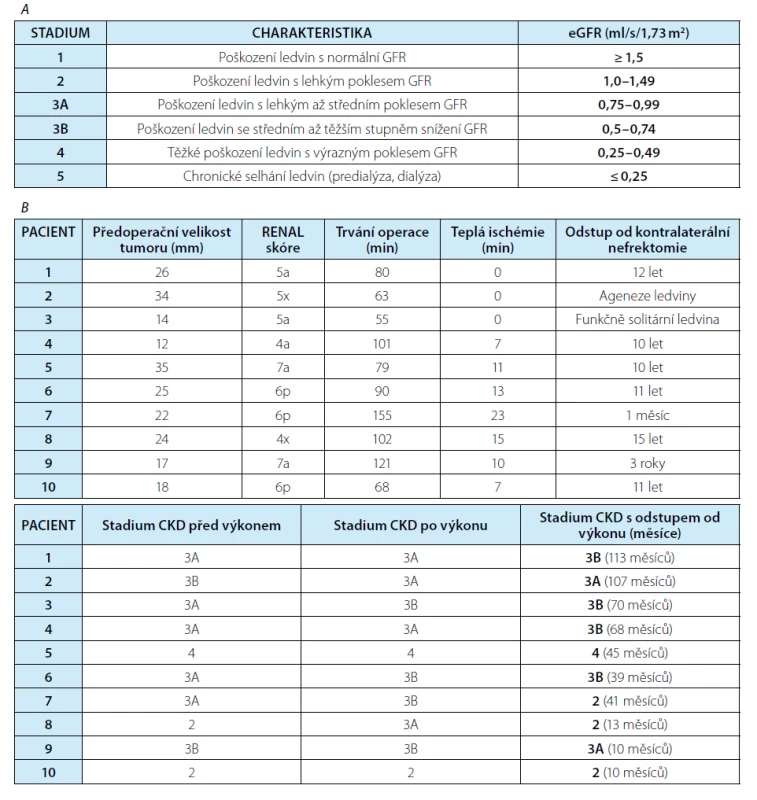
V rámci onkologické dispenzarizace (průměrná doba sledování 51 měsíců; rozmezí 10–113 měsíců) nedošlo u žádného pacienta po LR k lokální recidivě tumoru v místě resekce. Z 10 nemocných dva zemřeli na kardiální selhání (107 a 113 měsíců po urologickém výkonu), u jednoho probíhá léčba generalizovaného karcinomu plic. Ke generalizaci karcinomu ledviny došlo u jedné nemocné. Jedná se o pacientku, u které byly zachyceny bilaterální tumory ledvin a suspektní metastáza do nadledviny. V první době jsme provedli transperitoneální nefrektomii vlevo (histologicky ccRCC pT3a G3), s odstupem jednoho měsíce byla přijata k řešení 22mm tumoru pravé ledviny a suspektní metastázy v pravé nadledvině. Provedena byla laparoskopická adrenalektomie a zároveň resekce tumoru solitární pravé ledviny. Pro neúplnou resekci při zhodnocení resekátu (makroskopicky pozitivní okraj) byl výkon konvertován s provedením nové resekce až do dutého systému ledviny (histologicky byla zastižena nádorová infiltrace stěny cévy svalového typu, klasifikováno tedy jako ccRCC pT3a pM1 pR0). Čtyři měsíce po výkonu bylo provedeno PET/CT s průkazem generalizace RCC do plic, pankreatu a levostranné nadledviny. Nemocná nyní podstupuje onkologickou léčbu (v 1. linii sunitinib, nyní ve 2. linii podáván cabozatinib) a onemocnění je stabilní. Pro porovnání – stran následné onkologické dispenzarizace u nemocných po otevřené resekci tumoru solitární ledviny máme k dispozici data u 33 jedinců (78,6 %) – z nich sedm zemřelo v důsledku generalizace renálního karcinomu a u dvou nyní vzhledem k metastatickému rozsevu probíhá paliativní systémová léčba.
DISKUZE
Chirurgické řešení karcinomu ledviny je hlavní modalitou onkologické léčby, která může vést k trvalé remisi onemocnění (1). Cílem operační léčby u tumoru solitární ledviny je zachování dostatečného reziduálního objemu funkčního renálního parenchymu při dodržení onkologické radikality výkonu. Při operaci tumoru anatomicky nebo funkčně solitární ledviny má ledvinu šetřící výkon (NSS – nephron sparing surgery) absolutní indikaci. Relativní indikací NSS je stav, kdy kontralaterální ledvina je funkční, nicméně již ve stavu, kdy lze předpokládat poškození její funkce v budoucnu. Mezi relativní indikace můžeme také zařadit nemocné s hereditárními syndromy asociovanými s renálním karcinomem, kteří mají zvýšené riziko vzniku mnohočetných a bilaterálních tumorů a s tím spojeným rizikem opakovaných operačních výkonů (2).
Nefrektomie solitární ledviny by rezultovala v arenálního pacienta s nutností trvalé náhrady funkce ledvin. Případná hemodialýza či peritoneální dialýza pak výrazně snižuje kvalitu pacientova života a zároveň vede k vysoké morbiditě a mortalitě (3). Lepší kvalitu života a zvýšené přežití ve srovnání s ostatními trvalými náhradami funkce ledvin přináší transplantace ledviny. U kandidáta na transplantaci s anamnézou onkologického onemocnění musí být vybalancovány benefity transplantace s rizikem rekurence tumoru. Imunosuprese zvyšuje riziko nádorové rekurence a potenciálně ovlivňuje posttransplantační mortalitu. Časový interval mezi chirurgickou léčbou nádoru a transplantací dříve býval většinou založen na datech z mezinárodního transplantačního registru IPITTR (Israel Penn International Transplant Tumor Registry), zohledňován byl především typ tumoru. Čekací doba se pak pohybovala od méně než 2 let do 5 let. Nevýhodou registru je, že nezohledňuje epidemiologii nádorů ani diagnostické a terapeutické pokroky v jejich léčbě, v datech dále není zahrnut staging, grading ani způsob léčby nádoru (4, 5, 6). Dle recentního konsenzu Americké společnosti pro transplantaci (AST – American Society of Transplantation) jsou při stanovování časového intervalu mezi onkologickou léčbou a provedením transplantace solidního orgánu zohledňovány i další parametry, jako je staging i grading tumoru, kinetika nádorové rekurence, vliv imunosuprese a pokroky v nádorové léčbě (7). Doporučení pro transplantaci ledviny u nemocných s anamnézou RCC dle AST ukazuje tabulka 4.
Tab. 4. Doporučený časový interval k transplantaci solidního orgánu u kandidátů s anamnézou renálního karcinomu dle AST (American Society of Transplantation)
Tab. 4. Recommended wait time for solid organ transplantation candidates with prior history of renal cell carcinoma according to AST (American Society of Transplantation)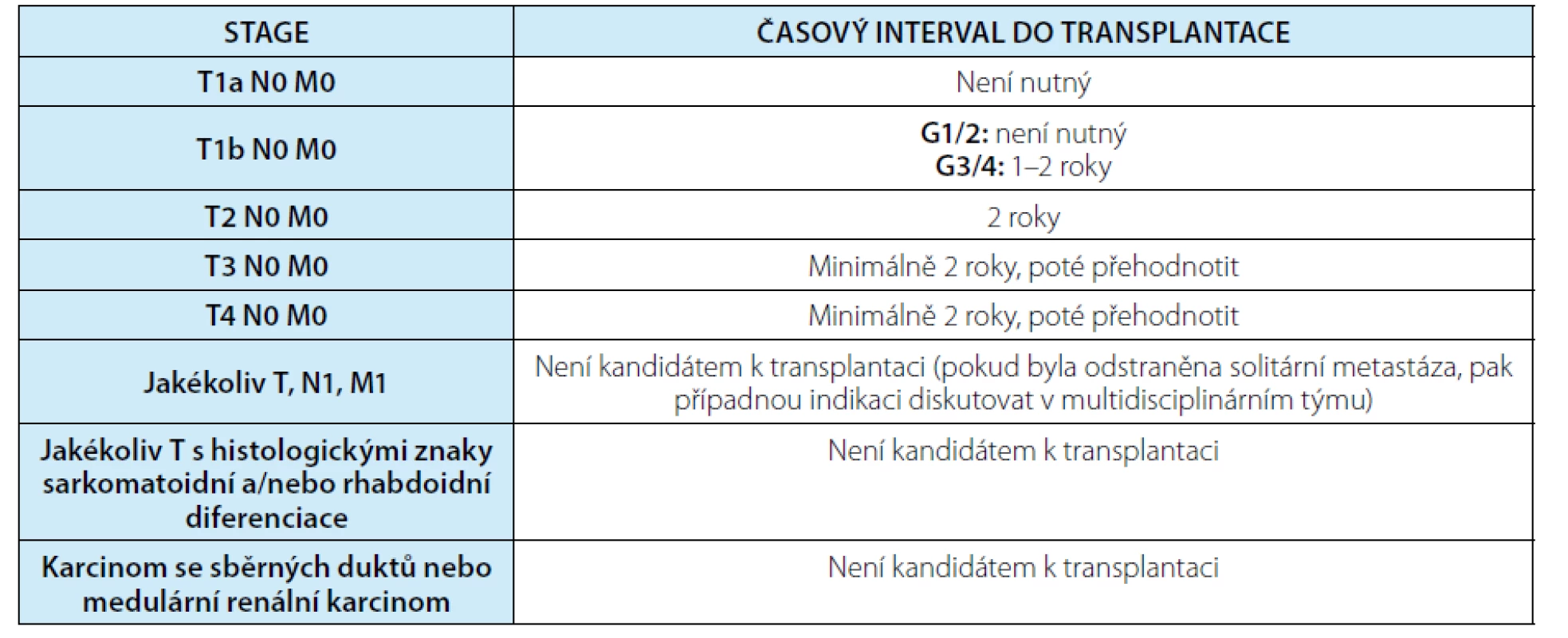
Riziko dočasného i trvalého poškození funkce ledvin roste s rostoucí dobou teplé ischemie (WIT – warm ischemia time). Uzavření hilových cév pomáhá v hemostáze, vede k lepší přehlednosti v relativně bezkrevném operačním poli a možnosti preciznějšího uzavření dutého systému, cév a parenchymového defektu, zejména u nádorů centrálně uložených nebo těch s hlubokou parenchymovou invazí. Ischemie ledvinného parenchymu vede k poškození buněk nefronů a renálních cév. Nejcitlivější k nedostatku kyslíku jsou tubulární buňky bohaté na mitochondrie – zejména buňky proximálního tubulu, silného raménka Henleovy kličky a proximálního sběrného kanálku na rozhraní mezi kůrou a dření. Mechanismy ischemického poškození renálního parenchymu jsou obecně zmiňovány tři. Cévní mechanismus založený na přetrvávající vazokonstrikci a abnormální reakci endoteliálních buněk, reperfuzní poškození a tubulární obstrukce se zpětným tokem moči (8, 9, 10). Thompson et al. ve své práci z roku 2010 posuzoval hraniční hodnoty WIT na skupině 362 pacientů se solitární ledvinou, kteří podstoupili otevřenou (n = 319) nebo laparoskopickou (n = 43) resekci s klampováním hilových cév (průměrná doba ischemie byla 21 minut, rozmezí 4–55 minut). Hraniční hodnota WIT, kdy nedochází ke krátkodobému nebo dlouhodobému poškození ledvinných funkcí, byla v této práci stanovena na 25 minut (11). Pooperační funkce ledviny je pak dle této studie závislá na její funkci před výkonem, množství zachovaného parenchymu a minimalizaci WIT na dobu kratší než 25 minut (12, 13).
K ischemickému poškození solitární ledviny nedochází při nulové ischemii (výkon bez klampování hilových cév), kdy funkce ledviny může být lehce zhoršena redukcí parenchymu solitární ledviny, celkovou anestezií a pooperačním stresem. K resekci tumoru ledviny bez uzavření hilu lze indikovat hlavně menší exofytické nádory bez hluboké parenchymové invaze. Při předpokládané delší době klampování cév je ke zvážení použití metod ischemie studené. Hypotermie vede k omezení bazálního buněčného metabolismu a snižuje nároky buněk na kyslík. V literatuře je popisováno několik možností chlazení při resekčních výkonech – metoda in situ studené arteriální perfuze, povrchové chlazení ledovou tříští, retrográdní perfuze dutého systému nebo ex situ studená arteriální perfuze s autotransplantací (9). Někteří autoři tyto metody doporučují zejména u komplexních tumorů s předpokladem složitého resekčního výkonu (14). Bezpečný čas studené ischemie s využitím ledové tříště je v literatuře udáván do 35–44 minut (15, 16). Na našem pracovišti metody studené ischemie nepoužíváme.
V indikovaných případech lze využít selektivní ischemii, kdy se při výkonu po přesné disekci větví renální tepny uzavírá pouze větev zásobující tumor. K identifikaci perfuze tkáně při selektivním klampování renálních arterií lze využít princip fluorescence s užitím indocyaninové zeleně (17). Bjurlin et al. ve své práci udávají pokles v hodnotách glomerulární filtrace o 6,2 % v průběhu dvou týdnů po robotické parciální nefrektomii při užití superselektivního arteriálního klampování s ICG (18).
Dalším faktorem, který může mít vliv na pooperační funkci solitární ledviny, je čas od kontralaterální nefrektomie. Během prvního roku po nefrektomii dochází ke kompenzatorní hypertrofii kontralaterální solitární ledviny a u nemocných s delším odstupem po kontralaterálním výkonu nebo se solitární ledvinou vrozenou bývají pooperační funkce příznivější (9, 19).
Obecně uznávaným standardem v řešení lézí solitárních ledvin je otevřená resekce. S rozvojem miniinvazivních operačních technik se ale zvyšuje jejich uplatnění i u komplikovaných výkonů, solitárních ledvin nevyjímaje (20, 21, 22, 23). Studie porovnávající laparoskopický a otevřený přístup při resekci ledviny neprokázaly rozdíl v PFS (přežití bez progrese – progression free survival) a OS (celkové přežití – overall survival) v centrech s laparoskopickými zkušenostmi (24). Pokles glomerulární filtrace je popisován vyšší u skupiny laparoskopických resekcí v bezprostředním pooperačním období, ale ne při delším sledování (25). Dle jiné komparativní studie nebyl chirurgický přístup prediktorem pro rozvoj pooperační chronické renální insuficience (26).
První větší soubor nemocných, kteří podstoupili resekci solitární ledviny laparoskopicky, popsali v roce 2006 Gill et al. (27). Průměrná doba operace byla 3,3 hodiny a doba teplé ischemie 29 minut (rozmezí 14–55 minut). Autoři závěrem konstatují, že laparoskopie může být bezpečně a účinně použita u resekcí solitárních ledvin při pečlivé selekci pacienta a při výborně zvládnuté technice laparoskopie. Lane et al. ve své práci z roku 2008 uvádějí, že laparoskopický přístup s sebou nese delší dobu teplé ischemie, vyšší míru peri - a postoperačních komplikací a vyšší riziko nutnosti náhrady funkce ledviny po výkonu (28).
Mues et al. ve své multicentrické studii, která mimo jiné porovnává funkční a onkologické výsledky laparoskopického a otevřeného přístupu u solitární ledviny, uvádí u laparoskopického přístupu kratší čas operace, kratší dobu WIT a menší krevní ztrátu ve srovnání s přístupem otevřeným. Navíc popisují u laparoskopických výkonů menší procento pozitivních okrajů a následných recidiv. Ve výskytu komplikací nebyl statisticky významný rozdíl, stejně jako v ovlivnění renálních funkcí. Nicméně výsledky je nutno vnímat s rezervou vzhledem k uplatněné selekci pacientů k laparo ‑ skopickému výkonu. Nemocní, kteří podstoupili resekci otevřenou, měli pravděpodobně ložiska komplexnější (větší, endofytické tumory či léze v blízkosti renálních hilových struktur) (29). Takto lze hodnotit i výsledky z našich souborů, kdy je patrné, že k laparoskopickému výkonu byly indikovány většinou tumory méně komplikované s nejvyšším RENAL skóre 7a. S rostoucí komplexitou tumoru převažovala indikace k výkonům otevřeným.
V posledních letech dochází k přesunu výkonů laparoskopických k roboticky asistovaným. Robotické operace umožňují urologům obejít limitace laparoskopie, zejména při parciální nefrektomii. Výhodou je lepší ergonomie, kratší learning curve a vyšší přehlednost oproti standartní laparoskopii. Roboticky asistovaná resekce solitární ledviny (RPN – robotic partial nephrectomy) nabízí v rukách zkušeného chirurga ve vybraných případech spolehlivé zachování renálních funkcí, nízkou chirurgickou morbiditu a onkologickou bezpečnost (30). Dle metaanalýzy z roku 2018 mají roboticky asistované NSS oproti operacím laparoskopickým signifikantně nižší počet konverzí v otevřený nebo radikální výkon, kratší WIT, menší vliv na pokles eGFR, méně peroperačních a pooperačních komplikací a méně pozitivních resekčních okrajů (31). Gul et al. ve své recentní multicentrické studii udávají průměrnou dobu trvání RPN u solitární ledviny 172 minut, WIT 16 minut a krevní ztrátu 113 ml. Medián délky hospitalizace byl jeden den (rozmezí 1–7 dní), více než polovina nemocných (54,3 %) byla propuštěna z hospitalizace první den po výkonu. RPN u solitární ledviny signifikantně nevedla ke zhoršení funkce ledvin v horizontu dvou let po operaci (32). S příchodem robotického systému na naše pracoviště provádíme nyní všechny miniinvazivní resekční výkony na ledvině tímto přístupem. Do 2/2021 jsme zatím provedli 42 RPN, z toho ve dvou případech se jednalo o ledvinu solitární. Doba trvání těchto výkonů byla 145 minut a 86 min, WIT 7,5 minuty a 9 minut. Krevní ztráta v obou případech byla minimální, pooperační období bylo bez komplikací. Propuštění z hospitalizace proběhlo v obou případech pátý pooperační den.
Alternativou k chirurgickému řešení tumoru solitární ledviny jsou ablační techniky (radiofrekvenční ablace, kryoablace). Výhodou je menší invazivita a morbidita a malé ovlivnění renálních funkcí po výkonu (33). Nicméně onkologické výsledky jsou inferiorní k resekčním výkonům, je zde vyšší riziko lokální recidivy v porovnání s resekcí a nevýhodou je také nedostatečné histopatologické zhodnocení léze (34). Dle současných guidelines Evropské urologické společnosti by se pro vysoké riziko rekurence neměla termální ablace rutinně provádět u tumorů s velikostí nad 3 cm (35).
ZÁVĚR
Cílem operace solitární ledviny by měla být co nejkratší doba teplé ischemie (je-li použito klampování cév), bez snížení nároku na onkologickou bezpečnost a radikalitu výkonu. Obecně je doporučován čas teplé ischemie kratší než 25 minut bez ohledu na zvolený operační přístup, který je nutno volit vždy individuálně dle konkrétního pacienta.
Ve vybraných indikacích (méně komplexní tumory) a v rukách zkušeného operatéra je laparoskopická resekce tumoru solitární ledviny bezpečnou alternativou resekci otevřené. Došlo: 11. 4. 2021 Přijato: 30. 5. 2021
Kontaktní adresa:
MUDr. Jiří Kolář
Urologická klinika LF UK a FN Plzeň Edvarda Beneše 13, 305 99 Plzeň
e-mail: kolarj@fnplzen.cz
Střet zájmů: Žádný.
Prohlášení o podpoře: Zpracování tohoto sdělení bylo podpořeno programem rozvoje vědních oborů Univerzity Karlovy (Projekt P36) a MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPI, 00669806).
Hlavní stanovisko práce: Retrospektivní hodnocení souboru deseti pacientů, kteří na našem pracovišti podstoupili laparoskopickou resekci tumoru solitární ledviny v letech 2007–2020.
Major statement: A retrospective analysis of 10 patients who underwent laparoscopic partial nephrectomy of a solitary kidney at our Department during the years 2007–2020.
Zdroje
1. Ljungberg B, Albiges L, Abu-Ghanem Y, et al. European Association of Urology Guidelines on Renal Cell Carcinoma: The 2019 Update. Eur Urol 2019; 75(5): 799–810.
2. Kolář J, Pitra T, Pivovarčíková K, et al. Hereditární renální nádorové syndromy. Ces Urol. 2020; 24(1): 26–41.
3. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351(13): 1296–1305.
4. Penn I. Evaluation of transplant candidates with pre-existing malignancies. Ann Transplant 1997; 2(4): 14–17
5. Boissier R, Hevia V, Bruins HM, et al. The Risk of Tumour Recurrence in Patients Undergoing Renal Transplantation for End-stage Renal Disease after Previous Treatment for a Urological Cancer: A Systematic Review. Eur Urol 2018; 73(1): 94–108.
6. Rodríguez Faba O, Boissier R, Budde K, et al. European Association of Urology Guidelines on Renal Transplantation: Update 2018. Eur Urol Focus 2018; 4(2): 208–215.
7. Al-Adra DP, Hammel L, Roberts J, et al. Pretransplant solid organ malignancy and organ transplant candidacy: A consensus expert opinion statement. Am J Transplant 2021; 21(2): 460–474.
8. Secin FP. Importance and limits of ischemia in renal partial surgery: experimental and clinical research. Adv Urol 2008 : 102461.
9. Stránský P, Hora M, Hrbáček J, et al. Ischemie ledviny pri resekcích ledvin a možnosti jejího ovlivnění. Ces Urol 2015; 19 : 118–130.
10. Volpe A, Blute ML, Ficarra V, et al. Renal Ischemia and Function After Partial Nephrectomy: A Collaborative Review of the Literature. Eur Urol 2015; 68(1): 61–74.
11. Thompson RH, Lane BR, Lohse CM, et al. Every minute counts when the renal hilum is clamped during partial nephrectomy. Eur Urol 2010; 58(3): 340–345.
12. Thompson RH, Lane BR, Lohse CM, et al. Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney. Urology 2012;79(2):356-60.
13. Mir MC, Campbell RA, Sharma N, et al. Parenchymal volume preservation and ischemia during partial nephrectomy: functional and volumetric analysis. Urology 2013; 82(2): 263–268.
14. Naya Y, Kawauchi A, Yoneda K, et al. A comparison of cooling methods for laparoscopic partial nephrectomy. Urology 2008; 72(3): 687–689.
15. Becker F, Van Poppel H, Hakenberg OW, et al. Assessing the impact of ischaemia time during partial nephrectomy. Eur Urol 2009; 56(4): 625–634.
16. Gill IS, Abreu SC, Desai MM, et al. Laparoscopic ice slush renal hypothermia for partial nephrectomy: the initial experience. J Urol 2003; 170(1): 52–56.
17. Pacigová D, Gaduš L, Heráček J, et al. Využití indocyaninové zeleně při robotických výkonech v urologii. Ces Urol 2018; 22(2): 99–105.
18. Bjurlin MA, Gan M, McClintock TR, et al. Near-infrared fluorescence imaging: emerging applications in robotic upper urinary tract surgery. Eur Urol 2014; 65(4): 793–801.
19. Fergany AF, Saad IR, Woo L, Novick AC. Open partial nephrectomy for tumor in a solitary kidney: experience with 400 cases. J Urol. 2006; 175(5): 1630–1633; discussion 3.
20. Hora M, Klečka J, Ürge T, et al. Laparoskopická resekce tumoru ledvin. Ces Urol 2006; 10(1): 32–39.
21. Pešl M, Novák K, Macek P, et al. Vícečetná laparoskopická resekce u pacientky s mnohočetnými tumory solitární ledviny. Ces Urol 2021; 25(1): 13–14.
22. Macek P, Novák K, Pešl M, et al. Laparoskopická resekce ledviny – komplexní hodnocení perioperačních výsledků jednoho centra. Ces Urol 2019; 23(3): 221–229.
23. Hora M, Eret V, Stránský P, et al. Evoluce operační techniky laparoskopické resekce nádoru ledvin. Ces Urol 2010; 14(1): 24–31.
24. Lane BR, Gill IS. 7-year oncological outcomes after laparoscopic and open partial nephrectomy. J Urol 2010; 183(2): 473–479.
25. Marszalek M, Meixl H, Polajnar M, et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients. Eur Urol 2009; 55(5): 1171–1178.
26. Muramaki M, Miyake H, Sakai I, Fujisawa M. Prognostic Factors Influencing Postoperative Development of Chronic Kidney Disease in Patients with Small Renal Tumors who Underwent Partial Nephrectomy. Curr Urol 2013; 6(3): 129–135.
Štítky
Dětská urologie Nefrologie Urologie
Článek EDITORIALČlánek Ohlédnutí za JEUS 2021
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Antibiotická profylaxe u transrektální fúzní biopsie prostaty
- Ultrasonografická versus fluoroskopická fokusácia urolitiázy pri extrakorporálnej litotrypsii rázovou vlnou
- Laparoskopická resekce tumoru solitární ledviny
- Chlopeň zadní uretry s pozdní manifestací u 14letého chlapce
- Dorzální protuberance pubické symfýzy jako překážka provedení radikální prostatektomie
- Vzácný případ získané herniace ledviny do hrudníku
- Oboustranná inguinální hernie řešená síťkou během extraperitoneální roboticky asistované radikální prostatektomie
- Životné jubileum prof. MUDr. Jána Klimenta, CSc.
- Jubileum profesora Tomáše Hanuše
- Profesor Babjuk slaví šedesátiny
- Ohlédnutí za JEUS 2021
- EDITORIAL
- Poranění dolní duté žíly jako komplikace laparoskopické radikální nefroureterektomie s retroperitoneální lymfadenektomií
- Transperineální biopsie v diagnostice karcinomu prostaty
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Transperineální biopsie v diagnostice karcinomu prostaty
- Antibiotická profylaxe u transrektální fúzní biopsie prostaty
- Chlopeň zadní uretry s pozdní manifestací u 14letého chlapce
- Laparoskopická resekce tumoru solitární ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



