-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiologická regrese metastatického renálního karcinomu po biologické léčbě sunitinibem – kazuistika a přehled literatury
Radiological regression of metastatic renal carcinoma after biological treatment with Sunitinib – case report and literature review
Renal cell carcinoma is a metastatic disease in up to 21% of patients at the time of diagnosis. Modern targeted therapy and immunotherapy a have significantly improved the prognosis of patients with metastatic disease. We present a case report of a patient with metastatic renal cell carcinoma, multiple lung and pleural metastases. There was complete radiological regression of lung metastases of seven months duration after sunitinib treatment. Only microscopic bearings of clear cell renal carcinoma were found in the pathological specimen after nephrectomy.
Keywords:
targeted therapy – imunotherapy – Metastatic renal cell carcinoma – sunitinib
Autoři: Vladimír Šámal 1,2; Igor Richter 3; Vít Paldus 1; Tomáš Jirásek 4; Jan Mečl 1
Působiště autorů: Urologické oddělení, Krajská nemocnice Liberec, a. s., Liberec 1; Urologická klinika FN a LF UK, Hradec Králové 2; Onkologické oddělení, Krajská nemocnice Liberec, a. s., Liberec 3; Oddělení patologie, Krajská nemocnice Liberec, a. s., Liberec 4
Vyšlo v časopise: Ces Urol 2019; 23(4): 341-346
Kategorie: Kazuistika
Souhrn
Renální karcinom je v době diagnózy až u 21 % pacientů již generalizované onemocnění. Moderní cílená léčba a imunoterapie výrazně zlepšila prognózu pacientů s tímto onemocněním. Prezentujeme kazuistiku pacienta s generalizovaným karcinomem ledviny, mnohočetnými plicními a pleurálními metastázami. Po léčbě sunitinibem došlo ke kompletní radiologické regresi plicních metastáz v trvání sedmi měsíců. V patologickém preparátu po provedené nefrektomii byla zastižena pouze mikroskopická ložiska světlobuněčného renálního karcinomu.
Klíčová slova:
Metastatický renální karcinom – sunitinib – cílená léčba – imunoterapie
ÚVOD
Zhoubné nádory ledvin představují 2–3 % nádorových onemocnění, přibližně 21 % pacientů se prezentuje v době diagnózy metastatickým onemocněním a u 23 % pacientů, kteří podstoupí nefrektomii pro lokalizované onemocnění, se rozvine metastatické onemocnění v pětiletém období po výkonu (1). Možnosti léčby metastatického renálního karcinomu (mRCC) se za poslední dekádu dramaticky změnily. Do roku 2005 se léčba mRCC opírala o cytokiny. V roce 1992 byl pro léčbu schválen interleukin 2, později pak interferon‑α (2). Medián OS byl 13 měsíců, medián PFS byl 4,7 měsíce, navíc byla léčba provázena vysokou toxicitou (3).
Po roce 2005 nastává éra rychlého rozvoje cílené léčby. Identifikace genu VHL (von Hippel‑Lindau) a poznatky o jeho vlivu na regulaci proangiogenních faktorů hrály významnou roli ve výzkumu zaměřeném, jednak proti receptoru pro vaskulární endoteliální růstový faktor (VE‑GFR), a dále proti dráze mTOR. Registrační studie TARGET se sorafenibem prokázala v roce 2005 signifikantně delší dobu přežití do progrese (PFS) proti placebu (5,5 vs. 2,8 měsíce) jako léčba druhé linie po cytokinech (4). Poté Motzer et al. prokázali významné prodloužení PFS při léčbě sunitibem v porovnání s interferonem (PFS 11,0 vs. 5,0 mě ‑ síců) v první linii (5).
Cílená léčba významně zlepšila výsledky léčby mRCC ve smyslu prodloužení PFS a ve vyšších liniích i OS. Část pacientů dosáhne stabilizace onemocnění (SD – Stable Disease) nebo částečné odpovědi (PR – Partial Response). Kompletní remise (CR) dosáhnou asi 3 % pacientů (6). V současnosti máme standardně definované tři linie cílené terapie pro pacienty s mRCC (7). V léčbě první linie v ČR mají zatím dominantní postavení inhibitory tyrozinkinázových receptorů (TKI) sunitinib a pazopanib. Ve druhé a třetí linii se uplatňují TKI novější generace a hlavně imunoterapie, méně již mTOR inhibitory. Na podkladě proběhlých klinických studií však dojde v blízké buducnosti k zásadní změně léčebných postupů s využitím kombinované terapie.
Referujeme kazuistiku pacienta s mRCC s radiologickou remisí plicních a pleurálních metastáz a významnou regresí primárního nádoru.
KAZUISTIKA
V době diagnózy 50letý muž s anamnézou bronchiálního astmatu se dostavil k vyšetření pro 14 dní narůstající dušnost. V anamnéze bez dalších závažných komorbidit. Při vstupním vyšetření na rtg snímku hrudníku byl zobrazen objemný fluidotorax. Zaveden hrudní drén vlevo. Následné CT hrudníku potvrdilo fluidotorax vlevo s nálezem mnohočetných sytících se ložisek na pleuře i oboustranně v plicním parenchymu. Největší plicní ložiska velikosti až 55 mm. Okrajově zachycen tumor levé ledviny. Provedeno cíleně CT břicha s nálezem objemného tumoru levé ledviny s infiltrací zádových svalů. Scintigrafie skeletu v rámci stagingu bez nálezu kostních metastáz. Pro anamnézu vertiga doplněno také nativní CT mozku, kde byl normální nález. Vzhledem k velkoobjemovému a symptomatickému plicnímu nálezu jsme se rozhodli po multidisciplinárním konziliu zahájit systémovou léčbu. Proto byla provedena CT cílená biopsie tumoru ledviny s nálezem světlobuněčného renálního karcinomu grade II (Fuhrmann). Staging onemocnění cT4N0M1, 4. klinické stadium. Pacient stratifikován do kategorie středního rizika podle MSKCC (dva rizikové body – hemoglobin < dolní limit laboratorního rozpětí a interval do systémové léčby < 1 rok), celkový performance status 1 dle ECOG.
Od listopadu 2017 jsme zahájili léčbu sunitinibem v úvodní dávce 50 mg/den na 28 dní, pak 14 dní pauza. Po třech sériích provedeno restagingové CT vyšetření (únor 2018) – nález kompletní regrese plicních a pleurálních metastáz, vymizení fluidotoraxu (Obr. 1). Také došlo k výrazné redukci velikosti primárního tumoru levé ledviny ze vstupních 80 × 85 mm na velikost 45 × 40 mm se změnou sycení tkáně, která vykazovala spíš strukturu nekrotické tkáně (Obr. 2). Vzhledem k příznivé odpovědi na cílenou léčbu s kompletní radiologickou regresí metastáz a při dobrém performance stavu (ECOG 0) byl pacient indikován k operačnímu řešení primárního nádoru.
Obr. 1. Na vstupním CT vyšetření plic je patrný sytící se tumor pleury (A) s rozsáhlým fluidotoraxem a dvě plicní metastázy v pravém plicním křídle (B, na kontrolním CT za tři měsíce po léčbě sunitinibem regrese postižení pleury (C) i plicních ložisek (D); na CT snímcích zobrazeny řezy v přibližně stejné úrovni; ložiska označena šipkami
Fig. 1. Initial CT scan of the lung demonstrates a pleural metastasis (A) with pleural effusion. There are two metastases in the right lung base (B). CT three months after treatment with sunitinib demonstrates regression of the pleural (C) and pulmonary metastases (D). Slices at approximately the same level are displayed on CT images. Metastases indicated by the arrows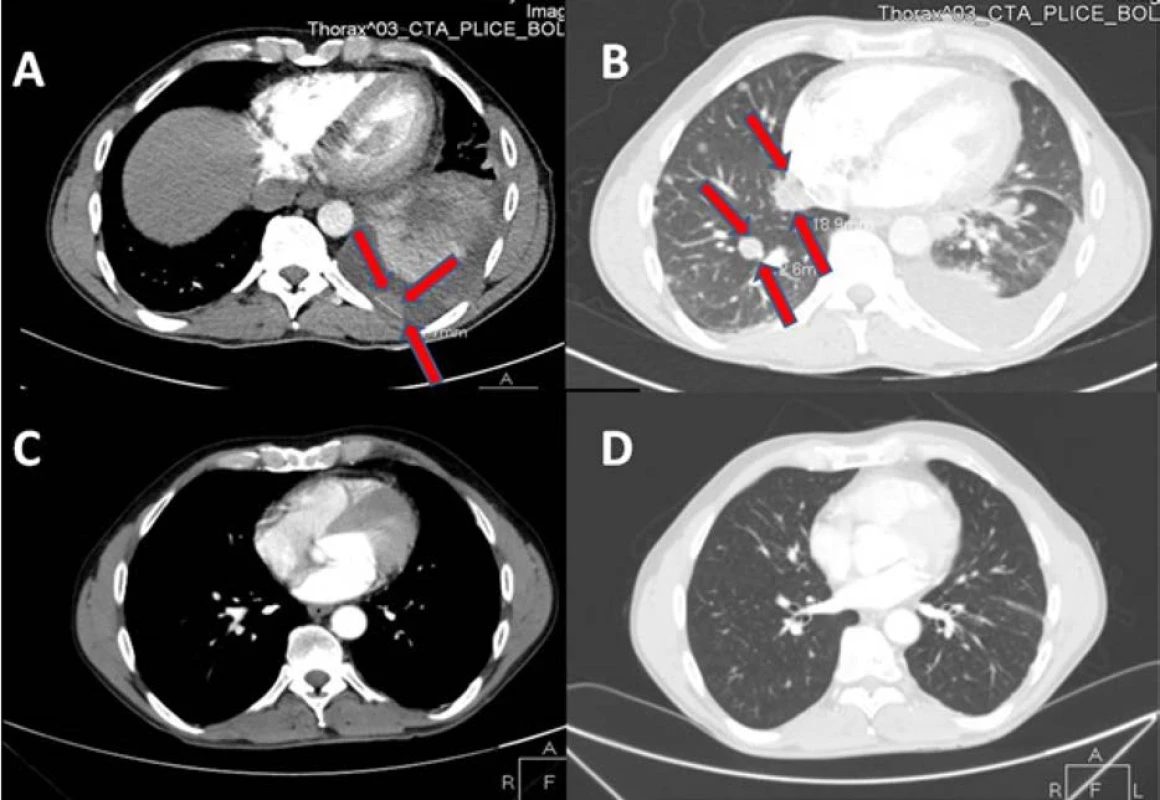
Obr. 2. CT vyšetření ledvin se zobrazením primárního nádoru levé ledviny v době diagnózy (A); kontrolní CT vyšetření po tříměsíční léčbě sunitinibem prokázala výraznou regresi primárního nádoru, bez sycení tkáně; denzita odpovídala fibrotické tkáni, centrálně pak nekróze (B)
Fig. 2. CT scan of the kidneys showing primary left kidney tumor at the time of diagnosis (A). Control CT examinations after three months of sunitinib treatment showed significant regression of the primary tumor, without tissue enhancement. The density corresponded to fibrotic tissue with central necrosis (B).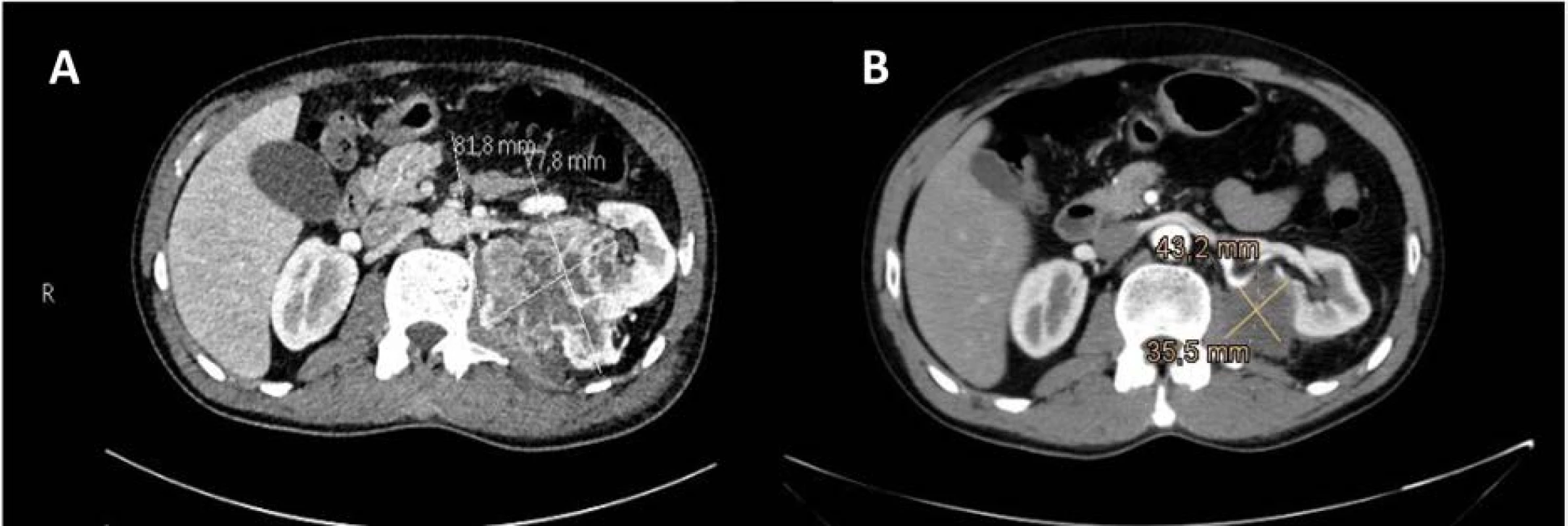
Nefrektomie provedena za čtyři měsíce od zahájení systémové léčby. Při výkonu odstraněna ledvina, kde v centrální části ledviny fibrózní tkáň o velikosti 25 × 35 × 25 mm. Mikroskopicky se jednalo o zcela regresivně změněnou tkáň s nekrózami a mikroložisky cystisticky transformovaného světlobuněčného renálního karcinomu (Obr. 3 a 4). Léčba sunitinibem nebyla přerušena z důvodu operace, nezaznamenali jsme komplikace s hojením operační rány.
Obr. 3. Zbytky světlobuněčného karcinomu (označeno bílými šipkami), v okolí známky regrese nádoru s depozicí fibrinu (1.), erytrocyty (2.) a ložisky nekrotické tkáně (3.); původní zvětšení x100, hematoxylin-eosin
Fig. 3. Residuals clear cell carcinoma (marked with white arrows), around signs of tumor regression with fibrin deposition (1.), erythrocytes (2.) and necrotic tissue foci (3.). Original magnification x100, hematoxylin- eosin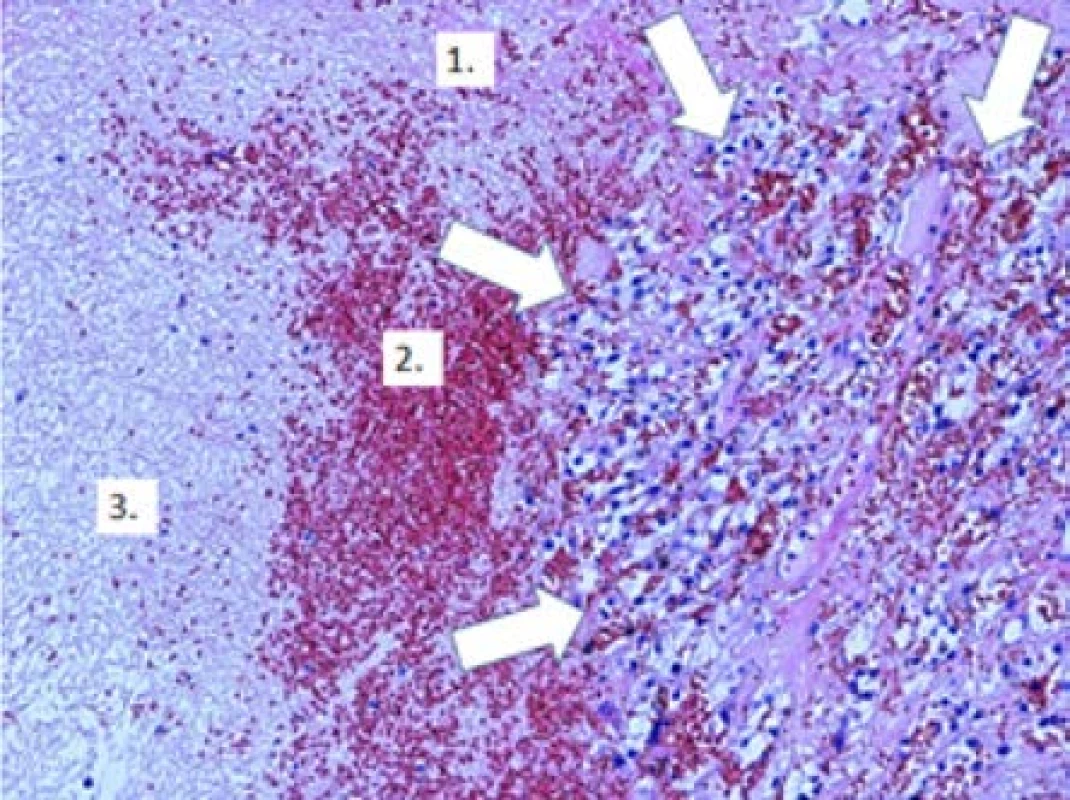
Obr. 4. Zbytky světlobuněčného karcinomu (označeno červenými šipkami), bílé šipky ozačují ložiska hemosiderinu, nejspíše související s organizací krevních sraženin v místě regrese nádoru po léčbě; původní zvětšení x40, hematoxylin-eosin
Fig. 4. Residuals of clear carcinoma (marked with red arrows), white arrows mark hemosiderin foci, most likely related to the organization of blood clots at the site of tumor regression after treatment. Original magnification x40, hematoxylin-eosin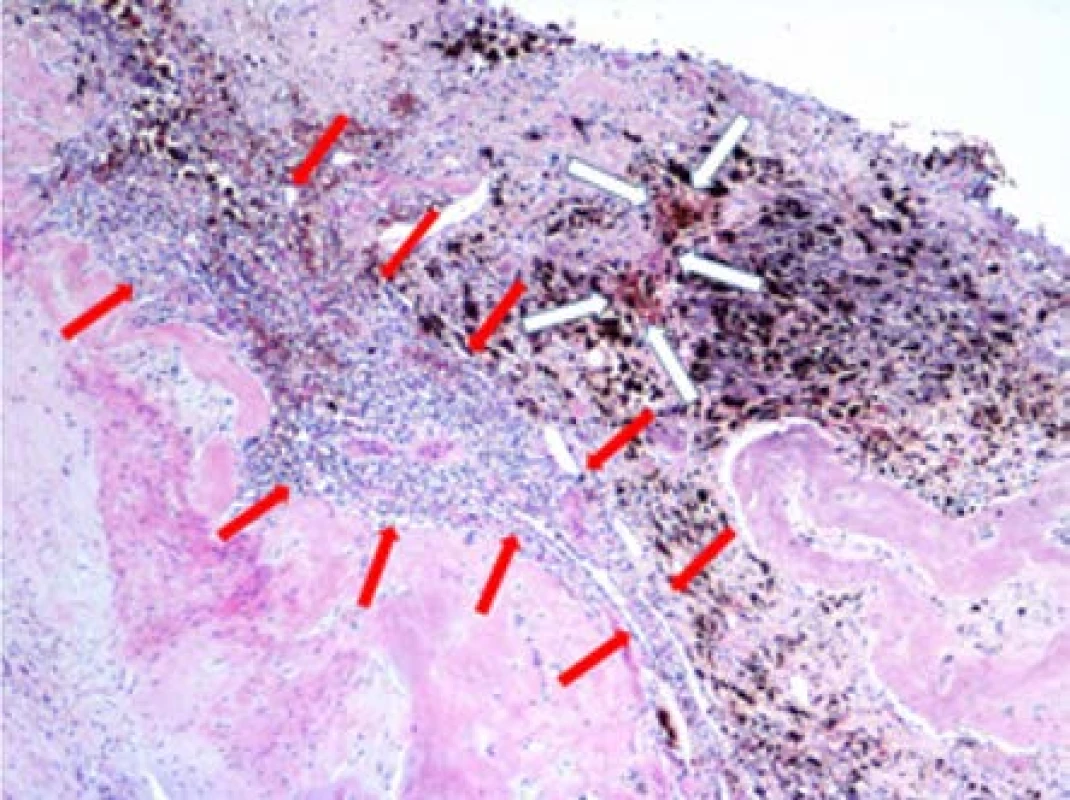
I přes kompletní remisi metastáz a odstranění primárního tumoru pacient pokračoval v medikaci sunitinibem. Za další tři měsíce (červenec 2018) po provedené nefrektomii, restagingové CT s nálezem metastatického kostního postižení lopaty kosti kyčelní vpravo a křížové kosti. Pacient indikován k léčbě II. linie kabozantinibem v dávce 60 mg/den. Další kontrolní CT po třech měsících ukázalo progresi kostního metaprocesu. Po dvou liniích cílené léčby jsme ve III. linii indikovali imunoterapii nivolumabem v dávce 480 mg i. v. á čtyři týdny. Během léčby III. linie pro bolesti skeletu pánve analgetická iradiace dávkou 3/30 Gy na sakrum a dávkou 3.6/36 Gy na levou pánevní kost. Další restagingové CT prokazuje další progresi kostního metaprocesu co do velikosti stávajících ložisek, tak i počtu nově vzniklých metastáz. Navíc se nově objevují mnohočetné plicní metastázy v obou plicních křídlech do velikosti 10 mm a metastázy do me ‑ diastinálních uzlin velikosti do 15 mm. Po zvážení byla ponechána léčba nivolumabem s časným kontrolním CT k vyloučení pseudoprogrese. I toto vyšetření ale prokázalo nález významné progrese počtu a velikosti plicních metastáz, progrese mediastinální lymfadenopatie a nově solidní metastáza v hrudní stěně vlevo velikosti 7 cm, progrese kostního metaprocesu s patologickou frakturou sakra. Léčba nivolumabem ukončena. V současné době je pacient na sympto ‑ matické terapii a klinický stav se horší. Cílenou léčbu i imunoterapii pacient dobře toleroval s výskytem běžných nežádoucích účinků (únava, stomatitida, průjem) 1. stupně toxicity.
DISKUZE
Histologický typ nádoru bývá často považován za jeden z klíčových prognostických faktorů, který rozhoduje o úspěchu léčby. Skupina RCC zahrnuje histologicky různorodou skupinu nádorů s rozdílným stupněm malignity a prognózy. Nejčastější je světlobuněčný renální karcinom (ccRCC) v 75–80 % případů. Až 70 % pacientů s ccRCC má alteraci VHL genu (8). Alterace VHL genu vede složitými mechanizmy k aktivaci angiogenze, zvýšení celulární migrace, což se považuje za promotor metastazování (9). Zbývajících 20–25 % tvoří nesvětlobuněčné nádory. Nejčastější je papilární renální karcinom typu I a II u 10–15 % pacientů, charakterizovaný alterací MET onkogenu a řadou dalších genových alterací. Chromofobní typ karcinomu se vyskytuje asi v 5 %, u tohoto typu nádoru jsou časté delece mitochondriální DNA. Mezi jednotlivými typy RCC se často nacházejí sarkomatózní elementy, jejich koexistence je prokázána až u 25 % pacientů a je spojena s horší prognózou. Vývoj nové cílené léčby přinesl také detailnější pohled na biologii metastáz. V řadě prací byla prokázaná výrazná heterogenita metastáz. Například v expresi PD‑L1 receptorů byl u renálního karcinomu nalezen sice konzistentní výskyt v metastáze, ale výrazná heterogenita v distribuci v různých částech metastázy, což může mít vliv na efektivitu léčby (10).
V počátcích klinického výzkumu sunitinibu Faivre et al. zaznamenali klinickou odpověď u třech z 28 pacientů v pilotním souboru trvající 28, 36 a 54 týdnů. S ohledem na zaznamenané nežádoucí účinky doporučili léčebnou dávku 50 mg/den po dobu čtyř týdnů s dvoutýdenní přestávkou (11). V klinické studii fáze II pak Motzer et al. zahrnuli do studie 106 pacientů s mRCC, všichni byli po nefrektomii a po sel hané léčbě cytokiny. U 36 pacientů (34 %) zaznamenal PR, 30 pacientů (29 %) mělo SD v trvání více než tři měsíce (5). Na tuto studii později navázal stejný autorský tým III. fází klinické studie, porovnávali léčbu mRCC sunitinibem a inferferonem ‑α. Medián PFS byl 11 vs. 5 měsíců ve prospěch sunitinibu (p < 0,00001).
Na základě této studie FDA registrovala sunitinib k léčbě mRCC v první linii (6). Léčba sunitibem je provázena také řadou nežádoucích účinků. Mezi nejčastější patří únava (63 %), stomatitida (27 %), dermatitida (23 %) a průjem (57 %). Časté jsou také laboratorní odchylky: neutropenie (78 %), trombocytopenie (78 %) nebo anémie (60 %). Převážně se ale jedná o toxicitu stupně 1–2. Výskyt závažnějších nežádoucích účinků se zpravidla řeší postupnou redukcí dávky až na 25 mg, nově také změnou dávkovacího schématu na 2/1, tedy dva týdny terapie s týdenní pauzou (12).
Cílená léčba signifikantně zlepšila výsledky pacientů s mRCC ve smyslu prodloužení PFS a ve druhé či třetí linii i OS, většina pacientů dosáhne SD nebo PR. Mnohem méně častá je CR, která se udává do 3 % u sunitinibu v III. fázi studie (6). CR je často prezentovaná spíše jako soubor kazuistik, než ucelený soubor, povětšinou u pacientů užívajících sunitinib či pazopanib (13).
Nelze opominout postavení cytoredukční nefrektomie v dnešní době. V éře léčby cytokiny byla často prováděna cytoredukční nefrektomie jako standardní součást léčby před podáním systémové léčby s cílem redukce nádorové tkáně. V současné době máme k dispozici výsledky studie CARMENA, která sledovala roli cytoredukční nefrektomie a její sekvenci při podávání VEGFR cílené léčby (14). Studie prokázala, že cytoredukční nefrektomie u pacientů se středním a vysokým rizikem (podle MSKCC klasifikace) a asymptomatickým nádorem, provedená před podáním cílené léčby má horší výsledky než primární podání cílené léčby. Operační výkon je často spojen s vysokou morbiditou, mortalitou. Na druhou stranu může být nefrektomie volbou pro pacienty s lokálními příznaky nebo pacienty s příznivou odpovědí na cílenou léčbu. Obdobné výsledky prokázala také studie SURTIME (15). Metastazektomie je vhodná u pacientů s oligomestatickým onemocněním a chirurgicky přístupnými metastázami. Kompletní metastazektomie prodlužuje OS (16).
Na prezentované kazuistice vidíme zajímavou kompletní radiologickou regresi plicního nálezu po léčbě sunitibem v první linii, další zajímavostí jsou výrazné regresivní změny v primárním nádoru ledviny po cílené léčbě. Parciální remise onemocnění trvala sedm měsíců.
ZÁVĚR
I přes moderní cílenou léčbu, která vede u řady pacientů k remisi onemocnění, je mRCC závažné nevyléčitelné onemocnění. Cílená léčba pacientů výrazně prodlouží život se zachováním jeho kvality.
Došlo: 11. 9. 2019
Přijato: 16. 10. 2019
Kontaktní adresa:
MUDr. Vladimír Šámal, Ph.D.
Urologické oddělení, Krajská nemocnice Liberec, a. s.
Husova 10,
460 63 Liberec
e‑mail: vladimir.samal@nemlib.cz
Střet zájmů: Žádný.
Prohlášení o podpoře: Autoři prohlašují, že práce nevznikla s finanční podporou.
Zdroje
1. Dabestani S, Thorstenson A, Lindblad P, et al. Renal cell carcinoma recurrences and metastases in primary nonmetastatic patients: a population‑based study. World J Urol 2016; 34(8): 1081–1086.
2. Motzer RJ, Bacik J, Murphy BA, Russo P, Mazumdar M. Interferon‑alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289–296.
3. Fyfe G, Fisher RI, Rosenberg SA, et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high ‑dose recombinant interleukin‑2 therapy. J Clin Oncol 1995; 13(3): 688–696.
4. Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear‑cell renal‑cell carcinoma. N Engl J Med 2007; 356(2): 125–134.
5. Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. Jama 2006; 295(21): 2516–2524.
6. Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27(22): 3584–3590.
7. Albiges L, Powles T, Staehler M, et al. Updated European Association of Urology Guidelines on Renal Cell Carcinoma: Immune Checkpoint Inhibition Is the New Backbone in First‑line Treatment of Metastatic Clear ‑cell Renal Cell Carcinoma. Eur Urol 2019; 76(2): 151–156.
8. Gong J, Maia MC, Dizman N, Govindarajan A, Pal SK. Metastasis in renal cell carcinoma: Biology and implications for therapy. Asian Journal of Urology 2016; 3(4): 286–292.
9. Zhou L, Liu XD, Sun M, et al. Targeting MET and AXL overcomes resistance to sunitinib therapy in renal cell carcinoma. Oncogene 2016; 35(21): 2687–2697.
10. Callea M, Albiges L, Gupta M, et al. Differential Expression of PD ‑L1 between Primary and Metastatic Sites in Clear‑Cell Renal Cell Carcinoma. Cancer Immunol Res 2015; 3(10): 1158–1164.
11. Faivre S, Delbaldo C, Vera K, et al. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol 2006; 24(1): 25–35.
12. Najjar YG, Mittal K, Elson P, et al. A 2 weeks on and 1 week off schedule of sunitinib is associated with decreased toxicity in metastatic renal cell carcinoma. Eur J Cancer 2014; 50(6): 1084–1089.
13. Staehler M, Haseke N, Zilinberg E, et al. Complete remission achieved with angiogenic therapy in metastatic renal cell carcinoma including surgical intervention. Urol Oncol 2010; 28(2): 139–144.
14. Mejean A, Ravaud A, Thezenas S, et al. Sunitinib Alone or after Nephrectomy in Metastatic Renal ‑Cell Carcinoma. N Engl J Med 2018; 379(5): 417–427.
15. Bex A, Mulders P, Jewett M, et al. Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncol 2019; 5(2): 164–170.
16. Dabestani S, Marconi L, Hofmann F, et al. Local treatments for metastases of renal cell carcinoma: a systematic review. Lancet Oncol 2014; 15(12): e549–561.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2019 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Laparoskopická transperitoneální rekonstrukce symptomatického retrokaválního močovodu - kazuistika
- Urogenitální tuberkulóza
- Hormonálně senzitivní karcinom prostaty
- Prevalence uropatogenů v moči a spektrum jejich rezistence – analýza dat z jednoho pracoviště
- Porovnání měření velikosti prostaty pomocí transrektálního ultrazvuku a magnetické rezonance a jejich vlivu na PSA denzitu
- Plastika tříselné kýly a laparoskopická radikální extraperitoneální prostatektomie
- Radiologická regrese metastatického renálního karcinomu po biologické léčbě sunitinibem – kazuistika a přehled literatury
- Emfyzematózní cystitida u 78leté ženy
- Možnost roboticky asistované augmentace močového měchýře typu „Patch“ pomocí daVinci XI®
- Zpráva z konání 17th European Urology Residents Education Programme (EUREP)
- V Praze je blaze aneb ohlédnutí za 65. ročníkem výroční konference ČUS
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2018
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Porovnání měření velikosti prostaty pomocí transrektálního ultrazvuku a magnetické rezonance a jejich vlivu na PSA denzitu
- Plastika tříselné kýly a laparoskopická radikální extraperitoneální prostatektomie
- Emfyzematózní cystitida u 78leté ženy
- Hormonálně senzitivní karcinom prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



