-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laparoskopická resekce ledviny – komplexní hodnocení perioperačních výsledků jednoho centra
Laparoscopic partial nephrectomy: a comprehensive evaluation of single-centre perioperative outcomes
Aim: Assessment of perioperative and oncological results of laparoscopic nephron-sparing procedures for renal tumors.
Material a methods: We evaluate data from a prospectively collected database in one center between 1/2013 and 6/2018. Operations were performed by 3 surgeons. There were 174 patients available for final analysis. The cohort included also 1 one-stage bilateral case, 9 cases of multiple one-stage partial nephrectomy (PN) (2–5 lesions) and in 8 cases PN of solitary kidney. Altogether, 190 renal masses were resected (left side 102×, right side 88×), in 64 women and 110 men. Cohort medians (IQR = interquartile range) were: age 64 (55–70) years, Charleson comorbidity index 3 (2–4), creatinine 78 (68–95) μmol/L, lesion diameter 27 (20–35) mm, PADUA score 8 (7–9).
Results: Length of surgery median 118 (IQR 88 – 150) min, blood loss median 150 (IQR 80–300) ml, no warm ischemia (WI) used in 51 of 190 lesions, in other length of WI median 15 (IQR 12–17) min, in 2 patients conversion to open PN was needed and in 2 patients conversion to laparoscopic nephrectomy (1× bleeding; 1× renal vein tumor thrombus). There were 44 complications according to Clavien-Dindo (CD) classification within 30 post-operative days: 17× grade 1, 13× grade 2, 10× grade 3, 1× grade 4, 3× grade 5, i.e. CD ≥ 3 in 8 % of patients. Symptomatic pseudoaneurysm was diagnosed in 4 pts – all treated by selective embolization. Post-operative hospital stay was median 6 (IQR 5–7) days. Histology found 45 benign and 145 malignant lesions, of the latter 122× pT1a, 16× pT1b, 3× pT2a and 4× pT3a. Positive margin rate was 11%. Only 1 patient underwent new PN via open approach, others were monitored. We detected 1 local kidney recurrence (in R0 surgery), 1 rapid distant progression (cerebral metastases) and 1 combined local (in perirenal fat) and distant (lungs) recurrence (in R0 surgery). Trifecta based on Montsouris (R0 + WI ≤ 25min + absence of CD ≥ 3 complication) was 74,1%, based on Khalifeh et al. (R0 + WI ≤ 25 min + no complication) was 59,2% and based on Porpiglia et al. (R0 + WI ≤ 20 min + absence of CD ≥ 3 complication) was 69 %.
Conclusion: Laparoscopic PN is a standard management option of solid renal masses providing favorable outcomes. Trifecta rate was comparable to published results. The work was supported by a grant project MZ ČR – RVO VFN64165.
Keywords:
Partial nephrectomy – laparoscopy – trifecta
Autoři: Petr Macek 1,2; Květoslav Novák 1; Michael Pešl 1; Maria Stevens 1; Tomáš Hradec 1; Vojtěch Fiala 1; Rodrigo Gouveia 1; Lenka Plincelnerová 1; Lucie Vávřová 1; Lenka Bauerová 3; Tomáš Hanuš 1
Působiště autorů: Urologická klinika 1. LF UK a VFN v Praze 1; Department of Urology, Institut Montsouris, Université Paris Descartes, Paris, France 2; Ústav patologie 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Ces Urol 2019; 23(3): 221-229
Kategorie: Originální práce
Souhrn
Cíl: Zhodnocení perioperačních funkčních a onkologických výsledků laparoskopických nefron‑šetřících operací pro nádor ledvin.
Materiál a metoda: Hodnoceny jsou údaje z prospektivně vedené databáze jednoho centra z období od 1/2013 do 6/2018. Výkony prováděli tři operatéři. Finálně bylo vyhodnoceno 174 pacientů. Uvedený počet výkonů zahrnoval také jeden oboustranný výkon, děvet vícečetných jednodobých resekcí (2–5 lézí) a v osmi případech resekce solitární ledviny. Celkem bylo odstraněno 190 ložisek (vlevo 102×, vpravo 88×), u 64 žen a 110 mužů. Mediány souboru (IQR = interkvartilové rozpětí): věk 64 (55–70) let, index komorbidit Charlesonové 3 (2–4), kreatinin 78 (68–95) μmol/L, velikost léze 27 (20–35) mm, PADUA skóre 8 (7–9).
Výsledky: Délka výkonu medián 118 (IQR 88–150) min, krevní ztráty medián 150 (IQR 80–300) ml, výkon bez ischemie (IT) 51×/190 lézí, délka IT medián 15 (IQR 12–17) min, 2× proběhla konverze na otevřenou RL, 2x konverze na laparoskopickou nefrektomii. Během 30 dnů bylo zaznamenáno 44 komplikací Claviena‑Dinda (CD): stupeň 1–17×, 2–13×, 3–10×, 4–1×, 5–3×; tj. CD ≥ 3 u 8 % pacientů. Ve čtyřech případech bylo zjištěno symptomatické pseudoaneuryzma, které vždy vyřešeno selektivní embolizací. Pooperační hospitalizace byla s mediánem 6 (IQR 5–7) dní. Histologicky bylo 45 lézí benigních, 145x maligních, z toho 122× pT1a, 16× pT1b, 3× pT2a, 4× pT3a. Pozitivní okraj byl zaznamenám u 11 %. Pouze jedna pacientka podstoupila otevřenou re‑resekci, ostatní byli sledováni. Při sledování byla zaznamenána jedna lokální recidiva v ledvině (při R0 výkonu), 1× rychlá vzdálená progrese (mozkové metastázy) a 1× současně vzdálená (plíce) i lokální progrese v perirenálním tuku (při R0). Trifekta hodnocená dle Montsouris (R0 výkon + IT ≤ 25 min + absence komplikace CD ≥ 3) dosažena u 74,1 %, dle Khalifeha a kol. (R0 + IT ≤ 25 min + žádná komplikace) u 59,2 %, dle Porpiglii a kol. (R0, IT ≤ 20 min, absence komplikace CD ≥ 3) u 69 %.
Závěr: Laparoskopická RL je standardním řešením solidních expanzí ledvin poskytující příznivé výsledky. Míra dosažení komplexního klinického úspěchu (= trifekta) byla srovnatelná s literárními údaji.
Klíčová slova:
Resekce ledviny – laparoskopická – trifekta
ÚVOD
Celosvětově je stále zaznamenáván mírný růst solidních expanzí ledvin související s rozšiřováním indikací k abdominálnímu zobrazovacímu vyšetření. Celkově tvoří 2–3 % zhoubných nádorů. Česká republika má v této oblasti světovou prioritu (1).
Resekce ledviny (RL) je doporučovaným řešením pro ložiska kategorie cT1 (2). Možné jsou přístupy otevřené, laparoskopické nebo roboticky‑asistované v závislosti na vybavení pracoviště a zkušenostech operatéra. Výsledky RL lze hodnotit z mnoha hledisek – onkologických, funkčních nebo perioperačních výsledků, kam patří také míra komplikací. Srovnání jednotlivých souborů může být složité s ohledem na odlišnosti ve vstupních charakteristikách jednotlivých souborů a z tohoto důvodu jsou často vedeny diskuze, který přístup či postup je vhodnější. Určitou standardizaci umožňuje jednak předoperační hodnocení komplexnosti tumorů nejen dle velikost, ale také dle nefrometrických skóre (3). Další možností je pak spojit více parametrů do jednoho ukazatele, jehož příkladem je trifekta. Ta hodnotí současné dosažení tří stanovených kritérií u jednoho pacienta a míra trifekty v daném souboru může pomoci v hodnocení úspěšnosti péče, byť i tento parametr úzce souvisí s předoperačními charakteristikami a zkušenostmi operatéra.
Tato práce prezentuje výsledky laparoskopických resekcí ledvin jednoho centra z pohledu perioperačních výsledků, komplikací, onkologických parametrů i dosažení trifekty podle vybraných definic.
MATERIÁL A METODIKA
Provedli jsme zpracování výsledků prospektivně vytvářené databáze záchovných výkonů na ledvinách z důvodu indikace solidní expanze ledviny. Jedná se o výsledky jednoho terciárního retenčního centra. Zpracované období zahrnuje výsledky pacientů operovaných v období mezí 1. lednem 2013 a 6. červnem 2018.
V uvedeném období bylo operováno 178 pacientů. Pro nekompletnost dat byli čtyři pacienti vyřazeni a hodnoceno bylo 174 pacientů. Funkce ledviny byla hodnocena hladinou kreatininemie a hodnotou vypočtené glomerulární filtrace (eGF = estimated glomerular filtration). Hodnocení odhadované glomerulární filtrace bylo provedeno podle rovnice Lund‑Malmö (LM) s korekcí na množství svalové hmoty (LBM = lean body mass) (4). Hodnocení komorbidit bylo provedeno dle indexu Charlesonové (CCI = Charleson comorbidity index) (5). Statistické zpracování bylo provedeno softwarem Microsoft Office EXCEL 2016. Charakteristiky souboru jsou uváděny jako mediány s interkvartilovým rozpětí (IQR), není‑li uvedeno jinak. Charakteristiky expanzí ledvin byly hodnoceny velikostí a nefrometrickým skóre PADUA (= Perioperative Aspects and Dimensions Used for Anatomical classification) (6). Jako pozitivní okraj byl považován kontakt nádoru s barvenou spodinou resekátu, případně byl jako pozitivní označen i tehdy, pokud nebylo patologem explicitně uvedeno, že se jedná o okraj negativní. Ke klasifikaci lokálního rozsahu byla použita UICC TNM klasifikace z roku 2009 (platná v roce 2013 a bez výraznějších změn pro T kategorii i později) (7). Komplikace byly hodnoceny dle Claviena‑Dinda (CD) (8) v období do 30 dnů po operaci. K hodnocení komplexnosti kvality výkonu byly použity tři definice „trifekta“ s různými parametry a naše výsledky srovnány s originálními publika cemi. Ke splnění trifekta je nutné splnění všech tří kritérií současně. Použité trifekta definice zahrnovaly zhodnocení dle: 1) Institutu Montsouris (negativní okraj (R0) + teplá ischemie (TI) maximálně 25 minut + absence velké „MAJOR“ komplikace Clavien‑Dindo ≥ 3) (9); 2) dle Khalifeha (negativní okraj + TI maximálně 25 minut + absence pooperační komplikace) (10); 3) dle Porpiglii (také známou jako definici MIC = „margin, ischemia, complications“ = negativní okraj + TI maximálně 20 minut + absence velké „MAJOR“ komplikace Clavien‑Dindo ≥ 3) (11). Funkční výsledky nejsou prezentovány, protože nejde o uniformní skupinu pacientů, kde výkony jako multiresekce, resekce solitární ledviny nebo oboustranný výkon a samozřejmě heterogenita předoperační funkce, znamenají velké odchylky v krátkodobých výsledcích. Dlouhodobé funkční výsledky nejsou pak dostupné u všech pacientů s ohledem na sledování jinými spolupracujícími pracovišti.
VÝSLEDKY
Hodnocení bylo provedeno u 174 pacientů. Soubor zahrnoval 64 žen a 110 mužů. U uvedených pacientů bylo odstraněno celkem 190 ložisek. Výkony ovšem zahrnovaly také: jeden oboustranný výkon, devět vícečetných jednodobých resekcí (2–5 lézí) a v osmi případech resekce solitární ledviny. Z celkového počtu 190 ložisek se jednalo 102× o postižení vlevo a 88x vpravo. Laparoskopické výkony prováděli tři operatéři. Věk souboru měl medián 64 (IQR 55–70) let a index komorbidit Charlesonové medián 3 (IQR 2–4). Medián předoperačního kreatininu byl 78 (IQR 68–95) μmol/L. Uvedený kreatinin odpovídal mediánu eGF dle rovnice LM 70,9 (IQR 58–78,8) ml/min. Typickou indikací byla ložiska kategorie cT1. Resekci podstoupilo také několik pacientů s větším, ale příznivě uloženým ložiskem. Nejmenší ložisko mělo 5 mm (neresekováno samostatně, ale jako součást vícečetné resekce), největší pak 93 mm. Charakteristiky souboru v rozšířené formě jsou v tabulce 1. Rozdělení do jednotlivých stupňů renální insuficience je v souhrnné tabulce 2.
Tab. 1. Charakteristiky souboru pacientů (BMI = body mass index, CCI = index komorbidit Charlesonové, eGF = estimated glomerular filtration = odhadovaná (= vypočtená dle rovnice) glomerulární filtrace, IQR = interquartile ratio = mezikvartilové rozpětí)
Tab. 1. Characteristics of patient groups (BMI = body mass index, CCI = Charlson comorbidity index, eGF = estimated glomerular filtration, IQR = interquartile ratio)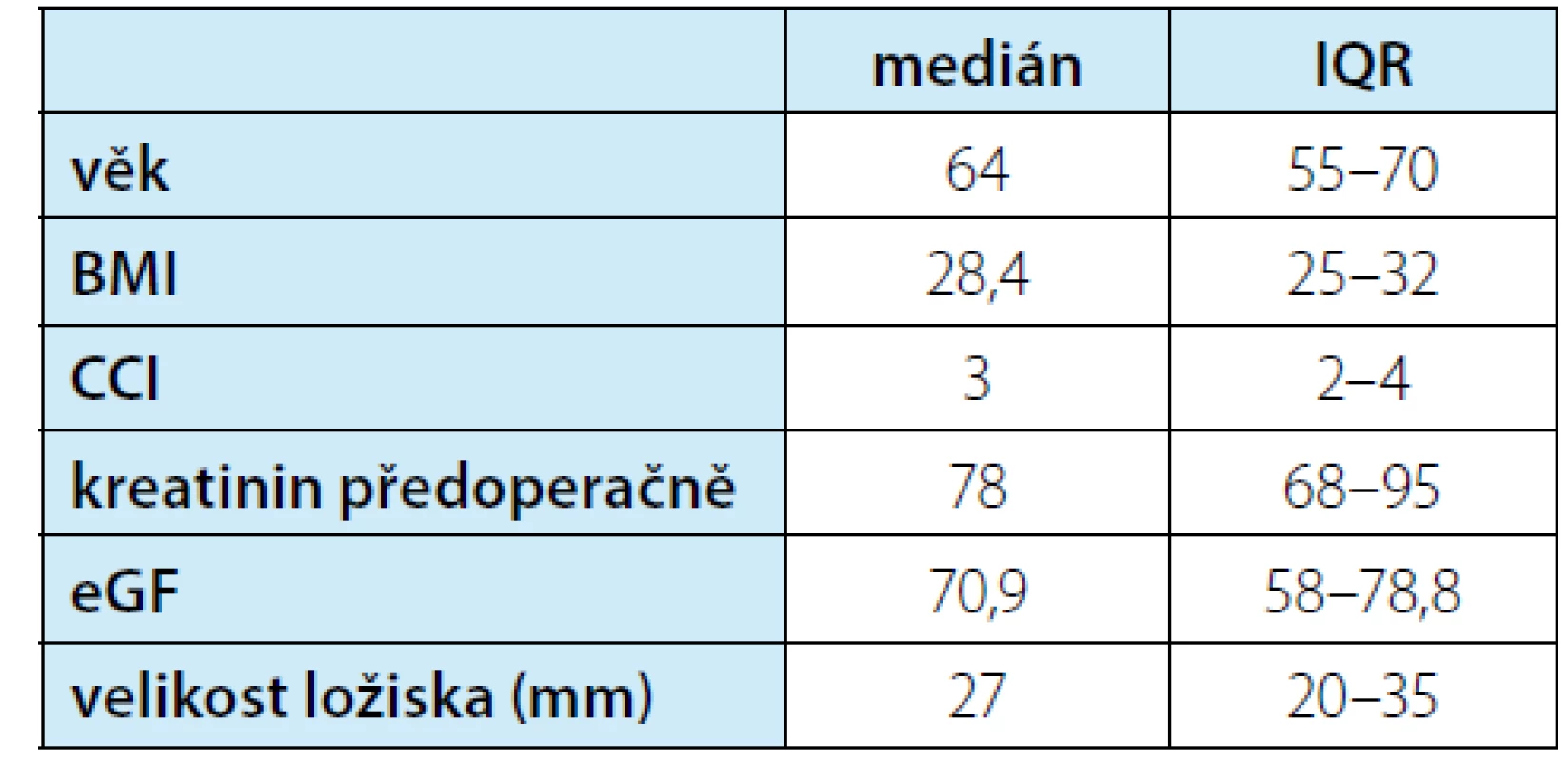
Tab. 2. Rozdělení pacientů podle úrovně nedostatečnosti ledvin na základě odhadované glomerulární filtrace (eGF) (12)
Tab. 2. Patient distribution according to the degree of renal insufficiency based on estimated glomerular filtration (eGF) (12)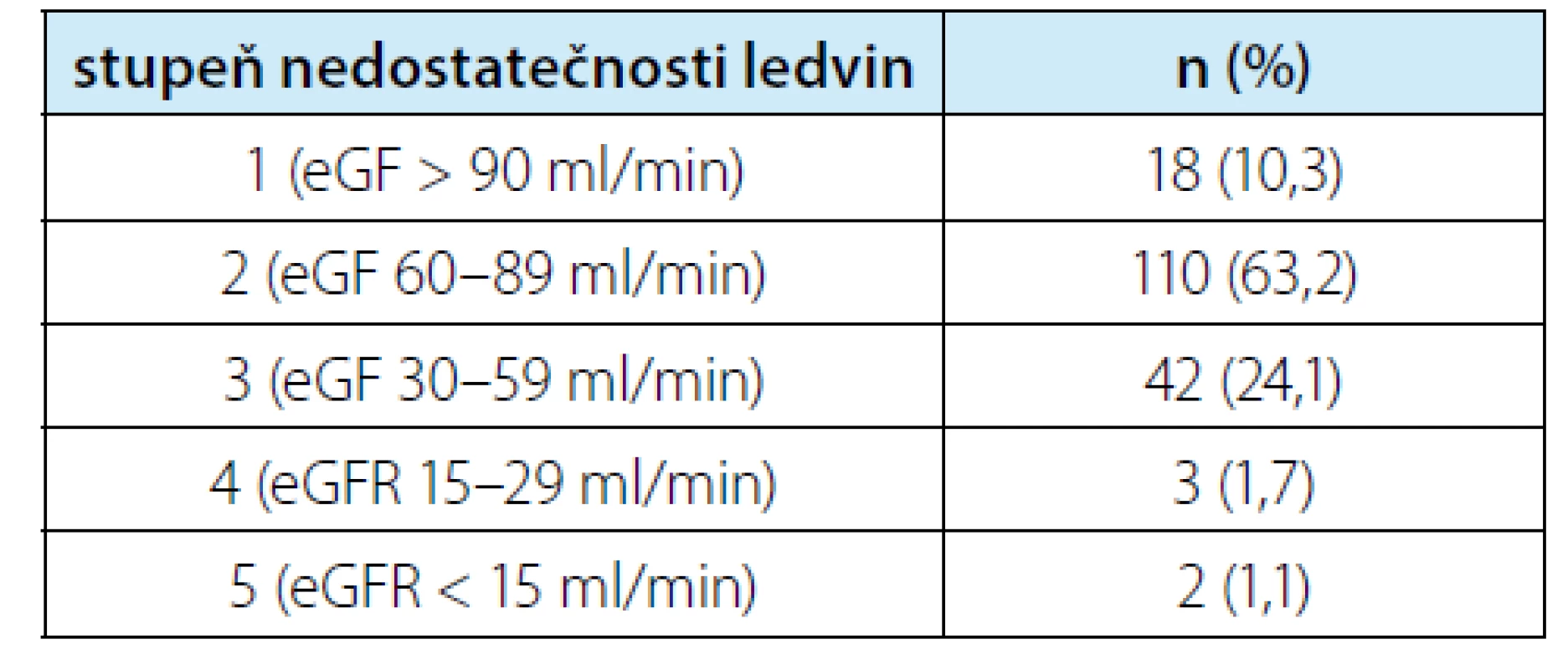
Medián velikost nádoru byl 27 (IQR 20–35) mm. Pro nefrometrické skóre PADUA byl medián 8 (IQR 7–9), rozdělení dle obtížnosti je uvedeno v tabulce 3. Krevní ztráty, délka výkonu a teplé ischemie, zastoupení nádorů resekovaných bez ischemie a délka pooperační hospitalizace jsou shrnuty v tabulce 4. Celkem 51 resekcí (tj. ložisek) bylo odstraněno bez ischemie. V případě resekčního výkonu v teplé ischemii (TI) byla nejkratší doba 7 min, maximum 31, čemuž odpovídá medián 15 minut. Z celkového počtu resekcí pouze 15× délka TI přesahující 20 minut, resp. pouze u tří pacientů byla přesažena doba 25 minut. Volba metody dočasného přerušení oběhu ledvinou je volbou operatéra v závislosti na komplexnosti výkonu, anatomii pacienta apod. Použity byly jak uzávěr hlavního kmene, tak uzávěry jednotlivých hlavních větví či selektivní uzávěr větví vyššího řádu. Hodnocení vztahu techniky přerušení oběhu a délky TI nebylo prováděno z důvodu malých počtů u některých technik. Volba techniky uzávěru průtoku může ovlivnit délku výkonu. Ta je však také odrazem i jiných faktorů, proto není ve vztahu k technice uzávěru hodnocena.
Tab. 3. Rozdělení operovaných expanzí ledvin dle obtížnosti do skupin podle skóre PADUA
Tab. 3. Classification of operated kidney masses based on difficulty level into groups according to the PADUA score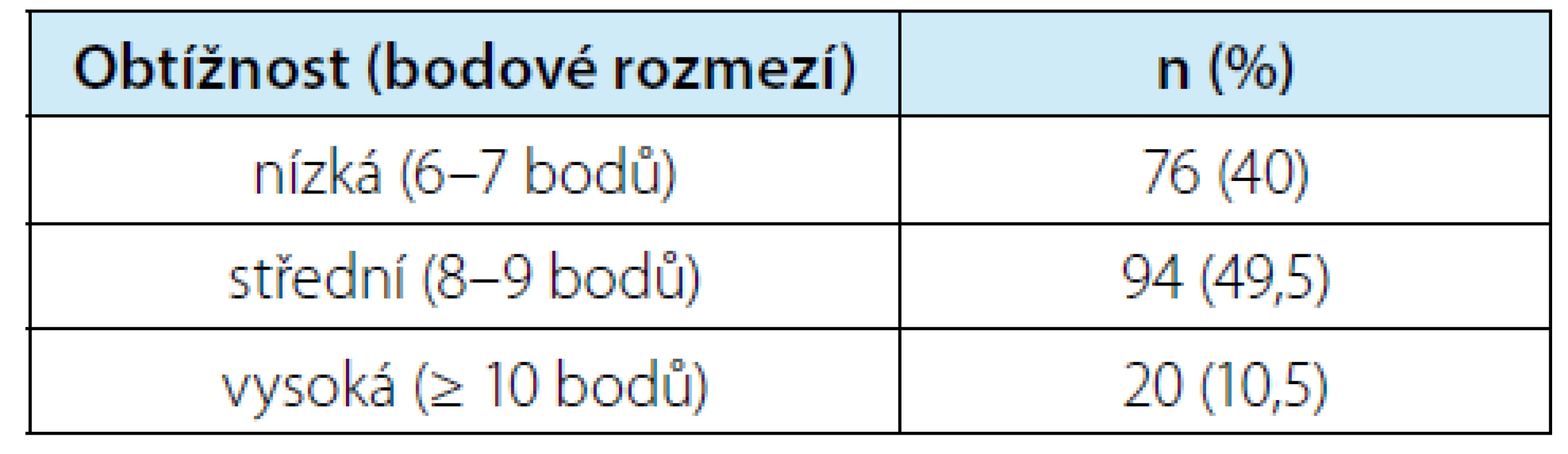
Tab. 4. Souhrn perioperačních výsledků resekcí ledvin. Počet lézí odstraněných bez ischemie je vyšší než počet pacientů operovaných bez ischemie, protože u některých pacientů bylo více jednotlivých ložisek resekováno bez ischemie
Tab. 4. Summary of perioperative outcomes of partial nephrectomies. The number of lesions removed without ischemia is higher than the number of patients operated on without ischemia because, in some patients, more individual lesions were removed without ischemia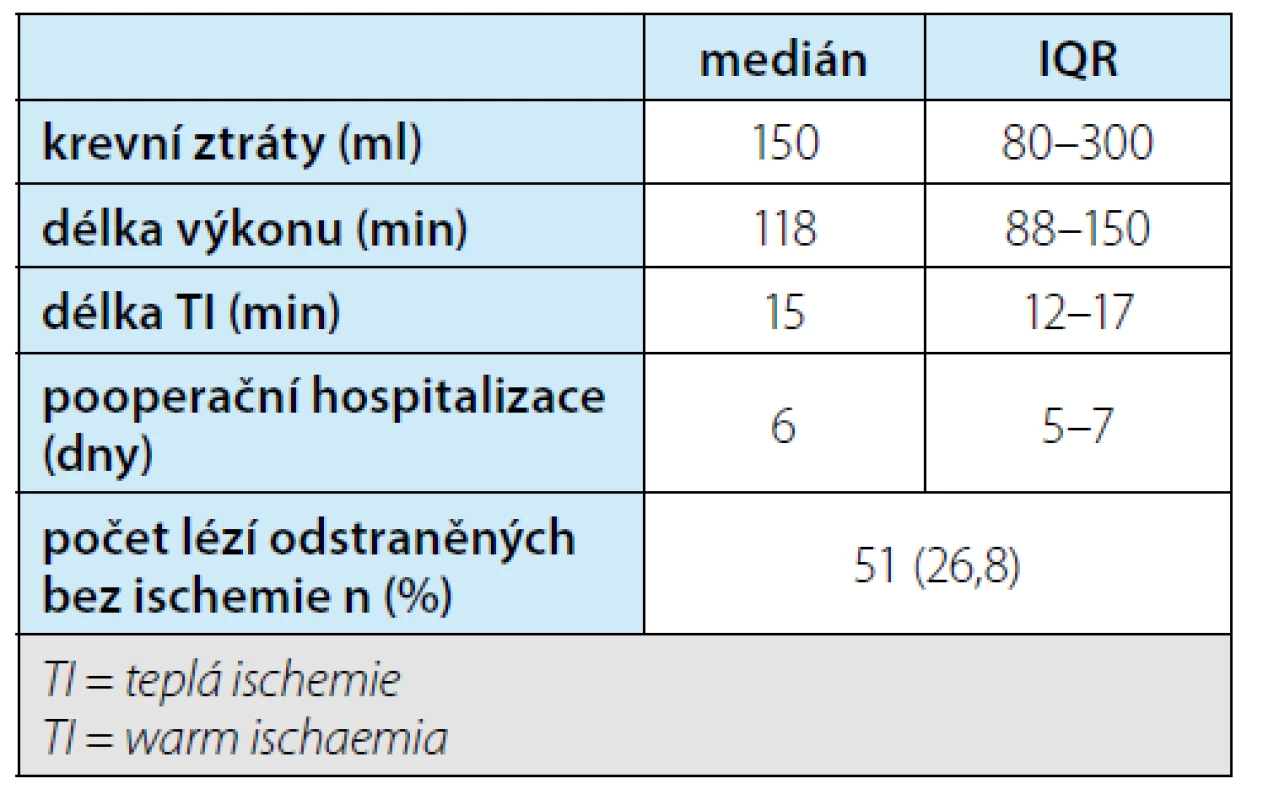
Perioperační konverze na laparoskopickou nefrektomii byla nutná u dvou případů – 1× pro krvácení z resekční plochy, které nereagovalo na několik různých způsobů hemostázy a 1× konverze pro nález nádorového trombu v druhé renální žíle (ani jejíž přítomnost, ani podezření na nádorový trombus nebylo předoperačně popsáno na zobrazovacím vyšetření). Ve dvou případech byla nutná perioperační konverze na otevřený výkon – 1× pro krvácení z dolní duté žíly (výkon dokončen jako resekce), 1× pro nenalezení nádoru při laparoskopii – po konverzi na otevřený výkon a následné vizuální aspekci a perioperační sonografii byl nádor identifikován a výkon dokončen jako resekce.
Bylo zaznamenáno celkem 44 komplikací (u 174 pacientů) v období do 30 dnů pooperačně. Tyto zahrnovaly 30 případů menších („minor“) a 14 větších („major“) komplikací dle CD. Rozdělení zaznamenaných komplikací je uvedeno v tabulce 5. V našem souboru došlo k úmrtí 3 pacientů v pooperačním období. U dvou pacientů došlo k plicní embolizaci i přes odpovídající tromboprofylaxi a jeden pacient zemřel na nevyřešitelné krvácení z dolní duté žíly (vyčerpání chirurgických i nechirurgických možností multioborového týmu) v kontextu komplexní anatomické situace a fibrózním terénu po předchozí operaci v retroperitoneu. U čtyř pacientů bylo na základě symptomů (významná makroskopická hematurie, někdy intermitentní; často také přidružené bolesti v boku) diagnostikováno symptomatické pseudoaneurysma (PSAE). Verifikace podezření na PSAE byla prostřednictvím angioCT, nicméně u 3 ze 4 pacientů bylo možné vyslovit podezření na PSAE již na základě UZ vyšetření s dopplerovským zobrazením. Jeden pacient měl dvě PSAE současně. Ošetření PSAE bylo provedeno selektivní embolizací intervenčními radiology. Žádný pacient nevyžadoval k řešení PSAE radiologickou nebo chirurgickou reintervenci. U pěti pacientů bylo nutné zavést pooperačně ureterální stent (1× léze močovodu rozpoznaná během výkonu a stent zaveden na jeho konci; 1× léze močovodu rozpoznaná časně pooperačně zobrazovací metodou; 1× urinózní sekrece drénem – zhojeno na stentu; 1x perirenální urinom – stent + současná punkce urinomu bez drénu – zhojeno; 1× hydronefróza diagnostikovaná na rutinním UZ při první kontrole 30. den – obstrukce pyeloureterální junkce fibrózními změnami, vyřešeno laparoskopickou pyeloplastikou za šest měsíců od výkonu).
Tab. 5. Přehled komplikací dle klasifikace Claviena-Dinda a jejich rozdělení do kategorií
Tab. 5. Overview of complications according to Clavien- Dindo classification and their distribution into categories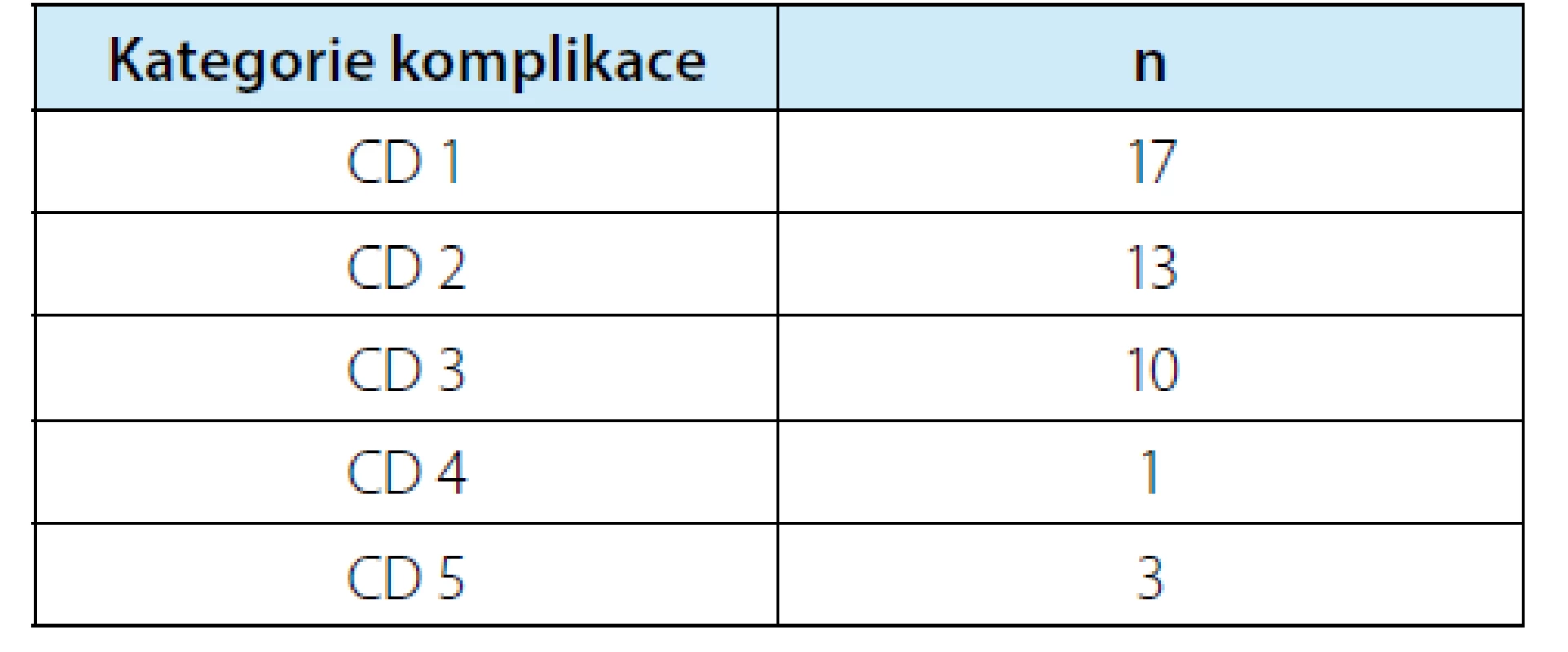
Histologické vyšetření diagnostikovalo 45 benigních lézí (tj. 23,7 %) a 145 maligních renálních nádorů. Mezi benigní afekcemi bylo 42 benigních renálních nádorů (22,1 %) a tři nenádorové benigní léze (1× jizevnatá tkáň, 1x Wegenerův granulom, 1× cysta). Rozdělení dle kategorií T klasifikace uvádí tabulka 6. Nejčastějším maligním typem renálního tumoru byl světlobuněčný renální karcinom přítomen ve 105 ložiscích (tj. 72,4 % ze 145 maligních, resp. 55,3 % ze všech 190 ložisek). V hodnocení kompletnosti resekátu byly jako negativní označeny pouze ty situace, kdy patolog jasně označil, že není kontakt nádoru s místem řezu. U ostatních, kde bylo označení jako „pozitivní“ nebo případně „nejisté“, byly tyto situace počítány jako pozitivní. Míra pozitivní okrajů v souboru byla 11 %. Pouze jedna pacientka podstoupila otevřenou re‑resekci, ostatní byli sledováni. Ve sledovaném souboru byla zaznamenána 1× lokální recidiva v ledvině (při R0 výkonu) – řešeno nefrektomií, 1× rychlá vzdálená progrese (mozkové metastázy tři měsíce po výkonu) – řešeno Lekselovým gama nožem, pacient nicméně zemřel za šest měsíců od výkonu a 1x současná vzdálená (vícečetné plicní metastázy) a lokální progrese v perirenálním tuku (při R0) za osm měsíců po výkonu – řešeno systémovou léčbou sunitinibem, později axitinibem, v době hodnocení 3,5 roku od výkonu byl pacient stále naživu.
Tab. 6. Rozdělení maligních nádorů do jednotlivých kategorií T klasifikace
Tab. 6. Distribution of malignant tumors into individual T classification categories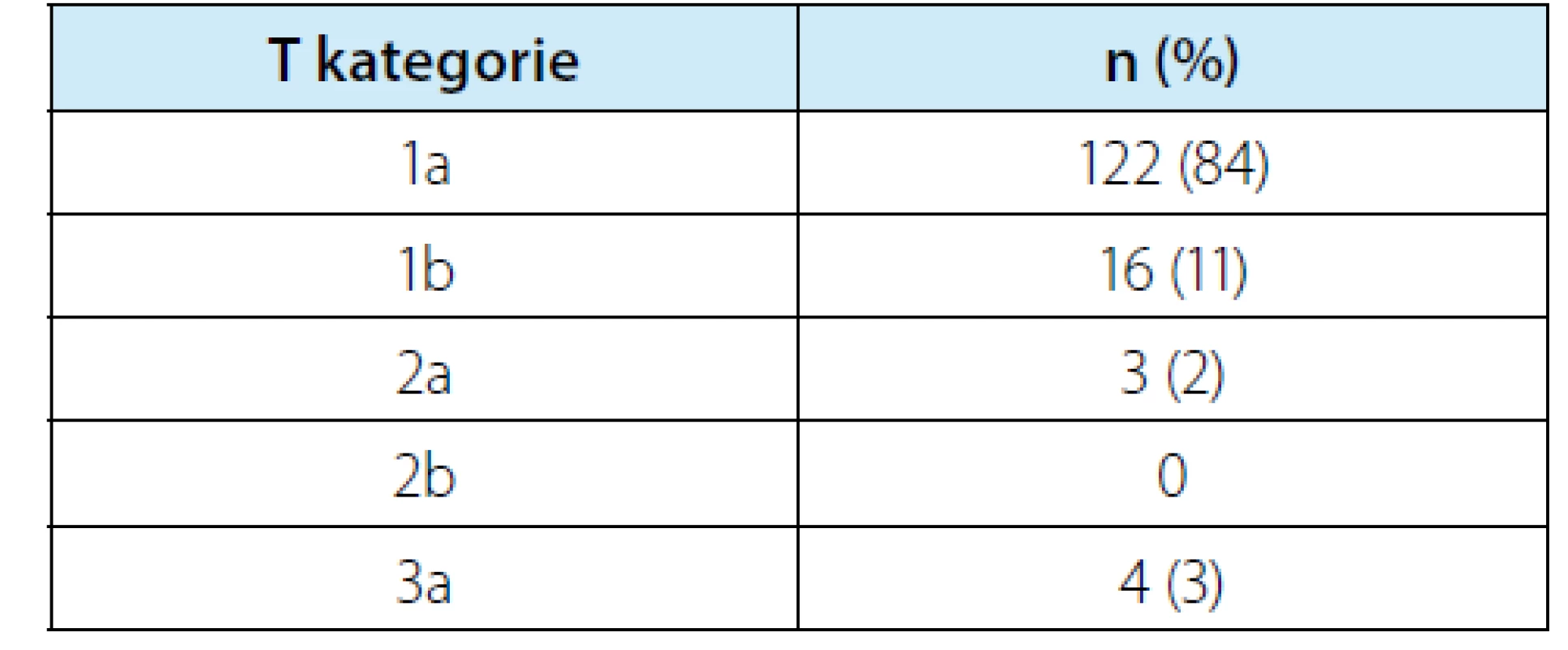
Tab. 7. Zastoupení jednotlivých typů maligních nádorů ze všech 145 odstraněných ložisek (ccRCC = světlobuněčný renální karcinom, chRCC = chromofobní renální karcinom, pRCC = papilární renální karcinom)
Tab. 7. Proportions of individual types of malignant tumors among all 145 removed lesions (ccRCC = clear cell renal cell carcinoma, chRCC = chromophobe renal cell carcinoma, pRCC = papillary renal cell carcinoma)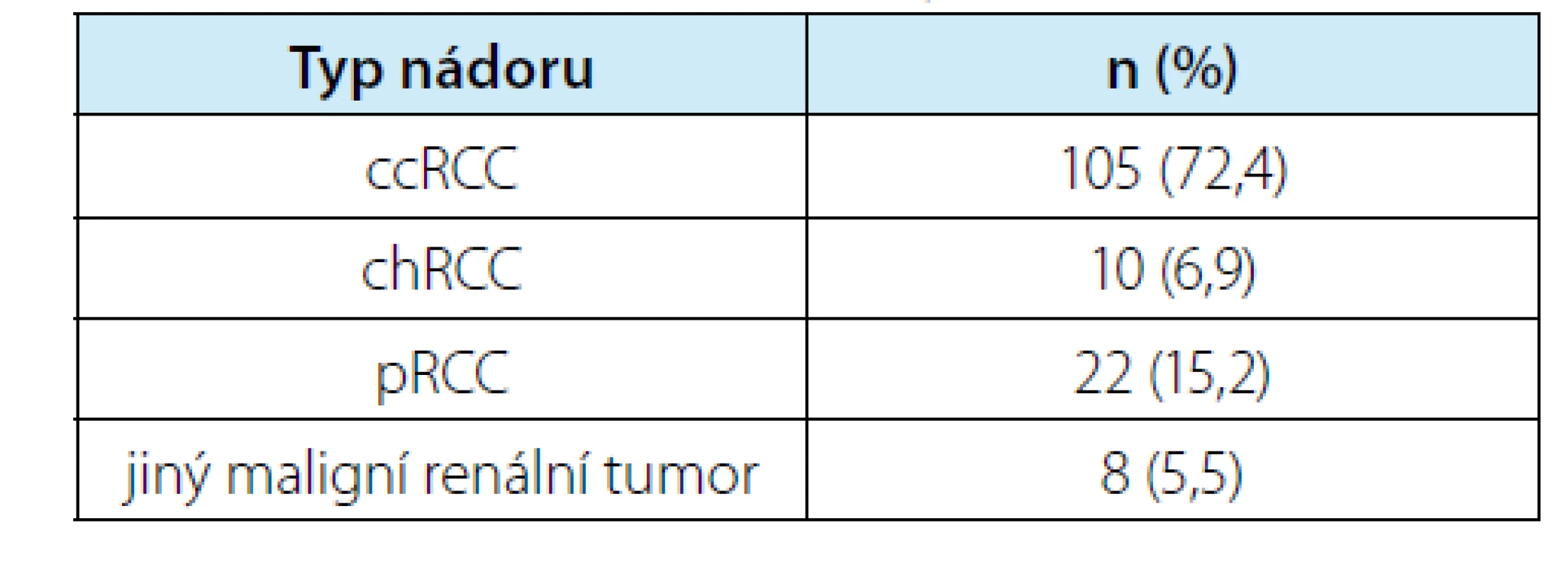
Pro hodnocení celkové kvality resekce ledvin jsme použili některé dostupné definice označené jako trifekta. Dle definice Montsouris (R0, TI ≤ 25 min, absence komplikace CD ≥ 3) (9) bylo v našem souboru dosaženo trifekty u 74,1 % pacientů. Při použití definice Khalifeha a kol. (10) (R0, IT ≤ 25 min + žádná komplikace) bylo trifekty dosaženo u 59,2 %. Pokud bychom se řídili definicí Porpiglii a kol. (R0, IT ≤ 20 min, absence komplikace CD ≥ 3) (11), tak dosáhla míra trifekty v našem soboru 69 %.
DISKUZE
Resekce ledviny je komplexní výkon, jeho obtížnost je ovlivněna řadou faktorů na straně pacienta i operatéra. Mezi faktory na straně pacienta se jedná zejména o charakteristiky solidní expanze, neboť větší a/nebo komplexnější tumory jsou obvykle spojeny s delším výkonem, větší krevní ztrátou a/nebo výraznějším zhoršením pooperační funkce nebo delší dobou hospitalizace (13, 14). Podobně také pacienti starší (hranice je nejčastěji udávána mezi 70–75 lety), s předoperačně horší renální funkcí nebo s abnormálním body mass indexem jsou také vystaveni většímu riziku pooperačních komplikací (13). Některé zdroje uvádí horší pooperační výsledky u mužů (13, 15). Na druhou stranu je zcela nepochybné, že významnou roli v dosažení funkčních i onkologických výsledků má i osoba operatéra, resp. jeho celková zkušenost (14, 16). Nepřímo lze na zkušenosti operatéra odvozovat od celkového počtu konkrétních operací provedených na pracovišti („case volume“ či „case load“), kde je patrná taktéž závislost počtu výkonů a peri - a pooperačních či onkologických výsledků (17). Poměrně velké spory se vedou o tom, zda je některý z přístupů k resekci ledviny lepší či horší. V průběhu rozvoje urologie byla dlouho otevřená resekce ledviny dominantním výkonem, nicméně s nástupem minimálně invazivních metod (MI) (laparoskopie a následně roboticky‑asistované operativy) došlo na řadě pracovišť k částečnému nebo většinovému posunu ve prospěch MI výkonů. Změnu přístupu do značné míry podmiňuje i posun velikosti nádorů k menším rozměrům v době primární (typicky náhodné) diagnózy. Nicméně srovnání mezi jednotlivými přístupy k resekci ledviny je obtížné, protože prospektivní randomizovanou studii lze realizovat obtížně. Dostupná srovnání jsou spíše retrospektivní nebo jsou založena na spíše nesystematickém zhodnocení a/nebo meta‑analýzách již publikovaných dat. Problémem takového srovnání je však nehomogenita studií, nesourodost dat a obecný trend k tomu, že stále je řada větších a/nebo komplexních nádorů resekována otevřeně (18, 19). V rámci meta‑analýz jsou často srovnávány historické soubory resekcí ledvin laparoskopických (LRL) a otevřených výkonů s recentnějšími roboticky‑asistovanými výkony (RRL), kde mimo nesporné technické výhody může roli hrát také právě pokročilá zkušenost a množství pacientů operovaných v referenčních centrech. Přesto lze najít rozdíly mezi jednotlivými přístupy. Longova studie (retrospektivní, 381 pacientů) uvádí, že není rozdíl mezi LRL a RRL z pohledu funkčních výsledků u středně a vysoce komplexních expanzí (RENAL skóre ≥ 7), nicméně byla zaznamenána mírně vyšší pravděpodobnost konverze na radikální nefrektomii při LRL (20). Recentní práce Mehry a kol. (retrospektivní; 28 ORL, 14 LRL a 13 RRL), která hodnotila dosažení trifekty, nezjistila rozdíly mezi jednotlivými přístupy, nicméně na úrovni jednotlivých parametrů rozdíly byly, byť je vzhledem k velikosti souboru obtížné dovodit klinickou významnost. Jako zajímavost lze uvést délku pooperační drenáže 6 dní u RL a 4,5, resp. 4 dny pro LRL, resp. RRL (21).
Při meta‑analýze onkologických výsledků ORL, LRL a RRL práce Changa a kol. nezjistila rozdíly v míře lokální či vzdálené recidivy a pětiletém nádorově specifickém přežití. Nicméně byla pozorována menší pravděpodobnost zhoršení stupně chronického renálního onemocnění po RRL (22). Při srovnání výsledků RRL a ORL (retrospektivně; 203 RRL a 76 ORL) u vysoce komplexních tumorů (RENAL skóre > 9) z jednoho pracoviště bylo prokázáno, že v případě obou intervencí dochází k významnému a srovnatelnému funkčnímu pooperačnímu zhoršení (18). Srovnání krátkodobých výsledků onkologických, funkčních a perioperačních z operacích prováděných v letech 2013–2016 ukázala, že doba TI u RRL byla kratší než u LRL (15,7 vs. 23 min), ale v souboru LRL nebyla jediná konverze na nefrektomii či otevřený výkon, u RRL bylo 6 % (n = 3) konvertováno na ORL a 6 % (n = 3) na nefrektomii. Nebyl přitom zjištěn významný rozdíl v míře pozitivních okrajů (23).
je ale srovnávání operačních přístupů zatížené nízkou kvalitou dat a spíše než nástroj rozhoduje osoba operatéra (příprava plánu; volba přístupu; hloubka resekce; použití či absence ischemie; preferovaná metoda hemostázy – stehy vs. hemostatika vs. vícevrstvá sutura vs. časné uvolnění ischemie po první vrstvě vs. typ použitého šicího materiálu; řešení pooperačních komplikací apod.) (24).
Pokud bychom srovnali naše výsledky trifekta s referenčními, je patrné, že odlišnosti jsou patrné oběma směry, nicméně závisí také na tom, zda je porovnáván soubor celkový či výsledky dílčí a zda jde o laparoskopické výkony nebo roboticky‑asistované – přehled v tabulce 8. Navíc naše výsledky mohou pak také „trpět“ relativní striktní definicí negativity pozitivních okrajů. Poslední uvedený fakt ale může mít vliv na následné pooperační intervaly zobrazovacích vyšetření, není‑li zcela jasné, zda je okraj negativní či nikoliv, byť nelze vyloučit, že v některých případech jde o možné „defenzivní“ vyjádření patologa. Protože jde ale o retrospektivní soubor, bylo by obtížné zajistit druhé čtení všech sporných případů zpětně.
Tab. 8. Souhrnné srovnání našich výsledků s referenčními soubory, všechna čísla jsou procenta označující zastoupení pacientů v souboru, kteří dosáhli trifekty. (IM = Institut Montsouris = Carneiro et al. (9), Cleveland = Cleveland Clinic = Khalifeh et al. (10) , Turín = Porpiglia et al. (11)). Horní řádek jsou naše výsledky vypočtené dle jednotlivé definice. V korespondujícím sloupci jsou pak uvedené původní výsledky v referenčních publikací, kde je obvykle rozdělení podle jednotlivých etap
Tab. 8. Summary comparison of our results with reference groups; all figures are percentages designating proportions of patients in the group who reached trifecta outcomes. (IM = Institut Montsouris = Carneiro et al. (9), Cleveland = Cleveland Clinic = Khalifeh et al. (10), Torino = Porpiglia et al. (11)). The upper line is our results calculated according to an individual definition. In the corresponding column, there are original results in reference publications with distribution according to particular periods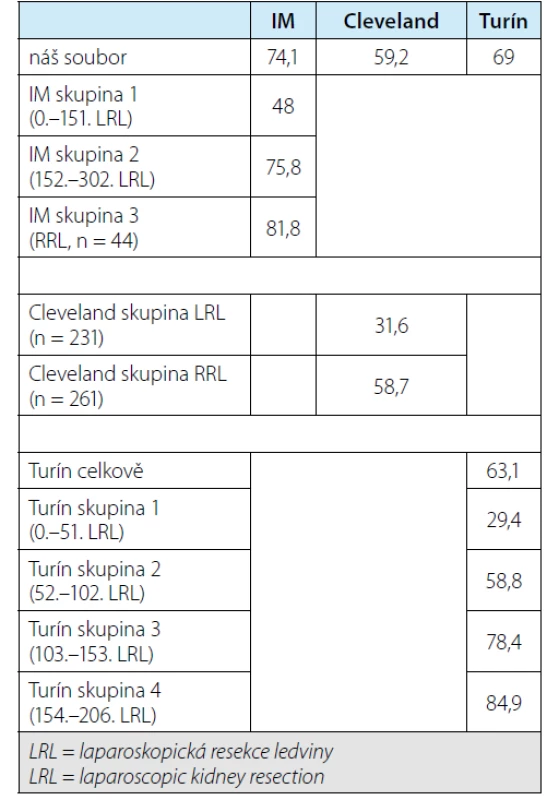
ZÁVĚR
Laparoskopická resekce ledviny (či obecně resekce ledviny) je v souladu s doporučeními odborných společností indikována u solidních ložisek kategorie cT1, za předpokladu, že dané pracoviště disponuje odpovídajícími zkušenostmi, technickým zázemím a je schopné také vyřešit potenciální komplikace. Roli jistě hraje nejen velikost ale i uložení nádoru. Předoperační posouzení dle skórovacích schémat je jistě možné a je známo, že vyšší počet bodů ve všech skórovacích schématech zvyšuje pravděpodobnost nefrektomie. Je‑li pacient vhodný k resekci a pracoviště nedisponuje odpovídajícím vybavení k minimálně invazivnímu výkonu, pak je otevřený výkon zcela na místě. Pokud nejsou zkušenosti s resekčním výkonem obecně, mělo by dojít k doporučení na pracoviště, které jimi disponuje, přičemž by neměla být preferována např. laparoskopická nefrektomie, před otevřenou resekcí. Jakákoliv skórovací schémata jsou spíše vhodná pro srovnání jednotlivých souborů a nenahradí zkušenosti a manuální zručnost. Pozitivní okraje jsou vždy určitým psychologickým „oříškem“ pro lékaře i pacienta, nicméně obecná doporučení preferují sledování před aktivním novým výkonem jakéhokoliv typu. Aktivní přístup může být na místě v případě extenzivního či makroskopicky jasně patrného resekčního okraje (hranice není z literatury zřejmá či jasně daná), kde lze důvodně předpokládat perzistenci nádorových struktur. Řešení komplikací po resekci ledviny je vždy stejné bez ohledu na techniku provedení. Urinomy se typicky drenáží močových cest +/ - eventuální perkutánní drenáží tekutinové kolekce. Hematurie může být přechodná či epizodická. Mírná hematurie bezprostředně po výkonu není výjimkou a při stabilitě pacienta je obvykle sledována. Řešení je jen v případě obstrukce močových cest koaguly. Při hematurii vznikající až s odstupem více dní a někdy epizodické, by mělo být pravidlem angioCT urotraktu k vyloučení pseudoaneuryzmatu. To je preferenčně řešeno pokusem o selektivní (zřídka méně selektivní) embolizaci. Výkon lze i opakovat, protože v případě selhání či nedostupnosti intervenčního radiologa se zkušenostmi je zbývajícím řešením nefrektomie ve velmi obtížném terénu.
Laparoskopická resekce ledviny je standardní výkon, který má dokumentovanou účinnost a je součástí možných řešení solidní expanzí ledvin. Dosažené komplexní výsledky v našem souboru, tzv. trifekta, odpovídají dříve publikovaným definicím referenčních souborů. Možné odlišnosti mohou vycházet z různých vstupních charakteristik souborů, které dosažené výsledky ovlivňují nejvíce – velikost a komplexnost lézí, případně komorbidity pacientů a jejich vstupní renální funkce.
Došlo: 24. 6. 2019
Přijato: 19. 8. 2019
Kontaktní adresa:
MUDr. Petr Macek, Ph.D., FEBU
Department of Urology, Institut Montsouris,
42 Boulevard Jourdan, 750 14 Paris, France
e‑mail: macekp@gentlemail.com
Střet zájmů: Žádný.
Prohlášení o podpoře: Práce byla podpořena grantem MZ ČR – RVO VFN64165.
Zdroje
1. Richter I, Dvořák J. Úvod do problematiky léčby zhoubných nádorů ledvin. Klin onkol 2018; 31(2): 110–116.
2. Ljungberg BL, Albiges K, Bensalah A, et al. Eau guidelines on renal cell carcinoma 2019 [online]. 2019. Dostupné z: https://uroweb.org/guideline/renal-cell-carcinoma/#7.
3. Macek P, Stevens M, Novák K, Pešl M, Hanuš T. Nefrometrická skóre první a druhé generace pro predikci peri - a pooperačních výsledků resekci ledvin. Ces Urol 2017; 21(2): 154–160.
4. Nyman U, Bjork J, Lindstrom V, Grubb A. The lund-malmo creatinine-based glomerular filtration rate prediction equation for adults also performs well in children. Scandinavian journal of clinical and laboratory investigation 2008; 68(7): 568–576.
5. Charleson Comorbidity Calculator. Dostupné z: http://touchcalc.com/calculators/cci_js.
6. Ficarra V, Novara G, Secco S, et al. Preoperative aspects and dimensions used for an anatomical (padua) classification of renal tumours in patients who are candidates for nephron-sparing surgery. European urology 2009; 56(5): 786–793.
7. Sobin lHM, Gospodariwicz A, Wittekind C. Renal neoplasms. In: l.h. sobin, m. Gospodariwicz a c. Wittekind, ed. Tnm classification of malignant tumors. 7th vyd. B.m.: Wiley-Blackwell 2009 : 255–257.
8. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Annals of surgery 2004; 240(2): 205–213.
9. Carneiro A, Sivaraman A, Sanchez-Salas R, et al. Evolution from laparoscopic to robotic nephron sparing surgery: a high-volume laparoscopic center experience on achieving „trifecta" outcomes. World journal of urology 2015; 33(12): 2039–2044.
10. Khalifeh A, Autorino R, Hillyer SP, et al. Comparative outcomes and assessment of trifecta in 500 robotic and laparoscopic partial nephrectomy cases: a single surgeon experience. The journal of urology 2013; 189(4): 1236–1242.
11. Porpiglia F, Bertolo R, Amparore D, Fiori C. Margins, ischaemia and complications rate after laparoscopic partial nephrectomy: impact of learning curve and tumour anatomical characteristics. Bju International 2013; 112(8): 1125–1132.
12. Vachek J, Zakiyanov O, Tesař V. Chronické onemocnění ledvin. Internal medicine for practice 2012; 14(3): 107–110.
13. Cacciamani GE, Gill T, Medina L, et al. Impact of host factors on robotic partial nephrectomy outcomes: comprehensive systematic review and meta-analysis. Journal of urology 2018; 200(4): 716–730.
14. Kang M, Gong IH, Park HJ, et al. Predictive factors for achieving superior pentafecta outcomes following robot-assisted partial nephrectomy in patients with localized renal cell carcinoma. Journal of endourology 2017; 31(12): 1231–1236.
15. Rosen DC, Kannappan M, Kim Y, et al. The impact of obesity in patients undergoing robotic partial nephrectomy. Journal of endourology 2019; 33(6): 431–437.
16. Dagenais J, Bertolo R, Garisto J, et al. Variability in partial nephrectomy outcomes: does your surgeon matter? European urology 2019; 75(4): 628–634.
17. Khene ZE, Peyronnet B, Bernhard JCH, et al. A preoperative nomogram to predict major complications after robot assisted partial nephrectomy (uroccr-57 study). Urologic oncology 2019.
18. Garisto J, Bertolo RJ. Robotic versus open partial nephrectomy for highly complex renal masses: comparison of perioperative, functional, and oncological outcomes. Urologic oncology 2018; 36(10): 471.e1–471.e9.
19. Ficarra V, Rossanese M, Gnech M, Novara G, Mottrie A. Outcomes and limitations of laparoscopic and robotic partial nephrectomy. Current opinion in urology 2014; 24(5): 441–447.
20. Long JA, Yakoubi R, Lee B, et al. Robotic versus laparoscopic partial nephrectomy for complex tumors: comparison of perioperative outcomes. European urology 2012; 61(6): 1257–1262.
21. Mehra K, Manikandan R, Dorairajan LN, et al. Trifecta outcomes in open, laparoscopy or robotic partial nephrectomy: does the surgical approach matter? Journal of kidney cancer and vhl 2019; 6(1): 8–12.
22. Chang KD, Raheem AA, Kim KH, et al. Functional and oncological outcomes of open, laparoscopic and robot-assisted partial nephrectomy: a multicentre comparative matched-pair analyses with a median of 5 years’ follow-up. Bju international 2018; 122(4): 618–626.
23. Alimi Q, Peyronnet B, Sebe P, et al. Comparison of short-term functional, oncological, and perioperative outcomes between laparoscopic and robotic partial nephrectomy beyond the learning curve. Journal of laparoendoscopic advanced surgical techniques. Part a 2018; 28(9): 1047–1052.
24. Marconi L, Desai MM, Ficarra V, Porpiglia F, Poppel HV. Renal preservation and partial nephrectomy: patient and surgical factors. European urology focus 2016; 2(6): 589–600.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2019 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Prevence tromboembolických komplikací v urologii
- PSA a jeho izoformy jako moderní markery karcinomu prostaty
- Urologické komplikácie po transplantácii obličky
- Laparoskopická resekce ledviny – komplexní hodnocení perioperačních výsledků jednoho centra
- Wunderlichův syndrom – soubor pacientů s netraumatickým spontánním krvácením do retroperitonea
- Uroteliální karcinom ledvinné pánvičky vpravo a distálního močovodu vlevo
- Hranice možností záchovného výkonu u tumorů ledviny – desetinásobná resekce solitární ledviny
- Bilaterální tumor ledvin jako náhodný nález při ultrazvukovém vyšetření u 82letého pacienta s močovou retencí
- Centrálně lokalizovaná cystická renální léze nejasné biologické povahy
- Komentář k článku Šuldová K. Současné trendy při rekonstrukci striktur penilní uretry
- Komentář k článku Schraml J, Hlavička M, Broul M, Cihlář F. Miniivazivní uzávěr vezikovaginální píštěle pomocí robota jednoportovým vstupem
- Komentář ke Zprávě z výroční konference EAU v Barceloně
- Looking back at the 30th Annual Meeting of Pediatric Urologists
- 3rd Ostrava Urological-Neurological Symposium
- Report on the 7th Annual Video Seminar „Tips and tricks in urological surgery”
- Report from the 26th annual meeting of Slovak urological society
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- PSA a jeho izoformy jako moderní markery karcinomu prostaty
- Urologické komplikácie po transplantácii obličky
- Wunderlichův syndrom – soubor pacientů s netraumatickým spontánním krvácením do retroperitonea
- Uroteliální karcinom ledvinné pánvičky vpravo a distálního močovodu vlevo
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



