-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti léčby kastračně refrakterního karcinomu prostaty, co nového k roku 2013
New therapeutic modalities for castrate resistant prostate cancer at the beginning of 2013
Pharmacotherapy of castrate resistant prostate cancer (CRPC) has undergone remarkable changes within the last several decades. A crucial discovery of hormonal dependence of prostate cancer by Huggins and Hodges, in the late 1940’s, opened new therapeutic possibilities. In the 80’s, the U.S. Food and Drug Administration approved the first luteinizing hormone-releasing hormone (LHRH) agonist. These drugs have a suppressive effect on the testosterone levels in the blood, which is equivalent to an orchiectomy. Nevertheless, this method has been associated with negative side effects, such as miniflares. Also, the level of testosterone in the blood was not always sufficiently low. Despite the initial therapeutic effects and good long term response, the cancer becomes hormone resistant over time. The next notable improvement in the treatment of CRPC was introduced at the beginning of this century and it included a combination of docetaxel with prednisone, as a 1st line treatment modality for CRPC. This represented a firts new therapeutic approach which prolonged the survival of patients suffering from CRPC. Within the last decade, several new molecules have been introduced, referred to as biological drugs. These are nonsteroideal antiandrogens, such as enzalutamid, selective CYP 17 inhibitor abirateron acetate, 2nd generation taxan, cabazitaxel, and Sipuleucel T which represents a new agent active in cancer immunotherapy. Several phase II and III studies are currently ongoing to test additional new drugs, which are showing a promising effect. New drugs modulating the metabolism of bones in metastatic CRPC became available as well.
Key words:
castrate resistant prostate cancer (CRPC), hormonal therapy chemotherapy, targeted therapy, new drugs.
Autoři: Michaela Matoušková; Miroslav Hanuš
Působiště autorů: Urocentrum Praha
Vyšlo v časopise: Ces Urol 2013; 17(3): 141-153
Kategorie: Přehledový článek
Souhrn
Farmakoterapie pokročilého zhoubného onemocnění prostaty prochází velkými zlomy. Prvním z nich byl objev hormonální závislosti karcinomu prostaty. Vliv kastrace na diseminované onemocnění popsali Huggins a Hodges ve čtyřicátých letech 20. století. V osmdesátých letech 20. století byl FDA (Food and Drug Administration) schválen první agonista LHRH, který vedl k supresi testosteronu srovnatelnému s chirurgickou kastrací, a tím k možnému posunu od chirurgické k medikamentózní kastraci. Vzhledem ke kolísání hladin testosteronu během podávání LHRH (miniflare up fenomén) a působení nekastračních hladin testosteronu v průběhu léčby na androgenní receptor, se zdá výhodnější a preferovanější podávání GnRH antagonistů. Přes dobrou a dlouhodobou odpověď vůči hormonální léčbě dochází k selhání této léčebné modality, zhoubný nádor nabývá odlišné růstové charakteristiky a mění zásadně svou prognózu. Dalším zlomem již v našem tisíciletí pak bylo standardizování I. linie léčby kastračně refrakterního karcinomu prostaty. Podání docetaxelu s prednisonem bylo první terapií, která vedla k prodloužení přežití u pacientů s CRPC. Nově registrované molekuly jsou v efektivitě a výskytu nežádoucích účinků srovnávány s režimem docetaxel s prednisonem. Jedním z nových agens je selektivní a ireverzibilní inhibitor CYP17, abirateron acetát, dalším je nesteroidní antiandrogen enzalutamid. Cytotoxickou látkou vhodnou pro podání pacientům s CRPC je cabazitaxel, taxan II. generace. Uplatnění v léčbě může mít i imunoterapie, jedinou k dnešnímu dni schválenou látkou je sipuleucel T. V klinickém zkoušení je však velká řada dalších přípravků samostatně nebo v kombinaci se standardní léčbou. U již schválených přípravků by nám měly probíhající studie odpovědět otázky s optimální dobou použití a sekvence léčby. Nedílnou součástí léčby mCRPC je podání látek modulujících kostní metabolismus.
Klíčová slova:
kastračně refrakterní karcinom prostaty (CRPC), hormonální léčba, chemoterapie. cílená léčba.ÚVOD
Zhoubné nádory prostaty jsou nejčastějším onkologickým onemocněním mužů a druhou nejčastější příčinou úmrtí na nádorová onemocnění v České republice, západních zemích i v USA. K úmrtí nemocných vede obvykle kastračně rezistentní varianta onemocnění, progredující lokálně a metastazující, nejčastěji do kostí, ale až ve 30 % i do měkkých tkání či parenchymových orgánů. V širším slova smyslu rozumíme progresí nárůst prostatického specifického antigenu (PSA), vznik nových ložisek či zvětšování již diagnosticky ověřených a/nebo klinické zhoršení obtíží. Odpověď nádorových buněk vůči androgenní deprivaci s jejím trváním mizí a nádor přes kastrační hladiny testosteronu progreduje.
U onemocnění, kdy není dostatečně účinná nebo kontraindikovaná chemoterapie docetaxelem, jsou další možnosti léčby bohužel velmi omezené. Nové objevy mechanismů signálních cest stimulující buněčný androgenní receptor (AR) v prostředí androgenní deprivace vedou k hledání lékových molekul, které stimulaci inhibují. Snahou je zpomalení průběhu onemocnění a prodloužení přežití. Stávající přípravky lze rozdělit do skupin podle místa a způsobu účinku. Vedle cíleného zásahu zaměřeného na AR zahrnuje nové léčebné armamentarium non-androgenní signální cíle, dále možnost imunoterapie, imunomodulace, některé enzymatické blokátory nová chemoterapeutika a cílené ovlivnění buněk kostních metastáz. Tento nadějný směr je označován jako biologická léčba. Článek předkládá aktuální přehled přípravků, jejichž ověřování ve studiích velmi pokročilo a přináší slibné výsledky.
Od klíčového objevu závislosti růstu prostatické buňky na androgenech uplynulo více než 70 let (1). Tento princip je dodnes v léčbě karcinomu prostaty využíván. Na bližší objasnění mechanismu hormonální senzitivity i rezistence je léta soustředěn molekulární, základní i aplikovaný výzkum.
Ovlivnění hypotalamo-hypofyzárně testikulární osy působením hormonální suprese na různých etážích (obr. 1) vede k různě dlouhé odpovědi nádorových buněk. Medián trvání odpovědi u metastatického onemocnění se pohybuje mezi 12–18 měsíci. Aplikace hormonální léčby formou intermitentní androgenní suprese (IAS) u pacientů s rozsáhlou generalizací není vhodné, u ostatních vede k oddálení, nikoliv však potlačení hormonální indepenence (2). Podání IAS snižuje pravděpodobnost mutací androgenního receptoru. Selhání dvou linií hormonální léčby by mělo být důvodem ke změně typu terapie.
Obr. 1. Hypothalamo-hypofyzární testikulární osa (převzato z Remedia 2010 (3)) Fig. 1. Axis hypothalamus-hypophysis – testis (from Remedia with permission) 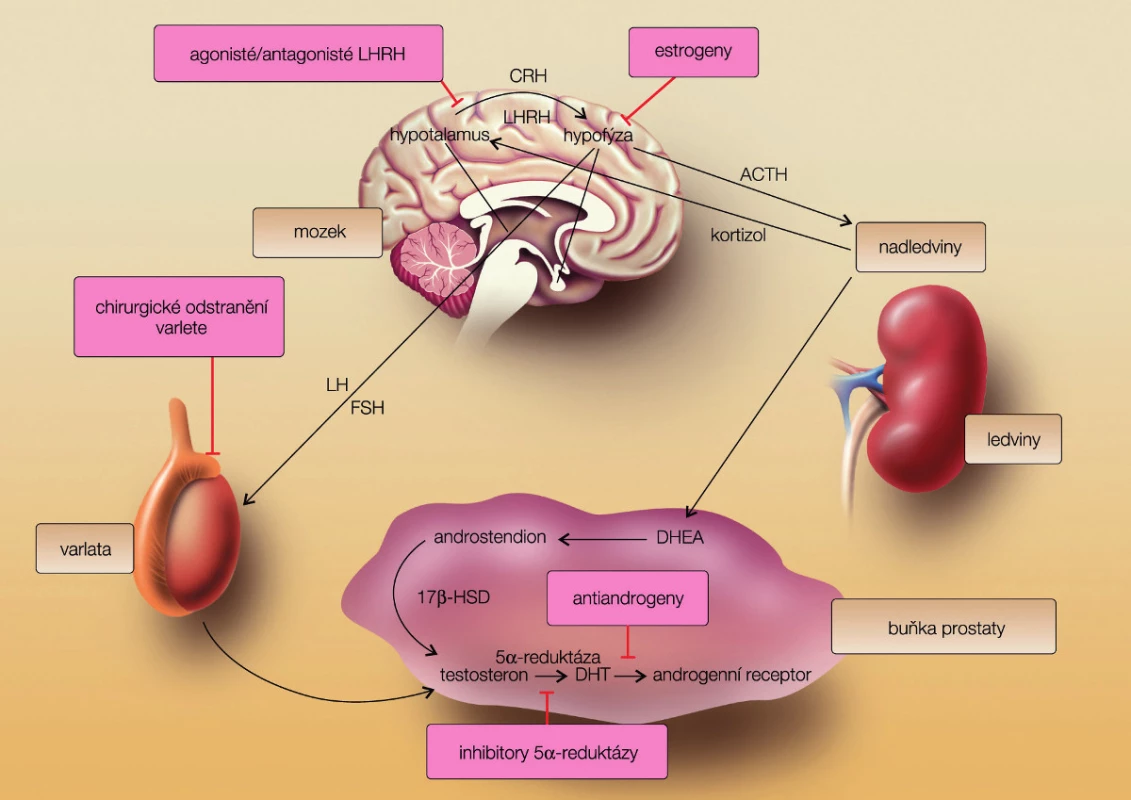
Ze zkušenosti je dlouho známý tzv. antiandrogen withdrawal phenomenon (AAWP). Náhlé vysazení antiandrogenů vede po 4–6 týdnech u 15–30 % nemocných k výraznému poklesu hladiny PSA. Tento pokles může trvat až 6 měsíců. AAWP je evropskými guidelines uváděn jako možný terapeutický zásah po II. li-nii hormonální léčby. V polovině devadesátých let byl publikován vysvětlující názor, že podávání antiandrogenů navozuje mutaci AR receptoru. Podávaný antiandrogen pak působí na vzniklý fenotyp jako aktivační ligand. Vysazení antiandrogenu vyvolává AAWP efekt (4).
Metodou volby při selhání hormonální suprese je chemoterapie. Obdobně jako hormonální léčba má pouze paliativní účinek. Prvním cytotoxicky působícím přípravkem byl derivát antrachinonu antracendion (mitoxantron, MTX), cytostatikum s interkalačním mechanismem účinku, schválené FDA v roce 1996 ke klinickému použití. MTX inhibuje topoizomerázu II, tím vyřazuje její protektivní a reparativní účinek na poškozené struktury molekul DNA i RNA. MTX také inhibuje celulární imunitní reakci. V kombinaci s prednisonem jej GDL EAU (Guidelines of European Association of Urology) doporučují k podání u symptomatického CRPC. Zlomem v léčbě CRPC bylo zařazení docetaxelu (extrakt Taxus baccata) do armamentária léčby. Taxany vazbou na β-podjednotku tubulinu vyvolávají polymerizaci mikrotubulů, a tím inhibují buněčnou mitózu. Dále fosforylací bcl-2 urychlují apoptózu nádorových buněk. Mají též anti-angiogenní účinky. Mezi hlavní nežádoucí účinky patří útlum krvetvorby, neuropatie, myalgie, pocit únavy, průjem, alopecie, změny na kůži a nehtech. Premedikací kortikosteroidy je možné zmírnit retenci tekutin. V roce 2004 byl schválen na základě výsledků studie TAX327 docetaxel s prednisonem FDA ke klinickému použití v první linii léčby CRCP (5).
NOVÉ MOŽNOSTI LÉČBY CRPC – PRINCIPY A CÍLOVÁ MÍSTA
Začlenení docetaxelu s prednisonem do léčebných schémat vedlo k prodloužení přežití pacientů s CRPC. Přes podání docetaxelu však nádor posléze progreduje lokálně i metastazuje predilekčně do kostí, ale i do parenchymových orgánů. Důvodem je adaptace nádorové buňky na nízkou hladinu androgenu a využití dalších (jinak marginálních) zdrojů androgenů, a to tvorbu v nadledvině či přímo intracelulárně v buňce karcinomu prostaty. Nádorová buňka umí využít rovněž příbuzné steroidy a vytváří si i náhradní cesty k udržení aktivity receptoru. Významně pokročily znalosti o struktuře a funkci androgenního receptoru, úvodní molekuly vyvolávající řetězec složitých dějů vedoucích k biosyntéze nádorové buňky (obr. 2).
Obr. 2. Možnosti cíleného zásahu na úrovni prostatické nádorové buňky (převzato z Remedia 2012) Fig. 2. Various points of drugs therapeutic effect on prostate cancer cell (from Remedia with permission) 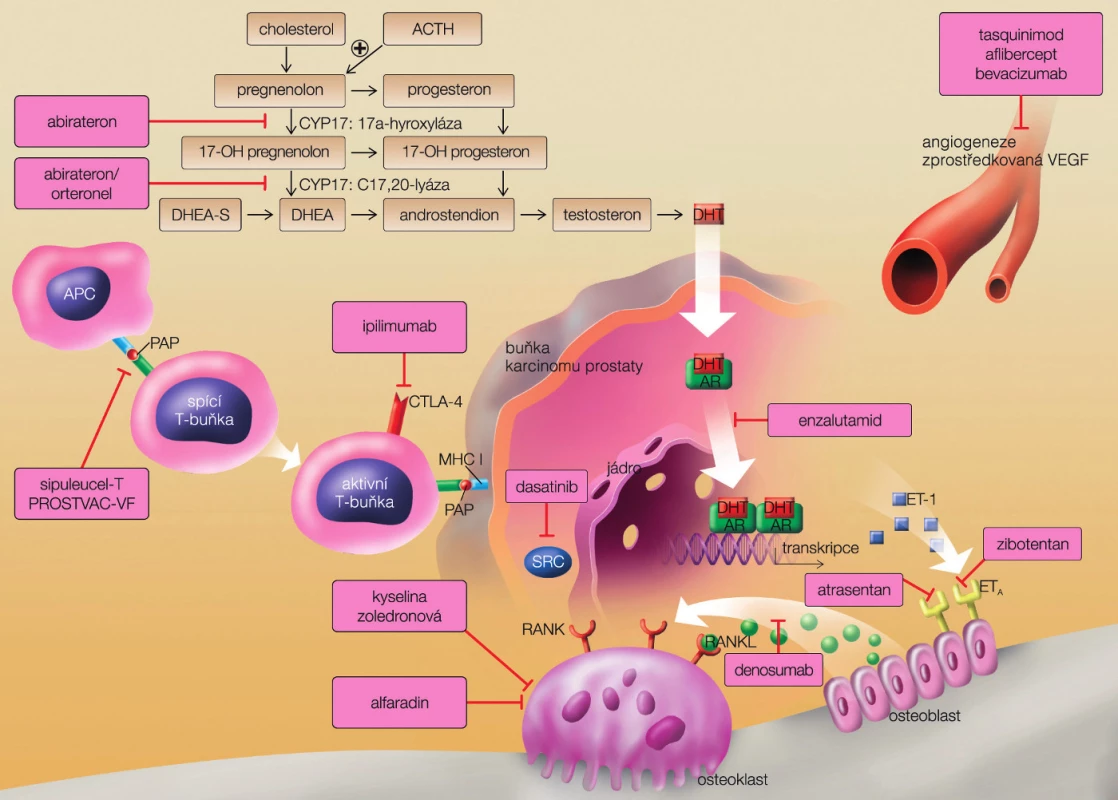
Androgenní receptor (AR) je ligandy aktivovaný transkripční faktor z podskupiny steroidních hormonů patřících do velké rodiny nukleárních receptorů. Zprostředkovává buňce androgenní signály a je kódován na X. chromozomu. AR sestává z 919 aminokyselin a obsahuje tyto dosud popsané strukturální a funkční domény: N-terminálmí transaktivační doménu (kódovanou exonem 1), DNA vážící doménu (DBD), kódovanou exony 2 a 3, schopnou identifikovat specifické sekvence DNA zvané AREs (androgen response elements). Dále je zde ligandy vážící doména, dokující androgeny (LBD, ligand-binding domain, exony 4–8), situovaná na C-terminálním úseku. Androgenní receptor ještě obsahuje dva transaktivační lokusy – AF-l na N terminální doméně a AF-2 lokalizovaný na LBD. Mezi DBD a LBD je situován vazebný region obsahující acetylační motiv. AR má pevně definovanou stavební i funkční organizaci. Důležitou roli v genové regulaci AR hraje enzymaticky ovlivňovaná rovnováha mezi acetylací a de-acetylací. Funkci AR významně ovlivňují i kinázy. Androgenní receptor má schopnost vázat se na úseky genů, které ovlivňují růst, přežívání a buněčnou proteosyntézu. Tuto vlastnost si uchovává i u buněk nádorových. Hovoříme-li dále o hormonální manipulaci, zahrnuje tento přístup endokrinní regulaci androgenů, chirurgickou i chemickou kastrací a nově inhibici enzymů steroidogeneze a inhibici vlastního AR (6). U CRPC se však uplatňují další mechanismy udržující funkční aktivitu AR. Mezi ně patří amplifikace nebo somatická mutace AR, hyperaktivita AR a pozměněná reakce s kofaktory, které v souhrnu vedou k promiskuitní aktivaci receptoru nonandrogenními ligandy a růstovými faktory (7).
Hladina testosteronu v nádorové buňce CRPC i v buňkách metastáz je podobná jako u nekastrovaných jedinců. Důvodem je zvýšená exprese enzymů steroidogeneze androgenů konvertujících T na DHT. Typickou změnou je amplifikace DNA, která podmiňuje zviditelnění AR. Receptor se stává více citlivý i na nízké hladiny ligandů (androgenů) (8). Mutace androgenního receptoru, zvláště v oblasti DBD, vede k jeho aktivaci neandrogenními steroidními molekulami a také paradoxně molekulami antiandrogeny. Touto cestou bývá vysvětlován náhlý pokles PSA po vysazení léčby antiandrogeny (AAWP) (8). Mechanismus AAWP však může být i odlišný, a to propojením dvou AR mutant s delecí exonů 5, 6, 7, jehož výsledkem je nová schopnost translokace AR do jádra i bez navázání ligandů (androgenů) (9, 10). K aktivaci androgenního receptoru může docházet i prostřednictvím odlišných transdukčních cest, kde se uplatňují jiné stimulující faktory jako EGF (epidermal growth factor), IGF (insulin-like growth factor), receptor tyrozinkinázy. Kinázy patří do velké skupiny SFK (Src family kinases), u kterých je prokázáno ovlivňování základních intracelulárních procesů zahrnujících buněčný růst, dělení, morfologii, migraci, prodloužené přežívání a též modifikace signálů (11). Nonreceptorové tyrozinkinázy přenášejí signály od jiných receptorů jako EGF, PDGF (platelet-derived growth factor) a VEGF (vascular endothelial growth factor). Jejich hladina může být zvýšena až o 30 % u pacientů s karcinomem prostaty. Také IGF-1R (insulin-like growth factor 1 receptor) vykazuje transformační aktivitu (migrace, adheze, invaze) a antiapoptotickou aktivitu zjišťovanou především u metastáz CRPC. Předpokládá se, že nález zvýšené exprese IGF-1R u nádorových buněk může být považován za nepříznivý prognostický faktor (12). Rezistence CRPC se může projevovat snížením apoptózy nádorových buněk, kterou terapeuticky indukuje androgenní deprivace. Překlenutí tohoto efektu je možné zvýšenou aktivitou antiapoptotických proteinů, např. zmíněného bcl-2 (13). Konečně k hormonální rezistenci udržující si růstovou schopnost mohou přispět i kmenové buňky karcinomu prostaty. Bylo prokázáno, že tyto nečetné buňky nepotřebují pro přežití androgeny. Mohou tedy být příčinou rezistence a udržovat nádorový růst v průběhu hormonální léčby. Jejich identifikace je možná průkazem integrinu α1β1 a CD133 na povrchu nádorové buňky. Tato cesta by mohla být i cíleným zásahem léčebně využitelná (8).
NOVÉ MOŽNOSTI LÉČBY CRPC – PŘÍPRAVKY
Nové léčivé přípravky využívají nejen další možnost ovlivnění hormonálního prostředí, ale i cílené zasažení do jednotlivých fází růstu nádorové buňky, např. inaktivací prorůstových faktorů, stimulací imunitních reakcí, potlačením angiogeneze a dalšími.
Každá nová molekula, resp. dosažený terapeutický efekt, je srovnávána se standardem, tedy režimem docetaxel s prednisonem. Na základě srovnávacích studií jsou pak regulačními orgány zařazovány do terapeutických schémat, nejčastěji do II. linie léčby po selhání režimu docetaxel plus prednison. Nejnověji však i před tento režim. V budoucnu nás čeká jistě úprava léčebných schémat.
Hormonální přípravky
Mnoho let jsou léčebně podávány steroidní a nesteroidní antagonisté androgenních receptorů (antiandrogeny), které vazbou na androgenní receptory vedou k jejich inaktivaci. Bližším poznáním biologických procesů byly objeveny další možnosti ovlivnění této cesty (tab. 1).
Tab. 1. Možnosti ovlivnění hladin testosteronu při terapii karcinomu prostaty Table 1. Possible ways of influence on testosterone level in prostate cancer therapy 
T – testosteron, AR – androgenní receptor Prvním přípravkem celé skupiny, který má již schválení na podkladě studie NCT00638690 (COU-AA-301) pro léčbu II. linie CRPC je abirateron acetát (AAC, Zytiga®). Abirateron je perorální přípravek, který navozuje ireverzibilní inhibici CYP17 (17α-hydroláza a C 17,20-lyáza), tedy blokuje hydroxylaci pregnenolonu (14). U nemocných předléčených docetaxelem vede podání abirateronu k prodloužení přežití (OS) o 4,6 měsíce a zlepšení přežití bez progrese (PFS – progression free survival) o 5,6 měsíce oproti 3,6 měsíců u předléčených nemocných (15). Primárním sledovaným parametrem bylo OS. Průběžná analýza prokázala snížení rizika úmrtí o 53,4 % ve skupině s AAC proti placebu (graf 1), navíc výsledky dokládají prodloužení doby do biochemické i radiologické progrese. Ze subanalýzy studie je zřejmé, že nelze očekávat odpověď u mužů předléčených dvěma a více režimy chemoterapie, u nemocných s Gleasonovým skóre 8 a vyšším a nemocných, kteří neodpovídali na léčbu docetaxelem. V této indikaci je schváleno od 8. února 2013 podání přípravku i v České republice. Podání je vázáno na komplexní onkologická centra (KOC).
Graf 1. Vliv podání abirateron acetátu na celkové přežití ve srovnání s placebem (výsledky studie COU AA 301) (podle 15) Graph 1. Abirateron acetate effect on overall survival compared with placebo (Results COU AA 301 study) (15) 
Novinkou od podzimu 2012 je možnost podání abirateronu u chemonaivních pacientů. Tato indikace byla otevřena na pokladě výsledků studie COU-AA-302, prezentované na kongresu ASCO 2012 (16). V únoru 2012 byla po průběžné analýze studie otevřena a pacienti z větve s placebem mohou být převedeni na léčbu AAC (17). I v této studii jsou primárními sledovanými parametry OS a radiologické PFS. Tato indikace, tedy podání pacientům před aplikací deocetaxelu, je však schválena pouze FDA, a platí tedy zatím pouze pro Spojené státy a Kanadu.
Dalším přípravkem v této skupině je orteronel (TAK-700), selektivní nesteroidní inhibitor C 17,20-lyázy). Je ověřován ve dvou studiích fáze III. Je studován i TOK-001, duální antiandrogen a inhibitor CYP17.
U předléčených i nepředléčených pacientů byl velmi dobrý efekt prokázán u přípravku enzalutamid (MDV3100) ve studiích AFFIRM a PREVAIL. Enzalutamid byl na ASCO 2012 hodnocen jako molekula desetiletí. Vedle inhibice biosyntézy androgenů je tlumena i jaderná translokace a vazba AR na jadernou DNA. Proti klasickým antiandrogenům je popisován až osminásobný účinek. Podání enzalutamidu vede k prodloužení OS (graf 2), doby do progrese PSA i radiografické PFS (18). Přípravek má v současné době schválení FDA pro II. linii léčby CRPC po selhání chemoterapie. V Evropě je podáván v rámci specifického léčebného programu shodného se studií AFFIRM a zatím nemá schváleno podání Evropskou lékovou agenturou.
Graf 2. Celkové přežití pacientů ve studii AFFIRM (podle 18) Graph 2. Overall patients survival in AFFIRM study (18) 
Na androgenní signální dráhu mají tlumivý vliv i proteiny tepelného šoku (heat shock protein – Hsp90).
Cytotoxické přípravky
Od počátku devadesátých let je používán antracendion, mitoxantron v kombinaci s prednisonem. Od roku 2004 jej nahradil v uroonkologii z větší části docetaxel v kombinaci s prednisonem na podkladě studií III. fáze (TAX 327 a SWOG 9916) (19), kdy byl prokázán významně delší interval PFS (19 měsíců), i když střední doba přežití (OS) nebyla významněji ovlivněna (1,9 měsíce).
Novým přípravkem ze skupiny taxanů je taxan III. generace kabazitaxel. Rozdíl v chemické struktuře umožňuje překonat rezistenci vůči předchozí generaci taxanů (obr. 3). Efektivita byla prokázána studií III. fáze (TROPIC) (20) u pacientů předléčených docetaxelem nebo s progresí při léčbě docetaxelem.
Obr. 3. Chemická struktura docetaxelu a kabazitaxelu Fig. 3. Docetaxel and cabazitaxel chemical structure 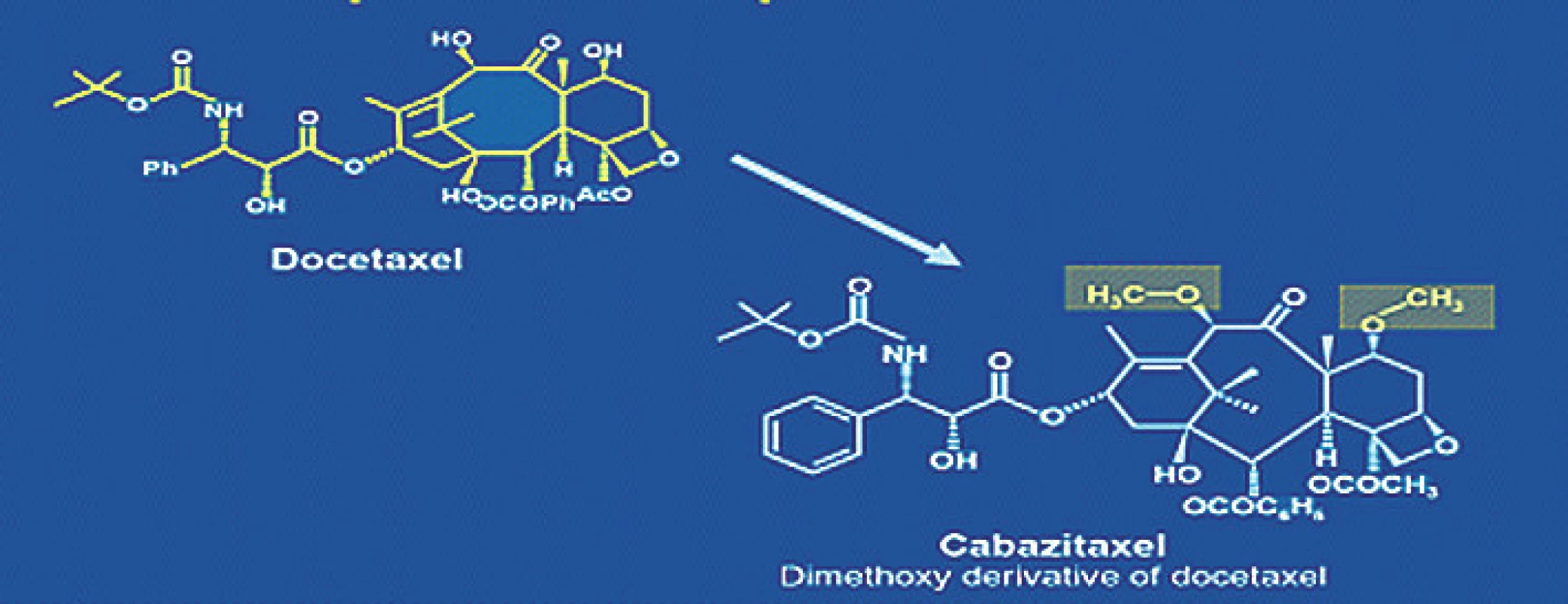
Do studie TROPIC bylo zařazeno 775 mužů s HRCP. Pacienti byli randomizováni do ramene s mitoxantronem (12 mg/m2 a 3 týdny; n = 377) nebo do ramene s kabazitaxelem (25 mg/m2 a 3 týdny; n = 378), současně pa-cienti užívali prednison 10 mg p.d.. Primárním cílem bylo hodnocení OS; sekundárním cílem PFS, hodnocení odpovědi na léčbu, sledování bolesti a bezpečnost podání. Medián dalšího sledování dosáhl 12,8 měsíce. Medián léčebných cyklů činil 6 cyklů v rameni s kabazitaxelem a 4 cykly v rameni s mitoxantronem. V primární analýze dosáhli pacienti léčení režimem kabazitaxel/prednison signifikantně delšího celkového přežití (graf 3) ve srovnání s režimem mitoxantron/prednison (15,1 měsíce vs. 12,7 měsíce, HR: 0,70; 95% CI: 0,59–0,83; p < 0,0001). Na rozdíl od abirateronu je u kabazitaxelu dosažena odpověď i u pacientů, kde selhala léčba docetaxelem. Studie TROPIC je jednou z mála, kde šlo o srovnání proti účinné látce, nikoliv proti tzv. best supportive care. Nejvýznamnější v toxicitě léčby byla hematologická toxicita (tab. 2), z nehematologické toxicity pak průjmy, nauzea a únava. Vzhledem k hematologické toxicitě bývá režim podáván za podpory růstových faktorů.
Graf 3. Přežití bez progrese onemocnění ve studii TROPIC (podle 20) Graph 3. Survival without disease progression in TROPIC study (20) 
Tab. 2. Hematologická toxicita ve studii TROPIC (podle 20) Table 2. Haematologic toxicity in TROPIC study (20) 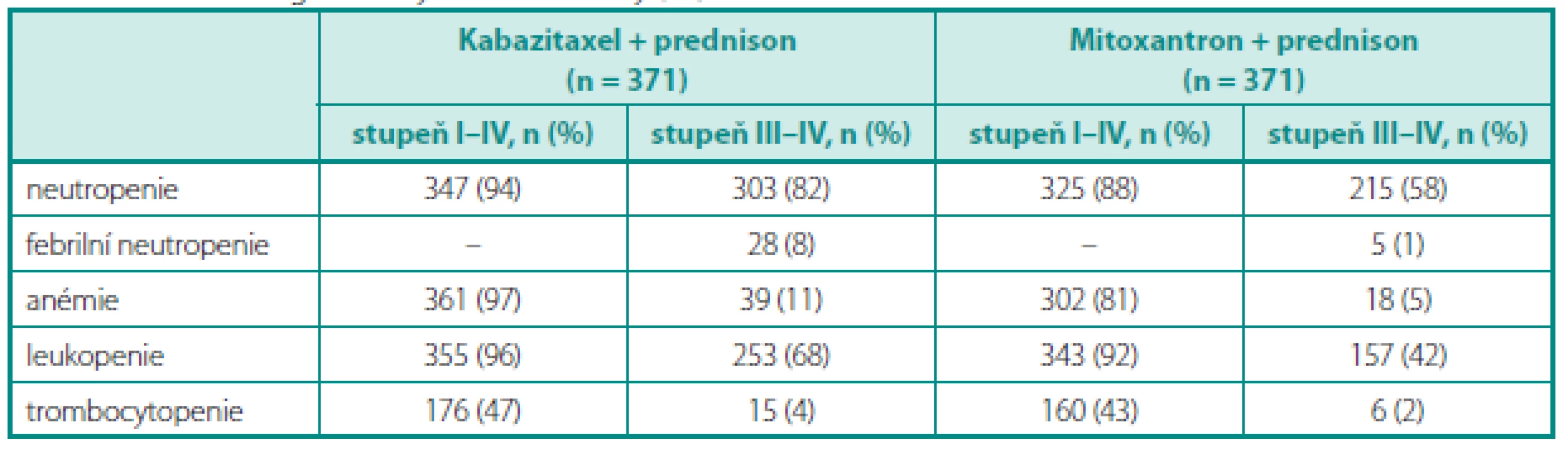
Studie TROPIC dokládá efektivitu režimu kabazitaxel v kombinaci s prednisonem, kdy dochází ke statisticky signifikantnímu prodloužení přežití u pacientů s metastatickým kastračně rezistentním karcinomem prostaty po předchozí léčbě docetaxelem. V indikaci léčby mCRPC ve II. linii léčby je schváleno od 8. února 2013 podání přípravku i v České republice. Podání je vázáno na komplexní onkologická centra (KOC).
Do skupiny cytostatik jsou řazeny i epothilony (ixabepilon a patupilon) tvořící novou skupinu. Interferencí s tubulinem narušují rovnováhu polymerizace a depolymerizace mikrotubulů, a tím brání buněčné mitóze. Jsou lépe hydrosolubilní, a tím vyvolávají méně nežádoucích účinků než taxany, které způsobují hypersenzitivitu a kardiotoxicitu v důsledku přidaných solubilizujících kremoforů. Je připravena studie III. fáze s ixabepilonem a probíhá studie fáze II s patupilonem, obě jako druhá linie po léčbě docetaxelem (21). Z nových přípravků na bázi platiny byla syntetizována satraplatina (JM216); jedná se o sloučeninu třetí generace na bázi platiny určenou k perorálnímu použití. Ve studii SPARC je její podávání ověřováno jako léčba druhé linie v kombinaci s prednisonem po terapii docetaxelem. Tato léčba vykazuje signifikantní zlepšení PFS (22).
Ovlivnění (inhibice) angiogeneze
Inhibice růstu cévního zásobení významně limituje nádorovou progresi. Delší dobu je s tímto cílem podáván parenterální bevacizumab, který však není indikován pro léčbu karcinomu prostaty. V současnosti dospěla do závěrečné fáze studie III. fáze s přípravkem aflibercept (VEGFTrap), který neutralizuje faktory skupiny VEGF. Výsledky ještě nejsou v současné době k dispozici. Přípravek je podáván v kombinaci s docetaxelem. Aflibercept je složitý protein s vysokou afinitou na vazebná místa VEGFR1 a VEGFR2, která medializují angiogenezi. Touto cestou se významně redukuje růst u řady nádorů (23). Inhibice angiogeneze je prokázána u imunomodulačních preparátů thalidomidu a jeho derivátů (skupina IMiDs). Lenalidomid, orální derivát thalidomidu s významně nižšími vedlejšími příznaky, moduluje intracelulární prostředí nádorové buňky, inhibuije TNF-α, angiogenezi a proliferaci; u CAP je ověřována studiemi fáze II (24).
Ve III. fázi zkoušení u asymptomatických a mírně symptomatických CRPC je studován inhibiční efekt cévního růstu při podávání přípravku tasquinimod (versus placebo). Ve II. fázi pak podání po docetaxelu. Tasquinimod zvyšuje produkci TSP1 mRNA a následně extracelulární sekreci TSP1 (trombospondinu 1), který tím tlumí produkci VEGF a proteinu HIF-1α androgenního receptoru. Tento mechanismus vede k inhibici iniciálního stupně angiogeneze (25). Výsledky zatím nejsou k dispozici, zdá se, že limitujícím pro podání by mohla být neurotoxicita.
Stimulace imunitní odpovědi (imunoterapie)
Léčebný efekt je založen na imunitní reakci systému nositele na zviditelněný antigen nádorové prostatické buňky. V roce 2010 na podkladě výsledků studií IMPACT, D9901 a D9902 schválil FDA (USA) autologní vakcínu sipuleucel-T. Sipuleucel je protinádorovou vakcínou, která obsahuje aktivované autologní mononukleáry periferní krve nositele a buňky nesoucí antigen. Ty jsou aktivovány ex vivo s rekombinantním proteinem skládajícím se z molekuly prostatické kyselé fosfatázy a GM-CSF (granulocyte-macrophage colony-stimulating factor) jako aktivátoru buněčné imunity. Přípravek je zatím dostupný v USA, pacient je zařazen na waiting list a použití přípravku je omezeno na okruh vybraných klinických pracovišť. Dosavadní výsledky udávají prodloužení OS o 3,9 měsíce, avšak PFS nebyl ovlivněn (26). Další vakcína PROSTVAC-VF se skládá ze dvou virových vektorů, z nichž každý kóduje transgeny pro PSA, a dále ze tří kostimulačních molekul (B7.1, ICAM-1 a LFA-3). Je ověřována ve studii III. fáze proti docetaxelu, i když výsledky fáze II byly rozporuplné (27). Ve studiích VITAL-1 a VITAL-2 byla ověřována účinnost vakcíny GVAX. Vakcína je tvořena geneticky adenoviry modifikovanými nádorovými buňkami CAP produkujícími hormon GM-CSF, který stimuluje imunitní odpověď organismu nositele. Dokončená studie VITAL-2 přinesla slibné výsledky a v současnosti probíhá studie VITAL-3 (GVAX plus docetaxel vs. docetaxel plus prednison) (28).
V České republice probíhají studie fáze II s využitím autologního léčivého přípravku buněčné protinádorové imunoterapie s aktivovanými dendritickými buňkami (DCVAC/PCa) u pacientů s mCRPC, ale také u pacientů v časných fázích onemocnění. Na rozdíl od sipuleucelu-T nevyužívá k pulzaci dendritických buněk pouze jediný antigen – ACPT, nýbrž celou nádorovou linii z buněk karcinomu prostaty LNCaP. Rovněž DCVAC/PCa je vyráběn individuálně z leukaferetickeho produktu. Subkutánní aplikace je pohodlnější pro pacienta. V průběhu roku 2013 bude zahájena registračni studie fáze III v Evropě i USA.
Látky modifikující kostní metabolismus
Vedle stále hojně užívaných bisfosfonátů je v klinickém použití denosumab (Dmab). Jde o monoklonální protilátku, která vazbou na RANK ligand, mediátor maturace, funkce i přežívání osteoklastů, zpomaluje osteolýzu, vznik metastáz a riziko kostní destrukce. FDA schválil v roce 2011 denosumab ke klinickému použití na podkladě výsledků rozsáhlé studie v 342 centrech s 1902 pacienty. Studie prokázala významné prodloužení doby do vzniku kostních komplikací (SRE – skeletal related events) na medián 20,7 měsíce proti 17,1 měsíce při aplikaci kyseliny zoledronové. Více se vyskytovala hypokalcémie, byť asymptomatická, i při náležité suplemetaci kalciem a vitaminem D3. Obávaná nekróza čelisti byla zjištěna u 22 pacientů, zatímco při léčbě kyselinou zoledronovou se nekróza čelisti objevila u 17 pacientů (29), ale ve skupině s Dmabem byla mírně vyšší úspěšnost v léčbě. Dmab neovlivňuje přežití pacientů se zhoubným nádorem. Denosumab byl schválen FDA k léčbě pacientů s karcinomem prostaty i k prevenci kostních příhod u mužů léčených androgenní deprivací (30). V České republice je podání přípravku schváleno pouze v indikaci maligní osteolýzy. Od 1. února 2013 je přípravek hrazen ze všeobecného zdravotního pojištění.
Další slibnou cestu představuje dasatinib. Inhibitor SRC protoonkogenu ze skupiny nonreceptorových tyrozinkináz, enzymů podílejících se na fosforylaci buněčných proteinů SRC, se významně podílí na aktivitě osteoklastů, proliferaci osteoblastů a metabolismu kostní tkáně. Po ukončeném náboru jsou vyhodnocovány výsledky studie III. fáze z hlediska ovlivnění OS. Dasatinib byl aplikován v kombinaci s docetaxelem (31).
Stimulace apopotózy
V různých studiích je využíván protein clusterin vykazující antiapoptotický účinek (obr. 4). Clusterin má zvýrazněnou expresi u různých nádorů včetně karcinomu prostaty. Předpokládá se jeho protektivní účinek proti radioterapii, chemoterapii i hormonální léčbě. Ve studii fáze II (OGX-011-03) byl ověřován custirsen, inhibitor clusterinu, v kombinaci s docetaxelem a prednisonem proti docetaxelu a prednisonu. I když nebylo dosaženo 50% poklesu PSA, podávání trojkombinace vedlo k mírnému prodloužení PFS (7,3 vs. 6,1 měsíce) a OS (23,8 vs. 16,9 měsíce). Nyní probíhají dvě studie fáze III (OGX-011-12) v jedné dostávají pacienti s mCRPC v první linii custirsen v kombinaci s docetaxelem a prednisonem, v další je nemocným s mCRPC podáván ve druhé linii léčby custirsen s kabazitaxelem.
Obr. 4. Apoptotický účinek clusterinu Fig. 4. Clusterin apoptotic effect 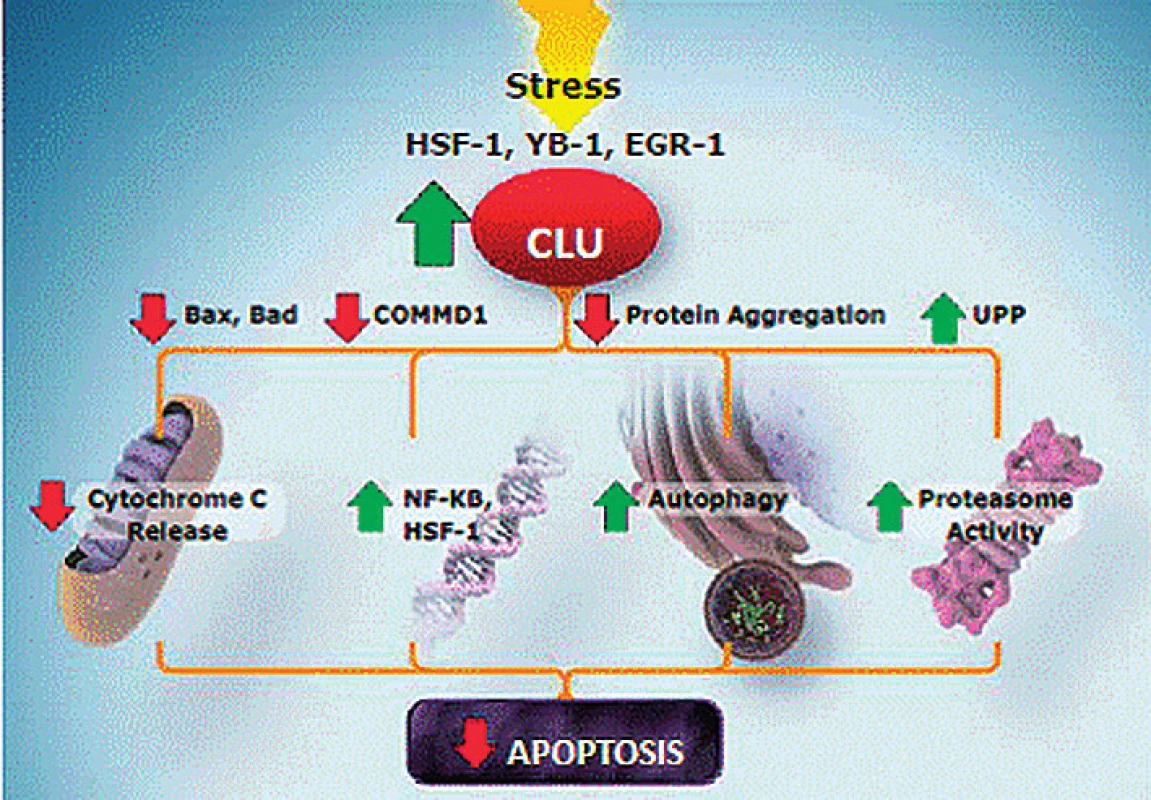
Využití antagonistů endotelinových receptorů ETA
Endotelin ET1 (IGF a PDGF) působí v konečné fázi kostní mineralizaci, která převažuje nad resorpcí a vede ke vzniku osteoblastických metastáz. ET-1 se váže na plazmatický receptor ETA, který působí jako faktor prodlužující buněčné přežití. ETA se vyskytuje ve vyšší koncentraci u nositelů CRPC, zatímco varianta ETB má vyšší koncentrace v buňkách BPH. Zvýšení ETA je považována za znamení horší prognózy. Vazba ET-1 a ETA inhibuje resorpční aktivitu osteoklastů a má za následek růst osteoblastických metastáz. Ty jsou pak tvořeny řídkými svazky kolagenu a tato místa ve spojení s osteoklastickou aktivitou způsobují závažné kostní komplikace, bolesti a fraktury. Byl doložen i antiapoptotický efekt a stimulace angiogeneze. Inhibice endotelinu antagonistou receptoru tedy může příznivě ovlivnit vznik a projevy kostních metastáz.
Atrasentan, antagonista ETA, byl ověřován ve dvou studiích III. fáze u metastazujícího a nemetastazujícího CRPC, v obou studiích byl pacientům podáván atrasentan proti placebu. I když nebylo dosaženo prodloužení OS, byl zaznamenán významný pokles hladin PSA a alkalické fosfatázy. Nyní probíhá studie SWOG, kde je podáván atrasentan v kombinaci s docetaxelem (32). Další Zibotentan, antagonista ET-1 obsazující receptor ETA, prokázal ve studii II. fáze proti placebu prodloužení OS, avšak doba do progrese ovlivněna nebyla. Probíhají studie III. fáze, výsledky jsou však zatím rozporuplné (33).
Radiofarmaka v kostním metabolismu
Další možnost cílené léčby kostních metastáz představují radionuklidy. Imitují kalcium a jsou inkorporovány do buňky CRPC. Radionuklidy alfa emitují vysokou radiaci na krátkou vzdálenost (asi do 10 buněčných průměrů) navozující rozvolnění DNA šroubovice. Tím vedou ke smrti buňky. Vzhledem k mechanismu účinku působí difuzně, tedy i na mikrometastázy. Proti emitérům beta zatěžují tkáň významně nižší radiací. Prvním představitelem těchto radiofarmak je radium 223. Ve studii ALSYMCA fáze III u metastazujícího CRPC bylo proti placebu prokázáno prodloužení mediánu OS o 3,6 měsíce a medián do první SRE byl 5,5 měsíce (34–36). Výskyt nežádoucích účinků aplikace 223radia je prakticky nulový (graf 4).
Graf 4. Celkové přežití ve studii ALSYMCA (podle 34) Graph 4. Overall survival in ALSYMCA study (34) 
ZÁVĚR
V přehledu jsou uvedeny možnosti terapeutického ovlivnění progrese mCRPC a některé přípravky, které postoupily do II. a III. fáze klinického zkoušení a přípravky, které jsou schváleny v léčebném schématu. Velká část z nich, ač se nyní zdají slibné, bude vyžadovat další analýzy a k jejich eventuálnímu začlenění do algoritmu léčby zbývá ještě dlouhá cesta a podrobný výzkum.
Do klinické praxe byly uvedeny na podkladě registračních studií (tab. 3) kabazitaxel, abirateron acetát, enzalutamid a denosumab s rozdíly mezi jednotlivými zeměmi Evropy a USA, ve Spojených státech nádorová vakcína sipuleucel-T. Zkrácené řízení u FDA probíhá u radia 223.
Tab. 3. Přehled registračních studií, které dokumentují pokroky v přežití u mCRPC Table 3. Overview of registration studies confirming progress in survival in mCRPC patients 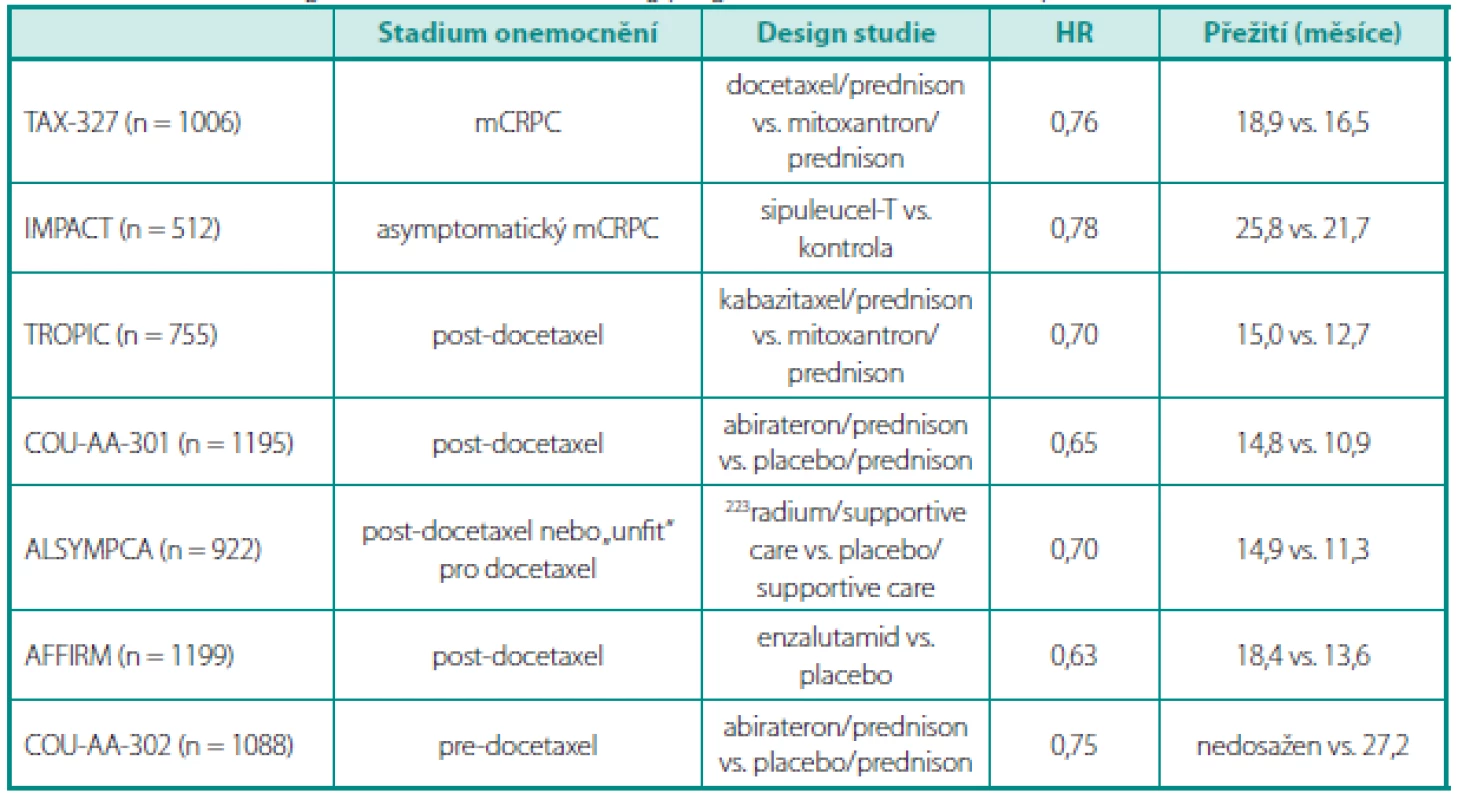
mCRPC – metastatický kastračně rezistentní karcinom prostaty mCRPC – metastatic castrate resistant prostate cancer Zatímco jsou jednotlivé přípravky schvalovány a postupně zařazovány do schémat léčby, na pořadí se dostává otázka časování terapie, tedy zda před či po podání režimu s docetaxelem, sekvence léčby a eventuální kombinace jednotlivých modalit. V současnosti probíhá řada studií, ve kterých jsou testovány kombinace docetaxelu s abirateronem, docetaxelu s enzalutamidem, docetaxelu s TAK700 nebo kabazitaxelu s abirateronem a řadou nových dalších molekul. Některé z přípravků jsou testovány i v časné adjuvanci u high risk karcinomů prostaty, např. kombinace abirateronu a LHRH analog.
Přestože dosahujeme při použití nových přípravků prodloužení celkového přežití (OS), prodloužení PFS a zlepšení kvality života nemocných s mCRPC, musíme mít a mysli, že se jedná o paliativní léčbu, tedy léčbu bez možnosti vyléčení zhoubného nádorového onemocnění.
Došlo: 18. 2. 2013.
Přijato: 12. 3. 2013.
Kontaktní adresa
MUDr. Michaela Matoušková
Urocentrum Praha
Karlovo náměstí 3, Praha 2
e-mail: matouskova@urocentrum.cz
Střet zájmů: Autorka je členem advisory board společností AMGEN, Bayer, GSK, Johnsson and Johnsson, Sanofi-Aventis.
Zdroje
1. Huggins C, Hodges C. Studies on prostatic cancer I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1 : 293–297.
2. Heidenreich A, Bastion PJ, Bellmunt J, et al. Guidelines on prostate cancer. European Association of Urology 2012; http://www.uroweb.org/gls/pdf/08%20Prostate%20Cancer_LR%20March%2013th%202012.pdf
3. Matoušková M, Hanuš M. Pokročilý karcinom prostaty, možnosti léčebného ovlivnění. Remedia 2010; 20 : 30–38.
4. Taplin ME, Bublej GJ, Shuster TD, et al. Mutation of the androgen-receptor gene in metastatic androgen-independent prostate cancer. N Engl J Med 1995; 332 : 1393–1398.
5. Tannock IF, de Witt R, Berry WR, et al. Docetaxel plus prednisone or Mitoxantrone plus prednisone for advanced prostate cancer. New Engl J Med 2004; 351, 1502–1512.
6. Massard Ch, Fizazi K. Targeting continued androgen receptor signaling in prostate cancer. Clin Cancer Res 2011; 17 : 3876.
7. Lavery DN, Bevan CL. Androgen receptor signalling in prostate cancer: the functional consequences of acetylation. J Biomed Biotechnol 2011; 2011 : 862125. Epub 2010 Dec 28.
8. Attard G, Sarker D, Reid A, et al. Improving the outcome of patients with castration-resistant prostate cancer through rational drug development. Br J Cancer 2006; 95 : 767–774.
9. Sprenger S, Vessella RL, et al. Castration resistance in human prostate cancer is conferred by a frequently occurring androgen receptor splice variant. J Clin Invest 2010; 120 : 2715–2730.
10. Watson PA, Chen YF, Balbas MD, et al. Constitutively active androgen receptor splice variants expressed in castration-resistant prostate cancer require full-length androgen receptor. Proc Natl Acad Sci USA 2010; 107 : 16759–16765.
11. Parsons SJ, Parsons JT. Src family kinases, key regulators of signal transduction. Oncogene 2004; 23 : 7906–7909., doi:10.1038/sj.onc.1208160.
12. Aggarwala R, Ryanb CJ. Castration-resistant prostate cancer: targeted therapies and individualized treatment. Oncologist 2011; 16 : 264–275.
13. Dutt SS, Gao AC. Molecular mechanisms of castration-resistant prostate cancer progression. Future Oncol 2009; 5 : 1403–1413.
14. Stein MN, Goodin S, Dipaola RS. Abiraterone in prostate cancer: a new angle to an old problem. Clin Cancer Res. 2012; 18(7): 1848–18-54. Epub 2012 Mar 26.
15. Fizazi K, Scher HI, Molina A, et al. Final overall survival (OS) analysis of COU-AA-301, a phase 3 study of abiraterone acetate plus prednisone in patients with metastatic castration-resistant prostate cancer (mCRPC) pretreated with docetaxel. European Multidisciplinary Cancer Congress 2011; Abstr 7000.
16. Ryan CJ, Smith MR, de Bono JS, et al. Abiraterone in Metastatic Prostate Cancer without Previous Chemotherapy. NEJM 2013; 368 : 38–48. DOI: 10.1056/NEJMoa1209096
17. Ryan CJ, Smith MR, De Bono JS, et al. Interim analysis (IA) results of COU-AA-302, a randomized, phase III study of abiraterone acetate (AA) in chemotherapy-naive patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). Presented at ASCO Annual Meeting 2012, Chicago, Illinois. J Clin Oncol 2012; 30(Suppl): Abstr LBA4518.
18. Scher HI, Fizzzazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. NEJM 2012; DOI 10.1056/NEJMoa1207506
19. Berthold DR, Pond GR, Roessner M, et al. TAX-327 investigators. Treatment of hormone-refractory prostate cancer with docetaxel or mitoxantrone: relationships between prostate-specific antigen, pain, and quality of life response and survival in the TAX-327 study. Clinical Cancer Research 2008; 14 : 2763–2767.
20. De Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376 : 1147–1154.
21. Goodin S, Kane MP, Rubin EH. Epothilones: Mechanism of Action and Biologic Activity. JCO 2004; 22 : 2015–2025.
22. Sternberg CN, Petrylak DP, Sartor O, et al. Multinational, double-blind, phase III study of prednisone and either satraplatin or placebo in patients with castrate-refractory prostate cancer progressing after prior chemotherapy: the SPARC trial. J Clin Onkol 2009; 27 : 5431–5438.
23. Stewart MW. Aflibercept (VEGF-TRAP): the next anti-VEGF drug. Inflamm Allergy Drug Targets 2011; 10 : 497–508.
24. Keizman D, Zahurak M, Sinibaldi V, et al. Lenalidomide in Nonmetastatic Biochemically Relapsed Prostate Cancer: Results of a Phase I/II Double-Blinded, Randomized Study. Clin Cancer Res 2010; 16 : 5269.
25. Olsson A, Björk A, Vallon-Christersson J, et al. Tasquinimod (ABR-215050), a quinoline-3-carboxamide anti-angiogenic agent, modulates the expression of thrombospondin-1 in human prostate tumors. Mol Cancer 2010; 9 : 107.
26. Kantoff PW, Gitano CS, Shore ND, el al. Sipuleucel-T Immunotherapy for Castration-Resistant Prostate Cancor. N Engl J Med 2010; 363 : 411–422.
27. Kantoff PW, Schuetz TJ, Blumenstein BA, et al. Overall survival analysis of a phase II randomized controlled trial of a Poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancor. J Clin Onkol 2010; 28 : 1099–1105.
28. Cell Genesys Initiates Second Phase 3 Clinical Trial Of GVAX® Vaccine For Prostate Cancer http://www.psa-rising.com/med/immun/GVAX-2005.htm
29. Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377 : 813–822.
30. SPC Prolia http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-Product_Information/human/001120/WC500093526.pdf
31. Randomized study comparing docetaxel plus dasatinib to docetaxel plus placebo in castration-resistant prostate cancer (READY) http://clinicaltrials.gov/ct2/show/NCT00744497
32. Nelson JB, Love W, Chin JL, et al. Phase 3, Randomized controlled trial of atrasentan in patients with nonmetastatic hormone-refractory prostate cancer. Cancer 2008; 113 : 2478–2487.
33. Petrylak DP. Evolving therapeutic paradigms for advanced prostate cancer: what‘s needed to make optimal use of the new treatments. Oncology http://www.cancernetwork.com/prostate-ancer/content/article/10165/1859420
34. Parker C, Nilsson S, Heinrich D, et al. Updated analysis of the phase III, double-blind, randomized, multinational study of radium‑223 chloride in castration-resistant prostate cancer (CRPC) patients with bone metastases (ALSYMPCA) ASCO 6/2012.
35. Cheetham PJ, Petrylak DP. Alpha particles as radiopharmaceuticals in the treatment of bone metastases: mechanism of action of radium-223 chloride (alpharadin) and radiation protection. Oncology (Williston Park) 2012; 26 : 330–337, 341.
36. Harrison MR, Wong TZ, Armstrong AJ, George DJ. Radium-223 chloride: a potential new treatment for castration-resistant prostate cancer patients with metastatic bone dinase. Cancer Management and Research 2013; 5 : 1–14
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2013 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Možnosti léčby kastračně refrakterního karcinomu prostaty, co nového k roku 2013
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Eskalace dávky na intraprostatickou lézi – výsledky akutní a časné chronické toxicity
- Využití dvoufázové 3 T MRI angiografie v plánování operační léčby u nádorů ledvin
- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
- Exprese genů BCL-2 a BAX-1 ve tkáni Ta, T1uroteliálních karcinomů močového měchýře a jejich prognostický význam
- 1. ostravské urologicko-neurologické sympozium
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



