-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní radioterapie lokalizovaného karcinomu prostaty
Modern radiotherapy of localized prostate cancer
Aim:
Radiotherapy has been one of the standard treatments for prostate cancer for decades. Rapid technological development over the last 20 years has changed the way we use radiotherapy to treat prostate cancer.Methods:
This communication reviews study outcomes and summarizes the current knowledge regarding the use of newer technologies in the radia-tion treatment for localized prostate cancer.Results:
Randomized studies have shown that higher doses of radiation improve clinical outcomes, but with increased toxicity to healthy tissue. The introduction of the techniques of conformal radiotherapy, intensity modulated radiotherapy, proton therapy, stereoactic radiation therapy and brachytherapy allows for the escalation of radiation doses with a simultaneous reduction in toxicity. However, its use has been associated with errors and inaccuracies due to the motion of the prostate in real time. Recent technological developments allow for better monitoring and response to these changes.Conclusion:
Technological advances in radiotherapy have led to improved delivery of high doses of radiation to the prostate while reducing the toxicity of the surrounding healthy tissue. Randomized studies are justified and important, but often cannot be performed at the same rate at which new technological innovations are developed and introduced into clinical practice.Key words:
modern radiotherapy, prostate cancer.
Autoři: Renata Soumarová 1,2,3; Hana Perková 1; Luboš Homola 1; Stanislav Machala 1; Halina Richterová
Působiště autorů: Nemocnice Nový Jičín a Komplexní onkologické centrum Nový Jičín 1; Lékařská fakulta Ostravské univerzity v Ostravě 2; Vzdělávací a výzkumný institut AGEL, o. p. s. – pobočka Nový Jičín, Nemocnice Nový Jičín a. s., Onkologické oddělení 3
Vyšlo v časopise: Ces Urol 2013; 17(3): 154-165
Kategorie: Přehledový článek
Souhrn
Úvod:
Radioterapie neboli léčba zářením patří mezi standardní léčbu rakoviny prostaty již několik desetiletí. V posledních dvou desetiletích dochází k velmi rychlému technologickému rozvoji, který mění náš pohled na tuto modalitu a současný přístup k léčbě rakoviny prostaty.Metody:
V přehledovém článku se zabýváme výsledky studií a použitím novějších technologií v léčbě zářením u lokalizovaného karcinomu prostaty.Výsledky:
Randomizované studie prokázaly, že vyšší dávky záření zlepšují klinické výsledky, ale se zvýšením toxicity zdravé tkáně. Zavedení konformní techniky radioterapie, radioterapie s modulovanou intenzitou, protonové terapie, stereotaktické radioterapie a brachyterapie umožňuje eskalaci dávek se současným snížením toxicity. To s sebou přináší i možný vznik chyb a nepřesností daných pohybem prostaty v reálném čase. Další technologický pokrok dovoluje sledovat a reagovat i na tyto změny.Závěr:
Technologický pokrok v radioterapii vede ke zlepšení dodání vysoké dávky do prostaty se snížením toxicity na okolní zdravé tkáně. Randomizované studie jsou oprávněné a důležité, ale často rychlost vzniku a zavádění technologických novinek do praxe výsledky klinických studií teprve dohánějí.Klíčová slova:
moderní radioterapie, karcinom prostaty.ÚVOD
V posledních 20 letech randomizované studie prokázaly, že použití vyšších dávek záření v léčbě lokalizovaného karcinomu prostaty vede ke zlepšení výsledků (1–5). Nicméně, použití tradičních konvenčních technik pro zvyšování dávek mělo za následek vyšší toxicitu především konečníku a močového měchýře, za zmínku stojí i sexuální dysfunkce (6, 7).
V osmdesátých letech 20. století umožnilo zlepšení v oblasti plánování radioterapie využití počítačové tomografie (CT), což vedlo k rozvoji trojrozměrné konformní radioterapie (3D CRT). Použití 3D CRT u karcinomu prostaty dovoluje zvyšování dávky záření (kolem 70 Gy) s lepším šetřením okolní zdravé tkáně.
V polovině devadesátých let, další vývoj software pro plánování spolu se zavedením tzv. multileaf kolimátorů (tj. tvarování svazku záření pohybem tenkých lamel), vedl k rozvoji techniky s modulovanou intenzitou (IMRT). Plánování je usnadněno tím, že stanovujeme maximální dávku záření v cílovém objemu a omezujeme dávky záření v přilehlých orgánech a strukturách (tzv. constrains). Technika IMRT, která se pravděpodobně v současnosti stala standardem v zevní radioterapii karcinomu prostaty, umožňuje další zvyšování dávky již nad 81 Gy (8, 9), ale také umožňuje lépe stanovovat vztah mezi dávkami v určitém objemu zdravých orgánů (10, 11).
Se zavedením konformní techniky radioterapie, konformní ve smyslu přizpůsobení se ozařovaného objemu cílovému, stoupá význam pohybu prostaty. Pohyb prostaty může vést k nepřesnostem při dodání dávky záření. Pro denní monitoraci pohybu prostaty a s tím související přesné dodávání dávky záření využíváme techniku radioterapie známou jako obrazem řízená RT – image guided RT (IGRT).
Další novinkou v aplikaci léčby zářením je rychlost dodání dávky záření, tedy doba, po kterou radioterapie probíhá. Krátké kurzy velmi konformní radioterapie využívají extrémně vysokých dávek záření na jednotlivou frakci. Tento přístup je známý jako stereotaktická radioterapie (SBRT). Kromě technik zevní radioterapie, vývoj zaznamenala i brachyterapie (BRT), která též využívá akcelerace v léčbě zářením. Probíhají též studie a prospektivní analýzy u pacientů léčených protonovou terapií.
KONFORMNÍ RADIOTERAPIE
Dávka potřebná pro kurativní léčbu lokalizovaného karcinomu prostaty je dle řady studií stanovena minimálně na 74–76 Gy (1–5, 12). Avšak pro zevní radioterapii u karcinomu prostaty je limitující těsná blízkost konečníku a močového měchýře. Při použití konvenčních technik radioterapie však bylo zlepšení výsledků zatíženo vysokou toxicitou (6, 7).
V osmdesátých letech příchod sofistikovanějšího plánování léčby záření na podkladě využití CT umožňuje zavedení konformní radioterapie (3D CRT). Tato technika všeobecně používá pět až sedm tvarovaných polí. Pohled ze svazku záření, tzv. BEV ukazuje obrázek 1. Pollackova studie (3) hodnotila 301 pacientů léčených 3D CRT v dávce 70 Gy ve srovnání s pacienty léčenými 78 Gy. Kuban et al. (13) nedávno uvedl desetileté výsledky této studie, které prokazují zlepšení biochemické i klinické kontroly onemocnění ve prospěch ramene s vyšší dávkou (73 % vs. 50 %). Několik dalších randomizovaných studií využívajících 3D CRT s eskalací dávky v rozmezí 78–81 Gy ve srovnání s dávkou 68–70 Gy tyto výsledky podpořilo (1, 5).
Obr. 1. Tvarované pole využívané v konformní radioterapie, pohled ze svazku záření (BEV) Fig. 1. Shaped field used in conformal radiotherapy, beams eye view (BEV) 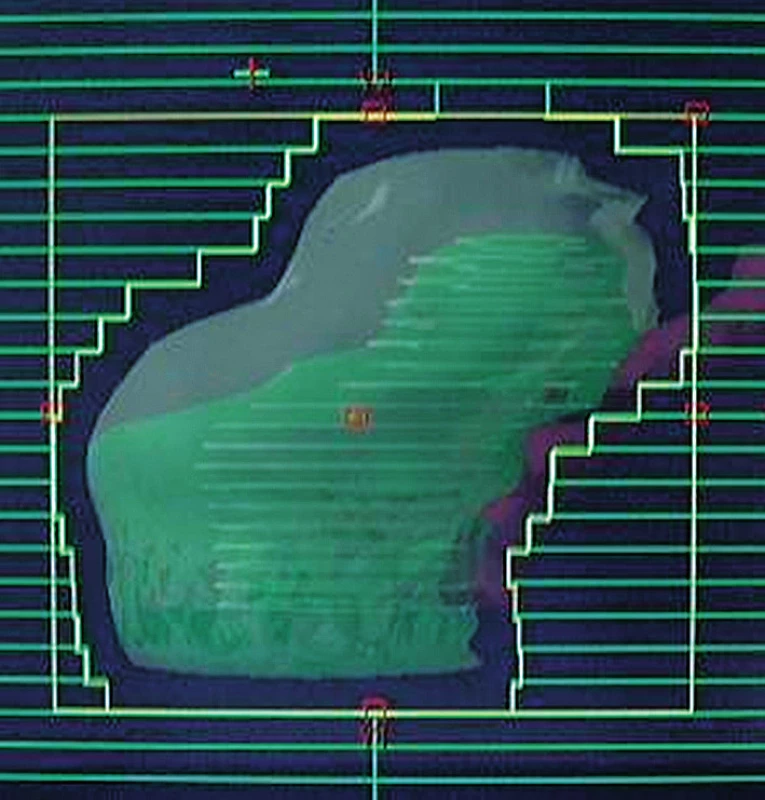
I přes použití konformní radioterapie dochází ke zvyšování zejména rektální toxicity. Kubanova studie z MD Anderson Cancer Centra zjistila, že gastrointestinální (GIT) toxicita 2. stupně se zvýšila při použití 78 Gy ve srovnání s dávkou 70 Gy z 11 % na 19 % a toxicita 3. stupně z 1 % na 7 % (13). Dearnaley et al. (1) uvádí zvýšení pozdní toxicity stupně 2 a 3 z 14 % a 4 % na 20 % a 6 % u dávek záření 74 Gy vs. 64 Gy. Zvýšení rektální toxicity je potvrzeno, vliv eskalace dávky na zvýšení genitourinární toxicity (GU) již tak jasné není. Opět Dearnaley et al. (1) prokázal výrazný nárůst stupně 2 a 3 GU toxicity při dávce 74 Gy. Podobně Zelefsky et al. (4) prokázal významně vyšší podíl GU toxicity stupně 2 u pacientů, kteří dostávali dávky > 75,6 Gy. Nicméně, několik jiných randomizovaných studií neprokázalo významnější nárůst pozdní GU toxicity se zvýšenými dávkami při použití techniky 3D CRT (1, 5, 14, 15).
RADIOTERAPIE S MODULOVANOU INTENZITOU (IMRT)
IMRT je vysoce přesný způsob dodávání dávky záření do cílového objemu. Zlepšuje schopnost přizpůsobit aplikaci potřebné dávky záření do konkávního cílového objemu, což odpovídá tvaru prostaty. Ústředním bodem této techniky je integrace multileaf kolimátorů, které jsou složeny z jednotlivých „listů“, a které se mohou pohybovat nezávisle ve svazku záření. Teoretickým principem je rozdělení ozařovacího pole na mnoho tužkových svazků s různou intenzitou. Srovnání konformní techniky a techniky IMRT je uvedeno na obrázku 2.
Obr. 2. Rozložení předepsané dávky (červeně) při použití techniky konformní radioterapie (A) radioterapie s použitím techniky IMRT (B) Fig. 2. Dose fractionalisation (in red) to be used for conformal radiotherapy (A) and radiotherapy techniques with the use of IMRT (B) 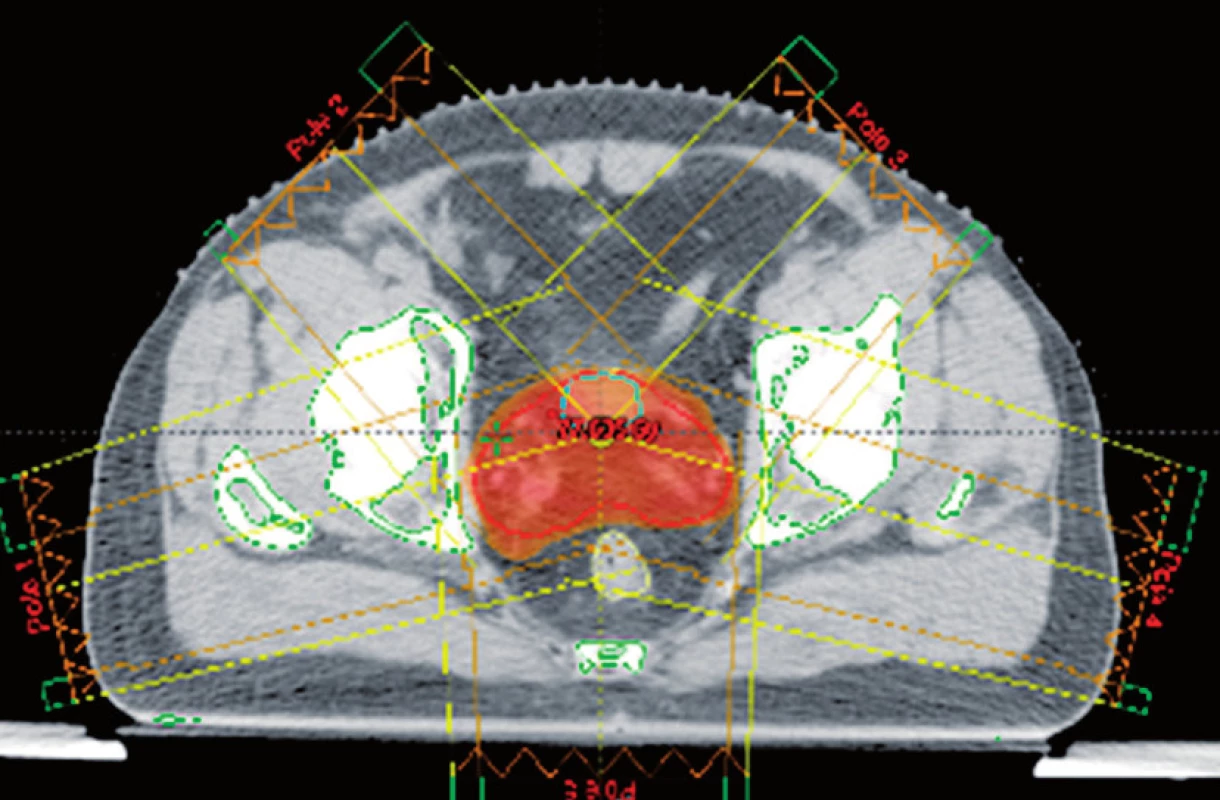
S použitím techniky IMRT může dojít ke snížení toxicity zdravých tkání i přes použití vysokých dávek záření. Zelefsky et al. (8) publikoval studii, ve které srovnával pacienty léčené 81 Gy buď technikou 3D CRT (n = 61), nebo IMRT (n = 171). Zjistil, že GU i GIT toxicita je výrazně nižší u pacientů léčených technikou IMRT. Tyto výsledky potvrdilo i několik dalších studií s dávkami v rozmezí 76–86,4 Gy (8, 16, 17). Nižší toxicita měla vliv i na zlepšení kvality života (18).
Technika IMRT kromě snížení toxicity umožňuje další dávkovou eskalaci vedoucí ke zlepšení přežití bez biochemické recidivy onemocnění (BFS). Vora et al. publikoval data 272 pacientů léčených 3D CRT dávkou 68,4 Gy ve srovnání se 145 pacienty léčených technikou IMRT dávkou 75,6 Gy (19). Použití vyšších dávek vedlo ke zlepšení BFS o 14 % (p < 0,0001) bez rozdílu v toxicitě léčby. Vědci z Memorial Sloan-Kettering Cancer Centra (MSKCC) publikovali výsledky velké studie u 561 pacientů léčených dávkou až 81 Gy s použitím techniky IMRT (8). Pacienti byli rozděleni dle rizika rekurence do skupiny nízkého, středního a vysokého rizika rekurence. Osmileté přežití bez biochemické recidivy bylo pro jednotlivé skupiny 85%, 76% a 72%. V poslední době se skupina MSKCC zabývá hodnocením protokolu s eskalací dávky až na 86,4 Gy, 81, 75,6, 70,2 a méně u různě rizikových skupin (20). Žádné rozdíly nebyly pozorovány u pacientů s nízkým rizikem při použití různých dávek, avšak významné zlepšení bylo pozorováno s vyššími dávkami záření u pacientů se středním a vysokým rizikem rekurence. Zejména ve skupině středně rizikových pacientů bylo zjištěno, že dávka záření je důležitým ukazatelem zlepšení PSA přežití bez relapsu, zejména pokud jde o dávky > 75,6 Gy. U vysoce rizikových pacientů jsou také vyšší dávky spojeny s lepšími výsledky. Vliv na zlepšení přežití bez vzdálených metastáz byl nejvíce patrný u pacientů, kteří obdrželi 81 Gy a vyšší dávku ve srovnání s těmi, kteří dostali 75,6 Gy (p = 0,035).
TERAPIE PROTONY
Techniky výše popsané využívají k léčbě fotonového neboli brzdného záření vznikajícího zabrzděním urychlených elektronů. Rozvoj urychlovačů částic vedl ke klinickému používání i jiného druhu záření a mezi prvními částicemi takto využívanými byly protony. Protonový svazek se odlišuje od fotonového ve fyzikálním chování: 1. velmi nízké množství dávky vstupující do těla, 2. maximální dávka, tzv. Braggův peak, může být definována v určité hloubce v závislosti na energii protonů, 3. za tímto vrcholem je dávka minimální. Tyto vlastnosti nabízejí možné výhody oproti standardním fotonům zejména ve snížení dávky ve zdravé tkáni. Náklady této léčby jsou však nesmírně vysoké. Retrospektivní studie z Yale Univerzity z roku 2013 neprokázala rozdíl v časné toxicitě léčby (po 12 měsících) mezi protony a technikou IMRT (21). V současné době jedinými typy nádorů, u nichž existují důkazy o nadřazenosti protonů nad fotony na základě klinických výsledků, jsou chordomy a oční nádory (22).
Navzdory tomu, že protony jsou v klinické praxi používány již polovinu století, existují pouze omezená data týkající se léčby rakoviny prostaty. Lékaři z Loma Linda Medical Centra, kteří začali léčbu rakoviny prostaty pomocí protonové terapie již v roce 1991, publikovali své první zkušenosti s 1255 muži (23). Ve studii bylo 731 pacientů léčeno dávkou 45 Gy pomocí fotonů a dále 30 Gy (GYE) protony, 524 pacientů bylo léčeno pouze protony v dávce 74 GYE. Přestože rizikové faktory těchto pacientů byly různorodé, většina pacientů před léčbou měla PSA < 10 ng/ml a Gleasonovo skóre ≤ 7. Osmileté BFS pro celou skupinu bylo 73%. Zietman et al. (5) publikoval výsledky randomizované studie, v níž 393 pacientů bylo randomizováno do dvou ramen s dávkou protonového svazku 19,8 nebo 28,8 GYE poté, co obdrželi 50,4 Gy fotonového ozáření. BFS po 5 letech bylo 61,4 % pro konvenční dávky léčby a 80,4 % u vysokých dávek (p = 0,001), což představovalo 49% snížení rizika selhání. Výhoda vysokých dávek byla pozorována ve všech skupinách. V současnosti však neexistuje žádné randomizované porovnání dat protonové terapie a techniky IMRT a zůstávají nezodpovězeny otázky, zda teoretické výhody mají skutečný klinický přínos a zda se vyváží náklady spojené s protonovou terapií (24). V březnu 2013 Americká společnost pro radiační onkologii (ASTRO) vydala prohlášení, ve kterém vyzývá ke sběru dat a sledování pacientů s karcinomem prostaty léčených protony (25).
OBRAZEM ŘÍZENÁ RADIOTERAPIE (IGRT)
Používání konformní techniky záření s menšími a více tvarovanými ozařovacími poli vyžaduje lepší pochopení změn polohy prostaty v průběhu vlastní léčby. Při použití techniky IMRT se kolem prostaty používá bezpečnostní lem od 0,4 cm až do 1,0 cm. Nicméně prostata se může pohybovat až v rozmezí 1–2 cm. Tento pohyb je většinou způsoben různou náplní konečníku (obr. 3), ale může také přispět různá náplň močového měchýře. Skutečnost, že pohyb prostaty může vést k potenciální geografické chybě, a tím i k horším klinickým výsledkům prokázal de Crevoisier et al. (26). Ve své práci zjistil, že pacienti, kteří měli roztažené rektum na CT při plánování léčby, měli o více než 30 % horší poléčebné výsledky PSA. Proto denní nastavení pacienta pouze dle značek na kůži a dle kostních struktur není přesné (27, 28). Řešením je použití dalších zobrazovacích metod k určení polohy prostaty v den aplikace záření. Jednou z prvních metod byl břišní ultrazvuk. Nicméně, tato technika je značně subjektivní a ultrazvukové sondy mohou odsunout prostatu, čímž zpochybňují jeho klinickou přesnost (29, 30). Velmi efektní se jeví markery vložené přímo do prostaty. K tomuto účelu se nejčastěji využívají pod kontrolou ultrazvuku intersticiálně uložená tři zlatá zrna (obr. 4). Ta jsou dobře viditelná na RTG i CT a mohou určit změnu polohy prostaty ve všech třech směrech s následnou úpravou polohy izocentra. Součástí lineárních urychlovačů jsou programy, které tyto odchylky vyhodnotí a upraví polohu pacienta. Tím se sníží možnost nepřesného ozáření (31).
Obr. 3. Vliv náplně rekta na uložení prostaty Fig. 3. The influence of the rectal fullness on the position of the prostate 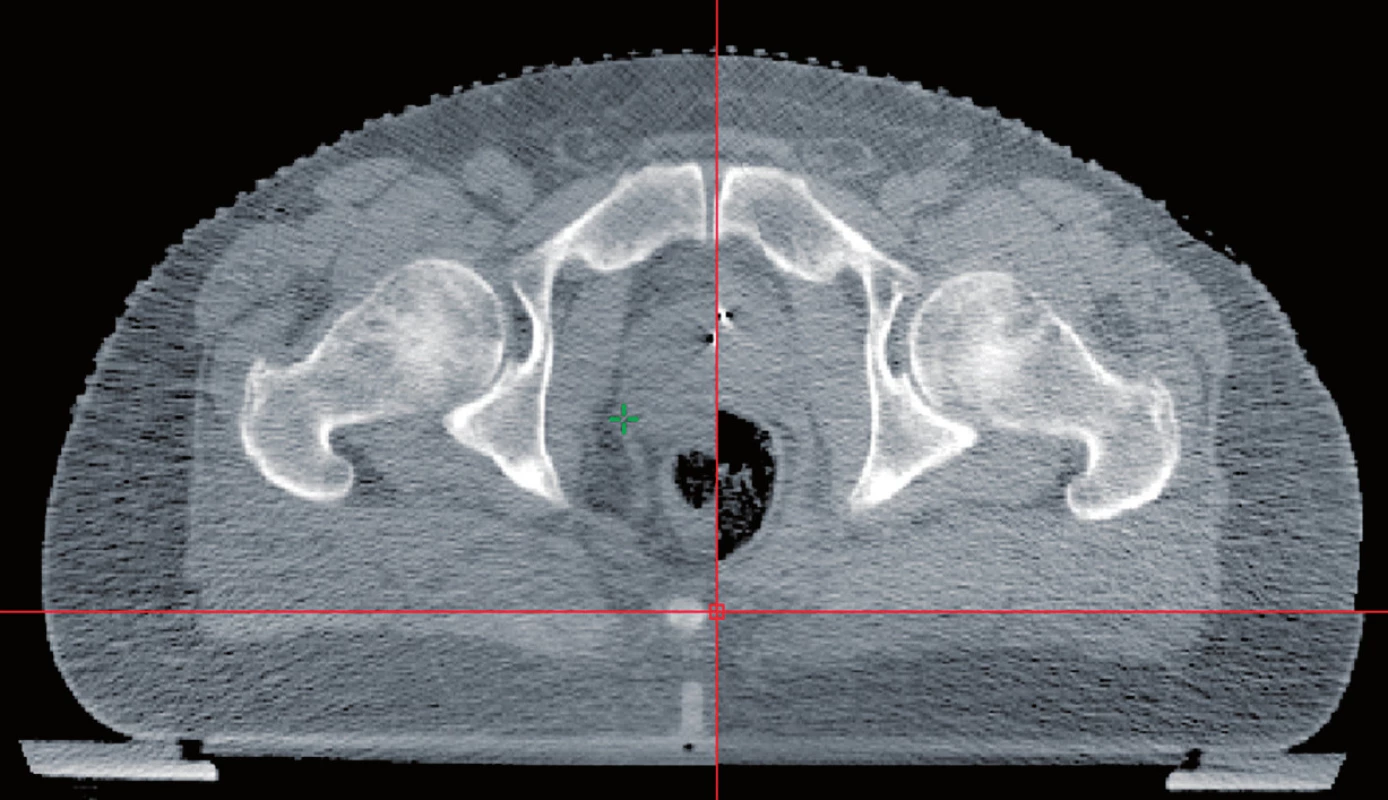
Obr. 4. Zavedená lokalizační zlatá zrna v prostatě Fig. 4. Localization of gold marker in the prostate 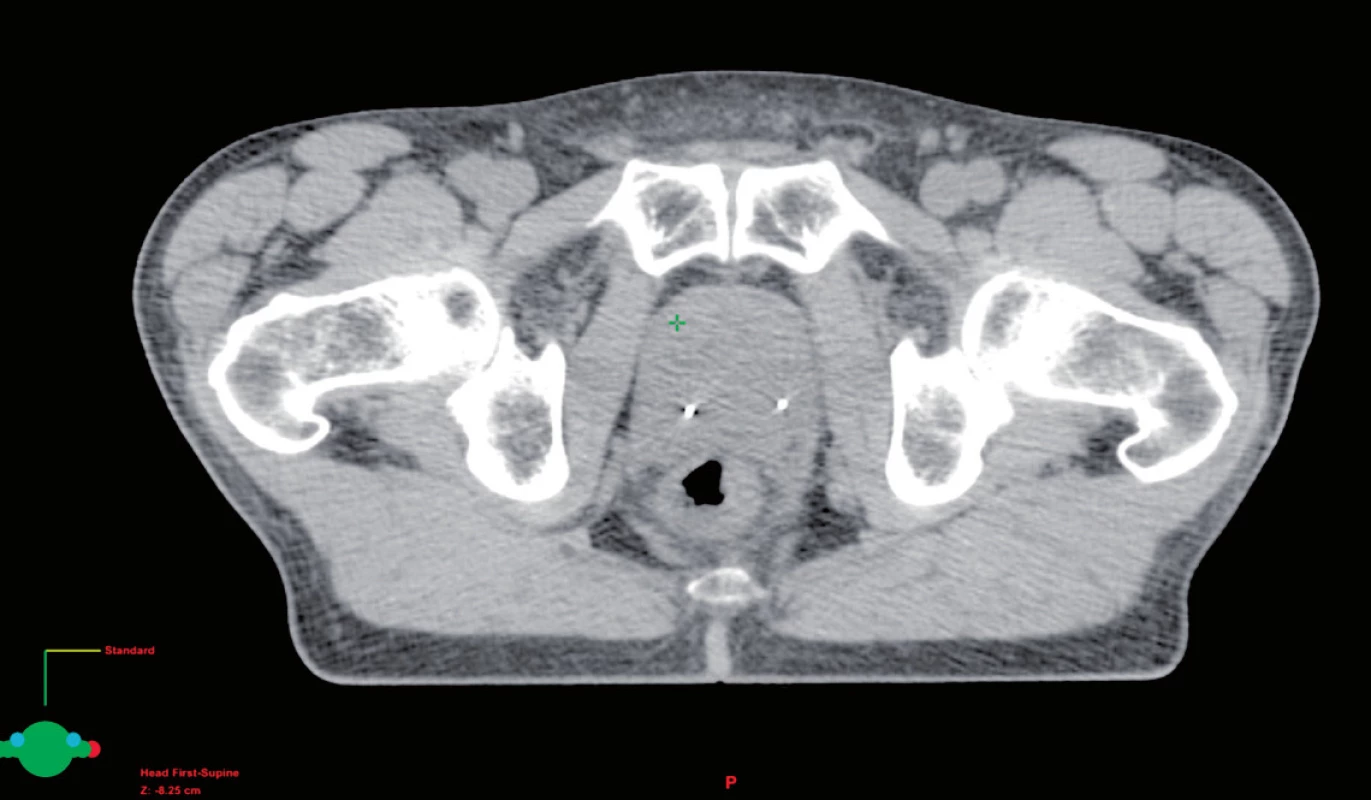
Pro další zvýšení přesnosti je integrální součástí lineárního urychlovače CT, které se provede před vlastním ozářením a srovná se obraz s obrazem získaným při plánování léčby zářením, jedná se o systém tzv. cone beam CT (CBCT) (obr. 5) (31). Odchylky však mohou vzniknout i v průběhu jedné frakce záření, tzv. intrafrakční pohyby. Systém, který sleduje nepřetržitě polohu prostaty (Calypso Medical Technologies, Inc, Seattle, WA), umožňuje např. i zastavení ozáření, pokud se prostata pohybuje mimo nastavené vzdálenosti po předem stanovenou dobu. Kupelian et al. (32) jako první publikoval zprávu o klinickém využití tohoto systému v rámci multiinstitucionální studie. V souboru 41 hodnocených pacientů zjistil, že pohyb prostaty byl nepředvídatelný.
Obr. 5. Lineární urychlovač se zabudovaným systémem cone beam CT Fig. 5. Linear accelerator with cone beam CT 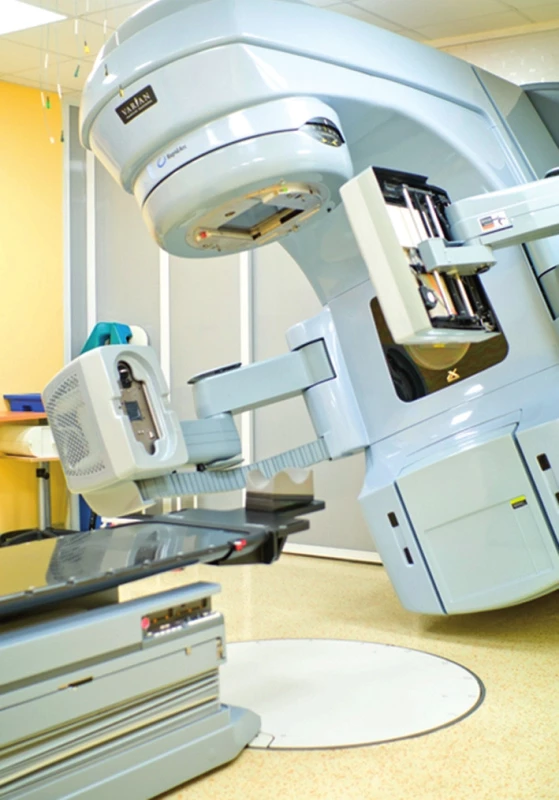
Zelefsky publikoval studii, ve které u pacientů léčených technikou s využitím IGRT ve srovnání s technikou IMRT prokázal snížení pozdní genitourinární toxicity stupně dvě a vyšší, ale také zlepšení biochemické kontroly onemocnění (33).
INTERSTICIÁLNÍ BRACHYTERAPIE (BRT)
Intersticiální brachyterapie prostaty představuje vynikající konformní radioterapii umožňující použití vysokých dávek záření. Ve srovnání se zevní radioterapií její hlavní výhodou je aplikace zdrojů záření přímo do prostaty a prudký pokles dávky do okolí, což umožňuje lepší šetření okolních zdravých tkání a téměř žádný vliv pohybů prostaty. Brachyterapie (BRT) zaznamenala také prudký rozvoj, což umožnila zejména transrektální sonografie a implantace jehel či zrn pod její kontrolou (TRUS – „guided“ techniky) (obr. 6), nové plánovací systémy i nové radioizotopy. S pomocí konformní brachyterapie je možné dosáhnout zvýšení dávky v cílovém objemu až přes hranici 100 Gy.
Obr. 6. Intersticiální brachyterapie pod kontrolou transrektální sonografie Fig. 6. Interstitial brachytherapy under the control of transrectal ultrasonography 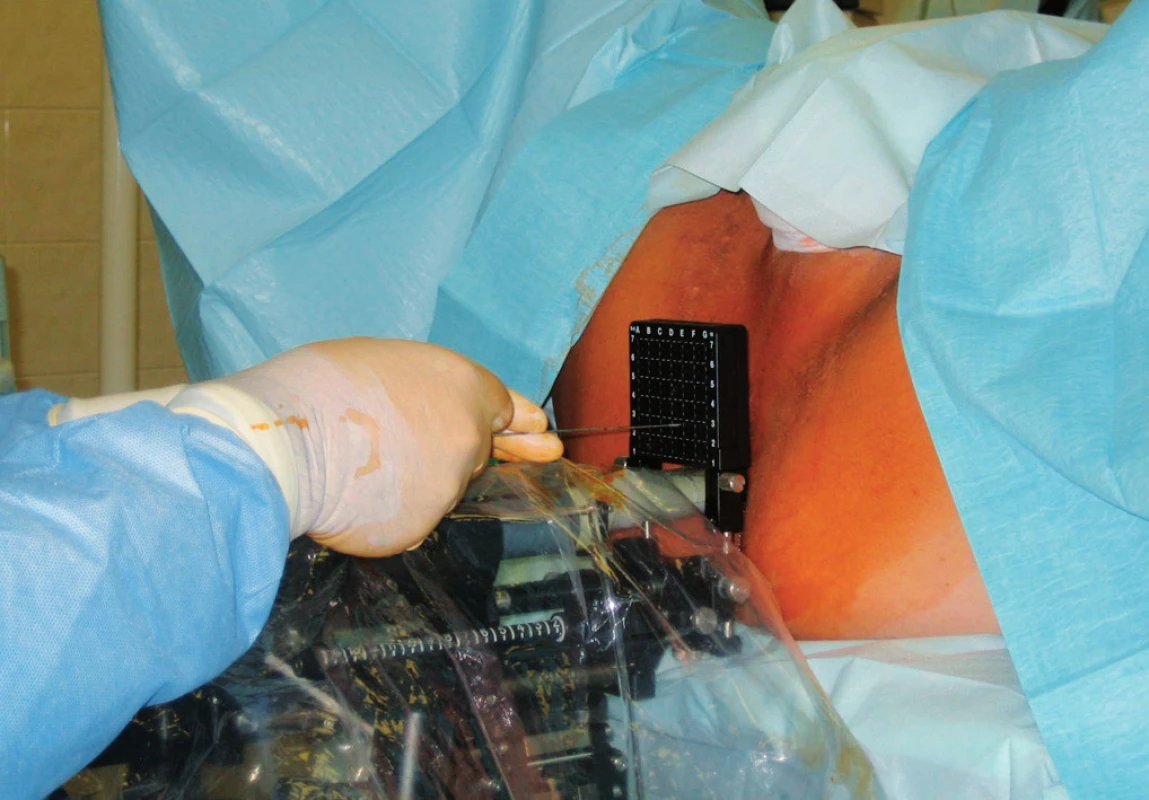
Existují dva typy brachyterapie dle aktivity zdroje: trvalá (permanentní) BRT s nízkým dávkovým příkonem (LDR) a dočasná BRT s vysokým dávkovým příkonem (HDR). Oba tyto typy mohou být použity jako monoterapie nebo v kombinaci se zevní RT. Americká brachyterapeutická společnost (ABS) v současné době doporučuje BRT monoterapii u pacientů s tumorem stadia T1–T2b onemocnění, PSA < 10 ng/ml a Gleasonovo skóre ≤ 6 (34). U pacientů s tumorem T2c a vyšším nebo Gleasonova skóre ≥ 7 nebo PSA > 10 ng/ml je doporučena kombinace se zevní RT. Nicméně, rostoucí množství studií uvádí, že zevní RT lze vynechat i u některých pacientů s vyšším rizikem při provedení vysoce kvalitní implantace (35). K relativním kontraindikacím BRT patří skóre mezinárodní prostatických symptomů (IPSS) > 15, objem prostaty < 20 ml nebo > 50 ml, invaze do semenných váčků, anatomicky nepříznivý oblouk stydkých kostí (34). Velký objem prostaty může být technickým problémem, proto je někdy vhodné podání hormonální terapie před BRT. Ale i u těchto pacientů lze s použitím vhodné polohy dosáhnout dobrých parametrů kvality implantátu (36). Pacienti s příznaky močové obstrukce před BRT mohou mít vyšší riziko retence moči, avšak ani tato závislost není jasná. Terk et al. (37) uvádí, že předimplantační IPSS předpovídalo postimplantační retenci moči. Naopak Merrick et al. (38) nenalezl žádný vztah mezi vstupním IPSS a retencí moči s použitím preventivního a dlouhodobé podání alfa-blokátorů. I v prospektivní studii Landis et al. (39) našel pouze malou korelaci mezi IPSS a akutní retencí nebo dlouhodobým ovlivnění močových funkcí.
PERMANENTNÍ LDR BRACHYTERAPIE (PBRT)
Permanentní brachyterapie je relativně jednoduchá procedura s velmi krátkou dobou hospitalizace, s brzkým zotavením a s rychlým návratem k běžným aktivitám. U vhodně indikovaných pacientů má dlouhodobé excelentní výsledky a nízkou morbiditu. Je možné ji použít i jako salvage terapii po selhání zevní radioterapie. Neustále se zdokonalují techniky provedení a její obliba rychle roste.
V současnosti se používá permanentní implantace s paladiovými (Pd103) nebo jodovými zrny (I125). Zavedená jodová zrna v prostatě ukazuje obrázek 7. U pacientů s nízkým rizikem rekurence má PBRT velmi dobré výsledky s dlouhodobým vysokým přežitím bez biochemické recidivy onemocnění (40–43). Velmi důležitým faktorem je zde lékař se zkušeností a dovednostmi BRT. Kvalita implantátu, čili technické dovednosti lékaře, významně ovlivňují výsledky léčby (44). Neméně důležitá je i křivka učení (65). Důvodem pro kombinaci PBRT u středního a vysokého rizika rekurence onemocnění je lepší pokrytí periprostatické tkáně. Critz et al. (45) publikoval retrospektivní výsledky tohoto postupu u 689 pacientů se středním a vysokým rizikem. DFS po 7 letech bylo 88%. V další studie Sylvester et al. (46), 15leté přežití bez biochemické recidivy (BFS) bylo 80,3% u středně rizikových pacientů a 67,8% u vysoce rizikových pacientů. Podobná data lze nalézt i v jiných multiinstitucionálních studiích (47). Na druhou stranu použití samostatné PBRT i u středního rizika má opodstatnění v patologických studiích. Extraprostatické šíření nádoru je téměř vždy 5 mm nebo méně, což je v oblasti pokrytí implantátu monoterapií. Publikované studie používající tento přístup mají též velmi dobré výsledky (35,48).
Obr. 7. Permanentní brachyterapie, jodová zrna v prostatě Fig. 7. Permanent brachytherapy, iodine seeds in the prostate 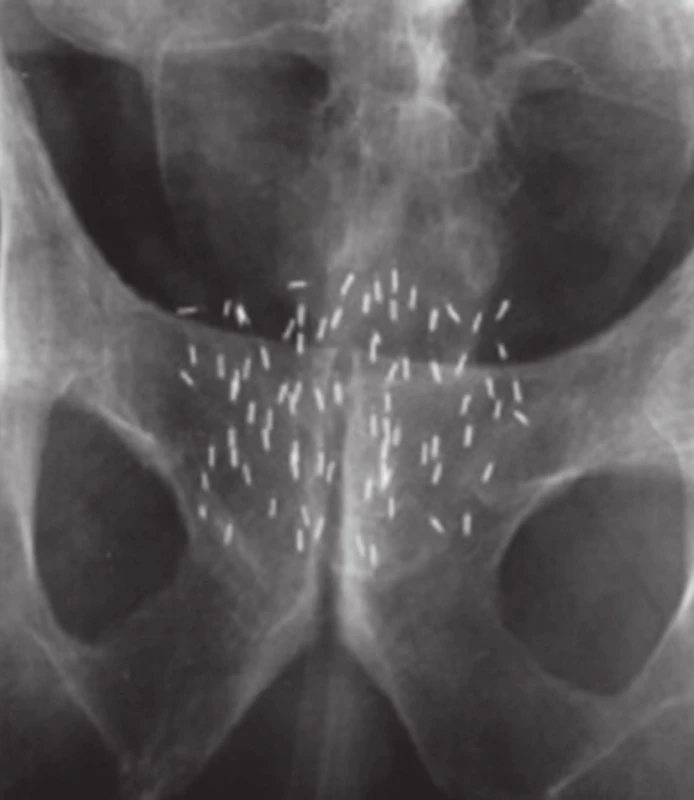
DOČASNÁ HDR BRACHYTERAPIE
HDR BRT je o něco mladší než PBRT, poprvé byla představena v roce 1986 na Univerzitě Kiel v Německu. Na rozdíl od PBRT, kdy jsou radio-aktivní zrna trvale implantována do prostaty, HDR BRT používá dočasné transperineální umístění katétrů do prostaty. Radioaktivním zdrojem je iridium-192, které se do jednotlivých katetrů dostává automaticky na dobu několika málo minut. Tato tzv. stepping source technologie dokáže objemovou optimalizaci díky umístění zdroje a modifikací časů dle 3D zobrazení a dle individuálního předpisu dávky. Toto napomáhá zabránit vzniku hot a cold spotů, které se mohou objevit u permanentní implantace, pokud jsou zrna implantovaná příliš blízko nebo příliš daleko od sebe. HDR BRT má několik potenciálních výhod oproti PBRT. HDR katétry mohou být umístěny mimo kapsulu nebo do semenných váčků, a tím je možné ozářit i periprostatickou oblast. Je nejprecisnějším způsobem dodání dávky do prostaty: je více konformní než zrna, protony, IMRT či 3D CRT (obr. 8). Permanentní implantace je ireverzibilní. Pokud je již zrno umístěno, nemůžeme s ním pohnout, přemístit ho, odstranit či aplikovat jinam. HDR katétry mohou být přemístěny, přidány, odstraněny a znovu implantovány. Implantace dokonce může být odstraněna a ozáření neprovedeno. Permanentní zrna musejí být objednána předem a v případě neprovedení BRT to způsobí ztrátu několik desítek tisíc. U PBRT existují restrikce s ohledem na těhotné ženy a děti, které by neměly být v těsné blízkosti cca 2 měsíce po implantaci, u HDR BRT existuje plná radio-protekce.
Obr. 8. Konformní HDR BRT (jehly označeny zeleně) Fig. 8. Conformal HDR BRT (needle marked in green) 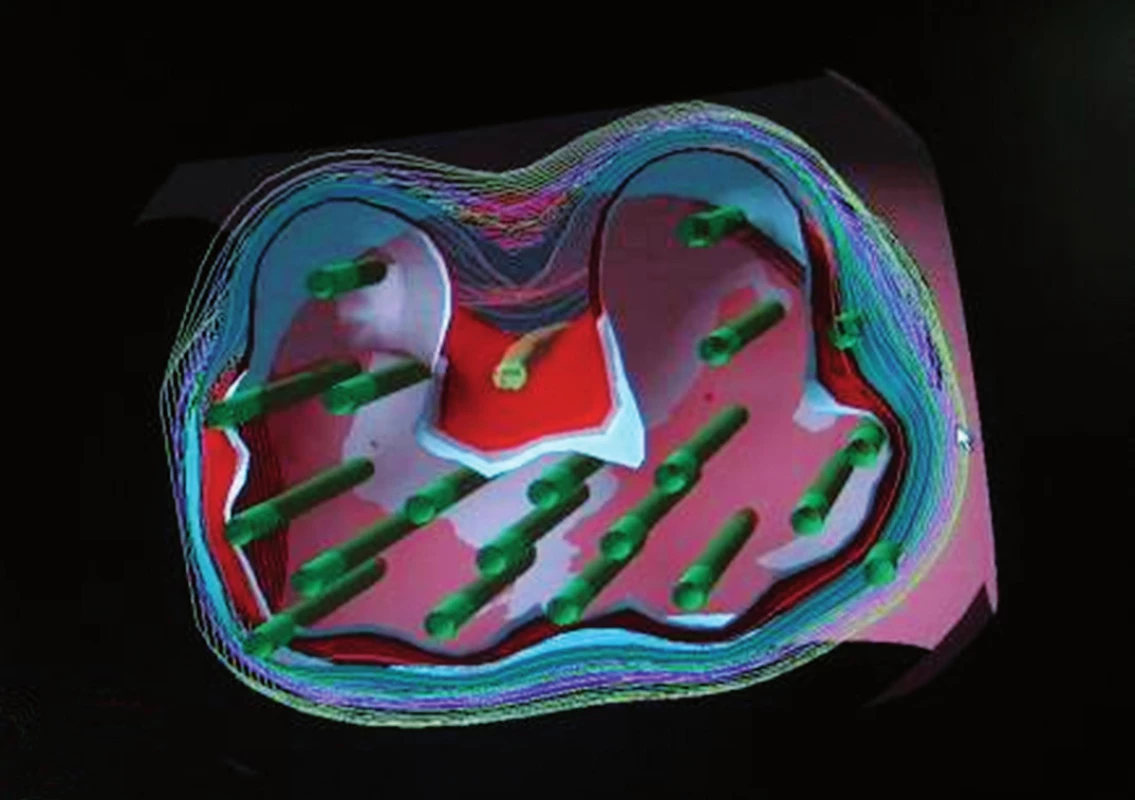
Stejně jako u PBRT může být HDR BRT použita jako monoterapie u pacientů s nízkým rizikem. Demanes et al. (49) hodnotil 298 pacientů léčených HDR BRT a zjistil, že pětileté BFS bylo 94%. Podobně tříleté výsledky z Univerzity Utah u 209 pacientů s nízkým rizikem ukázaly BFS 99% (50). Mark et al. (51) publikoval osmileté výsledky u 278 pacientů, kde BFS bylo 88,5%.
U pacientů se středním a vysokým rizikem onemocnění je HDR BRT obvykle kombinována se zevní RT a je prováděna déle a častěji než samostatná HDR BRT. Retrospektivní analýza tří studií ze Seattlu, William Beaumont Hospital a Kielu zahrnovala 188 středně rizikových pacientů a 359 vysoce rizikových pacientů (52). Pětileté BFS a CSS pro středně rizikové pacienty bylo 88% a 99%. Podobně u pacientů s vysokým rizikem, BFS a CSS bylo 69% a 95%. Další studie z Kalifornie uvádí osmileté BFS pro 146 středně a vysoce rizikových pacientů 87% a 69% (53). Bachand et al. (54) nedávno publikoval výsledky u 153 pacientů. Pětileté BFS činilo 96 %. 94 z těchto pacientů souhlasilo s rebiopsií po 24 měsících a negativní výsledek mělo 92 % z nich. Bohužel, pacienti nebyli rozdělení podle rizikových skupin, a tak není jasné, zda tyto údaje nejsou ovlivněny nepřiměřeným zastoupením středně rizikových pacientů. Výzkumníci z Univerzity v Kielu uvádí osmileté BFS ve výši 73 % a DFS 82,6 % (55). Podobně, Swanson et al. (56) hodnotil 1697 pacientů ze tří institucí a desetileté BFS a DFS bylo 67 % a 80 %.
STEREOTAKTICKÁ RADIOTERAPIE
Stereotaktická radioterapie (SBRT) je definována jako přesné dodání vysoké dávky záření v jedné až pěti frakcích. Poprvé byla použita u mozkových metastáz. Timmerman et al. (57) ukázal, že SBRT by mohla být bezpečně používána i mimo mozek.
Představa o léčbě rakoviny prostaty vyššími jednotlivými dávkami v několika málo frakcích není nic nového. Nádory prostaty se považují za nádory s nízkou frakcí proliferujících buněk, kde poměr α/β je nižší než u epiteliálních nádorů. Poměr α/β popisuje senzitivitu tkání k frakcionačním režimům. Z radiobiologického hlediska je proto u karcinomu prostaty vyšší dávka na frakci optimální.
Kupelian et al. (58) aplikoval 70 Gy ve frakcích po 2,5 Gy pomocí IMRT techniky s přijatelnou toxicitou. Lloyd-Davies et al. (59) již publikoval 22leté výsledky hypofrakcionačního režimu 6 × 6 Gy v 6 týdnech.
Bohužel neexistuje zatím dostatek studií hodnotících SBRT u rakoviny prostaty. Madsen et al. (60) použil u 40 pacientů dávku 33,5 Gy, 6,7 Gy na frakci, což odpovídá ekvivalentní dávce 78 Gy. BFS s mediánem sledování 41 měsíců bylo 90%. Pozdní GU a GIT toxicita stupně 2 a 3 byla 20% a 7,5%. King et al. (61) ze Stanford Univerzity nedávno zveřejnil své první výsledky ze studie 67 pacientů léčených pomocí CyberKnife (Accuray Inc, Sunnyvale, CA) v dávce 36,25 Gy, 7,25 Gy na frakci. Pozdní GU toxicita stupně 2 a 3 byla 5% a 3%, GIT toxicita stupně 3 se objevila u jednoho pacienta. Medián sledování je zatím 2,7 let.
Tyto počáteční výsledky jsou slibné. Ale vzhledem k tomu, že je u karcinomu prostaty potřeba osmi - až desetileté sledování, by SBRT prostaty nemělo být považováno za standard péče. Americká společnost pro radiační onkologii (ASTRO) vydala následující prohlášení týkající se jeho použití: „Není dostatek důkazů nebo nejsou dostatečně zralé k prokázání rovnocennosti ke stávajícím běžným léčebným postupům a podle našeho názoru, SBRT u pacientů s karcinomem prostaty nepředstavuje standardní péči. Je možné ji použít u pacientů v časném stadiu, s nízkým rizikem rakoviny prostaty. U rizika středního by mělo být dále testováno v kontextu vhodně uspořádané klinické studie (62).“
ZÁVĚR
V radiační onkologii za posledních 20 let došlo k významným technologickým pokrokům. Vývoj konformní radioterapie, zpočátku s 3D CRT následně IMRT, má za následek snížení toxicity zdravé tkáně a eskalaci dávky až k 86,5 Gy. V současné době není známá optimální dávka záření potřebná pro maximální kontrolu nádoru. Nicméně, několik randomizované studií prokázalo, že dávky 76 Gy nebo větší jsou lepší než předchozí standardní dávky 70 Gy. V posledních 10 letech technologie IGRT umožňují reagovat na polohové odchylky. To vede k dalšímu snížení toxicity léčby a rozšíření možností pro další eskalaci dávky. Kromě toho, brachyterapie prostaty představuje minimálně invazivní postup, který je alternativou k osmitýdennímu kurzu zevní RT. Oba typy BRT (PBRT i HDR) jsou velmi šetrné ke konečníku a v kombinaci se zevní RT mohou představovat vynikající formu terapie pro středně a vysoce rizikové pacienty. Konečně, nedávno představená SBRT pro léčbu pacientů s nízkým a středním rizikem rekurence rakoviny prostaty představuje zajímavou alternativu ke standardnímu ozařování.
Došlo: 19. 3. 2013.
Přijato: 10. 5. 2013.
Kontaktní adresa
doc. MUDr. Renata Soumarová, Ph.D., MBA
Vedoucí oddělení radioterapie a onkologie a Komplexního onkologického centra
Purkyňova 2138/16, 741 01 Nový Jičín
e-mail: renata.soumarova@radioterapie.cz
Střet zájmů: žádný.
Zdroje
1. Dearnaley DP, Sydes MR, Graham JD, et al. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8(6): 475–487.
2. Peeters ST, Heemsbergen WD, Koper PC, et al. Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 2006; 24(13): 1990–1996.
3. Pollack A, Zagars GK, Smith LG, et al. Preliminary results of a randomized radiotherapy dose-escalation study comparing 70 Gy with 78 Gy for prostate cancer. J Clin Oncol 2000; 18(23): 3904–3911.
4. Zelefsky MJ, Leibel SA, Gaudin PB, et al. Dose escalation with three-dimensional conformal radiation therapy affects the outcome in prostate cancer. Int J Radiat Oncol Biol Phys 1998; 41(3): 491–500.
5. Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 2005; 294(10): 1233–1239.
6. Chism DB, Horwitz EM, Hanlon AL, et al. Late morbidity profiles in prostate cancer patients treated to 79–84 Gy by a simple four-field coplanar beam arrangement. Int J Radiat Oncol Biol Phys 2003; 55(1): 71–77.
7. Lawton CA, Won M, Pilepich MV, et al. Long-term treatment sequelae following external beam irradiation for adenocarcinoma of the prostate: analysis of RTOG studies 7506 and 7706. Int J Radiat Oncol Biol Phys 1991; 21(4): 935–939.
8. Zelefsky MJ, Chan H, Hunt M, et al. Long-term outcome of high dose intensity modulated radiation therapy for patients with clinically localized prostate cancer. J Urol 2006; 176(4 Pt 1): 1415–1419.
9. Cahlon O, Zelefsky MJ, Shippy A, et al. Ultra-high dose (86.4 Gy) IMRT for localized prostate cancer: toxicity and biochemical outcomes. Int J Radiat Oncol Biol Phys 2008; 71(2): 330–337.
10. Peeters ST, Hoogeman MS, Heemsbergen WD, et al. Rectal bleeding, fecal incontinence, and high stool frequency after conformal radiotherapy for prostate cancer: normal tissue complication probability modeling. Int Int J Radiat Oncol Biol Phys 2006; 66(1): 11–19.
11. Heemsbergen WD, Hoogeman MS, Hart GA, et al. Gastrointestinal toxicity and its relation to dose distributions in the anorectal region of prostate cancer patients treated with radiotherapy. Int J Radiat Oncol Biol Phys 2005; 61(4): 1011–1018.
12. Valicenti R, Lu J, Pilepich M, et al. Survival advantage from higher-dose radiation therapy for clinically localized prostate cancer treated on the Radiation Therapy Oncology Group trials. J Clin Oncol 2000; 18(14): 2740–2746.
13. Kuban DA, Tucker SL, Dong L, et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(1): 67–74.
14. Ryu JK, Winter K, Michalski JM, et al. Interim report of toxicity from 3D conformal radiation therapy (3D-CRT) for prostate cancer on 3DOG/RTOG 9406, level III (79.2 Gy). Int J Radiat Oncol Biol Phys 2002; 54(4): 1036–1046.
15. Sandhu AS, Zelefsky MJ, Lee HJ, et al. Long-term urinary toxicity after 3-dimensional conformal radiotherapy for prostate cancer in patients with prior history of transurethral resection. Int J Radiat Oncol Biol Phys 2000; 48(3): 643–647.
16. Jani AB, Su A, Correa D, et al. Comparison of late gastrointestinal and genitourinary toxicity of prostate cancer patients undergoing intensity modulated versus conventional radiotherapy using localized fields. Prostate Cancer Prostatic Dis 2007; 10(1): 82–86.
17. Cahlon O, Hunt M, Zelefsky MJ. Intensity-modulated radiation therapy: supportive data for prostate cancer. Semin Radiat Oncol 2008; 18(1): 48–57.
18. Lips I, Dehnad H, Kruger AB, et al. Health-related quality of life in patients with locally advanced prostate cancer after 76 Gy intensity-modulated radiotherapy vs. 70 Gy conformal radiotherapy in a prospective and longitudinal study. Int J Radiat Oncol Biol Phys 2007; 69(3): 656–661.
19. Vora SA, Wong WW, Schild SE, et al. Analysis of biochemical control and prognostic factors in patients treated with either low-dose threedimensional conformal radiation therapy or high-dose intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2007; 68(4): 1053–1058.
20. Zelefsky MJ, Yamada Y, Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71(4): 1028–1033.
21. Yu JB, Soulos PR, Herrin J, Cramer LD, Potosky AL, Roberts KB, Gross CP. Proton versus intensity-modulated radiotherapy for prostate cancer: patterns of care and early toxicity. J Natl Cancer Inst 2013; 105(1): 25–32.
22. Macbeth FR, Williams MV. Proton therapy should be tested in randomized trials. J Clin Oncol 2008; 26(15): 2590–2591; author reply 2593–2596.
23. Slater JD, Rossi CJ Jr, Yonemoto LT, et al. Proton therapy for prostate cancer: the initial Loma Linda University experience. Int J Radiat Oncol Biol Phys 2004; 59(2): 348–352.
24. Mouw KW, Trofimov A, Zietman AL, Efstathiou JA. Clinical controversies: proton therapy for prostate cancer. Semin Radiat Oncol. 2013; 23(2): 109–114.
25. www.astro.org, 2013
26. de Crevoisier R, Tucker SL, Dong L, et al. Increased risk of biochemical and local failure in patients with distended rectum on the planning CT for prostate cancer radiotherapy. Int J Radiat Oncol Biol Phys 2005; 62 (4): 965–973.
27. Balter JM, Sandler HM, Lam K, et al. Measurement of prostate movement over the course of routine radiotherapy using implanted markers. Int J Radiat Oncol Biol Phys 1995; 31(1): 113–118.
28. van Herk M, Bruce A, Kroes AP, et al. Quantification of organ motion during conformal radiotherapy of the prostate by three dimensional image registration. Int J Radiat Oncol Biol Phys. 1995; 33(5): 1311–1320.
29. Langen KM, Pouliot J, Anezinos C, et al. Evaluation of ultrasound-based prostate localization for image-guided radiotherapy. Int J Radiat Oncol Biol Phys 2003; 57(3): 635–644.
30. Lattanzi J, McNeeley S, Pinover W, et al. A comparison of daily CT localization to a daily ultrasound-based system in prostate cancer. Int J Radiat Oncol Biol Phys 1999; 43(4): 719–725.
31. Owen R, Kron T, Foroudi F, et al. Comparison of CT on rails with electronic portal imaging for positioning of prostate cancer patients with implanted fiducial markers. Int J Radiat Oncol Biol Phys 2009; 74(3): 906–912.
32. Kupelian P, Willoughby T, Mahadevan A, et al. Multi-institutional clinical experience with the Calypso System in localization and continuous, realtime monitoring of the prostate gland during external radiotherapy. Int J Radiat Oncol Biol Phys 2007; 67(4): 1088–1098.
33. Zelefsky MJ, Kollmeier M, Cox B, et al. Improved clinical outcomes with high-dose image guided radiotherapy compared with non-IGRT for the treatment of clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2012; 84(1): 125–129.
34. Nag S, Beyer D, Friedland J, et al. American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer. Int J Radiat Oncol Biol Phys 1999; 44(4): 789–799.
35. Zelefsky MJ, Hollister T, Raben A, et al. Five-year biochemical outcome and toxicity with transperineal CT-planned permanent I-125 prostate implantation for patients with localized prostate cancer. Int J Radiat Oncol Biol Phys 2000; 47(5): 1261–1266.
36. Stone NN, Stock RG. Prostate brachytherapy in patients with prostate volumes ≥ 50 cm3: dosimetic analysis of implant quality. Int J Radiat Oncol Biol Phys 2000; 46(5): 1199–1204.
37. Terk MD, Stock RG, Stone NN. Identification of patients at increased risk for prolonged urinary retention following radioactive seed implantation of the prostate. J Urol 1998; 160(4): 1379–1382.
38. Merrick GS, Butler WM, Lief JH, et al. Temporal resolution of urinary morbidity following prostate brachytherapy. Int J Radiat Oncol Biol Phys 2000; 47(1): 121–128.
39. Landis D, Wallner K, Locke J, et al. Late urinary function after prostate brachytherapy. Brachytherapy 2002; 1(1): 21–26.
40. Stock RG, Cesaretti JA, Stone NN. Disease-specific survival following the brachytherapy management of prostate cancer. Int J Radiat Oncol Biol Phys 2006; 64(3): 810–816.
41. Khaksar SJ, Laing RW, Henderson A, et al. Biochemical (prostatespecific antigen) relapse-free survival and toxicity after 125I low-dose-rate prostate brachytherapy. BJU Int 2006; 98(6): 1210–1215.
42. Potters L, Morgenstern C, Calugaru E, et al. 12-year outcomes following permanent prostate brachytherapy in patients with clinically localized prostate cancer. J Urol 2005; 173(5): 1562–1566.
43. Lawton CA, DeSilvio M, Lee WR, et al. Results of a phase II trial of transrectal ultrasound-guided permanent radioactive implantation of the prostate for definitive management of localized adenocarcinoma of the prostate (radiation therapy oncology group 98-05). Int J Radiat Oncol Biol Phys 2007; 67(1): 39–47.
44. Zelefsky MJ, Kuban DA, Levy LB, et al. Multi-institutional analysis of long-term outcome for stages T1-T2 prostate cancer treated with permanent seed implantation. Int J Radiat Oncol Biol Phys 2007; 67(2): 327–333.
45. Critz FA, Williams WH, Levinson AK, et al. Simultaneous irradiation for prostate cancer: intermediate results with modern techniques. J Urol 2000; 164(3 Pt 1): 738–741; discussion 741–743.
46. Sylvester JE, Grimm PD, Blasko JC, et al. 15-Year biochemical relapse free survival in clinical Stage T1-T3 prostate cancer following combined external beam radiotherapy and brachytherapy; Seattle experience. Int J Radiat Oncol Biol Phys 2007; 67(1): 57–64.
47. Stone NN, Potters L, Davis BJ, et al. Multicenter analysis of effect of high biologic effective dose on biochemical failure and survival outcomes in patients with Gleason score 7–10 prostate cancer treated with permanent prostate brachytherapy. Int J Radiat Oncol Biol Phys 2009; 73(2): 341–346.
48. Taira AV, Merrick GS, Galbreath RW, et al. Natural history of clinically staged low - and intermediate-risk prostate cancer treated with monotherapeutic permanent interstitial brachytherapy. Int J Radiat Oncol Biol Phys 2010; 76(2): 349–354.
49. Demanes DJ, Gilhezan M, Schour L, et al. High dose rate brachytherapy (HDR-BT) as monotherapy for favorable prostate cancer: excellent 5-year control rates and low toxicity. Int J Radiat Oncol Biol Phys 2007; 69(3 Suppl 1): S83.
50. Rogers L, Hayes, J, Childs L, et al. High Dose Rate Brachytherapy as Monotherapy for Clinically Localized Prostate Cancer. Int J Radiat Oncol Biol Phys 2006; 66(3 Suppl 1): S377–S378.
51. Mark RJ, Anderson PJ, Akins M, et al. Interstitial high-dose rate (HDR) brachytherapy as monotherapy for stage T1 and T2 prostate cancer: 8-year results in 278 patients. Int J Radiat Oncol Biol Phys 2009; 75(3 suppl 1): S156.
52. Galalae RM, Martinez A, Mate T, et al. Long-term outcome by risk factors using conformal high-dose-rate brachytherapy (HDR-BT) boost with or without neoadjuvant androgen suppression for localized prostate cancer. Int J Radiat Oncol Biol Phys 2004; 58(4): 1048–1055.
53. Demanes DJ, Rodriguez RR, Schour L, et al. High-dose-rate intensity-modulated brachytherapy with external beam radiotherapy for prostate cancer: California endocurietherapy‘s 10-year results. Int J Radiat Oncol Biol Phys 2005; 61(5): 1306–1316.
54. Bachand F, Martin AG, Beaulieu L, et al. An eight-year experience of HDR brachytherapy boost for localized prostate cancer: biopsy and PSA outcome. Int J Radiat Oncol Biol Phys 2009; 73(3): 679–684.
55. Galalae RM, Kovács G, Schultze J, et al. Long-term outcome after elective irradiation of the pelvic lymphatics and local dose escalation using high-dose-rate brachytherapy for locally advanced prostate cancer. Int J Radiat Oncol Biol Phys 2002; 52(1): 81–90.
56. Swanson TA, Martinez AA, Kestin LL, et al. Improved 10-year outcomes for prostate cancer patients with Gleason 8–10 treated with intensity modulated high dose rate brachytherapy boost in the PSA era. Int J Radiat Oncol Biol Phys 2007; 69(3 suppl 1): S84–S85.
57. Timmerman R, Papiez L, Suntharalingam M. Extracranial stereotactic radiation delivery: expansion of technology beyond the brain. Technol Cancer Res Treat 2003; 2(2): 153–160.
58. Kupelian PA, Willoughby TR, Reddy CA, et al. Hypofractionated intensity-modulated radiotherapy (70 Gy at 2.5 Gy per fraction) for localized prostate cancer: Cleveland Clinic experience. Int J Radiat Oncol Biol Phys 2007; 68(5): 1424–1430.
59. Lloyd-Davies RW, Collins CD, Swan AV. Carcinoma of prostate treated by radical external beam radiotherapy using hypofractionation. Twenty-two years‘ experience (1962–1984). Urology. 1990; 36(2): 107–111.
60. Madsen BL, Hsi RA, Pham HT, et al. Stereotactic hypofractionated accurate radiotherapy of the prostate (SHARP), 33.5 Gy in five fractions for localized disease: first clinical trial results. Int J Radiat Oncol Biol Phys 2007; 67(4): 1099–1105.
61. King CR, Brooks JD, Gill H, et al. Long-term outcomes from a prospective trial of stereotactic body radiotherapy for low-risk prostate cancer. Int J Radiat Oncol Biol Phys 2012; 82(2): 877–882.
62. www.astro.org, 2011
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2013 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Možnosti léčby kastračně refrakterního karcinomu prostaty, co nového k roku 2013
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Eskalace dávky na intraprostatickou lézi – výsledky akutní a časné chronické toxicity
- Využití dvoufázové 3 T MRI angiografie v plánování operační léčby u nádorů ledvin
- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
- Exprese genů BCL-2 a BAX-1 ve tkáni Ta, T1uroteliálních karcinomů močového měchýře a jejich prognostický význam
- 1. ostravské urologicko-neurologické sympozium
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




