-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Primární Sjögrenův syndrom
Primary Sjögren’s Syndrome
Background:
Primary Sjögren‘s syndrome is a progressive autoimmune disease that affects predominantly middle-aged women, typically in the fourth to sixth decenium. It is believed the third most common autoimmune disease after rheumatoid arthritis and systemic lupus erythematosus. The cause of the disease is not fully recognized but a combination of inherited disposition, influence of sex hormones, infectious and environmental factors has been assumed. The examination algorithm requires ophthalmological, dental and immuno-rheumatological examinations as per current diagnostic criteria are from 2016. Despite of all advances in diagnostic methods, the diagnosis of the primary Sjögren‘s syndrome remains rather difficult because of the variability of clinical manifestations. The disease manifests most often by xerostomia and xerophthalmia caused by a lymphocytic infiltration of the salivary and lacrimal glands. In addition, patients often suffer from various musculoskeletal, cutaneous, internal and gynecologic disorders, as well. Clinical manifestations of Sjögren‘s syndrome in the oral cavity are usually the initial symptoms. Oral signs may lead to the suspicion for the disease.Conclusion:
The review deals with history, epidemiology, etiology and pathogenesis, immunopathology, diagnostics, clinical symptoms and therapy of the primary Sjögren‘s syndrome.Keywords:
primary Sjögren‘s syndrome – sicca syndrome – xerostomia – malignant lymphoma – immunopathology – autoantibodies – salivary glands – lacrimal glands
Autoři: M. Šembera; R. Slezák; V. Radochová
Působiště autorů: Stomatologická klinika LF UK a FN, Hradec Králové
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 118, 2018, 2, s. 39-47
Kategorie: Přehledový článek
Souhrn
Předmět sdělení:
Primární Sjögrenův syndrom je progresivní autoimunitní onemocnění, které postihuje převážně ženy ve středním věku, typicky ve čtvrtém až šestém desetiletí života. Je třetí nejčastější autoimunitní chorobou v současné populaci po revmatoidní artritidě a systémovém lupus erythematodes. Příčina onemocnění není plně objasněna, ale předpokládá se kombinace vrozené dispozice, vlivu pohlavních hormonů, infekčních faktorů a životního prostředí. Aktuální diagnostická kritéria jsou z roku 2016; vyšetřovací algoritmus vyžaduje oftalmologické, stomatologické a imuno-revmatologické vyšetření. Přes veškeré pokroky ve vyšetřovacích metodách zůstává diagnostika primárního Sjögrenova syndromu relativně obtížná pro variabilitu klinických projevů. Nejčastěji se projevuje xerostomií a xeroftalmií vznikající při lymfocytární infiltraci slinných a slzných žláz. Vedle postižení exokrinních žláz mají nemocní často různě závažné obtíže muskuloskeletální, kožní, interní, gynekologické. Orální projevy mohou vést k podezření na tuto chorobu.Závěr:
Přehledový článek se zabývá souhrnně historií, epidemiologií, etiologií a patogenezí, imunopatologií, diagnostikou, klinickými projevy a terapií primárního Sjőgrenova syndromu.Klíčová slova:
primární Sjögrenův syndrom – sicca syndrom – xerostomie – maligní lymfom – imunopatologie – autoprotilátky – slinné žlázy – slzné žlázyÚVOD
Sjögrenův syndrom je relativně dlouho známou chorobou. Názory odborné veřejnosti na její příčiny, závažnost a léčebné možnosti prošly dlouhým a zajímavým vývojem. Vznikne-li samostatně, nazývá se primární Sjögrenův syndrom (PSS). Může se však objevit i v souvislosti s jinými systémovými autoimunitními chorobami, jako je revmatoidní artritida (RA), systémový lupus erythematodes (SLE), sklerodermie či polymyozitida, a v těchto případech se označuje jako sekundární Sjögrenův syndrom (SSS). Zubním lékařům je relativně dobře známa tzv. orální komponenta této choroby plynoucí z poruchy tvorby sliny, jejíž produkce je různě výrazně omezená až zcela chybějící a projevující se klinicky řadou druhotných potíží spojených s velkými slinnými žlázami, mízními uzlinami, denticí a ústní sliznicí. Toto přehledové sdělení si klade za cíl seznámit odbornou stomatologickou veřejnost především s ostatními, nestomatologickými či extraorálními projevy této choroby, a zasadit tak problematiku PSS do širšího medicínského rámce.
Jako první zmínil v odborné medicínské literatuře sucho v ústech čili xerostomii anglický lékař W. B. Hadden, který již v roce 1888 prezentoval kazuistiku 65leté ženy s xerostomií a xeroftalmií [13]. Prvenství v popisu projevů PSS je připisováno Johannu von Mikuliczovi-Radeckému, který v roce 1892 prezentoval postižení 42letého muže se zduřením příušních a slzných žláz, spojeným s průkazem jejich kulatobuněčné infiltrace a acinární atrofie [23]. Avšak kritéria, která stanovil, často vedla k mylné diagnóze tohoto Mikuliczova syndromu. Řada chorob, zejména tuberkulóza, sarkoidóza a lymfomy, totiž splňovala podmínky uvedené v jeho definici. Přesto je Mikuliczův syndrom i dnes někdy uváděn v popisech biopsií ze slinných žláz. V roce 1926 popsal H. Gougerot postižení tří pacientů s atrofií slinných žláz spojenou s atrofií slzných žláz a žlázek sliznice úst, nosu, laryngu, vaginy, již považoval za projevy jediné choroby [12]. PSS však nese nejčastěji eponymum po švédském oftalmologovi H. Sjögrenovi. Ten totiž v roce 1933 uveřejnil svoji disertační práci, popisující soubor devatenácti žen, které vykazovaly klinické a patologické projevy jediného syndromu [33]. Až roku 1951, po rozsáhlém výzkumu a shromažďování potřebných dat, Sjögren publikoval zásadní článek, který popsal soubor 80 pacientů se suchou keratokonjunktivitidou (keratoconjunctivitis sicca). Jeho následující vědecká práce a účast na odborných konferencích vedla k mezinárodnímu zájmu o jeho práci a PSS začal být uváděn ve světové literatuře [24].
EPIDEMIOLOGIE
PSS je v současné populaci nejčastějším celkovým onemocněním autoimunitní povahy po RA a SLE. V literatuře nejsou popisovány žádné geografické rozdíly v incidenci a prevalenci PSS [22]. V roce 2014 byla provedena rozsáhlá metaanalýza epidemiologie PSS. Souhrnná prevalence PSS v celkové populaci činila 60,82 případů na 100 000 obyvatel. Odhad incidence PSS byl 6,92 na 100 000 osob za rok. Celkový poměr v postižení žen/mužů činil 10,72. PSS postihuje především dospělé jedince středního věku, ale byl popsán i u dětí [34]. Metaanalýza ukázala, že průměrný věk nemocných PSS byl 56,20 roků [27]. Kromě vyšší prevalence PSS u žen byly identifikovány jako epidemiologicky významné rizikové faktory příbuzenský vztah prvního stupně s jedincem s jinou autoimunitní chorobou a předchozí těhotenství [26].
ETIOPATOGENEZE
Etiopatogenetické mechanismy PSS nejsou plně objasněny. Je předpokládána kombinace vrozené dispozice, vlivu pohlavních hormonů, infekčních faktorů a faktorů životního prostředí. Důležitou roli v patogenezi PSS hraje pravděpodobně také porucha regulace apoptózy. Existuje vztah mezi antigenem HLA B8 a antigenem druhé třídy DR3 u PSS a antigenem DR4 při SSS [19]. Vzhledem k převažujícímu postižení slinných žláz se uvažuje také o vlivu tzv. sialotropních virů na vznik onemocnění. Virové proteiny, pohlcené a degradované imunitním systémem lidského organismu, mohou iniciovat sebedestrukční autoimunitní proces molekulárními mimikry a zvýšit pravděpodobnost rozvoje PSS. Nejvíce studovaným infekčním agens je virus Epsteina-Barrové; kromě toho se předpokládá spojitost PSS též s virem hepatitidy C (HCV) a lidským T-lymfotropním virem leukemie [3]. V případě vnímavého genetického pozadí se předpokládá, že faktory životního prostředí i hormonální faktory jsou schopny iniciovat v některých tkáních zánětlivou lymfocytární infiltraci, konkrétně CD4+ T-lymfocyty, B-lymfocyty a plazmatickými buňkami, což způsobuje glandulární dysfunkce ve slinných a slzných žlázách [20, 40]. Laboratorně je PSS spojen rovněž se zvýšenou hyperaktivitou B-lymfocytů, která je reaktivním důsledkem jejich polyklonální aktivace [21]. Tvorba autoprotilátek, cirkulujících imunokomplexů a kryoglobulinů s tím spojená se projevuje hypergamaglobulinémií [35].
IMUNOPATOLOGIE
V séru jedinců s PSS lze detekovat přítomnost různých autoprotilátek, především orgánově nespecifických antinukleárních protilátek (ANA), které jsou přítomny v séru 80 % jedinců s PSS. Další, častěji se vyskytující orgánově nespecifickou protilátkou je revmatoidní faktor (RF), který bývá detekován u 50–80 % jedinců s PSS a který může být asociován s vyšší aktivitou onemocnění. Autoprotilátkami silně spojovanými s PSS jsou protilátky proti intracelulárním ribonukleoproteinovým strukturám, označované jako anti-Ro/SS-A a anti-La/SS-B. Tyto autoprotilátky hrají významnou úlohu při diagnostice a klasifikaci choroby [5]. Přítomnost autoprotilátek anti-Ro/SS-A při PSS činí 60–80 % a 40–60 % pro anti-La/SS-B. Titr těchto autoprotilátek klinicky koreluje se sicca symptomy. Přítomnost anti-Ro/SS-A je spojena s výskytem různorodých systémových manifestací této choroby [3, 28].
Kromě výskytu různých autoprotilátek je při PSS charakteristickým laboratorním nálezem triáda cytopenie, urychlené sedimentace erytrocytů a již zmiňovaná vysoká hladina imunoglobulinů v séru. Vysoká hodnota sedimentace úzce koreluje se zvýšením hladiny imunoglobulinů, ale nebývá provázena zvýšením sérové hodnoty C-reaktivního proteinu. Hypergamaglobulinémie je asociovaná s přítomností autoprotilátek. U 10 % jedinců s PSS se vyvine monoklonální gamapatie. Dále dochází k poklesu C3 a C4 složky komplementu v séru [39].
HISTOPATOLOGIE
Histologické vyšetření tkáně malých slinných žláz je tzv. zlatým standardem objektivního průkazu fokální lymfocytární sialoadenitidy (FLS). Lymfocytární infiltrát se skládá převážně z CD4+ T-lymfocytů a CD20+ B-lymfocytů, lokalizován je v okolí vývodů a perivaskulárně. Hodnotí se semikvantitativně podle přítomnosti shluků 50 a více mononukleárů neboli fokusů na ploše 4 mm2. Analogicky mohou být postiženy i slzné žlázy. U většiny jedinců je FLS při průkazu PSS plně rozvinutá a zůstává trvale neměnná. V histologických nálezech ze slinných žláz jedinců s PSS bývají popisovány terciár-ní lymfoidní struktury podobné germinálním centrům (GC-like struktury), jež jsou přítomny ve 25 % všech biopsií slinných žláz při PSS, a jsou prediktivním markerem pro vznik maligního lymfomu [28].
DIAGNOSTIKA
Diagnostika PSS je podmíněna rozsahem příznaků, které se mohou u nemocných objevit, a podobností příznaků PSS se symptomy jiných onemocnění. V letech 1965–2002 bylo publikováno celkem jedenáct různých typů diagnostických/klasifikačních kritérií PSS, avšak ani jedno z nich nebylo schváleno současně American College of Rheumatology (ACR) a European League Against Rheumatism (EULAR). V poslední dekádě byla běžně užívána klasifikační kritéria vytvořená American-European Consensus Group (AECG) v roce 2002 (tab. 1) [38]. Ukázalo se však, že je potřeba stanovit nová kritéria, která by byla přijata jak ACR, tak i EULAR. Výsledkem dohody z roku 2016 jsou nová, mezinárodně uznávaná klasifikační kritéria, která schválily obě výše zmíněné organizace (tab. 2) [32]. Tato kritéria jsou aplikovatelná na každého jedince s alespoň jedním symptomem typu suchého oka nebo suchosti v ústech (založeno na AECG dotazníku) a při podezření na systémovou manifestaci PSS odvozenou od ESSDAI (index aktivity nemoci zahrnující postižení kloubů, kůže, plic a ledvin), při alespoň jediném pozitivním bodu.
Tab. 1. Revidovaná klasifikační kritéria pro primární Sjögrenův syndrom, rok 2002 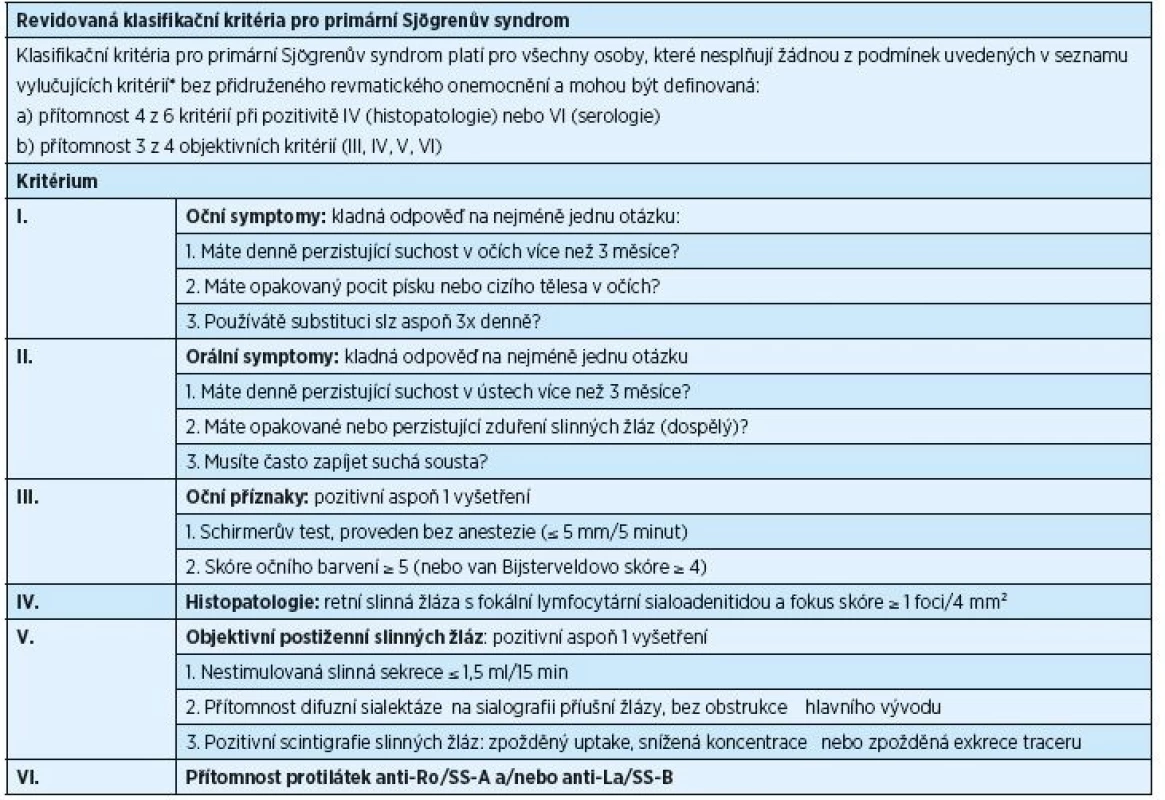
* historie radioterapie hlavy a krku, hepatitis C, AIDS, sarkoidóza, amyloidóza, graft-versus-host nemoc, IgG4-related nemoc Tab. 2. ACR/EULAR klasifikační kritéria pro primární Sjögrenův syndrom, rok 2016 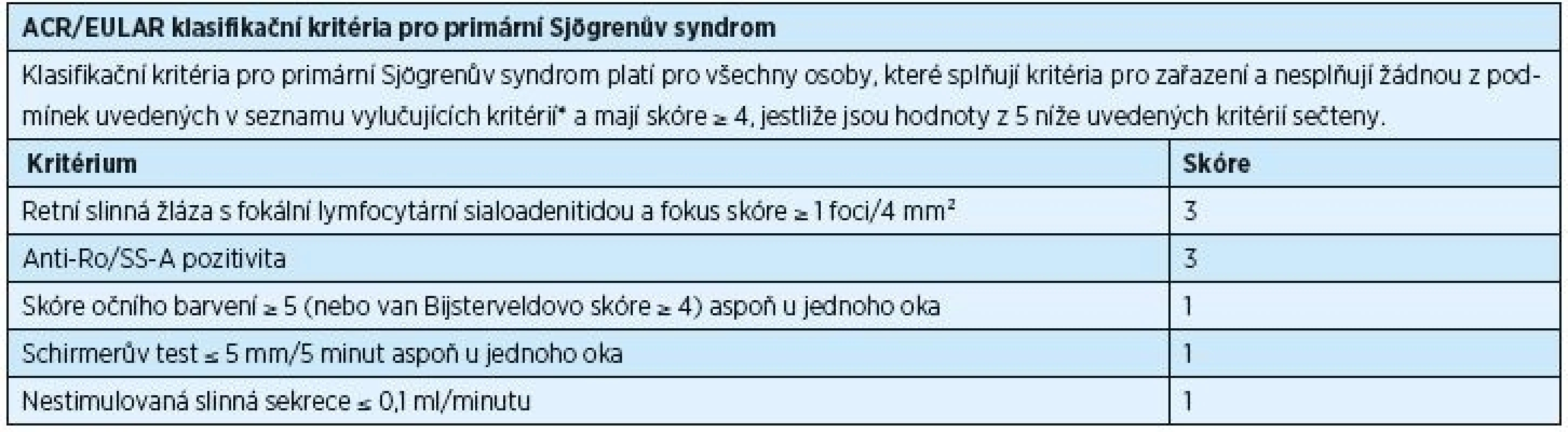
* historie radioterapie hlavy a krku, hepatitis C, AIDS, sarkoidóza, amyloidóza, graft-versus-host nemoc, IgG4-related nemoc Nová klasifikační kritéria jsou založena na pěti objektivních testech. U vyšetřovaných jedinců je potvrzen PSS, pokud celkové skóre činí ≥ 4. Toto skóre se získá součtem bodů přiřazených jednotlivým testům. Pozitivní histologické vyšetření slinné žlázy (fokální lymfocytická sialoadenitida s fokus skóre ≥ 1) a přítomnost autoprotilátek typu anti-Ro/SS-A mají hodnotu 3. Occular staining skóre ≥ 5 (nebo van Bijsterveld skóre ≥ 4) alespoň v jednou oku, Schirmerův test ≤ 5 mm/5 min alespoň v jednom oku a nestimulovaná slinná sekrece ≤ 0,1 ml/min mají shodně hodnotu 1 (tab. 2) [32].
KLINICKÝ OBRAZ PSS
Klinický obraz onemocnění je dosti variabilní. Odvíjí se od postižení jednotlivých orgánů a tkání, věku a doby trvání choroby. Má řadu tzv. dílčích projevů, tzv. komponent (orální, oční aj.).
Sicca syndrom
Sicca syndrom je nejčastějším projevem PSS. Nejrozsáhlejší studie (n = 6110) popsala projevy sucha v ústech (xerostomie) nebo očích (xeroftalmie) u 98 % jedinců, přičemž u 89 % byla nalezena současně xerostomie i xeroftalmie. Ačkoliv přetrvává stimulovaná sekrece slz a slin, jejich bazální produkce je snížená nebo zcela chybí. Suchost dýchacích cest se projevuje chraplavým hlasem, recidivující bronchitidou i pneumonií. Snížená vaginální sekrece vede k dyspareunii a poruše sexuálních funkcí. Sucho v nose, uších a na kůži způsobuje lokální iritaci, dyskomfort a svědění. Je velice důležité odlišit sicca příznaky při PSS od neautoimunitních příčin obdobných potíží a pokusit se předejít vzniku systémových komplikací PSS [28].
Xerostomie je subjektivním pocitem sucha v ústech, objektivní nedostatek slin je označován pojmem hyposialie. Lze jej verifikovat produkcí nestimulované sliny ≤ 0,1 ml/min. Xerostomie je nepatognomickým příznakem PSS, neboť může být příznakem některých dalších chorob, např. s věkem související glandulární atrofie, dehydratace, radioterapie v oblasti hlavy a krku, traumat slinných žláz, tumorů slinné žlázy, bakteriální a virové sialoadenitidy, endokrinních příčin, např. diabetes mellitus, dále GVHD, sarkoidózy, IgG4-related choroby, amyloidózy, cystické fibrózy, psychologických faktorů, Alzheimerovy choroby, léky indukovaného sicca syndromu. Proto je třeba počítat s xerostomií jako variabilní proměnnou a je nutná její anamnestická a klinická objektivizace.
Xerostomie je nejčastějším subjektivním steskem pacientů s PSS. Ti dále uvádějí dyskomfort v ústech při řeči, žvýkání, polykání, dále narušené vnímání chuti, pálení a brnění ústní sliznice. Nedostatek antikariogenní funkce slin vede k zvýšené kazivosti zubů. Zubní kazy vznikají mnohdy na atypických místech (cervikální části korunek a incizní hrany frontálních zubů). Nedostatek sliny, která chrání tvrdé zubní tkáně před demineralizací, vede k jejich erozím. Nedostatek antimikrobiálních látek obsažených ve slinách vede ke vzniku oportunních mykotických infekcí a angulární cheilitidě. Hyposialie může vést ke vstupu bakterií do vývodu velkých slinných žláz a následně ke vzniku akutní či chronické ascendentní purulentní sialoadenitidy. Nejčastěji je postižena příušní slinná žláza.
Bezzubí pacienti s PSS mají problémy s nestabilitou zubních protéz, bolestivostí a tvorbou ulcerací v oblasti protézního lože. Hyposialie je příčinou alterace sliznice jazyka. Hřbet jazyka bývá rozbrázděný (cobblestone tongue), depapilovaný, lepivý a zarudlý [1, 28, 35].
Příčinou xeroftalmie jsou obdobné patologické změny v slzných žlázách. Sucho v očích často vede k suché keratokonjunktivitidě (KCS) s chronickou iritací očí a destrukcí korneálního konjunktiválního epitelu. Pacienti s KCS mají zarudlé oči, stěžují si na svědění, pálení a pocit cizího tělesa nebo písku v očích a výraznou fotofobii [28, 35].
Některé pacientky s PSS trpí též vaginální xerózou. Ta je příčinou dyspareunie a problémů spojených s intimním životem postižených žen. Recentních zpráv na toto téma je však jen minimum.
Únavnost
Únava je subjektivní pocit vysílení nebo vyčerpání. Zatímco je příležitostná únava běžnou součástí každodenního života, konstantní únava nikoli. U jedinců s PSS je únava častou a někdy nejvíce omezující manifestací onemocnění. U autoimunitních onemocnění hrají důležitou úlohu v chronickém zánětlivém procesu prozánětlivé cytokiny, mimo jiné i interleukin-1. Up regulace interleukinu-1 při chronickém zánětu je spojována se sníženou aktivitou, ospalostí, únavou a ztrátou chuti k jídlu. Je prokázané, že jedinci s PSS mají zvýšenou hladinu interleukinu-1 oproti zdravé populaci [15].
Zduření slinných žláz
Chronické zduření a epizody zduření slinných žláz jsou při PSS velice časté. Až u 82 % jedinců s PSS se objevuje jednostranné či oboustranné zduření příušní slinné žlázy. To obvykle začíná unilaterálně, později však dojde i k postižení druhostranné slinné žlázy [28]. Při sonografickém zobrazení bývají v slinných žlázách nacházeny typické změny ve smyslu hypoechogenit [31, 41]. Rychlé zvětšení slinné žlázy může být předzvěstí vývoje maligního B-lymfomu. Jestliže zvětšení slinné žlázy doprovází její palpační bolestivost, zduření a zarudnutí ústí vývodu slinné žlázy s hnisavou exsudací a celková alterace jedince ve smyslu zvýšené teploty, nevolnosti a nechutenství, je třeba pomýšlet na ascendentní purulentní sialoadenitidu bakteriálního původu s akutním či chronickým průběhem. IgG4-related onemocnění je důležitou diferenční diagnózou u jedinců s bilaterálním zduřením slinných žláz a současným zduřením slzných žláz [28].
Maligní lymfom nehodgkinského typu
Extranodální B-lymfom z marginální zóny (MZL), též low grade B-lymfom se vznikem z tzv. mucosa associated lymphoid tissue (MALT), je extranodálním lymfomem, který vzniká z lymfoidní tkáně asociované s epitelem slinných žláz, plic, tenkého střeva, štítné žlázy a jiných tkání. Má tendenci zůstat lokalizován ve tkáni původu po dlouhou dobu, ale má i potenciál k systémovému šíření a transformaci na high-grade B-lymfom. Extranodální MZL tvoří pět procent všech maligních lymfomů nehodgkinského typu. Jedná se o nádory výrazně asociované s dospělým věkem a s vyšší prevalencí u žen. Jeden patogenetický mechanismus předpokládá, že chronický zánět vede k lokální akumulaci a proliferaci antigen-dependentních B - a T-lymfocytů a následně ke vzniku MZL [9, 14, 30, 37].
Vzhledem k tomu, že u jedinců s PSS je přítomen chronický zánět slinných žláz, mají nemocní šestnáctkrát vyšší riziko vzniku MZL slinných žláz oproti zdravé populaci [25]. Podobný trend lze zaznamenat i u jiných autoimunitních onemocnění (RA, SLE, celiakie), ale nejvyšší riziko existuje právě při PSS. Prevalence MZL u jedinců s PSS je 4–5 %. Nejčastěji jsou postiženy slinné žlázy, následně slzné žlázy. Se PSS asociovaný MZL je zpravidla lokalizovaný nádor s pomalou klinickou progresí, který se však ve 20 % případů projevuje extranodálně a v 10 % případů se může transformovat na high-grade B-lymfom. Rizikovými faktory spojenými se vznikem MZL při PSS jsou chronická zvětšení slinných žláz, lymfadenopatie a Raynaudův fenomén, přítomnost revmatoidního faktoru, pozitivita autoprotilátek anti-Ro/SS-A nebo anti-La/SS-B, monoklonální gamapatie, C3 a C4 hypokomplementémie a kryoglobulinémie [9, 14, 30, 37]. Je však nutno podotknout, že maligní lymfomy nehodkinského typu jsou v orofaciální krajině včetně dutiny ústní a slinných žláz druhými nejčastěji diagnostikovanými malignitami, jejichž výskyt není striktně vázán na diagnózu PSS [25].
Klouby
Kloubní postižení u jedinců s PSS patří mezi časté manifestace onemocnění s frekvencí výskytu u 15–90 % pacientů. Artropatie postihuje muže i ženy stejně často, ve 30 % případů předchází vzniku sicca syndromu. Nejčastější artropatií je artralgie, která postihuje rovnoměrně malé i velké klouby. Dále se při PSS setkáváme s intermitentní symetrickou neerozivní polyartropatií postihující převážně malé klouby. Rekurentní monoartritidy nebo oligoartritidy se vyskytují v 10–20 % případů. Synovitidy jsou vzácné a ve většině případů mírné. Synoviální biopsie, které byly v minulosti prováděny, prokázaly nespecifickou infiltraci synovie lymfocyty a plazmatickými buňkami. Symetrická distribuce kloubních postižení, která se běžně u jedinců s PSS popisuje, je obdobná jako při SLE. Naproti tomu trpí jedinci s PSS nedestruktivní polyartritidou, která může imitovat RA, zvláště když je v 50–80 % případů u PSS pozitivní průkaz revmatoidního faktoru. Byla prokázána asociace kloubního postižení jedinců s PSS trpících rekurentním zduřením příušních žláz, Raynaudovým fenoménem, dále také asociace s pozitivitou RF, kryoglobulinémií, pozitivitou anti-Ro/SS-A nebo anti-La/SS-B. Je tedy možné odvodit vztah mezi kloubním postižením, systémovými komplikacemi a aktivním imunologickým profilem [26].
Kůže
Závažnost kožních projevů bývá podceňována a zůstává v pozadí, přestože jsou tyto projevy relativně běžné. Kožní projevy PSS zahrnují xerózu – suchost kůže, Raynaudův fenomén, epidermální depozita IgG, kožní vaskulitidu a kožní B-lymfom [28, 29].
Nejčastějším kožním projevem je xeróza a její následek – svědění. Xeróza se vyskytuje u 23–67 % jedinců s PSS. Přestože je tento projev častý, nepříjemné pocity s ním spojené bývají zastiňovány xerostomií a xeroftalmií. Xeróza je charakterizovaná nespecifickým subjektivním svěděním a pocitem suché kůže. Kůže je hrubá a hypotrofní, není elastická, často je provázena angulární cheilitidou. Punkční biopsie postižené kůže ukazuje redukci počtu ekkrinních žláz a vývodových struktur v dermis, ostatní epiteliální struktury jsou hustě infiltrovány lymfocyty. Xeróza se nejčastěji projevuje na dolních končetinách a v axilách. Faktory spojenými s xerózou jsou starší věk, časté koupání a nízká vlhkost. Symptomy mají tendenci se horšit ve chladném počasí [29].
Raynaudův fenomén má při PSS prevalenci 10–37 %. Jeho klinické projevy jsou obvykle mírnější než při systémové skleróze, pro kterou je Raynaudův fenomén typický [28]. Častým sérologickým nálezem u jedinců s PSS je hypergamaglobulinémie, která je připisována polyklonální B-lymfocytární hyperaktivitě. Tato inflace imunoglobulinů inkorporuje do epidermis autoprotilátky za vzniku depozit. Při užití přímé imunofluorescence byla tato depozita IgG detekována v intercelulárních prostorech epidermis u dvou třetin jedinců s PSS. Nejčastěji dochází k ukládání RF, ANA, anti-Ro/SS-A a anti-La/SS-B [29].
Na podkladě perivaskulárního buněčného infiltrátu lokalizovaného kolem malých cév vzniká u jedinců s PSS kožní vaskulitida. Klinicky se projevuje různě, od benigních manifestací, jako jsou petechie, až po závažné komplikace, jako je prominující purpura, která je popisována u 11–45 % jedinců s PSS [28]. Nejzávažnějšími komplikacemi PSS jsou maligní lymfomy nehodgkinského typu, jež v kontrastu s kožními maligními lymfomy, které vznikají z T-lymfocytů, jsou B-lymfocytárního původu. Avšak v retrospektivní studii 16 NHL u jedinců s PSS se ve třech případech jednalo o kožní NHL [30].
Dýchací soustava
U více než 50 % jedinců s PSS se objevuje postižení dýchací soustavy. Klinicky významné je však jen u 10–20 % jedinců. Může však být první klinicky zřejmou manifestací choroby. Rizikovými faktory pro postižení dýchacího systému u jedinců s PSS jsou mužské pohlaví, nikotinismus, pozdní vznik choroby a dlouhodobé postižení PSS. Může být postižen celý dýchací systém s širokým spektrem projevů, zahrnující suchost dýchacích cest (xerotrachea), bronchiální suchost, obstrukci malých cest dýchacích, různé druhy intersticiálního onemocnění plic, lymfoinfiltrační a lymfoproliferativní plicní postižení. Dále může vznikat plicní hypertenze, plicní cysty a amyloidóza. Xerotrachea vzniká buď lymfoinfiltrací horních cest dýchacích CD4+ T-lymfocyty, nebo destrukcí exokrinních žláz. Vzniká lokální sicca syndrom odpovědný za snížený mukociliární clearens, který je spojen se stagnací sputa, poruchou lokální imunitní obranyschopnosti [7, 16] a má za následek vznik suchého kašle a sípání. Při těchto počátečních projevech může PSS napodobovat ne-alergické bronchiální astma.
Při postižení dolních cest dýchacích vzniká folikulární bronchiolitida, která způsobuje suchý kašel, dušnost a rekurentní bronchitidu. Rekurentní respirační infekce jsou popisovány u 10–35 % jedinců s PSS. Při postižení plicního parenchymu vzniká intersticiální pneumonie, která se obvykle klinicky projevuje kašlem a dušností. Intersticiální plicní pneumonie je asociovaná s předčasnou úmrtností a je spojována s přítomností anti-Ro/SS-A. Kromě běžných plicních komplikací mají jedinci s PSS také vyšší riziko vzniku plicního B-lymfocytárního maligního lymfomu. Plíce jsou tak druhou nejčastější extranodální lokalizací maligního lymfomu u jedinců s PSS. V 90 % případů se jedná o MZL s nízkým stupněm malignity. Prognóza plicních lymfomů asociovaných s PSS je poměrně dobrá, pětileté přežití se pohybuje v rozmezí 65–90 %. Klinickými a laboratorními nálezy asociovanými s vysokým rizikem vzniku plicního lymfomu jsou kožní vaskulitida, rekurentní parotidomegalie, lymfopenie, hypogamaglobulinémie, nízká hladina C4 a kryoglobulinémie [7, 16].
Ledviny
Postižení ledvin se objevuje u méně než 10 % jedinců s PSS a manifestuje se jako tubulointersticiální nefritida nebo distální renální acidóza. Jedná se o časné manifestace PSS, které bývají mnohdy nerozpoznány. Mohou se prezentovat hypokalemickou slabostí, méně často renální kolikou, nefrokalcinózou, osteomalacií, vzácně i jako diabetes insipidus [10, 34].
Gastrointestinální soustava
Manifestace PSS jsou popisovány v celém gastrointestinálním traktu, játrech a slinivce břišní. U jedinců s PSS se projevují jako dysfagie, nevolnost, dyspepsie, gastritida, zvýšená incidence celiakie a hepatálních abnormalit, subklinické postižení pankreatu. Dyspepsie obtěžuje 23 % jedinců s PSS. Může být sdružená s gastritidou, sníženou produkcí žaludečních šťáv a přítomností antiparietálních autoprotilátek, avšak jen zřídka vzniká perniciózní anémie. Postižení slinivky břišní je vzácné, zahrnuje pankreatitidu a pankreatickou insuficienci. U 49 % pacientů jsou prokazovány abnormální hodnoty jaterních testů, spojené obvykle s klinickým negativním nálezem. Celiakie se vyskytuje u jedinců s PSS stejně jako při diabetes mellitus typu 1 a při autoimunitním onemocnění štítné žlázy desetkrát častěji než u zdravé evropské populace [4, 36].
Nervová soustava (neurologická symptomatologie)
Prevalence neurologických projevů u PSS se pohybuje v rozmezí 10–60 %, převážně jako senzorická polyneuropatie. Až 17 % neuropatií se může projevit krátkými záchvaty velmi intenzivních a šlehavých bolestí v dermatomu některé z větví n. trigeminus. Jiné kraniální neuropatie jsou méně časté, postižené jsou převážně motorické nervy. Příčina neuropatií při PSS je nejasná, předpokládá se podíl ganglionitidy nebo vaskulitidy, jež byly popsány v bioptických histologických na periferních nervech [18].
Sjögrenův syndrom a těhotenství
Těhotenství u žen s PSS má ve většině případů stejný průběh jako u zdravé populace, avšak ženy s PSS, které tvoří autoprotilátky anti-Ro/SS-A, mají zvýšené riziko porodu dítěte s neonatálním SLE [14]. Dále se ukazuje, že ženy s PSS mají dvakrát vyšší riziko potratu oproti zdravé populaci [2].
TERAPIE
Terapie PSS se dělí obvykle na symptomatickou (terapie xerostomie, xeroftalmie atd.) a na chorobu modifikující terapii. Terapeutické postupy při PSS jsou primárně empirické. Evidence-based doporučení pro léčbu této choroby dosud chybí, neboť žádná terapie zatím výrazněji neovlivnila průběh choroby [28].
Systémová terapie je indikována při systémových projevech PSS. Ačkoliv neexistuje přesvědčivý důkaz podporující užitek z podávání kortikosteroidů u nekomplikovaného PSS, jejich podávání je nezbytné při projevech vaskulitidy, pneumonie, nefropatie. Pacienti s distální renální tubulární acidózou jsou běžně léčeni bikarbonátem sodným kvůli korekci metabolické acidózy a udržení relativně fyziologické hladiny bikarbonátu v séru. Hydrochlorochin se podává při kožních a kloubních manifestacích PSS. Metotrexát se běžně užívá pro léčbu zánětlivé artritidy, ovšem s malou evidence-based podporou užití při PSS. Slibně se jeví použití monoklonální protilátky rituximabu, tj. anti-CD20 B-lymfocyt-depleting přípravku. Je popisováno jeho příznivé působení na systémové manifestace, zahrnující zduření slinných žláz, plicní a kloubní projevy. Dále se uvádí zvýšení stimulované slinné sekrece a snížení únavy [28].
V roce 2015 byla vydána doporučení pro terapii xeroftalmie spojené s PSS. První linii terapie xer-oftalmie představuje umělá slza, která zvyšuje objem slzného filmu, snižuje odpařování slz a má lubrikační vlastnosti, včetně zavedení intrakanalikulárních implantátů do slzovodů [17]. Při KCS, při níž je přítomna zánětlivá reakce na očním povrchu, terapií volby je podávání lokálních kortikosteroidů po dobu dvou až čtyř týdnů. Dlouhodobé podávání kortikosteroidů je spojeno s potenciální toxicitou asociovanou se vznikem katarakty, glaukomu a oportunních infekcí [8].
Klinické doporučení pro terapii xerostomie bylo publikováno v roce 2014. Doporučují se pravidelné stomatologické preventivní prohlídky a vyvarování se faktorů, které podporují vysychání ústní sliznice (kouření, konzumace alkoholu a kofeinu), dále eliminace nemocí, jež vedou k ústnímu dýchání (sinusitida, rinitida). Léčba xerostomie se zaměřuje na udržení vlhkosti ústní sliznice umělou slinou a stimulací slinné produkce. Jako nejpřínosnější se jeví žvýkačky a bonbony bez cukru a pravidelné popíjení malých objemů tekutiny, zejména vody [11].
ZÁVĚR
Povědomí o existenci, závažnosti a projevech PSS v odborné veřejnosti včetně zubních lékařů stoupá. Nově doporučovaná klasifikační kritéria zpřesňují diagnózu. Přesto bývá PSS mnohdy jen obtížně rozpoznáván díky variabilitě svých klinických i laboratorních projevů. Současná diagnostika je podmíněna multioborovou spoluprací. Nemocný musí vždy podstoupit odborné oftalmologické, stomatologické a imuno-revmatologické vyšetření, následně pak podle potřeby i různá další, doplňující vyšetření. Otázkou zůstává, který specialista by měl celkově léčit nemocné jedince s PSS, zda revmatolog, nebo klinický imunolog. Ve většině zdravotnických zařízení, v nichž jsou tito pacienti vyšetřováni a léčeni, je toto dáno tamními zvyklostmi; kompetentními k tomu jsou lékaři obou odborností.
Lokální obtíže vznikající ve spojení s postižením slinných žláz, ústní sliznice a dentice jsou při PSS velice časté a v klinickém obrazu choroby z pohledu pacienta mnohdy i dominující, a proto značná část těchto celkově nemocných jedinců potřebuje intenzivní, a zejména kvalitní péči zubních lékařů, kteří musí být schopni těmto celkově nemocným jedincům kvalifikovaně pomoci. Tuto péči však nelze vytrhávat z výše uvedených širších medicínských souvislostí. Zubní lékař je tak nedílnou a nepostradatelnou součástí týmu ošetřujících lékařů u všech pacientů trpících PSS.
Práce vznikla v rámci výzkumného záměru PROGRES Q40/13.
MDDr. Martin Šembera
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: martin.sembera@fnhk.cz
Zdroje
1. Aoun, G., Nasseh, I., Berbe, A.: Evaluation of the oral component of Sjögren‘s syndrome: An overview. J. Int. Soc. Prev. Community Dent., roč. 6, 2016, č. 4, s. 278–284.
2. Ballester, C., Grobost, V., Roblot, P., Pourrat, O., Pierre, F., Laurichesse-Delmas, H., Gallot, D., Aubard, Y., Bezanahary, H., Fauchais, A. L.: Pregnancy and primary Sjögren‘s syndrome: management and outcomes in a multicentre retrospective study of 54 pregnancies. Scand. J. Rheumatol., roč. 46, 2017, č. 1, s. 56–63.
3. Delaleu, N., Jonsson, R., Koller, M. M.: Sjögren‘s syndrome. Eur. J. Oral. Sci., roč. 113, 2005, č. 2, s. 101–113.
4. Ebert, E. C.: Gastrointestinal and hepatic manifestations of Sjőgren syndrome. J. Clin. Gastroenterol., roč. 46, 2012, č. 1, s. 25–30.
5. Drahošová, M., Hrnčíř, Z., Andrýs, C., Slezák, R., Havlasová, J., Kopecký, O.: Analýza autoprotilátky proti 52 kDa a 60 kDa Ro/SSA u pacientek se Sjőgrenovým syndromem a systémovým lupus erythematodes imunoblotem. Rheumatologie, XIV, 2000, č. 1, s. 1–6.
6. Fauchais, A. L., Ouattara, B., Gondran, G., Lalloué, F., Petit, D., Ly, K., Lambert, M., Launay, D., Loustaud-Ratti, V., Bezanahari, H., Liozon, E., Hachulla, E., Jauberteau, M. O., Vidal, E., Hatron, P. Y.: Articular manifestations in primary Sjögren‘s syndrome: clinical significance and prognosis of 188 patients. Rheumatology (Oxford)., roč. 49, 2010, č. 6, s 1164–1172.
7. Flament, T., Bigot, A., Chaigne, B., Henique, H., Diot, E., Marchand-Adam, S.: Pulmonary manifestations of Sjögren‘s syndrome. Eur. Respir. Rev., roč. 25, 2016, č. 140, s. 110–123.
8. Foulks, G. N., Forstot, S. L., Donshik, P. C., Forstot, J. Z., Goldstein, M. H., Lemp, M. A., Nelson, J. D., Nichols, K. K., Pflugfelder, S. C., Tanzer, J. M., Asbell, P., Hammitt, K., Jacobs, D. S.: Clinical guidelines for management of dry eye associated with Sjögren disease. Ocul. Surf., roč. 13, 2015, č. 2, s. 118–132.
9. Fragkioudaki, S., Mavragani, C. P., Moutsopoulos, H. M.: Predicting the risk for lymphoma development in Sjogren syndrome: An easy tool for clinical use. Medicine (Baltimore), roč. 95, 2016, č. 25, s. e3766.
10. François, H., Mariette, X.: Renal involvement in primary Sjögren syndrome. Nat. Rev. Nephrol., roč. 12, 2016, č. 2, s. 82–93.
11. González, S., Sung, H., Sepúlveda, D., González, M., Molina, C.: Oral manifestations and their treatment in Sjögren‘s syndrome. Oral Dis., roč. 20, 2014, č. 2, s. 153–161.
12. Gougerot, H.: Insuffisance progressive et atrophie des glandes salivaires et muqueuses de la bouche, des conjonctives (et parfois des muqueuses nalase, laryngee, vulvaire). Sécheresse de la bouche, des conjonctives, etc. Bull. Med. (Paris), roč. 40, 1926, s. 360–368.
13. Hadden, W. B.: On dry mouth, or suppression of the salivary and buccal secretions. Transactions of the Clinical Society of London. Vol 5. London, England Longmans Green & Co, 1888, s. 176–179.
14. Haga, H. J., Gjesdal, C. G., Koksvik, H. S., Skomsvoll, J. F., Irgens, L. M., Ostensen, M.: Pregnancy outcome in patients with primary Sjögren‘s syndrome. A case-control study. J. Rheumatol., roč. 32, 2005, č. 9, s. 1734–1736.
15. Harboe, E., Tjensvoll, A. B., Vefring, H. K., Gøransson, L. G., Kvaløy, J. T., Omdal, R.: Fatigue in primary Sjögren‘s syndrome – a link to sickness behaviour in animals? Brain Behav. Immun., roč. 23, 2009, č. 8, s. 1104–1108.
16. Hatron, P. Y., Tillie-Leblond, I., Launay, D., Hachulla, E., Fauchais, A. L., Wallaert, B.: Pulmonary manifestations of Sjögren‘s syndrome. Presse Med., roč. 40, 2011, č. 1, s. e49–64.
17. Hejcmanová, D., Němcová, I., Slezák, R.: Podrobné zhodnocení zrakových funkcí pacientů se Sjőgrenovým syndromem před a po zavedení intrakanalikulárních implantátů (typ Smart Plug) (první výsledky). Čes.-slov. Oftalmol., roč. 62, 2006, č. 3, s. 183–189.
18. Chai, J., Logigian, E. L.: Neurological manifestations of primary Sjogren‘s syndrome. Current Opin. Neurol., roč. 23, 2010, č. 5, s. 509–513.
19. Jean, S., Quelvennec, E., Alizadeh, M., Guggenbuhl, P., Birebent, B., Perdriger, A., Grosbois, B., Pawlotsky, P. Y., Semana, G.: DRB1*15 and DRB1*03 extended haplotype interaction in primary Sjögren‘s syndrome genetic susceptibility. Clin. Exp. Rheumatol., roč. 16, 1998, č. 6, s. 725–728.
20. Krejsek, J., Koláčková, M., Lindrová, I., Slezák, R., Andrýs, C.: Increase of intracellular BAFF in B cells of Sjőgren´s patiens is not affected by decrease of BAFFR. Acta Medica (Hradec Králové), roč. 58, 2015, č. 1, s. 25–31.
21. Kong, L., Ogawa, N., Nakabayashi, T., Liu, G. T., D‘Souza, E., McGuff, H. S., Guerrero, D., Talal, N., Dang, H.: FasandFas ligand expression in the salivary glands of patients with primary Sjögren‘s syndrome. Arthritis Rheum., roč. 40, 1997, č. 1, s. 87–97.
22. Mavragani, C. P., Moutsopoulos, H. M.: The geoepidemiology of Sjögren‘s syndrome. Autoimmun. Rev., roč. 9, 2010, č. 5, s. A305–310.
23. Mikulicz-Radecki, J. von.: Über eine eigenartige symmetrische Erkrankung der Thränen - und Mundspeicheldrüsen. In: Beiträge zur Chirurgie. Festschrift gewidmet. Stuttgart: Theodor Billroth; 1892, s. 610–630.
24. Murube, J.: Henrik Sjögren, 1899–1986. The Ocular Surface, roč. 8, č. 1, s. 2–7.
25. Nováková, V., Belada, D., Laco, J., Kašparová, P., Nová, M., Slezák, R.: Malignant lymphomas of non-Hodgkin type in the annals of Stomatology Clinic in Hradec Králové 1998–2008. Čes. Stomatol., roč. 111, 2011, č. 2, s. 36–45.
26. Priori, R., Medda, E., Conti, F., Cassarà, E. A., Sabbadini, M. G., Antonioli, C. M., Gerli, R., Danieli, M. G., Giacomelli, R., Pietrogrande, M., Valesini, G., Stazi, M. A.: Risk factors for Sjögren‘s syndrome: a case-control study. Clin. Exp. Rheumatol., roč. 25, 2007, č. 3, s. 378–384.
27. Qin, B., Wang, J., Yang, Z., Yang, M., Ma, N., Huang, F., Zhong, R.: Epidemiology of primary Sjögren‘s syndrome: a systematic review and meta-analysis. Ann. Rheum. Dis., roč. 74, 2015, č. 11, s. 1983–1989.
28. Rischmueller, M., Tieu, J., Lester, S.: Primary Sjögren‘s syndrome. Best Pract. Res. Clin. Rheumatol., roč. 30, 2016, č. 1, s. 189–220.
29. Roguedas, A. M., Misery, L., Sassolas, B., Le Masson, G., Pennec, Y. L., Youinou, P.: Cutaneous manifestations of primary Sjögren‘s syndrome are underestimated. Clin. Exp. Rheumatol., roč. 22, 2004, č. 5, s. 632–636.
30.Royer, B., Cazals-Hatem, D., Sibilia, J., Agbalika, F., Cayuela, J. M., Soussi, T., Maloisel, F., Clauvel, J. P., Brouet, J. C., Mariette, X.: Lymphomas in patients with Sjogren‘s syndrome are marginal zone B-cell neoplasms, arise in diverse extranodal and nodal sites, and are not associated with viruses. Blood, roč. 90, 1997, č. 2, s. 766–775.
31. Saied, F., Włodkowska-Korytkowska, M., Maślińska, M., Kwiatkowska, B., Kunisz, W., Smorawińska, P., Sudoł-Szopińska, I.: The usefulness of ultrasound in the diagnostics of Sjögren‘s syndrome. J. Ultrason., roč. 13, 2013, č. 53, s. 202–211.
32. Shiboski, C. H., Shiboski, S. C., Seror, R., Criswell, L. A., Labetoulle, M., Lietman, T. M., Rasmussen, A., Scofield, H., Vitali, C., Bowman, S. J., Mariette, X. and the International Sjogren‘s Syndrome Criteria Working Group.: 2016 American College of Rheumatology/European League Against Rheumatism Classification Criteria for Primary Sjogren‘s Syndrome. Arthritis Rheumatol., roč. 00, 2016, č. 00, s. 00–00.
33. Sjögren, H.: Zur Kenntnis der Keratoconjunctivitis Sicca Keratitis filiformis bei hypofunction der Tränendrüsen. Acta Ophthalmol. (Suppl. II), 1933, s. 1–151.
34. Skálová, S., Minxová, L., Slezák, R.: Hypokalemic paralysis revealing Sjőgren´s syndrome in a 16-year-old girl. Ghana Med. J., roč. 42, 2008, č. 3, s. 124–128.
35. Slezák, R., Rencová, E., Krejsek, J.: Sjögrenův syndrom – polysystémové onemocnění. Pohled stomatologa, oftalmologa a klinického imunologa. Folia Gastroenterol. Hepatol., roč. 1, 2003, č. 1, s. 30–47.
36. Szodoray, P., Barta, Z., Lakos, G., Szakáll, S., Zeher, M.: Coeliac disease in Sjögren‘s syndrome – a study of 111 Hungarian patients. Rheumatol. International, roč. 24, 2004, č. 5, s. 278–282.
37. Teixeira Mendes, L. S., Wotherspoon, A.: Marginal zone lymphoma: Associated autoimmunity and auto-immune disorders. Best Pract. Res. Clin. Haematol., roč. 30, 2017, č.1–2, s. 65–76.
38. Vitali, C., Bombardieri, S., Jonsson, R., Moutsopoulos, H. M., Alexander, E. L., Carsons, S. E., Daniels, T. E., Fox, P. C., Fox, R. I., Kassan, S. S., Pillemer, S. R., Talal, N., Weisman, M. H; European Study Group on Classification Criteria for Sjögren‘s Syndrome.: Classification criteria for Sjögren‘s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann. Rheum. Dis., roč. 61, 2002, č. 6, s. 554–558.
39. Voulgarelis, M., Moutsopoulos, H. M.: Mucosa-associated lymphoid tissue lymphoma in Sjögren‘s syndrome: risks, ma-nagement, and prognosis. Rheum. Dis. Clin. North Am., roč. 34, 2008, č.4, s. 921–933.
40. Voulgarelis, M.,Tzioufas, A. G.: Pathogenetic mechanisms in the initiation and perpetuation of Sjögren‘s syndrome. Nat. Rev. Rheumatol., roč. 6, 2010, č. 9, s. 529–537.
41. Yonetsu, K., Takagi, Y., Sumi, M., Nakamura, T., Eguchi, K.: Sonography as a replacement for sialography for the diagnosis of salivary glands affected by Sjögren‘s syndrome. Ann. Rheum. Dis., roč. 61, 2002, č. 3, s. 276–277.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2018 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- Diagnostika alergie na bílkoviny kravského mléka − aktuální postupy a jejich vypovídací hodnota
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Konference úsměv 2018
- Rejstříky
- Rejstříky
- Neobvyklé postižení parodontu stálého horního středního řezáku vyvolané implantací cizorodého materiálu (lokalizovaná destrukce parodontu)
- Primární Sjögrenův syndrom
- Chirurgická léčba parodontálních nitrokostních defektů kalcium sulfátem v kombinaci s beta-trikalcium fosfátem
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Primární Sjögrenův syndrom
- Neobvyklé postižení parodontu stálého horního středního řezáku vyvolané implantací cizorodého materiálu (lokalizovaná destrukce parodontu)
- Chirurgická léčba parodontálních nitrokostních defektů kalcium sulfátem v kombinaci s beta-trikalcium fosfátem
- Konference úsměv 2018
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



