-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zubní pulpa – zdroj mezenchymových kmenových buněk
Dental Pulp – the Source of Mesenchymal Stem Cells
Objective:
the study aimed to isolation of dental pulp stem cells (DPSC), determination of proliferative and differentiation potential and observation of morphological changes and viability of DPSC cultured in vitro.Methods:
the authors used a total of 16 DPSC cell lines isolated from the third molars. The cells were cultured in a modified medium for mesenchymal stem cells (MSC) enriched with growth factors (EGF, PDGF), 2% FCS and ITS supplement. For the determination of quantitative parameters and cell viability the Vi-Cell XR and Z2 Counter were used.Results:
Enzyme dissociation of the complete dental pulp provided isolation of 45 ± 6 (10 - 108) stem cells. These cells were cultured through 60 population duplications (PD) in a modified medium for MSC. The analysis revealed increased time required for duplication from original 15-23 h for the first PD to 24-35 h for the subsequent 30 PD. Viability of the cultured cells was continually 96 ± 3%. In the course of the long-term cultivation of DPSC no signs of culture degeneration or spontaneous differentiation of the cells were observed.Conclusion:
these cells represent a morphologically homogenous population with a marked proliferation potential and stable phenotype in cultivation conditions in vitro. The dental pulp stem cells represent a highly potent source of histocompatible stem cells for cellular therapy, which is not limited to diseases of dental pulp and periodontium only. Their broad differentiation potential opens the way for application of these cells in other medical branches.Key words:
stem cells - dental pulp stem cells - dental pulp - cultivation
Autoři: J. Suchánek 1; T. Soukup 2; R. Ivančaková 1; B. Víšek 2
Působiště autorů: Stomatologická klinika LF UK a FN, Hradec Králové 1; Ústav histologie a embryologie LF UK, Hradec Králové 2
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 108, 2008, 5, s. 122-128
Souhrn
Cíle:
Cílem naší práce je izolace kmenových buněk zubní pulpy (KBZP), stanovení proliferačního a diferenciačního potenciálu, sledování morfologických změn a viability KBZP kultivovaných in vitro.Metodika:
V experimentu bylo použito celkem 16 linií KBZP izolovaných ze třetích molárů. Buňky byly kultivovány v modifikovaném médiu pro mezenchymové kmenové buňky (MKB) obohaceném o růstové faktory (EGF, PDGF), 2%FCS a ITS suplement. Pro stanovení kvantitativních parametrů a viability buněk jsme použili přístroje Vi-Cell XR a Z2 Counter.Výsledky:
Enzymatickou disociací celé zubní pulpy bylo izolováno v průměru 45 ± 6 (10 – 108) kmenových buněk. Tyto jsme kultivovali přes 60 populačních zdvojení (PD) v modifikovaném médiu pro MKB. Analýza ukázala zvýšení času potřebného pro zdvojení z původních 15-23 hodin pro prvních 30 PD na 24-35 hodin pro dalších 30 PD. Viabilita kultivovaných buněk byla dlouhodobě 96 ± 3 %. V průběhu dlouhodobé kultivace KBZP jsme nepozorovali známky degenerace kultury či znaky spontánní diferenciace buněk.Závěr:
Jedná se o morfologicky homogenní populaci s výrazným proliferačním potenciálem a se stabilním projevem v kultivačních podmínkách in vitro. Kmenové buňky zubní pulpy představují vysoce potentní zdroj histokompatibilních kmenových buněk pro buněčnou terapii, a to nejen pro onemocnění zubní pulpy a periodoncia. Jejich široký diferenciační potenciál otevírá cestu využití těchto buněk i v dalších medicínských oborech.Klíčová slova:
kmenové buňky - kmenové buňky zubní pulpy - zubní pulpa - izolace - kultivaceÚVOD
Zubní pulpa (ZP) je pro většinu stomatologů tkání, se kterou se ve své praxi neradi setkávají. Je to právě zubní pulpa (resp. nervová zakončení v ní obsažená), která je příčinou bolesti při některých našich zákrocích nebo při zánětu v ní probíhajícím. Další nepříjemnou vlastností pro klinického stomatologa je nízký regenerační potenciál ZP in situ. V případě toxického nebo mechanického poškození ZP dochází často k její nekróze a z toho plynoucí potřeba endodontického ošetření. ZP však nemusí být vždy jen zdrojem obtíží pro pacienta. Právě díky ZP si člověk uvědomuje, že některý z jeho zubů je poškozen a často tak navštíví stomatologa ještě v době, kdy je náprava škod možná. Navíc je zubní pulpa vybavena populací buněk s vlastnostmi typickými pro dospělé kmenové buňky – vysoká proliferační aktivita, fenotyp typický pro nediferencované buňky a v neposlední řadě též široký diferenciační potenciál [10].
V současné době zkoumá řada výzkumných týmů možnost využití kmenových buněk zubní pulpy (KBZP) v regeneraci zubních tkání, dále v terapii řady onemocnění v ústní dutině i celkových nemocí [16, 10].
VÝVOJ ZUBU A ZUBNÍ PULPY
Vývoj zubu a ZP je z hlediska embryologie velmi zajímavým procesem. Zub se zakládá ze dvou mezenchymálních zdrojů a z ektodermu. Z ektodermu, listu kryjícího povrch embrya, vzniká orgán skloviny. Na vývoji zubní pulpy se podílejí mezenchymové buňky, odvozené jednak z tkání obklopujících dentální lištu, a dále z neurální lišty samotné - buňky během počátečních dnů embryogeneze migrují z předního mozku pod ektoderm primitivní ústní dutiny. Zde tvoří tzv. ektomezenchym, z něhož vzniká část zubní pulpy (odontoblasty).
V první fázi vývoje zubu, asi v 6. týdnu embryonálního vývoje, dochází k zanoření buněk ektodermu do ektomezenchymu. Vzniká tzv. dentální lišta, ze které se vyvíjejí zuby dočasné i stálé dentice. Dalším vývojovým stupněm je stadium pupenu. Poté dochází ke zmnožení buněk ektodermu a vzniká tzv. stadium pohárku. V této fázi je již patrné zmnožení buněk ektomezenchymu, začíná se tvořit orgán skloviny. Posledním vývojovým stupněm korunky zubu je stadium zvonku. V této fázi je již dotvořen orgán skloviny, buňky ektodermu téměř obklopily budoucí zubní pulpu a dochází postupně k tvorbě dentinu a skloviny.
HISTOLOGICKÁ STAVBA ZUBNÍ PULPY
Jelikož je ZP ohraničena pomocí tvrdých zubních tkání od okolních struktur již v období embryonálního vývoje, zachovává si stavbu unikátního, tzv. rosolovitého vaziva. Jedná se o typ pojivové tkáně s velkým množstvím mezibuněčné hmoty (glykosaminoglykany, glykoproteiny) a s malým množstvím kolagenních vláken, zejména typu I a III.
ZP z mikroskopického pohledu rozdělujeme do 4 částí: 1. vrstva odontoblastů, 2. bezbuněčná Weilova zóna, 3. vrstva bohatá na buňky (fibroblasty, imunokompetentní buňky a buňky nediferencované) a 4. centrum ZP (obr. 1).
Obr. 1. Zubní pulpa s tenkou vrstvou dentinu. Vrstva odontoblastů (1) - palisádovitě (epiteloidně) uspořádaná vrstva buněk.Weilova bezbuněčná zóna (2) - vrstva řídkého (rosolovitého) vaziva. Vrstva bohatá na buňky (3) - vrstva řídkého (rosolovitého) vaziva s fibroblasty a imunokopetentními buňkami. Centrum zubní pulpy (4) - část zubní pulpy obsahující cévní a nervové svazky, v dolní část obrázku zastižen okraj centra zubní pulpy. HE, původní zvětšení 100x. 
Odontoblasty jsou palisádovitě (epiteloidně) uspořádané buňky nacházející se těsně pod vrstvou dentinu. Jsou zodpovědné za tvorbu primárního a sekundárního dentinu. Pod vrstvou odontoblastů je vrstvička dřeně s minimálním množstvím buněk - bazální Weilova vrstva. Pod Weilovou vrstvou se nachází tzv. silně buněčná vrstva s vřetenitými buňkami, které jsou štíhlými výběžky v kontaktu s odontoblasty i mezi sebou navzájem. Weilova vrstva i buněčná vrstva tvoří tzv. subodontoblastovou vrstvu dřeně. Tato zóna je velmi bohatě inervována. Nervová vlákna zde tvoří plexus Raschkowi, z něhož odbočují terminální vlákna. Ta probíhají spolu s výběžky odontoblastů v dentinových tubulech. ZP je velmi bohatě vaskularizovaná a v jejím centru nacházíme i větší cévní a nervové kmeny.
KMENOVÉ BUŇKY ZUBNÍ PULPY
Kmenové buňky (KB) se ve vznikajícím organismu zakládají jako jedny z prvních buněčných populací. Jejich hlavní úlohou je produkce specializovaných buněčných typů při současném zachování populace KB až do dospělosti. Z tohoto důvodu jsou KB obdařeny biologickými vlastnostmi, které je odlišují od všech ostatních buněk v tkáních (např. primitivním fenotypem, vysokou proliferační schopností, širokým diferenciačním potenciálem, schopností sebeobnovy). Zatímco za vývoje je jejich hlavní funkcí vytvoření základu jednotlivých orgánů, v dospělosti slouží k udržení homeostázy jednotlivých tkání a k jejich reparaci.
Mezenchymové kmenové buňky (MKB) jsou vzácnou buněčnou populací vyskytující se v kostní dřeni s frekvencí zhruba 10-6 až 10-4 jaderných buněk v závislosti na věku pacienta [25]. MKB jsou schopné diferenciace v buňky specializovaných tkání, podpůrného stromatu kostní dřeně, v kostní tkáň, šlachu, chrupavku, tukovou tkáň, srdeční svalovinu aj., a to buď po přenesení do příslušného permisivního prostředí in vivo [2, 9], nebo po poskytnutí diferenciačních podnětů in vitro [11, 15, 17, 19, 20]. Tyto vlastnosti MKB vzbuzují nejen naděje na nové způsoby léčby defektů kostí a chrupavek, ale například i infartku myokardu [18] či mozkomíšních poranění a defektů [8].
Obecně lze výskyt MKB předpokládat ve většině tkání a orgánů. Mezenchymové kmenové buňky či kmenové buňky mezenchymovým podobné byly v lidském organismu identifikovány např. v tukové tkáni [26], amniové tekutině [1], fetálních tkáních a orgánech [3], periostu [14], periodontálním ligamentu [21] a v neposlední řadě také v zubní pulpě stálých i exfoliovaných mléčných zubů [6, 7, 22].
V roce 2000 Gronthos a spolupracovníci poprvé izolovali a popsali kmenové buňky zubní pulpy (KBZP) [7]. V jejich experimentu byla zubní pulpa (ZP) izolována z neprořezaného třetího moláru. V dalších experimentech prokázali schopnost sebeobnovy KBZP a jejich schopnost diferencovat se ve zralé buněčné elementy [6, 22]. Nebyli však schopni lokalizovat KBZP uvnitř pulpy samotné, a tak otázka jejich lokalizace zůstává dodnes nezodpovězena. Výzkumná skupina vedená Miurou izolovala v roce 2003 KBZP i ze ZP exfoliovaného zubu [13].
MKB se dle současných poznatků zdají být nejvhodnějším typem buněk pro regenerativní medicínu. MKB jsou schopné diferencovat v široké spektrum zralých buněčných linií a navíc jsou schopné konverze i v elementy odlišných zárodečných listů v rámci tzv. plasticity KB. Širší diferenciační spektrum mají pouze lidské embryonální KB, které ovšem nesplňují předpoklad histokompatibility s tkáněmi potencionálního příjemce a jejich získání je navíc eticky sporné. V této chvíli tak ZP představuje snadno dosažitelný zdroj KB.
Na základě výše uvedených faktů a vzhledem ke skutečnosti, že zubní pulpa představuje ohraničený a od ostatních tkání oddělený kompartment, který si uchoval stavbu typickou pro primitivní (embryonální) tkáně, se domníváme, že KB v ní obsažené by měly vykazovat spíše vlastnosti časných (embryonálních) KB. Protože zubní pulpa není homogenní, nýbrž polarizovaná, předpokládáme v ní existenci dvou subpopulací KB, tedy dvou odlišných kompartmentů (subodontoblastického - SO a perivaskulárního - PV) různě bohatých na KB. Nabízí se také hypotéza o různém embryonálním původu KB těchto kompartmentů.
Cílem naší práce bylo stanovení proliferačního potenciálu a sledování morfologických změn a viability kmenových buněk zubní pulpy in vitro. Za unikátní považujeme použití námi modifikovaného média pro kultivaci mezenchymových progenitorových buněk [23, 24], které oproti jiným autorům používá pouze 2 % fetálního bovinního séra a přibližuje tak podmínky k bezsérovým kultivačním protokolům, předcházejícím klinické aplikace.
METODIKA
Každý pacient je před odběrem (odběrem rozumíme extrakci zubu prováděnou v lokální anestezii za sterilních podmínek) zubu pro výzkumné účely krátce seznámen s teorií kmenových buněk a podepisuje informovaný souhlas. Pokud se jedná o odběr zubu u dítěte, informovaný souhlas podepisuje zákonný zástupce. Informace pro nemocné a text informovaného souhlasu schválila Etická komise Lékařské fakulty a Fakultní nemocnice v Hradci Králové. Při zařazení do studie jsou osobní data pacientů uchována s plnou ochranou důvěrnosti podle platných zákonů ČR. Extrakce jsou plánovaným zákrokem a pacientovi tím nevzniká žádná újma, nedochází k žádnému vyšetření ani jakémukoli zákroku navíc. Zuby byly indikovány k extrakci ošetřujícím lékařem nejčastěji z ortodontických důvodů a nebyly postiženy kariézním procesem (obr. 2, obr. 3 obr. 4).
Obr. 2. Extrahovaný zub 38 po preparaci sterilním diamantovým brouskem. 
Obr. 3. Extrahovaný zub 18 s nedokončeným vývojem kořene. 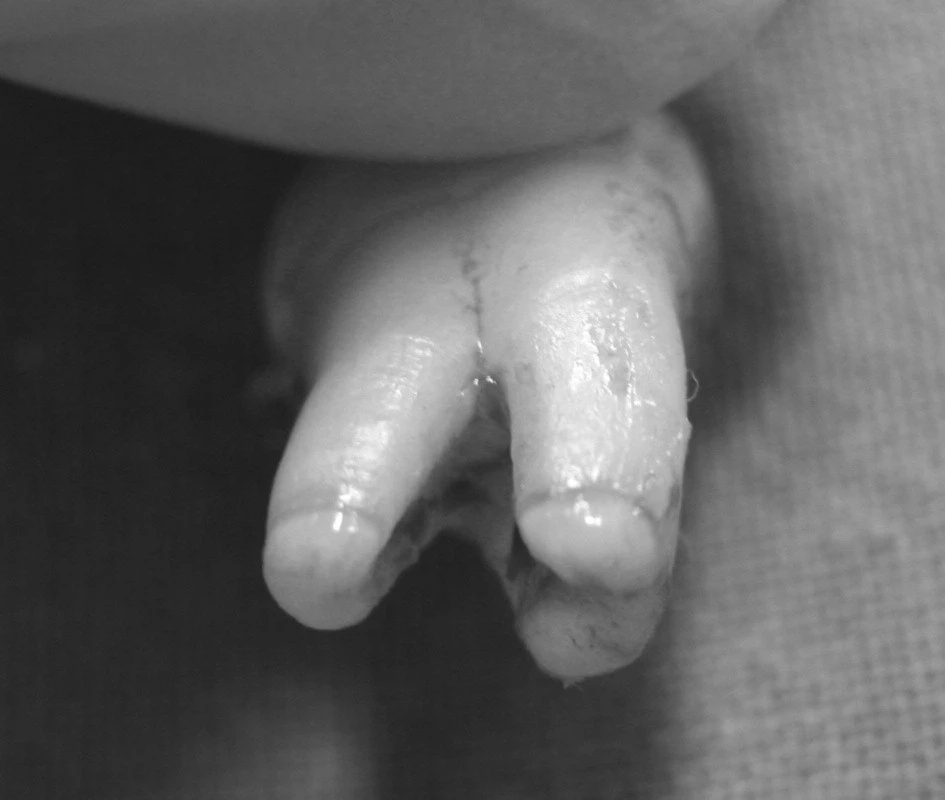
Obr. 4. Extrahovaný zub 38 – dřeňová dutina široce komunikuje s okolím 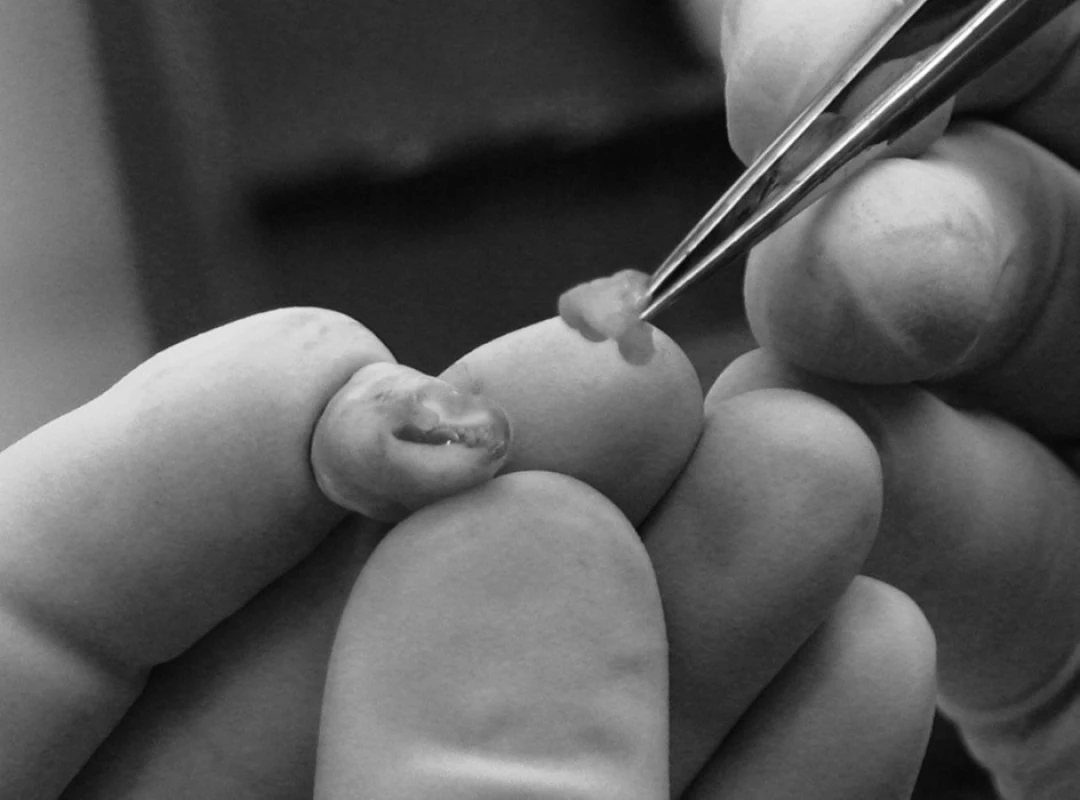
Dle daných kritérií jsme získali 16 třetích molárů od dárců ve věku 12 – 23 let s průměrným věkem 19 let. Zub i ZP byly transportovány do laboratoře tkáňových kultur v Hankově balancovaném solném roztoku (HBSS) (Gibco) při teplotě 4 °C.
Metodika získání samotné ZP se lišila podle stupně vývoje kořene zubu. Nejobtížnější je získat pulpu ze zubů s dokončeným vývojem kořene. Tyto zuby fixujeme sterilním mulovým čtvercem na pevné podložce. Provedeme sterilním diamantovým brouskem longitudinální řez směřující kolmo na směr dlouhé osy zubu. Během řezu chladíme brousek fyziologickým roztokem. Tím získáme dvě části zubu a materiál k odběru KB. Zubní dřeň exkavujeme z cavum pulpae ostrým sterilním exkavátorem (Henry Schein Inc.) tak, abychom zachytili tkáň pulpy i v těsné blízkosti dentinu a získali tak subodontoblastickou vrstvu dřeně. Tkáň zubní dřeně spolu s extrahovaným zubem uložíme do sterilních zkumavek s HBSS médiem.
Při výše popsané technice však hrozí nebezpečí poškození buněk ZP nejen mechanicky, ale i tepelně. V současné době proto preferujeme extrakci ZP za použití Luerových kleští. Kleštěmi odštípeme části kořene a ZP exstirpujeme pomocí exstirpační jehly. Tento postup zabrání termickému poškození ZP. Pokud nedošlo k uzavření foramen apicale (obr. 4), můžeme pulpu vybavit rovněž pomocí exstirpační jehly, což je technicky snazší a vyvarujeme se tím i termického poškození buněk ZP. Nejsnazší je odběr ZP ze zárodku zubu. Pulpa široce komunikuje s okolím zubu a je velmi dobře přístupná (obr. 7).
Obr. 5. Karyotyp 46 XX, KBZP po dosažení Hayflickova limitu. 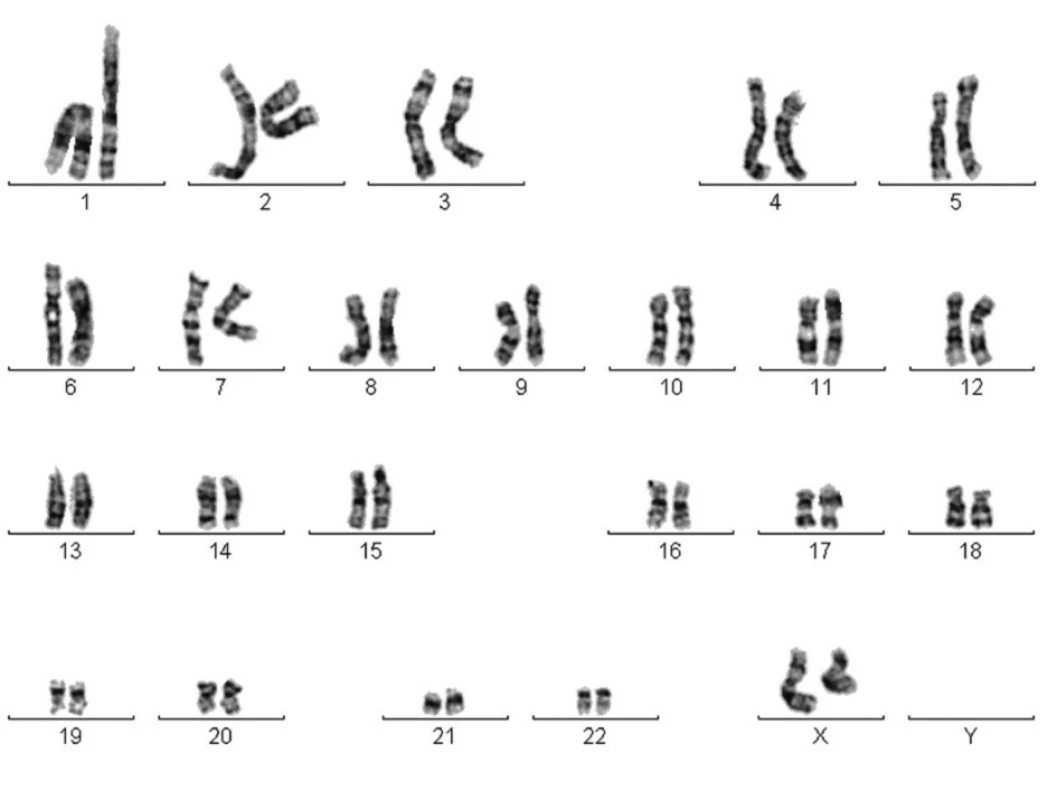
Izolace KBZP je prováděna enzymatickou disociací při 37 °C enzymy dispázou (Gibco) a kolagenázou typu I (Sevapharma). ZP je vystavena působení enzymů po dobu 30 minut, poté je zbytek ZP přesunut do nové nádoby a znovu vystaven působení enzymů po dobu 30-40 minut. Takto oddělené dvě frakce (z povrchových vrstev a z centrální části zubní pulpy) nasazujeme na misky s plastovým povrchem pro tkáňové kultury (Sarstedt).
Buňky kultivujeme při 37 °C za aerobních podmínek (5 % CO2), a to v námi modifikovaném expanzním médiu pro kultivaci lidských mezenchymových progenitorových buněk (MPCs) [19], s 2 % fetálního bovinního séra (FBS, PAA), ITS (inzulin, transferrin, sodium selenite) (Sigma) a růstovými faktory – EGF (PeproTech), PDGF-BB (PeproTech). Po 5 - 7 dnech buňky z primokultury disociujeme trypsinizací, počítáme a pasážujeme v poměru 1 : 3. K dalšímu pasážování přistupujeme vždy při dosažení 70% splývavosti buněk v kultivačních nádobkách. Analýzu viability, distribuce průměrů a počtů buněk provádíme pomocí přístrojů Z2 Counter a ViCell (oba Beckman Coulter).
VÝSLEDKY
Podle našich předpokladů se nám podařilo izolovat 2 odlišné populace KBZP z extrahovaných třetích molárů. Izolace KBZP byly úspěšné při použití exstirpační jehly a Luerových kleští. Izolace metodou užívající rotační nástroje nebyly úspěšné, a proto jsme od nich upustili.
Po enzymatické disociaci jsme získali v průměru 46 ± 6 (10 – 108) KBZP (počítáno v primokultuře 24 h po nasazení) (obr. 5). Po 5 dnech byly KB nasazeny do kultivačních nádob pro tkáňové kultury (Sarstedt) (obr. 6). Další pasáž byla provedena vždy při dosažení 70% splývavosti.
Obr. 6. Malá kolonie kmenových buněk zubní pulpy 2 dny po inokulaci do kultivační nádoby. KBZP mají v průměru 12 až 18 μm. Mikroskop s fázovým kontrastem, zvětšení 200x. 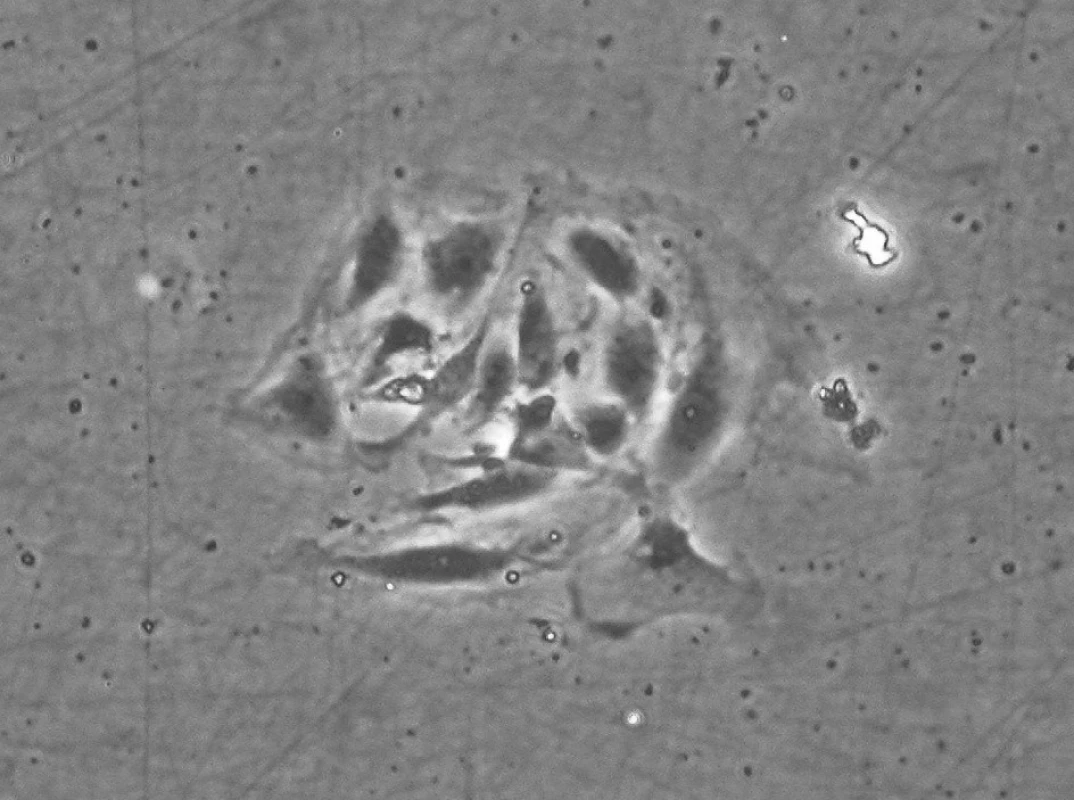
Obr. 7. Kolonie kmenových buněk zubní pulpy 5. den po nasazení. Primokultura je připravena k pasážování. KBZP mají v průměru 12 - 18 μm.Mikroskop s fázovým kontrastem, zvětšení 200x. 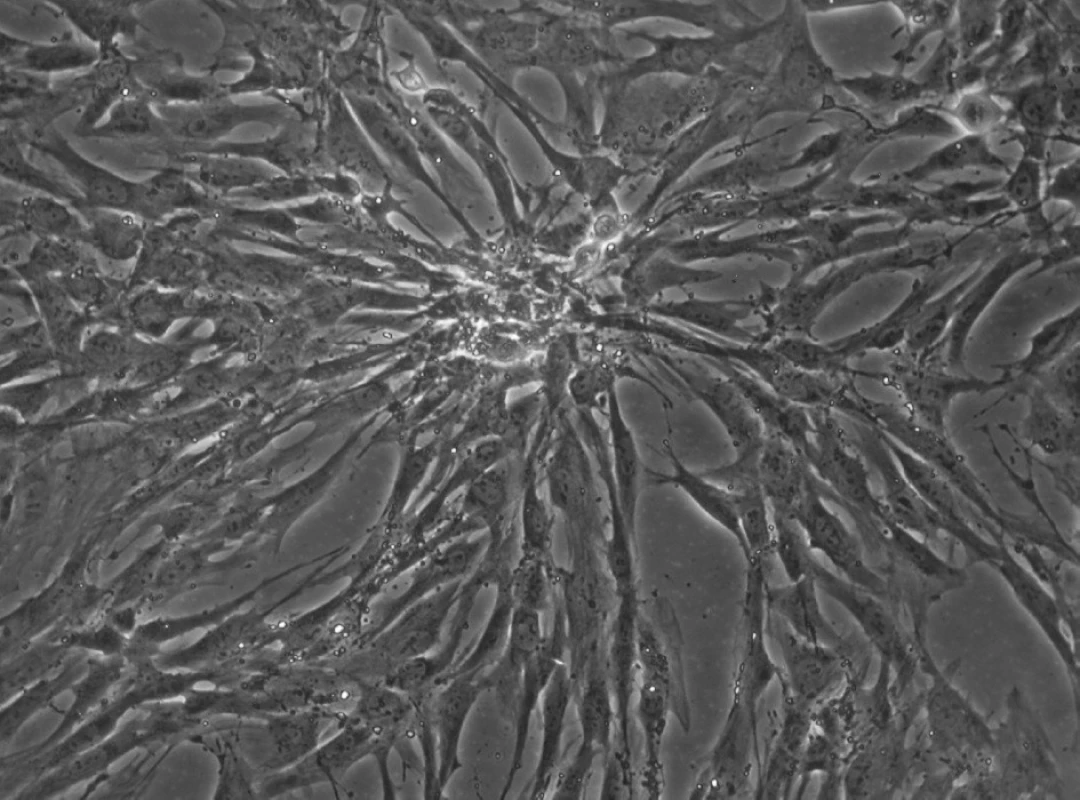
KBZP se jevily proliferačně velmi aktivní. Čas potřebný na zdvojnásobení populace, tzv. doubling time (DT), byl pro úvodních 30 populačních zdvojeních (PD) 15 - 23 hodin a po dosažení 30 PD vzrostl na 24 - 35 hodin. KBZP byly po nasazení i po dosažení Hayflickova limitu (graf. 1) cytogeneticky stabilní (obr. 7) a nevykazovaly žádné známky spontánní diferenciace. Během celého experimentu si udržely vysokou viabilitu 96 ± 3% (89 - 100%).
Graf 1. Kumulace počtu populačních zdvojení u linie KBZP, celkem dosaženo 60 populačních zdvojení 
KBZP izolované z obou studovaných kompartmentů se odlišovaly pouze morfologicky. KB izolované z PV byly vřetenité s dlouhými výběžky (obr. 8), zatímco KB z SO byly spíše okrouhlé, s více rozvinutým cytoskeletem (obr. 9). Tyto morfologické rozdíly nebyly spojeny se změnou ve velikosti (průměru) buněk. Velikost buněk dominantní populace byla v rozmezí 12 - 18 μm. KB ze SO také více dodržovaly kontaktní inhibici.
Obr. 8. Kmenové buňky zubní pulpy izolované z perivaskulárního kompartmentu při 30. pasáži. Buňky jsou vřetenaté, s dlouhými výběžky a rozvinutým cytoskeletem. KBZP mají v průměru 12 - 18 μm. Mikroskop s fázovým kontrastem, zvětšení 200x. 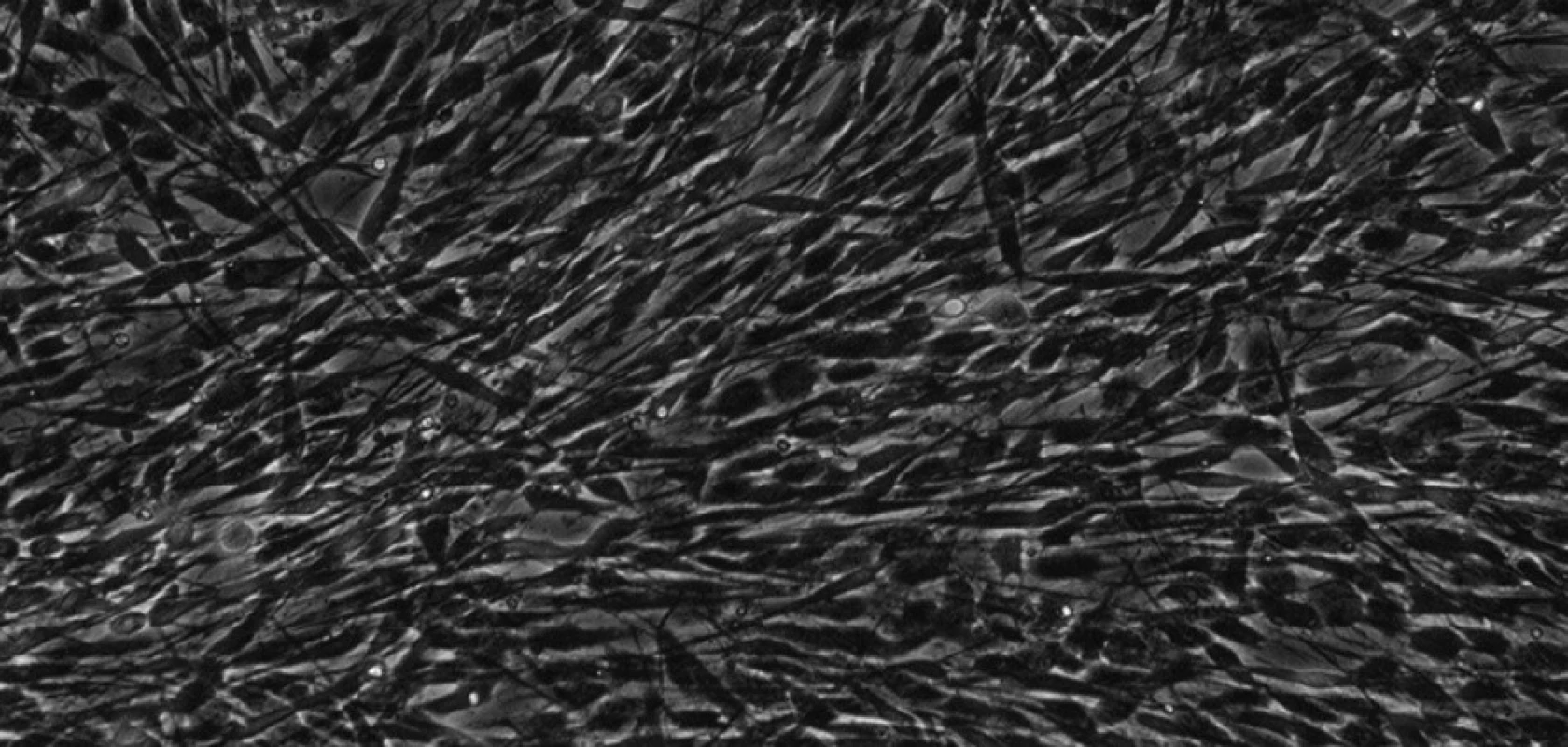
Obr. 9. Kmenové buňky zubní pulpy izolované ze subodontoblastického kompartmentu při 30. pasáži. Buňky jsou více okrouhlé. KBZP mají v průměru 12 - 18 μm.Mikroskop s fázovým kontrastem, zvětšení 200x. 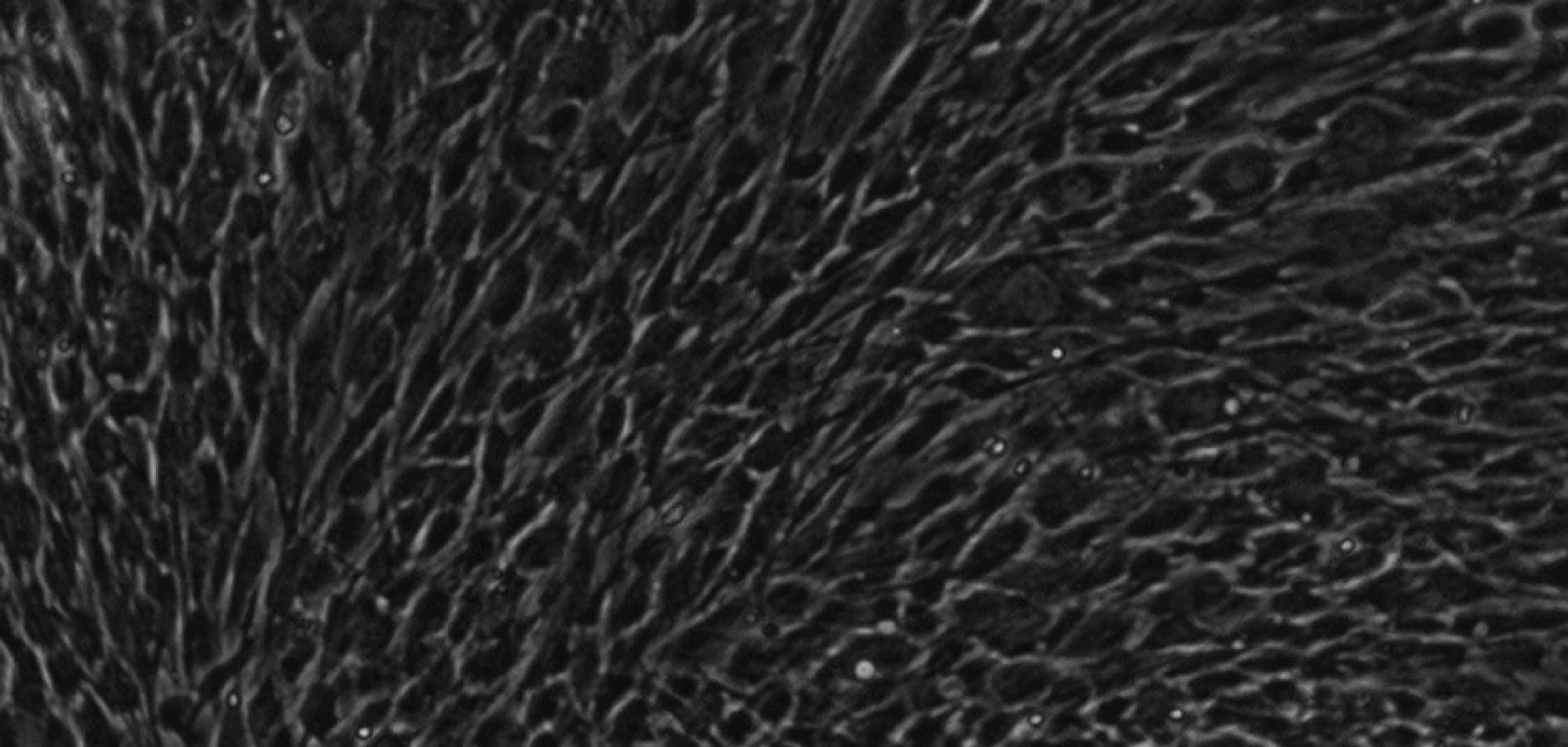
DISKUSE
Zubní pulpa představuje dobře ohraničený a od ostatních tkání oddělený kompartment, který si ponechává strukturu podobnou embryonálním tkáním. Vzhledem ke komplikovanému procesu odontogeneze, na kterém se podílejí dva zárodečné listy (mezenchym stomodea a neuroektoderm z crista neuralis), lze i v ZP očekávat dvě populace KB, které jsou ve vzájemné interakci, avšak nemají zcela shodné vlastnosti
Izolovali a kultivovali jsme 16 linií KBZP získaných ze třetích molárů v kultivačním médiu pro mezenchymové progenitorové buňky izolované z kostní dřeně. Na rozdíl od ostatních autorů [7, 12] jsme KBZP kultivovali přes 60 PD. Po dosažení Hayflickova limitu KBZP byly cytogeneticky stabilní a nejevily žádné známky spontánní diferenciace
Jsme prvními autory, kteří u KBZP prokázali závislost času potřebného na zdvojnásobení populace na množství populačních zdvojnásobení. DT byl pro úvodních 30 populačních zdvojení 15-23 hodin a po dosažení 30 PD vzrostl na 24-35 hodin.
Autoři prvních publikovaných studií o KBZP [4, 5, 13] předpokládali, že se tyto buňky v ZP nacházejí perivaskulárně. V našem experimentu jsme byli schopni izolovat dvě linie KBZP, a to z centra (perivaskulární kompartment) a z povrchové vrstvy (subodontoblastický kompartment) zubní pulpy. KBZP izolované z PV byly vřetenité, protáhlé a s dlouhými výběžky, na rozdíl od KB izolovaných ze SO, které byly spíše okrouhlé. Kmenové buňky z obou kompartmentů jsou vysoce proliferačně aktivní.
Otázky, zda jsou KBZP schopné diferenciace v jiné buněčné elementy a zda je rozdílný původ subpopulací KBZP spojen i s rozdílným fenotypem, se pokusíme zodpovedět při dalším řešení této problematiky.
ZKRATKY
DT doubling time; čas potřebný na zdvojnásobení populace
EGF epidermal growth factor; epidermální růstový faktor
FBS fetální bovinní sérum
FCS fetal calf serum; fetální telecí sérum
HBSS Hank’s balanced salted solution; Hankův balancovaný solný roztok
HE hematoxylin-eosin
ITS liquid media supplement (inzulin, transferrin, sodium selenite)
KB kmenové buňky
KBZP kmenové buňky zubní pulpy
MAPCs multipotent adult progenitor cells
MKB mezenchymové kmenové buňky
MPB mezenchymové progenitorové buňky
PD population doublings; populační zdvojnásobení
PDGF-BB platelet-derived growth factor; z krevních destiček derivovaný růstový faktor
PV perivaskulární kompartment zubní pulpy
SO subodontoblastický kompartment zubní pulpy
Práce vznikla za podpory grantu IGA MZ NR 9182-3/07 a grantu Grantové agentury Univerzity Karlovy v Praze, číslo 102908-3029/2008.
MUDr. Jakub Suchánek
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: suchanekj@lfhk.cuni.cz
Zdroje
1. Anker, P. S., Scherjon, S. A., Kleijburg-van der Keur, C. et al.: Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation. Blood, roč. 102, 2003, s. 1548-1549.
2. Bruder, S. P., Kraus, K. H., Goldberg, V. M., Kadiyla, S.: The effect of implants loaded with autologous mesenchymal stem cells on thehealing of canine segmental bone defects. J. Bone Joint Surg. Am., roč. 80, 1998, s. 985-996.
3. Campagnoli, C., Roberts, I. A., Kumar, S. et al.: Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood, liver, and bone marrow. Blood, roč. 98, 2001, s. 2396-2402.
4. Colter, D. C., Class, R., DiGirolamo, C. M. et al.: Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow. Proc. Natl. Acad. Sci. USA, 2000, č. 97, s. 3213-3218.
5. Doetsch, F.: A niche for adult neural stem cells. Curr. Opin. Genet. Dev., 2003, č. 13, s. 543-550.
6. Gronthos, S., Brahim, J., Li, W. et al.: Stem cell properties of human dental pulp stem cells. J. Dent. Res., roč. 81, 2002, č. 8, s. 531-535.
7. Gronthos, S., Mankani, M., Brahim, J. et al.: Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc. Natl. Acad. Sci. USA, 2000, č. 97, s. 13625-13630.
8. Jendelová, P., Herynek, V., De Cross, J., Glogárová, K., Andersson, B., Hájek, M., Syková, E.: Imaging the fate of implanted bone marrow stromal cells labeled with superparamagnetic nanoparticles. Magn. Reson. Med., roč. 50, 2003, s. 767-776.
9. Jiang, Y., Jahagirdar, B. N., Reinhardt, L. et al.: Pluripotency of mesenchymal stem cells derived from adult marrow. Nature, roč. 418, 2002, s. 41-49, supplementary information www.nature.com/nature.
10. Liu, H., Gronthos, S., Shi, S.: Dental pulp stem cells. Methods Enzymol., 419, 2006, s. 99-113.
11. Makino, S., Fukuda, K., Miyoshi, S., Konishi, F., Kodama, H., Pan, J., Sano, M., Takahashi, T., Hoti, S., Abe, H., Hata, J., Umezawa, A., Ogawa, S. Cardiomyocytes can be generated from marrow stromal cells in vitro. J. Clin. Invest., roč. 103, 1999, s. 697-705.
12. Minguel, J. J., Erices, A., Conget, P.: Mesenchymal stem cells. Exp Biol Med, 2001, č. 226, s. 507-520.
13. Miura, M., Gronthos, S., Zhao, M., Lu, B., Fischer, L. W., Robey, P. G., Shi, S.: SHED: Stem cells from human exfoliated deciduous teeth. Proc. Natl. Acad. Sci. USA, 100, 2003, s. 5807-5812. 80. Mesenchymal stem cells. Exp. Biol. Med., 226, 2001, s. 507-520.
14. Nakahara, H., Dennis, J. E., Bruder, S. P. et al.: In vitro differentiation of bone and hypertrophic cartilage from periosteal-derived cells. Exp. Cell. Res., roč. 195, 1991, s. 492-503.
15. Pereira, R. F., Halford, K. W., O’Hara, M. D. et al.: Cultured adherent cells from marrow can serve as long-lasting precursor cells for bone, cartilage and lung in irradiated mice. Proc. Natl. Acad. Sci. USA, 1995, č. 92, s. 4857-4861.
16. Perry, B. C., Zhou, D., Wu, X., Yang, F. C., Byers, M. A., Chu, T. M., Hockema, J. J., Woods, E. J., Goebel, W. S: Collection, cryopreservation, and characterization of human dental pulp-derived mesenchymal stem cells for banking and clinical use tissue. Eng. Part C Methods, 14,2008, 2, s. 149-156.
17. Pittenger, M. F., Mackay, A. M., Beck, S. C. et al.: Multilineage potential of adult human mesenchymal stem cells. Science, 1999, č. 284, s. 143-147.
18. Pittenger, M. F., Martin, B. J.: Mesenchymal stem cells and their potential as cardiac therapeutics. Circ. Res., roč. 95, 2004, s. 9-20.
19. Reyes, M., Lund, T., Lenvik, T. et al.: Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood, roč. 98, 2001, č. 9, s. 2615-2625.
20. Sanchez-Ramos, J. et al.: Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp. Neurol., 2000, č. 164, s. 247-256.
21. Seo, B. M., Miura, M., Gronthos, S., Bartold, P. M., Batouli, S. et al.:. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet, roč. 364, 2004, s. 149-155.
22. Shi, S., Gronthos, S.: Perivascular niche of postnatal mesenchymal stem cells in human bone marrow and dental pulp. J. Bone Miner. Res., roč. 18, 2003, č. 4, s. 696.
23. Soukup, T., Mokrý, J., Karbanová, J., Pytlík, R., Suchomel, P., Kučerová, L.: Mesenchymal stem cells isolatér from human bone marrow: cultivation, phenotypic analysis and changes in proliferation kinetice. Acta Medica, Hradec Králové, roč. 49, 2006, 1, s. 27-33.
24. Suchánek, J., Soukup, T., Ivančaková, R., Karbanová, J., Hubková, V., Pytlík R., Kučerová, L.: Human dental pulp stem cells —isolation and long term cultivation. Acta Medica, Hradec Králové, roč. 50, 2007, s. 195-201.
25. Werntz, J. R., Lane, J. M., Burstein, A. H., Justin, R., Klein, R., Tomin, E.: Qualitative and quantitative analysis of orthotopic bone regeneration by marrow. J. Orthop. Res., roč. 14, 1996, s. 85-93.
26. Zuk, P. A., Zhu, M., Aashijian, P., et al.:. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell., roč. 13, 2002, s. 4279-4295.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2008 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- Diagnostika alergie na bílkoviny kravského mléka − aktuální postupy a jejich vypovídací hodnota
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Zvyšují self-etching adheziva spolehlivost dentinového bondingu? In-vitro studie
- Fraktúry hornej časti strednej tretiny tvárovej kostry a dolnej časti hornej tretiny tvárovej kostry
- Zubní pulpa – zdroj mezenchymových kmenových buněk
- Rizikový pacient a specializovaná zubní péče
- Využití moderních technologií ve studiu zubního lékařství – PREPassistant
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rizikový pacient a specializovaná zubní péče
- Zubní pulpa – zdroj mezenchymových kmenových buněk
- Fraktúry hornej časti strednej tretiny tvárovej kostry a dolnej časti hornej tretiny tvárovej kostry
- Využití moderních technologií ve studiu zubního lékařství – PREPassistant
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



