-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPoměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PET
Cerebrospinal fluid ratio of phosphorylated tau protein and beta amyloid predicts amyloid PET positivity
Aim: Current diagnostic criteria for Alzheimer’s disease shift the focus from clinical findings to metabolic biomarkers. Most widely used metabolic biomarkers in the Czech Republic are cerebrospinal fluid levels of beta amyloid 1-42, total tau, and phosphorylated tau 181, as well as amyloid PET. Our aim was to investigate the concordance of amyloid PET and cerebrospinal fluid biomarkers in clinical settings and propose a way of interpreting cerebrospinal fluid biomarker results in order to better predict the amyloid PET status in contradictory cases.
Methods: A total of 103 patients underwent neuropsychological assessment, brain MRI, visually evaluated flutemetamol amyloid PET and examination of biomarkers in the cerebrospinal fluid. Concordance of amyloid PET and cerebrospinal fluid biomarkers was compared and subsequent optimal cut-off for the beta amyloid 1-42 and phosphorylated tau protein ratio was calculated.
Results: Concordance between amyloid PET and beta amyloid 1-42 was 79%, followed by phosphorylated tau protein (72%). In 40% of cases, the results of cerebrospinal fluid biomarkers was contradictory. Beta amyloid 1-42 and phosphorylated tau protein ratio was found to best discriminate between amyloid PET positive and negative patients (AUC = 0.938, 95% CI = 0.890–0.986; P < 0.001). Ratio of 9.47 provided 91.0% sensitivity and 91.3% specificity.
Conclusion: Both methods show good diagnostic concordance. In case of contradictory cerebrospinal fluid biomarkers, we encourage using the beta amyloid 1-42 and phosphorylated tau protein ratio.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Keywords:
Alzheimer‘s disease – biomarkers – amyloid PET – cerebrospinal fluid – flutemetamol – beta amyloid Aβ 1-42 – tau protein
Autoři: J. Cerman 1,2; J. Laczó 1,2; M. Vyhnálek 1,2; J. Malinovská 1
; J. Hanzalová 1; J. Hort 1,2
Působiště autorů: Neurologická klinika 2. LF UK, a FN Motol, Praha 1; Mezinárodní centrum klinického, výzkumu, FN u sv. Anny v Brně 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(2): 173-179
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2020173Současná diagnostická kritéria Alzheimerovy nemoci zdůrazňují vedle klinické diagnózy také vyšetření metabolických biomarkerů. V ČR je dostupné vyšetření pomocí amyloidové PET a vyšetření biomarkerů v likvoru (hladiny beta amyloidu Aβ 1-42, celkového tau a fosforylovaného tau 181). Cílem této studie bylo zhodnotit konkordanci amyloidové PET a biomarkerů v likvoru v klinických podmínkách a navrhnout způsob interpretace výsledků likvoru ke zlepšení predikce výsledku amyloidové PET především u rozporných případů.
Souhrn
Cíl: Současná diagnostická kritéria Alzheimerovy nemoci zdůrazňují vedle klinické diagnózy také vyšetření metabolických biomarkerů. V ČR je dostupné vyšetření pomocí amyloidové PET a vyšetření biomarkerů v likvoru (hladiny beta amyloidu Aβ 1-42, celkového tau a fosforylovaného tau 181). Cílem této studie bylo zhodnotit konkordanci amyloidové PET a biomarkerů v likvoru v klinických podmínkách a navrhnout způsob interpretace výsledků likvoru ke zlepšení predikce výsledku amyloidové PET především u rozporných případů.
Metodika: Celkem 103 pacientů podstoupilo neuropsychologické vyšetření, MR mozku, vyšetření biomarkerů v likvoru a vizuálně hodnocenou PET s flutemetamolem. Následně byly srovnány konkordance výsledků biomarkerů likvoru a PET a byla vypočítána optimální hraniční hodnota pro poměr beta amyloidu 1-42 a fosforylovaného tau proteinu.
Výsledky: Výsledek PET byl konkordantní s vyšetřením beta amyloidu 1-42 v likvoru v 79 %, s výsledkem fosforylovaného tau v 72 %. Ve 40 % byl rozporný výsledek mezi biomarkery v likvoru vzájemně. Mezi PET pozitivními a negativními pacienty nejlépe rozlišoval poměr beta amyloidu 1-42 a fosforylovaného tau (AUC = 0,938, 95% CI = 0,890–0,986; p < 0,001), kdy hraniční hodnota 9,47 měla senzitivitu 91 % a specificitu 91,3 %.
Závěr: Obě metody vykazují dobrou vzájemnou diagnostickou shodu. V případě rozporných nálezů v likvoru doporučujeme využít poměrné hodnoty beta amyloidu 1-42 a fosforylovaného tau.
Klíčová slova:
Alzheimerova nemoc – amyloidová PET – biomarkery – likvor – flutemetamol – beta amyloid Aβ 1-42 – tau protein
Úvod
Časná a přesná diferenciální diagnostika neurodegenerativních onemocnění je v současnosti v popředí zájmu oboru neurologie a bude nabývat na významu v souvislosti se zvyšující se prevalencí těchto nemocí u stárnoucí populace. Současná diagnostická kritéria pro Alzheimerovu nemoc (AN) kladou vedle klinické diagnózy stále větší důraz na vyšetření biomarkerů [1]. Zařazení metabolických biomarkerů do diagnostických kritérií umožňuje diagnostikovat AN časněji, již ve stadiu mírné kognitivní poruchy (mild cognitive impairment; MCI) [2], subjektivního kognitivního poklesu (subjective cognitive decline; SCD) nebo i v dřívějších fázích – preklinického stadia. Současně umožňuje diagnostikovat atypické formy AN ve stadiu demence. Vyšetření biomarkerů u atypických případů uvádějí i česká doporučení [3,4]. Nově byla popsána také jednotka LATE (limbic-predominant age-related TDP-43 encephalopathy), která by mohla zahrnovat část pro AN sice typických klinických nálezů a nálezů na MR, které jsou však v rozporu s negativním výsledkem metabolických biomarkerů [5]. Na základě současných teoretických modelů onemocnění je možné očekávat pozitivitu biomarkerů již 10–15 let před výskytem prvních klinických příznaků [6].
V roce 2018 vznikla konsenzuální iniciativa [7] a snaha předních světových odborníků na AN definovat toto onemocnění nikoli klinicky, ale pouze biologicky na základě biomarkerů. Nová výzkumná diagnostická kritéria posuzují jejich pozitivitu pomocí systému ATN, kde A značí přítomnost agregovaného beta amyloidu (Aβ) na PET, popř. sníženou hladinu Aβ 42 nebo patologický poměr Aβ 1-42/Aβ 1-40 v likvoru, T značí zvýšenou hladinu fosforylovaného tau proteinu v likvoru nebo přítomnost patologických depozit tau proteinu na PET a N známky neurodegenerace, např. atrofii na strukturálních zobrazovacích metodách nebo zvýšení celkového tau proteinu v likvoru. Tento systém tvoří kontinuum, kde AN je definována pouze přítomností patologických Aβ a tau proteinů bez ohledu na klinické obtíže pacienta. Ačkoli tato diagnostická kritéria jsou zejména výzkumná a jejich primárním cílem je umožnit klinické studie nových léků, lze očekávat, že budou pronikat do klinické praxe a v případě úspěchů se uplatní i v léčbě AN (monoklonální protilátky, vakcinace, inhibitory enzymů podílejících se na tvorbě patologických proteinů).
Přesná diferenciální diagnostika neurodegenerativních onemocnění je významná také z důvodu informování pacienta o prognóze onemocnění a dle našich klinických zkušeností též vede k větší ochotě dodržovat možná preventivní opatření zvláště u relativně mladých pacientů či pacientů v časném stadiu (léčba interních rizikových faktorů, fyzická a duševní aktivita, úprava stravovacích návyků atd.). Diagnóza, která se neopírá o biomarkery, může být zavádějící či chybná. Jak ukázaly retrospektivní studie [8], i na zahraničních pracovištích s dlouholetou zkušeností v diagnostice AN se senzitivita klinické diagnózy v porovnání s patologickou pohybovala mezi 70,9–87,3 % a specificita dokonce mezi 44,3–70,8 %. Zařazení falešně pozitivních (Aβ negativních) pacientů se navíc pravděpodobně podílelo na selhání klinických studií s novými léčivy [9,10]. Současné klinické studie tak již v naprosté většině případů vyžadují pozitivní výsledek biomarkerů AN jako základní vstupní kritérium.
Nejčastěji používanými metabolickými biomarkery jsou hladiny beta amyloidu Aβ 1-42, celkového tau (t-tau) a fosforylovaného tau 181 (p-tau) proteinu v likvoru. Ze zobrazovacích vyšetření je v ČR od roku 2015 klinicky dostupná amyloidová PET s využitím flutemetamolu, který je z radiofarmak logisticky nejdostupnější. Mezi další radiofarmaka schválená k diagnostice AN patří ještě florbetaben a florbetapir. Amyloidová PET je v ČR plně hrazena z veřejného zdravotního pojištění, pokud pacient splňuje indikační kritéria stanovená Státním ústavem pro kontrolu léčiv (SÚKL). Vyšetření musí indikovat vybraná pracoviště se zkušeností v diagnostice AN a u pacienta musí být prokázáno narušení kognitivních funkcí v neuropsychologických testech. U pacientů, u kterých je prokázána diagnóza AN na základě platných kritérií [1], a u asymptomatických jedinců vyšetření uhradit nelze [11].
Vyšetření metabolických biomarkerů v likvoru je ve srovnání s amyloidovou PET pro superkonziliární centra v ČR dostupnější metodou. Jedná se o relativně levné, avšak invazivní vyšetření, určitou nevýhodou také může být obtížná standardizace metody, která se projevuje velkou variabilitou výsledků mezi laboratořemi i různými kity [12–14]. Amyloidová PET má v porovnání s histopatologickou diagnózou dobrou senzitivitu a specificitu [15–17] a při vizuálním čtení i dobrou shodu mezi hodnotiteli [18]. Nevýhodou je vysoká cena vyšetření: cca 45 000 Kč za individuálně připravovanou látku flutemetamol, dále pak je nutno připočíst cca 14 500 bodů za využití PET/CT (hodnoty platné k červnu 2019).
Obě metody – amyloidová PET i vyšetření biomarkerů v likvoru – sledují obdobný patofyziologický proces, ačkoli amyloidová PET zobrazuje agregovaný kortikální Aβ, zatímco analýza likvoru stanovuje rozpustný Aβ. Recentní práce ovšem ukazují, že obě formy Aβ spolu velmi úzce souvisejí [19].
V ideálním případě je tedy snaha dosáhnout mezi výsledky biomarkerů co nejvyšší diagnostické shody. V praxi se pro hodnocení této shody používá procentuální hodnota konkordance. Předchozí studie udávají konkordanci amyloidové PET a Aβ 1-42 mezi 60–84 % [20,21], avšak jako radiofarmakum byla v těchto studiích použita Pittsburská substance B, která je z důvodu rychlého poločasu rozpadu obtížně využitelná v klinické praxi. Radiofarmakum flutemetamol, které je v ČR klinicky nejdostupnější a nejpoužívanější, bylo využito ve švédské studii BioFINDER. Dle nedávno publikovaných výsledků prokázala tato studie konkordanci výsledku amyloidové PET a Aβ 1-42 mezi 74,6–84,4 % [22], pro analýzu likvoru však byly využity elektrochemiluminiscenční kity (metoda ECLIA), které nejsou v ČR zatím dostupné, a kohorta se skládala výhradně z pacientů s SCD a MCI. Zatím není k dispozici studie, která by porovnávala diagnostickou shodu amyloidové PET a biomarkerů v likvoru u pacientů s podezřením na AN v klinických podmínkách specifických pro ČR, kde je amyloidová PET plně hrazena ze zdravotního pojištění, nicméně pouze u pacientů s nejasnou klinickou diagnózou či atypickou prezentací onemocnění.
Cíle této studie byly: 1. zhodnotit konkordanci vizuálně hodnocené flutemetamolové amyloidové PET a biomarkerů v likvoru v klinických podmínkách; 2. navrhnout způsob interpretace nekonkordantních výsledků v likvoru.
Metodika
Charakteristika kohorty
Studie se zúčastnilo celkem 103 pacientů s MCI nebo lehkou demencí klasifikovanou jako „možnou“ AN dle kritérií National Institute on Aging-Alzheimer‘s Association (NIA-AA) [1], kteří byli vyšetřeni na Neurologické klinice 2. LF UK a FN Motol v období mezi roky 2016–2018 v rámci Kognitivního centra. Pacienti s MCI byli klasifikováni na základě doporučení NIA-AA [2]. Účastníci studie byli referováni k superkonziliárnímu vyšetření ambulantními neurology nebo psychiatry či se přímo obrátili s žádostí o vyšetření na naše pracoviště, často na doporučení praktického lékaře. Diagnostická kategorie „možná AN“ umožňuje dle kritérií SÚKL indikovat vyšetření amyloidovou PET na rozdíl od jasné klinické prezentace AN, která by spadala do kategorie „pravděpodobná AN“. Vyšetření biomarkerů podstoupili především pacienti s MCI s podezřením na neurodegenerativní etiologii obtíží a pacienti s lehkou demencí, u kterých AN byla možnou diagnózou, avšak klinická prezentace připouštěla i jinou etiologii (pacienti s řečovou poruchou, behaviorálními symptomy či nálezem postischemických gliových změn na MR nejasného významu aj.). Všichni pacienti podstoupili klinické neurologické vyšetření, volumetrickou 1,5 T MR mozku, neuropsychologické vyšetření, amyloidovou PET s flutemetamolem a vyšetření biomarkerů v likvoru. Pacienti s odstupem mezi provedením amyloidové PET a vyšetřením likvoru větším než 24 měsíců byli ze studie vyřazeni.
Vyšetření likvoru
Vzorky odebraného likvoru byly zpracovány a archivovány při teplotě –80 °C. Odběr, zpracování a archivace likvoru byly provedeny v souladu s evropskými doporučeními [23]. Hladiny Aβ 1-42, t-tau, p-tau v likvoru byly následně změřeny metodou ELISA za pomocí komerčních kitů od firmy Innogenetics (Gent, Belgie). Hraniční hodnoty pro pozitivitu AN byly na našem pracovišti na základě předchozích publikací a klinických zkušeností stanoveny takto: t-tau ≥ 358 pg/ml a p-tau ≥ 48 pg/ml [4]. U Aβ 1-42 jsme vycházeli jednak z konzervativnější hraniční hodnoty Aβ 1-42 ≤ 458 pg/ml [4] a také mírnější hraniční hodnoty Aβ 1-42 ≤ 665 pg/ml. Hraniční hodnoty t-tau, p-tau a konzervativnější Aβ 1-42 jsou obdobné jako hodnoty používané na jiných pracovištích v ČR [24] nebo hodnoty uváděné v recentní normativní studii [25]. Relativně nižší hraniční hodnoty Aβ 1-42 se sice ukazují jako poměrně specifické pro AN, mohou však vykazovat poměrně nízkou senzitivitu [24]. V klinické praxi je proto na našem pracovišti používána vyšší hodnota Aβ 1-42 ≤ 665 pg/ml, která vznikla konsenzuálně na základě zatím nepublikovaných interních ROC (receiver operating characteristic) analýz a lépe odráží klinickou diagnózu při longitudinálním sledování.
Za charakteristický pozitivní likvorový nález u pacientů s AN bylo považováno současné snížení Aβ 1-42 a zvýšení hladiny p-tau. Výsledky, kdy pro AN svědčil pouze jeden z těchto biomarkerů a druhý nikoliv, byly označeny jako nejednoznačné pro AN.
Amyloidová PET
Všechna vyšetření amyloidovou PET byla provedena v nemocnici Na Homolce na přístroji PET/CT (Biograph 40 TrueV HD od firmy Siemens [Mnichov, Německo]), jako radiofarmakum byla využita látka flutemetamol (Vizamyl od firmy GE Healthcare [Chicago, IL, USA]). Pro korekci atenuace byl iniciálně proveden nekontrastní low-dose CT sken. Snímání aktivity probíhalo ve dvou fázích. První fáze snímání (časná – „perfuzní“) započala ihned po podání radiofarmaka (celkem 4× 2 min pro korekci pohybu pacienta), druhá fáze (pozdní – „amyloidová“) proběhla za 90 min po podání radiofarmaka a trvala celkem 10 min. Snímky byly hodnoceny vizuálně pomocí metody GM-EDGE [18].
Statistická analýza dat
Pro statistické vyhodnocení jsme použili softwarový balík IBM SPSS verze 22 pro Windows (IBM, Armonk, NY, USA). Pro charakteristiku kohorty byly použity průměrné hodnoty věku, vzdělání, Mini-Mental State Examination (MMSE) a procentuální zastoupení pohlaví pacientů. Konkordance byla hodnocena jako diagnostická shoda uvnitř následujících skupin metabolických biomarkerů: amyloidová PET + Aβ 1-42, amyloidová PET + p-tau, amyloidová PET + t-tau, Aβ1-42 + p-tau a amyloidová PET + Aβ 1-42 + p-tau. Následně byly porovnány hodnoty plochy pod křivkou (area under the curve; AUC) jednotlivých ROC křivek pro Aβ 1-42, p-tau a poměr Aβ 1-42/p-tau vůči výsledku amyloidové PET. Optimální hraniční hodnota pro poměr Aβ 1-42/p-tau byla určena na základě nejvyššího Youdenova J indexu.
Výsledky
V kohortě 103 pacientů tvořily ženy 54 %. Průměrný věk pacientů byl 69,6 let, průměrná délka vzdělání 14,6 let a průměrný výsledek v testu Mini-Mental State Examination (MMSE) v době indikace amyloidové PET byl 24,7/30 bodů. Celkem 55 % pacientů bylo dle vyšetření PET Aβ pozitivních a 45 % Aβ negativních. Medián času mezi vyšetřením likvoru a provedením amyloidové PET byl 350 dní (tab. 1).
Tab. 1. Charakteristika kohorty 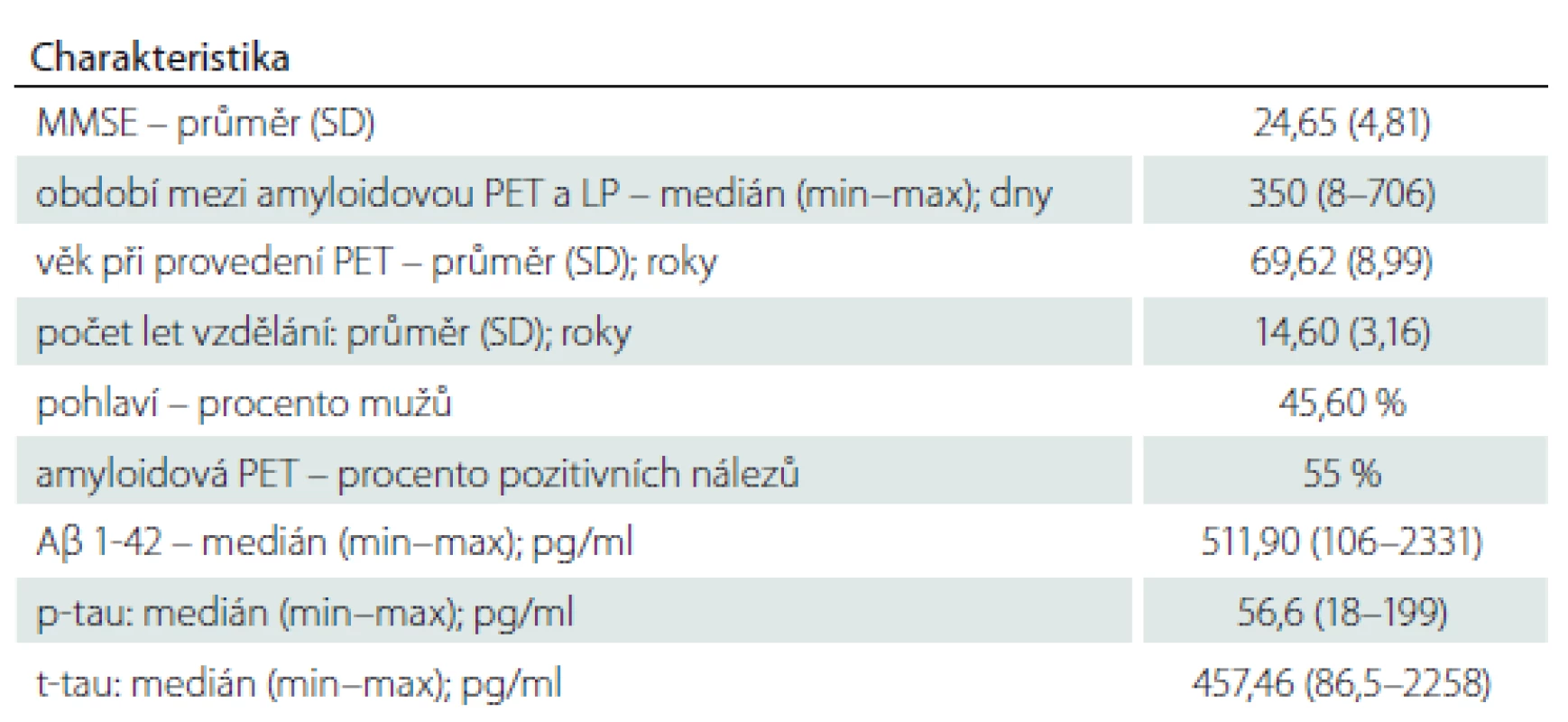
Aβ 1-42 – beta amyloid 1-42; LP – lumbální punkce; MMSE – Mini-Mental State Examination; p-tau – fosforylovaný tau protein 181; SD – směrodatná odchylka; t-tau – celkový tau protein Tab. 2. Analýza křivky receiver operating characteristic. V prvním řádku jsou uvedeny charakteristiky pro upravenou hraniční hodnotu Aβ 1-42 (665 pg/ml). Ve druhém řádku jsou uvedeny charakteristiky pro původní konzervativní hraniční hodnotu Aβ 1-42 (458 pg/ml). Ve třetím řádku jsou uvedeny charakteristiky pro hraniční hodnotu Aβ 1-42 s nejlepší senzitivitou a specifi citou vůči amyloidové PET (614 pg/ml). 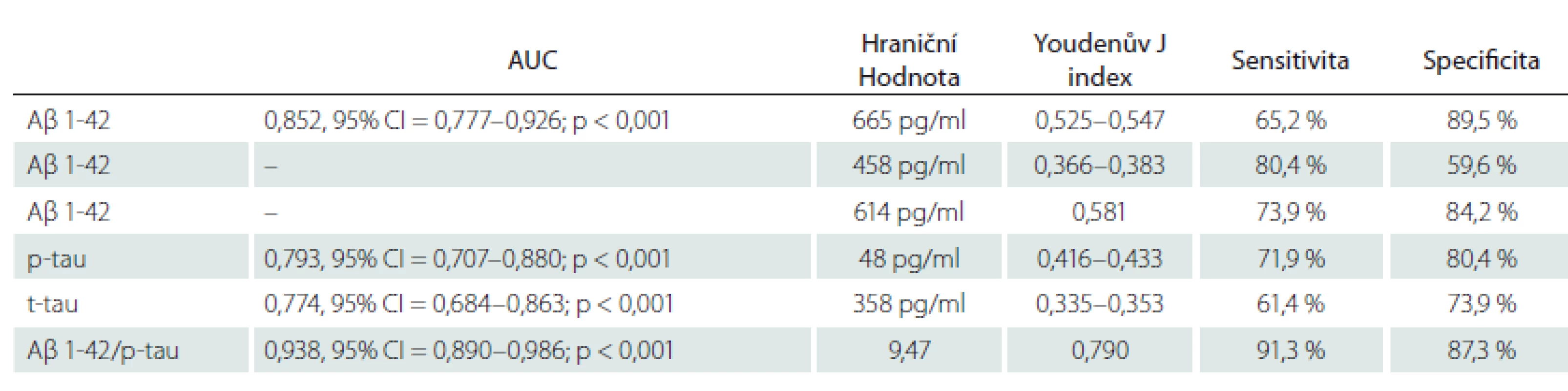
Aβ 1-42 – beta amyloid 1-42; AUC – plocha pod křivkou; CI – interval spolehlivosti; p-tau – fosforylovaný tau protein; t-tau – celkový tau protein Konkordance mezi pozitivním výsledkem amyloidové PET a pozitivitou Aβ 1-42 v likvoru byla 79 %, mezi amyloidovou PET a pozitivitou p-tau 72 % a konkordance amyloidové PET a t-tau byla 66 %. Při porovnání výsledků pozitivit Aβ 1-42 a p-tau panovala shoda (nízká hladina Aβ a vysoká p-tau) v 60 %, což znamená, že 40 % výsledků likvoru bylo nejednoznačných pro AN. Diagnostická shoda mezi současnou pozitivitou amyloidové PET, Aβ 1-42 a p-tau byla 54 %. Konkordance mezi amyloidovou PET a Aβ 1-42 s hraniční hodnotou 458 pg/ml byla 69 %.
Mezi pacienty s pozitivní a negativní PET nejlépe rozlišoval poměr Aβ 1-42/p-tau (AUC = 0,938, 95% CI = 0,890–0,986; p < 0,001), následovaný samotným Aβ 1-42 (AUC = 0,852, 95% CI = 0,777–0,926; p < 0,001). Hodnoty p-tau (AUC = 0,793, 95% CI = 0,707–0,880; p < 0,001) a t-tau (AUC = 0,774, 95% CI = 0,684–0,863; p < 0,001) byly srovnatelné. Výsledky shrnují tab. 2 a obr. 1. Dle křivky ROC jsme stanovili v případě poměru Aβ 1-42/p-tau hraniční hodnotu 9,47 (J-index 0,790), při které došlo s největší senzitivitou (91 %) a specificitou (91,3 %) k oddělení Aβ PET pozitivních a negativních pacientů (obr. 2).
Obr. 1. ROC křivka znázorňující predikci pozitivity amyloidové PET podle hodnot biomarkerů v likvoru. Aβ 1-42 – beta amyloid 1-42; p-tau – fosforylovaný tau protein; ROC – křivka receiver operating characteristic; t-tau – celkový tau protein
Fig. 1. ROC curve showing prediction of amyloid PET positivity according to the levels of cerebrospinal fluid biomarkers. Aβ 1-42 – beta amyloid 1-42; p-tau – phosphorylated tau protein; ROC – receiver operating characteristic curve; t-tau – total tau protein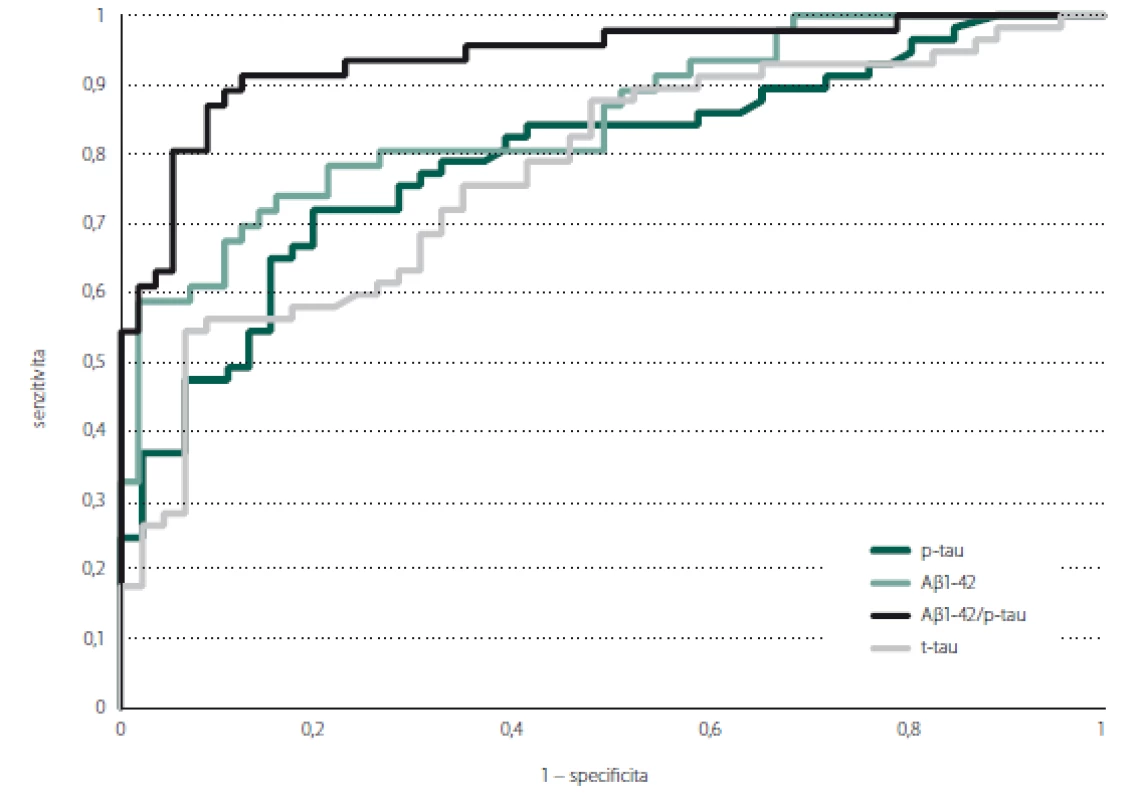
Obr. 2. Konkordance. Graf znázorňuje na ose y hodnoty Aβ 1-42 v likvoru podle skupin pacientů s pozitivním (PET pozitivní) a negativním (PET negativní) výsledkem amyloidové PET. Aβ 1-42 – beta amyloid 1-42
Fig. 2. Concordance. Graph shows the values of Aβ 1-42 in cerebrospinal fl uid on the y-axis according to patient groups with positive (PET positive) or negative (PET negative) amyloid PET results. Aβ 1-42 – beta amyloid 1-42
Diskuze
V této studii byla analyzována konkordance výsledku amyloidové PET a metabolických biomarkerů v likvoru u pacientů s klinickou indikací k provedení amyloidové PET. Vzhledem k nastaveným indikačním kritériím SÚKL se jednalo převážně o pacienty v časných stadiích onemocnění a s atypickou prezentací onemocnění. Výsledky likvoru nebyly v řadě případů jednoznačné pro AN, nekorespondovaly s klinickou diagnózou, nebyly v době PET dostupné nebo byl likvor odebrán až po vyšetření PET.
Studie prokázala, že konkordance výsledku amyloidové PET s výsledky Aβ 1-42 a p-tau v likvoru u pacientů z Kognitivního centra Neurologické kliniky 2. LF UK a FN Motol (78 a 72 %) je srovnatelná s výsledky udávanými na zahraničních kohortách [20–22]. Snížená hladina Aβ 1-42 v likvoru je považována za senzitivní a specifický marker pro AN s nejvyšší konkordancí s amyloidovou PET, dále se pak za senzitivní a specifickou považuje zvýšená hladina p-tau, která však může být zvýšená i u jiných neurodegenerativních onemocnění. T-tau, který měl nejnižší konkordanci s amyloidovou PET (66 %), se z těchto tří likvorových biomarkerů považuje za nejméně specifický pro AN a jeho zvýšená hladina může být přítomna u jiných a nejen neurodegenerativních onemocnění CNS [26].
Ve 40 % případů jsme zaznamenali výsledek biomarkerů, který byl nejednoznačný pro AN (Aβ 1-42 byl normální a zároveň byl p-tau zvýšený anebo Aβ 1-42 snížený a zároveň p-tau normální). Diagnostická shoda napříč výsledky amyloidové PET, Aβ 1-42 a zároveň p-tau pak byla pozorována ještě u menšího procenta případů (54 %). Interpretovat výsledek vyšetření pouze na základě výsledku Aβ 1-42 může vzhledem ke známým preanalytickým obtížím vést k chybné diagnóze [27]. Odběr do různých typů zkumavek, odlišná denní doba odběru, různé laboratorní zpracování, časové prodlevy mezi náběrem a zpracováním a zamrazením vzorků jsou nejčastějšími faktory, které se na nekonzistentních výsledcích podílejí. Pro minimalizaci těchto preanalytických chyb je již několik let na našem pracovišti zaveden přesný protokol synchronizovaný s evropskými doporučeními pro odběr moku zahrnující použití atraumatické jehly, odběr v dopoledních hodinách, použití polypropylenových zkumavek, standardní centrifugaci, homogenizaci, rozpipetování do alikvotů a okamžité zamrazení na teplotu –80 °C [23,28].
Využití poměru Aβ 1-42/p-tau umožňuje jednoznačněji interpretovat výsledek nekonzistentního nálezu v likvoru a zvýšit diagnostickou shodu mezi výsledkem PET a likvoru. Na základě dostupných dat jsme jako hraniční hodnotu pro poměr Aβ 1-42/p-tau zvolili hodnotu ≤ 9,47, která predikuje pozitivitu flutemetamolové amyloidové PET s 91,3% senzitivitou a 87,3% specificitou a odpovídá 90% celkové shodě (AUC = 0,938). Tento výsledek se velice blíží shodě mezi hodnotiteli (92 %) při vizuálním čtení snímků amyloidové PET s flutemetamolem metodou GM-EDGE, která byla v naší kohortě použita.
Výhodou analýzy biomarkerů likvoru je, že v preklinickém stadiu AN by dle současných modelů onemocnění měla být pozitivita Aβ v likvoru detekovatelná dříve než na amyloidové PET, ale v klinickém stadiu by již měla být obě vyšetření pozitivní [29]. Z likvoru lze rovněž na rozdíl od amyloidové PET kromě hodnoty Aβ 1-42 zjistit také hodnoty fosforylovaného a celkového tau proteinu. Naopak jeho nevýhodou může být, že se jedná se o invazivní vyšetření, které někdy vyžaduje krátkou hospitalizaci pacienta na neurologickém lůžku a u pacientů na trvalé antikoagulační terapii může být provedení tohoto vyšetření organizačně náročné a je nutno zvažovat klinický risk-benefit. Ačkoli incidence postpunkčních obtíží je u pacientů relativně nízká a pohybuje se v řádech jednotek procent [30,31], je dle našich zkušeností spolupráce (compliance) pacientů indikovaných k vyšetření biomarkerů v likvoru nižší než v případě pacientů indikovaných k provedení amyloidové PET, kde nejčastějším důvodem odmítnutí vyšetření byla radiofobie.
Výhodou amyloidové PET je dobrá standardizace a validita metody. Vizuálně čtené a binárně (pozitivní/negativní) hodnocené snímky s flutemetamolem dosahují v porovnání s histopatologickou diagnózou vysoké senzitivity 88–92 %, i specificity 88–90 % [15–17] a shody mezi hodnotiteli až 92 % [18]. Snímky PET je možno hodnotit také automatizovanou metodou, která umožňuje kvantitativní popis výsledného obrazu (standardized uptake value ratio; SUVr) a která dle dostupných dat má dobrou shodu jak s histopatologickým nálezem, tak vizuálně hodnocenými snímky [17]. Využití automatizované metody však vyžaduje, aby stanovené hraniční hodnoty pro SUVr byly validovány v rámci pracoviště.
Vyšetření biomarkerů v likvoru metodou ELISA vykazuje dle dostupných dat dobrou shodu v rámci jednotlivých setů. Většina studií se však shoduje na vysoké variabilitě mezi různými laboratořemi, která je pravděpodobně způsobena rozdíly v preanalytických a analytických metodách, např. používání rozdílných analytických kitů [12–14].
Důvodů, proč poměrná hodnota Aβ 1-42/p-tau zlepšuje senzitivitu a specificitu při predikci pozitivity amyloidové PET, může být více. Jedním z nich je skutečnost, že většina nekonkordantních hodnot se nachází v „šedé zóně“ blízko hraničních hodnot, což potvrzují i data získaná v naší studii (obr. 1). Podobný jev popisovala i dříve zmiňovaná studie srovnávající konkordanci amyloidové PET s Pittsburskou substancí B a Aβ 1-42 [21]. Poměrná hodnota potom využije trendu ze „silnějšího“ z obou metabolitů. Za druhé tento poměr spojuje dvě metabolické cesty stejného patofyziologického procesu. I když dle hypotetického modelu nemoci je snížení hodnoty Aβ 1-42 v likvoru dřívějším markerem onemocnění než zvýšení hodnoty p-tau [29], v době, kdy pacient přichází s rozvinutými klinickými příznaky, by již měly být pozitivní oba markery. Třetím důvodem může být určitá normalizace hodnot Aβ 1-42 vůči p-tau, která snižuje vliv fluktuací a variací v produkci a sekreci Aβ 1-42 do likvoru [32].
Za pozitivní zjištění považujeme, že výsledky konkordance jsou srovnatelné s výše citovanou studií BioFINDER se stejným radiofarmakem, která jednak zahrnovala více subjektů (celkem 277 pacientů), jednak využila novější metodu ECLIA ke stanovení hladin metabolických biomarkerů v likvoru oproti metodě ELISA použité v naší kohortě [22]. Poměr Aβ 1-42/p-tau (resp. poměr p-tau/Aβ 1-42) ve studii BioFINDER dosahoval celkové diagnostické shody v 85,7–93,2 % (AUC 0,91–0,97). Naše kohorta zahrnovala více atypických případů, neboť se jednalo o pacienty s MCI či lehkou demencí klasifikovanou jako „možnou AN“ dle kritérií NIA-AA splňující PET indikační kritéria SÚKL, narozdíl od studie BioFINDER, která se orientovala spíše na časná stadia (pacienti s SCD a MCI).
V naší práci byly použity upravené hraniční hodnoty pro Aβ 1-42 a také konzervativnější hodnoty, které původně vycházely z metody validované na pacientech s demencí při AN [4]. Porovnáním s výsledkem amyloidové PET se ukázalo, že na základě analýzy Youdenova J indexu námi upravené hodnoty v této kohortě pacientů lépe vystihovaly přítomnost amyloidové patologie na PET než původně navržená norma. Youdenův J index u Aβ 1-42 pro původní konzervativní hodnotu ≤ 458 pg/ml byl mezi hodnotami 0,366–0,383, zatímco u novější hraniční hodnoty 665 pg/ml byl mezi hodnotami 0,525–0,547. Negativní a pozitivní pacienty dle amyloidové PET nejlépe oddělovala hodnota 614 pg/ml, jejíž J index byl 0,581 (tab. 2).
Na základě informací z předchozích obdobných studií [20] byly ze studie vyřazeni pacienti, u nichž odstup mezi amyloidovou PET a vyšetřením likvoru byl více než 24 měsíců. Následná post hoc analýza také ukázala, že časový interval mezi amyloidovou PET a vyšetřením likvoru se nelišil mezi pacienty s konkordantními a nekonkordantními výsledky (amyloidová PET + Aβ 1-42, amyloidová PET + p-tau a amyloidová PET + t-tau).
Za největší limitaci této studie považujeme skutečnost, že ačkoli je zde vizuálně hodnocená amyloidová PET brána za nejbližší skutečnému histopatologickému obrazu, nebylo možné určit definitivní diagnózu pomocí pitvy a histologických nálezů. Cílem práce však bylo zmapovat konkordanci nejpoužívanějších biomarkerů a navrhnout způsoby interpretace nejednoznačných výsledků biomarkerů z likvoru tak, aby konkordance byla co nejvyšší. Dále je nutno zdůraznit, že depozita kortikálního fibrilárního amyloidu, která je možno zobrazit metodami PET, nejsou totožná s rozpustným Aβ 1-42 v likvoru, ačkoli odrážejí stejný patofyziologický proces. V dalších studiích by také bylo vhodné porovnat poměr Aβ 1-42 a Aβ 1-40, ke kterému jsme v naší studii neměli přístup.
Z klinického pohledu nadále zůstává otevřena otázka možnosti smíšených patologií, které nejsou z neuropatologického pohledu nijak vzácným nálezem [33]. Symptomatičtí pacienti s pozitivním výsledkem amyloidové PET mohou být primárně postiženi jinou patologií (např. frontotemporální lobární degenerací) a zároveň AN v preklinickém stadiu. Interpretace výsledku amyloidové PET je proto jednoznačnější u pacienta s negativním výsledkem než u pacienta s výsledkem pozitivním. Dále je nutno zdůraznit, že ačkoli dle klasifikace ATN (navrhované jako výzkumný rámec) znamená pozitivita biomarkerů přítomnost Alzheimerovské patologie (A+) nebo Alzheimerovy nemoci (A+T+), z klinického pohledu pacienty pouze na základě výsledků biomarkerů zatím takto diagnostikovat nelze a při interpretaci je nutno přihlížet i ke klinické prezentaci a kontextu [34].
Závěr
Závěrem lze shrnout, že amyloidová PET s flutemetamolem i analýza Aβ 1-42 a p-tau v likvoru představují perspektivní metody, které umožňují přesnější a časnější diagnostiku AN. Každá z těchto metod má své limitace a přednosti využitelné v různých klinických situacích, avšak z diagnostického pohledu vykazují obě metody dobrou vzájemnou shodu, nejsou však jednoduše zaměnitelné. V případě nejednoznačných nálezů v likvoru doporučujeme využít poměrné hodnoty Aβ 1-42 a p-tau, která celkovou diagnostickou shodu biomarkerů likvoru a amyloidové PET významně zvyšuje.
Etické aspekty
Práce byla schválena etickou komisí FN Motol (č. EK-701/16, dne 25. 5. 2016), Všichni pacienti podepsali informovaný souhlas.
Grantová podpora
Práce byla podpořena granty: IPE 6012, AZV 16-27611A, MZ ČR – RVO, FN v Motole 0006420. Podpořeno také z Evropského fondu pro regionální rozvoj – projekt ENOCH (reg. č. CZ.02.1.01/0.0/0.0/16_019/0000868).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Poděkování
Doc. MUDr. Otakar Bělohlávek, CSc., MUDr. Monika Jarůšková, MUDr. Ondřej Lerch, MUDr. Ivana Mokrišová, MUDr. Martina Pařízková, Mgr. Hana Marková, Mgr. Adéla Fendrych Mazancová, Mgr. Kateřina Čechová, Mgr. Veronika Matušková, Vladislava Fulínová a dále všichni laboratorní a radiologičtí asistenti, kteří pomáhali s vyšetřením pacientů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílanédo biomedicínských časopisů.
MUDr. Jiří Cerman, Ph.D.
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: cermanjiri@gmail.comPřijato k recenzi: 27. 6. 2019
Přijato do tisku: 27. 2. 2020
Zdroje
1. McKhann GM, Knopman DS, Chertkow H et al. The diag-nosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7 (3): 263–269. doi: 10.1016/j.jalz.2011.03.005.
2. Albert MS, Dekosky ST, Dickson D et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7 (3): 270–279. doi: 10.1016/j.jalz.2011.03.008.
3. Ressner P, Hort J, Rusina R. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemoc-nění spojených s demencí. Cesk Slov Neurol N 2008; 71/104 (4): 494–501.
4. Hort J, Glosová L, Vyhnálek M et al. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 70/103 (1): 30–36.
5. Nelson PT, Dickson DW, Trojanowski JQ et al. Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain 2019; 142 (6): 1503–1527. doi: 10.1093/brain/awz099.
6. Jack CR, Knopman DS, Jagust WJ et al. Tracking pathophysiological processes in Alzheimer’s disease: an updated hypothetical model of dynamic biomarkers. Lancet Neurol 2013; 12 (2): 207–216. doi: 10.1016/S1474-4422 (12) 70291-0.
7. Jack CR, Bennett DA, Blennow K et al. NIA-AA research framework: toward a biological definition of Alzheimer’s disease. Alzheimers Dement 2018; 14 (4): 535–562. doi: 10.1016/j.jalz.2018.02.018.
8. Beach TG, Monsell SE, Phillips LE et al. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005–2010. J Neuropathol Exp Neurol 2012; 71 (4): 266–273. doi: 10.1097/NEN.0b013e31824b211b.
9. Salloway S, Sperling R, Fox NC et al. Two phase 3 trials of bapineuzumab in mild-to-moderate Alzheimer’s disease. N Engl J Med 2014; 370 (4): 322–333. doi: 10.1056/NEJMoa1304839.
10. Degenhardt EK, Witte MM, Case MG et al. Florbetapir F18 PET amyloid neuroimaging and characteristics in patients with mild and moderate Alzheimer dementia. Psychosomatics 2016; 57 (2): 208–216. doi: 10.1016/j.psym.2015.12.002.
11. SÚKL. Opatření obecné povahy. [online]. Dostupné z URL: http: //www.sukl.cz/file/88095_1_1.
12. Vos SJB, Visser PJ, Verhey F et al. Variability of CSF Alzheimer’s disease biomarkers: implications for clinical practice. PLoS One 2014; 9 (6): e100784. doi: 10.1371/journal.pone.0100784.
13. Mattsson N, Andreasson U, Persson S et al. The Alzheimer’s Association external quality control program for cerebrospinal fluid biomarkers. Alzheimers Dement 2011; 7 (4): 386–395. doi: 10.1016/j.jalz.2011.05.2243.
14. Verwey NA, van der Flier WM, Blennow K et al. A worldwide multicentre comparison of assays for cerebrospinal fluid biomarkers in Alzheimer’s disease. Ann Clin Biochem 2009; 46 (Pt 3): 235–240. doi: 10.1258/ acb.2009.008232.
15. Salloway S, Gamez JE, Singh U et al. Performance of [18F] flutemetamol amyloid imaging against the neuritic plaque component of CERAD and the current (2012) NIA-AA recommendations for the neuropathologic diagnosis of Alzheimer’s disease. Alzheimers Dement (Amst.) 2017; 9 : 25–34. doi: 10.1016/j.dadm.2017.06. 001.
16. Curtis C, Gamez JE, Singh U et al. Phase 3 trial of flutemetamol labeled with radioactive fluorine 18 imaging and neuritic plaque density. JAMA Neurol 2015; 72 (3): 287–294. doi: 10.1001/jamaneurol.2014.4144.
17. Thurfjell L, Lilja J, Lundqvist R et al. Automated quantification of 18F-flutemetamol PET activity for categorizing scans as negative or positive for brain amyloid: concordance with visual image reads. J Nucl Med 2014; 55 (10): 1623–1628. doi: 10.2967/jnumed.114.142109.
18. Belohlavek O, Jaruskova M, Skopalova M et al. Improved beta-amyloid PET reproducibility using two-phase acquisition and grey matter delineation. Eur J Nucl Med Mol Imaging 2019; 46 (2): 297–303. doi: 10.1007/s00259-018-4140-y.
19. Blennow K, Mattsson N, Schöll M et al. Amyloid biomarkers in Alzheimer’s disease. Trends Pharmacol Sci 2015; 36 (5): 297–309. doi: 10.1016/j.tips.2015.03.002.
20. Leuzy A, Carter SF, Chiotis K et al. Concordance and diagnostic accuracy of [11C]PIB PET and cerebrospinal fluid biomarkers in a sample of patients with mild cognitive impairment and Alzheimer’s disease. J Alzheimers Dis 2015; 45 (4): 1077–1088. doi: 10.3233/JAD-142952.
21. Zwan MD, van Harten A, Ossenkoppele R et al. Concordance between cerebrospinal fluid biomarkers and [11C]PIB PET in a memory clinic cohort. J Alzheimers Dis 2014; 41 (3): 801–807. doi: 10.3233/JAD-132561.
22. Hansson O, Seibyl J, Stomrud E et al. CSF biomarkers of Alzheimer’s disease concord with amyloid-β PET and predict clinical progression: a study of fully automated immunoassays in BioFINDER and ADNI cohorts. Alzheimers Dement 2018; 14 (11): 1470–1481. doi: 10.1016/j.jalz.2018.01.010.
23. Vanderstichele H, Bibl M, Engelborghs S et al. Standardization of preanalytical aspects of cerebrospinal fluid biomarker testing for Alzheimer’s disease diagnosis: a consensus paper from the Alzheimer’s Biomarkers Standardization Initiative. Alzheimers Dement 2012; 8 (1): 65–73. doi: 10.1016/j.jalz.2011.07.004.
24. Bartoš A, Čechová L, Švarcová J et al. Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci. Cesk Slov Neurol N 2012; 75/108 (5): 587–594.
25. Bartoš A, Smětáková M, Nosková L et al. Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka Cesk Slov Neurol N 2019; 82/115 (5): 533–540. doi: 10.14735/amcsnn2019533.
26. Blennow K. A review of fluid biomarkers for Alzheimer’s disease: moving from CSF to blood. Neurol Ther 2017; 6 (Suppl 1): 15–24. doi: 10.1007/s40120-017-0073-9.
27. Schauer SP, Mylott WR, Yuan M et al. Preanalytical approaches to improve recovery of amyloid-β peptides from CSF as measured by immunological or mass spectrometry-based assays. Alzheimers Res Ther 2018; 10 (1): 118. doi: 10.1186/s13195-018-0445-0.
28. Teunissen CE, Petzold A, Bennett JL et al. A consensus protocol for the standardization of cerebrospinal fluid collection and biobanking. Neurology 2009; 73 (22): 1914–1922. doi: 10.1212/WNL.0b013e3181c47cc2.
29. Jack CR, Knopman DS, Jagust WJ et al. Hypothetical model of dynamic biomarkers of the Alzheimer’s pathological cascade. Lancet Neurol 2010; 9 (1): 119–128. doi: 10.1016/S1474-4422 (09) 70299-6.
30. Blennow K, Wallin A, Häger O. Low frequency of post-lumbar puncture headache in demented patients. Acta Neurol Scand 1993; 88 (3): 221–223. doi: 10.1111/j.1600-0404.1993.tb04221.x.
31. Duits FH, Martinez-Lage P, Paquet C et al. Performance and complications of lumbar puncture in memory clinics: results of the multicenter lumbar puncture feasibility study. Alzheimers Dement 2016; 12 (2): 154–163. doi: 10.1016/j.jalz.2015.08.003.
32. Lucey BP, Fagan AM, Holtzman DM et al. Diurnal oscillation of CSF Aβ and other AD biomarkers. Mol Neurodegener 2017; 12 (1): 36. doi: 10.1186/s13024-017-0161-4.
33. Woodward M, MacKenzie IR, Hsiung GY et al. Multiple brain pathologies in dementia are common. Eur Geriatr Med 2010; 1 (5): 259–265. doi: 10.1016/j.eurger.2010.07.012.
34. Kalvach P, Kupka K, Vogner M. Je amyloid podstatný pro senilní demenci? Cesk Slov Neurol N 2018; 81/114 (2): 164–170. doi: 10.14735/amcsnn2018csnn.eu1.
Štítky
Dětská neurologie Neurochirurgie Neurologie Psychiatrie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
-
Všechny články tohoto čísla
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Je koncept vaskulární demence trvale udržitelný?
- Je koncept vaskulární demence trvale udržitelný? NE
- Je koncept vaskulární demence trvale udržitelný? Komenář
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Schwannóm extrakraniálnej časti trojklanného nervu
- Chirurgická léčba mozkových metastáz
- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PET
- Provokační faktory a reakce na léčbu juvenilní myoklonické epilepsie – zkušenosti z tertiárního epileptického centra
- Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientů
- Transkraniální sonografie mediotemporálního laloku u pacientů s Alzheimerovou demencí
- Endarterektomie zevní karotické tepny
- Vestibulární funkce u pacientů s kochleárním implantátem
- Cystická hydatidóza mozečku – vzácná kazuistika
- Případ pozdní brachiální plexopatie po chemoterapii a radioterapii
- Spontánní vaginální extruze distálního katetru ventrikuloperitoneálního zkratu
- Opakovaná trombektómia u pacienta so zriedkavou kombináciou etiologických faktorov
- Dopis redakci
- Komentář redakce
- Prof. Mraček oslavil 90 let
- Odešla MUDr. Olga Baudyšová
- K jubileu profesorky Soni Nevšímalové
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Chirurgická léčba mozkových metastáz
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



